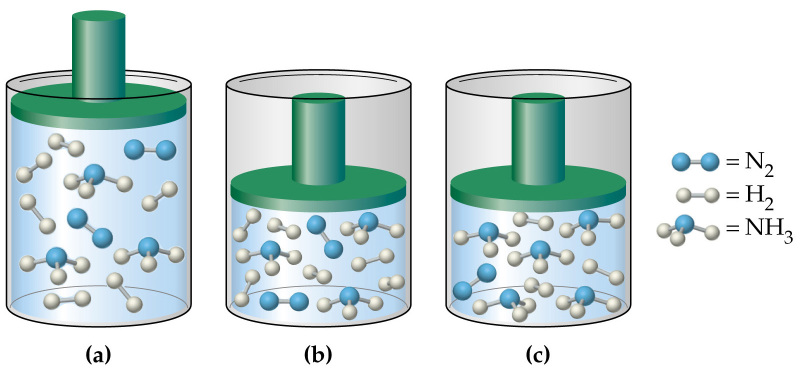
Формулы для определения давления газа применимы только для так называемого идеального газа. Это такой газ, когда пренебрегается взаимодействием между молекулами. Для этого газ должен быть достаточно разряженным. Газ с хорошей точностью можно считать идеальным вплоть до давлений 20 – 30 атмосфер. Так что атмосферу Земли можно считать идеальной даже у самой поверхности Земли. Давление газа на какую-либо поверхность определяется ударами молекул об эту поверхность. Естественно, что тогда давление газа должно зависеть от скоростей движения молекул. Вот формула для определения давления газа р
p = (Nmv^2)/3V (1)
Естественно, что давление зависит от числа молекул N, от массы молекулы m, от средней скорости движения молекул v и от объема сосуда V, где находятся молекулы. Средняя кинетическая энергия молекулы равна Е = mv^2/2. Тогда получим следующую формулу для расчета давления газа через среднюю энергию молекул
р = 2NЕ/3V (2)
Больцман рассчитал, что средняя кинетическая энергия молекул пропорциональна абсолютной температуре Т. Е = (3/2)kT, где k – постоянная Больцмана и T – абсолютная температура. Тогда получим для давления идеального газа формулу р = (NkT)/V. Перепишем эту формулу в следующем виде
рV = NkT (3)
Концентрация молекул в газе равна n = N/V. Тогда формула (3) примет такой вид
pV = NkT (4)
Концентрацию молекул можно выразить через произведение числа молей ν на число частиц в моле N = νNa. Произведение Na*k = R. Где R – газовая постоянная. Тогда (4) запишется в виде
pV = νRT (5)
Число молей газа ν = M/μ, где М – масса газа и μ – масса одного моля (молярная масса). Тогда уравнение (5) примет вид
pV = (M/μ)RT (6)
Уравнение состояния идеального газа в таком виде называют уравнением Клапейрона – Менделеева. При постоянных температуре и массе из (6) следует, что
pV = const (7)
То есть давление будет обратно пропорционально объему газа. Такой закон получил название закона Бойля – Мариотта. Если же постоянным является давление, то
V = (MR/Vμ)T (8)
Давление пропорционально абсолютной температуре. Этот закон получил название закон Шарля.
Вот и используйте любую из этих формул для расчета давления газа.
Само понятие «давление газа» для
вакуумной техники является условным,
так как почти нет таких процессов,
которые определялись бы давлением газа,
как усилием на единицу поверхности.
Гораздо более важными характеристиками
газовой среды в вакуумной технике
являются плотность ρилимолекулярная
концентрация N1газа. Именно
они определяют теплоперенос,
сорбционно-десорбционные процессы,
воздействие газа на элементы электронных
приборов и другие явления, наблюдаемые
в вакууме. Приборы для измерения давления
газа ниже атмосферного называются
вакуумметрами. Большинство вакуумметров
состоит из двух элементов:манометрического
преобразователя сигнала давления в
электрический сигнал иизмерительного
блока.
По принципу действия вакуумметры можно
свести в следующие классы:
Жидкостные, непосредственно
измеряющие давление (U-образные вакууметры
и их модификации).
Компрессионные, действие которых
основано на законах изотермического
сжатия идеального газа (вакууметр
Мак-Леода).
Деформационные, использующие
в качестве чувствительного элемента
сильфон, мембрану и т.п., в которых
деформация чувствительного элемента
служит мерой двления.
Тепловые вакуумметры, использующие
зависимость теплопроводности газа от
давления. Они подразделяются на
термопарные и вакуумметры сопротивления.
Ионизационные, которые основаны
на процессах ионизации газов в вакуумных
системах. Они подразделяются в свою
очередь на типы:
а) электроразрядные, принцип действия
которых основан на зависимости параметров
электрического разряда в разряженном
газе от давления;
б) электронные-ионизационные, ионизация
газов, в которых осуществляется потоком
электронов, ускоряемых электрическим
полем.
В лабораторной работе используются два
типа вакуумметров: термопарный (до
давления 10−3мм.рт.ст.) и ионизационный,
для более высокого вакуума.
Манометрический
термопарный преобразователь
Схематическое
отображение манометрического термопарного
преобразователя представлено на рис.3.
|
|
|
Рис..3 Схема |
Преобразователь представляет собой
стеклянный или металлический корпус,
в котором на двух вводах смонтирован
нагреватель, а на двух других вводах
крепится термопара, изготовленная из
хромель-копеля или хромель-алюмеля.
Термопара приварена к нагревателю,
режим нагрева которого можно регулировать
реостатом и контролировать миллиамперметром.
Спай термопары, нагреваемый подогревателем,
является источником термо-э.д.с., значение
которой показывает милливольтметр. При
атмосферном давлении, при заданном
рабочем токе подогревателя для данной
конкретной лампы, стрелка вольтметра
стоит вблизи нуля.
Из курса молекулярной физики известно,
что в плотном газе теплопроводность не
зависит от давления. Однако. это
утверждение справедливо до тех пор пока
длина свободного пробега молекул газа
не становится сравнима с характерными
размерами термопарного преобразователя.
При понижении давления уменьшается
теплопроводность газа, соответственно
возрастает температура подогревателя
и увеличивается термо-э.д.с. Точность
измерения давления термопарным
вакууметром существенно зависит от
правильного подбора тока накала
подогревателя. Как правило ток накала
лампы устанавливается до вскрытия новой
лампы, либо при откачке преобразователя
до давления ниже 10−4мм.рт.ст. При
этих давлениях, теплоотвод по газу
пренебрежимо мал и осуществляется
только через излучение (63%) и теплоотвод
по вводам (37%). Таким образом калибровка
термопарной лампы, (установка тока
подогревателя) подбирается таким
образом, чтобы стрелка милливольтметра
точно совпадала с последним делением
шкалы. При этих условиях, согласно
градуировочной кривой термопарного
манометрического преобразователя можно
по показаниям милливольтметра определить
давление в вакуумной системе.
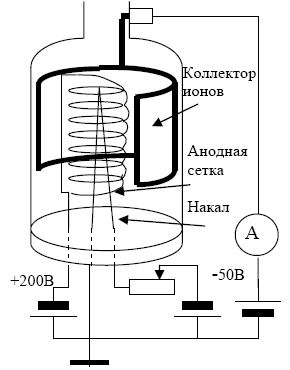
Электронно-
ионизационный преобразователь
Работа ионизационных манометрических
преобразователей основана на ионизации
газа электронным потоком и измерении
ионного тока, по которому судят о давлении
в вакуумной системе. Конструкция
манометрических преобразователей
применяемых в лабораторной работе
приведена на рис.4.
В стеклянном баллоне смонтирована
трехэлектродная система, состоящая из
коллектора ионов, анодной сетки и
прямонакального катода. На анодную
сетку подается напряжение +200 В относительно
катода, а на цилиндрический коллектор
−50 В. Анодная сетка выполнена из
вольфрамовой проволоки в виде спирали.
При прогреве преобразователя и его
обезгаживании по спирали пропускается
ток 3А.
|
|
|
Рис.4. Схема |
Вольфрамовый катод преобразователя
испускает электроны, которые ускоряются
электронным полем и движутся к анодной
сетке. Часть электронов пролетают через
анодную сетку и попадают в пространство
между анодной сеткой и коллектором.
Так как коллектор имеет отрицательный
потенциал относительно катода, электроны
останавливаются и начинают движение
обратно к анодной сетке. В результате
у сетки происходит колебательное
движение электронов, причем прежде чем
попасть на сетку, электроны успевают
совершить в среднем 5 колебаний. При
столкновении электронов с молекулами
газа происходит ионизация молекул.
Образовавшиеся в результате столкновения
положительные ионы попадают на коллектор,
и тем самым создают в его цепи электрический
ток.
Как показывает опыт, при достаточно
низких давлениях (ниже 10−3мм.рт.ст.) ионный ток коллектора прямо
пропорционален давлению газа ( т.е.Р
~Iколлек.), поэтому его удобно
использовать в качестве показателя
степени вакуума.
Соседние файлы в папке ФОЭ
- #
- #
- #
- #
- #
- #
- #
- #
Давление является одним из трех основных термодинамических макроскопических параметров любой газовой системы. В данной статье рассмотрим формулы давления газа в приближении идеального газа и в рамках молекулярно-кинетической теории.
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия — упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Причина возникновения давления в газах
Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
P = F/S
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
F*Δt = Δp
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 1023), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Формула давления газа идеального из молекулярно-кинетической теории
При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
P = N*m*v2/(3*V)
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
Формула давления из уравнения состояния
В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
P*V = n*R*T
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
P = n*R*T/V
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.
Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
Давление в газовой смеси
Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример задачи
Известно, что средняя скорость молекул кислорода составляет 500 м/с. Необходимо определить давление в сосуде объемом 10 литров, в котором находится 2 моль молекул.
Ответ на задачу можно получить, если воспользоваться формулой для P из МКТ:
P = N*m*v2/(3*V)
Здесь содержатся два неудобных для выполнения расчетов параметра – это m и N. Преобразуем формулу следующим образом:
m = M/NA;
n = N/NA;
m*N = M*n;
P = M*n*v2/(3*V)
Объем сосуда в кубических метрах равен 0,01 м3. Молярная масса молекулы кислорода M равна 0,032 кг/моль. Подставляя в формулу эти значения, а также величины скорости v и количества вещества n из условия задачи, приходим к ответу: P = 533333 Па, что соответствует давлению в 5,3 атмосферы.
Если обозначить Ра — абсолютное давление, — барометрическое, или атмосферное, давление, Р — избыточное (по манометру) давление и Р — давление вакуума (разрежение), то. можно написать [c.410]
Давление абсолютное, избыточное и разрежение (вакуум). [c.32]
Различают абсолютное и избыточное давление. Абсолютным (полным) называют давление, отсчитываемое от абсолютного нуля, т. е. истинное давление. Оно может быть как выше, так и ниже атмосферного. Если абсолютное давление ниже атмосферного, его называют остаточным. Разность между атмосферным и остаточным давлением называют вакуумом или разрежением. Избыточное давление представляет собой разность между абсолютным давлением и давлением окружающей среды. [c.199]
ИЗБЫТОЧНОЕ ДАВЛЕНИЕ, РАЗРЕЖЕНИЕ И АБСОЛЮТНОЕ ДАВЛЕНИЕ [c.12]
Абсолютное давление равно избыточному давлению, которое показывает стрелка манометра, плюс давление атмосферы, измеряемое барометром. При разрежении же абсолютное давление 14 [c.14]
Давление абсолютное, избыточное и разрежение (вакуум). Если гидростатическое давление определяют с учетом атмосферного, то такое давление называют полным или абсолютным, т. е. [c.29]
Приборы для измерения давления (манометры или вакуумметры) показывают не абсолютное давление р , внутри замкнутого объема, а разность между абсолютным и атмосферным, или барометрическим, давлением р м- Эту разность называют избыточным давлением р , если давление в объеме превышает атмосферное, и разрежением Рразр, если оно ниже атмосферного (в системе вакуум). Таким образом [c.25]
При измерении давлений различают абсолютное давление р , избыточное давление и разрежение р . [c.152]
Если при заданном состоянии газа абсолютное давление р его в сосуде является вполне определенной величиной, то избыточное давление ризб. или разрежение V, как видно из выражений (2.93) и (2.95), не являются определенными параметрами, т. е. зависят не только от абсолютного давления р, но и от величины барометрического давления ра, которое может быть переменной величиной. [c.55]
Жидкостные манометры служат для градуировки и поверки приборов други Х систем, для измерения небольших избыточных давлений, разрежений, очень малых абсолютных давлений, а также атмосферного давления. [c.174]
В системах пыле- и золоулавливания газ находится под абсолютным давлением Рабе, которое складывается из атмосферного барометрического Рбар и избыточного давления или разрежения р, Па, т. е. [c.30]
При построении эпюр абсолютное давление откладывают от линии абсолютного нуля давлений. Избыточное давление, превышающее атмосферное, откладывают вверх от линии атмосферного давления, а давление меньше атмосферного (разрежение) откладывают вниз. Отрицательными могут быть относительное полное и статическое давления во всасывающем воздуховоде. Динамическое давление всегда положительное. [c.917]
Избыточным давлением жидкости называется разница между абсолютным давлением жидкости внутри трубопроводэ и таким же давлением окружающей атмосферы. Выражения вроде разрежение в миллиметрах ртутного столба (или столба другой жидкости) , вакуум в kz m и т. п. обозначают отрицательное давление, т. е. давление меньще атмосферного. Отсчеты обычных манометров на трубопроводах выражаются в мерах избыточного давления. [c.833]
Если давление газа Дольше атмосферного, то его называют положительным или избыточным, а если оно меньше—отрицательным или разрежением. Приборы, служащие для измерения давления газов в печах, или, как их называют, тягомеры, показывают не абсолютное давление газа, а насколько оно больше или меньше атмосферного. Тягомеры или манометры бывают самых разнообразных конструкций. Простейшим из них является стеклянная подковообразная трубка, наполненная жидкостью (рис. 69), Когда оба конца трубки открыты, то вода стоит в обоих коленах на одинаковом уровне. Соединим один конец трубки [c.171]
Пример 6-5. Вакуумметр, установленный на всасывающем патрубке насоса, показывает разрежение, равное/>вак.= 440 мм рт. ст., манометр на нагнетательном патрубке того же насоса показывает избыточное давление 1,6 бар. Барометрическое давление В = 1 бар (750 мм рт. ст.). Определить абсолютное давление жидкости во всасывающем и нагнетательном патрубка насоса (в бар, ат, кгс/м и h m ). [c.132]
Избыточное давление может иметь положительное и отрицательное значение. Если из замкнутого объема удалить часть воздуха или газа, то абсолютное давление внутри объема станет меньше атмосферного. Такое состояние называется разрежением. Для измерения давления и разрежения используют одинаковые единицы измерения. [c.17]
Рн = Рб — Ра-Абсолютное и избыточное давление обычно выражают в кПсм и кПм , а разрежение — в мм рт. ст. или мм вод. ст. [c.152]
Разрежение во всасывающих трубопроводах измеряют с помощью вакуумметров, установленных на всасывающих патрубках насосов. Если во всасывающих патрубках может возникнуть избыточное давление, например, когда насосы некоторое время работают под заливом, то на этих патрубках следует устанавливать мановакуумметры — приборы, которые могут измерять и вакуум, и избыточное давление. В этих случаях можно применять также манометры абсолютного давления. [c.190]
Приборы, измеряющие избыточное давление, называют манометрами, абсолютное — барометрами и разрежение — вакуумметрами. [c.315]
В технике различают давления, отсчитываемые от абсолютного вакуума и от барометрического давления. Первое называют абсолютным давлением, а второе, в зазисмости от того, больше оно или меньше барометрического — избыточным давлением или разрежением. [c.31]
Так как большие количества воздуха подаются на станцию или под разрежением, или при очень небольшом избыточном давлении, сечение воздухопровода достигает нескольких квадратных метров. Поэтому удаленный воздухозабор представляет собой дорогостоящее сооружение. Кроме того, большая протяженность воздухозабора приводит к увеличению расхода энергии на сжатие воздуха и снижению производительности компрессоров вследствие нагрева воздуха и снижения абсолютного давления на всасе. Все это заставляет приближать станцию разделения воздуха к наиболее чистой зоне воздушного бассейна. [c.181]
Большие давления принято измерять в технических атмосферах. Давление можно отсчитывать от абсолютного вакуума, тогда оно измеряется в абсолютных атмосферах (ата), и от атмосферного давления, тогда оно измеряется в избыточных атмосферах (ати). Отсчеты величины давления выше атмосферного могут быть обозначены знаком плюс, а ниже — знаком минус (разрежение, вакуум). [c.12]
Итак, хотя абсолютное давление газов понижается по мере перемещения их вверх, разрежение все же уменьшается. Это значит, что разность между давлением воздуха на данной высоте около трубы и давлением газов в трубе на той же высоте будет падать до момента уравнивания этих давлений на выходе из трубы. Это и понятно, так как по мере перемещения газов вверх давление более тяжелого, холодного воздуха должно уменьшаться быстрее, чем давление легких топочных газов. Этот факт имеет также значение и в других процессах. Легко понять, почему, например, светильный газ имеет более высокое давление в зданиях на верхних этажах, чем на нижних. Ибо давление легкого газа понижается медленнее, чем давление более тяжелого воздуха поэтому разность на одном и том же уровне, т. е. избыточное давление газа, будет больше наверху, чем на нижних этажах. [c.128]
Различают также абсолютное давление, отсчитываемое от абсолютного вакуума, и давление, отсчитываемое от атмосферного. Во втором случае иногда давление большее, чем атмосферное, называют избыточным, а меньшее — разрежением. [c.11]
Измерение абсолютного и избыточного давления, разрежения и разности давлений может быть произведено с помощью одного из трех основных измерительных элементов 1) столбика жидкости с известной плотностью, высота которого используется для измерения давления 2) металлического элемента, деформирующегося под давлением и восстанавливающего форму с помощью противодействующей силы (например, пружины) или за счет сил упругости 3) различных электрических И электронных элементов, например, тензометров (приборов для измерения деформации), приборов, действие которых осйовано на явлении теплопро-водности или ионизации . [c.388]
Для прохода лагдкости или газа через фильтрующую перегородку, а в дальнейшем через перегородку и слой осадка, представляющие сопротивление потоку, требуется неренад давления, который ц является движущей силой ироцесса фильтрации. Перепад давления может создаваться весом столба жидкости над фильтрующей перегородкой (гидростатическая фильтрация), избыточным давлением жидкости, например ири подаче ео насосом (фиJ[ьтpaция под давлением), или, наконец, путем создания разрежения под фильтрующей перегородкой при помощи вакуум-насоса (фильтрация под вакуумом), причем в последнем случае движущей силой ироцесса будет разность между давлением над перегородкой атмосферы или среды инертного газа и абсолютным давлением под перегородкой, т. е. в конечном счете величина вакуума. [c.329]
Следует различать а) да,влен1ие атмосферное, б) давление маяо метрическое (избыточное) и в) давление абсолютное (полное). Абсолютное давление равно сумме атмосферного давления и избыточного. Если давление меньше атмосферного, то это давление обозначают как вакуум или разрежение. Абсолютное давление и манометрическое выражают обычно в кг/см . Атмосферное давление и вакуум—,в мм рт. ст. или в мм вод. ст. Приборы для измерения давления выше атмосферного называют манометрами, для измерения давления ниже атмосферного — вакуумметрами. Принципиальной разницы между этими приборами нет, и поэтому одни и те же приборы часто применяют для измерения давления и разрежения. [c.409]
Кроме приведенных в табл. I давлений, в практике приняты давления абсолютное, барометрическое, избыточное и разрежение (замеряемое вакууметром или жидкостным манометром). [c.4]
Под давлением подразумевают абсолютное его значение, отсчи тываемое от абсолютного вакуума. В практике вентиляции принято принимать значения давления, отсчитываемые от барометрического давления, причем при давлениях, больших барометрического, их называют избыточными, при меньших—разрежением. [c.6]
Манометры обычно показывают избыточное давление над барометрическим или разрежение. При технических расчетах обычно выражают абсолютное давление в Мн1м или кГ1м . Величина абсолютного давления определяется как сумма избыточного давления п [c.15]
Соотношение между абсолютным Рабе > избыточным и барометрическим р ар давлениями наглядно показано на рис. 7. Если избыточное давление или разрежение дается в мм столба жидкости, необходимо догтолнительное обозначение, указывающее, что имеется в виду избыточное давление или разрежение. [c.15]
Формулы Поле и Веймаута выведены для случая горизонтального газопровода. Если такой газопровод наполнен неподвижным газом (например закрыт с двух сторон задвижками), то давление газа в различных точках по длине газопровода одинаково. Если начало и конец газопровода имеют различные горизонтальные отметки, то давление в этих точках может оказаться различным. Это различие давлений по высоте газопровода имеет ту же природу, что и разрежение, вызываемое дымовой трубой, и объясняется различием в удельных весах газа и окружающего трубу воздуха. Действительно, статическое давление в газе, так же как и в жидкости, увеличивается с глубиной слоя и это увеличение на один метр глубины равно Y кг./м (или мм Н О), если у выражено в кг/м . Следовательно, увеличение давления с глубиной тем больше, чем больше удельный вес жидкости или газа. Для воды у = 1000 гг/ ж и поэтому на каждый метр глубины давление в воде увеличивается на 1000 иг/м (мт Н 0), для воздуха у = 1,293 кг/м следовательно на 1 м глубины давление увеличивается на 1,293 кг/м (мм Нг О). Если газопровод заполнен газом объемного веса у . а и имеет разность уровней между точками А и В, равную Н м, а избыточное давление газа в точке А равно р кг/м-, то избыточное давление газа в точке В найдем следующим образом. Избыточное давление в некоторой точке газопровода является разностью между абсолютным давлением газа и воздуха в этой точке. При переходе от точки А к точке В на высоту Я м абсолютное давление в воздухе уменьшилось на у воза Н кг/м , а в газе НЗ Y газ Н. Следовательно, разность между этими давлениями, которая в точке А составляла р кг/м , в точке В будет уже [c.349]
В хим. пром-стн распространены датчики, основанные обычио на принципе электрич. (реже-пневматич.) компенсации. Диапазон измерения от 100 Па до 1000 МПа, погрешность 0,5-1,5%. Нанб. перспективны приборы, действие к-рых основано на т. наз. тензорезистивном эффекте-изменении элеггрич сопротивления твердого проводника (чувствит. элемента) в результате его деформации, пропорциональной измеряемому давлению. Этн датчики отличаются простотой конструкции, небольшими габаритами и массой, повыш. виброустойчивостью, высокими динамич характеристиками и небольшой погрешностью (0,25-0,50%). В СССР разработан комплекс тензорезисторных преобразователей давления (избыточного и абсолютного, а также разрежения) и разности давлений с упругими чувст-вит. элементами на основе монокристаллич. подложек нз искусств, сапфира с кремниевыми тензорезисторами. Диапазон измерения от 60 до 10 Па, погрешность обычно не превышает 0,1, 0,25 или 0,5%. В комплекс входят также преобразователи гидростатич. давления, предназначенные для получения информации о плотности или уровне жидкостей, к-рые находятся в открытых либо закрытых резервуарах под давлением. Фланцевое крепление датчика к резервуару с рабочей жидкостью и бескамерная конструкция мембранного измерит, узла позволяют контролировать гид- [c.646]
Давление идеального газа, теория и онлайн калькуляторы
Давление идеального газа
Определение давления идеального газа
Определение
Давление идеального газа — это один из самых важных макроскопических параметров, при помощи которого характеризуют состояние
системы в молекулярной физике.
Обозначают давление буквой $p$. Если для известной массы идеального газа определены давление и температура (или объем), то полагают, что состояние термодинамической системы в состоянии равновесия определяется однозначно, так как существующие законы и уравнения молекулярно кинетической теории (МКТ) позволяют все остальные параметры вычислить.
В общем случае давление определяют как:
[p={mathop{lim }_{Delta Sto 0} frac{Delta F_n}{Delta S} }left(1right),]
где $F_n$ проекция силы на нормаль к поверхности S данная сила оказывает воздействие, $Delta S$- площадь поверхности.
Идеальный газ оказывает давление на стенки сосуда, в котором он находится, за счет того, что молекулы этого газа движутся и ударяются о стенки сосуда. Давление идеального газа можно найти, применяя основные положение МКТ. При этом получают, что давление идеального газа равно:
[p=frac{1}{3}nm_0{leftlangle v_{kv}rightrangle }^2left(2right),]
где $m_0$ — масса одной молекулы газа; $n$- концентрация молекул газа; $leftlangle v_{kv}rightrangle =sqrt{frac{1}{N}sumlimits^N_{i=1}{v^2_i}}, N $- количество молекул в объеме газа равном $V$. Уравнение (2) называют основным уравнением МКТ. Его можно записать в другом виде, используя среднюю кинетическую энергию молекул ($leftlangle E_krightrangle $):
[p=frac{2}{3}nleftlangle E_krightrangle left(3right).]
С таким важным термодинамическим параметром как термодинамическая температура давление связывает формула:
[p=nkT left(4right),]
где $k$ — постоянная Больцмана. Уравнение (4) называют уравнением состояния идеального газа.
Если проводить изохорный процесс ($V=const$) с некоторой массой идеального газа, то давление его будет подчинено закону Шарля:
[p_2=p_1frac{T_2}{T_1}left(5right),]
где $p_1$- давление газа имеющего температуру $T_1$.
При проведении изотермического процесса ($T=const$) c постоянной массой некоторого газа поведение давления можно характеризовать, используя уравнение:
[p_1V_1=p_2V_2left(6right).]
В соответствии с законом Дальтона давление смеси газов можно найти как сумму давлений каждого газа:
[p=sumlimits^N_{i=1}{p_i} left(7right),]
где $p_i$ — давление каждого газа в отдельности.
Уравнения МКТ, содержащие давление идеального газа
Уравнение Менделеева — Клапейрона (еще один вариант уравнения состояния):
$pV=frac{m}{mu }RT$(8),
где $frac{m}{mu }=nu $ -количество вещества; $m$ — масса газа; $mu $- молярная масса газа; $R$ — универсальная газовая постоянная.textit{}
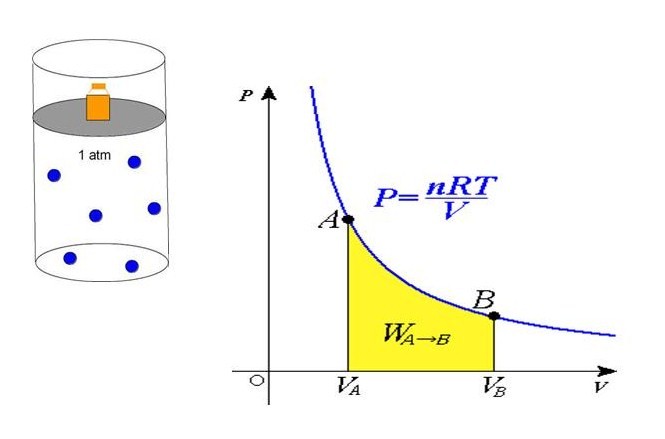
Определение работы газа в термодинамике:
[A=intlimits^{V_2}_{V_1}{pdV}left(9right).]
Соответственно, первое начало термодинамики для идеального газа в дифференциальном виде запишем как:
[delta Q=pdV+frac{i}{2}nu RdTleft(10right),]
где $i$ — число степеней свободы молекулы газа; $delta Q$ — элементарное количество теплоты, которое получает идеальный газ; $frac{i}{2}nu RdT=dU$ — изменение внутренней энергии термодинамической системы.textit{}
Примеры задач с решением
Пример 1
Задание. В идеальном газе проводят процесс, при котором $p=frac{AU}{V},$ где $U$ — внутренняя энергия газа; $A=const$ для определенного газа. Сравните коэффициенты пропорциональности $A$, если в первом случае газ одноатомный, во втором двух атомный. textit{}
Решение. Внутренняя энергия идеального газа для любого процесса равна:
[U=frac{i}{2}nu RT left(1.1right).]
Состояние идеального газа описывает уравнение Менделеева — Клайперона:
[pV=nu RT left(1.2right).]
Подставим правую часть уравнения, которое описывает заданный в условиях задачи процесс ($p=frac{AU}{V}$) вместо давления в (1.2), имеем:
[frac{AU}{V}V=nu RT left(1.3right).]
Получим из (1.3), что внутренняя энергия вычисляется как:
[U=frac{1}{A}nu RTleft(1.4right).]
Сравним выражения для внутренней энергии (1.1) и (1.4), имеем:
[frac{i}{2}=frac{1}{A}left(1.5right).]
Для одноатомного газа $i=3$; для двухатомного газа (без учета колебаний молекул) $i=5$.
[frac{3}{2}=frac{1}{A_1};; frac{5}{2}=frac{1}{A_2}to frac{A_2}{A_1}=frac{3}{2}cdot frac{2}{5}=frac{3}{5}.]
Ответ. $frac{A_2}{A_1}=frac{3}{5}$
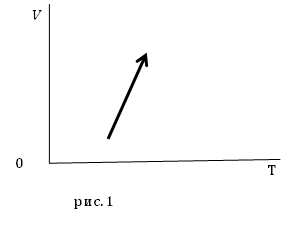
Пример 2
Задание. На рис.1 представлены процессы, проводимые с постоянной массой идеального газа, укажите, как изменяются давления в процессах?
Решение. Уравнение процесса можно аналитически описать уравнением:
[V(T)=AT-B left(2.1right),]
где $A$ и $B$ положительные постоянные величины.
Состояние газа определим при помощи уравнения Менделеева — Клапейрона:
[pV=nu RT left(2.2right).]
Вместо объема подставим уравнение процесса в (2.2):
[pleft(AT-Bright)=nu RTleft(2.3right).]
Раздели обе части (2.3) на температуру:
[frac{pleft(AT-Bright)}{T}=nu Rto pleft(A-frac{B}{T}right)=nu Rto p=frac{nu R}{A-frac{B}{T}} left(2.4right).]
Из уравнения (2.4) следует, что при увеличении температуры $frac{B}{T}$ уменьшается, следовательно, знаменатель дроби правой части выражения (2.4) увеличивается, значит, давление уменьшается.
Ответ. Давление в заданном процессе уменьшается.
Читать дальше: диэлектрический гистерезис.

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 430 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!