Э.Д.С. гальванического элемента определяется по формуле, применение которой рассмотрим в данной статье.
Содержание:
1.Что такое Э.Д.С. и от чего она зависит
2. Стандартные электродные потенциалы
2.1.Как устроен и как работает гальванический элемент с водородным электродом
2.2. Э.Д.С. гальванического элемента с водородным электродом
2.3. Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
2.4. Ряд напряжений металлов. Что это такое и каково его значение
3.Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Гальванический элемент является прибором, который позволяет при посредстве химической реакции получить электрическую энергию. А происходит это потому, что один металл готов отдать свои электроны другому, тот же, в свою очередь, их принять.
Но что обеспечивает такую готовность, какая сила заставляет эти электроны перемещаться?
Для сравнения способности одного металла отдавать свои электроны другому измеряют и рассчитывают электродвижущую силу (обозначим ее как Э.Д.С.)
Что такое Э.Д.С. и от чего она зависит
Сила, позволяющая перемещаться электронам по цепи в гальваническом элементе, называется электродвижущей силой (E), которая в данном случае означает то же, что и напряжение, и потенциал. Поэтому Э.Д.С. измеряется в вольтах.
Вспомним, что 1 вольт (В) представляет собой электродвижущую силу, которая позволяет заряду в 1 кулон (Кл) приобрести энергию в 1 джоуль (Дж).
ЭДС гальванического элемента определяется многими факторами:
— проводимым в элементе химическим процессом;
— концентрацией участников процесса (как реагентов, так и продуктов);
— температурой.
Если гальванический элемент работает в стандартных условиях, то его Э.Д.С. называется стандартной и обозначается Е°.
Стандартные электродные потенциалы
Еще со времен Галилея известно, что все в мире относительно. С тех пор любые события, процессы и явления мы можем рассматривать относительно других событий, процессов или явлений.
Чтобы понять, какова же Э.Д.С. конкретного металла, нужно сравнить ее с такой Э.Д.С., величина которой нам наверняка известна. Для этого был составлен гальванический элемент с газообразным водородом в качестве электрода.
Как устроен и как работает гальванический элемент с водородным электродом
Значение потенциала водородного электрода, с которым будут сравниваться величины измеряемых потенциалов электродов гальванического элемента, условно принимается на ноль.
Конечно же сам водород подключить к цепи мы не можем, так как это газообразное вещество.
Итак, в цепь включена тонкая платиновая Pt пластинка, имеющая дополнительное покрытие из платины, осажденной на ее поверхности электролитическим путем. Здесь адсорбируется газообразный водород, который дополнительно удерживается стеклянной колбой. Последняя же заполнена электролитом: 2н. раствором серной кислоты H2SO4. Кроме того, сюда из баллона подается водород H2.
Вторая часть гальванического элемента, как обычно, представлена цинковой пластинкой (анод), погруженной в раствор соли этого же металла, например, сульфата цинка ZnSO4 . Электроны анода после замыкания цепи переходят в катодное пространство и обеспечивают там восстановление ионов водорода H+:
Схематично рассмотренный гальванический элемент записывают так:
После замыкания цепи стрелка прибора покажет величину потенциала 0,76 В.
ЭДС гальванического элемента с водородным электродом
Итак. Стрелка вольтметра остановилась на значении 0,76 В. Это и есть величина Э.Д.С. гальванического элемента, устройство которого мы рассмотрели.
Поскольку в гальваническом элементе всегда одновременно протекают два противоположных процесса: окисление и восстановление, то Э.Д.С. элемента будет представлена суммой двух потенциалов: окислительного и восстановительного соответственно
Тогда посчитаем:
Поскольку в ходе процесса окисляется цинк, посчитанное (и измеренное) значение Э.Д.С. будет относиться не столько ко всему элементу, сколько к цинковому аноду.
Именно таким же образом, имея в распоряжении стандартный водородный электрод, были получены значения других стандартных электродных потенциалов.
Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
Возможны случаи, когда электрод в одном гальваническом элементе является анодом, а в другом (в паре с другим металлом) катодом. Иными словами, в зависимости от ситуации он может как окисляться, так и восстанавливаться. Какой же электродный потенциал будет иметь металл?
В таких ситуациях работает правило:
потенциалы окислительного и восстановительного процессов имеют одинаковое численное значение и противоположны по знаку
Например, для цинка:
Важно отметить, что в справочных таблицах стандартных электродных потенциалов принято отображать только восстановительные процессы. Поэтому, если электрод, значение Э.Д.С. которого вам надо взять из такой таблицы, является участником окислительного процесса, вы находите в ней значение Э.Д.С. для него, как для участника восстановительного процесса, и меняете знак на противоположный.
Итак, в самом общем случае Э.Д.С. гальванического элемента определяется по формуле:
Необходимо учесть, что
Э.Д.С. гальванического элемента всегда положительна
Определим Э.Д.С. гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их солей:
Для вычисления воспользуемся справочной таблицей стандартных электродных потенциалов металлов и формулой для расчета Э.Д.С., учитывая, что из двух значений потенциалов, меньшее будет соответствовать окислительным процессам на аноде, а большее – восстановительным процессам на катоде.
По данным таблицы восстановительный потенциал цинка равен -0,763 В. В данном процессе цинк окисляется, значит, его окислительный потенциал составляет +0,763 В. Медь восстанавливается, ее потенциал равен +0,337 В.
Ряд напряжений металлов. Что это такое и каково его значение
Если измерить указанным выше образом значения стандартных электродных потенциалов металлов и расположить их в порядке возрастания, то получится знаменитый ряд напряжений металлов (не совсем верный термин). Лучше его называть рядом стандартных электродных потенциалов металлов. Он имеет еще несколько названий: электрохимический ряд активности металлов, ряд Бекетова. В нем кроме металлов присутствует единственный неметалл водород. Надеемся, теперь понятно, почему.
Вот этот ряд:
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Cu Hg Ag Pt Au
Каково же значение данного ряда?
По величинам стандартных электродных потенциалов можно предположить, насколько ярко выражены те или иные свойства соответствующих металлов:
1) Чем меньше величина потенциала, тем более активным является металл. Так, ряд начинается литием. Величина его потенциала Е°=-3,045 В. Это самое маленькое значение среди всех остальных. И действительно, литий очень активный металл. Он легко окисляется и трудно восстанавливается из своего иона.
2) Все металлы, стоящие в данном ряду левее водорода (т.е. имеющие отрицательное значение потенциала) вытесняют его из разбавленных кислот (кислот, подобных соляной, серной).
3) Каждый предыдущий металл ряда вытесняет все последующие из растворов их солей. Например:
Этот вывод можно подтвердить расчетами:
А вот такая реакция не возможна:
И это также легко подтверждается вычислением Э.Д.С. предполагаемого окислительно-восстановительного процесса:
Полученное отрицательное значение Э.Д.С. говорит о том, что переход электронов с меди на железо не возможен.
4) Если построить из металлов данного ряда гальванический элемент, то его Э.Д.С. будет тем больше, чем больше разность стандартных электродных потенциалов этих металлов.
Например, какой окислительно-восстановительный процесс будет идти эффективнее: вытеснение железа из его соли магнием или цинком? Для ответа на этот вопрос необходимо посчитать Э.Д.С. обоих процессов и сравнить полученные значения:
В обоих случаях Э.Д.С. положительна. Значит, процессы возможны. Однако, взаимодействие сульфата железа (II) с магнием более эффективно, чем с цинком почти в 6 раз.
Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Разберем еще несколько примеров, в которых применяется формула, по которой определяется Э.Д.С. гальванического элемента.
Задача 1. Рассчитайте, будет ли протекать реакция при погружении пластинки железа в 1М раствор сульфата никеля.
Решение:
Так как значение Э.Д.С. предполагаемой окислительно-восстановительной реакции положительное, то такая реакция возможна.
Задача 2. Рассчитайте Э.Д.С., укажите направление движения электронов в имеющейся комбинации электродов:
Решение:
Окисляется свинцовый Pb анод, его электроны будут переходить на серебряный Ag катод.
Задача 3. Подтвердите расчетом, будет ли металлический никель растворяться: а) в 2М растворе серной кислоты; б) в растворе сульфата калия с той же активностью ионов.
Решение:
Задача 4. Определите возможность протекания в водном растворе реакции между хлором и хлоридом железа (II).
Решение:
Задача 5. Вычислите стандартную Э.Д.С. гальванического элемента, в котором протекает реакция:
Решение:
Важный вывод из этой задачи:
значение Э.Д.С. гальванического элемента зависит от концентраций участников окислительно-восстановительного процесса, но не зависит от их количеств.
Количество вещества йода, которое мы умножили в окислительной полуреакции на три для соблюдения электронного баланса, не имеет значения, и поэтому величину стандартного электродного потенциала этой полуреакции на три умножать не нужно. Так же поступают во всех подобных случаях.
Таким образом, ЭДС гальванического элемента определяется по формуле, учитывающей значения стандартных электродных потенциалов. Она позволяет определить эффективность окислительно-восстановительного процесса, как в гальваническом элементе, так и при взаимодействии металла с раствором соли другого металла.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ
Возникновение разности потенциалов на границе металл-раствор.
При контакте металлической пластины с водой катионы, расположенные на поверхности металла, взаимодействуют с диполями воды (рис.4.1 а). Выделяющаяся при этом энергия гидратации идет на разрыв связи катионов с кристаллической решеткой металла, и часть ионов переходит в раствор. В результате этого процесса поверхность металла заряжается отрицательно, а раствор около пластинки — положительно. Образующийся при этом двойной электрический слой (ДЭС), схематически показанный на рис.4.1б, приводит к возникновению разности потенциалов на границе раздела двух фаз металл-раствор. Система, состоящая из металла, погруженного в раствор соли, содержащей катионы этого металла, называют
электродом.
Рис 4.1 а) взаимодействие катионов металла с диполями воды и б) образование двойного электрического слоя на границе металл-вода.
С ростом заряда поверхности скорость перехода ионов в раствор (VМ→р-р) уменьшается и увеличивается скорость обратного процесса (V р-р →Ме) до тех пор, пока не установится состояние динамического равновесия, при котором VМ→р-р = Vр-р →М .
При погружении металла(проводник Ιрода) в раствор его соли(проводникΙΙ рода) , заряд металла будет зависеть от начального соотношения скоростей перехода катионов в раствор и обратно, что определяется химической природой металла.
(раствор) (электрод)
Если в начальный момент времени VМ→р >V р →М, металл окисляется и заряжается отрицательно, в случае VМе→р < Vр →М, (металл восстанавливается) поверхность металла приобретает положительный заряд. Так при погружении цинка в раствор его соли металл заряжается отрицательно, в то время как контакт меди с раствором соответствующей соли сопровождается образованием положительного заряда на металле. Направление самопроизвольного перехода ионов определяется убылью энергии Гиббса в этих процессах (∆G<0).
Двойной электрический слой на границе металл-раствор может возникать не только за счёт перехода ионов металла в раствор, но также за счет поверхностных химических реакций, сопровождающихся переходом заряженных частиц с поверхности металла в раствор и обратно. Так, например, водород, адсорбируясь на поверхности платины (инертного металла), диссоциирует на ионы по реакции
Образующийся ион Н+ переходит в раствор, при этом платина заряжается отрицательно. Если концентрация Н+ в растворе велика, возможен обратный процесс, и Pt заряжается положительно. Такой электрод называется водородным. Изменение давления водорода и концентрации ионов Нр+ приводит к смещению равновесия реакции (4.2) и изменению заряда электрода.
Водородный электрод при давлении водорода равном 1 атм и активности ионов водорода равной 1 называют стандартным водородным электродом и
используют для определения величины скачка потенциала на границе металлраствор, абсолютное значение которого измерить невозможно. Потенциал
стандартного водородного электрода ∆φ0 H+/ H2 условно принят за нуль.
В лабораториях часто используют электроды, состоящие из металла, покрытого слоем его труднорастворимой соли, погруженного в раствор хорошо растворимой соли с тем же анионом. К таким электродам относится, например, хлорсеребряный электрод, представляющий собой серебряную проволоку, покрытую слоем AgCI и погруженную в раствор KCI. Электродный потенциал такого электрода возникает за счет реакции
AgCl=Ag+ + Cl —
Ag+ + e=Ag0
|
Суммарная реакция |
|
|
AgClтв+ e=Ag0+ Cl— |
(4.3), |
Если инертный металл (например, Pt) погрузить в раствор, содержащий окисленную и восстановленную форму одного вещества (например, раствор FeCl2 и FeCl3), то такой электрод называют окислительно-восстановительнымили редокс-электродом.
Потенциал, который возникает в данной окислительно-восстановительной системе,
называется окислительно-восстановительным или редокс-потенциалом. Редокс-
потенциал возникает в результате того, что на поверхности Pt протекает окислительновосстановительная реакция, например:
Платина в электродных реакциях не участвует, а является лишь переносчиком электронов для протекающей на ее поверхности реакций и в зависимости от направления процесса является акцептором или донором электронов. В рассмотренном выше примере при избытке окисленной формы в растворе CFe3+> CFe2+ поверхность Pt заряжается положительно. В случае CFe3+< CFe2+ поверхность Pt заряжается отрицательно.
Во всех рассмотренных выше примерах (реакции (4.1) — (4.4)) скачок потенциала на границе электрод-раствор возникает вследствие окислительно-восстановительных реакций, протекающих на поверхности металла. Если окисленную форму вещества обозначить ох, а восстановленную red, то в общем виде электродную реакциюможно записать в виде:
ох+ ne = red
Величина скачка потенциала определяется температурой, природой окислительновосстановительной системы и соотношением активностей окисленной и восстановленной форм:
|
∆φ=∆φ0 + |
RT |
ln(aox/ ared) |
(4.5), |
|
nF |

где ∆φ0 — скачок потенциала при аox = ared = 1, R — газовая постоянная, F -число Фарадея. Этуформулуназывают уравнением Нернста.
Гальванические элементы.
Химическая энергия, выделяющаяся в результате реакций окисления и восстановления, протекающих на электродах, может быть превращена в электрическую в гальваническом элементе, который составляют из двух электродов или полуэлементов. Условием работы подобного источника тока является пространственное разделение процессов окисления и восстановления. В качестве примера такого устройства на рис.4.2 показан медно-цинковый элемент Даниэля-Якоби.
На цинковом электроде протекает реакция окисления и цинк заряжаетсяотрицательно:
|
1. Znтв-2 е—→Zn2+р-р |
∆G= — 146 кДж/моль (4.6) |
На медном– реакциявосстановления, поверхность меди заряжаетсяположительно:
|
2. Cu2+p-р+ 2e—→ Cuтв |
∆G= — 66 кДж/моль (4.7) |
|
Суммарная реакция, протекающая в элементе, |
|
|
Znтв + Cu2+p = Zn2+p + Cuтв |
∆G= — 212 кДж/моль (4.8) |
Эту же реакцию можно провести внеся кусочек цинка в раствор CuSO4, однако тока в этом случае не получим.
Медно-цинковый элемент схематически можно записать следующим образом
(-)Cu │ Zn │ZnSO4р
|
или |
Cu │ Zn │ZnSO4 ││ CuSO4 │ Сu (4.9) |
Отрицательный электрод, на котором протекает реакция окисления (анод) принято записывать слева. Сплошной вертикальной чертой (│) обозначают границу раздела фаз, на которой возникает скачок потенциалов ,границы между электролитами обычно обозначают пунктирной вертикальной чертой.
Электродвижущую силу (ЭДС ),которая численно равна максимальной работе по перемещению заряда рассчитывают как
|
E=ECu2+|Cu— EZn2+|Zn+φk+φD, |
(4.10) |
где φk— скачок потенциала на границе контакта двух металлических проводников(этот потенциал в данной цепи равен нулю); φD— скачок потенциала на границе раздела
проводников второго рода:р-р ZnSO4|р-р KCl| р-р CuSO4.На этих границах раздела возникают двойные электрические слои. Однако подвижности ионов K— и Cl— близки, поэтому эти скачки потенциала пренебрежительно малы. Практически ЭДС гальванического элемента равна:
|
E=ECu2+|Cu— EZn2+|Zn |
(4.11) |
Величина ЭДС связана с изменением изобарного потенциала для реакции, протекающей в гальваническом элементе, по уравнению:
где n — число электронов, участвующих в реакции; F — число Фарадея (96485 Кл/моль).
Электродные потенциалы.
Так как экспериментально невозможно измерить разность потенциалов между двумя точками, находящимися в разных фазах, например между металлом и раствором его соли, для определения потенциала исследуемого электрода составляют гальванический элемент из исследуемого электрода и стандартного водородного электрода, при этом последний всегда стоит слева. Например:
M│Pt │ H2 │ H+││Mn+│M
Электродвижущая сила такого элемента Электродный потенциал обозначают как восстановления.
Mn+ + пе— = М°
EMn+/M =∆φ0H 2/H+ + ∆φM n+/M =∆φMn+ /M
называется электродным потенциалом.
ЕMen+/Me всегда к электродной реакции
(4.13)
Подставляя в (4.13) уравнение (4.5) получим зависимость электродного потенциала от природы металла, активности его ионов и температуры
|
E = E0 + |
RT |
ln(aox/ ared) = E0 + |
RT |
ln(aMn+/ aM0 ) |
(4.14) |
|
nF |
nF |
где E0Mn+/M — стандартный электродный потенциал.
|
Для металлического электрода aM0 = const и |
|||
|
E = E0 + |
RT |
ln aMn+ |
(4.15) |
|
nF |
Для окислительно-восстановительных электродов величина электродного потенциала определяется соотношением окисленной и восстановленной форм и уравнение Нернста записывается в виде:
|
E = E0 + |
RT |
ln(aox/ ared) |
(4.16) |
|
nF |
Стандартный электродный потенциал Е° считается положительным, если электрод заряжен более положительно, чем стандартный водородный электрод и отрицательным в противоположном случае.
В случае медного электрода на нем идет реакция восстановления и знак электродного потенциала будет положительным.
|
Cu2++ 2e→ Cu0 |
E0Cu2+/Cu= 0, 34B |
Если на электроде протекает реакция окисления, как на цинковом электроде, то знак электродного потенциала противоположный. Например,
Zn2+ + 2e = Zn0 E0Zn2+/Zn= — 0,76 B
Значения стандартных электродных потенциалов (E0Mn+/M ) приведены в справочнике. Величина стандартного электродного потенциала характеризует стремление
электродной реакции протекать в направлении восстановления иона. Чем больше значение потенциала, тем больше способность окисленной формы вещества присоединить электроны и перейти в восстановленную, тем более сильным окислителем она является, и наоборот. Для сравнения:
E0Mg2+/Mg= — 2, 37 B ,E0F—/F2 /Pt = 2,87 B.
На практике для измерения электродного потенциала обычно используют электроды сравнения, более простые в употреблении, чем водородный. В качестве электродов сравнения используют такие электроды, потенциал которых известен, точно воспроизводим и остается постоянным во время измерений.
К таким электродам относится хлорсеребряный электрод, описанный выше (см. уравнения (4.3)). Потенциал этого электрода определяется активностью ионов хлора
|
∆ E = ∆ E0 — |
RT |
ln aCl — |
(4.17) |
|
F |
Значения электродного потенциала хлорсеребряного электрода приведены в справочнике. В нашем практикуме используется хлорсеребряный электрод с насыщенным раствором КСl. Потенциал такого электрода зависит только от температуры и его
величина, выраженная в вольтах, рассчитывается по формуле:
|
E =0, 2224–0, 00065(t–25). |
(4.18) |
Зная величины стандартных электродных потенциалов можно рассчитать ЭДС любого гальванического элемента. При этом удобно пользоваться следующими правилами:
1.Реакция, протекающая у левого электрода, записывается как реакция окисления, а реакция у правого электрода — как реакция восстановления. Суммарная реакция в гальваническом элементе представляет собой сумму обеихреакций.
2.Стандартная ЭДС элемента равна стандартному электродному потенциалу правого электрода минус стандартный электродный потенциал левого электрода
|
E0 = E0 прав – Е0 лев |
(4.19) |
Для Сu-Zn гальванического элемента ЭДС можно вычислить следующим образом :
|
0 |
0 |
RT |
2+ |
RT |
2+ |
|||||
|
E= ECu – EZn = E |
Cu – E |
Zn + |
ln aCu |
— |
ln aZn |
= |
||||
|
2F |
2F |
|||||||||
|
=E0 — |
RT |
ln (aZn2+/aCu2+) |
(4.20) |
|||||||
|
2F |
Работа 7. Измерение ЭДС гальванического элемента.
Цель работы: 1. Измерить ЭДС Cu-Zn гальванического элемента и электродные потенциалы отдельных электродов, сравнить ЭДС Cu-Zn элемента с вычисленной по значениям измеренных электродных потенциалов и по уравнению Нернста. 2. Измерить ЭДС концентрационного элемента и сравнить ее с вычисленной по уравнению Нернста.
Порядок выполнения работы:
I. Измерение ЭДСCu-Znгальванического элементапотенциометром.
1.Составить для работы медно-цинковый гальванический элемент. С этой целью налить в сосуды с медным и цинковым электродами растворы CuSO4 и ZnSO4 , соответственно. Стеклянный соединительный мостик заполнить насыщенным раствором KCl, избегая появления пузырьков. В соединительную пробирку налить насыщенный раствор КСl.
2.Подключить медно-цинковый элемент к потенциометр:медный электрод подключит к клемме «+»потенциометра, цинковый к «-»
3. Измерить ЭДС Cu-Zn элемента с помощью потенциометра. Результаты измерений записать в таблицу4.1.
3.Вычислить ЭДС Cu-Zn элемента по формуле (4.20) и результат вычислений записать в таблицу4.1.
Таблица4.1ОпределениеЭДСCu-Znэлемента.
|
E0Cu2+/Cu= ……………………..E0Zn2+/Zn=……………. |
E0г.э. =……………………. |
||||||||
|
CuSO4 |
ZnSO4 |
Еизм |
Евыч |
||||||
|
(В) |
|||||||||
|
Смоль/л |
γ +- |
а |
Смоль/л |
γ+ — |
а |
(В) |
|||
|
0,1 |
0,1 |
||||||||
|
0,1 |
1,0 |
||||||||
|
1,0 |
0,1 |
||||||||
II. Определение потенциалов Zn- и Си— электродов.
1. Определить электродный потенциал Zn-электрода. Для этого составить гальванический элемент из цинкового и хлорсеребряного электродов и с помощью потенциометра измерить его ЭДС. Записать в тетради электродные реакции, протекающие в этом элементе.
Zn│ZnSO4 ││Klнасыщ │AgCl│Ag
Величину потенциала Zn-электрода рассчитать по формуле (4.21). Значение потенциала хлорсеребряного электродаЕАg найти по формуле (4.18).
|
Eг.э. =EAg– EZn |
и |
EZn = EAg — Eг.э. |
(4.21) |
2. Определить потенциал Cu-электрода, составив гальванический элемент из медного и хлорсеребряного электродов и измерив его ЭДС. Записать в тетради электродные реакции, протекающие в этом элементе.
Ag│ AgCl│ Klнасыщ ││CuSO4│Cu

3. Рассчитать электродный потенциал Cu-электрода, учитывая, что Cu-электрод
|
является положительным: |
||
|
Eг.э. =EСu – EAg |
и |
ECu = Eг.э. + EAg |
4. Вычислить по формуле Нернста (4.15) электродные потенциалы Zn- и Си- электродов. Значения стандартных потенциалов и коэффициентов активности взять из справочных таблиц. Результаты вычислений записать в таблицу4. 2.
Таблица 4.2 Определение электродных потенциалов Zn- и Сuэлектродов.
t0C………… EAg………………………………
|
электрод |
MeS04 |
Ег.э |
Е г.э(изм) |
Е в |
|||
|
С |
γ + — |
а |
(В) |
||||
|
Zn2+/Zn |
0,1 |
||||||
|
1,0 |
|||||||
|
Cu2+/Cu |
0,1 |
||||||
|
1,0 |
|||||||
III. Измерение ЭДС концентрационного элемента.
1. Подготовить для работы один из двух указанных ниже концентрационных гальванических элементов
|
(-)Zn│ZnSO4││ZnSO4│Zn(+) или |
(-)Cu │CuSO4│CuSO4│Cu(+) |
||
|
С1 |
С2 |
С1 |
С2 |
с концентрациями солей С1= 0,1 моль/л и С2 = 1,0 моль/л, подключить элемент к потенциометру и измерить его ЭДС.
2.Рассчитать ЭДС концентрационного элемента по формуле:
|
R T |
С |
2 |
|||||||||||
|
E Eправ Елев |
ln |
||||||||||||
|
для |
комнатной |
||||||||||||
|
С1 |
|||||||||||||
|
температуры |
2 F |
||||||||||||
|
Результаты записать в таблицу 4.3 |
|||||||||||||
|
Таблица 4.3 |
|||||||||||||
|
MeSO4 |
|||||||||||||
|
элемент |
C1 |
γ+- |
a1 C2 γ+- a2 |
Ег.э.выч Ег.эизм |
Сu
Zn
от log(Cox /Cred) (линейные координаты
Контрольные вопросы
Перед выполнением работы:
1.Какова цель данной работы?
2.Как производится измерение ЭДС медно-цинкового и концентрационного гальванических элементов?
3.Как измерить потенциалы Си- и Zn— электродов?
4.Какие электроды используются в данной работе?
5.Запишите схемы гальванических элементов, используемых в работе.
6.Как вычислить ЭДС медно-цинкового гальванического элемента по уравнению Нернста?
7.Как вычислить потенциалы Си- и Zn— электродов?
К защите работы:
1.Поясните термины: электрод, электродная реакция, гальванический элемент, ЭДС, электродный потенциал, стандартный электродный потенциал.
2.Если в гальваническом элементе протекает самопроизвольный процесс, а) на каком электроде происходит окисление; б) какой из электродов считается отрицательным; в) каков знак ЭДС.; г) каков знак изменения энергии Гиббса данной реакции?
3.Запишите электродные реакции для используемых в работе гальванических элементов.
4.Как по величине электродных потенциалов рассчитать ЭДС элемента определить направление реакции, протекающей в этом элементе?
5.Какие электроды используют в качестве электродов сравнения?
6.Какой элемент называется концентрационным?
Работа 8. Измерение окислительно-восстановительных потенциалов.
Цель работы. Измерить редокс-потенциал раствора, содержащего соли К3Fе(СN)6 и К4Fе(СN)6, и изучить зависимость величины потенциала от соотношения концентраций окисленной и восстановленной форм железа.
Порядок выполнения работы.
1. Включить иономер, подсоединить к нему платиновый и хлорсеребряный электроды. Схема составленного гальванического элемента:
(-)Ag│ AgCl, KClнасыщ││ K3[Fе(СN)]6— , K4[Fе(СN)6] │Pt(+)
2.Пользуясь бюретками отмерить в химический стакан растворы K4Fe(CN)6 и K3Fe(CN)6 в соотношении, указанном в табл. 4.4, добавить раствор КСl. Опустить в стакан электроды и измерить ЭДС гальванического элемента. Результаты записать в таблицу.
3.Аналогичные измерения произвести с другими редокс-системами.
4.Величинуредокс-потенциалаEox/red рассчитать по формуле:
Eox/red= Eг.э +EAg,
где Eox/red — редокс-потенциал; Eг.э — измеренная ЭДС гальванического элемента; EAg — потенциал насыщенного хлорсеребряного электрода, величину которого для данной тепературы найти по формуле (4.18).
5. Построить график зависимости Eox/red
уравнения Нернста). Из графика определить тангенс угла наклона прямой и сравнить его с величиной 2,3RT/F в уравнении Нернста.
6. Из графика определить величину стандартного редокс-потенциала E°ox/red. Объясните расхождение величины E°ox/red с табличным значением стандартного редокспотенциала для этой системы.
7.Запишите в тетради уравнения электродных реакций.
Таблица 4.4
|
Объем, мл |
Сox/Сred |
lg(Сox/Сred |
E, |
Er, |
|||
|
K3[Fе(СN)]6 |
K4[Fе(СN)6] |
КСl |
В |
B |
|||
|
20 |
2 |
10 |
|||||
|
16 |
6 |
10 |
|||||
|
11 |
11 |
10 |
|||||
|
6 |
16 |
10 |
|||||
|
2 |
20 |
10 |
|||||
Контрольные вопросы
Перед выполнением работы
1.Какие электроды используются при определении редокс — потенциала?
2.Запишите схему гальванического элемента, используемого в работе.
3.Как рассчитывается редокс-потенциал системы?
4.Почему зависимость редокс-потенциала от log(Cox/Cred) изображается прямой линией?
5.С какой целью во все исследуемые редокс-системы вводится раствор КСl?
Кзащите
1.Какие системы называют окислительно-восстановительными?
2.Что называют стандартным окислительно-восстановительным потенциалом?
3.От каких параметров зависит величина редокс-потенциала?
4.Какова роль Pt при измерении окислительновосстановительного потенциала? Можно ли её заменить другим металлом и каким?
5.Как зависит заряд поверхности Pt от соотношения концентраций окисленной и восстановленной форм в растворе?
6.Запишите электродные реакции для используемого в работе гальванического элемента. ?
7.Как по величине электродных потенциалов рассчитать ЭДС элемента и определить направление реакции, протекающей в этом элементе?
8.Как по величине редокс-потенциала можно охарактеризовать окислительные свойства системы?
7.Приведите примеры веществ, которые в стандартном состоянии могут быть а) окислены бромом; б) восстановлены иодид-ионами в водном растворе.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
…
Электродные потенциалы. ЭДС реакции
Окислительно — восстановительный потенциал является частным, узким случаем понятия электродного потенциала. Рассмотрим подробнее эти понятия.
В ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции переходит в теплоту.
Энергия любой ОВР, протекающей в растворе электролита, может быть превращена в электрическую энергию, если, например, окислительно-восстановительные процессы разделить пространственно, т.е. передача электронов восстановителем будет происходить через проводник электричества.
Это реализовано в гальванических элементах, где электрическая энергия получается из химической энергии окислительно-восстановительной реакции.
Элемент Даниэля-Якоби
Рассмотрим гальванический элемент Даниэля-Якоби, в котором левый сосуд наполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой.
Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Значение и знак (+ или -) электродного потенциала определяются природой раствора и находящегося в нем металла.
При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно.
Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e— = Zn2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu2+ + 2e— = Cu
Таким образом, в элементе Даниэля-Якоби происходит такая реакция:
Zn + Cu2+ = Zn2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю).
Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
Проведем реакцию
2Fe3+ + 2I— = 2Fe2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник.
В сосуды, содержащие растворы Fe3+ и I—, поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток.
Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe3+:
2I— — 2e— = I2
2Fe3+ + 2e— = 2Fe2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом.
Факторы, влияющие на значение окислительно-восстановительного потенциала
Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
1) Природа вещества (окислителя и восстановителя)
2) Концентрация окисленной и восстановленной форм.
При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
E = E° + (RT/nF)ln(Cок/Cвос), где
E – окислительно-восстановительный потенциал данной пары;
E°- стандартный потенциал (измеренный при Cок = Cвос);
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
Cок – концентрация (активность) окисленной формы;
Cвос– концентрация (активность) восстановленной формы.
Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения:
E = E° + (0,059/n)lg(Cок/Cвос)
При Cок > Cвос, E > E° и наоборот, если Cок < Cвос, то E < E°
3) Кислотность раствора
Для пар, окисленная форма которых содержит кислород (например, Cr2O72-, CrO42-, MnO4—) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H+. И наоборот, окислительно-восстановительный потенциал падает с уменьшением H+.
4) Температура
При увеличении температуры окислительно-восстановительный потенциал данной пары также растет.
Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С.
Такие таблицы дают возможность сделать некоторые выводы:
Что можно определить по значению окислительно-восстановительного потенциала
- Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют предсказать какие свойства (окислительные или восстановительные) будут проявлять атомы, ионы или молекулы в химических реакциях, например
E°(F2/2F—) = +2,87 В – сильнейший окислитель
E°(K+/K) = — 2,924 В – сильнейший восстановитель
Окислительно-восстановительная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал.
- Возможно определить какое из соединений одного элемента будет обладать наиболее сильным окислительными или восстановительными свойствами.
- Возможно предсказать направление ОВР. Известно, что работа гальванического элемента имеет место при условии, что разность потенциалов имеет положительное значение. Протекание ОВР в выбранном направлении также возможно, если разность потенциалов имеет положительное значение. ОВР протекает в сторону более слабых окислителей и восстановителей из более сильных, например, реакция
Sn2+ + 2Fe3+ = Sn4+ + 2Fe2+
практически протекает в прямом направлении, т.к.
E° (Sn4+/Sn2+) = +0,15 В,
E° (Fe3+/Fe2+) = +0,77 В,
т.е. E° (Sn4+/Sn2+) < E° (Fe3+/Fe2+).
Реакция
Cu + Fe2+ = Cu2+ + Fe
невозможна в прямом направлении и протекает только справа налево, т.к.
E° (Сu2+/Cu) = +0,34 В,
E° (Fe2+/Fe) = — 0,44 В,
E° (Fe2+/Fe) < E° (Сu2+/Cu).
В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются.
- Если при данных условиях возможно протекание нескольких ОВР, то в первую очередь будет протекать та реакция, у которой разность окислительно-восстановительных потенциалов наибольшая.
- Пользуясь справочными данными, можно определить ЭДС реакции.
Как определить электродвижущую силу (ЭДС) реакции?
Рассмотрим несколько примеров реакций и определим их ЭДС:
- Mg + Fe2+ = Mg2+ + Fe
- Mg + 2H+ = Mg2+ + H2
- Mg + Cu2+ = Mg2+ + Cu
E° (Mg2+/Mg) = — 2,36 В
E° (2H+/H2) = 0,00 В
E° (Cu2+/Cu) = +0,34 В
E° (Fe2+/Fe) = — 0,44 В
Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя
ЭДС = Е0ок — Е0восст
- ЭДС = — 0,44 — (- 2,36) = 1,92 В
- ЭДС = 0,00 — (- 2,36) = 2,36 В
- ЭДС = + 0,34 — (- 2,36) = 2,70 В
Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0.
Связь константы равновесия и окислительно — восстановительного потенциала
Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия.
Например, для реакции
Zn + Cu2+ = Zn2+ + Cu
Применяя закон действующих масс, можно записать
K = CZn2+/CCu2+
Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди.
Значение константы равновесия можно вычислить, применив уравнение Нернста
E = E° + (0,059/n)lg(Cок/Cвос)
Подставим в уравнение значения стандартных потенциалов пар Zn/Zn2+ и Cu/Cu2+, находим
E0Zn/Zn2+ = -0,76 + (0,59/2)lgCZn/Zn2+
E0Cu/Cu2+ = +0,34 + (0,59/2)lgCCu/Cu2+
В состоянии равновесия E0Zn/Zn2+ = E0Cu/Cu2+, т.е.
-0,76 + (0,59/2)lgCZn2+ = +0,34 + (0,59/2)lgCCu2+, откуда получаем
(0,59/2)( lgCZn2 — lgCCu2+) = 0,34 – (-0,76)
lgK = lg (CZn2+/CCu2+) = 2(0,34 – (-0,76))/0,059 = 37,7
K = 1037,7
Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 1037,7 раз меньше, чем концентрация ионов цинка.
Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой:
lgK = (E10 -E20 )n/0,059, где
K — константа равновесия
E10 и E20 – стандартные потенциалы окислителя и восстановителя соответственно
n – число электронов, отдаваемых восстановителем или принимаемых окислителем.
Если E10 > E20, то lgK > 0 и K > 1.
Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E10 — E20) достаточно велика, то она идет практически до конца.
Напротив, если E10 < E20, то K будет очень мала.
Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E10 — E20) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий.
Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции.
По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций.
Как составить схему гальванического элемента?
Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции:
- ЭДС элемента — величина положительная, т.к. в гальваническом элементе работа производится.
- Значение ЭДС гальванической цепи – это сумма скачков потенциалов на границах раздела всех фаз, но, учитывая, что на аноде происходит окисление, то из значения потенциала катода вычитают значение потенциала анода.
Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод).
- Граница раздела фаз обозначается одной чертой — |
- Электролитный мостик на границе двух проводников обозначается двумя чертами — ||
- Растворы, в которые погружен электролитный мостик записываются слева и справа от него (если необходимо, здесь же указывается концентрация растворов). Компоненты одной фазы, при этом записываются через запятую.
Например, составим схему гальванического элемента, в котором осуществляется следующая реакция:
Fe0 + Cd2+ = Fe2+ + Cd0
В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый.
Анод Fe0|Fe2+ || Cd2+|Cd0Катод
Типичные задачи на составление схем гальванического элемента и вычисление ЭДС реакции с решениями вы найдете здесь.
ЭДС. Закон Ома для полной цепи
-
Темы кодификатора ЕГЭ: электродвижущая сила, внутреннее сопротивление источника тока, закон Ома для полной электрической цепи.
-
Сторонняя сила
-
Закон Ома для полной цепи
-
КПД электрической цепи
-
Закон Ома для неоднородного участка
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: электродвижущая сила, внутреннее сопротивление источника тока, закон Ома для полной электрической цепи.
До сих пор при изучении электрического тока мы рассматривали направленное движение свободных зарядов во внешней цепи, то есть в проводниках, подсоединённых к клеммам источника тока.
Как мы знаем, положительный заряд :
• уходит во внешнюю цепь с положительной клеммы источника;
• перемещается во внешней цепи под действием стационарного электрического поля, создаваемого другими движущимися зарядами;
• приходит на отрицательную клемму источника, завершая свой путь во внешней цепи.
Теперь нашему положительному заряду нужно замкнуть свою траекторию и вернуться на положительную клемму. Для этого ему требуется преодолеть заключительный отрезок пути — внутри источника тока от отрицательной клеммы к положительной. Но вдумайтесь: идти туда ему совсем не хочется! Отрицательная клемма притягивает его к себе, положительная клемма его от себя отталкивает, и в результате на наш заряд внутри источника действует электрическая сила
, направленная против движения заряда (т.е. против направления тока).
к оглавлению ▴
Сторонняя сила
Тем не менее, ток по цепи идёт; стало быть, имеется сила, «протаскивающая» заряд сквозь источник вопреки противодействию электрического поля клемм (рис. 1).
Рис. 1. Сторонняя сила
Эта сила называется сторонней силой; именно благодаря ей и функционирует источник тока. Сторонняя сила не имеет отношения к стационарному электрическому полю — у неё, как говорят, неэлектрическое происхождение; в батарейках, например, она возникает благодаря протеканию соответствующих химических реакций.
Обозначим через работу сторонней силы по перемещению положительного заряда q внутри источника тока от отрицательной клеммы к положительной. Эта работа положительна, так как направление сторонней силы совпадает с направлением перемещения заряда. Работа сторонней силы
называется также работой источника тока.
Во внешней цепи сторонняя сила отсутствует, так что работа сторонней силы по перемещению заряда во внешней цепи равна нулю. Поэтому работа сторонней силы по перемещению заряда вокруг всей цепи сводится к работе по перемещению этого заряда только лишь внутри источника тока. Таким образом,
— это также работа сторонней силы по перемещению заряда по всей цепи.
Мы видим, что сторонняя сила является непотенциальной — её работа при перемещении заряда по замкнутому пути не равна нулю. Именно эта непотенциальность и обеспечивает циркулирование электрического тока; потенциальное электрическое поле, как мы уже говорили ранее, не может поддерживать постоянный ток.
Опыт показывает, что работа прямо пропорциональна перемещаемому заряду
. Поэтому отношение
уже не зависит от заряда и является количественной характеристикой источника тока. Это отношение обозначается
:
(1)
Данная величина называется электродвижущей силой (ЭДС) источника тока. Как видим, ЭДС измеряется в вольтах (В), поэтому название «электродвижущая сила» является крайне неудачным. Но оно давно укоренилось, так что приходится смириться.
Когда вы видите надпись на батарейке: «1,5 В», то знайте, что это именно ЭДС. Равна ли эта величина напряжению, которое создаёт батарейка во внешней цепи? Оказывается, нет! Сейчас мы поймём, почему.
к оглавлению ▴
Закон Ома для полной цепи
Любой источник тока обладает своим сопротивлением , которое называется внутренним сопротивлением этого источника. Таким образом, источник тока имеет две важных характеристики: ЭДС и внутреннее сопротивление.
Пусть источник тока с ЭДС, равной , и внутренним сопротивлением
подключён к резистору
(который в данном случае называется внешним резистором, или внешней нагрузкой, или полезной нагрузкой). Всё это вместе называется полной цепью (рис. 2).
Рис. 2. Полная цепь
Наша задача — найти силу тока в цепи и напряжение
на резисторе
.
За время по цепи проходит заряд
. Согласно формуле (1) источник тока совершает при этом работу:
(2)
Так как сила тока постоянна, работа источника целиком превращается в теплоту, которая выделяется на сопротивлениях и
. Данное количество теплоты определяется законом Джоуля–Ленца:
(3)
Итак, , и мы приравниваем правые части формул (2) и (3):
После сокращения на получаем:
Вот мы и нашли ток в цепи:
(4)
Формула (4) называется законом Ома для полной цепи.
Если соединить клеммы источника проводом пренебрежимо малого сопротивления , то получится короткое замыкание. Через источник при этом потечёт максимальный ток — ток короткого замыкания:
Из-за малости внутреннего сопротивления ток короткого замыкания может быть весьма большим. Например, пальчиковая батарейка разогревается при этом так, что обжигает руки.
Зная силу тока (формула (4)), мы можем найти напряжение на резисторе с помощью закона Ома для участка цепи:
(5)
Это напряжение является разностью потенциалов между точками и
(рис. 2). Потенциал точки
равен потенциалу положительной клеммы источника; потенциал точки
равен потенциалу отрицательной клеммы. Поэтому напряжение (5) называется также напряжением на клеммах источника.
Мы видим из формулы (5), что в реальной цепи будет — ведь
умножается на дробь, меньшую единицы. Но есть два случая, когда
.
1. Идеальный источник тока. Так называется источник с нулевым внутренним сопротивлением. При формула (5) даёт
.
2. Разомкнутая цепь. Рассмотрим источник тока сам по себе, вне электрической цепи. В этом случае можно считать, что внешнее сопротивление бесконечно велико: . Тогда величина
неотличима от
, и формула (5) снова даёт нам
.
Смысл этого результата прост: если источник не подключён к цепи, то вольтметр, подсоединённый к полюсам источника, покажет его ЭДС.
к оглавлению ▴
КПД электрической цепи
Нетрудно понять, почему резистор называется полезной нагрузкой. Представьте себе, что это лампочка. Теплота, выделяющаяся на лампочке, является полезной, так как благодаря этой теплоте лампочка выполняет своё предназначение — даёт свет.
Количество теплоты, выделяющееся на полезной нагрузке за время
, обозначим
.
Если сила тока в цепи равна , то
Некоторое количество теплоты выделяется также на источнике тока:
Полное количество теплоты, которое выделяется в цепи, равно:
КПД электрической цепи — это отношение полезного тепла к полному:
КПД цепи равен единице лишь в том случае, если источник тока идеальный .
к оглавлению ▴
Закон Ома для неоднородного участка
Простой закон Ома справедлив для так называемого однородного участка цепи — то есть участка, на котором нет источников тока. Сейчас мы получим более общие соотношения, из которых следует как закон Ома для однородного участка, так и полученный выше закон Ома для полной цепи.
Участок цепи называется неоднородным, если на нём имеется источник тока. Иными словами, неоднородный участок — это участок с ЭДС.
На рис. 3 показан неоднородный участок, содержащий резистор и источник тока. ЭДС источника равна
, его внутреннее сопротивление считаем равным нулю (если внутреннее сопротивление источника равно
, можно просто заменить резистор
на резистор
).
Рис. 3. ЭДС «помогает» току:
Сила тока на участке равна , ток течёт от точки
к точке
. Этот ток не обязательно вызван одним лишь источником
. Рассматриваемый участок, как правило, входит в состав некоторой цепи (не изображённой на рисунке), а в этой цепи могут присутствовать и другие источники тока. Поэтому ток
является результатом совокупного действия всех источников, имеющихся в цепи.
Пусть потенциалы точек и
равны соответственно
и
. Подчеркнём ещё раз, что речь идёт о потенциале стационарного электрического поля, порождённого действием всех источников цепи — не только источника, принадлежащего данному участку, но и, возможно, имеющихся вне этого участка.
Напряжение на нашем участке равно: . За время
через участок проходит заряд
, при этом стационарное электрическое поле совершает работу:
Кроме того, положительную работу совершает источник тока (ведь заряд прошёл сквозь него!):
Сила тока постоянна, поэтому суммарная работа по продвижению заряда , совершаемая на участке стационарным электрическим полем и сторонними силами источника, целиком превращается в тепло:
.
Подставляем сюда выражения для ,
и закон Джоуля–Ленца:
Сокращая на , получаем закон Ома для неоднородного участка цепи:
(6)
или, что то же самое:
(7)
Обратите внимание: перед стоит знак «плюс». Причину этого мы уже указывали — источник тока в данном случае совершает положительную работу, «протаскивая» внутри себя заряд
от отрицательной клеммы к положительной. Попросту говоря, источник «помогает» току протекать от точки
к точке
.
Отметим два следствия выведенных формул (6) и (7).
1. Если участок однородный, то . Тогда из формулы (6) получаем
— закон Ома для однородного участка цепи.
2. Предположим, что источник тока обладает внутренним сопротивлением . Это, как мы уже упоминали, равносильно замене
на
:
Теперь замкнём наш участок, соединив точки и
. Получим рассмотренную выше полную цепь. При этом окажется, что
и предыдущая формула превратится в закон Ома для полной цепи:
Таким образом, закон Ома для однородного участка и закон Ома для полной цепи оба вытекают из закона Ома для неоднородного участка.
Может быть и другой случай подключения, когда источник «мешает» току идти по участку. Такая ситуация изображена на рис. 4. Здесь ток, идущий от
к
, направлен против действия сторонних сил источника.
Рис. 4. ЭДС «мешает» току:
Как такое возможно? Очень просто: другие источники, имеющиеся в цепи вне рассматриваемого участка, «пересиливают» источник на участке и вынуждают ток течь против . Именно так происходит, когда вы ставите телефон на зарядку: подключённый к розетке адаптер вызывает движение зарядов против действия сторонних сил аккумулятора телефона, и аккумулятор тем самым заряжается!
Что изменится теперь в выводе наших формул? Только одно — работа сторонних сил станет отрицательной:
Тогда закон Ома для неоднородного участка примет вид:
(8)
или:
где по-прежнему — напряжение на участке.
Давайте соберём вместе формулы (7) и (8) и запишем закон Ома для участка с ЭДС следующим образом:
Ток при этом течёт от точки к точке
. Если направление тока совпадает с направлением сторонних сил, то перед
ставится «плюс»; если же эти направления противоположны, то ставится «минус».
Повторим основные понятия и определения по теме «Закон Ома».
Напомним, что напряжение измеряется в вольтах.
Сила тока измеряется в амперах.
Сопротивление измеряется в омах. Эта единица измерения названа в честь Георга Симона Ома, открывшего взаимосвязь между напряжением, сопротивлением цепи и силой тока в этой цепи.
Основные определения, которые мы используем в решении задач:
Источник тока – это устройство, способное создавать необходимую для существования тока разность потенциалов.
Можно сказать, что источник тока действует, как насос. Он «качает» электроны по проводникам, как водяной насос воду по трубам. Эту аналогию можно продолжить. При этом источник тока совершает работу, за счёт химических реакций, происходящих внутри него.
Если эту работу разделить на переносимый источником заряд q (суммарный заряд всех проходящих через источник электронов), то мы получим величину, которую называют электродвижущей силой или сокращённо ЭДС.
Измеряется эта ЭДС, как и разность потенциалов, в вольтах и имеет примерно тот же смысл.
По определению, сила тока равна отношению суммарного заряда электронов, проходящих через сечение проводника, ко времени прохождения. Измеряется сила тока в амперах (А).
Свойство проводника препятствовать прохождению по нему тока характеризуется величиной, которую назвали электрическим сопротивлением – R. Проходя через проводник, электрический ток нагревает его.
Сопротивление измеряют в омах (Ом).
Сам источник тока тоже обладает сопротивлением. Такое сопротивление принято называть внутренним сопротивлением источника r (Ом).
Именно немецкому учёному Георгу Ому удалось установить, от чего может зависеть электрическое сопротивление проводника. Проведя многочисленные эксперименты, Ом сделал следующие выводы:
- Сопротивление проводника тем больше, чем больше его длина.
- Сопротивление проводника тем больше, чем меньше его толщина или площадь поперечного сечения.
Кроме того, Ом выяснил, что каждый материал обладает своим электрическим сопротивлением. Величина, которая показывает, каким сопротивлением будет обладать проводник единичной длины и единичной площади сечения из данного материала, называется удельным электрическим сопротивлением: (Ом*мм2/м). Эта величина справочная. Таким образом, получается, что электрическое сопротивление проводника равно:
Рассмотрим задачи ЕГЭ по теме «Закон Ома» для полной цепи.
Задача 1. На рисунке приведён график зависимости напряжения на концах железного провода площадью поперечного сечения 0,05 мм2 от силы тока в нём. Чему равна длина провода? Ответ дайте в метрах. Удельное сопротивление железа 0,1 Ом*мм2/м.
Решение:
Из закона Ома для проводника или участка цепи без источника следует:
По графику: при
Из формулы сопротивления выражаем и находим длину проводника:
Ответ: 10.
Задача 2. Через поперечное сечение проводников за 8 с прошло 1020 электронов. Какова сила тока в проводнике? Ответ дайте в амперах.
Решение:
По определению силы тока:
Заряд всех электронов: где е — модуль заряда электрона,
Кл.
Тогда
Ответ: 2.
Задача 3. Идеальный амперметр и три резистора общим сопротивлением 66 Ом включены последовательно в электрическую цепь, содержащую источник с ЭДС равной 5 В, и внутренним сопротивлением r=4 Ом. Каковы показания амперметра? (Ответ дайте в амперах, округлив до сотых.)
Решение:
По закону Ома для полной цепи:
Тогда
Ответ: 0,07.
Задача 4. ЭДС источника тока равна 1,5 В. Определите сопротивление внешней цепи, при котором сила тока будет равна 0,6 А, если сила тока при коротком замыкании равна 2,5 А. Ответ дайте в Ом, округлив до десятых.
Решение:
Сила тока короткого замыкания определяется следующим образом:
Отсюда выражаем и находим внутреннее сопротивление источника:
При внешнем сопротивлении, не равном нулю, сила тока в цепи определяется законом Ома для полной цепи:
Отсюда выражаем сопротивление резистора и находим его:
Ответ: 1,9.
Задача 5. На рисунке изображена схема электрической цепи, состоящей из источника постоянного напряжения с ЭДС 5 В и пренебрежимо малым внутренним сопротивлением, ключа, резистора с сопротивлением 2 Ом и соединительных проводов. Ключ замыкают. Какой заряд протечет через резистор за 10 минут? Ответ дайте в кулонах.
Решение:
Выражаем время в секундах: t = 10 минут = 600 с.
Определяем силу тока по закону Ома для полной цепи:
Внутреннее сопротивление пренебрежимо мало, поэтому r = 0.
По определению силы тока:
Отсюда Кл.
Ответ: 1500.
Если вам нравятся наши материалы — записывайтесь на курсы подготовки к ЕГЭ по физике онлайн
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «ЭДС. Закон Ома для полной цепи» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Содержание:
- Определение и формула ЭДС
- Закон Ома для произвольного участка цепи
- Единицы измерения
- Примеры решения задач
Для поддержания электрического тока в проводнике длительное время, необходимо чтобы от конца проводника, имеющего меньший потенциал
(учтем, что носители тока предполагаются положительными зарядами) постоянно убирались доставляемые током заряды, при этом к концу с
большим потенциалом заряды постоянно подводились. То есть следует обеспечить круговорот зарядов. В этом круговороте заряды должны
перемещаться по замкнутому пути. Движение носителей тока при этом реализуется при помощи сил неэлектростатического происхождения.
Такие силы именуются сторонними. Получается, что для поддержания тока нужны сторонние силы, которые действуют на всем протяжении цепи
или на отдельных участках цепи.
Определение и формула ЭДС
Определение
Скалярная физическая величина, которая равна работе сторонних сил по перемещению единичного положительного заряда, называется
электродвижущей силой (ЭДС), действующей в цепи или на участке цепи. ЭДС обозначается
$varepsilon$ . Математически определение ЭДС запишем как:
$$varepsilon=frac{A}{q}(1)$$
где A – работа сторонних сил, q – заряд, над которым производится работа.
Электродвижущая сила источника численно равна разности потенциалов на концах элемента, если он разомкнут, что дает возможность измерить ЭДС по напряжению.
ЭДС, которая действует в замкнутой цепи, может бытьопределена как циркуляция вектора напряжённости сторонних сил:
$$varepsilon=oint_{L} bar{E}^{*} d bar{l}(2)$$
где $bar{E}^{*}$ — напряженность поля сторонних сил. Если напряженность поля сторонних
сил не равна нулю только в части цепи, например, на отрезке 1-2, тогда интегрирование в выражении (2) можно вести только по
данному участку. Соответственно, ЭДС, действующая на участке цепи 1-2 определяется как:
$$varepsilon=int_{1}^{2} bar{E}^{*} d bar{l}(3)$$
Формула (2) дает самое общее определение ЭДС, которое можно использовать для любых случаев.
Закон Ома для произвольного участка цепи
Участок цепи, на котором действуют сторонние силы, называют неоднородным. Для него выполняется равенство:
$$U_{12}=varphi_{1}-varphi_{2}+varepsilon_{12}(4)$$
где U12=IR21 – падение напряжения (или напряжение) на участке цепи 1-2 (I-сила тока);
$varphi_{1}-varphi_{2}$ – разность потенциалов концов участка;
$varepsilon_12$ – электродвижущая сила, которую содержит участок цепи.
$varepsilon_12$ равна алгебраической сумме ЭДС всех источников, которые находятся на данном участке.
Следует учитывать, что ЭДС может быть положительной и отрицательной. ЭДС называют положительной, если она увеличивает потенциал в
направлении тока (ток течет от минуса к плюсу источника).
Единицы измерения
Размерность ЭДС совпадает с размерностью потенциала. Основной единицей измерения ЭДС в системе СИ является: [$varepsilon$]=В
1В=1Дж/1Кл
Примеры решения задач
Пример
Задание. Электродвижущая сила элемента равна 10 В. Он создает в цепи силу тока равную 0,4 А.
Какова работа, которую совершают сторонние силы за 1 мин?
Решение. В качество основы для решения задачи используем формулу для вычисления ЭДС:
$$varepsilon=frac{A}{q}(1.1)$$
Заряд, который проходит в рассматриваемой цепи за 1 мин. можно найти как:
$$q=I Delta t(1.2)$$
Выразим из (1.1) работу, используем (1.2) для вычисления заряда, получим:
$$A=varepsilon I Delta t$$
Переведем время, данной в условиях задачи в секунды ($Delta t$ мин=60 с), проведем вычисления:
$A=10 cdot 0,4 cdot 60=240$ (Дж)
Ответ. A=240 Дж

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 430 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!
Пример
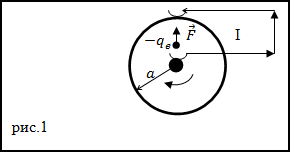
Задание. Металлический диск, имеющий радиус a, вращается с угловой скоростью
$omega$, включен в электрическую цепь при
помощи скользящих контактов, которые касаются оси диска и его окружности (рис.1). Какой будет ЭДС, которая появится между осью
диска и его наружным краем?
Решение. В условиях, которые описаны в задаче, на каждый электрон проводника действует центробежная сила (F)
которая является сторонней. Вследствие ее действия, в диске возникает ЭДС и между осью диска и его наружным краем появляется напряжение.
Формулу для вычисления центробежной силы запишем как:
$$F=m r omega^{2}(2.1)$$
где m – масса электрона, r – расстояние от оси диска.Fдействует на заряженную частицу (электрон), следовательноучитывая (2.1), имеем:
$$E^{*}=frac{F}{q}=frac{m r omega^{2}}{q}$$
где q – заряд электрона.
В соответствии с формулой, определяющей ЭДС участка цепи, получаем:
$$varepsilon=int_{1}^{2} bar{E} d bar{l}=int_{0}^{a} E^{*} d r=int_{0}^{a} frac{m r omega^{2}}{q} d r=frac{m r omega^{2} a^{2}}{2 q}$$
Ответ. $varepsilon=frac{m r omega^{2} a^{2}}{2 q}$
Читать дальше: Формулы по физике.