Как понять, что лечение работает?
Что такое контрольное обследование и зачем оно проводится?
Контрольное обследование пациента — комплекс медицинских мероприятий, проводимых с определенной периодичностью и включающих:
- прохождение диагностических процедур (компьютерная томография, магнитно-резонансная томография, анализы крови и т.д.);
- посещение врача с результатами исследований.
Контрольное обследование необходимо:
- для оценки эффективности проводимого лечения;
- для своевременного обнаружения прогрессирования или рецидива метастатической меланомы;
- для выявления токсичности проводимой терапии и отмены лечения в случае ее непереносимости или угрозы жизни пациента.
Как часто необходимо делать контрольное обследование?
Единых рекомендаций по периодичности проведения контроля при лечении метастатической меланомы нет. Как правило, контрольное обследование на фоне таргетной или иммунотерапии метастатической меланомы проводится каждые 2-3 месяца по усмотрению лечащего врача.
Если в процессе лечения появились новые симптомы, которые могут указывать на прогрессирование заболевания, контрольное обследование проводится сразу, независимо от даты предыдущих исследований.
Как понять, что лечение работает?
Для объективной оценки проводимого лечения используют специальную шкалу RECIST 1.1., которая изначально применялась при проведении клинических исследований, а сейчас является стандартным методом оценки эффективности лечения в клинической практике.
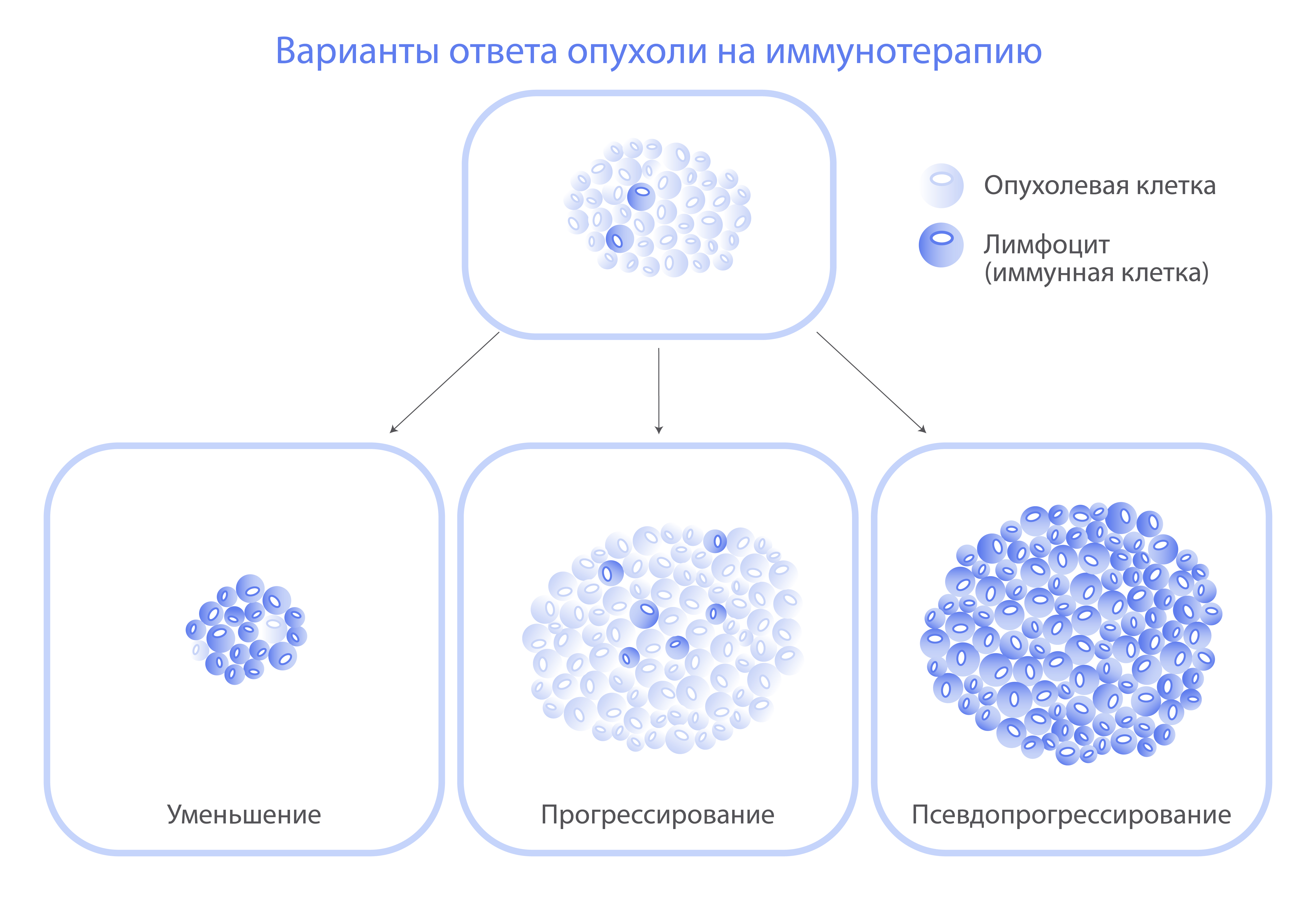
Как оценить эффективность иммунотерапии?
Действие иммунотерапии проявляется постепенно — в течение нескольких месяцев, поэтому оценка ее эффективности имеет некоторые особенности. Для этого существует более точная шкала — iRECIST 1.1.
У одного из двадцати пациентов, получавших иммунотерапию, компьютерная томография выявляет псевдопрогрессирование — увеличение раковых очагов, которое связано не с ростом самой опухоли, а с притоком и оседанием в ней лимфоцитов.
При подозрении на псевдопрогрессирование иммунотерапия продолжается до следующего контрольного обследования. Оно либо подтвердит прогрессирование заболевания, либо покажет наличие частичного или полного противоопухолевого ответа на лечение.
Какие еще есть способы оценить эффективность лечения?
Не все опухолевые очаги подходят для оценки по критериям RECIST и iRECIST. Поэтому эффективность лечения приходится определять путем комплексного анализа общей картины заболевания у конкретного пациента. На что еще можно ориентироваться?
- Улучшение самочувствия пациента, уменьшение выраженности симптомов, связанных с метастатическим поражением, свидетельствуют об эффективности проводимого лечения.
- Появление новых очагов, не выявленных на предыдущем контрольном обследовании, как правило, говорит о прогрессировании заболевания.
- Ухудшение самочувствия может быть связано как с развитием нежелательных побочных эффектов лекарственной терапии, так и с прогрессированием заболевания. Именно поэтому появление новых симптомов является поводом для внеочередного обследования.
Выводы:
- Контрольное обследование пациента включает прохождение диагностических процедур и посещение врача с результатами исследований.
- Контрольное обследование необходимо для оценки эффективности проводимого лечения, своевременного выявления прогрессирования заболевания и отмены лечения в случае ее непереносимости.
- Эффективность лечения определяется по шкале RECIST 1.1.
- При ухудшении самочувствия пациента и появлении новых симптомов необходимо проведение внеочередного обследования.
Что еще почитать?
- Park, H. J., Kim, G. H., Kim, K. W., Lee, C. W., Yoon, S., Chae, Y. K., Tirumani, S. H., & Ramaiya, N. H. (2021). Comparison of RECIST 1.1 and iRECIST in Patients Treated with Immune Checkpoint Inhibitors: A Systematic Review and Meta-Analysis.
- UptoDate: Overview of the management of advanced cutaneous melanoma Author:Jeffrey A Sosman, MD
- Ma, Y., Wang, Q., Dong, Q., Zhan, L., & Zhang, J. (2019). How to differentiate pseudoprogression from true progression in cancer patients treated with immunotherapy. American journal of cancer research, 9(8), 1546–1553.
Онколог, химиотерапевт, выпускник Высшей школы онкологии
20 июня 2022
Пройдите короткий тест, получите рекомендации и график обследований.
пройти тест
Помочь фонду «Не напрасно» прямо сейчас
Все собранные средства идут на оплату экспертов, задействованных в консультациях, и на работу сервиса. Поддерживая системные проекты — образование талантливых врачей, просвещение широкой аудитории, внедрение технологий скрининга рака, — вы можете внести вклад в спасение сотен и тысяч людей в России и обеспечить помощь себе и своим близким, если в ней возникнет необходимость.
-
Эффективность препарата – это способность производить эффект (например, понижение артериального давления).
Эффективность может быть точно определена только в идеальных условиях (то есть, когда отбор пациентов проводился согласно надлежащим критериям и график дозировки был строго выдержан). Таким образом, эффективность измеряется под руководством экспертов в группе пациентов, у которых наиболее вероятно произойдет ответная реакция на лекарство – например, в контролируемых клинических испытаниях.
-
Результативность отличается от эффективности тем, что она учитывает, насколько хорошо препарат работает в реальных условиях
Часто препарат, который является эффективным в клинических испытаниях, оказывается малоэффективен в практическом использовании. Например, препарат может проявлять высокую эффективность в снижении АД, но иметь при этом низкую результативность, поскольку он вызывает столько побочных действий Побочные эффекты Само собой разумеется, что лекарственный препарат (как и любой курс лечения) должен назначаться исходя исключительно из его лечебного эффекта на пациента. Для этого необходимо учитывать способность… Прочитайте дополнительные сведения , что пациенты прекращают его прием. Результативность также может быть ниже, чем эффективность, если врачи по неосмотрительности неправильно назначают препарат (например, назначая фибринолитический препарат пациенту с предполагаемым ишемическим инсультом, у которого имелось нераспознанное на КТ внутримозговое кровоизлияние). Таким образом, результативность, как правило, ниже, чем эффективность.
Чтобы судить об эффективности и результативности препарата, следует использовать пациент-ориентированные результаты, а не суррогатные или промежуточные.
Пациент-ориентированные результаты – это результаты, которые влияют на самочувствие пациентов. Они включают одно или несколько из следующее:
-
Продление жизни
-
Улучшение функции (например, предотвращение инвалидности)
-
Облегчение симптомов
-
Суррогатные или промежуточные результаты включают параметры, которые непосредственно не касаются самочувствия пациентов
Часто сюда относятся такие показатели как физиологические параметры (например, артериальное давление) или результаты исследований (например, концентрация глюкозы или холестерина, размер опухоли на КТ), которые, как полагают, могут спрогнозировать фактические пациент-ориентированные результаты. К примеру, врачи зачастую предполагают, что снижение артериального давления предотвратит пациент-ориентированный исход неконтролируемой артериальной гипертензии (например, смерть в результате инфаркта миокарда или инсульта). Тем не менее, можно допустить, что препарат может снизить артериальное давление, но не уменьшит смертность, что, возможно, обусловлено наличием нежелательных явлений, часто заканчивающихся летальным исходом. Кроме того, если суррогатный показатель является лишь маркером заболевания (например, HbA1С), а не причиной болезни (например, повышенного артериального давления), то вмешательство может понизить маркер, не влияя на первопричинное нарушение. Таким образом, суррогатные результаты – это менее предпочтительные меры определения эффективности, чем пациент-ориентированные результаты.
С другой стороны, использование суррогатных результатов может быть гораздо более целесообразным, например, когда проявление пациент-ориентированных результатов требует много времени (например, проявление почечной недостаточности в результате неконтролируемой гипертонии) или в случае их редкости. В этих случаях клинические испытания должны быть очень масштабными и проводиться в течение длительного времени, если только не используются суррогатные результаты (например, пониженное артериальное давление). Кроме того, основные пациент-ориентированные результаты – смерть и потеря трудоспособности – являются дихотомическими (т.е., да/нет), в то время как суррогатные результаты часто представляют собой непрерывные числовые переменные (например, артериальное давление, уровень глюкозы в крови). Числовые переменные, в отличие от дихотомических результатов, могут указывать на величину эффекта. Таким образом, использование суррогатных результатов зачастую может предоставить намного больше данных для анализа, чем пациент-ориентированные результаты, позволяя проводить клинические испытания при значительно меньшем количестве пациентов.
Тем не менее, корреляция суррогатных результатов с пациент-ориентированными предпочтительно должна быть подтверждена. Во многих исследованиях такая корреляция представлялась целесообразной, но не присутствовала на самом деле. Например, лечение некоторых женщин в постменопаузе с помощью эстрогена и прогестерона привело к более благоприятной липидограмме, но гипотетическое соответствующее уменьшение случаев инфаркта миокарда или сердечной смерти не было достигнуто. Аналогичным образом, у пациентов с сахарным диабетом снижение уровня глюкозы в крови до почти нормальной концентрации в палате интенсивной терапии и реанимации и приводило к более высокой смертности и заболеваемости (возможно, вследствие инициируемых эпизодов гипогликемии), чем снижение уровня глюкозы до чуть более высокого уровня. Некоторые пероральные гипогликемические препараты снижают концентрацию глюкозы в крови, в том числе концентрацию HbA1C, но не уменьшают риск кардиальных событий. Некоторые антигипертензивные препараты уменьшают артериальное давление, но не уменьшают риск инсульта.
Побочные эффекты
Подобным образом, клинически значимые побочные эффекты – это пациент-ориентированные результаты Примерами могут служить следующие:
-
Смерть
-
Нарушение функций
-
Дискомфорт
Суррогатные побочные эффекты (например, изменение концентрации сывороточных маркеров) используются часто, но, как и в случае с суррогатными результатами эффективности, они предпочтительно должны коррелировать с пациент-ориентированными побочными эффектами. В клинических испытаниях, которые тщательно разрабатываются для доказательства эффективности, все же могут возникнуть трудности с определением побочных эффектов, если для развития побочного явления необходимо больше времени, чем для проявления лечебного эффекта, или в случае редкого побочного эффекта. Например, ингибиторы циклооксигеназы-2 (ЦОГ-2) быстро купируют боль и, таким образом, их эффективность может быть показана в сравнительно коротком исследовании. Тем не менее, увеличение числа случаев инфаркта миокарда, вызванное некоторыми ингибиторами ЦОГ-2, проявилось в течение более длительного периода времени и не было зафиксировано в более коротких, небольших испытаниях. По этой причине, а также ввиду того, что клинические испытания могут исключать определенные подгруппы и пациентов высокого риска, побочные эффекты могут быть не полностью изучены, пока препарат не войдет в широкое многолетнее клиническое использование (см. Разработка лекарственного препарата [Drug Development] Разработка лекарственного препарата Потенциальные лекарственные вещества могут быть найдены путем полномасштабного скрининга сотен и тысяч молекул на предмет наличия биологической активности. В других случаях знание специфических… Прочитайте дополнительные сведения ).
Многие побочные ракции лекарственных веществ связаны с их дозировкой.
Показания к использованию препарата зависят от соотношения его пользы и вреда. При принятии таких решений врачи часто учитывают в некоторой степени субъективные факторы, такие как личный опыт, единичные случаи излечения, практику коллег и мнение экспертов.
Число больных, которых необходимо лечить (ЧБНЛ), является менее субъективным методом учета вероятных преимуществ препарата (или любых других вмешательств). ЧБНЛ – это количество пациентов, которое нужно пролечить для получения одного благоприятного исхода. Например, рассмотрим препарат, который снижает смертность определенного заболевания с 10% до 5%; абсолютное снижение риска составляет 5% (у 1 из 20). Это означает, что 90 пациентов из 100 выживут даже без лечения и, таким образом, не получат никакой пользы от приема препарата. Кроме того, 5 пациентов из 100 умрет, даже если они будут принимать препарат, и, соответственно, препарат также не принесет им пользы. Только 5 пациентов из 100 (1 из 20) получат пользу от приема препарата; таким образом, необходимо пролечить 20 пациентов, чтобы 1 получил пользу, и ЧБНЛ будет равняться 20. ЧБНЛ можно попросту вычислить как величину, обратную абсолютному снижению риска; если абсолютное снижение риска составляет 5% (0,05), то ЧБНЛ = 1/0,05 = 20. ЧБНЛ также можно рассчитать для побочных эффектов, в этом случае его иногда называют индексом потенциального вреда (ИПВ).
Важно отметить, что ЧБНЛ основывается на изменениях абсолютного риска; оно не может быть вычислено исходя из изменений относительного риска. Относительный риск является пропорциональной разницей между двумя уровнями риска. Например, препарат, который снижает смертность с 10% до 5%, уменьшает абсолютную смертность на 5%, а относительную смертность – на 50% (то есть, 5%-ный коэффициент смертности означает на 50% меньше смертей, чем 10%-ный коэффициент смертности). Чаще всего польза представлена в литературе как относительное, а не абсолютное сокращение риска, поскольку так препарат выглядит более эффективным (в предыдущем примере снижение смертности на 50% звучит гораздо лучше, чем снижение на 5%). Побочные эффекты, наоборот, как правило, представляют в виде абсолютного увеличения риска, поскольку так препарат кажется безопаснее. Например, если препарат увеличивает частоту кровотечений с 0,1% до 1%, скорее всего, это увеличение будет представлено как 0,9%, а не 1000%.
При определении соотношения ЧБНЛ и ИПВ важно оценивать величину конкретных пользы и вреда. Например, назначение препарата, который оказывает вреда намного больше, чем пользы, может быть оправдано, если этот вред незначительный (например, обратимый, умеренный), а польза – существенная (например, предотвращение смертности или заболеваемости). В любом случае, лучше всего опираться на пациент-ориентированные результаты.
На данный момент все чаще используется генетическое профилирование для идентификации подгрупп пациентов, которые более восприимчивы к лечебным и побочным эффектам некоторых лекарственных препаратов. Например, при раке молочной железы можно провести анализ на наличие генетического маркера HER2, который прогнозирует ответ на конкретные химиотерапевтические препараты. Пациентов с ВИЧ/СПИДом можно обследовать на наличие аллеля HLA-B*57:01, который определяет гиперчувствительность к абакавиру, снижая количество случаев реакции гиперчувствительности и, таким образом, увеличивая ИПВ. Генетические вариации различных ферментов, метаболизирующих лекарственные препараты, помогают определить ответ пациентов на препараты (см. Фармакогенетика Фармакогенетика Фармакогенетика изучает различия фармакологического ответа в зависимости от генетической структуры организма. Активность ферментов, метаболизирующих лекарственные средства, часто варьирует в… Прочитайте дополнительные сведения ), а также часто влияют на вероятность полезного и/или вредного воздействия.
Одной из целей разработок лекарственного препарата является обеспечение большой разницы между дозой, которая дает лечебный эффект, и дозой, которая вызывает побочные эффекты. Большая разница называется широким терапевтическим индексом, терапевтическим соотношением или терапевтическим окном. Если терапевтический индекс узкий (например, < 2), факторы, которые, как правило, являются клинически несущественными (например, взаимодействие лекарственных препаратов с пищей, межлекарственное взаимодействие Лекарственное взаимодействие Лекарственное взаимодействие – это изменение эффектов препарата, обусловленное недавним или одновременным приемом других лекарственных средств (межлекарственное взаимодействие) либо приемом… Прочитайте дополнительные сведения , небольшие ошибки в дозировке) могут иметь вредные клинические эффекты. Например, варфарин имеет узкий терапевтический индекс и взаимодействует со многими препаратами и пищевыми продуктами. Недостаточная антикоагуляция при лечении антикоагулянтами повышает риск осложнений (например, увеличивает риск инсульта при фибрилляции предсердий), в то время как чрезмерная антикоагуляция повышает риск кровотечения.
Традиционный стиль написания руководств и монографий предусматривает последовательное изложение этиологии, патогенеза, клинической картины и средств диагностики. Только после этого, вооружив читателя теоретическими, клиническими и инструментальными данными, авторы обычно переходят к принципам лечения. Казалось бы, что может быть логичнее? Но логичные методы лечения часто оказываются неэффективными или даже опасными для больных, поэтому мы начнем эту книгу, посвященную вопросам лечения ЧМТ, нетрадиционно – с методологии оценки эффективности лечебных мероприятий. Иными словами, мы начнем с конца – с вопроса: «Как правильно оценить эффективность лечения?» После этого вернемся к этиологии и патогенезу, необходимым средствам диагностики, рассмотрим все теоретически возможные способы лечения. Затем на основе научно обоснованного анализа отберем только те методы терапии, эффективность которых доказана. Опираясь на них, мы закончим нашу работу практическими алгоритмами интенсивной терапии ЧМТ.
Слово «методология» только на первый взгляд кажется заумным и высоконаучным. На самом деле, в приложении к процессу врачевания, это очень простое и важное понятие. Методология описывает процесс получения и критического анализа информации об эффективности лечения. Этот процесс может опираться на ощущения, теоретические представления, изменения в клиническом состоянии пациента и данные, полученные в ходе специально подготовленных и проведенных исследований. Именно последний подход, называемый доказательной медициной, заслуживает пристального внимания.
В чем смысл доказательной медицины – «evidence based medicine»? Самое главное – в осознании необходимости данных доказательных исследований. Нужно понять, что доказательная медицина – это не мода. Прошло то время, когда принципы лечения различных патологических состояний зависели только от мнения авторитетных исследователей и врачей. Врачебное сообщество внимательно прислушивалось к этому мнению и, в зависимости от убедительности авторитетов, использовало в практической деятельности. Чем же современных врачей перестал устраивать этот веками отработанный подход? В основном своей субъективностью. Конечно, нельзя лечить без теоретических предпосылок и клинического опыта. Однако чтобы полученные результаты оказались не субъективным мнением увлеченного человека, а объективной реальностью, их эффективность должна быть подтверждена в рамках сравнительных исследований, удовлетворяющих определенным требованиям.
Каким же требованиям должны соответствовать исследования, результаты которых можно рассматривать в качестве руководства к действию? Наиболее важным требованием является правильная организация (дизайн) (Ф. Флетчер и соавт., 1998). С точки зрения дизайна различают следующие типы клинических исследований: экспериментальные (или контролируемые, с преднамеренным вмешательством) и обсервационные (рис. 1.1). В экспериментальных исследованиях (в смысле организации исследований, а не использования лабораторных животных) исследователь может контролировать или манипулировать тем фактором, влияние которого на исход болезни подлежит изучению и анализу. При отсутствии такой возможности исследования относятся к обсервационным. Несмотря на очевидное преимущество экспериментальных исследований к обсервационным не следует относиться свысока. Хорошо организованное обсервационное исследование является более информативным, чем плохо выполненное экспериментальное.
Все экспериментальные исследования являются проспективными. Обсервационные исследования могут быть проспективными и ретроспективными. Проспективные исследования предпочтительнее ретроспективных из-за большей точности сбора информации. По дизайну обсервационные исследования делятся на одномоментные (которые также называют поперечными) и продольные, или лонгитудинальные (т.е. проводимые на протяжении определенного временного интервала). К поперечным обсервационным исследованиям относятся описание случая, исследование серии случаев, к продольным – исследование типа «случай-контроль», а также когортное исследование. Исследование «случай-контроль» представляет собой ретроспективную оценку различий группы пациентов с той или иной болезнью (случай) и без этой болезни (контроль). Когортное исследование позволяет производить проспективное наблюдение за выделенной группой населения (когортой).
Экспериментальные исследования обязательно используют как минимум две группы пациентов: основную, которая подвергается изучаемому способу лечения, и контрольную, в которой лечение проводят по общепринятым стандартам. В качестве контроля может служить и сам больной до лечения. Основная (экспериментальная) и контрольная группа могут меняться местами по ходу исследования. Такой перекрестный дизайн позволяет уменьшить различия между группами больных, однако увеличивает вероятность ошибок из-за изменений патологического процесса во времени (рис. 1.2). В контролируемых исследованиях должны соблюдаться следующие условия:
•Четкое обозначение и соблюдение критериев включения и исключения больных из исследования
•Математически обоснованный способ рандомизации.
•Правильный выбор критериев исхода болезни.
•Корректное использование статистических методов обработки данных.
Критерии включения и исключения из исследования необходимо четко формулировать. Они должны иметь однозначное толкование. Это обеспечивает возможность проверки результатов работы и понимание, имеют ли результаты исследования отношение к тем больным, которых читающий статью специалист лечит в повседневной практике. Обязательным условием хорошо спланированного экспериментального исследования является проведение рандомизации. Дословный перевод английского слова «random» означает «сделанный или выбранный наугад, случайный». Под рандомизацией понимают процедуру, обеспечивающую случайное распределение больных между экспериментальной и контрольной группами. Рандомизация является вторым этапом исследования, проводимым после того, как больной включен в испытание. Случайное или рандомизированное разделение не является синонимом беспорядочного, при котором процесс разделения не поддается математическому описанию. Рандомизация считается плохо организованной при разделении больных на группы по номеру истории болезни, страхового полиса или дате рождения. Лучше всего пользоваться таблицей случайных чисел, методом конвертов или путем централизованного компьютерного распределения вариантов лечения.
Исследования могут быть одноцентровыми или многоцентровыми. В одном лечебном учреждении за короткий срок очень трудно сформировать выборку, однородную по всем признакам, поэтому в испытания часто включаются несколько клиник (многоцентровые исследования). Рандомизированные исследования также могут быть открытыми и «слепыми» (маскированными) (табл. 1).

Открытым испытание считается в том случае, если и пациент, и врач сразу после проведения рандомизации узнают о том, какой вид лечения будет применен. При слепом исследовании больному не сообщается о виде применяемого лечения. Этот момент обговаривается с пациентом заранее при получении информированного согласия на исследование. В случае недееспособности пациента информированное согласие необходимо получить у его представителей (обычно близких родственников). Информированное согласие предполагает полное разъяснение больному всех возможных преимуществ и недостатков участия в исследовании, прав и обязанностей врача и пациента. Эта процедура предполагает, что больной получит все необходимые средства лечения независимо от согласия или несогласия участвовать в исследовании. Объем медицинской помощи не изменится и в том случае, если пациент решит прекратить участвовать в исследовании после первоначального согласия. Врач узнает, какой вариант лечения получит больной, после процедуры рандомизации. При выполнении двойного слепого исследования ни врач, ни пациент не знают, какой из видов лечения используется в конкретном случае. В тройном слепом исследовании о типе вмешательства не знают ни больной, ни врач, ни исследователь (статистик), обрабатывающий собранные данные.
Результаты нескольких рандомизированных исследований по какой-либо проблеме можно объединять. Количественный анализ объединенных результатов нескольких клинических испытаний одного и того же вмешательства называют метаанализом. За счет увеличения размера выборки при метаанализе обеспечивается большая статистическая мощность, чем в каждом отдельном испытании. Однако некорректно проведенный метаанализ может вводить в заблуждение из-за недостаточной сопоставимости групп больных и условий проведения лечения в различных исследованиях (В.В. Власов, 2001).
Необходимо остановиться на статистике, при применении которой чаще всего встречаются серьезные ошибки (С. Гланц, 1999). Часто исследователи нечетко представляют, какие статистические критерии должны быть использованы при разном дизайне исследований. Характерным примером является использование критерия Стьюдента при сравнении нескольких групп друг с другом без поправки на так называемый «эффект множественных сравнений». В результате получаются «странные» результаты, которые, впрочем, не смущают исследователей. Нередко приходится сталкиваться со следующими выводами: исследуемый показатель недостоверно отличается между первой и второй группами больных, недостоверно – между второй и третьей, а вот между первой и третьей различия достоверны (рис. 1.3). Согласно здравой логике такого результата быть не должно, однако при неправильном использовании статистических методов — возможно. Корректным в этой ситуации является использование не критерия Стьюдента, а дисперсионного анализа (ANOVA).
Распространенной ошибкой является статистический анализ различий между группами, выделенными из всей популяции обследованных пациентов уже после получения результатов.
Типичный пример
При введении лекарственного средства X результаты лечения в основной группе не отличаются от контрольной. Однако если оценивать результаты лечения только пациентов мужского пола в возрасте от 30 до 40 лет, то при введении этого средства они выздоравливают быстрее. Казалось бы, можно сделать вывод, что данное лекарство следует применять у молодых мужчин.
Такой подход отражает тенденциозность исследователей, их стремление получить определенные результаты. Его использование приводит к ошибочным заключениям, так как желание исследователей подтвердить эффективность того или иного метода лечения заставляет их интуитивно подбирать сравниваемые группы больных. С точки зрения статистики, положительные результаты лечения в группе больных, выделенной постфактум, могли выявиться случайно. Это не значит, что так вовсе нельзя поступать. Просто после подобного анализа необходимо новое отдельное исследование для проверки полученных различий, в котором группы больных будут выделены до проведения лечения.
В нашем случае нужно провести исследование эффекта введения лекарственного средства X при условии, что и в контрольной, и в основной группе будут только мужчины в возрасте от 30 до 40 лет.
Современные возможности дисперсионного анализа и его программное обеспечение позволяют корректно планировать исследование, в котором сравнивают лечение разными методами нескольких групп больных, со значительной экономией времени и средств.
Обычным является незнание о существовании ошибок первого и второго рода. Чаще всего авторы рассчитывают ошибку первого рода (α-ошибку). В медицинских исследованиях при величине этой ошибки меньше 5% (обычное обозначение р < 0,05) можно быть уверенным в наличии достоверных различий между экспериментальной и контрольной группами. Многие исследователи уверены, что при величине α–ошибки, равной или большей 5%, группы больных ничем не отличаются и методы лечения не имеют преимущества друг перед другом. Это не так. Для суждения об отсутствии достоверных различий между группами необходим расчет ошибки второго рода (β-ошибки). Величина этой ошибки в медицинских исследованиях должна быть меньше 20%. Этого достичь часто удается только при значительном числе обследованных больных, поэтому не найденные в большинстве работ различия объясняются недостаточным количеством наблюдений.
Типичный пример
В контрольной группе пострадавших с тяжелой ЧМТ летальность составляет 40%. Исследователь считает, что если в результате лечения летальность в экспериментальной группе снизится на 10%, то эффект лечения можно считать существенным. Если изучаемый метод очень эффективен, то может понадобиться обследование всего 40-50 больных, летальность которых снизится на искомые 10%, и разница между основной и контрольной группами будет признана достоверной (α-ошибка менее 5%, р <0,05). Но если в такой выборке пациентов искомого эффекта не наблюдается, то это не всегда значит, что метод не влияет на летальность. Величина α-ошибки более 5% (р> 0,05) свидетельствует только о недостаточном количестве обследованных больных. Для достоверного вывода об отсутствии эффективности лечения и, следовательно, отсутствии достоверных различий между основной и контрольными группами нужно, чтобы величина β-ошибки была менее 20%. Согласно законам статистики, для этого понадобится обследование около 350 пациентов.
Если исследователь считает существенным для клинической практики еще меньший эффект лечения, например, снижение летальности не 10%, а на 5%, то для того, чтобы достичь в этом случае величины β-ошибки менее 20%, понадобится обследовать в три раза больше пациентов.
В настоящее время в мировой практике золотым стандартом считаются рандомизированные контролируемые (проспективные) испытания с двойным или тройным слепым контролем, результаты которых корректно обработаны статистическими методами (табл. 2). Эти исследования относятся к I классу. Материалы таких испытаний и данные метаанализа, корректно проведенного на основе исследований I класса, должны использоваться в медицинской практике в качестве источников наиболее достоверной информации. Методы лечения, эффективность которых доказана в исследованиях I класса, обязательны для использования в клинической практике. Верно и обратное. Методы, неэффективность которых доказана в этих исследованиях, должны быть исключены из практической деятельности.

Хорошо спланированные открытые экспериментальные исследования, а также обсервационные проспективные и ретроспективные работы относятся ко II классу. При известной доле критичности результаты этих испытаний могут применяться на практике. Исследования, в организации которых допущены значительные ошибки, а также работы, описывающие случаи из практики и серии случаев, относятся к III классу. Результаты этих исследований нужно использовать только в качестве информации к размышлению.
Сложнее выработать позицию в отношении методов, эффективность которых не доказана. Для ряда способов лечения этого просто не нужно делать. Например, это касается использования антибиотиков при лечении септических осложнений. Но есть огромное количество фармакологических препаратов, методов лечения, инструментальных средств, рациональность которых нуждается в доказательстве. Нельзя их безоглядно использовать только потому, что интуитивно они кажутся безупречными. В истории медицины в целом и реаниматологии, в частности, есть масса примеров, когда подобный подход вместо пользы наносил только вред больному.
Показательным примером являются результаты исследований по эффективности антиаритмического средства флекаинида в качестве средства вторичной профилактики внезапной смерти после перенесенного инфаркта миокарда. Предпосылки для испытаний были вполне логичными: аритмии являются причиной внезапной смерти после инфаркта миокарда, флекаинид эффективно их купировал. Однако многоцентровое исследование с использованием препарата пришлось прервать из-за того, что летальность в экспериментальной группе была больше, чем в контрольной. При детальном рассмотрении свойств флекаинида оказалось, что он, кроме антиаритмического эффекта, сам по себе вызывал аритмии (A.E. Epstein et al., 1989).
Проблемы, возникшие при анализе результатов цитированного исследования, объясняются выбором критериев эффективности (исходов лечения). Эти критерии делят на косвенные (суррогатные) и прямые (табл. 3). К косвенным критериям относят положительные изменения какого-либо исследуемого показателя (например, нормализацию артериального давления, сердечного выброса, уровня биологических субстанций в крови, восстановление активности ферментов и т.п.). К прямым критериям эффективности относят выздоровление, снижение летальности и числа осложнений, сокращение срока госпитализации, улучшение качества жизни.

К сожалению, большинство исследований посвящено оценке суррогатных исходов. В качестве еще одного примера можно привести изучение уровня внутричерепного давления при ЧМТ. Высоко оценивая значение этого показателя для исхода повреждения мозга, нужно подчеркнуть, что врача больше интересует не уровень внутричерепной гипертензии, а исход ЧМТ. Исследование эффективности профилактической гипервентиляции для лечения внутричерепной гипертензии показало, что метод снижал внутричерепное давление, но имел негативное влияние на исход повреждений мозга (J.P. Muizelaar et al., 1991).
Приведенные факты не означают, что на суррогатные критерии не надо опираться совсем. Громоздкость и высокая стоимость исследований первого класса не позволяет проверить таким образом все методы лечения. В связи с этим во многих случаях врач должен ориентироваться и на суррогатные критерии, и на исследования второго класса, а также на теоретические предпосылки, коллективный опыт и собственную практику. В таких ситуациях основу действий врача составляют постоянная оценка состояния больного и получаемых инструментальных данных (мониторинг в широком смысле слова). Критический анализ лечебных действий, готовность к их коррекции при неэффективности лечения является традицией отечественной медицины, следуя которой можно избежать ошибок. При получении доказательных данных, даже противоречащих традиционным представлениям, нужно быть готовым изменить свою позицию.
В нашей работе основное внимание уделено лечебным концепциям, которые опираются на данные, полученные в рамках доказательной медицины. При отсутствии таких данных мы обратимся к традиционному для российской медицины подходу – оценке лечебных мероприятий с точки зрения их клинической эффективности. Необходимые для осуществления этой постоянной оценки средства диагностики и мониторинга мы подробно рассмотрим.
Онкология — одна из самых сложных сфер медицины. В настоящее время многие злокачественные опухоли хорошо изучены, о них имеется много данных. Но зачастую эти данные сложны для понимания. Человеку без медицинского образования очень непросто увязать их в общую стройную картину.
Медицина — не математика. То, что в ней происходит, нельзя четко разделить на «черное» и «белое». Организм человека можно сравнить со сложным уравнением, в котором тысячи неизвестных. Решая его, зачастую нельзя получить точный однозначный ответ. В медицине дважды два не равно четырем. Врач скажет, что получается примерно четыре с вероятностью 90% плюс-минус 0,051.
Все это бывает очень сложно объяснить пациентам. А там, где человек не до конца понимает ситуацию, возникает масса сомнений и вопросов. Действительно ли медицина может помочь? Врач понимает, что со мной происходит, и как меня лечить? Работает ли курс химиотерапии, который мне назначили?
В этой статье мы постараемся ответить — максимально подробно и понятно.
- В первую очередь нужно понимать цель лечения
- На основании чего врач приходит к выводу о том, что именно данная комбинация препаратов поможет конкретному пациенту?
- Что такое ремиссия?
- Как контролируют эффективность химиотерапии в процессе лечения?
- Что делать, если вы сомневаетесь в эффективности лечения?
В первую очередь нужно понимать цель лечения
В большинстве случаев единственный радикальный метод лечения, который помогает избавиться от рака — хирургическое вмешательство. Противоопухолевые препараты применяют как дополнение к операции, чтобы уничтожить оставшиеся раковые клетки и снизить риск рецидива.
Если основным методом лечения является химиотерапия, а не хирургия, это, как правило, говорит о том, что опухоль успела сильно распространиться в организме. Она неоперабельна, имеются отдаленные метастазы. Прогноз в плане полного излечения от рака в данном случае неблагоприятен. Скорее всего, врачи не смогут полностью ликвидировать опухолевый процесс.
Но это еще не приговор. Таким пациентам можно помочь. Химиотерапия может преследовать другие цели:
- Затормозить или полностью остановить рост опухоли.
- Уменьшить размеры опухоли.
- Продлить жизнь больного.
- Избавить от мучительных симптомов.
- Улучшить общее состояние.
Для пациента с самого начала важно понимать: для чего врач назначил химиопрепараты, какого результата он ожидает? Обязательно побеседуйте с доктором на эту тему. Не бойтесь задавать вопросы. Это поможет избежать недопонимания и ненужных сомнений в будущем. Если у вас нет медицинского образования, в некоторых моментах вам будет сложно разобраться сразу. Не стесняйтесь, попросите доктора еще раз объяснить более понятным языком.
На основании чего врач приходит к выводу о том, что именно данная комбинация препаратов поможет конкретному пациенту?
В настоящее время существует огромное количество разновидностей химиопрепаратов и других противоопухолевых средств: таргетных препаратов, иммунопрепаратов, гормональных препаратов. Как понять, какие именно и в каких комбинациях помогут в вашем случае? Ни один онколог не сможет на 100% правильно ответить на этот вопрос, руководствуясь лишь собственным опытом. Но этого и не требуется.
Каждый лицензированный химиопрепарат хорошо изучен. Проведены многочисленные клинические исследования с участием тысяч пациентов. Это очень серьезный, сложный и дорогостоящий процесс.
Например, для того чтобы создать и протестировать новый препарат, современным фармкомпаниям в среднем нужно потратить 12 лет и миллиард евро.
Если какой-либо препарат помог или не помог одному пациенту, это еще ни о чем не говорит. Не существует двух людей с полностью одинаковыми организмами, как и двух совершенно одинаковых по своим свойствам злокачественных опухолей. Но когда лекарство проверено на тысячах людей, ученые получают результаты, которым можно доверять, и на которые можно ориентироваться.
На основании проведенных исследований составлены протоколы химиотерапии. Ориентируясь на них, онколог может назначить лечение, которое с очень высокой вероятностью поможет. Конечно же, предварительно нужно провести тщательное обследование, разобраться во всех характеристиках конкретной злокачественной опухоли.
Но даже в рамках протоколов каждый пациент индивидуален. Например, два немелкоклеточных рака легких могут иметь очень разные молекулярно-генетические свойства, и против них будут эффективно работать разные комбинации препаратов. Нужен персонализированный подход, и современные технологии предоставляют такую возможность. В клиниках сети «Евроонко» можно провести специальный анализ и составить «молекулярный портрет» опухолевых клеток. Вместе с результатом анализа лаборатория выдает списки комбинаций химиопрепаратов, которые будут наиболее эффективны в конкретном случае.
Что такое ремиссия?
«Доктор, сможете ли вы избавить меня от рака?» Если онколог отвечает на этот вопрос однозначное «да», то он в некоторой степени кривит душой.
Что подразумевает пациент под словом «выздоровление»? Скорее всего, что в его организме не останется ни одной раковой клетки. Проблема в том, что это нельзя проверить ни одним самым современным методом диагностики. Раковые клетки крайне малы и могут находиться в организме где угодно. Они могут годами «спать», а потом начать быстро размножаться и образовать метастазы.
Вместо слова «выздоровление» в онкологии применяют специальный термин «ремиссия»: с помощью доступных на данный момент методов диагностики в организме пациента не обнаруживаются признаки злокачественной опухоли. Это не означает, что в будущем рак не может вернуться. Иногда рецидивирует прежнее онкологическое заболевание или возникает новое. Врачи применяют разные методы профилактического лечения, чтобы этого не произошло. Но полностью застраховаться нельзя, можно лишь снизить риски.
Для того чтобы вовремя выявить возможный рецидив, после наступления ремиссии пациент должен периодически проходить обследования.
В зависимости от того, как пациент отвечает на химиотерапию, онкологи описывают результат лечения разными терминами:
- Полный ответ (полная ремиссия): опухоль исчезла и больше не обнаруживается.
- Частичный ответ (частичная ремиссия): опухоль осталась, но уменьшилась на определенный процент.
- Стабильное состояние: опухоль не уменьшается, но и не растет, не увеличивается количество очагов, не вовлекаются новые органы.
- Прогрессирование: опухоль растет, несмотря на лечение.
Опухолевые клетки коварны. Со временем в них происходят новые мутации. Начинается самый настоящий естественный отбор, как в теории эволюции: слабейшие быстро погибают под действием химиопрепарата, но сильнейшие выживают и обзаводятся новыми механизмами защиты. Поэтому все противоопухолевые средства помогают лишь в течение некоторого времени. Потом развивается резистентность (устойчивость), и вновь начинается прогрессирование. В таком случае врач назначит новые комбинации препаратов.
Как контролируют эффективность химиотерапии в процессе лечения?
Химиотерапию проводят циклами. Это означает, что пациенту вводят препараты, а потом дают время на «передышку». Продолжительность цикла кратна неделе и составляет 7, 14, 21 день. Обычно для того чтобы оценить ответ на лечение, требуется 2–3 цикла. Для контроля используют те же методы, что и для диагностики рака:
- Инструментальные исследования: КТ, УЗИ, МРТ и др.
- Анализы крови на онкомаркеры.
- Исследование функции пораженных органов.
- Осмотр врача, беседа. Доктор оценивает состояние пациента, спрашивает о симптомах, общем самочувствии.
Если рак отвечает на химиотерапию, лечение продолжают в прежнем режиме. Если начинается прогрессирование, нужно менять тактику.
Одновременно контролируют побочные эффекты. При их возникновении назначают поддерживающую терапию, меняют состав и дозировки химиопрепаратов. В клиниках «Евроонко» этому моменту уделяется особое внимание. Мы считаем, что пациенты должны переносить курсы химиотерапии максимально комфортно и без лишних рисков.
Что делать, если вы сомневаетесь в эффективности лечения?
В первую очередь стоит поговорить с лечащим врачом, спросить, как он оценивает эффективность лечения, нельзя ли сделать что-то еще.
Но в онкологии нередко встречаются сложные ситуации, когда сам врач не до конца уверен в диагнозе, правильности назначений. По объективным причинам встречаются ошибки. Поэтому во всем цивилизованном мире давно стала нормой практика получения второго врачебного мнения. Не стесняйтесь проконсультироваться с другим специалистом.
Врачи «Евроонко» всегда воспринимают позитивно возможность услышать мнение опытных коллег. У нас даже существует специальная система контроля качества. Ведь в конечном счете это идет на пользу пациенту, жизнь и здоровье которого — главные ценности для нас.
| Подробнее о лечении в «Евроонко»: | |
| Приём химиотерапевта | 6 900 руб |
| Паллиативная терапия в Москве | от 35 000 руб в сутки |
Как оценивается эффективность проводимой химиотерапии?
Начало использования химиопрепаратов для лечения злокачественных опухолей относится к 1943 г., когда был описан выраженный эффект воздействия азотистого иприта у больных лимфосаркомой.
В 1948 г. появилось сообщение о клинической эффективности аминоптерина — антагониста фолиевой кислоты при лечении лейкоза. В 1953 г. отмечена эффективность 6-меркаптопурииа, а уже к концу 1950-х и в начале 1960-х гг. противоопухолевые препараты синтезировались и испытывались в больших количествах.
Однако из тысячи препаратов лишь небольшая их часть была отобрана для клинических испытаний, а еще меньшее количество доказало свою эффективность. В клиническую практику вошло более 100 противоопухолевых средств. Поскольку процесс деления нельзя считать особенностью лишь злокачественных клеток, многие препараты токсичны для нормальных, особенно интенсивно делящихся клеток (костный мозг, слизистые оболочки).
Именно по этой причине при назначении химиотерапии следует выбирать вещества, замедляющие или контролирующие рост опухолевых клеток и при этом минимально токсичные для нормальных тканей.
Наиболее эффективные режимы химиотерапии могут не только подавлять рост опухолевых тканей, но и полностью их уничтожать.
Основным показателем эффективности лечения, как и при других заболеваниях, считают выживаемость больных со злокачественными опухолями. Вместе с тем для оценки непосредственного лечебного действия разработаны единые критерии объективного и субъективного эффекта. Критерием объективного эффекта (ответа на терапию) при лечении солидных опухолей служит уменьшение опухоли и метастазов.
Традиционно в течение длительного времени для оценки объективного эффекта химиотерапии использовались критерии комитета экспертов ВОЗ. При этом применялась оценка размера опухоли и метастазов как производное двух наибольших перпендикулярных диаметров.
Критерии эффекта по шкале ВОЗ при солидных опухолях:
1) полный эффект — исчезновение всех поражений на срок не менее 4 недель;
2) частичный эффект — большее или равное 50% уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов сроком не менее 4 нед.;
3) стабилизация (без изменений) — уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения;
4) прогрессирование — увеличение более чем на 25 % одной или более опухолей либо появление новых очагов поражения.
Существуют отдельные критерии эффективности при лечении метастазов в костях:
1) полный эффект — полное исчезновение всех поражений на рентгенограммах или сканограммах;
2) частичный эффект — частичное уменьшение остеолитических метастазов, их рекальцификация или уменьшение плотности остеобластных поражений;
3) стабилизация — отсутствие изменений в течение 8 нед. от начала лечения;
4) прогрессирование — увеличение существующих или появление новых очагов поражения.
При гемобластозах критерии эффективности химиотерапии: полная ремиссия — исчезновение всех признаков болезни сроком не менее 4 нед. Для гемобластозов с вовлечением костного мозга необходима полная нормализация миелограммы и гемограммы. Вводится понятие полной цитогенетической ремиссии (для лейкозов) — полное исчезновение (во всех клетках при исследовании методом FISH-флюоресцентной гибридизации in situ) бывших до лечения цитогенетических аберраций и полной молекулярной ремиссии — отсутствие опухолевых клеток при определении методом количественной полимерной цепной реакции.
При лимфоме Ходжкина и неходжскинской лимфоме вводится понятие «неуверенная» или «недоказанная» полная ремиссия — отсутствие признаков болезни, определяемых клинически и объективными методами обследования; резидуальные лимфатические узлы размерами до 1,5 см в максимальном диаметре должны быть результатом регрессии более чем на 75% (сокращение объема опухолевой массы); данные исследования костного мозга интерпретируются как «неопределенные».
Особо обращаем Ваше внимание, что эффективность химиотерапии определяет Ваш лечащий врач-онколог, врач-терапевт по месту жительства.
Самостоятельно Вы можете также оценить изменение размера опухоли, если это наружная локализация: уменьшение размеров, изменение цвета, эластичности, снижение болевого синдрома, либо отсутствие появления новых очагов или увеличения размеров очага.
В арсенале врачей РЯОЦ имеется широкий арсенал средств, которые помогают улучшить эффект от проводимой химиотерапии и одномоментно снизить токсические реакции химиопрепаратов при этом сохраняется высокое качество жизни пациентов.
Для этого проводится консилиум врачей, при необходимости привлекаются дополнительные специалисты, на котором разрабатывается индивидуальная программа ведения пациента с учетом проводимой химиотерапии и ее режима, а также имеющейся сопутствующей патологии.
Лечение проводится в соответствии с высокими международными стандартами, используя научную клиническую базу и опыт ученых Российской Федерации и Японии.
Если Вы хотите гарантированно получить эффект от:
- АФП терапии
- NLS терапии
- Онкопротекторной терапии
- Гепатопротекторной терапии
- Регенерационной терапии
- Антиоксидантной терапии
- Антигомотоксикологической терапии
- Иммуномодулирующей терапии
- Терапии нормализации метаболических процессов
- Противовоспалительной и противоопухолевой терапии
Специалисты высокого класса
Наши врачи высшей квалификационной категории со стажем работы более 20 лет!
Для тех, кто думает о своем здоровье!
- С нами всегда есть связь, мы доступны всегда
- Если Вам отказали в обслуживании в другом медицинском учреждении, мы примем
- Если у Вас сомнения в поставленном диагнозе, то программа «Второе мнение врача» как раз для Вас
- Вы не хотите стоят в очередях и любите хорошее отношение, комфортные условия и понимание, мы сможем Вам помочь
- Остались наедине с тяжелым заболеванием, разберемся, поможем, направим на путь выздоровления
Нам можно доверять!
Специализированная помощь пациенту и близким. Для успеха лечения важно всё — сотрудничество пациента и врача, правильно поставленный диагноз и выбранная тактика лечения, информированность о лечении и комфорт лечебного процесса.
Наши лицензии и документы
Мы гарантируем комфортные условия обследования и лечения!