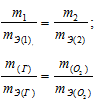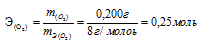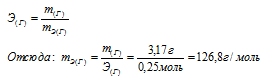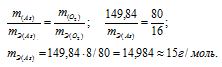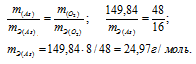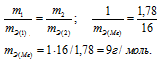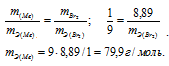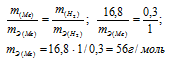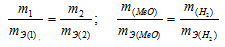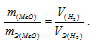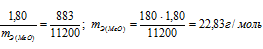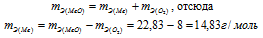Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,17 г одного из галогенов. Определить эквивалентную массу галогена.
Решение: По закону эквивалентов:
Массы реагирующих веществ относятся между собой как эквиваленты этих веществ.
Эквивалент кислорода равен 8. Отсюда:
0,2 г кислорода соответствует 3,17 г одного из галогенов
Э кислорода – « – « – « – Э галогена
Э галогена = 8*3,17/ 0,2 = 126,8
Ответ: эквивалент галогена равен 126,8 г/моль
Не знаете как решить или выполнить курсовую или дипломную?
Заказать решение
Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение эквивалентной массы вещества
Задача №1
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Из условия задачи следует, что в оксиде металла на 5г металла приходится 4,44г кислорода (9,44 – 5 = 4,44). Согласно закону эквивалентов, массы (объёмы) взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
5г металла эквивалентны 4,44г кислорода
mЭ(Ме) г/моль металла эквивалентны 8г/моль кислорода
Откуда mЭ(Ме) = 8 . 5/4,44 = 9,01г/моль.
Ответ: mЭ(Ме) = 9,01г/моль.
Задача №2
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
I Вариант
Из условия задачи следует, что 0,200г кислорода и 3,17г галогена эквивалентно соединяются с металлом. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
0,200г кислорода эквивалентны 3,17г галогена
mЭ(О2) 8г/моль кислорода эквивалентны mЭ(Г) Х г/моль
Откуда: mЭ(Г) 8 . 3,17/0,200 = 126,8г/моль.
Ответ: mЭ(Г) = 126,8г/моль.
II Вариант
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Таким образом, количество эквивалентов галогена и кислорода численно равны между собой, что составляет:
Зная количество эквивалентов и массу вещества можно определить эквивалентную массу этого вещества:
Ответ: 126,г/моль.
Задача №3
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Находим эквивалентную массу магния: mЭ(Mg) = 1/2M(Mg) =24/2 = 12г/моль. Следовательно, 21г магния составляет 21/2 =1,75 эквивалентной массы Mg. Согласно закону эквивалентов масса израсходованного кислорода составляет 1,75 его эквивалентной массы. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, рассчитаем массу кислорода, расходуемую на сжигание магния: m(O2) = 1,75 . 8 = 14г. Зная, что 1л кислорода по массе составляет 1,4г, рассчитаем объём кислорода расходуемого при сгорании 21г магния, составив пропорцию:
1,4 : 1 = 14 : х;
х = 14 . 1/1,4 = 10л.
Ответ: V(O2) = 10л.
Задача№4
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Из условия задачи следует, что в оксиде металла на 3,24г металла приходится 0,24г кислорода (3,48 – 3,24 = 0,24г). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам). Так как эквивалентная масса кислорода составляет 8г/моль, то эквивалентную массу металла находим из пропорции:
8 : 0,24 = х : 3,24;
х = 8 . 3,24/0,24 =108г/моль.
В сульфиде металла на 3,24г металла приходится 0,48г серы (3,72 – 3,24 = 0,48г). Эквивалентную массу серы находим из пропорции:
3,24 : 108 = 0,48 : х;
х = 108 . 3,24/0,48 = 16г/моль.
Ответ: mэ(Me) = 108г/моль; mэ(S) = 16г/моль.
Задача№5
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Зная, что эквивалентный объём кислорода равен 5,6л/моль, рассчитаем эквивалентную массу металла, составив пропорцию:
8,345 : 0,680 = х : 5,6;
х = 8,34 . 5,6/0,680 = 68,68г/моль.
Атомную массу металла находим, учитывая, что металл двухвалентный, умножением его эквивалентной массы на 2:
М(Ме) = mэ(Ме) . В, где
В – валентность металла; М – молярная масса металла; mэ(Ме) – эквивалентная масса металла.
М(Ме) = 68,68 . 2 = 137,4г/моль.
Определяем, какой это металл по таблице «Периодическая система химических элементов Д.И. Менделеева», учитывая, что его атомная масса составляет 137,4. Такой атомной массе соответствует барий – элемент№56.
Ответ: 137,4; Ba.
Задача№6
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
а) Находим формулу оксида мышьяка, учитывая, что оксид содержит 65,2% As по массе. Тогда оксид содержит кислорода по массе 34,8% (100 – 65,2 = 34,8). Находим формулу оксид мышьяка:
AsхОу = х : у = 65,2/Ar(As) : 34,8/Ar(O2) = 65,2/74,92 : 34,8/16 = 1 : 2,5 = 2 : 5
Формула оксида будет иметь вид: As2O5.
M(As2O5) = 229,84г/моль.
Находим массу мышьяка и массу кислорода в оксиде:
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 5 = 80г.
Согласно закону эквивалентов массы элементов в оксиде пропорциональны их эквивалентным массам:
б) Подобные расчеты производим, учитывая, что оксид содержит 75,7% As и 24,3% О2 (100 – 75,7 = 24,3) по массе:
AsхОу = х : у = 75,7/74,92 : 24,3/16 = 1,01 : 1,51 = 1 : 1,5 2 : 3
Формула оксида будет иметь вид: As2O3.
M(As2O5) = 197,84г/моль.
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 3 = 48г.
Ответ: а) 15г/моль; 24,97г/моль.
Задача№7
,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:
Ответ: 9г/моль; 79,9г/моль.
Задача№8
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Согласно закону эквивалентов:
mэ(соли) = mэ(Cu) + mэ(Cl2).
Отсюда mэ(Cl2) = mэ(соли) — mэ(Cl2) = 99,5 – 35,5 = 64г/моль.
Зная эквивалентные массы хлора и меди можно определить количество их атомов в молекуле соли: mэ(А) = М(А)/mэ(А).
Тогда: CuxCly = x : y = 63,5/63,546 : 35,45/35,5 = 0,992 : 0,999 = 1 : 1
Отсюда CuxCly = CuCl.
Ответ: CuCl.
Задача№9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
M(H2SO4) =98г/моль.
Находим массу водорода в 14,7г серной кислоты, составив пропорцию: 98 : 2 14,7 : х;
х = 2 . 14,7/98 = 0,3г.
Согласно закону эквивалентов массы взаимодействующих веществ пропорциональны их эквивалентным массам:
Учитывая, что эквивалентный объём водорода равен 11,2л/моль, рассчитаем объём который занимает 0,3г водорода: из пропорции:
1 : 11,2 = 0,3 : х;
х = 11,2 . 0,3/ 1 = 3,36л.
Ответ: mэ(Ме) = 56г/моль; V(H2) = 3,36л.
Задача№10
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Так как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 4л. Отсюда эквивалентный объём водорода равен, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000мл/моль.
Отношение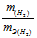
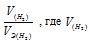
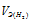
Тогда получим отношение
Находим эквивалентную массу оксида металла:
Согласно закону эквивалентов:
Ответ: 22,83г/моль; 14,83г/моль.
вычислить эквивалент галогена
-
07nastya
- Сообщения: 7
- Зарегистрирован: Вт апр 22, 2008 5:05 pm
вычислить эквивалент галогена
Помогите решить задачу. Одно и то же оличество металла соединяется с 0,2 г кислорода и с 3,173 г одного из галогенов.Вычислить эквивалент галогена
-
Polychemist
- Сообщения: 9336
- Зарегистрирован: Вт дек 21, 2004 11:42 am
Сообщение
Polychemist » Вт апр 22, 2008 6:11 pm
Для начала найдите ответы на вопросы: что такое зквивалент (четкое определение) и чему равен эквивалент кислорода.
-
Hedgehog
- химик ежовый
- Сообщения: 13401
- Зарегистрирован: Ср янв 19, 2005 7:41 pm
Сообщение
Hedgehog » Вт апр 22, 2008 9:18 pm
Всё-таки лучше в данном случае употреблять термин «молярная масса эквивалента»
bacco, tabacco e Venere
-
Findarato Ingoldo
- Сообщения: 494
- Зарегистрирован: Ср ноя 01, 2006 10:25 am
- Контактная информация:
Сообщение
Findarato Ingoldo » Ср апр 23, 2008 9:07 am
Hedgehog писал(а):Всё-таки лучше в данном случае употреблять термин «молярная масса эквивалента»
Согласен, эквивалент (количество вещества, эквивалентное 1 молю атомов водорода) галогена в реакции с металлами всегда равен 1.
Ónen i-Estel Edain, Ú-chebin Estel anim.
Эквивалентом
вещества называется такое его количество,
которое соединяется с 1 молем атомов
водорода или замещает то же количество
атомов водорода в химических реакциях.
Эквивалентной
массой называется масса 1 эквивалента
вещества.
На основе законов
эквивалентов можно вывести следующие
формулы для вычисления эквивалентных
масс сложных веществ – оксидов, кислот,
оснований и солей:

где
М – молярная масса соединений, г/моль;
Э – их эквивалентная масса.
* Основность кислоты
определяется числом атомов водорода,
которые замещаются на металл. Кислотность
основания определяется числом
гидроксильных групп, замещающихся на
кислотный остаток.
Пример
1
При растворении 0,0547 г
металла в кислоте выделилось 50,4 мл
водорода, измеренного при нормальных
условиях. Вычислить эквивалент металла.
Р
е ш е н и е. Эквиваленты вычисляются по
закону эквивалентов, который математически
может быть выражен зависимостью
mМе
/
ЭМе
= mН2
/
ЭН2
,
где
mМе
–
масса металла; mН2
– масса водорода; ЭМе
— эквивалент металла; ЭН2
–
эквивалент водорода.
Если
одно из веществ находится в газообразном
состоянии, то, как правило, его количество
измеряется в объемных единицах, отношение
mН2/ЭН2
можно
заменить равным ему отношением:
VН2
/
VЭН2,
где
VН2
–
объем водорода, мл;
VЭН2
—
эквивалентный объем водорода, мл.
Тогда получим
ЭМе
=
mМе
V
ЭН2
/ V
Н2 =
0,0547х 11200/ 50,4 = 12,16 моль/л
(11200
мл
– эквивалентный объем водорода)
Пример
2.
Вычислить эквивалент H2SO4
в реакциях: а) с магнием, б) с едким кали
зная, что при взаимодействии с КОН
образуется кислая соль.
Р
е ш е н и е. Из уравнения реакции
H2SO4
+ Mg = MgSO4
+ H2
видно,
что одна молекула серной кислоты, т.е.
98 г
взаимодействует с 24,312 г
магния. По закону эквивалентов
mМе
/
ЭМе
= mН2SO4
/
Э Н2SO4
Зная,
что эквивалент магния равен половине
атомного веса, т.е. 12,156, находим эквивалент
Н2SO4:
Э
Н2
SO4
=
98 х 12,156/ 24,312 = 49 г/моль
Из
уравнения реакции
H2SO4
+ КОН = КНSO4
+ H2О
следует,
что одна молекула серной кислоты, т.е.
98 г
взаимодействует с одной молекулой КОН,
эквивалент
которой
численно равен молярной массе КОН.
Следовательно, эквивалент H2SO4
в
данной реакции равен 98.
Пример
3.
Рассчитать атомную массу и эквивалент
элемента, зная, что содержание данного
элемента в оксиде составляет 46,7% и на
один атом приходится два атома кислорода.
Р
е ш е н и е. Из закона эквивалентов
следует:
46,7
/ 53,3 = Э /8, Э = 46,7 х 8 / 53,3 = 7,01 г/моль
Так,
как на один атом элемента в оксиде
приходится два атома кислорода, то
валентность элемента равна четырем, а
атомная масса равна 7,01 х 4 = 28,04 г/моль
Задания
-
Один грамм
некоторого металла реагирует с 1,78 г
серы или 8,89 г брома. Вычислите эквивалентные
массы брома и металла, если известно,
что эквивалентная масса серы составляет
16 г/моль. -
Одно и то же
количество металла соединяется с 0,2 г
кислорода и с 3,173 г одного из галогенов.
Определите эквивалент галогена. -
При разложении
0,4638 г оксида металла получено 0,4316 г
металла. Определите эквивалентную
массу металла. -
Сколько литров
водорода (условия нормальные) потребуется
для восстановления 112 г оксида металла,
содержащего 71,43% металла? Каковы
эквивалентная масса и эквивалент
металла? -
1
г двухвалентного металла вытесняет
из кислоты при нормальных условиях
0,921 л водорода. Определите, с каким
металлом вступает в реакцию кислота. -
Известно, что
0,432 г металла образуют 0,574 г хлорида.
Вычислите эквивалентную массу металла,
приняв эквивалентную массу хлора
равной 35,5 г/моль. -
При восстановлении
водородом 10,17 г оксида двухвалентного
металла образовалось 2,25 г воды,
эквивалентная масса которой 9,00 г/моль.
Вычислите эквивалентные массы металла
и его оксида. -
Вычислите
эквивалентную массу ортофосфорной
кислоты в реакциях с раствором КОН с
образованием: а) дигидрофосфата калия;
б) гидрофосфата калия; в) фосфата калия. -
Некоторое количество
металла, эквивалентная масса которого
равна 27,9 г/моль, вытесняет из кислоты
700 мл водорода, измеренного при нормальных
условиях. Определите массу металла. -
Для растворения
16,8 г металла потребовалось 14,7 г серной
кислоты. Определить эквивалентную
массу металла и объем выделившегося
водорода (условия нормальные). -
Один оксид марганца
содержит 22,56% кислорода, а другой —
50,50%. Вычислите эквивалентные массы
марганца в этих оксидах и составьте их
формулы. -
Вещество содержит
39,0% серы, эквивалентная масса которой
16,0, и мышьяк. Вычислите эквивалентную
массу и валентность мышьяка. Составьте
формулу этого вещества. -
При сгорании серы
в кислороде образовалось 12,8 г оксида
серы(IV). Сколько эквивалентных масс
кислорода потребуется на эту реакцию?
Чему равны эквивалентные массы серы и
ее оксида? -
При взаимодействии
3,24 г трехвалентного металла с кислотой
выделяется 4,03 л водорода, измеренного
при нормальных условиях. Вычислите
эквивалентную массу и определите, с
каким металлом реагировала кислота. -
На нейтрализацию
1 г основания израсходовано 2,14 г соляной
кислоты. Вычислите эквивалентную массу
основания. -
При
восстановлении водородом 20,342 г
оксида металла образовалось 4,504 г
воды, эквивалент которой 9,008. Чему равны
эквиваленты металла и его оксида? -
Вычислите
процентное содержание кислорода в
оксиде трехвалентного металла, зная,
что эквивалент металла 8,9938. Чему равен
эквивалент оксида металла? Какой это
металл? -
На
полное сгорание 0,15 г
некоторого неметалла расходуется 280
мл
кислорода, измеренного при нормальных
условиях, а при неполном сгорании того
же количества неметалла требуется в
два раза меньше кислорода. Вычислите
эквиваленты: получающихся веществ;
неметалла в каждом из получающихся
веществ. -
Вычислите
эквивалент и атомную массу элемента,
зная, что в его оксиде на один атом
элемента приходится три атома кислорода,
а содержание кислорода в оксиде
составляет 60%. -
На
образование 43,239 г
гидрида щелочного металла требуется
5,6 л
водорода, измеренного при нормальных
условиях. Вычислите эквиваленты
щелочного металла и его гидрида. Какой
это металл?
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- Назад
- 1
- 2
- Далее
- Страница 1 из 2
Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
Одинаковое количество металла соединяется с 0,2 г О2 и 2,00 г галогена. Найти эквивалентную массу галогена.
С решением пожалуйста
Ссылка на комментарий
—>
-
- Поделиться
Одинаковое количество металла соединяется с 0,2 г О2 и 2,00 г галогена. Найти эквивалентную массу галогена.
С решением пожалуйста
2*(8/0,2) = …
Ссылка на комментарий
- Автор
-
- Поделиться
А можно узнать какие формулы были использованы?
Ссылка на комментарий
-
- Поделиться
А можно узнать какие формулы были использованы?
Закон эквивалентов.
Ссылка на комментарий
-
- Поделиться
В принципе, можно и без эквивалентов, но с ними быстрее.
Ссылка на комментарий
- 10 месяцев спустя…
-
- Поделиться
Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,17 г одного из
галогенов. Определить эквивалентную массу галогена.
с решением
Ссылка на комментарий
-
- Поделиться
Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,17 г одного из
галогенов. Определить эквивалентную массу галогена.
с решением
Ого, разрешите приступить к выполнению?
Ссылка на комментарий
-
- Поделиться
Ого, разрешите приступить к выполнению?
разрешаю)))))))))))))
Ссылка на комментарий
-
- Поделиться
разрешаю)))))))))))))
Выполнено. О результатах доложено Вашему руководству. Вы свободны.
Где дверь, знаете?
Ссылка на комментарий
- Назад
- 1
- 2
- Далее
- Страница 1 из 2
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти