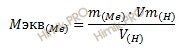Определение эквивалента и эквивалентной массы металла по водороду
Цель
работы:
практически, опытным путем научиться
определять эквивалент и эквивалентную
массу металла по объему газа, выделенного
в ходе реакции. Научиться проводить
различные рациональные расчеты с
использованием закона эквивалентов.
Теоретическая
часть.
Из
закона постоянства состава, кратных и
объемных отношений следует, что элементы
соединяются друг с другом в строго
определенных количественных соотношениях,
которые называют эквивалентами или
эквивалентными массами.
Для
определения эквивалентов и эквивалентных
масс нужно знать, что такое моль и мольная
масса.
Моль—
это количество вещества, в котором
содержится число частиц любого
определяемого сорта, равное постоянной
Авогадро (6,02 .1023).
Например: 3 .1024
молекул воды составят 5 моль.
Мольная
(молярная) масса
вещества в граммах численно равна его
относительной молекулярной (атомной)
массе, выраженной в атомных единицах
массы (а.е.м.). Масса 1 моля вещества
выражается в г/моль. Например: молярная
масса Н2О
и атомная масса кислорода соответственно
равны 18 и 16 а.е.м., их мольные массы равны
18 г/моль и 16 г/моль. Эквивалентом
элемента
называется такое его количество, которое
соединяется 1с молем атомов водорода
или замещает то же количество атомов
водорода в химических реакциях. Например,
в соединениях НВг, Н2О,
РН3
эквиваленты брома, кислорода, фосфора
соответственно равны 1 моль, 1/2 моль, 1/3
моль.
Масса
одного эквивалента называется его
эквивалентной
массой.
Так, в приведенных выше примерах,
эквивалентные массы брома, кислорода,
фосфора соответственно равны 79,9 г/моль,
16:2 = 8 г/моль, 31:3= 10,3 г/моль.
Эквивалентом
сложного вещества
называется такое его количество, которое
взаимодействует без остатка с одним
эквивалентом водорода или с одним
эквивалентом любого другого вещества.
Расчеты, связанные с определением
эквивалентных масс, проводятся по закону
эквивалентов:
массы
(объемы) реагирующих друг с другом
веществ, пропорциональны их эквивалентным
массам (объемам). Математически закон
выражается зависимостью:

где:
m,
(V)
— массы (объемы) реагирующих веществ;
Э,
(Vэкв.)
— эквивалентные массы (объемы).
Эквивалентную
массу простого вещества можно вычислить
по формуле:
где
— мольная масса атома элемента,
В
— валентность элемента.
Так, например,
эквивалентные массы водорода и кислорода
соответственно равны:
Эквивалентный
объем газа можно вычислить по формуле:
Так, например,
эквивалентные объемы водорода и кислорода
соответственно равны:
Эквивалентные
массы сложных веществ можно вычислить
по формулам:
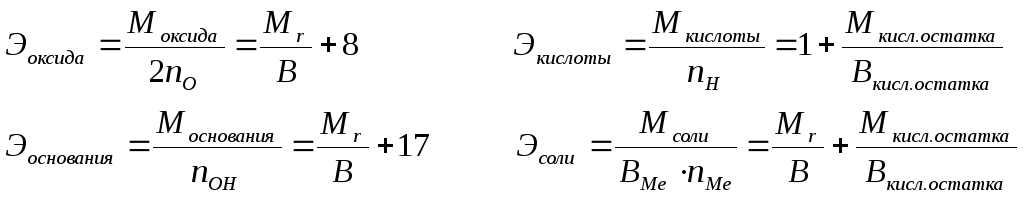
nO,
nOH,
nH,
nMe
– число
атомов кислорода, гидроксильных групп,
атомов водорода, металла соответственно
в оксиде, основании, кислоте, соли; В
– валентность, 8 – эквивалентная масса
кислорода, 1 – эквивалентная масса
водорода, 17 – эквивалентная масса
гидроксильной группы.
В
данной работе определение эквивалентной
массы металла основано на
измерении
объема водорода, вытесненного активным
металлом из разбавленной кислоты.
Измеренный объем водорода при условиях
опыта приводится к нормальным условиям:
Затем
по формуле (1) определяют эквивалентную
массу.
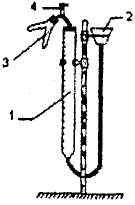
Рисунок
и описание
прибора для определения
эквивалента
металла
Рис.1.1
Прибор состоит из
бюретки 1, соединенной резиновыми
трубками с воронкой 2 и двухколенной
пробиркой 3. Прибор смонтирован на
штативе Бунзена.
Реактивы и посуда.
Прибор
для определения эквивалента металла
(рис.1.1), барометр, термометр, мерный
цилиндр емкостью 10 мл, воронка, 10 % —
ный раствор соляной кислоты, металлический
магний.
Практическая
часть
1. В
одно колено пробирки 3
внесите магний, а в другое колено пробирки
через воронку налейте около 12мл 10%- ного
раствора соляной кислоты. Наденьте
двухколенную пробирку на пробку,
соединенную резиновой трубкой с бюреткой.
2.
Необходимым условием протекания опыта
является герметичность всей системы,
поэтому проверьте прибор на герметичность.
Для этого воронку 2
опустите или поднимите на 25-30 см и держите
на одном уровне 1 -2 минуты. Если уровень
воды в бюретке 1
не изменится за это время, то прибор
герметичен. Если же уровень воды в
бюретке будет снижаться или подниматься
до уровня воды в воронке, то вращательными
движениями добейтесь плотного прилегания
всех пробок и снова проверьте герметичность
прибора.
3.
Убедившись в герметичности прибора,
отметьте уровень воды в бюретке 1,
а затем постепенно (первая порция кислоты
должна быть небольшой во избежание
бурного выделения газа) наклоните
двухколенную пробирку так, чтобы кислота
перелилась в колено с магнием.
4. По
окончании реакции подождите 1 минуту,
пока газ примет температуру помещения
и измерьте объем водорода, вытесненного
магнием. Для этого установите воронку
на такой высоте, чтобы вода в воронке и
бюретке была на одном уровне, то есть
газ находился при атмосферном давлении.
Деление бюретки, против которого
установится уровень воды, будет
соответствовать объему выделившегося
водорода при условиях проведения опыта.
( Если в начале опыта уровень воды
находился не на нулевой отметке, то из
конечного показания уровня воды надо
вычесть число, соответствующее начальному
уровню воды). В таблицу 1.1 запишите
значения указанных в ней величин.
Таблица
1.1 Параметры для расчета эквивалента
металла.
|
m, г |
P, Па |
Т, К |
V мл |
Р0, Па |
Т0, К |
V0, мл |
h, Па |
Определите давление
Р по барометру и температуру Т по
термометру.
Давление
насыщенного водяного пара h,
соответствующее температуре опыта Т,
выпишите из следующей таблицы:
Таблица
1.2 Давление насыщенного водяного пара
при различных температурах
|
Т, К |
h, |
|
293 |
2300 |
|
294 |
2500 |
|
295 |
2700 |
|
296 |
2900 |
|
297 |
3100 |
|
298 |
3300 |
|
299 |
3500 |
|
300 |
3700 |
Р0
— давление при нормальных условиях,
равное 101325 Па;
Т0
—
температура при нормальных условиях,
равная 273 К.
Расчет
Напишите уравнение
реакции магния с соляной кислотой.
Измеренный
объем водорода V
приведите к нормальным условиям по
уравнению Клапейрона (3):
Из математического
выражения (1) закона эквивалентов
определите эквивалентную массу магния:
Определите
теоретическое значение эквивалентной
массы магния по формуле:
где
— мольная масса металла, В валентность
металла.
Сравните
полученное практическое значение
эквивалентной массы Э магния с
теоретическим
значением Эт.
Рассчитайте процент
относительной ошибки опыта по формуле:
Указания по
технике безопасности
Необходимым
условием протекания опыта является
герметичность всей системы. Она в
основном определяется тем, насколько
плотно прилегают пробки к двухколенной
пробирке и бюретке. При проверке
герметичности прибора во избежание
порезов рук стеклом, которые могут
возникнуть при чрезмерном нажиме пробки
на стекло, необходимо двухколенную
пробирку, пробку и бюретку держать
полотенцем.
Лабораторная
работа №2
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Эквивалентная масса металла
При растворении в кислоте металла массой 11,9 грамм выделился водород объемом 2,24 литра (нормальные условия). Чему равна эквивалентная масса металла ( Мэкв) и фактор эквивалентности металла (fэкв).
Решение
Согласно закону эквивалентов: массы (объемы)реагирующих веществ пропорциональны молярным массам (объемам) эквивалента этих веществ.
Учитывая, что эквивалентный объем водорода (H) равна 11,2 л, определим эквивалентную массу металла по закону эквивалентов:
Откуда выразим эквивалентную массу металла:
Получаем:
M экв (Me) = 11,9 ∙ 11,2 / 2,24 = 59,5 (г/моль).
Молярная масса эквивалента – равна произведению фактора эквивалентности на молярную массу вещества.
Если валентность металла z (Ме) = 1, то М = Мэ = 59,5 г/моль — одновалентного металла с такой молярной массой нет (смотри таблицу Менделеева).
Если z(Ме) = 2, то М = 2Мэ = 119 г/моль – двухвалентного металла с такой молярной массой нет.
Если z(Ме) = 3, то М = 3Мэ = 178,5 г/моль – гафний.
Фактор эквивалентности металла 1/3.
Ответ:
эквивалентная масса металла 59,5 г/моль;
фактор эквивалентности металла 1/3.
Как вычислить массу эквивалента металла
Эквивалентом какого-либо химического элемента называется такое его количество, которое вступает во взаимодействие с одним молем атомов водорода. Взаимодействие может заключаться в соединении с водородом, либо его вытеснении (в реакциях замещения). Молярной массой эквивалента элемента называется, соответственно, масса одного моля эквивалента.

Инструкция
Чтобы понять, как вычислить массу эквивалента, рассмотрите пример. Щелочной металл литий вступил в соединение с водородом, образовав гидрид лития: LiH. Требуется найти массу эквивалента этого металла.
Атомная масса лития составляет 6,94 а.е.м. (атомных единиц массы), водорода – 1,008 а.е.м. Для упрощения расчетов, немного округлите эти величины и примите их за 7 и 1.
Итак, какова же массовая доля (массовый процент) обоих компонентов в этом веществе? 7/8 = 0,875 или 87,5% для лития, и 1/8 = 0,125 или 12, 5% для водорода. Согласно закону эквивалентов, открытому немецким химиком И.В. Рихтером в конце 18-го века, все вещества реагируют друг с другом в эквивалентном соотношении, следовательно, в вашем конкретном случае массовая доля водорода во столько же раз меньше массовой доли лития, во сколько раз эквивалентная масса лития больше эквивалентной массы водорода. Следовательно, вычислите: 0,875/0,125 = 7. Задача решена: эквивалентная масса лития в его гидриде равна 7г/моль.
Теперь рассмотрите такие условия. Предположим, какой-то металл (Ме) подвергся реакции окисления. Она протекла полностью, из 30 г металла в итоге получилось 56, 64 г его оксида. Какова же эквивалентная масса этого металла?
Вспомните, какова эквивалентная масса (МЭ) кислорода. Его молекула двухатомная, следовательно, МЭ = 8г/моль. Сколько кислорода содержится в образовавшемся оксиде? Вычитая из общей массы оксида первоначальную массу металла, получите: 56,64 – 30 = 26,64 г.
По тому же закону эквивалентов, эквивалентная масса металла определяется как произведение эквивалентной массы кислорода на величину дроби: масса металла/масса кислорода. То есть 8г/моль * 30/26,64. Произведя эти вычисления, вы получите ответ: 9,009 г/моль или округленно 9 г/моль. Вот такова эквивалентная масса этого металла.
Видео по теме
Полезный совет
Вы пользовались округленными величинами для ускорения расчетов. Если по условиям задачи требуется высокая точность, к округлениям прибегать нельзя.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Определение молярной массы эквивалента металла методом вытеснения водорода
-
Вид работы:
Практическое задание
-
Предмет:
Химия
-
Язык:
Русский
,
Формат файла:
MS Word
30,76 Кб
-
Опубликовано:
2015-06-11
Вы можете узнать стоимость помощи в написании студенческой работы.
Определение молярной массы эквивалента металла методом вытеснения водорода
МИНОБРНАУКИ
РОССИИ
Федеральное
государственное бюджетное образовательное учреждение
высшего
профессионального образования
«Ижевский
государственный технический университет имени М.Т. Калашникова»
Кафедра
«Химия и химическая технология»
Лабораторная
работа №1
Тема:
«Определение молярной массы эквивалента металла методом вытеснения водорода »
Выполнил:
студент гр. Б01-131-1 Федорова
С.Н.
Проверил:
к.т.н., доцент Кибенко
В.Д.
Ижевск,
2014
Цель работы
Экспериментальным путем по реакции металла с
кислотой определить малярную массу эквивалента металла оценить погрешность
опыта
Теоретическая часть
. Эквивалент — условная или реальная частица
вещества, которая может присоединять, замещать или быть каким-либо другим образом
равнозначной одному атому или иону водорода в кислотно-основных или
ионно-обменных реакциях или одному электрону в окислительно-восстановительных
реакциях.
. Молярная масса эквивалента вещества — масса
одного моля эквивалента вещества.
М()=
=f*
[г/моль]
где z-число эквивалентности, а 1/z-фактор
эквивалентности (число, обозначающее какая доля от реальной частицы
эквивалентна одному атому водорода).
Экспериментальная часть
Реакция, на которой
основан эксперимент
Al+6HCl=2AlCl3+3H2
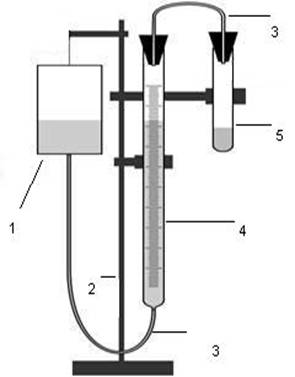
Схема установки:
-сосуд с водой; 2-штатив; 3-соединительные
трубки; 4-бюретка на 50 мл; 5-пробирка
Порядок выполнения
опыта
реакция погрешность опыт металл
1. Проверил установку на герметичность;
. Установили уровень воды в бюретке на 0
отрезке;
. Залили в пробирку HCl;
. Всыпали в кислоту порошок метала;
. Закрыть пробирку пробкой с газоотводной
трубкой;
. По окончанию записали объем
выделившегося водорода по показаниям газоизмерительной бюретке.
Экспериментальные
данные
=0,0189 г
V(H2)=20,0
=
=
C=
=273°K
=760 мм рт. Ст
р=724.53 мм рт. ст.
V()=11200
мл/моль
Вычисления
. Приводим объем выделившегося водорода к
нормальным условиям, используя уравнение состояния газа:
.По закону эквивалентов:
Вычисление ошибки
. ∆абс=|M(Э(Ме))тер
— М(Э(He)экв|= 0,66
M(Э(Me)тер
= =
= 9 гмоль
. ∆отр = •
100% = 7,3%
Вывод
Проводя опыт, я экспериментальным путем по
реакции металла с кислотой определила малярную массу эквивалента металла и
оценила погрешность опыта.
.
.