1 Найти электрохимический эквивалент натрия. Молярная масса натрия μ = 0,023 кг/моль, его валентность z=1. Постоянная Фарадея
Решение:
2 Цинковый анод массы m = 5 г поставлен в электролитическую ванну, через которую проходит ток I=2 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка
Решение:
3 Найти постоянную Фарадея, если при прохождении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота m = 5 г. Химический эквивалент золота А = 0,066 кг/моль.
Решение:
Согласно объединенному закону Фарадея
отсюда
4 Найти элементарный электрический заряд е, если масса вещества, численно равная химическому эквиваленту, содержит N0=NА/z атомов или молекул.
Решение:
Ионы в растворе электролита несут на себе число элементарных зарядов, равное валентности z. При выделении массы вещества, численно равной его химическому эквиваленту, через раствор проходит заряд, численно равный постоянной Фарадея, т. е.
Следовательно, элементарный заряд
5 Молярная масса серебра μ1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент . Найти электрохимический эквивалент золота k2, если молярная масса золота μ2 = 0,197 кг/моль, его валентность z2 = 3.
Решение:
По второму закону Фарадея имеем
отсюда электрохимический эквивалент золота
6 Найти массы веществ, выделившихся за время τ = 10 ч на катодах трех электролитических ванн, включенных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuSO4, NiSО4 и AgNО3. Плотность тока при электролизе j=40 А/м2, площадь катода в каждой ванне S= 500 см2. Электрохимические эквиваленты меди, никеля и серебра
Решение:
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ
7 При никелировании изделий в течение времени τ = 2 ч отложился слой никеля толщины l=0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля , его плотность
Решение:
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток I0=1,5А. Какую поправку надо внести в показание амперметра, если за время τ = 10 мин на катоде отложилась масса меди m= 0,316 г? Электрохимический эквивалент меди .
Решение:
По первому закону Фарадея m = kIτ, где I-ток в цепи; отсюда I=m/kτ=1,6 А, т.е. в показание амперметра надо внести поправку
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R= 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время τ = 5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра .
Решение:
По первому закону Фарадея m = klτ, где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kτ= 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения
10 Для серебрения ложек через раствор соли серебра в течение времени τ = 5 ч пропускается ток I=1,8 А. Катодом служат n=12 ложек, каждая из которых имеет площадь поверхности S=50 см2. Какой толщины слой серебра отложится на ложках? Молярная масса серебра μ = 0,108 кг/моль, его валентность z = 1 и плотность .
Решение:
Толщина слоя
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl2), во второй — раствор хлорного железа (FeCl3). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда . Молярные массы железа и хлора
.
Решение:
В первой ванне железо двухвалентно (z1=2), во второй — трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне
во второй ванне
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора
12 При электролизе раствора серной кислоты (CuSO4) расходуется мощность N=37 Вт. Найти со-противление электролита, если за время t = 50 мин выделяется масса водорода m = 0,3 г. Молярная масса водорода μ = 0,001 кг/моль, его валентность z=1.
Решение:
13 При электролитическом способе получения никеля на единицу массы расходуется Wm= 10 кВт·ч/кг электроэнергии. Электрохимический эквивалент никеля . При каком напряжении производится электролиз?
Решение:
14 Найти массу выделившейся меди, если для ее получения электролитическим способом затрачено W= 5 кВт·ч электроэнергии. Электролиз проводится при напряжении V=10 В, к.п.д. установки η = 75%. Электрохимический эквивалент меди .
Решение:
К.п.д. установки
где q-заряд, прошедший через ванну. Масса выделившейся меди m=kq; отсюда
15 Какой заряд проходит через раствор серной кислоты (CuSO4) за время τ = 10 с, если ток за это время равномерно возрастает от I1=0 до I2 = 4А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди .
Решение: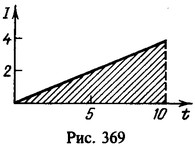
Заряд, протекший через раствор,
Нахождение заряда графическим путем показано на рис. 369. На графике зависимости тока от времени заштрихованная площадь численно равна заряду. Масса меди, выделившейся на катоде,
16 При рафинировании меди с помощью электролиза к последовательно включенным электролитическим ваннам, имеющим общее сопротивление R = 0,5 Ом, подведено напряжение V=10 В. Найти массу чистой меди, выделившейся на катодах ванны за время τ = 10 ч. Э.д.с. поляризации ε = 6 В. Электрохимический эквивалент меди .
Решение:
17 При электролизе воды через электролитическую ванну в течение времени τ = 25 мин шел ток I=20 А. Какова температура t выделившегося кислорода, если он находится в объеме V= 1 л под давлением р = 0,2 МПа? Молярная масса воды μ = 0,018 кг/моль. Электрохимический эквивалент кислорода .
Решение:
где R= 8,31 Дж/(молъ К)-газовая постоянная.
18 При электролитическом способе получения алюминия на единицу массы расходуется W1m = 50 кВт·ч/кг электроэнергии. Электролиз проводится при напряжении V1 = 16,2 В. Каким будет расход электроэнергии W2m на единицу массы при напряжении V2 = 8,1 В?
Решение:
Молярная масса
эквивалента ионного соединения может
быть определена двумя способами:
1. Как произведение
молярной массы формульной единицы
вещества на фактор эквивалентности: Mf
= f
× М
2. Как сумма молярных
масс эквивалентов катиона и аниона:
Второй
способ удобнее и проще осуществлять
табличным способом:
-
Katn+m
Anm-n
f
1/n
1/m
Mf
M(Kat)/n
+M(An)/m
Упражнения для самостоятельного решения
-
Рассчитайте
двумя способами молярную массу
эквивалента для,
,
,
.
-
Рассчитайте
молярные массы эквивалента перечисленных
соединений, исходя из их молярных масс:
,
,
,
,
.
-
Чему
равен фактор эквивалентности воды при
ее взаимодействии: а) с оксидом натрия,
б) с металлическим натрием? -
Одинаков
ли эквивалент металла в двух соединениях:
и
;
и
?
*Закон эквивалентов:
«Эквивалентные
количества всех веществ, участвующих
в реакции одинаковы»:
Для
реакции А + В = С
nf(A)
= nf(B)
= nf(C)
или
m(A)
: m(B) : m(C) =
Mf
(A) : Mf
(B) : Mf
(C)
Этот закон лег в
основу практических методов определения
эквивалентов, атомных и молярных масс.
1. Метод прямого определения молярной массы эквивалента вещества
Пример 1.
При сжигании
2,28 г металла получено 3,78 г его оксида.
Найти молярную массу эквивалента
вещества Mf.
Решение:
Находим массу
кислорода, пошедшего на окисление
металла:
Далее
из пропорции, согласно закону эквивалентов,
находим эквивалент металла:
,
где
г/моль.
г/моль.
2. Аналитический метод нахождения молярной массы эквивалента вещества
Пример
2. Вычислить
молярную массу эквивалента металла,
если химическим анализом установлено,
что сульфид металла содержит 67,15% металла
по массе, а эквивалент серы равен 16
г/моль.
Решение:
Пусть
масса образца 100 г, тогда масса металла
67,15 г, а масса серы (100 – 67,5) = 32,85 г.
По
закону эквивалентов:
,
откуда
г/моль.
3. Электрохимический метод нахождения молярной массы эквивалента металла
Пример 3.
Определить молярную массу эквивалента
никеля, если для выделения на катоде 4
г металла через раствор его соли было
пропущено 13150 Кл электричества.
Решение:
В соответствии с
уравнением, объединяющим два закона
Фарадея,
,
где
—
масса продукта электролиза,
—
число Фарадея (96500 Кл/моль),
—
количество прошедшего через раствор
электричества, Кл,
—
сила тока, А,
—
время, с,
Следовательно,
г/моль.
4. Нахождение молярной массы эквивалента металла методом вытеснения водорода
Для
газообразных веществ вводится понятие
«эквивалентный объем» — объем, занимаемый
1 моль эквивалента вещества (Vm,f,
л/моль).
При
нормальных условиях согласно гипотезе
Авогадро Vm
= 22,4 л/моль
Vm,f
= Vm×
f
или
Vm,f
= 22,4 × f
Для
водорода (Н2)
Vm,f
= 22,4/2 = 11,2 л/моль,
Для
кислорода (О2)
Vm,f
= 22,4/4 = 5,6 л/моль.
Пример
4. При
взаимодействии 5 г металла с кислотой
выделилось 2,8 л водорода (н.у.). Вычислить
.
Решение:
Согласно
закону эквивалентов эквивалент металла
должен вытеснить из кислоты эквивалент
водорода.
При
нормальных условиях: 5 г
– 2,8 л
– 11,2 л/моль
.
г/моль
Примечание
1. Если
объем водорода измерен при условиях,
отличающихся от нормальных, необходимо
привести его к н.у. по формуле объединенного
газового закона:
Примечание
2. Если
выделяющийся водород собран методом
вытеснения воды, хранится в газометре
над водой, то он насыщен водяными парами.
Объем сухого водорода рассчитывается
с учетом давления насыщенных водяных
паров при температуре опыта
,
значения которых можно найти в Приложении
1.
,
и
.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Законы электролиза
С количественной стороны явления электролиза впервые были изучены в 30-х годах XIX в, английским физиком Михаилом Фарадеем, который в результате своих исследований установил следующие законы электролиза:
1. Весовое количество выделяемого при электролизе вещества пропорционально количеству протекшего через раствор электричества и совершенно не зависит ни от каких других факторов.
Закон этот логически вытекает из общего представления о механизме электропроводности растворов и сущности электролиза. Так как перенос электричества через раствор осуществляется только посредством одновременно разряжающихся ионов, то понятно, что количества выделившихся у электродов веществ всегда будут пропорциональны числу перенесенных по проводам электронов, т. е. количеству протекшего электричества.
2. Равные количества электричества выделяют при электролизе из различных химических соединений эквивалентные количества веществ.
Следующий опыт является наглядной иллюстрацией этого закона. Электрический ток пропускают через ряд растворов, содержащих, например, такие вещества: HCl, AgNО3, CuSО4, FeCl3, SnCl4 (рис. 133). Растворы помещают в приборы, позволяющие по окончании опыта определить количества выделившихся веществ (на рисунке приборы условно изображены в виде стаканов; в каждый стакан погружено два электрода). Чтобы через все растворы проходило совершенно одинаковое количество электричества, электроды соединяют последовательно.
Через некоторое время, когда у электродов накопится достаточное количество продуктов электролиза, прекращают пропускание тока и производят измерения. Оказывается, что за время, в течение которого из раствора соляной кислоты выделяется 1 г водорода, т. е. 1 грамматом, из остальных растворов выделяются указанные ниже количества металлов.
Сопоставляя выделившиеся количества металлов с атомными весами этих металлов, находим, что серебра выделяется один
грамматом, меди только 1/2 грамматома, железа 1/3 грамматома, а олова всего 1/4 грамматома. Другими словами, количества выделяющихся у катода веществ равны их граммэквивалентам. Ккакому же результату приводит и измерение количеств веществ, выделяющихся у анода. Так, в первом, четвертом и пятом приборах выделяется по 1 граммэквиваленту хлора (35,6 г), во втором и третьем приборах — по 1 граммэквиваленту кислорода (8 г.).
Законы электролиза относятся в равной мере и к электролизу растворов и к электролизу расплавов.
Рассматривая второй закон электролиза с точки зрения электронной теории, нетрудно понять, почему при электролизе вещества выделяются в химически эквивалентных количествах.Обратимся, например, к электролизу хлорного железа. При выделении железа из раствора каждый ион Fe••• получает от катода три электрона, в то же время три иона Cl’ отдают свои лишние электроны аноду» превращаясь в атомы хлора. Следовательно, «перенос» каждых трех электронов через раствор сопровождается выделением одного атома железа и трех атомов хлора. Сколько бы электронов ни прошло через раствор, число выделившихся атомов железа всегда будет втрое меньше числа выделившихся атомов хлора, т. е. количества железа и хлора будут относиться друг к другу, как их химические эквиваленты.
Измерениями установлено, что количество электричества, выделяющее при электролизе один граммэквивалент вещества, равно 96 500 кулонам . Исходя из этого, второй закон электролиза можно сформулировать еще так:
Для выделения из раствора электролита одного граммэкви-валента любого вещества нужно пропустить через раствор 96 500 кулонов.
Второй закон электролиза дает прямой метод определения эквивалентов различных элементов. На этом же законе основаны все расчеты, связанные с электрохимическими производствами.
Пример 1. Определить эквивалент никеля, если известно, что ток силой 2 ампера выделяет в течение 40 мин. из раствора никелевой соли 1,46 в никеля.
Находим количество электричества, прошедшего через раствор, пользуясь известной из физики формулой Q = I • t, Q — количество электричества в кулонах; I — сила тока в амперах; t — время в секундах.
Подставляя в эту формулу данные задачи, получаем:
Q = 2 • 40 • 60 = 4800 кулонов
Так как для выделения 1 граммэквивалента вещества требуется 96 500 кулонов, то граммэквивалент никеля определится из пропорции:
96 500 : 4800 = x : 1,46
x = (96500 • 1,46) : 4800 = 29,35 г.
Следовательно, эквивалент никеля 29,35.
202 203 204
Вы читаете, статья на тему Законы электролиза
Как рассчитать молярную массу и молярную концентрацию эквивалента, молярную
Вычисление молярной концентрации вещества
Задача 338.
На нейтрализацию 31 мл 0,16 н. раствора щелочи требуется 217 мл раствора Н2SO4. Чему равны молярная концентрация эквивалента Н2SO4?
Решение:
Из закона эквивалентов следует, что объемы реагирующих и образующихся веществ пропорциональны молярным концентрациям их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
Сн(А) . V(А) = Cн(В) . V(В), где
Сн(А) и Cн(В) — эквивалентные концентрации веществ А и В;
V(А) и V(В) — объемы растворов веществ А и В.
Тогда
Сн(А) . V(А) = Cн(В) . V(В) = Сн(щел.) . V(щел.) = Cн(Н2SO4) . V(Н2SO4);
Cн(Н2SO4) = [Сн(щел.) . V(щел.)]/V(Н2SO4) = (31 мл . 0,16 н)217 мл = 0,02286 н.
Ответ: Cн(H2SO4) = 0,02286 н.
Расчет молярной массы эквивалента и числа эквивалентности вещества
Задача 339.
Рассчитать молярные массы эквивалентов соединений сульфида аммония, хромовой кислоты, гидроксида калия.
Решение:
M[(NH4)2S] = 68,154 г/моль;
M(H2CrO4) = 118 г/моль;
M(KOH) = 56,106 г/моль.
1. Эквивалентное число (фактор эквивалентности) Z для (NH4)2S равно произведению числа NH4(+) в ее составе и заряду иона NH4(+):
Z[(NH4)2S] = n(NH4(+) · [З.И.(NH4(+)] = 2 . 1 = 2.
Тогда
MЭ[(NH4)2S] = M[(NH4)2S]/Z[(NH4)2S] = 68,154/2 = 34,077 г/моль.
2. Эквивалентное число Z для кислоты равно числу катионов водорода в ее составе, или ее основности:
Z(кислоты) = n(Н+) = Z(H2CrO4) = 2.
Тогда
МЭ(H2CrO4) = М(H2CrO4)/Z(H2CrO4) = 118/2 = 59 г/моль.
3. Эквивалентное число (фактор эквивалентности) Z для основания равно числу гидорксогрупп в его составе, или его кислотности:
Zоснования = n(ОН–) = кислотности = 1.
Тогда
МЭ(KOH) = М(KOH)/Z(KOH) = 56,106/1 = 56,106 г/моль.
Задача 340.
16,25 г цинка вытесняют из соли никеля 14,75 г металла. Рассчитать молярную массу эквивалента никеля.
Решение:
Из закона эквивалентов следует, что массы реагирующих и образующихся веществ пропорциональны молярным массам их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
m1/M(Э)1 = m2/M(Э)2, где
m1 и m2 – массы реагентов и (или) продуктов реакции, г;
M(Э)1 и m2/M(Э)2 — молярные массы эквивалентов реагентов и (или) продуктов реакции, г/моль.
Известно, что fЭ(Zn) = 1/2, а MЭ(Zn) = M(Zn) . fЭ(Zn) = 65,38 1/2 = 32,69 г/моль.
Рассчитаем молярную массу эквивалента никеля, получим:
m1/M(Э)1 = m2/M(Э)2;
m(Zn)/MЭ(Zn) = m(Ni)/MЭ(Ni);
MЭ(Ni) = [m(Ni) . MЭ(Zn)]/m(Zn) = (14,75 . 32,69)/16,25 = 29,67 г/моль.
Ответ: MЭ(Ni) = 29,67 г/моль.
Задача 341.
При реакции 1,525 г сурьмы соединяются с 1.00 г серы. Вычислить молярную массу эквивалента сурьмы, исходя из молярной массы эквивалента серы, равной 16 г/моль
Решение:
Согласно закону эквивалентов имеем формулу:
m(Sb)/m(S) = МЭ(Sb)/МЭ(S).
Отсюда
МЭ(Sb) = [m(Sb) * МЭ(S)]/m(S) = (1.525 * 16)/1 = 24,4 г/моль.
Ответ: 24,4 г/моль.
Задача 342.
Чему равно число эквивалентности и молярная масса эквивалентов сульфата бериллия в реакциях со щелочью, идущих с образованием Be(OH)2 , (BeOH)2SO4 и Na2[Be(OH)4]?
Решение:
М(BeSO4) = 105 г/моль.
Фактор эквивалентности (fЭ) соли определяется по формуле:
fЭ(соли) = 1/[n(Ме . В(Ме)] = 1/[n(А) . В(А)], где
n(Ме) – число атомов металла (индекс в химической формуле соли);
В(Ме) – валентность металла; n(А) – число кислотных остатков;
В(А) – валентность кислотного остатка.
Молярная масса эквивалента (МЭ) сложного вещества в реакциях определяется по формуле:
МЭ(соли) = fЭ(соли) . fЭ(соли), где
fЭ(соли) — фактор эквивалентности соли в реакции; М(соли) — молярная масса соли.
Между BeSO4 и NaОН могут происходить разные реакции. При этом сульфат бериллия будет иметь разные значения фактора эквивалентности, а гидроксид натрия во всех реакциях будет иметь одно значение фактора эквивалентности равное 1 [fЭ(NaOH) = 1/1 = 1]:
а) BeSO4 + 2NaOH = Be(OH)2↓ + Na2SO4
В ходе этой реакции две гидроксильные группы присоединяет Ве2+, иначе, в реакцию вступают два иона ОН—. Тогда по определению эквивалентом BeSO4 будет являться условная частица 1/2BeSO4, т.к. если одна молекула BeSO4 присоединяет два иона ОН—, то один ион ОН— присоединяет половина молекулы BeSO4.
С другой стороны, на реакцию с одной молекулой сульфата бериллия щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом сульфата бериллия является условная частица 1/2BeSO4, а эквивалентом щелочи частица NaОН. Следовательно, fЭ[Ba(OH)2] = 1/2.
Тогда
МЭ(соли) = fЭ(соли) . fЭ(соли) = МЭ(BeSO4) = fЭ(BeSO4) . fЭ(BeSO4) = 1/2 . 105 = 52,5 г/моль.
б) 2BeSO4 + 2NaOH = (ВеOH)2SO4 + Na2SO4
В ходе этой реакции одну гидроксильную группу присоединяет Ве2+, иначе, в реакцию вступают один ион ОН—. Тогда по определению эквивалентом BeSO4 будет являться условная частица 1BeSO4, т.к. если одна молекула BeSO4 присоединяет один ион ОН—, то один ион ОН— присоединяет одна молекулы BeSO4.
С другой стороны, на реакцию с одной молекулой сульфата бериллия щелочь отдает один ион ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/1 молекулы кислоты. Эквивалентом сульфата бериллия является условная частица 1/1BeSO4, а эквивалентом щелочи частица NaОН. Следовательно, fЭ[Ba(OH)2] = 1/1 = 1.
Тогда
МЭ(соли) = fЭ(соли) . fЭ(соли) = МЭ(BeSO4) = fЭ(BeSO4) . fЭ(BeSO4) = 1 . 105 = 105 г/моль.
в) Be(OH)2 + 2NaOH = Na2[Be(OH)4]
В ходе этой реакции одну четыре гидроксильные группы присоединяет Ве2+, иначе, в реакцию вступают четыре иона ОН-. Тогда по определению эквивалентом BeSO4 будет являться условная частица 1/4BeSO4, т.к. если одна молекула BeSO4 присоединяет четыре иона ОН—, то четыре иона ОН— присоединяет одна молекулы BeSO4.
С другой стороны, на реакцию с одной молекулой сульфата бериллия щелочь отдает четыре иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/4 молекулы кислоты. Эквивалентом сульфата бериллия является условная частица 1/4BeSO4, а эквивалентом щелочи частица NaОН. Следовательно, fЭ[Ba(OH)2] = 1/4.
Тогда
МЭ(соли) = fЭ(соли) . fЭ(соли) = МЭ(BeSO4) = fЭ(BeSO4) . fЭ(BeSO4) = 14 . 105 = 26,25 г/моль.
Вычисление электрохимического эквивалента металла в растворе соли
Задача 344.
Вычислите электрохимические эквиваленты меди в растворе CuSO4, никеля в растворе NiCl2, железа в растворе FeCl3, кадмия в растворе CdSO4.
Решение:
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
Фактор эквивалентности — f — часть частицы, составляющей один эквивалент; f принимает значение 1, 1/2, 1/3, и т.д. Показатель эквивалентности Z = 1/f (он равен стехиометрической валентности).
Фактор эквивалентности элемента в ввеществе определяется по формуле:
fЭ = 1/B(Э), где
B(Э) — валентность металла.
Тогда
а) fЭ(Cu)CuSO4 = 1/B(Э) = 1/2;
б) fЭ(Ni)NiCl2 = 1/B(Э) = 1/2;
в) fЭ(Fe)FeCl3 = 1/B(Э) = 1/3;
г) fЭ(Cd)CdSO4 = 1/B(Э) = 1/2.
Эвтектика 255 Эквивалент углерода 34, 364 Эквиваленты хрома и никеля 32 Электрическая дуга 83 Электрическое поглощение газов 22 Электродные покрытия 113, 115 Электрододержатель 111 Электроды для контактной сварки 287 Электроды для ручной дуговой сварки 112 [c.394]
При малом значении отношения эквивалентов хрома и никеля ( rj/Ni,) ширина зоны переменной твердости 5 минимальна. [c.390]
Структуры перемешанного металла швов с различными эквивалентами хрома и никеля [c.64]
На величину эквивалентов [Сг] и [N1] для сталей и сплавов оказывают влияние не только соотношение содержаний элементов и режим термообработки, но и состояние стали (прокат, литье), величина зерна и др. Для катаных сталей эквиваленты хрома и никеля выражаются следующими формулами [c.584]
Эту формулу следует, однако, рассматривать как грубо ориентировочную, принимая во внимание разброс до 4% феррита. Аналогичный разброс получается и при определении содержания феррита в структуре в зависимости от отношения эквивалентов хрома и никеля. Учитывая быстрый распад феррита при температуре сенсибилизации 650° С, для испытаний следует применять отжиг при 600° С, который достаточно хорошо выявляет неудовлетворительную стабилизацию против межкристаллитной коррозии [53]. При отжиге 600° С продолжительностью 1—2 ч у стали с содержанием феррита 10% образуется только незначительное количество а-фазы, что не является препятствием при оценке склонности к межкристаллитной коррозии испытанием на загиб. [c.176]
Точка, соответствующая заданному составу- металла шва на этой диаграмме, определяется по величинам эквивалентов хрома и никеля, отложенных соответственно по осям абсцисс и ординат. [c.494]
По требованию потребителя нижняя массовая доля марганца в стали, нелегированной хромом и никелем, может быть уменьшена против норм табл. 1 на величину марганцового эквивалента (Э ), но не более чем на 0,30 %. [c.289]
Как следует из классификации (рис. 23), некоторые марки стали занимают промежуточное положение между двумя соседними группами. В этом случае необходимо эти стали отнести к такой группе, в которой значение хромоникелевого эквивалента и сумма эквивалентной концентрации хрома и никеля соответствуют содержанию легирующих элементов, взятых по верхнему пределу. [c.59]
Если деформационная способность металла кромки в период остывания зависит от отношения объемов твердой и жидкой фаз. размеров и форм кристаллитов, характера структуры и субструктуры, то пластичность его в основном определяется химическим составом сплава. В частности, трещинообразование хромоникелевых сталей усиливается с увеличением в них суммарного содержания хрома и никеля. Поэтому стали по степени возрастания склочности их к трещинообразованию обычно располагают в следующей последовательности 18-8, 25-15, 25-20 и 15-35. С другой стороны, ряд исследователей считает, что склонность к возникновению кристаллизационных трещин определяется в основном не суммарным содержанием хрома и никеля в сплаве, а соотношением между ферритообразующими и аустенитообразующими элементами, т. е. величиной хромоникелевого эквивалента. [c.71]
На основании обобщения производственного опыта ряда заводов и данных, полученных при лабораторных исследованиях, было установлено, что при оценке разрезаемости следует сумму эквивалентов содержания хрома и никеля в стали (Сг э + N1 ас ) сопоставить со значением хромоникелевого эквивалента (Сгл /N1 ) данной стали. [c.75]
На рис. 40 приведена диаграмма, показывающая распределение высоколегированных сталей по группам разрезаемости, а в табл. 23 даны технологические рекомендации по резке сталей этих групп. Некоторые стали занимают промежуточное положение между двумя соседними группами. В этом случае их необходимо отнести к такой группе, в которой значение хромоникелевого эквивалента и сумма эквивалентной концентрации хрома и никеля соответствуют содержанию легирующих элементов, взятых по верхнему пределу. [c.75]
Высоколегированные стали, как правило, относятся к трудно разрезаемым сталям (4-й разряд). Исключение составляют стали IV группы, у которых хромоникелевый эквивалент находится в пределах 1,2—2,5 и сумма эквивалентного содержания хрома и никеля больше 30. Эти стали можно считать ограниченно разрезаемыми (3-й разряд). [c.56]
В соответствии с этой диаграммой (рис. 361) сплав, содержащий 0,1% С, 2% Мп, 18% Сг, 112% Ni, 2% Мо, является аустенитным (эквивалент никеля 16″/о, эквивалент хрома 20%). В стали с 22% Сг и таким же содержанием остальных элементов эквивалент хрома повысится до 24%, и сталь будет содержать примерно 5% феррита. При снижении эквивалента никеля до 8%, а эквивалента хрома до 20% сплав будет состоять из аустенит и двух фер-ритных фа и+а первая образовалась при высокой температуре, вторая при низкой, т. е. при низкой температуре структурное состояние может быть описано у+а + а, а при высокой у+ — [c.486]
| Рис. 19. Номограмма для определения структурных составляющих в хромоникелевых сталях в зависимости от содержания никеля, углерода, марганца, а также хрома, кремния и ниобия (эквивалент никеля N 4-ЗОС-Ь 0,5 Мп эквивалент хрома Сг + 1,5 31-Ь + 0,5 N5) | 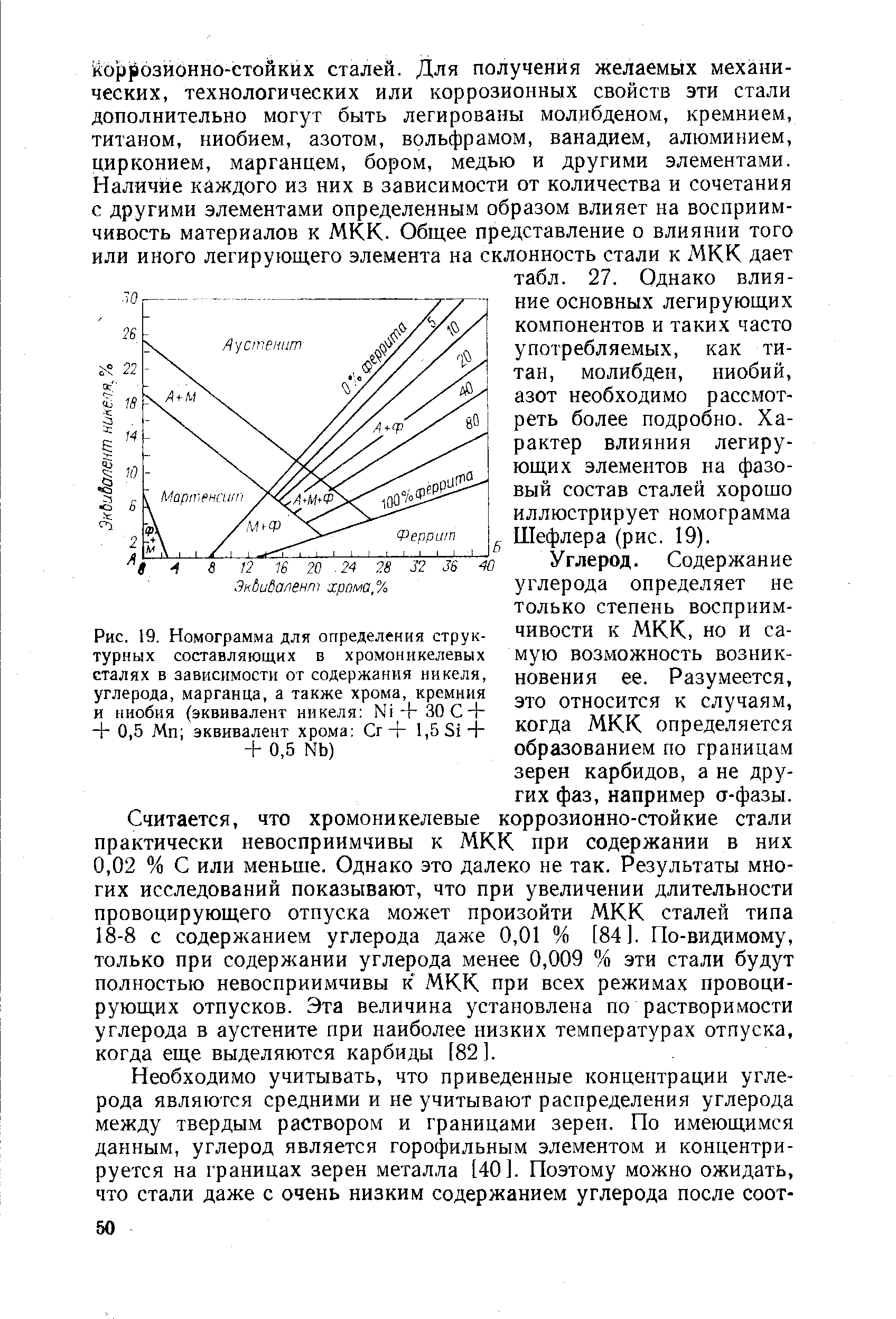 |
Эквивалент хрома 0,5, эквивалент никеля 3,5. Феррит и мартенсит. 200 1, (16) табл. 2.4. [c.64]
Эквивалент хрома 13, эквивалент никеля 3. Мартенсит и феррит. 200 1, (16) табл. 2.4. [c.64]
Как известно, основным и решающим условием для получения металла шва, не склонного к образованию горячих трещин, является правильно выбранное соотношение между аустенитообразующими и ферритообразующими элементами, обеспечивающими структуру металла шва с наличием 2—5% феррита. Количество ферритообразующих определяют по эквиваленту хрома (хром приведенный), а аустенитообразующих по эквиваленту никеля (никель приведенный) по соответствующим формулам [c.155]
Эквиваленты аустенито- и ферритообразующего влияния различных алементов в хромоникелевых аустенитных сталях и в сварных швах по отношению к никелю и хрому, действие которых принято за единицу ) [c.29]
Эффективность действия ряда элементов на понижение температуры мартенситного превращения увеличивается в следующем порядке кремний, марганец, хром, никель, углерод или азот. Приняв никель за единицу эквивалента, эффективность влияния этих элементов будет следующая кремний 0,45 марганец 0,55 хром 0,68 углерод и азот по 27. [c.230]
Скорость растворения сплавов зависит главным образом от их состава, электрохимической активности и электрохимических эквивалентов компонентов, составляющих сплав, а также от физико-химических параметров электролита. При увеличении содержания в сплаве хрома затрудняется нарущение его пассивного состояния при воздействии галоидных анионов [193]. Вследствие различия электрохимических эквивалентов компонентов сплава, их потенциалов растворения и способности к пассивированию во многих случаях при ЭХО происходит увеличение в поверхностном слое содержания более электроположительных составляющих (например, никеля, меди, молибдена). При этом в анодной поляризационной характеристике сплава может наблюдаться несколько участков, соответствующих пассивации его различных компонентов [178]. Это обусловливает необходимость обеспечения приблизительно одинаковой скорости растворения всех основных компонентов сплава при подборе электролита. Определенное влияние на процесс анодного растворения кроме химического состава сплава оказывает и его структура. Связь производительности электрохимической обработки сталей с их микроструктурой показана в работе [127]. При анодном растворении жаропрочных сплавов на никелевой основе отмечалось преимущественное растворение (растравливание) границ зерен вследствие их относительно более высокой активности. В зависимости от природы фаз, составляющих данный сплав, существенно различаются параметры возникающих на них пленок [117]. [c.34]
Хром — твердый, хрупкий металл серебристо-стального цвета. Атомный вес хрома 52,01, удельный вес 6,92—7,2 г/см , температура плавления 1520° С. Электрохимический эквивалент 0,323 г/а-ч. Все хромовые покрытия обладают хорошим сцеплением со сталью, медью, латунью, никелем и другими металлами и придают изделиям, особенно после полирования, красивый блестящий голубоватый оттенок. Хром характеризуется высокой твердостью, износостойкостью, жаростойкостью только при температуре 480—500° С он начинает приобретать цвета побежалости. Хром имеет большую склонность к пассивированию, благодаря чему хромовые покрытия длительное время сохраняют блестящий вид, что выгодно отличает их от других гальванических покрытий. [c.158]
Так, при сварке и наплавке сочетаний различных сталей, представленных в табл. 10.1, происходит смешивание в различных соотношениях (табл. 10.3) перлитной стали с аустенитной или ферритной, либо феррит-ной с аустенитной. Получаемый при этом химический состав шва имеет промежуточные значения по содержанию элементов и другую структуру, оцениваемую по эквивалентам хрома и никеля на диаграмме Шеффлера (рис 10.2). [c.383]
Другое важное применение диаграммы Шеффлера заключается в прогнозировании структуры металла шва и его свойств при сварке легированных сталей присадочными материалами с иной концентрацией легирующих элементов и при наплавке хромоинкелевыми присадочными материалами. В этих случаях металл шва имеет структуру, соответствующую линии, соединяющей точки эквивалентов хрома и никеля в основном и присадочном металлах. Если известны доли участия основного и присадочного металлов в шве, а перемешивание в сварочной [c.58]
Содержание феррита в присадочном материале и в металле шва сварного соединения из аустенитной стали зависит, главным образом, от химического состава наплавленного металла. Суммарное влияние отдельных элементов сплава может быть определено по диаграмме Шеффлера, построенной на основании диаграммы Маурера (рис. 43) [246]. Эта диаграмма позволяет предопределить структуру стали, если известен ее химический состав [216]. Свойство элементов сплава способствовать образованию аустенита или феррита учитывается соответствующими коэффициентами в формулах для расчета эквивалентов никеля и хрома. Если эквиваленты хрома и никеля в металле шва соответствуют на диаграмме области с высоким содержанием феррита, то можно считать, что шов устойчив против горячих трещин, и наоборот. [c.107]
Так, при сварке и наплавке сочетаний различных сталей, представленных в табл. 13.1, происходит смешивание в различных пропорциях (см. табл. 13.2) перлитной стали с аустенитной или ферритной либо ферритной с аустенитной. Получаемый при этом химический состав шва имеет промежуточные значения и различную структуру, оцениваемую по эквивалентам хрома и никеля на диаграмме Шеффлера (рис. 13.2). Металлу шва, соответствующему области А, свойственна однофазная аустенитная структура, весьма склонная к образованию ГТ кристаллизационного и подсолидусного типов. Шов со структурой А + Ф, т.е. с аустенитно-ферритной структурой, при повторных нагревах претерпевает охрупчивание в результате превращения феррита в сигма-фазу (5-Ре ст). [c.176]
Кроме хрома и никеля, на характер структуры металла шва влияют еще и другие легирующие и сопутствующие элементы. Обобщенное влияние элементов-аустенитизаторов н элемеитов-ферритизаторов Шеффлер выразил эквивалентом никеля и эквивалентом углерода . Позже другими авторами было учтено влияние еще ряда элементов. Полученные ими данные согласуются редко, поскольку не всегда могут быть воспроизведены одинаковые условия опытов. Диаграмма, построенная Шеффлером, действительна только для условий ручной дуговой сварки. При сварке в аргоне вольфрамовым или плавящимся электродом диаграмма пригодна для приближенных оценок, а при сварке под флюсом, при электрошлаковой сварке и при контактной сварке может служить лишь как сугубо ориентировочная. [c.58]
И. По требованию потребителя в стали, нелегированной хромом и никелем, массовая доля марганца может быть умень-щена на величину марганцового эквивалента, равного [c.46]
Так, например, Б. И. Медовар [20] для обеспечения качественной сварки стали 18-8 рекомендует применять присадочную проволоку, в которой соотношение концентраций хрома и никеля составляет не менее 2,2. М. X. Шоршоров [15] считает, что с повышением аустенитно-сти (когда хромоникелевый эквивалент значительно меньше 1,1) сопротивляемость стали образованию горячих трещин резко снижается. По данным А. Г. Строева и В. П. Ворновицкого, избежать горячих трещин можно только в том случае, когда величина хромоникелевого эквивалента в металле шва будет больше 1,5. Повышение содержания никеля при сварке аустеиитных сталей увеличивает склонность к образованию горячих трещин. Такое влияние никеля на трещинообразование особенно следует учитывать при кислородно-флюсовой резке высоколегированных сталей. Ранее было отмечено, что в процессе резки хромоникелевых сталей на кромке повышается содержание никеля. Повышение концентрации никеля в оплавленном участке кромки может привести к утолщению жидких межкристаллических прослоек и к снижению температуры их затвердевания ввиду появления легкоплавких сульфидов и силицидов [20]. Это, следовательно, способствует возникновению горячих трещин в момент остывания кромки. Известно также, что в сложнолегированных сталях положение критических точек определяется величиной хромоникелевого эквива- [c.56]
N 9 ) со значением хромоникелевого эквивалента (Сг,к/Ы1эк) данной стали. При этом сумма эквивалентного содержания хрома и никеля характеризует склонность стали к трещинообразованию, а хромоникелевый эквивалент — положение критических точек при нагреве и остывании, а также восприимчивость стали к горячим треш.инам. [c.55]
В сплавах серии 2000 с низким соотношением u/Mg добавки хрома и марганца повышают прочность [2]. Сообщалось, что в разрабатываемых перспективных сплавах повышению прочности способствовали также добавки кобальта и молибдена [142]. Добавки железа и никеля, как, например, в сплаве 2618, стабилизируют размер зерна, образуя нерастворимые частицы [2]. В британском эквиваленте сплава 2618 — сплаве R.R. 58, широко используемом в конструкции сверхзвукового лайнера Конкорд , наблюдался сравнительно быстрый рост трещин на II стадии (см. рис. 2), что может быть отчасти связано с присутствием железа и никеля [2]. [c.85]
Определить, к какому классу по структуре относится та или иная сложнолегированная хромоникелевая сталь, можно с помощью схематической диаграммы Шеффлера (рис. 7.10), в которой использованы в качестве критериев эквиваленты хрома (Эс, = %Сг + %Мо -ь 1,5х%81 + 0,5х%КЬ) и никеля (Эн1 = %№ +30х%С + 0,5х%Мп). [c.170]
НИИ феррита не менее 10%), ферритный, аустенито-ферритный (при содержании феррита не менее 10 %), аустенитный и аустенитно-мартенсит-. ный (ГОСТ 5632-72). Суммарное влияние феррито- и аустенитообразую-щих элементов характеризуют эквиваленты хрома Сгэкв и никеля NigKs [c.477]
Метод основан на полярографировании свинца в молярной концентрации эквивалента соляной кислоты 3 моль/дм при потенциале полуволны от минус 0,43 до минус 0,45 В по отношению к анодной ртути. Присутствие в растворе более 1 мг хрома, молибдена и никеля делает полярографическую волну менее четкой и удобной для измерений. Для устранения влияния хрома последний окисляется до шестивалентно-го хлорной кислотой, а свинец осаждается на гидроокиси железа аммиаком. Молибден, никель и шестивалентный хром остаются в фильтрате. [c.246]
Получение строго дозированного количества феррита в сварных швах является достаточно сложной задачей. Количество ферритной фазы зависит от соотношения в стали ферритизаторов и аустенизаторов. Однако по допускам ГОСТа 2246—60 на содержание элементов это соотношение может изменяться в широких пределах. Например, для сварочной проволоки Св06Х19Н10МЗТ содержание ферритизаторов (в эквивалентах хрома) может колебаться от 21,45 до 25,8%, аустенизаторов (в эквивалентах никеля) — от 11,3 [c.63]
В новой диаграмме структурного состояния по оси абсцисс отложены эквиваленты ферритообразования всех легирующих элементов по отношению к хрому, а по оси ординат — всех легирующих элементов по их влиянию на температуру мартенситного превращения. Эквиваленты приняты на основании анализа многочисленных литературных источников, которые, к сожалению, дают неодинаковые значения. Поэтому некоторые из приведенных в диаграмме эквивалентов будут в дальнейшем уточняться. Сочли целесообразным (что подтвердилось экспериментально) ввести переменные эквиваленты фер-рито- и мартенситообразования для углерода и азота и для ферритообразования никеля в зависимости от содержания этих элементов в стали. Титан следует учитывать только тот, который находится в твердом растворе, а уг- [c.143]


