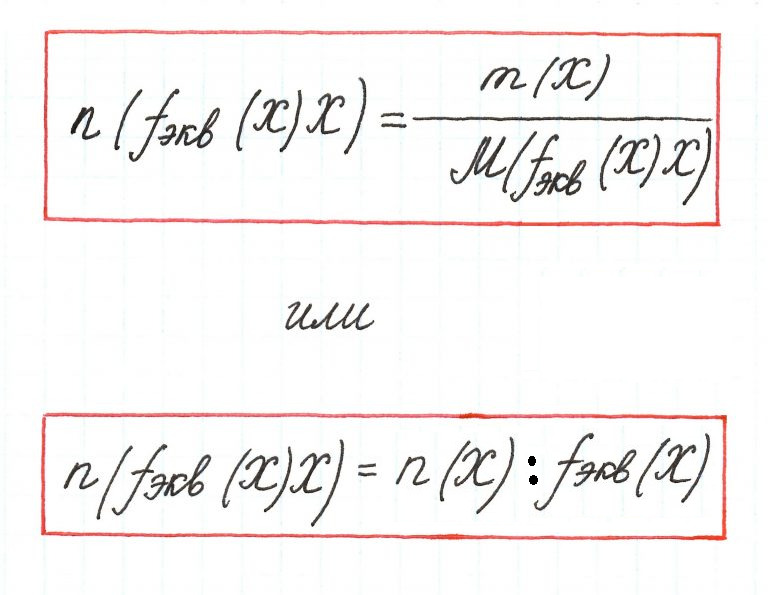Химический эквивалент является одним из основных понятий в химии. Эта характеристика вещества, несмотря на свою простоту, часто достаточно запутанна и вызывает ряд затруднений.
Содержание:
1 Химический эквивалент и фактор эквивалентности
1.1 Химический эквивалент в реакциях обмена
1.2 Химический эквивалент в окислительно-восстановительных реакциях
2 Молярная масса эквивалента
3 Химический эквивалент и количественный анализ. Закон эквивалентов
4 Химический эквивалент элемента и сложного вещества
В знаменитом толковом словаре русского языка С.И. Ожегова эквивалент трактуется как «нечто равноценное другому, вполне заменяющее его». Что это значит? Например, книга стоит 500 рублей. Таким образом, 500 рублей – это денежный эквивалент данной книги.
Понятие «эквивалент» в химии относится к реакциям окислительно-восстановительным, ионного обмена, используется при определении концентрации раствора, в реакциях электро-аналитических методов анализа.
Эквивалент является безразмерной величиной.
Химический эквивалент и фактор эквивалентности
Химический эквивалент в реакциях обмена
Разберемся с понятием «химический эквивалент» на примере реакции обмена.
Например, карбонат натрия Na2CO3 и соляная кислота HCl, взаимодействуя между собой, приведут к образованию разных продуктов реакции.
Здесь оба исходных вещества (Na2CO3 и HCl) реагируют друг с другом в соотношении 1:1, т.е. на одну частицу соли приходится одна частица кислоты. Это и есть эквивалентные количества реагирующих веществ. Химическим эквивалентом карбоната натрия в данном случае является одна частица Na2CO3, а эквивалентом соляной кислоты будет одна молекула HCl.
В другом случае оба вещества взаимодействуют иначе:
Исходные вещества реагируют в соотношениях 1:2. То есть с одной частицей соли взаимодействуют 2 молекулы кислоты. Что же здесь будет являться эквивалентом? При определении эквивалента принято сравнивать количество частиц исходного вещества с одним ионом (или атомом) водорода, с которым это исходное вещество может провзаимодействовать (или заместить) в реакции.
В данном случае ионы (атомы) водорода входят в состав соляной кислоты. Тогда в пересчете на одну молекулу HCl (или что то же самое, на один ион Н+), с ней будет реагировать только половина частицы (1/2 часть) Na2CO3. То есть соотношение реагирующих веществ будет 1/2:1. Таким образом, в данной реакции химическим эквивалентом соли является половина частицы Na2CO3. Химическим эквивалентом кислоты является одна молекула HCl.
Очевидно, что в реальности половины частицы Na2CO3 не существует. Поэтому говорят об условной частице вещества, когда определяют ее эквивалент.
Итак, химический эквивалент – это реальная или условная частица вещества, которая в данной химической реакции может прореагировать (или заместить) один атом (или ион) водорода или прореагировать с одним эквивалентом любого другого вещества.
Фактор эквивалентности ƒэкв – количественная характеристика эквивалента, он используется в расчетах.
Фактор эквивалентности показывает, какая доля частицы вещества прореагировала (заместила) в данной химической реакции один ион (атом) водорода.
Так, в первом случае, ƒэкв(Na2CO3)=1, а во втором – ƒэкв(Na2CO3)=1/2. Для соляной кислоты в обоих случаях ƒэкв(HCl)=1.
Рассмотрим другой пример реакции обмена: взаимодействие фосфорной кислоты и гидроксида калия. Определим ее эквивалент и фактор эквивалентности по отношению к одному эквиваленту гидроксида калия.
Фосфорная кислота H3PO4 является многоосновной кислотой. Для подобных кислот (двух- и трехосновных) необходимо учитывать стехиометрию конкретных реакций.
В данном случае одна молекула фосфорной кислоты реагирует с одной частицей гидроксида калия. Поэтому эквивалентом является одна молекула H3PO4. И тогда ее ƒэкв (H3PO4)=1.
А здесь одна молекула фосфорной кислоты реагирует с двумя частицами гидроксида калия. То есть в реакции участвует половина молекулы H3PO4. Это и есть ее эквивалент, который численно выражается фактором эквивалентности ƒэкв(H3PO4)=1/2.
Одна молекула H3PO4 реагирует с тремя частицами КОН. Таким образом, эквивалентом фосфорной кислоты здесь будет одна треть молекулы H3PO4. Тогда фактор эквивалентности ƒэкв(H3PO4)=1/3.
Определение эквивалента и фактора эквивалентности в реакциях обмена для оснований, солей также зависит от стехиометрии реакции.
Химический эквивалент в окислительно-восстановительных реакциях
В окислительно-восстановительных реакциях (ОВР), в отличие от реакций обмена, происходит переход электронов от одного вещества к другому, изменяются степени окисления окислителя и восстановителя. Именно эти процессы и важны при определении эквивалента и фактора эквивалентности в ОВР.
Рассмотрим примеры. Начнем с самого простого.
Взаимодействие водорода и кислорода с образованием воды – это окислительно-восстановительная реакция. В ней восстановителем является водород Н2, а окислителем – О2.
При определении эквивалентов в ОВР ориентируются на то, какая часть частицы принимает или отдает 1 (один) электрон.
Запишем еще раз каждую из полуреакций. Для восстановителя:
Одна молекула Н2 отдает 2ē. Тогда половина молекулы Н2 (а это один атом Н) отдаст 1ē. Следовательно, эквивалентом восстановителя в данной реакции будет половина (1/2 часть) молекулы Н2. И фактор эквивалентности ƒэкв(H2)=1/2.
Для окислителя:
Одна молекула О2 принимает 4ē. Тогда четверть этой молекулы (а это половина атома О) примет 1ē. Следовательно, эквивалентом окислителя в данной реакции будет 1/4 часть молекулы О2 (это условная частица, поскольку реально 1/4 часть молекулы О2 не существует). И фактор эквивалентности ƒэкв(О2)=1/4.
Рассмотрим еще один пример. Так, KMnO4 является сильным окислителем и в любых ОВР всегда проявляет только окислительные свойства. Эквивалент KMnO4 будет отличаться в зависимости от того, в какой ОВР участвует это вещество.
Реакция между сульфитом натрия и перманганатом калия протекает в кислой среде. Из полуреакции восстановления видим, что один ион MnO4— принимает 5ē для перехода в ион Mn2+. Тогда 1ē может принять условная частица, представляющая одну пятую часть (1/5) иона MnO4—. Таким образом, эквивалентом окислителя в данной реакции будет одна пятая часть (1/5) KMnO4. Для окислителя фактор эквивалентности составит ƒэкв(KMnO4)=1/5.
С тем же сульфитом натрия перманганат калия в нейтральной среде реагирует иначе.
Как ясно из приведенной полуреакции восстановления, одна третья часть (1/3) иона MnO4— принимает 1ē. Фактор эквивалентности окислителя в этом случае составит ƒэкв(KMnO4)=1/3.
Взаимодействие сульфита натрия и перманганата калия осуществляется и в щелочной среде:
В данном случае эквивалентом является одна частица KMnO4, поскольку, согласно полуреакции восстановления, речь идет о принятии 1ē. И фактор эквивалентности окислителя в таком случае составляет ƒэкв(KMnO4)=1.
Таким образом, в случае окислительно-восстановительных реакций эквивалентом является реальная или условная частица вещества, которая в данной ОВР эквивалентна 1 (одному) электрону. Эквивалент и фактор эквивалентности в ОВР не определяются стехиометрией реакции в отличие от реакций ионного обмена.
Молярная масса эквивалента
Молярная масса эквивалента (или эквивалентная масса) – это масса одного моля эквивалента вещества.
Обозначается следующим образом:
И выражается, как и молярная масса, в г/моль, поскольку фактор эквивалентности является безразмерной величиной.
Вернемся к примерам, рассмотренным выше.
В данной реакции ƒэкв (H3PO4)=1. Это в том числе означает, что фосфорная кислота вступает в реакцию в количестве 1 моль. Тогда масса 1 моль эквивалента этого вещества соответствует (и равна) его молярной массе: 98 г/моль. Можно сделать вывод, что в данном случае:
В другой реакции гидроксида калия и фосфорной кислоты:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/2. Тогда:
И в третьем случае:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/3. Тогда:
Как видим, в зависимости от стехиометрии реакции молярная масса эквивалента вещества будет принимать различные значения. Так, для фосфорной кислоты это 98 г/моль, 49г/моль и 32,66 г/моль. В этом заключается отличие молярной массы эквивалента от молярной массы вещества, которая всегда постоянна, не зависимо от типа реакции (обмена, ОВР) и ее стехиометрии.
Итак, молярная масса эквивалента равна произведению фактора эквивалентности и молярной массы вещества:
Химический эквивалент и количественный анализ. Закон эквивалентов
В количественном анализе широко применяются еще два понятия, связанных с химическим эквивалентом.
Количество вещества эквивалента – количество вещества, в котором частицами являются эквиваленты.
Единицей измерения является моль. Вычисляется по формуле:
Молярная концентрация эквивалента (или нормальная концентрация, Сн) представляет собой количество вещества эквивалента, содержащееся в одном литре (или дм3) раствора (моль/л, или моль/дм3).
Иногда запись единиц измерения нормальной концентрации моль/л, или моль/дм3, заменяют более простой записью: н. Например, 0,2 моль/л записывают как 0,2 н.
Если в 1 л (1дм3) раствора содержится 1 моль эквивалентов вещества, то такой раствор называется нормальным. Если содержится 0,1 моль – децинормальным, 0,01 моль – сантинормальным, 0,001 моль – миллинормальным и т.д.
Пример 1. Какова нормальная концентрация раствора H2C2O4∙2H2O, полученного растворением 1,73334 г ее в мерной колбе вместимостью 250 мл?
Пример 2. Какую массу KMnO4 следует взять для приготовления 2 л раствора с С(1/5KMnO4) = 0,02 моль/л?
Используя нормальные концентрации, легко посчитать, какие объемы веществ должны быть смешаны, чтобы те прореагировали полностью, т.е. без остатка. Либо, зная объемы прореагировавших без остатка веществ, можно определить их концентрации.
Согласно закону эквивалентов (И.В. Рихтер), утверждающему, что вещества реагируют между собой в строго определенных (эквивалентных) количествах:
Пример 3. Определите нормальную концентрацию раствора гидроксида калия, если на полное взаимодействие 15,00 мл его раствора израсходовано 18,70 мл раствора соляной кислоты с нормальной концентрацией 0,078моль/л.
Химический эквивалент элемента и молярная масса эквивалента сложного вещества
Если речь не идет о конкретной химической реакции, то посчитать эквивалент и эквивалентную массу элемента или сложного вещества можно, воспользовавшись несколькими способами. Приведем наиболее простые из них.
Химический эквивалент элемента
Химический эквивалент элемента представляет количество элемента, способное полностью соединяться с одним атомом (ионом) водорода или замещать столько же их в химических реакциях.
Так, в молекуле хлороводорода HCl на атом Н приходится один атом Cl. В связи с этим:
У сероводорода H2S 2 атомам Н соответствует 1 атом S. Следовательно, 1 атому Н будет соответствовать 1/2 атома S. И тогда:
Аммиак NH3 характеризуется тем, что в его молекуле 3 атома водорода соединяются с 1 атомом азота. В пересчете на один атом водорода это будет 1/3 атома азота. Поэтому:
Как не трудно заметить из приведенных примеров,
фактор эквивалентности для элементов равен единице, деленной на валентность элемента:
Молярная масса эквивалента сложного вещества
Основными классами сложных веществ являются оксиды, основания, кислоты и соли.
Поскольку не будем останавливаться на факторе эквивалентности в данном случае, молярную массу эквивалента обозначим упрощенно: Мэ.
Для оксидов рассчитывается по формуле:
Например:
Для оснований:
Например:
Для кислот:
Например:
Для солей:
Например:
Подведем итог.
Химический эквивалент – это частица вещества, реальная или условная. Количественным выражением эквивалента является фактор эквивалентности. Для определения эквивалентов веществ в реакции обмена необходимо учитывать ее стехиометрию, а в окислительно-восстановительной реакции – число отданных или принятых веществом электронов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
МОСКОВСКИЙ ЭНЕРГЕТИЧЕСКИЙ ИНСТИТУТ
(ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ)
В.К.Камышова,
И.Л.Волчкова
Химический эквивалент. Расчетные задачи
Методическое
пособие для студентов 1-го курса всех
направлений
Москва Издательство МЭИ
2010
ВВЕДЕНИЕ
К
началу XIX
века произошел резкий прорыв в изучении
количественных методов исследования
веществ, что привело к новому
фундаментальному изменению в естествознании
вообще и в химии в частности.
Резкий
прорыв в изучении количественных методов
исследования веществ в началу XIX
века привел к новому фундаментальному
изменению в естествознании вообще и в
химии в частности.
После
открытия Лавуазье закона сохранения
массы последовал целый ряд новых
количественных закономерностей –
стехиометрических законов.

стехиометрическим законом стал закон
эквивалентов, который сформулировал
немецкий химик Иеремия Вениамин Рихтер
в результате проведенных им в 1791-1798
г.г. опытов по изучению количеств веществ
в реакциях нейтрализации и обмена,
обобщенных в работе «Начальные основания
стехиометрии или искусства измерения
химических элементов». Первоначальная
формулировка закона эквивалентов
(термин «эквивалент» ввел в 1767 г.
Г.Кевендиш) была следующей: «Если одно
и то же количество какой либо кислоты
нейтрализуется различными количествами
двух оснований, то эти количества
эквивалентны и нейтрализуются одинаковым
количеством любой другой кислоты».
Открытый
В.Рихтером закон подтвердил убеждения
многих химиков в том, что химические
соединения взаимодействуют не в
произвольных, а в строго определенных
количественных соотношениях.
-
Теоретическая часть
-
Понятие «химический эквивалент»
Химическим
эквивалентом (Э(В)) (по рекомендациям
ИЮПАК) называется условная или реальная
частица, равная или в целое число раз
меньшая соответствующей ей формульной
единице*:
где
В – формульная единица вещества:
реально
существующая частица, такая как атом
(Cu,
Na,
C),
молекула (N2,
HCl,
KOH,
Al2(SO4)3,
CO2),
анионы (OH—,
SO42-),
катионы (Cu
2+, K+),
радикалы (-NО2,
С2Н5-),
условные молекулы кристаллических
веществ и полимеров, любые другие частицы
вещества;
—
эквивалентное число, показывающее какое
число эквивалентов вещества В условно
содержится в данной формульной единице
этого вещества;
=
fэкв.
— фактор эквивалентности.
Использование
фактора эквивалентности как дробной
величины менее удобно.
Эквивалентное
число Z
всегда
больше или равно 1 и является безразмерной
величиной; при Z=1
эквивалент соответствует формульной
единице вещества.
Расчет
эквивалентного числа различных формульных
единиц представлен в таблице 1.1.
Величины
эквивалентного числа, а, следовательно,
и эквивалента зависят от химической
реакции, в которой участвует данное
вещество.
*
ранее под химическим эквивалентом
понимали количество вещества, которое
присоединяет или замещает 1 моль атомов
водорода в ходе реакции. Однако это
понятие относится не к самому эквиваленту,
а к количеству вещества эквивалента.
В
обменных реакциях,
например, в реакции нейтрализации
фосфорной кислоты, эквивалентное число
(эквивалент) кислоты меняется в зависимости
от полноты протекания реакции:
для
реакции H3PO4
+ 3KOH
→ K3PO4
+ 3H2O
эквивалентное число Z(H3PO4)=
=n(Н+)=3,
т.к. в реакции участвуют три иона Н+
фосфорной кислоты, и эквивалентом H3PO4
будет являться условная частица 1/3H3PO4
(Э (H3PO4)=
1/3H3PO4).
Таблица
1.1. Расчет эквивалентного числа Z
вещества.
|
частица |
эквивалентное |
Пример |
|
Элемент |
Z(Э) В(Э) |
Z(S)H2SO4 Z(C)CO2 |
|
Простое |
Z(в-ва) n(Э) В(Э) |
Z(O2) Z(Cl2) |
|
Оксид |
Z(Э2Ох) n(Э) В(Э) |
Z(Н2О) Z(SО2) Z(Al2О3) |
|
Кислота |
Z(к-ты) n(Н+) |
Z(Н2SО4) Z(Н2SО4) |
|
Основание |
Z(осн-я) n(ОН—) |
Z(Са(ОН)2 Z(Са(ОН)2) |
|
Соль |
Z(соли) n(А), |
Z(Na2SО4) Z(Al2(CO3)3) |
|
Частица |
Z(частицы) n |
SO42-+2H++ Z(SО42-)=2, 2Cl— Z(Cl—)=1, |
|
ион |
Z(иона) n |
Z(SО42-) |
В
реакции H3PO4
+ KOH
→ KН2PO4
+ H2O
замещается только один ион водорода Н+
и поэтому Z(H3PO4)=1,
а эквивалентом кислоты является частица
H3PO4
(Э(H3PO4)=
1H3PO4).
Эквивалентное
число (эквивалент) элемента также может
меняться в зависимости от вида соединения,
в состав которого он входит. Например,
в оксиде Cr2O3
эквивалентное число хрома Z(Cr)=3
и, следовательно, эквивалентом хрома
является условная частица 1/3Cr,
а в хромовой кислоте Н2CrО3
эквивалентное число хрома Z(Cr)=6,
а эквивалент Э(Cr)=1/6Cr.
В
обменных реакциях эквивалентное число
(эквивалент) определяется стехиометрией
реакции. Например,
Cr2(SO4)3
+ 12KOH
→ 2K3[Cr(OH)6]
+ 3K2SO4
на
одну формульную единицу Cr2(SO4)3
затрачивается 12 формульных единиц КОН.
Следовательно, эквивалентное число
Z(Cr2(SO4)3)=12,
а Z(КОН)=1.
Эквивалентом Cr2(SO4)3
будет являться условная частица 1/12
Cr2(SO4)3,
а Э(КОН)=1КОН.
Для
установления значений эквивалентных
чисел Z(В)
по уравнениям реакций обмена достаточно
найти наименьшее общее кратное всех
стехиометрических коэффициентов в
уравнении реакции и разделить их на
него. В рассматриваемом выше уравнении
наименьшее общее кратное равно 12:
1/12Cr2(SO4)3
+ KOH → 1/6K3[Cr(OH)6]
+ 1/4K2SO4
Для
данной реакции эквивалентные числа
равны: Z(Cr2(SO4)3)=12,
Z(КОН)=1,
Z(K3[Cr(OH)6])=6,
а Z(K2SO4)=4.
В
окислительно-восстановительных реакциях
эквивалентные числа окислителя и
восстановителя определяются числом
электронов, которое принимает одна
формульная единица окислителя или
отдает одна формульная единица
восстановителя.
Для
окислительно-восстановительной реакции
K
+ 14HCl = 2CrCl3
+ 3Cl2
+ 2KCl + 7H2O
Cr2O72-
+ 14H+
+
6e → 2Cr3+
+ 7H2O
6 1
2Cl—
— 2e → Cl2
3
Эквивалентные
числа определяют по числу электронов,
участвующих в соответствующих
полуреакциях, в расчете на одну формульную
единицу Cr2O72-,
Cr3+,
Cl—,
Cl2,
то есть Z(Cr2O72-)=6,
Z(Cr3+)=3,
Z(Cl—)=1,
Z(Cl2)=2.
Соответственно эквивалентные числа
веществ также будут равны: Z(К2Cr2O7)=6,
Z(Cr
Cl3)=3,
Z(НCl)=1.
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
Эквивалент – это реальная или условная
частица, которая в кислотно-основных реакциях присоединяет
(или отдает) один ион Н+ или ОН–, в
окислительно-восстановительных реакциях принимает (или отдает) один
электрон, реагирует с одним атомом водорода или с одним эквивалентом
другого вещества. Например, рассмотрим следующую
реакцию:
H3PO4 + 2KOH
®
K2HPO4 + 2H2O.
В
ходе этой реакции только два атома водорода замещаются на атомы
калия, иначе, в реакцию вступают два иона Н+ (кислота
проявляет основность 2). Тогда по определению эквивалентом
H3PO4
будет являться условная частица 1/2H3PO4,
т.к. если одна молекула H3PO4
предоставляет два иона Н+, то один ион Н+ дает
половина молекулы H3PO4.
С
другой стороны, на реакцию с одной молекулой ортофосфорной кислотой
щелочь отдает два иона ОН–, следовательно, один ион ОН–
потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом
кислоты является условная частица 1/2Н3РО4, а
эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы
или другой частицы вещества соответствует эквиваленту, называется
фактором эквивалентности (fЭ).
Фактор эквивалентности – это безразмерная величина, которая меньше,
либо равна 1. Формулы расчета фактора эквивалентности приведены в
таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу
вещества, можно составить формулу эквивалента какой-либо частицы,
где фактор эквивалентности записывается как химический коэффициент
перед формулой частицы:
fЭ
(формульная единица вещества)
º
эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты,
соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H3PO4
и КОН также могут происходить и другие реакции. При этом кислота
будет иметь разные значения фактора эквивалентности:
H3PO4 + 3KOH
®
K3PO4 + 3H2O
fЭ(H3PO4)
= 1/3
H3PO4 + KOH
®
KН2PO4
+ H2O fЭ(H3PO4)
= 1.
Следует учитывать, что эквивалент одного
и того же вещества может меняться в зависимости от того, в какую
реакцию оно вступает. Эквивалент элемента также может быть
различным в зависимости от вида соединения, в состав которого он
входит. Эквивалентом может являться как сама молекула или
какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 –
Расчет фактора эквивалентности
|
Частица |
Фактор |
Примеры |
|
Элемент |
где В(Э) – |
|
|
Простое вещество |
где |
fЭ(H2)
fЭ(O2)
fЭ(Cl2)
fЭ(O3) |
|
Оксид |
где |
|
|
Кислота |
где |
fЭ(H2SO4) или
fЭ(H2SO4) (основность равна 2) |
|
Основание |
где |
fЭ(Cu(OH)2)
fЭ(Cu(OH)2)
|
|
Соль |
где |
|
|
Частица в |
где |
Fe2+
fЭ(Fe2+)
MnO4–
fЭ(MnO4–) |
|
Ион |
где |
fЭ(SO42–) |
Пример.
Определите фактор эквивалентности и эквивалент у солей: а)
ZnCl2, б) КНСО3, в)
(MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в
таблице 1.1.
а)
ZnCl2 (средняя соль):
.
fЭ(ZnCl2)
= 1/2, поэтому эквивалентом ZnCl2
является частица 1/2ZnCl2.
б) КНСО3
(кислая соль):
.
fЭ(КНСО3) = 1,
поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4
(основная соль):
.
fЭ(
(MgOH)2SO4
) = 1/2, поэтому эквивалентом
(MgOH)2SO4
является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой
(молярным объемом) и определенным
количеством вещества
nэ.
Молярная масса эквивалента (МЭ)
– это масса одного моль эквивалента. Она равна
произведению молярной массы вещества на фактор эквивалентности:
Молярная масса
эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного
вещества равна сумме молярных масс эквивалентов образующих его
составных частей, например:
МЭ(оксида) = МЭ(элемента)
+ МЭ(О) = МЭ(элемента)
+ 8
МЭ(кислоты) = МЭ(Н)
+ МЭ(кислотного остатка) = 1 + МЭ(кислотного
остатка)
МЭ(основания) = МЭ(Ме)
+ МЭ(ОН) = МЭ(Ме) +
17
МЭ(соли) = МЭ(Ме)
+ МЭ(кислотного остатка).
Газообразные вещества помимо молярной массы эквивалента имеют
молярный объем эквивалента (
или VЭ)
– объем, занимаемый молярной массой эквивалента или объем одного
моль эквивалента. Размерность «л/моль».
При н.у. получаем:
Закон
эквивалентов был открыт в 1792 г. И. Рихтером.
Современная формулировка закона:
вещества реагируют и образуются согласно их эквивалентам.
Все вещества в уравнении реакции связаны законом эквивалентов,
поэтому:
nэ(реагента1)
= … = nэ(реагентаn)
=
nэ(продукта1)
= … =
nэ(продуктаn)
Из закона эквивалентов следует, что массы (или объемы)
реагирующих и образующихся веществ пропорциональны молярным массам
(молярным объемам) их эквивалентов. Для любых двух веществ,
связанных законом эквивалентов, можно записать:
где m1 и
m2 – массы реагентов и
(или) продуктов реакции, г;
,
–
молярные массы эквивалентов реагентов и (или) продуктов реакции,
г/моль;
V1, V2
– объемы реагентов и (или) продуктов реакции, л;
,
–
молярные объемы эквивалентов реагентов и (или) продуктов реакции,
л/моль.
Л.А. Яковишин
ЭКВИВАЛЕНТ.
ЗАКОН ЭКВИВАЛЕНТОВ.
РАСЧЕТЫ В ОБЪЕМНОМ (ТИТРИМЕТРИЧЕСКОМ) АНАЛИЗЕ.
Введение.
Как показывает опыт участия в муниципальном и региональном этапах ВОШ по химии в Московской области, задания практической части представляют собой элементы объемного (титриметрического) количественного анализа. В основе практической части лежат методы кислотно-основного (методы нейтрализации – алкалиметрия и ацидиметрия) и окислительно-восстановительного (редоксиметрия) титрования. При пояснении расчетов практической части, составители демонстрируют решение с использованием понятий «моль», «молярная масса» и традиционных подходов при количественных вычислениях по уравнению химической реакции.
Как известно, расчеты в объемном анализе опираются на понятия «эквивалент», «эквивалентная масса» и закон эквивалентов, которые в общеобразовательной школе не рассматриваются. Понятия «эквивалент», «эквивалентная масса», «количество вещества эквивалента» не абстрактны. Они вводятся для того, чтобы упростить расчеты по уравнениям химической реакции. В любой последовательности реакций из эквивалента одного вещества образуется один эквивалент любого другого вещества. Поэтому для определения выхода продукта реакции нет необходимости записывать уравнение реакции, устанавливать стехиометрические коэффициенты, проводить расчет для каждой реакции отдельно, так как число молей эквивалентов всех веществ одно и то же (закон эквивалентов).
В связи с вышесказанным представилось целесообразным научить школьников, участвующих в олимпиадах по химии, использовать данные понятия и законы при выполнении расчетов, связанных с титрованием. Учащиеся, хорошо усвоившие данный материал, могут успешно его применять при решении сложных химических задач.
Эквиваленты простых и сложных веществ. Закон эквивалентов.
Эквивалентом вещества (Э) называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. В общем случае, под эквивалентом понимают реальную или условную единицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна 1 молю атомов (ионов водорода) в реакциях ионного обмена или одному электрону в окислительно-восстановительных реакциях.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ).
Эквивалент (фактор эквивалентности) химического элемента несложно определить, исходя из химической формулы его водородного соединения. Так, например, атомы элементов VII-A группы (галогены) образуют водородные соединения общей формулы HR. Как видно из формулы, на 1 моль атомов водорода приходится 1 моль атомов галогена, из чего можно сделать вывод, что эквивалент галогена равен 1 молю. Аналогично определяем эквиваленты химических элементов остальных групп ПСХЭ:
VI-A группа (O, S, Se, Te) – Н2R → Э = ½ (fЭ = ½)
V-A группа (N, P, As, Sb) – RH3 → Э = 1/3 (fЭ = 1/3)
IV-A группа (C, Si, Ge, Sn) – RH4 → Э = 1/4 (fЭ = ¼)
Следует знать, что эквивалент водорода принят равным 1 молю.
Что касается металлов, то для ЩМ и ЩЗМ известны ионные соединения с водородом – гидриды, общей формулы МеН и МеН2 соответственно, из чего следует, что Э (ЩМ) = 1 моль и Э (ЩЗМ) = ½ моль. Для остальных металлов эквивалент не является постоянной величиной и определяется косвенно по уравнению реакции с веществом, эквивалент которого точно известен. Из всего вышесказанного можно сделать вывод, что эквивалент элемента есть величина, обратная его валентности в данном соединении:
Э = 1/В или fЭ = Э = 1/В.
Для определения эквивалента элемента необязательно исходить из его соединения с водородом. Эквивалент можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен (далее мы рассмотрим пример решения подобной задачи).
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает:
-
H3PO4 + KOH = KH2PO4 + H2O; fЭ = Э(H3PO4) = 1
-
H3PO4 + 2KOH = K2HPO4+ 2H2O; fЭ = Э(H3PO4) = 2
-
H3PO4 + 3KOH = K3PO4+ 3H2O; fЭ = Э(H3PO4) = 3
Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Расчет фактора эквивалентности
|
Частица |
Эквивалент (фактор эквивалентности) |
Примеры |
|
Элемент Простое вещество Оксид Кислота Основание Соль Окислитель (восстановитель) Ион |
fЭ = 1/В(Э), где В(Э) – валентность элемента fЭ = 1/n(Э)хВ(Э), где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента fЭ = 1/n(Э)хВ(Э), где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента fЭ = 1/n(Н+), n(Н+) – число отданных в ходе реакции ионов водорода (основность кислоты) fЭ = 1/n(ОН—), n(ОН—) – число отданных в ходе реакции гидроксид-ионов (кислотность основания) fЭ = 1/n(Ме)хВ(Ме)=1/n(А)хВ(А), где n(Ме) — число атомов Ме (индекс в химической формуле соли), В(Ме) – валентность Ме; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка. fЭ = 1/nе, где nе – число электронов, участвующих в процессе окисления или восстановления fЭ = 1/│z│, где z – заряд иона |
fЭ(Cr)в Сr2O3= 1/3 fЭ(Cr)в H2CrO4= 1/6 fЭ(H2)= ½ fЭ(O2)= ¼ fЭ(Cl2)= ½ fЭ(Сr2O3)= 1/(2×3)=1/6 fЭ(СrO)= 1/(1×2)=1/2 fЭ(P2O5)= 1/(2×5)=1/10 fЭ(H2SO4)= 1/1=1 (основность=1); fЭ(H2SO4)= 1/2 (основность=2) fЭ(Сг(OH)3)= 1/2(кислотность=2); fЭ(Сг(OH)3)= 1/3(кислотность=3); fЭ(Сг2(SO4)3)= 1/(2×3)=1/6 (расчет по Ме); fЭ(Сг2(SO4)3)= 1/(3×2) =1/6 (расчет по кислотному остатку) MnO4 —+ 8H+ + 5e—→ Mn+2 + H2O, fЭ(MnO4—)=1/ 5 fЭ(SO42-)= ½ |
Пример. Определите фактор эквивалентности и эквивалент солей: а) ZnCl2, б) КНСО3, в) (MgOH)2SO4.
Решение:
а) fЭ(ZnCl2) = 1/ n(Zn)хВ(Zn) = 1/(1×2) = ½ или
fЭ(ZnCl2) = 1/ n(Cl)хВ(Cl) = 1/(2×1) = ½;
б) fЭ(KHCO3) = 1/ n(K)хВ(K) = 1/(1×1) = 1 или
fЭ(KHCO3) = 1/n(HCO3)хВ(HCO3) = 1/(1×1) = 1
в) ) fЭ(MgOH)2SO4) = 1/ n(MgOH)хВ(MgOH) = 1/(2×1) = ½ или
fЭ(MgOH)2SO4) = 1/ n(SO4)хВ(SO4) = 1/(1×2) = ½
Эквивалентной массой или молярной массой эквивалента(МЭ) называется масса одного моль эквивалента и рассчитывается по формуле:
МЭ = Э×М = fЭ×M (г/моль)
где Э – эквивалент элемента (fЭ – фактор эквивалентности), М – молярная масса. Так, зная эквиваленты элементов, несложно рассчитать их эквивалентные массы:
МЭ (Br) = 1×80 = 80 г/моль; МЭ (О) = 1/2×16 = 8 г/моль; МЭ (N) = 1/3×14 = 4,67 г/моль и т.д.
Следует отметить, что наибольшее практическое значение имеет именно эквивалентная масса, а не сам эквивалент. Эквивалентные массы сложных веществ, участвующих в реакциях, протекающих без изменения степени окисления элементов, рассчитываются по следующим формулам:
Эоксида = Моксида/ (число атомов элемента × валентность элемента)
Экислоты = Мкислоты/основность кислоты
Эоснования = Моснования/кислотность основания
Эсоли = Мсоли/ (число атомов Ме × валентность Ме) (если расчет фактора эквивалентности соли по Ме)
Под основностью кислоты и кислотностью основания в данном случае подразумевается число нейтрализованных ионов Н+ в молекуле кислоты и
Н3РО4 + КОН = КН2РО4 + Н2О
основность ортофосфорной кислоты равна 1, следовательно Э(Н3РО4) = М/1 = 98 г/моль;
б) в реакции
Н3РО4 + 2КОН = K2HPO4+ 2Н2О
основность ортофосфорной кислоты равна 2, следовательно Э(Н3РО4) = М/2 = 49 г/моль;
в) в реакции
Al(OH)3 + 2HCl = AlOHCl2 + 2H2O
Кислотность Al(OH)3 = 2, следовательно Э(Al(OH)3) = М/2 = 78/2 = 39 г/моль.
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей:
МЭ(оксида) = МЭ(элемента) + МЭ(O) = МЭ(элемента) + 8
МЭ(кислоты) = МЭ(H) + МЭ(An) = 1 + МЭ(An)
МЭ(основания) = МЭ(Ме) + МЭ(OН) = МЭ(Ме) + 17
МЭ(cоли) = МЭ(Ме) + МЭ(An)
Если речь идет о газообразных веществах, целесообразно пользоваться при стехиометрических расчетах значением эквивалентного объема (VЭ).
Эквивалентным объемом (VЭ) газообразного вещества называется объем, занимаемый при данных условиях одним моль эквивалента вещества:
VЭ = (Vm × Э)/n или VЭ = fЭ х Vm = fЭ х 22,4
где Vm = 22,4 л/моль (молярный объем газа); Э – эквивалент элемента, образующего простое газообразное вещество; n — число атомов элемента в молекуле простого вещества.
Например, VЭ (Н2) = (22,4×1)/2 = 11,2 л/моль; VЭ (О2) = (22,4×0,5)/2 = 5,6 л/моль; VЭ (N2) = (22,4×1)/(2×3) = 3,73 л/моль.
Эквивалентные объемы газообразных сложных веществ определяются по их эквивалентам, определяемым косвенно в соответствии с химическим уравнением реакции. Например, при определении эквивалентного объема аммиака исходят из его кислотно-основных свойств. Аммиак, являясь основанием, реагирует с кислотами. Причем, в реакциях с кислотой аммиак присоединяет 1 моль ионов Н+:
NH3 + H+ = NH4+.
Откуда следует, что Э(NH3) = 1 и VЭ(NH3) = Э(NH3)×Vm = 1×22,4 = 22,4 л/моль. Аналогично эквивалентный объем определяется для фосфина — РН3, арсина — AsH3.
Эквиваленты летучих газообразных соединений IVA-группы (СН4, SiH4) зависят от конкретной реакции. Например, СН4 + Cl2 → CH3Cl + HCl, эквивалент метана равен 1 молю, так как замещает в реакции 1 моль атомов водорода. Следовательно, VЭ(СН4) = 22,4 л/моль. Как видно из данного примера, эквивалент не является постоянной величиной, а зависит от конкретной химической реакции.
Закон эквивалентов(И.Рихтер, 1792 г.): вещества реагируют и образуются согласно их эквивалентам.
Из закона эквивалентов следует, что массы (объемы) веществ, участвующих в химической реакции, пропорциональны их эквивалентным массам (эквивалентным объемам).
Другими словами, число молей эквивалентов (nЭКВ) всех веществ в реакции равны между собой. Число молей эквивалентов можно рассчитать по следующим формулам:
nЭКВ = m/MЭ,
где m – масса вещества (г), МЭ – эквивалентная масса вещества (г/моль);
nЭКВ = V/VЭ,
где V – объем газообразного вещества (н.у., л), VЭ – эквивалентный объем газа (л/моль).
Пример 1. При сжигании 2,28 г металла было получено 3,78 г его оксида. Определить эквивалентную массу металла.
Решение. Сначала находим массу кислорода, пошедшего на окисление металла: 3,78 г – 2,28 г = 1,5 г.
Далее по закону эквивалентов находим эквивалентную массу металла:
m(Me)/m(O) = MЭ(Me)/MЭ(O), следовательно MЭ(Me) = m(Me)×MЭ(О)/m(O) = 2,28 × 8/1,5 = 12,16 г/моль.
Для веществ, реагирующих между собой в растворе, число эквивалентов рассчитывается по формуле:
nЭКВ = Nр-ра × Vр-ра,
где Nр-ра – нормальность раствора (нормальная концентрация или молярная концентрация эквивалента): показывает число молей эквивалентов растворенного вещества, содержащееся в 1 л раствора (моль/л). Другими словами, нормальность раствора показывает сколько эквивалентных масс вещества содержится в 1 л раствора.
Vр-ра – объем раствора в литрах.
Пример 2. Рассчитать нормальную концентрацию раствора, в 250 мл которого содержится 10 г гидроксида кальция.
Решение:
-
Найдем сначала сколько граммов вещества будет содержаться в 1 л (100 мл) данного раствора
10 г ——————————- 250 мл
х ———————————- 1000 мл
х = 1000×10/250 = 40 (г/л)
-
Затем рассчитаем число моль эквивалентов, заключенное в 40 г
Ca(OH)2. Для этого для начала необходимо рассчитать МЭ(Ca(OH)2):
МЭ(Ca(OH)2) = 74/2 = 37 г/моль;
nЭКВ = m/МЭ = 40/37 = 1,08 моль
Следовательно, N (Ca(OH)2) = 1,08 моль/л.
Расчеты в объемном (титриметрическом) анализе.
Титриметрический анализ является методом количественного анализа, в котором измеряют количество реактива, затраченного в ходе химической реакции. При этом используют точное измерение объемов реагирующих веществ: заставляют реагировать два раствора, и, как можно точнее, определяют момент завершения реакции между обоими веществами. Зная точную концентрацию одного вещества, можно установить и точную концентрацию другого, опираясь на закон эквивалентов для двух взаимодействующих растворов веществ:
N1×V1 = N2×V2,
где N1 и N2 – нормальности растворов веществ, V1 и V2 – объемы растворов веществ (л).
Раствор вещества, концентрация которого точно известна, называется стандартным раствором. Концентрация стандартного раствора, приготовленного по точной навеске, взятой на аналитических весах с точностью до 4-го знака после запятой, рассчитывается следующим образом:
-
Сначала рассчитываем так называемый титр раствора (Т, г/мл) или простой титр, который показывает число граммов вещества, содержащегося в 1 мл раствора, по формуле
Т = mнавески/ Vколбы (г/мл)
-
Затем рассчитываем нормальность раствора по формуле:
N = T×1000/МЭ
Стандартный раствор можно приготовить также из фиксанала.
Раствор, концентрация которого подвергается стандартизации, называется рабочим раствором или титрантом. Стандартизация рабочего раствора осуществляется в процессе титрования. Иногда рабочим раствором служит раствор с известной концентрацией (стандартизованный раствор), при помощи которого определяется количество реагента в титруемом растворе.
Титрование – постепенное приливание рабочего раствора к стандартному до момента достижения точки эквивалентности. Точка эквивалентности (Т.Э.) – момент достижения полного взаимодействия двух веществ. Раствор, которым титруют (рабочий раствор), помещают в бюретку. Титруемый раствор находится в специальной конической колбе для титрования.
Среди известных методов титриметрического анализа следует выделить метод нейтрализации (кислотно-основного титрования), а также метод окислительно-восстановительного титрования (редоксиметрия) – именно данные методы предлагаются в качестве заданий практической части олимпиады.
В основе метода нейтрализации лежит одноименная реакция, краткое ионное уравнение которой: Н+ + ОН— = Н2О. В зависимости от того, раствор какого вещества (кислоты или щелочи) является стандартизованным и служит рабочим раствором при титровании, различают методы алкалиметрии и ацидиметрии.
Ацидиметрия – количественное определение щелочей при помощи титрованного раствора кислоты. Рабочий раствор – раствор кислоты, титруемый раствор – раствор щелочи.
Алкалиметрия – количественное определение кислот при помощи титрованного раствора щелочи. Рабочий раствор – раствор щелочи, титруемый раствор – раствор кислоты.
Поскольку реакция нейтрализации не сопровождается видимыми изменениями, для фиксирования Т.Э. к титруемому раствору прибавляют индикатор. Индикаторами в методе нейтрализации служат органические вещества, окраска которых меняется в зависимости от изменения величины рН: кислотно-основные индикаторы (метиловый оранжевый, фенолфталеин и др.). Резкое необратимое изменение окраски индикатора в Т.Э. указывает на то, что к титруемому веществу добавлено эквивалентное количество титранта (рабочего раствора).
Так, например, при титровании раствора щелочи раствором кислоты, в колбу для титрования помещают раствор щелочи и 2-3 капли раствора метилоранжа. Индикатор приобретает в щелочной среде желтую окраску, но по мере добавления раствора кислоты окраска раствора изменяется и в Т.Э. резко переходит из желтой в оранжевую. Изменение окраски указывает на то, что было добавлено ровно столько кислоты, сколько требуется для полной нейтрализации того количества щелочи, которое было в колбе для титрования. Иными словами, в момент изменения окраски индикатора число эквивалентов кислоты становится равным числу эквивалентов щелочи (закон эквивалентов).
В основе окислительно-восстановительного титрования лежит ОВР. Обычно восстановитель титруют окислителем. В отдельных случаях применяют обратное титрование. Методы в редоксиметрии классифицируют в соответствии с тем, какое вещество используется в качестве окислителя и, соответственно, присутствует в рабочем растворе:
— перманганатометрия (окислитель – раствор КMnO4);
— хроматометрия ( окислитель – растворы K2Cr2O7 или К2CrO4);
— броматометрия (окислитель – раствор KBrO3);
— йодометрия (окислитель – раствор I2) и т.д.
В редоксиметрии возможно как индикаторное титрование, так и безындикаторное. Титрование в отсутствии индикатора проводится всеми окрашенными окислителями (растворы перманганата, бихромата, йода и т.д.), меняющими окраску при переходе из окисленной в восстановленную форму, т.е. при достижении Т.Э. при титровании. Индикаторное титрование имеет ряд недостатков: зависимость изменения окраски среды от рН раствора, медленное изменение окраски, образование промежуточных соединений.
Так, например, в методе перманганатометрии раствором KMnO4 титруют раствор восстановителя (Na2SO3, NaNO2, Na2S и т.д.), обычно в кислой среде. Конец реакции легко определяется по изменению окраски от одной избыточной капли перманганата. В кислой среде титруемый раствор окрашивается в розовый цвет за счет избыточных MnO4— — ионов.
Эквивалентные массы окислителя и восстановителя рассчитываются по формуле:
MЭ = М/n,
где М – молярная масса вещества (г/моль), n – количество принятых или отданных электронов соответственно.
Например, для реакции
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + K2SO4 + 5Fe2(SO4)3 + 8H2O
MnO4— + 8H+ + 5e— → Mn+2 + 4H2O | 2
2Fe+2 – 2e— → 2Fe+3 | 5
МЭ(KMnO4) = М/5 = 158/5 = 31,6 г/моль; МЭ(Fe+2) = M/1 = 56/1 = 56 г/моль (в пересчете на один моль Fe+2).
Пример 3. На титрование 10 мл раствора КОН пошло 12 мл 0,1 н. раствора НСl. Определить N(KOH).
Решение:
Уравнение реакции: КОН + НСl = КСl + Н2О
По закону эквивалентов: NКОН × VKOH = NHCl × VHCl
Нормальность раствора КОН: NКОН = NHCl × VHCl/ VKOH = 12×0,1/10 = 0,12 н.
Ответ: NKOH = 0,12 н.
Пример 4. Определить, сколько граммов железа содержится в растворе, если на титрование этого раствора потребовалось 20 мл 0,05234 н. раствора KMnO4.
Решение:
Уравнение реакции (см. выше)
Для решения воспользуемся формулой сложного титра:
ТА/В = NA× ЭВ/1000 (г/мл),
где NA – нормальность раствора вещества А, ЭВ – эквивалентная масса вещества В. Сложный титр показывает какая масса вещества В реагирует с 1 мл раствора вещества А.
-
Определяем сложный титр перманганата калия по железу
Т(KMnO4/Fe) = N(KMnO4)×ЭFe/1000 = 0,05234×56/1000 = 0,002931 г/мл
-
1 мл KMnO4 восстанавливает из раствора 0,002931 г железа, а 20 мл – 0,002931 × 20 = 0,6058 г.
Ответ: масса железа – 0,6058 г.
Пример 5. Определить формулу соединения, если известно, что оно содержит 28% металла, 24% серы и 48% кислорода по массе.
Решение:
-
Исходя из элементного состава неизвестного вещества, можно предположить, что это – соль. Выразим состав соли формулой MexSyOz. Далее определим состав кислотного остатка (SyOz)n- через так называемый атомный фактор:
y : z = m(S)/Ar(S) : m(O)/Ar(O) = 24/32 : 48/16 = 0,75 : 3 = 1 : 4.
Из чего следует, что формула кислотного остатка соответствует сульфат-иону – SO42-.
-
Определяемое соединение – соль – сульфат неизвестного металла состава Ме2(SO4)х. Так как известен состав и валентность кислотного остатка (В = II), можно определить его эквивалентную массу*:
Э (SO42-) = М(SO42-)/В(SO42-) = 96/2 = 48 г/моль.
Эквивалентную массу металла рассчитаем, опираясь на уравнение реакции:
2Me + xH2SO4 = Me2(SO4)x + xH2,
n (Н2SO4) = n(SO4)в соли = (24 + 48)/96 = 72/96 = 0,75 моль. Следовательно, m(Н2SO4) = 0,75×98 = 73,5 г.
Согласно закону эквивалентов,
m(Me)/ m(Н2SO4) = Э(Ме)/Э(Н2SO4),
из чего следует: Э(Ме) = m(Me) × Э(Н2SO4)/ m(Н2SO4) = 28×49/73,5 = 18,7 г/моль.
-
Так же по закону эквивалентов число эквивалентов металла равно числу эквивалентов сульфат-ионов, из чего следует
m(Me)/Э(Me)= m(SO42-)/ Э(SO42-), т.е.
28/18,7 = 72/48, или
1,5 = 1,5.
Так как число эквивалентов составных частей формульной единицы соли Ме2(SO4)x не могут быть дробными, то
nЭКВ(Me) : nЭКВ(SO42-) = 3 : 3,
следовательно Ar(Me) = nЭКВ(Ме) × Э(Ме) = 3 × 18,7 = 56 (это железо).
-
Найдем валентность железа в данном соединении по формуле
В = Ar/Э = 56/18,7 = 3.
Следовательно, формула соли – Fe2(SO4)3
*Для простоты эквивалентные массы (Мэ) обозначили буквой «Э».