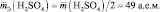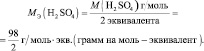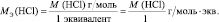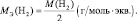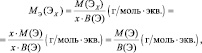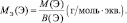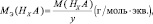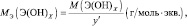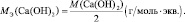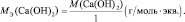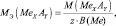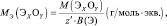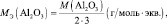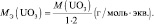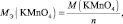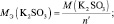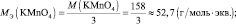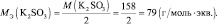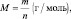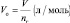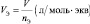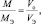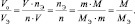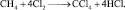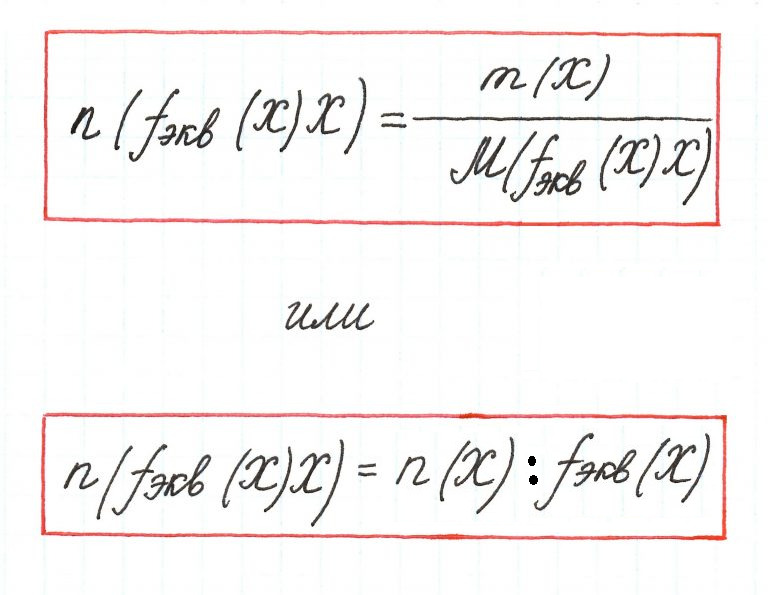§ 2.1.2. Эквивалент
Эквивалент молекулы сложного вещества – это условная часть молекулы, являющаяся носителем одной функциональной связи или одного электрона, участвующего в окислительно-восстановительном процессе.
Эквивалентная масса 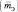
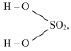
Например, если серная кислота (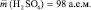
М (Н2 SO4) = 98 г/моль), имеющая структурную формулу:
взаимодействует с NaOH по реакции:
Н2SO4 + 2NaOH = Na2SO4 + 2Н2О, (2.1),
то у неё функциональны две связи Н – О. Вся молекула оказывается носительницей двух функциональных связей, а, значит, двух эквивалентов. Поэтому эквивалентом в данном случае является половина молекулы Н2SO4. Следовательно,
Молярная масса эквивалента (МЭ) – это масса одного моля эквивалента. В данном случае (MЭ(Н2SO4)) для приведённой реакции рассчитывается по формуле:
В аналогичной реакции взаимодействия NaOH с НСl молярная масса эквивалента соляной кислоты численно совпадает с молярной массой НСl:
НСl + NaOH = NaСl + Н2О;
Эквивалент молекулы простого вещества – это условная часть молекулы, являющаяся носителем одной валентности.
Например, молекула водорода состоит из двух атомов, каждый из которых обладает валентностью, равной единице. Поэтому, суммарная валентность молекулы этого простого вещества равна двум. Вся молекула оказывается носительницей двух валентностей, а, значит, согласно последнему определению, двух эквивалентов. Эквивалентом водорода оказывается половина молекулы. Молярная масса эквивалента ((MЭ(Н2)) рассчитывается по формуле:
Следует подчеркнуть, что хотя молекула водорода, также как и молекула соляной кислоты, содержит только одну функциональную связь, однако формулы для расчёта молярных масс эквивалентов этих веществ существенно различаются, потому что одно из них является простым, а другое сложным.
В общем случае, молярные массы эквивалентов (МЭ) рассчитываются следующим образом.
Для простых веществ:
где МЭ(ЭХ) – молярная масса эквивалента простого вещества, состоящего из х атомов элемента Э; М(ЭХ) – молярная масса этого вещества; М(Э) – молярная масса элемента; В(Э) – валентность элемента.
Для элементов (Э), входящих в состав сложного вещества:
То есть, молярные массы эквивалентов простых веществ и молярные массы эквивалентов элементов, входящих в состав сложного вещества, могут рассчитываться по одной и той же формуле.
Для кислот НХА, где А – кислотный остаток:
где y – основность кислоты, т. е. количество ионов H+, принимающих участие в процессе (y ≤ х).
Например, в реакции (2.1) основность серной кислоты равна двум. А для процесса:
Н2SO4 + NaOH = NaНSO4 + Н2О,
основность кислоты равна единице и не совпадает с общим количеством ионов Н+, принимающих участие в процессе.
Для оснований (Э(ОН)Х):
где у’ – кислотность основания, т. е. количество гидроксогрупп, принимающих участие в процессе. (y’ ≤ х).
Например, для реакции:
Са(ОН)2 + 2НСl = СаСl2 + 2Н2О;
А для процесса:
Са(ОН)2 + НСl = СаОНСl + Н2О;
Для солей (МеХАу, где Ме – металл):
где В(Ме) – валентность металла; z – количество атомов металла, принимающих участие в процессе (z ≤ х).
Для оксидов (ЭХОY):
где Э – элемент или фрагмент молекулы, неизменяемый в реакции; z′ – количество Э, принимающее участие в процессе.
Например, для реакции:
Аl2O3 + 6HCl = 2АlCl3 + 3H2O;
Э ≡ Al;
а для реакции:
UO3 + 2HCl = UO2Cl2 + H2O;
Э ≡ UO2;
Из приведённых примеров видно, что значение молярной массы эквивалента сложных веществ зависит от конкретной реакции, в которой они принимают участие. А значение молярной массы эквивалента элементов, входящих в состав сложного вещества – не зависит от реакции.
Следует подчеркнуть, что рассмотренные выше формулы для нахождения молярных масс эквивалентов сложных веществ, справедливы только в том случае если эти вещества не участвуют в окислительно – восстановительном процессе. Например, в реакции
2КMnO4 + 3 K2SO3 + H2O = 2MnO2 + 3 K2SO4 + 2KOH;
где n – количество электронов, получаемых перманганатом калия
n′ – количество электронов, отдаваемых сульфитом калия. В данном случае
Обобщив, приведённые выше равенства, можно утверждать, что молярную массу эквивалента любого вещества (МЭ) рассчитывают по формуле (2.2):
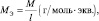
где M – молярная масса вещества, измеряемая в г/моль; l – количество эквивалентов, приходящееся на одну молекулу, численно равное количеству:
– валентностей (для простых веществ);
– функциональных связей (для сложных веществ, не участвующих в окислительно-восстановительном процессе);
– электронов, получаемых или отдаваемых молекулой (для сложных веществ, участвующих в окислительно-восстановительном процессе).
Подобно тому, как молярная масса вещества (М) представляет собой отношение массы (m) к количеству этого вещества (n)
а молярный объём газа (Vo) – отношение объёма (V), занимаемого им при нормальных условиях (p ≈ 105 Па; t °C ≈ 0 °C)[19] к количеству газа (nг):
молярный объём эквивалента газообразного вещества (VЭ) представляет собой отношение V к количеству молярных масс эквивалента nЭ:
из последних двух равенств вытекает соотношение
в котором все величины являются параметрами одного и того же газа.
Действительно:
Задачи для самостоятельного решения
1. Определить молярные массы эквивалентов соединения Н3РО4 в реакциях:
Н3РО4 + 3КОН = К3РО4 + 3Н2О;
Н3РО4 + 2КОН = К2НРО4 + 2Н2О;
Н3РО4 + КОН = КН2РО4 + Н2О.
Рассчитать молярные массы эквивалентов каждого из атомов в Н3РО4.
2. Определить эквивалентную массу Na2SO4 в реакциях:
Na2SO4 + ВаСl2 = ВаSO4 + 2NaСl;
Na2SO4 + H2SO4 = 2NaHSO4.
3. Определить молярную массу эквивалента Na2O в реакциях:
Na2O + 2НСl = 2NaСl + Н2О;
Na2O + Н2О = 2NaOН.
4. Определить эквивалентную массу Аl(OH)3 в реакциях:
2Аl(OH)3 + 3H2SO4 = Аl2(SO4)3 + 6Н2О;
Аl(OH)3 + H2SO4 = АlOHSO4 + 2Н2О.
5. Рассчитать молярную массу эквивалента кислорода и определить объём, занимаемый молярной массой эквивалента кислорода при н.у.
6. Определить эквивалентные массы, молярные массы эквивалента метана (СН4) и хлора в реакции
1. Дайте определения эквиваленту молекулы сложного вещества и эквиваленту молекулы простого вещества?
2. По какой формуле можно рассчитать молярную массу эквивалента любого вещества?
3. Какое уравнение связывает молярную массу, молярный объём, молярную массу эквивалента и молярный объём эквивалента одного и того же газа.
Химический эквивалент является одним из основных понятий в химии. Эта характеристика вещества, несмотря на свою простоту, часто достаточно запутанна и вызывает ряд затруднений.
Содержание:
1 Химический эквивалент и фактор эквивалентности
1.1 Химический эквивалент в реакциях обмена
1.2 Химический эквивалент в окислительно-восстановительных реакциях
2 Молярная масса эквивалента
3 Химический эквивалент и количественный анализ. Закон эквивалентов
4 Химический эквивалент элемента и сложного вещества
В знаменитом толковом словаре русского языка С.И. Ожегова эквивалент трактуется как «нечто равноценное другому, вполне заменяющее его». Что это значит? Например, книга стоит 500 рублей. Таким образом, 500 рублей – это денежный эквивалент данной книги.
Понятие «эквивалент» в химии относится к реакциям окислительно-восстановительным, ионного обмена, используется при определении концентрации раствора, в реакциях электро-аналитических методов анализа.
Эквивалент является безразмерной величиной.
Химический эквивалент и фактор эквивалентности
Химический эквивалент в реакциях обмена
Разберемся с понятием «химический эквивалент» на примере реакции обмена.
Например, карбонат натрия Na2CO3 и соляная кислота HCl, взаимодействуя между собой, приведут к образованию разных продуктов реакции.
Здесь оба исходных вещества (Na2CO3 и HCl) реагируют друг с другом в соотношении 1:1, т.е. на одну частицу соли приходится одна частица кислоты. Это и есть эквивалентные количества реагирующих веществ. Химическим эквивалентом карбоната натрия в данном случае является одна частица Na2CO3, а эквивалентом соляной кислоты будет одна молекула HCl.
В другом случае оба вещества взаимодействуют иначе:
Исходные вещества реагируют в соотношениях 1:2. То есть с одной частицей соли взаимодействуют 2 молекулы кислоты. Что же здесь будет являться эквивалентом? При определении эквивалента принято сравнивать количество частиц исходного вещества с одним ионом (или атомом) водорода, с которым это исходное вещество может провзаимодействовать (или заместить) в реакции.
В данном случае ионы (атомы) водорода входят в состав соляной кислоты. Тогда в пересчете на одну молекулу HCl (или что то же самое, на один ион Н+), с ней будет реагировать только половина частицы (1/2 часть) Na2CO3. То есть соотношение реагирующих веществ будет 1/2:1. Таким образом, в данной реакции химическим эквивалентом соли является половина частицы Na2CO3. Химическим эквивалентом кислоты является одна молекула HCl.
Очевидно, что в реальности половины частицы Na2CO3 не существует. Поэтому говорят об условной частице вещества, когда определяют ее эквивалент.
Итак, химический эквивалент – это реальная или условная частица вещества, которая в данной химической реакции может прореагировать (или заместить) один атом (или ион) водорода или прореагировать с одним эквивалентом любого другого вещества.
Фактор эквивалентности ƒэкв – количественная характеристика эквивалента, он используется в расчетах.
Фактор эквивалентности показывает, какая доля частицы вещества прореагировала (заместила) в данной химической реакции один ион (атом) водорода.
Так, в первом случае, ƒэкв(Na2CO3)=1, а во втором – ƒэкв(Na2CO3)=1/2. Для соляной кислоты в обоих случаях ƒэкв(HCl)=1.
Рассмотрим другой пример реакции обмена: взаимодействие фосфорной кислоты и гидроксида калия. Определим ее эквивалент и фактор эквивалентности по отношению к одному эквиваленту гидроксида калия.
Фосфорная кислота H3PO4 является многоосновной кислотой. Для подобных кислот (двух- и трехосновных) необходимо учитывать стехиометрию конкретных реакций.
В данном случае одна молекула фосфорной кислоты реагирует с одной частицей гидроксида калия. Поэтому эквивалентом является одна молекула H3PO4. И тогда ее ƒэкв (H3PO4)=1.
А здесь одна молекула фосфорной кислоты реагирует с двумя частицами гидроксида калия. То есть в реакции участвует половина молекулы H3PO4. Это и есть ее эквивалент, который численно выражается фактором эквивалентности ƒэкв(H3PO4)=1/2.
Одна молекула H3PO4 реагирует с тремя частицами КОН. Таким образом, эквивалентом фосфорной кислоты здесь будет одна треть молекулы H3PO4. Тогда фактор эквивалентности ƒэкв(H3PO4)=1/3.
Определение эквивалента и фактора эквивалентности в реакциях обмена для оснований, солей также зависит от стехиометрии реакции.
Химический эквивалент в окислительно-восстановительных реакциях
В окислительно-восстановительных реакциях (ОВР), в отличие от реакций обмена, происходит переход электронов от одного вещества к другому, изменяются степени окисления окислителя и восстановителя. Именно эти процессы и важны при определении эквивалента и фактора эквивалентности в ОВР.
Рассмотрим примеры. Начнем с самого простого.
Взаимодействие водорода и кислорода с образованием воды – это окислительно-восстановительная реакция. В ней восстановителем является водород Н2, а окислителем – О2.
При определении эквивалентов в ОВР ориентируются на то, какая часть частицы принимает или отдает 1 (один) электрон.
Запишем еще раз каждую из полуреакций. Для восстановителя:
Одна молекула Н2 отдает 2ē. Тогда половина молекулы Н2 (а это один атом Н) отдаст 1ē. Следовательно, эквивалентом восстановителя в данной реакции будет половина (1/2 часть) молекулы Н2. И фактор эквивалентности ƒэкв(H2)=1/2.
Для окислителя:
Одна молекула О2 принимает 4ē. Тогда четверть этой молекулы (а это половина атома О) примет 1ē. Следовательно, эквивалентом окислителя в данной реакции будет 1/4 часть молекулы О2 (это условная частица, поскольку реально 1/4 часть молекулы О2 не существует). И фактор эквивалентности ƒэкв(О2)=1/4.
Рассмотрим еще один пример. Так, KMnO4 является сильным окислителем и в любых ОВР всегда проявляет только окислительные свойства. Эквивалент KMnO4 будет отличаться в зависимости от того, в какой ОВР участвует это вещество.
Реакция между сульфитом натрия и перманганатом калия протекает в кислой среде. Из полуреакции восстановления видим, что один ион MnO4— принимает 5ē для перехода в ион Mn2+. Тогда 1ē может принять условная частица, представляющая одну пятую часть (1/5) иона MnO4—. Таким образом, эквивалентом окислителя в данной реакции будет одна пятая часть (1/5) KMnO4. Для окислителя фактор эквивалентности составит ƒэкв(KMnO4)=1/5.
С тем же сульфитом натрия перманганат калия в нейтральной среде реагирует иначе.
Как ясно из приведенной полуреакции восстановления, одна третья часть (1/3) иона MnO4— принимает 1ē. Фактор эквивалентности окислителя в этом случае составит ƒэкв(KMnO4)=1/3.
Взаимодействие сульфита натрия и перманганата калия осуществляется и в щелочной среде:
В данном случае эквивалентом является одна частица KMnO4, поскольку, согласно полуреакции восстановления, речь идет о принятии 1ē. И фактор эквивалентности окислителя в таком случае составляет ƒэкв(KMnO4)=1.
Таким образом, в случае окислительно-восстановительных реакций эквивалентом является реальная или условная частица вещества, которая в данной ОВР эквивалентна 1 (одному) электрону. Эквивалент и фактор эквивалентности в ОВР не определяются стехиометрией реакции в отличие от реакций ионного обмена.
Молярная масса эквивалента
Молярная масса эквивалента (или эквивалентная масса) – это масса одного моля эквивалента вещества.
Обозначается следующим образом:
И выражается, как и молярная масса, в г/моль, поскольку фактор эквивалентности является безразмерной величиной.
Вернемся к примерам, рассмотренным выше.
В данной реакции ƒэкв (H3PO4)=1. Это в том числе означает, что фосфорная кислота вступает в реакцию в количестве 1 моль. Тогда масса 1 моль эквивалента этого вещества соответствует (и равна) его молярной массе: 98 г/моль. Можно сделать вывод, что в данном случае:
В другой реакции гидроксида калия и фосфорной кислоты:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/2. Тогда:
И в третьем случае:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/3. Тогда:
Как видим, в зависимости от стехиометрии реакции молярная масса эквивалента вещества будет принимать различные значения. Так, для фосфорной кислоты это 98 г/моль, 49г/моль и 32,66 г/моль. В этом заключается отличие молярной массы эквивалента от молярной массы вещества, которая всегда постоянна, не зависимо от типа реакции (обмена, ОВР) и ее стехиометрии.
Итак, молярная масса эквивалента равна произведению фактора эквивалентности и молярной массы вещества:
Химический эквивалент и количественный анализ. Закон эквивалентов
В количественном анализе широко применяются еще два понятия, связанных с химическим эквивалентом.
Количество вещества эквивалента – количество вещества, в котором частицами являются эквиваленты.
Единицей измерения является моль. Вычисляется по формуле:
Молярная концентрация эквивалента (или нормальная концентрация, Сн) представляет собой количество вещества эквивалента, содержащееся в одном литре (или дм3) раствора (моль/л, или моль/дм3).
Иногда запись единиц измерения нормальной концентрации моль/л, или моль/дм3, заменяют более простой записью: н. Например, 0,2 моль/л записывают как 0,2 н.
Если в 1 л (1дм3) раствора содержится 1 моль эквивалентов вещества, то такой раствор называется нормальным. Если содержится 0,1 моль – децинормальным, 0,01 моль – сантинормальным, 0,001 моль – миллинормальным и т.д.
Пример 1. Какова нормальная концентрация раствора H2C2O4∙2H2O, полученного растворением 1,73334 г ее в мерной колбе вместимостью 250 мл?
Пример 2. Какую массу KMnO4 следует взять для приготовления 2 л раствора с С(1/5KMnO4) = 0,02 моль/л?
Используя нормальные концентрации, легко посчитать, какие объемы веществ должны быть смешаны, чтобы те прореагировали полностью, т.е. без остатка. Либо, зная объемы прореагировавших без остатка веществ, можно определить их концентрации.
Согласно закону эквивалентов (И.В. Рихтер), утверждающему, что вещества реагируют между собой в строго определенных (эквивалентных) количествах:
Пример 3. Определите нормальную концентрацию раствора гидроксида калия, если на полное взаимодействие 15,00 мл его раствора израсходовано 18,70 мл раствора соляной кислоты с нормальной концентрацией 0,078моль/л.
Химический эквивалент элемента и молярная масса эквивалента сложного вещества
Если речь не идет о конкретной химической реакции, то посчитать эквивалент и эквивалентную массу элемента или сложного вещества можно, воспользовавшись несколькими способами. Приведем наиболее простые из них.
Химический эквивалент элемента
Химический эквивалент элемента представляет количество элемента, способное полностью соединяться с одним атомом (ионом) водорода или замещать столько же их в химических реакциях.
Так, в молекуле хлороводорода HCl на атом Н приходится один атом Cl. В связи с этим:
У сероводорода H2S 2 атомам Н соответствует 1 атом S. Следовательно, 1 атому Н будет соответствовать 1/2 атома S. И тогда:
Аммиак NH3 характеризуется тем, что в его молекуле 3 атома водорода соединяются с 1 атомом азота. В пересчете на один атом водорода это будет 1/3 атома азота. Поэтому:
Как не трудно заметить из приведенных примеров,
фактор эквивалентности для элементов равен единице, деленной на валентность элемента:
Молярная масса эквивалента сложного вещества
Основными классами сложных веществ являются оксиды, основания, кислоты и соли.
Поскольку не будем останавливаться на факторе эквивалентности в данном случае, молярную массу эквивалента обозначим упрощенно: Мэ.
Для оксидов рассчитывается по формуле:
Например:
Для оснований:
Например:
Для кислот:
Например:
Для солей:
Например:
Подведем итог.
Химический эквивалент – это частица вещества, реальная или условная. Количественным выражением эквивалента является фактор эквивалентности. Для определения эквивалентов веществ в реакции обмена необходимо учитывать ее стехиометрию, а в окислительно-восстановительной реакции – число отданных или принятых веществом электронов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
для
разных веществ:
7.1.Для
простыходноатомных веществ и
дляодного химического элемента в
сложном веществе:МЭ
= М/п = А/п,
где А –
атомная масса,n– валентность химического элемента.
Например, МЭ(Al)
= 27/3 = 9г /моль (эквивалентов), МЭ(О)
= 16/2 = 8 г/моль;
7.2.Дляпростых
многоатомных (из двух и более атомов)
и сложныхвеществ эквивалентную массу
рассчитывают по общей формулеМЭ
= М/ п.k,
где М –
молярная масса вещества,п –
валентность одного, любого, элемента;
k
– количество атомов этого элемента
в молекуле.
Например, МЭ(О2)
=32/2.2 = 8, г /моль (эквивалентов),
МЭ(N2)
= 28/2.2 = 7, г /моль; МЭ(Al2О3)
= (27.2 + 16.3)/3.2 = (54 + 48)/6 = 102/6 = 17, г/моль.
7.3.Эквивалентная массасложного вещества
равна сумме эквивалентных масс образующих
его химических элементов.
Например, МЭ(Al2О3)
= М(Al)/п(Al) +
М(О)/п(О)= 27/3 + 16/2 = 17
г/моль. При этом fЭ(Al2О3)=
МЭ(Al2О3)/М(Al2О3)=
17 г/моль/102 г/моль = 1/6, Э(Al2О3)=
1/6 моль, число эквивалентов пЭ(Al2О3)
= 6 (6Э в 1 моле вещества
Al2О3).
7.4.Для
вычисления эквивалентных масссложных
веществ разных классовможно
использовать следующие формулы (при
условииполногозамещения
соответствующих функциональных групп
или атомов, ионов, количество которых
указано в формуле
индексом; в противном случае, в
реакцияхнеполногозамещения,
следует учитывать количествопрореагировавшихгрупп, атомов,
ионов):
7.4.1. Эквивалентная масса оксида:
МЭ(окс)
= М(окс)/k
. п =М(окс.)/пЭ
= М(окс). fЭ,
где М(окс) –
молярная масса оксида,k
– количество атомов какого-либо
одного элемента в составе молекулы
оксида,n –
валентность этого элемента;пЭ— число эквивалентов,пЭ
= k . п
эквивалентов Э иfЭ
— фактор эквивалентности оксида,fЭ
= 1/ пЭ.
Например, МЭ(Мп2О7)
= (55.2 + 16.7)/7.2 = 222/14 = 15,8 г/моль (эквивалентов).
7.4.2. Эквивалентная масса основания:
МЭ(осн)=М(осн)/k(ОН)
= М(осн)/пЭ ,
где М(осн.)
– молярная масса,k(ОН)
– кислотность основания, т.е. количество
гидроксидных групп ОН—в молекуле
основания, равное числу эквивалентовпЭ в случаеполного замещения групп ОН—;
принеполном замещении, например,
при недостатке кислоты, пЭ
равно числупрореагировавшихОН—-групп.
Например, МЭ
(Са(ОН)2) = 74/2 = 37
г/моль – в случае полного замещения
обеих
групп ОН—, как в химической
реакции: Са(ОН)2 + 2HCl
= СаCl2 +
2Н2О.
При замещении одной
ОН—–группы МЭ(Са(ОН)2)
= 74/1 = 74 г/моль–
как, например, в
реакции: Са(ОН)2 + HCl
= СаОНCl + Н2О.
7.4.3. Эквивалентная масса кислоты:
МЭ(кисл)
= М(кисл)/
k(Н)=
М(кисл)/пЭ ,
где М(кисл)
– молярная масса,k(Н)– основность кислоты, т.е. количество
атомовНв молекуле кислоты, равное
числу эквивалентов
пЭкислотыпри полном замещении атомов водорода;
в случае ихчастичного замещения– например,при избытке кислоты–пЭ равно числупрореагировавших атомов
Н).
Например, МЭ(Н2SO4)
= 98/2 = 49г /моль,пЭ=
2Э (эквивалентам) – приполном замещениидвухатомов водорода:2NaCl
+ H2SO4
= Na2SO4
+ 2HCl.
При недостатке соли
(избытке кислоты) возможна реакция
замещения только одного атома
водорода:NaCl + H2SO4
= NaНSO4
+ HCl,
и тогда МЭ(Н2SO4)
= 98/1 = 98г /моль,Э(Н2SO4)
=1 моль,пЭ =
1Э.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как найти эквивалентную массу
Химические элементы соединяются друг с другом в строго определенных количественных соотношениях. Именно поэтому появились такие понятия, как эквивалент и эквивалентная масса. («Эквивалент» в дословном переводе означает «равный», «равноценный»). Что такое эквивалент в химическом смысле этого слова? Как вычислить эквивалент и (или) эквивалентную массу?

Инструкция
Эквиваленты и эквивалентные массы обычно определяются либо по данным анализа соединений, либо на основании результатов замещения одного элемента другим. Нетрудно понять, что для определения эквивалента (или эквивалентной массы) элемента вовсе необязательно исходить из его соединения с водородом. Эквивалент (эквивалентную массу) можно точно так же вычислить по составу соединения данного элемента с любым другим, эквивалент (эквивалентная масса) которого известен.
Пример. При соединении 1,50 грамма натрия с избытком хлора образовалось 3,81 грамма хлорида натрия. Необходимо найти эквивалентную массу натрия и его эквивалент, если известно, что эквивалентная масса хлора равна 35,45 грамм/моль.Решение. Вычитайте из общей массы образовавшегося продукта исходную массу натрия.
Таким образом, 3, 81 – 1, 50 = 2, 31
То есть, в образовавшемся продукте (в вашем случае хлорид натрия) на 1,50 грамма натрия приходится 2,31 грамма хлора. Из этого следует, что зная эквивалентную массу хлора (35, 45 грамм/моль), вы легко найдете эквивалентную массу натрия по следующей формуле:
35, 45 х 1, 50 / 2, 31 Эквивалентная масса натрия получается равной 23,0 грамм/моль.
Молярная масса натрия также будет равна 23,0 грамм/моль. Из этого следует, что эквивалент натрия равен одному молю (поскольку молярная и эквивалентная массы натрия совпадают).
Понятие об эквивалентах и эквивалентных массах распространяется также и на сложные вещества. Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода.
Полезный совет
В настоящее время под эквивалентом элемента принято понимать такое его количество, которое соединяется с одним молем атомов водорода, или замещает такое же количество атомов водорода в химических реакциях. Масса одного эквивалента элемента называется его эквивалентной массой.
Источники:
- эквивалентные массы элементов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
ЭКВИВАЛЕНТНАЯ МАССА (химический эквивалент). Эквивалентная масса элемента — это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. При образовании соединений элементы взаимодействуют друг с другом в количествах, пропорциональных их эквивалентным массам или величинам, кратным этим массам. Для численного выражения эквивалентных масс необходим эталон; в качестве такого эталона приняты атомная масса водорода или ее эквивалент, например атомная масса хлора (Cl–), 1/2 атомной массы кислорода (O2–) или 1/3 атомной массы алюминия (Al3+). Таким образом, эквивалентная масса элемента равна его атомной массе, деленной на его валентность или степень окисления. В настоящее время атомные массы указывают в единицах, отнесенных к массе изотопа углерода с массовым числом 12; этому изотопу приписана масса 12,0000. Тогда атомная масса водорода будет равна 1,00797, хлора – 35,453, кислорода – 15,9994, алюминия – 26,9815. Следовательно, эквивалентная масса элемента – это масса, которая может химически соединяться или замещать в химическом соединении 1,00797 ч. (ч. – часть) водорода, 35,453 ч. хлора, 7,9997 (15,9994:2) ч. кислорода, 8,9938 (26,9815:3) ч. алюминия либо их эквиваленты. При таком определении эквивалентную массу можно найти экспериментально.
Методы определения.
Первые опыты по определению эквивалентных масс провели Дж.Дальтон, Й.Берцелиус, Ж.Дюма, Ж.Стас и другие ученые, но основная заслуга принадлежит здесь Т.Ричардсу, который впервые выполнил тщательные измерения эквивалентных масс с высочайшей точностью. Нагревая чистый перхлорат калия KClO3, превращали его в хлорид калия (KCl), при этом из 100 масс. ч. KClO3 образовывалось 60,835 масс. ч. KCl и 39,165 масс. ч. кислорода. Поскольку одна молекула KClO3 содержит на 3 атома кислорода, т.е. на 47,998 масс. ч., больше, чем KCl, то эквивалентная масса хлорида равна 47,998Ч(60,835:39,165) = 74,555. Далее, известное количество чистого серебра превращали в нитрат серебра, который использовали для осаждения хлорида серебра из раствора при взаимодействии с чистым хлоридом калия. Было установлено, что для полного превращения 74,555 масс. ч., т.е. массового эквивалента хлорида калия KCl, в хлорид серебра, который содержит 35,453 масс. ч. хлора, требуется 107,87 масс. ч. серебра. Эквивалентная масса калия при этом равна 74,555 – 35,453 = 39,102. Аналогично, зная эквивалентную массу серебра и изучая реакции образования им соответствующих галогенидов, например бромида AgBr, можно рассчитать эквивалентную массу галогена (в частности, брома). С использованием эквивалентных масс хлора и брома были определены эквивалентные массы многих металлов. Для нахождения эквивалентной массы какого-либо металла (М) синтезируют его чистый хлорид или бромид MBrx и осаждают галоген в виде галогенида серебра. Зная массы использованного MBrx и полученного AgBr, эквивалентные массы серебра (107,87) и брома (79,999), несложно определить эквивалентную массу металла М, который соединяется с 79,999 масс. ч. брома.
Описанный метод используется для точных расчетов, а для приближенных оценок можно применять другие способы, основанные на измерении объема и расчете массы водорода, выделившегося при растворении металла в кислоте, на определении массы одного металла, вытесняемого известным количеством другого из раствора, на определении состава гидридов или оксидов непосредственно по реакции соединения или аналитическими методами. Эквивалентные массы позволяют не только устанавливать соотношения, в которых элементы соединяются или замещают друг друга, но и точно определять атомные массы.
Кратные эквивалентные массы.
Иногда два элемента соединяются друг с другом в разных соотношениях, образуя два (или более) разных соединения. Например, известны два оксида меди. В одном из них, оксиде меди(II), 31,8 ч. меди соединены с эквивалентной массой, т.е. с 7,9997 масс. ч., кислорода, тогда как в оксиде меди(I) эта же эквивалентная масса кислорода соединена с 63,6 масс. ч. меди. Соответственно эквивалентные массы меди равны 31,8 и 63,6, при этом последняя величина ровно в два раза больше первой, а значит, эквивалентные массы являются кратными величинами. Этот вывод согласуется с ранее высказанным утверждением, что элементы соединяются пропорционально их эквивалентным массам или величинам, кратным этим массам.
Электрохимический эквивалент.
При прохождении через электролит количества электричества 1 F (фарадей) = 96 500 Кл (1 Кл = 1 АЧс) выделяется один химический эквивалент (т.е. эквивалентная масса) любого вещества. Следовательно, масса, выделяемая при прохождении 1 Кл (кулон), равна 1 экв., деленному на 96 500. Эта величина, называемая электрохимическим эквивалентом данного элемента, лежит в основе еще одного метода экспериментального определения эквивалентных масс.
Эквивалентные массы соединений.
Понятие эквивалентной массы было распространено и на соединения; в этом случае эквивалентная масса определяется как масса вещества, кратная эквивалентной массе элемента, являющегося ключевым для данного соединения. Например, для кислот ключевым элементом является водород, образующий в растворе ионы водорода; таким образом, эквивалентная масса кислоты есть масса кислоты, кратная 1,00797 массовым частям водорода, способного образовывать ионы водорода, т.е. водорода, который может быть замещен. Другими словами, эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты. Эквивалентная масса основания есть масса основания, которая реагирует с эквивалентной массой любой кислоты и, следовательно, является химическим эквивалентом этой массы. Иначе можно сказать, что эквивалентная масса основания равна его молярной массе, деленной на валентность металла, образующего основание. Для солей эквивалентная масса обычно кратна эквивалентной массе металла, образовавшего эту соль; она равна молярной массе соли, деленной на произведение валентности металла и числа его атомов в молекуле соли. Для эквивалентной массы окислителей и восстановителей можно дать несколько определений. С практической точки зрения наиболее удобно определение, согласно которому эквивалентная масса есть количество вещества, кратное 7,9997 ч. кислорода (или реагирующее с ними) либо его эквиваленту. Другое определение основано на том, что при восстановлении этого количества кислорода происходит перенос одного электрона. В этом случае эквивалентная масса окислителя или восстановителя есть масса, соответствующая массе вещества, принимающего или отдающего один электрон в окислительно-восстановительной реакции.