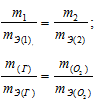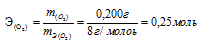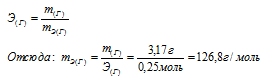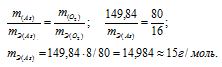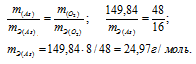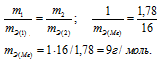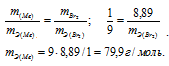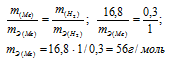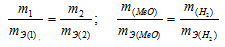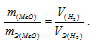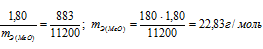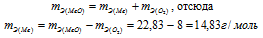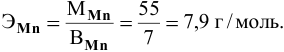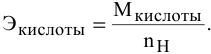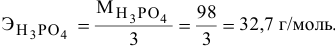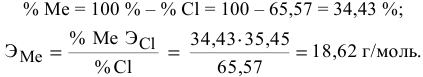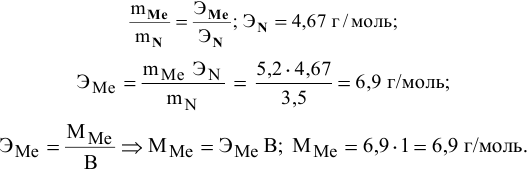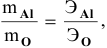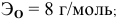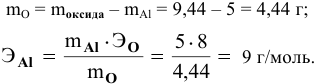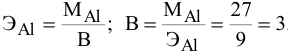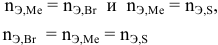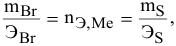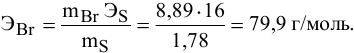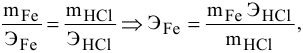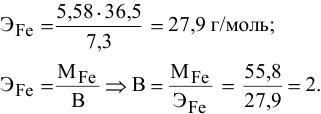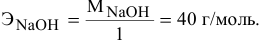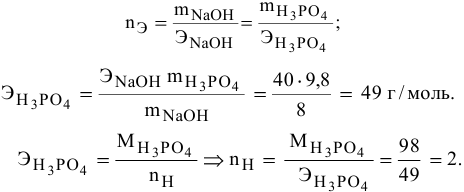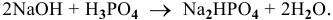Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение эквивалентной массы вещества
Задача №1
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Из условия задачи следует, что в оксиде металла на 5г металла приходится 4,44г кислорода (9,44 – 5 = 4,44). Согласно закону эквивалентов, массы (объёмы) взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
5г металла эквивалентны 4,44г кислорода
mЭ(Ме) г/моль металла эквивалентны 8г/моль кислорода
Откуда mЭ(Ме) = 8 . 5/4,44 = 9,01г/моль.
Ответ: mЭ(Ме) = 9,01г/моль.
Задача №2
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
I Вариант
Из условия задачи следует, что 0,200г кислорода и 3,17г галогена эквивалентно соединяются с металлом. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
0,200г кислорода эквивалентны 3,17г галогена
mЭ(О2) 8г/моль кислорода эквивалентны mЭ(Г) Х г/моль
Откуда: mЭ(Г) 8 . 3,17/0,200 = 126,8г/моль.
Ответ: mЭ(Г) = 126,8г/моль.
II Вариант
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Таким образом, количество эквивалентов галогена и кислорода численно равны между собой, что составляет:
Зная количество эквивалентов и массу вещества можно определить эквивалентную массу этого вещества:
Ответ: 126,г/моль.
Задача №3
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Находим эквивалентную массу магния: mЭ(Mg) = 1/2M(Mg) =24/2 = 12г/моль. Следовательно, 21г магния составляет 21/2 =1,75 эквивалентной массы Mg. Согласно закону эквивалентов масса израсходованного кислорода составляет 1,75 его эквивалентной массы. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, рассчитаем массу кислорода, расходуемую на сжигание магния: m(O2) = 1,75 . 8 = 14г. Зная, что 1л кислорода по массе составляет 1,4г, рассчитаем объём кислорода расходуемого при сгорании 21г магния, составив пропорцию:
1,4 : 1 = 14 : х;
х = 14 . 1/1,4 = 10л.
Ответ: V(O2) = 10л.
Задача№4
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Из условия задачи следует, что в оксиде металла на 3,24г металла приходится 0,24г кислорода (3,48 – 3,24 = 0,24г). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам). Так как эквивалентная масса кислорода составляет 8г/моль, то эквивалентную массу металла находим из пропорции:
8 : 0,24 = х : 3,24;
х = 8 . 3,24/0,24 =108г/моль.
В сульфиде металла на 3,24г металла приходится 0,48г серы (3,72 – 3,24 = 0,48г). Эквивалентную массу серы находим из пропорции:
3,24 : 108 = 0,48 : х;
х = 108 . 3,24/0,48 = 16г/моль.
Ответ: mэ(Me) = 108г/моль; mэ(S) = 16г/моль.
Задача№5
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Зная, что эквивалентный объём кислорода равен 5,6л/моль, рассчитаем эквивалентную массу металла, составив пропорцию:
8,345 : 0,680 = х : 5,6;
х = 8,34 . 5,6/0,680 = 68,68г/моль.
Атомную массу металла находим, учитывая, что металл двухвалентный, умножением его эквивалентной массы на 2:
М(Ме) = mэ(Ме) . В, где
В – валентность металла; М – молярная масса металла; mэ(Ме) – эквивалентная масса металла.
М(Ме) = 68,68 . 2 = 137,4г/моль.
Определяем, какой это металл по таблице «Периодическая система химических элементов Д.И. Менделеева», учитывая, что его атомная масса составляет 137,4. Такой атомной массе соответствует барий – элемент№56.
Ответ: 137,4; Ba.
Задача№6
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
а) Находим формулу оксида мышьяка, учитывая, что оксид содержит 65,2% As по массе. Тогда оксид содержит кислорода по массе 34,8% (100 – 65,2 = 34,8). Находим формулу оксид мышьяка:
AsхОу = х : у = 65,2/Ar(As) : 34,8/Ar(O2) = 65,2/74,92 : 34,8/16 = 1 : 2,5 = 2 : 5
Формула оксида будет иметь вид: As2O5.
M(As2O5) = 229,84г/моль.
Находим массу мышьяка и массу кислорода в оксиде:
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 5 = 80г.
Согласно закону эквивалентов массы элементов в оксиде пропорциональны их эквивалентным массам:
б) Подобные расчеты производим, учитывая, что оксид содержит 75,7% As и 24,3% О2 (100 – 75,7 = 24,3) по массе:
AsхОу = х : у = 75,7/74,92 : 24,3/16 = 1,01 : 1,51 = 1 : 1,5 2 : 3
Формула оксида будет иметь вид: As2O3.
M(As2O5) = 197,84г/моль.
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 3 = 48г.
Ответ: а) 15г/моль; 24,97г/моль.
Задача№7
,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:
Ответ: 9г/моль; 79,9г/моль.
Задача№8
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Согласно закону эквивалентов:
mэ(соли) = mэ(Cu) + mэ(Cl2).
Отсюда mэ(Cl2) = mэ(соли) — mэ(Cl2) = 99,5 – 35,5 = 64г/моль.
Зная эквивалентные массы хлора и меди можно определить количество их атомов в молекуле соли: mэ(А) = М(А)/mэ(А).
Тогда: CuxCly = x : y = 63,5/63,546 : 35,45/35,5 = 0,992 : 0,999 = 1 : 1
Отсюда CuxCly = CuCl.
Ответ: CuCl.
Задача№9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
M(H2SO4) =98г/моль.
Находим массу водорода в 14,7г серной кислоты, составив пропорцию: 98 : 2 14,7 : х;
х = 2 . 14,7/98 = 0,3г.
Согласно закону эквивалентов массы взаимодействующих веществ пропорциональны их эквивалентным массам:
Учитывая, что эквивалентный объём водорода равен 11,2л/моль, рассчитаем объём который занимает 0,3г водорода: из пропорции:
1 : 11,2 = 0,3 : х;
х = 11,2 . 0,3/ 1 = 3,36л.
Ответ: mэ(Ме) = 56г/моль; V(H2) = 3,36л.
Задача№10
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Так как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 4л. Отсюда эквивалентный объём водорода равен, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000мл/моль.
Отношение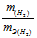
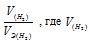
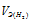
Тогда получим отношение
Находим эквивалентную массу оксида металла:
Согласно закону эквивалентов:
Ответ: 22,83г/моль; 14,83г/моль.
Эквивалентная
масса (Эм) называется масса одного
эквивалента вещества (элемента).
Эквивалентные
массы ранее рассмотренных элементов
равны Эм(Cl)=35.3 г/моль, Эм(O)=8 г/моль.
Эквивалентную
массу любого элемента можно определить
по формуле: Эм=μ/СО, где СО- абсолютная
величина степени окисления в соединениях.
Поскольку большинство элементов имеют
переменную степень окисления, то значения
их эквивалентов в различных соединениях
различно. Например найдем
Если
в задаче указаны объемы газов, то удобнее
пользоваться понятием эквивалентный
объем, вычисляемый с помощью закона
Авогадро. Эквивалентным объемом
называется объем занимаемый при н.у.
одним эквивалентом вещества. Так 1 моль
водорода, т.е. 2г. Занимает объем 22.4л.,
следовательно 1г. (т.е. одна эквивалентная
масса), будет занимать 11,2л. Аналогично
можно найти эквивалентный объем кислорода
который равен 5.6л.
6. Химические свойства хлора и его соединений. Примеры реакций
Строение
электронной оболочки
На
валентном уровне атома хлора содержится
1 неспаренный электрон:
1s2 2s2 2p6 3s2 3p5,
поэтому валентностьравная
1 для атома хлора очень стабильна. За
счёт присутствия в атоме хлора незанятой
орбитали d-подуровня, атом хлора может
проявлять и другие степени окисления.
Схема образования возбуждённых состояний
атома:
|
Валентность |
Возможные |
Электронное |
Пример |
|
I |
+1, |
3s2 3p5 |
NaCl,NaClO,Cl2 |
|
III |
+3 |
3s2 3p4 3d1 |
NaClO2 |
|
V |
+5 |
3s2 3p3 3d2 |
KClO3 |
|
VII |
+7 |
3s1 3p3 3d3 |
KClO4 |
Также
известны соединения хлора, в которых
атом хлора формально проявляет валентность
4 и 6, например ClO2 и
Cl2O6.
Однако, эти соединения являютсярадикалами,
то есть у них есть один неспаренный
электрон.
Взаимодействие
с металлами
Хлор
непосредственно реагирует почти со
всеми металлами(с
некоторыми только в присутствии влаги
или при нагревании):
Взаимодействие
с неметаллами
C неметаллами(кромеуглерода,азота,кислородаиинертных
газов), образует соответствующиехлориды.
На
свету или при нагревании
активно реагирует(иногда
со взрывом) сводородомпорадикальномумеханизму.
Смеси хлора с водородом, содержащие от
5,8 до 88,3 % водорода, взрываются при
облучении с образованиемхлороводорода.
Смесь хлора с водородом в небольших
концентрациях горит бесцветным или
желто-зелёным пламенем.
Максимальнаятемператураводородно-хлорного
пламени 2200 °C.:
или
С кислородомхлор
образуетоксиды,
в которых он проявляет степень окисления
от +1 до +7:Cl2O, ClO2,
Cl2O5, Cl2O7.
Они имеют резкий запах, термически и
фотохимически нестабильны, склонны к
взрывному распаду.
При
реакции с фтором,
образуется не хлорид, афторид:
Другие
свойства
Хлор
вытесняет бромииодиз
их соединений с водородом и металлами:
При
реакции с монооксидом
углеродаобразуетсяфосген:
При
растворении в воде или щелочах,
хлор диспропорционирует,
образуяхлорноватистую(а
при нагреваниихлорноватую)
исоляную
кислоты, либо их соли:
(при
нагревании)
Хлорированием
сухого гидроксида
кальцияполучаютхлорную
известь:
Действием
хлора на аммиакможно
получитьтрихлорид
азота:
Окислительные
свойства хлора
Хлор —
очень сильный окислитель:
Раствор
хлора в воде используется для отбеливания
тканей и бумаги.
Реакции
с органическими веществами
С насыщенными
соединениями:
(получение
хлороформа, реакция идет многоступенчато
с образованием тетрахлорметана CCl4)
Присоединяется
к ненасыщенным соединениям по кратным
связям:
Ароматические
соединения замещают атом водорода на
хлор в присутствии катализаторов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Эквивалент, эквивалентная масса. Закон эквивалентов
Задача:
Определить эквивалентную массу марганца в 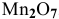
Решение:
По химической формуле определяем валентность марганца: 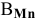
Задача:
Определить эквивалентную массу 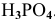
Решение:
Для кислот эквивалентная масса определяется по формуле
Так как число атомов водорода кислоты пн, участвующих в реакции, не указывается, в расчетной формуле принимается максимальное число атомов водорода в кислоте, способных участвовать в реакции: 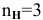
Задача:
Вычислить эквивалентную массу металла, зная, что его хлорид содержит 65,57 % хлора. Эквивалентная масса хлора равна 35,45 г/моль.
Решение:
Так как 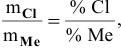
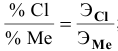
Задача:
5,2 г металла взаимодействуют с 3,5 г азота, образуя нитрид. Какой это металл, если его валентность равна 1, а валентность азота — 3?
Решение:
Согласно закону эквивалентов
Неизвестный металл — литий, с молярной массой, равной 6,9 г/моль.
Задача:
5 г алюминия, взаимодействуя с кислородом, образуют 9,44 г оксида алюминия. Найти эквивалентную массу алюминия и его валентность. Определить химическую формулу оксида алюминия.
Решение:
где
Химическая формула оксида алюминия — 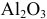
Задача:
Определенное количество металла взаимодействует с 1,78 г серы или с 8,89 г брома. Определить эквивалентную массу брома, если эквивалентная масса серы равна 16 г/моль.
Решение:
Так как количества эквивалентных масс реагирующих между собой веществ равны:
получаем:
или
откуда
Задача:
Какую валентность проявляет железо, если для растворения 5,58 г его потребовалось 7,3 г соляной кислоты? Какова формула образующегося хлорида железа?
Решение:
где 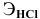
Формула образующегося хлорида — 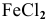
Задача:
Определить количества соляной, уксусной и серной (разбавленной) кислот, необходимые для растворения 10 г цинка (валентность цинка равна 2).
Решение:
Задача:
Составить уравнение реакции взаимодействия гидроксида натрия с ортофосфорной кислотой, если известно, что 8 г NaOH реагируют с 9,8 г фосфорной кислоты без остатка.
Решение:
Кислотность щелочи равна 1, поэтому эквивалентная масса NaOH будет следующей:
Так как основность фосфорной кислоты равна 3, то число атомов водорода, участвующих в реакции, может быть 1, 2 и 3. Для написания уравнения реакции необходимо определить число атомов водорода в фосфорной кислоте 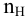
Уравнение химической реакции следующее:
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
Эквивалентная масса — хлор
Cтраница 1
Эквивалентная масса хлора равна 35 5 г / моль, мольная масса атомов меди равна 63 5 г / моль. Эквивалентная масса хлорида меди равна 99 5 г / моль.
[1]
Эквивалентная масса хлора равна 35 5 г / моль. Эквивалентная масса хлорида меди равна 99 0 г / моль.
[2]
Эквивалентная масса хлора равна 35 5 г / моль, мольная масса атомов меди равна 63 5 г / моль. Эквивалентная масса хлорида меди равна 99 5 г / моль.
[3]
Эквивалентная масса хлора равна 35 5 г / моль.
[4]
Эквивалентная масса хлора равна 35 5 г / моль, молярная масса атомов меди равна 63 5 г / моль. Эквивалентная масса хлорида меди равна 99 5 г / моль.
[5]
Эквивалентная масса хлора равна 35 5 г / моль, мольная масса атомов меди равна 63 5 г / моль. Эквивалентная масса хлорида меди равна 99 5 г / моль.
[6]
Металл массой 0 864 г образовал хлорид массой 1 148 г. Определите эквивалентную массу металла, зная, что эквивалентная масса хлора равна 35 5 г / моль.
[7]
Найти эквивалентную массу натрия ( Эка) и его эквивалент, если известно, что эквивалентная масса хлора равна 35 45 г / моль.
[8]
Найти эквивалентную массу натрия ( 3Na) и его эквивалент, если известно, что эквивалентная масса хлора равна 35 45 г / моль.
[9]
Найти эквивалентную массу натрия ( Эма) и его эквивалент, если известно, что эквивалентная масса хлора равна 35 45 г / моль.
[10]
Найти эквивалентную массу натрия ( Эт) и его эквивалент, если известно, что эквивалентная масса хлора равна 35 45 г / моль.
[11]
Найти эквивалентную массу натрия ( Эщ) и его эквивалент, если известно, что эквивалентная масса хлора равна 35 45 г / моль.
[12]
Найти эквивалентную массу натрия ( 5Na) и его эквивалент, если известно, что эквивалентная масса хлора равна 35 45 г / моль.
[13]
Найти эквивалентную массу натрия ( Эщ) и его эквивалент, если известно, что эквивалентная масса хлора равна 35 45 г / моль.
[14]
Найти эквивалентную массу натрия ( 5Na) и его эквивалент, если известно, что эквивалентная масса хлора равна 35 45 г / моль.
[15]
Страницы:
1
Как найти эквивалентную массу
Химические элементы соединяются друг с другом в строго определенных количественных соотношениях. Именно поэтому появились такие понятия, как эквивалент и эквивалентная масса. («Эквивалент» в дословном переводе означает «равный», «равноценный»). Что такое эквивалент в химическом смысле этого слова? Как вычислить эквивалент и (или) эквивалентную массу?

Инструкция
Эквиваленты и эквивалентные массы обычно определяются либо по данным анализа соединений, либо на основании результатов замещения одного элемента другим. Нетрудно понять, что для определения эквивалента (или эквивалентной массы) элемента вовсе необязательно исходить из его соединения с водородом. Эквивалент (эквивалентную массу) можно точно так же вычислить по составу соединения данного элемента с любым другим, эквивалент (эквивалентная масса) которого известен.
Пример. При соединении 1,50 грамма натрия с избытком хлора образовалось 3,81 грамма хлорида натрия. Необходимо найти эквивалентную массу натрия и его эквивалент, если известно, что эквивалентная масса хлора равна 35,45 грамм/моль.Решение. Вычитайте из общей массы образовавшегося продукта исходную массу натрия.
Таким образом, 3, 81 – 1, 50 = 2, 31
То есть, в образовавшемся продукте (в вашем случае хлорид натрия) на 1,50 грамма натрия приходится 2,31 грамма хлора. Из этого следует, что зная эквивалентную массу хлора (35, 45 грамм/моль), вы легко найдете эквивалентную массу натрия по следующей формуле:
35, 45 х 1, 50 / 2, 31 Эквивалентная масса натрия получается равной 23,0 грамм/моль.
Молярная масса натрия также будет равна 23,0 грамм/моль. Из этого следует, что эквивалент натрия равен одному молю (поскольку молярная и эквивалентная массы натрия совпадают).
Понятие об эквивалентах и эквивалентных массах распространяется также и на сложные вещества. Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода.
Полезный совет
В настоящее время под эквивалентом элемента принято понимать такое его количество, которое соединяется с одним молем атомов водорода, или замещает такое же количество атомов водорода в химических реакциях. Масса одного эквивалента элемента называется его эквивалентной массой.
Источники:
- эквивалентные массы элементов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.