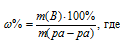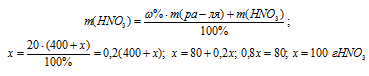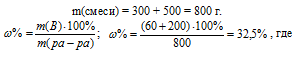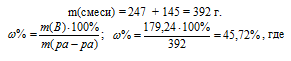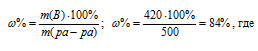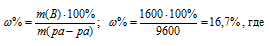Молярная масса эквивалента кислоты в окислительно-восстановительной реакции
Дана схема реакции:
H2SO3 + HNO3 = H2SO4 + NO + H2O
1) определить степень окисления атомов элементов, меняющих ее в процессе реакции;
2) составить электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов, указать процессы окисления и восстановления;
3) записать множители в уравнении окислительно-восстановительной реакции как основные стехиометрические коэффициенты;
4) подберите стехиометрические коэффициенты остальных участников реакции;
5) выписать формулы вещества окислителя и восстановителя и рассчитать их молярные массы эквивалентов.
Решение задачи
Запишем схему реакции взаимодействия сернистой кислоты (H2SO3) с азотной кислотой (HNO3):
1) Определим атомы, каких элементов изменяют степень окисления:
Следовательно, в процессе реакции степень окисления меняют сера (S) и азот (N).
2) Составим электронный баланс, укажем процессы окисления и восстановления:
S+4 – 2e— = S+6 2 3 окисление
N+5 + 3e—= N+2 3 2 восстановление
3) Переносят множители в уравнении окислительно-восстановительной реакции как основные стехиометрические коэффициенты:
4) Проверяют выполнение закона сохранения массы, если требуется, вводят новые или изменяют полученные коэффициенты.
В данном случае закон сохранения массы соблюдается.
Закон сохранения массы – число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым.
5)
H2SO3 – восстановитель
HNO3– окислитель
Рассчитаем молярную массу эквивалента сернистой кислоты (H2SO3) по формуле:
Напомню то, что молярная масса эквивалента – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Получаем:
Фактор эквивалентности (fэкв) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Рассчитаем молярную массу эквивалента азотной кислоты (HNO3) по формуле:
Получаем:
Ответ:
молярная масса эквивалента сернистой кислоты равна 41 г/моль, молярная масса эквивалента азотной кислотой равна 21 г/моль.
№144
Вычислите
эквивалентную и моляльную концентрации
20,8%-ного раствора НNО3
плотностью
1,12 г/см3.
Сколько граммов кислоты содержится в
4 л этого раствора?
Дано:
ω(HNO3)=20,8%
или 0,208
ρр-ра(HNO3)=1,12
г/см3
Vр-ра(HNO3)=4
л=4·103
см3
Cн(HNO3)=?
Cm(HNO3)=?
m(HNO3)=?
Решение:
Найдем массу 4-х
литров раствора:
mр-ра(HNO3)=ρр-ра(HNO3)·Vр-ра(HNO3);
mр-ра(HNO3)=1,12·4·103=4480
(г).
Вычислим
массу HNO3,
содержащуюся
в 4 л раствора:
m(HNO3)=ω(HNO3)·mр-ра(HNO3);
m(HNO3)=0,208·4480=931,84
(г).
Определим
молярную массу эквивалента HNO3:
MЭ(HNO3)=M(HNO3)/Основность;
M(HNO3)=63
г/моль;
MЭ(HNO3)=63/1=63
(г/моль).
Найдем
количество вещества эквивалентов HNO3
в
растворе:
nЭ(HNO3)=m(HNO3)/MЭ(HNO3);
nЭ(HNO3)=931,84/63≈14,8
(моль).
Вычислим нормальную
концентрацию раствора:
Cн(HNO3)=nЭ(HNO3)/Vр-ра(HNO3);
Cн(HNO3)=14,8/4=3,7
(моль/л).
Определим
количество вещества HNO3:
n(HNO3)=m(HNO3)/M(HNO3);
n(HNO3)=931,84/63≈14,8
(моль).
Найдем массу
воды, содержащуюся в растворе:
m(H2O)=mр-ра(HNO3)-m(HNO3);
m(H2O)=4480-931,84=3548,16
(г).
Вычислим моляльную
концентрацию раствора:
Cm(HNO3)=n(HNO3)·1000/m(H2O);
Cm(HNO3)=14,8·1000/3548,16≈4,17
(моль/кг H2O).
Ответ:
3,7 н.; 4,17 моль/кг H2O;
931,84
г.
Вычисление массовой доли и титра раствора
Решение задачи по химии на закон эквивалентов
Задание 155.
Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOН? Каков титр раствора NaOН? Ответ: 0,882 г; 0,0 16 г/см3.
Решение:
Эквивалентная масса HNO3 равна: МЭ(HNO3) = М(HNO3)/1 = 63/1 = 63 г/моль. Эквивалентная масса NaOH равна : МЭ(NaОН) = М(NaОН)/1 = 40/1 = 40 г/моль. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Находим число эквивалентов NaOН , содержащихся в 35 см3 его раствора из пропорции:
1000 : 0,4 = 35 : х; х = (0,4 . 35)/1000 = m0,014Н.
Из закона эквивалентов следует, что вещества реагируют друг с другом в эквивалентных соотношениях. Находим массу HNO3 по формуле:
m(HNO3) = МЭ(HNO3) . СН(HNO3) = 63 . 0,014 = 0,882 г
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Находим массу гидроксида натрия, содержащегося в 1 л 0,4Н раствора его:
m(NaOH) = МЭ(NaOH) . СН(NaOH) = 40 . 0,4 = 16 г.
Отсюда
Т(NaOH) = 16/1000 = 0,016 г/см3.
Можно титр раствора рассчитать, зная концентрацию эквивалента (СН) и массу эквивалента (МЭ) растворённого вещества по формуле:
Т = СН . МЭ(В)/1000;
Т(NaOH) = 0,4 . 40/1000 = 0,016 г/см3.
Ответ: 0,882 г; 0,0 16 г/см3.
Приготовление раствора
Задание 156.
Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г.
Решение:
Для расчета используем формулу:
m(B) – масса растворённого вещества; m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Обозначим массу растворённого вещества через х и подставим данные задачи в уравнение, получим искомую массу NaNO3:
Ответ: 100 г.
Массовая доля раствора
Задание 157.
Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaСI. Чему равна массовая доля полученного раствора? Ответ: 32,5%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(20%) = 300 . 20/100 = 60 г;
m(40%) = 500 . 40/100 = 200 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 32,5%.
Задание 158.
Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля полученного раствора? Ответ: 45,72%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(62%) = 247 . 62/100 = 153,14 г;
m(18%) = 145 . 18/100 = 26,1 г;
m(H2SO4) = 153,14 + 26,1 = 179,24 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 45,72%.
Задание 159.
Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора? Ответ: 84%.
Решение:
Находим массу серной кислоты в растворе:
m(H2SO4) = (700 . 60)/100 = 420 г.
Находим массу раствора после выпаривания:
m(ра-ра) = 700 – 200 = 500 г.
Находим массовую долю оставшегося раствора из формулы:
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 84%.
Задание 160.
Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна массовая доля охлажденного раствора? Ответ. 16,7%.
Решение:
Находим массу соли, содержащуюся в растворе:
m(соль) = (10000 . 20)/100 = 2000 г.
Находим массу соли после выпаривания:
Находим массу раствора после охлаждения:
m(ра-ра) = 10000 – 400 = 9600 г.
Находим массовую долю оставшегося раствора из формулы:
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ. 16,7%.
HNO3 — это кислота, значит экв. масса вычисляется по формуле M eq. = M/n, где М — это молярная масса данной кислоты, n — основность кислоты (т. е. количество атомов водорода в ней)
M eq. = 69 (г/моль) / 1 = 69 г/моль
Mg (OH) 2 — это основание, вместо основности в формулу подставляем кислотность (количество гидроксильных групп ОН)
M eq. = 58 (г/моль) / 2 = 29 г/моль
Na2SiO3 — это соль, формула вычисления массы эквивалента принимает следующий вид M eq. = M / (n*B), где M — молярная масса соли, n — количество атомов металла, В — валентность металла (почти всегда совпадает со степенью окисления)
M eq. = 128 (г/моль) / (2*1) = 64 г/моль
Ну вроде объяснил, если не сложно поставь лучший ответ=)
Вычислить молярные массы эквивалентов следующих соединений: A) HNO3 Б) H3AsO4 ; B) Fe(OH)3; г) Ag2O ; Д)Ca3(PO4)2 помогите решить
Светило науки — 1 ответ — 3 помощи
А) Формульная масса = 63.0129г/моль
H 1 1.00794 1.599578
N 1 14.0067 22.228376
O 3 47.9982 76.172049
Б) Формульная масса = 141.943г/моль
H 3 3.02382 2.130306
O 4 63.9976 45.086823
As 1 74.9216 52.782864
В) Формульная масса = 106.867г/моль
H 3 3.02382 2.829517
O 3 47.9982 44.913951
Fe 1 55.845 52.256535
Г) Формульная масса = 231.736г/моль
O 1 15.9994 6.904155
Ag 2 215.736 93.095843
Д) Формульная масса = 310.177г/моль
O 8 127.995 41.265250
P 2 61.9475 19.971687
Ca 3 120.234 38.763062
атом моль масса(г) масса(%)