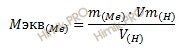Как вычислить эквивалентные массы оксида и металла
Эквивалент – такое количество химического элемента, которое либо связывает, либо замещает один моль атомов водорода. Соответственно, масса одного эквивалента называется эквивалентной массой (Мэ), и выражается в г/моль. Перед учащимися на химии часто ставят задачу определить эквивалентную массу того или иного вещества (соединения). Например, металла и образованного им оксида.

Инструкция
В первую очередь следует запомнить несколько простых правил. Если речь идет о металле, его эквивалентная масса рассчитывается по формуле: Мэ=М/В, где М – атомная масса металла, а В – его валентность. Рассмотрите это правило на конкретных примерах.
Кальций (Са). Его атомная масса 40,08. Округленно примите ее за 40. Валентность равна 2. Следовательно, Мэ(Са) = 40/2 = 20 г/моль. Алюминий (Al). Его атомная масса 26,98. (Округленно 27). Валентность равна 3. Таким образом, Мэ(Al) = 27/3 = 9 г/моль.
Перечисленные способы применимы, если речь идет о чистых металлах. А если они входят в состав какого-либо соединения, например, тех же оксидов? Тут надо запомнить другое правило: эквивалентная масса оксида вычисляется по формуле: Мэ + Мо, где Мо – эквивалентная масса кислорода. Она, соответственно, рассчитывается по уже рассмотренной формуле М/В, то есть 16/2 = 8.
Предположим, у вас есть основной оксид алюминия, Al2O3. Как посчитать его эквивалентную массу? Очень просто: 27/3 + 16/2 = 17 г/моль.
Есть ли другой способ определения эквивалентных масс металла и его оксида? Да, и весьма эффективный. Он основан на так называемом законе эквивалентов, согласно которому все вещества реагируют друг с другом в эквивалентных количествах. Например: металл массой 33,4 грамма вступил в реакцию окисления с кислородом воздуха. В результате получился оксид общей массой 43 грамма. Требуется определить эквивалентные массы самого металла и его оксида.
Сначала вычислите, сколько кислорода соединилось с металлом в ходе этой реакции: 43 – 33,4 = 9,6 грамм. Согласно закону эквивалентов, эта масса во столько же раз больше эквивалентной массы кислорода (которая, напомним, равна 8), во сколько раз эквивалентная масса металла меньше его первоначального количества. То есть 33,4/Мэ(ме) = 9,6/8. Следовательно, Мэ(ме) = 33,4*8/9,6 = 27,833 г/моль, или округленно 27,8 г/моль. Такова эквивалентная масса металла.
Эквивалентную же массу оксида найдите следующим действием: 27,8 + 8 = 35,8 г/моль.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Эквивалентная масса металла
При растворении в кислоте металла массой 11,9 грамм выделился водород объемом 2,24 литра (нормальные условия). Чему равна эквивалентная масса металла ( Мэкв) и фактор эквивалентности металла (fэкв).
Решение
Согласно закону эквивалентов: массы (объемы)реагирующих веществ пропорциональны молярным массам (объемам) эквивалента этих веществ.
Учитывая, что эквивалентный объем водорода (H) равна 11,2 л, определим эквивалентную массу металла по закону эквивалентов:
Откуда выразим эквивалентную массу металла:
Получаем:
M экв (Me) = 11,9 ∙ 11,2 / 2,24 = 59,5 (г/моль).
Молярная масса эквивалента – равна произведению фактора эквивалентности на молярную массу вещества.
Если валентность металла z (Ме) = 1, то М = Мэ = 59,5 г/моль — одновалентного металла с такой молярной массой нет (смотри таблицу Менделеева).
Если z(Ме) = 2, то М = 2Мэ = 119 г/моль – двухвалентного металла с такой молярной массой нет.
Если z(Ме) = 3, то М = 3Мэ = 178,5 г/моль – гафний.
Фактор эквивалентности металла 1/3.
Ответ:
эквивалентная масса металла 59,5 г/моль;
фактор эквивалентности металла 1/3.
Определение эквивалента и эквивалентной массы металла по водороду
Цель
работы:
практически, опытным путем научиться
определять эквивалент и эквивалентную
массу металла по объему газа, выделенного
в ходе реакции. Научиться проводить
различные рациональные расчеты с
использованием закона эквивалентов.
Теоретическая
часть.
Из
закона постоянства состава, кратных и
объемных отношений следует, что элементы
соединяются друг с другом в строго
определенных количественных соотношениях,
которые называют эквивалентами или
эквивалентными массами.
Для
определения эквивалентов и эквивалентных
масс нужно знать, что такое моль и мольная
масса.
Моль—
это количество вещества, в котором
содержится число частиц любого
определяемого сорта, равное постоянной
Авогадро (6,02 .1023).
Например: 3 .1024
молекул воды составят 5 моль.
Мольная
(молярная) масса
вещества в граммах численно равна его
относительной молекулярной (атомной)
массе, выраженной в атомных единицах
массы (а.е.м.). Масса 1 моля вещества
выражается в г/моль. Например: молярная
масса Н2О
и атомная масса кислорода соответственно
равны 18 и 16 а.е.м., их мольные массы равны
18 г/моль и 16 г/моль. Эквивалентом
элемента
называется такое его количество, которое
соединяется 1с молем атомов водорода
или замещает то же количество атомов
водорода в химических реакциях. Например,
в соединениях НВг, Н2О,
РН3
эквиваленты брома, кислорода, фосфора
соответственно равны 1 моль, 1/2 моль, 1/3
моль.
Масса
одного эквивалента называется его
эквивалентной
массой.
Так, в приведенных выше примерах,
эквивалентные массы брома, кислорода,
фосфора соответственно равны 79,9 г/моль,
16:2 = 8 г/моль, 31:3= 10,3 г/моль.
Эквивалентом
сложного вещества
называется такое его количество, которое
взаимодействует без остатка с одним
эквивалентом водорода или с одним
эквивалентом любого другого вещества.
Расчеты, связанные с определением
эквивалентных масс, проводятся по закону
эквивалентов:
массы
(объемы) реагирующих друг с другом
веществ, пропорциональны их эквивалентным
массам (объемам). Математически закон
выражается зависимостью:

где:
m,
(V)
— массы (объемы) реагирующих веществ;
Э,
(Vэкв.)
— эквивалентные массы (объемы).
Эквивалентную
массу простого вещества можно вычислить
по формуле:
где
— мольная масса атома элемента,
В
— валентность элемента.
Так, например,
эквивалентные массы водорода и кислорода
соответственно равны:
Эквивалентный
объем газа можно вычислить по формуле:
Так, например,
эквивалентные объемы водорода и кислорода
соответственно равны:
Эквивалентные
массы сложных веществ можно вычислить
по формулам:
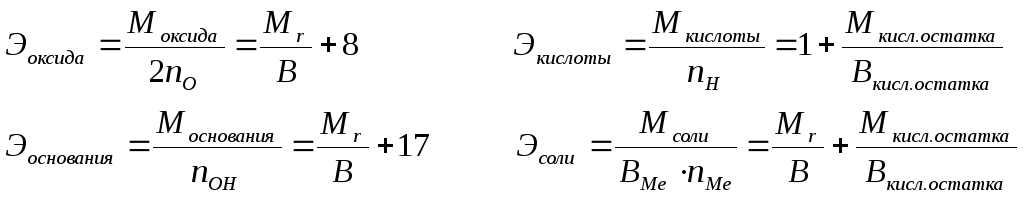
nO,
nOH,
nH,
nMe
– число
атомов кислорода, гидроксильных групп,
атомов водорода, металла соответственно
в оксиде, основании, кислоте, соли; В
– валентность, 8 – эквивалентная масса
кислорода, 1 – эквивалентная масса
водорода, 17 – эквивалентная масса
гидроксильной группы.
В
данной работе определение эквивалентной
массы металла основано на
измерении
объема водорода, вытесненного активным
металлом из разбавленной кислоты.
Измеренный объем водорода при условиях
опыта приводится к нормальным условиям:
Затем
по формуле (1) определяют эквивалентную
массу.
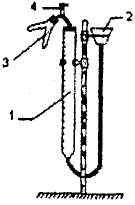
Рисунок
и описание
прибора для определения
эквивалента
металла
Рис.1.1
Прибор состоит из
бюретки 1, соединенной резиновыми
трубками с воронкой 2 и двухколенной
пробиркой 3. Прибор смонтирован на
штативе Бунзена.
Реактивы и посуда.
Прибор
для определения эквивалента металла
(рис.1.1), барометр, термометр, мерный
цилиндр емкостью 10 мл, воронка, 10 % —
ный раствор соляной кислоты, металлический
магний.
Практическая
часть
1. В
одно колено пробирки 3
внесите магний, а в другое колено пробирки
через воронку налейте около 12мл 10%- ного
раствора соляной кислоты. Наденьте
двухколенную пробирку на пробку,
соединенную резиновой трубкой с бюреткой.
2.
Необходимым условием протекания опыта
является герметичность всей системы,
поэтому проверьте прибор на герметичность.
Для этого воронку 2
опустите или поднимите на 25-30 см и держите
на одном уровне 1 -2 минуты. Если уровень
воды в бюретке 1
не изменится за это время, то прибор
герметичен. Если же уровень воды в
бюретке будет снижаться или подниматься
до уровня воды в воронке, то вращательными
движениями добейтесь плотного прилегания
всех пробок и снова проверьте герметичность
прибора.
3.
Убедившись в герметичности прибора,
отметьте уровень воды в бюретке 1,
а затем постепенно (первая порция кислоты
должна быть небольшой во избежание
бурного выделения газа) наклоните
двухколенную пробирку так, чтобы кислота
перелилась в колено с магнием.
4. По
окончании реакции подождите 1 минуту,
пока газ примет температуру помещения
и измерьте объем водорода, вытесненного
магнием. Для этого установите воронку
на такой высоте, чтобы вода в воронке и
бюретке была на одном уровне, то есть
газ находился при атмосферном давлении.
Деление бюретки, против которого
установится уровень воды, будет
соответствовать объему выделившегося
водорода при условиях проведения опыта.
( Если в начале опыта уровень воды
находился не на нулевой отметке, то из
конечного показания уровня воды надо
вычесть число, соответствующее начальному
уровню воды). В таблицу 1.1 запишите
значения указанных в ней величин.
Таблица
1.1 Параметры для расчета эквивалента
металла.
|
m, г |
P, Па |
Т, К |
V мл |
Р0, Па |
Т0, К |
V0, мл |
h, Па |
Определите давление
Р по барометру и температуру Т по
термометру.
Давление
насыщенного водяного пара h,
соответствующее температуре опыта Т,
выпишите из следующей таблицы:
Таблица
1.2 Давление насыщенного водяного пара
при различных температурах
|
Т, К |
h, |
|
293 |
2300 |
|
294 |
2500 |
|
295 |
2700 |
|
296 |
2900 |
|
297 |
3100 |
|
298 |
3300 |
|
299 |
3500 |
|
300 |
3700 |
Р0
— давление при нормальных условиях,
равное 101325 Па;
Т0
—
температура при нормальных условиях,
равная 273 К.
Расчет
Напишите уравнение
реакции магния с соляной кислотой.
Измеренный
объем водорода V
приведите к нормальным условиям по
уравнению Клапейрона (3):
Из математического
выражения (1) закона эквивалентов
определите эквивалентную массу магния:
Определите
теоретическое значение эквивалентной
массы магния по формуле:
где
— мольная масса металла, В валентность
металла.
Сравните
полученное практическое значение
эквивалентной массы Э магния с
теоретическим
значением Эт.
Рассчитайте процент
относительной ошибки опыта по формуле:
Указания по
технике безопасности
Необходимым
условием протекания опыта является
герметичность всей системы. Она в
основном определяется тем, насколько
плотно прилегают пробки к двухколенной
пробирке и бюретке. При проверке
герметичности прибора во избежание
порезов рук стеклом, которые могут
возникнуть при чрезмерном нажиме пробки
на стекло, необходимо двухколенную
пробирку, пробку и бюретку держать
полотенцем.
Лабораторная
работа №2
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Определение молярной массы эквивалента металла
Ульяна Власова
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Определение 1
Эквивалент — это частица вещества (реальная/условная), которая способна замещать/присоединять один ион водорода в кислотно-основных реакциях, а также присоединять/высвобождать один электрон в ходе окислительно-восстановительных реакций.
Молярная масса эквивалента металла
Молярная масса эквивалента ($mathrm {M_э}$ — это масса одного моля эквивалента.
Замечание 1
Моль — это количество вещества, которое содержит столько структурных единиц, сколько содержится атомов в 12 г изотопа углерода.
Рассчитывается молярная масса эквивалента следующим образом:
$mathrm {M_э = f_э cdot M_{в-ва} = frac {M_{в-ва}}{В_{в-ва}}}$
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Где:
- $mathrm {M_э}$ — молярная масса эквивалента (г/моль),
- $mathrm {f_э}$ — фактор эквивалентности (число, которое показывает, какая часть молекулы соответствует эквиваленту),
- $mathrm {M_{в-ва}}$ — молярная масса вещества,
- $mathrm {В_{в-ва}}$ — валентность вещества .
В качестве примера возьмем двухвалентное железо, тогда молярная масса эквивалента будет рассчитываться следующим образом:
$mathrm {M_{Э_{Fe}} = frac {56}{2} = 28 г/моль}$
Закон эквивалентов
Закон эквивалентов гласит, что вещества взаимодействуют в количествах, пропорциональных их эквивалентам.
Из этого следует:
$mathrm {frac{m_1}{m_2} = frac {M_Э1}{M_Э2}}$
Рассмотрим пример решения задачи:
В результате сгорания 5г Ме образовалось 9,44 г оксида этого металла. Необходимо рассчитать молярную массу эквивалента Ме.
- Составим уравнение: $mathrm {2Ме + О_2 to MeO}$.
- Найдем массу кислорода в оксида $mathrm {m_{O_2} = 9,44 — 5 = 4,44 г}$.
- Применим закон эквивалента $mathrm {frac{m_{Me}}{m_{O_2}} = frac{M_{Э_{Me}}}{M_{Э_{O_2}}}}$
Молярная масса эквивалента кислорода равна 8 г/моль ($mathrm {frac {16}{2} = 8}$)
Из этого следует, что молярная масса эквивалента Ме равна: $mathrm {frac {m_{Me}} cdot M_{Э_{О_2}}{m_{O_2}}= frac {40}{4,44} = 9г/моль}$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Дата последнего обновления статьи: 21.12.2022
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.