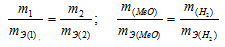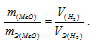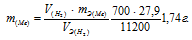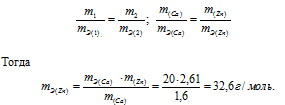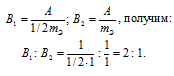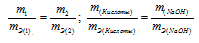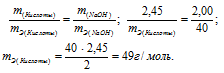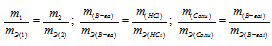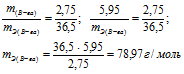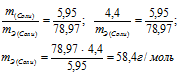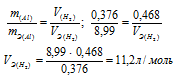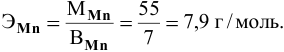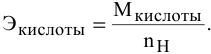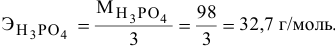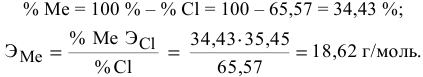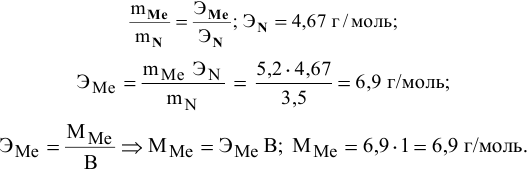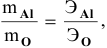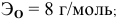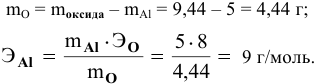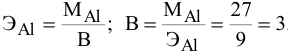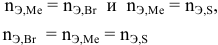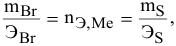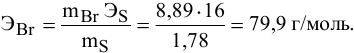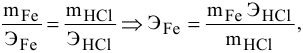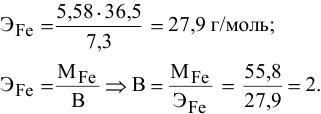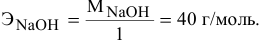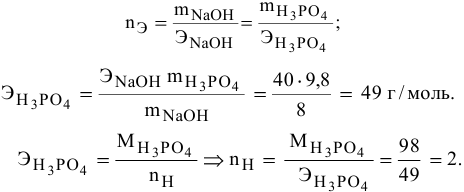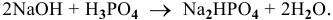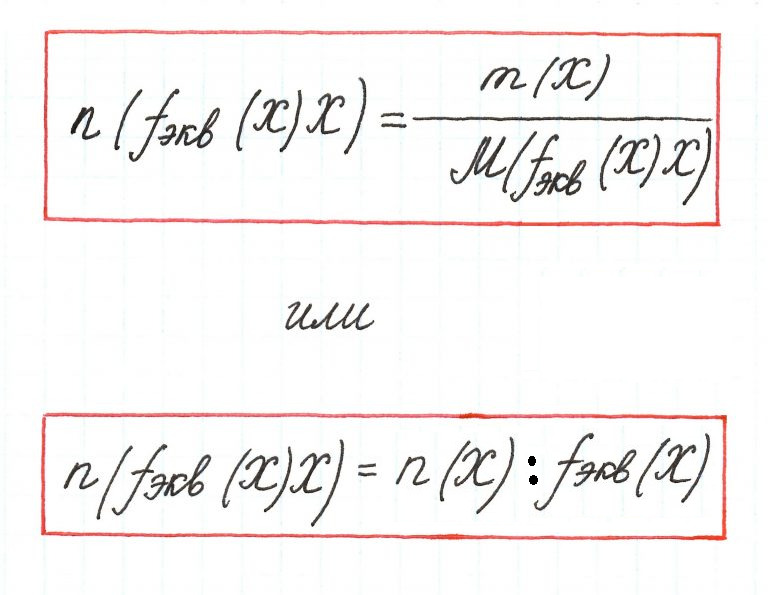Все
вещества, вступающие друг с другом в
химические реакции, реагируют в
количествах, пропорциональных химическим
эквивалентам этих веществ. Например, в
реакции нейтрализации
NaOH
+ Hcl
NaCl
+ H2O
количество
вещества щелочи, израсходованное на
реакцию, всегда эквивалентно количеству
вещества кислоты, прореагировавшему в
данной химической реакции:
N(NaOH)
= N(HCl),
или
CН(NaOH)
V(NaOH)
= CН(HCl)
V(HCl),
где
CН(NaOH)
и CН(HCl)
— эквивалентные концентрации NaOH
и НС1, моль/л; V(NaOH)
и V(HCl)
— объемы растворов NaOH
и НС1, пошедшие на химическую реакцию,
л.
Эквивалентная
концентрация (СН)
представляет собой отношение количества
вещества эквивалента в растворе к объему
этого раствора:
СН
= N/V
(моль/л).
Таким
образом, в общем виде для реагирующих
веществ, находящихся в растворе, закон
эквивалентов можно записать как
СН1V1
= CН2V2.
Пример
1
Для
нейтрализации 42 мл раствора H2SO4
потребовалось добавить 14 мл 0,3 Н раствора
щелочи. Определить молярную концентрацию
кислоты.
Решение
С
Нк
Vк
= CНщ
V2щ,
где
СНк
и CНщ
— эквивалентные концентрации кислоты
и щелочи; Vк
и Vщ
— соответствующие объемы. Следовательно
СНк
= (СНщ
Vщ)/Vк
= 0,314/42
= 0,1 моль экв/л.
Фактор
эквивалентности H2SO4
f
= 1/2
CМ
= fСН
=1/2
0,1 = 0,05 моль/л.
Задачи для самостоятельного решения
-
Для
нейтрализации 30 мл 0,1 Н раствора щелочи
потребовалось 12 мл кислоты. Определить
эквивалентную концентрации кислоты. -
Какой
объем 0,2 Н раствора щелочи потребуется
для осаждения в виде Fe(OH)3
всего железа, содержащегося в 100 мл 0,5
Н раствора FeCl3
? -
Для
нейтрализации 20 мл 0,1 Н раствора кислоты
потребовалось 8 мл NaOH.
Сколько г NaOH
содержит 1 л этого раствора ? -
На
нейтрализацию 40 мл раствора щелочи
израсходовано 24 мл 0,5 Н раствора H2SO4.
Какова нормальная концентрация щелочи?
Какой объем 0,5 Н раствора НС1 потребовался
бы для той же цели ? -
Для
нейтрализации 20 мл раствора, содержащего
2.4 г кислоты, потребовалось 25 мл 2 Н
раствора щелочи. Определить нормальность
раствора кислоты и ее эквивалентную
массу. -
На
нейтрализацию 20 мл раствора, содержащего
в 1 л 12 г щелочи, израсходовано 24 мл 0,25
Н раствора кислоты. Рассчитать
эквивалентную массу щелочи. -
Вычислить
эквивалентную массу гексафторкремниевой
кислоты, если на нейтрализацию 25 мл
раствора, содержащего 0,18 г кислоты,
пошло 50 мл раствора NaOH,
содержащего 0,1 г щелочи. -
К
250 мл 1,6 Н H2SO4
добавили 400 мл 0,35 Н NaOH.
Сколько мл щелочи дополнительно
требуется добавить до полной нейтрализации. -
К
100 мл 0,2 Н H2SO4
добавили
200 мл NaOH
с концентрацией 0,01 экв/л. Сколько
миллилитров 0,1 Н NaOH
нужно еще добавить до полной нейтрализации
раствора? -
Какой
объем 0,3 Н раствора кислоты требуется
для нейтрализации раствора, содержащего
0,32 г NaOH? -
Какая
масса HNO3
содержалась в растворе, если на его
нейтрализацию потребовалось 35 мл 0,4 Н
раствора NaOH
? -
Для
полного осаждения ВаSO4
из 100 г 15 % -раствора BaCl2
потребовалось 14,4 мл раствора H2SO4.
Определить нормальную концентрацию
раствора H2SO4. -
На
осаждение хлорид-ионов из раствора,
содержащего 0,924 г NaCl,
израсходовано 16,00 мл раствора AgNO3.
Вычислить нормальную концентрацию
раствора нитрата серебра. -
Сколько
0,50 Н раствора щелочи потребуется, чтобы
осадить в виде Cu(OH)2
всю медь, содержащуюся в 15 мл 1,2 Н
раствора CuCl2? -
Сколько
миллилитров 0,2 М раствора Na2CO3
требуется
для реакции с 50,0 мл 0,1 Н раствора СаС12
?
Соседние файлы в папке Химия_1
- #
- #
- #
- #
Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение объема водорода
Задача № 11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Та как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 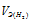
Тогда можно записать:
Отсюда:
Ответ: 1,74г.
Определение эквивалентной массы вещества
Задача № 12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Ответ: 32,6г/моль.
Определение отношения масс реагирующих веществ
Задача № 13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Формула сульфата имеет вид MeSO4, а дигидроортофосфата – MeH2PO4. Таким образом, на образование сульфата затрачивается две эквивалентные массы щёлочи, а на образование дигидроортофосфата – одна эквивалентная масса щёлочи. Так как H2SO4 с двумя эквивалентными массами щёлочи, то её эквивалентная масса в реакции нейтрализации равна М/2 г/моль, а фосфорная кислота реагирует с одной эквивалентной массой щёлочи, то её эквивалентная масса равна М/1г/моль. Отсюда, отношение мас этих кислот, с учётом, что их молекулярные массы равны будет иметь вид:
mH2SO4 : mH3PO4 = ½M : 1M = 1 : 2
Это можно подтвердить уравнениями реакций нейтрализации этих кислот с гидроксидом натрия:
H2SO4 +2NaOH = Na2SO4 + 2H2O;
H3PO4 + NaOH = NaH2PO4 +H2O.
Ответ: mH2SO4 : mH3PO4 = 1 : 2.
Задача № 14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Согласно закону эквивалентов 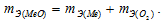
Таким образом, валентность меди в первом оксиде равна II, а во втором – I.
Ответ: 2 : 1.
Определение значения эквивалентной массы вещества
Задача № 15
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты.
Решение:
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Эквивалент (эквивалентная масса) кислоты равна мольной массе (М) делённой на число атомов водорода, замещённых в данной реакции на металл (на число вступающих в реакцию атомов водорода). Так как при взаимодействии ортофосфорной кислоты со щёлочью образовалась соль Na2HPO4, т.е. на натрий заместилось два атома водорода в кислоте H3PO4. Следовательно, эквивалентная масса ортофосфорной кислоты в реакции со щёлочью при образовании гидрофосфата натрия равна М/2 = М(H3PO4)/2 = 98/ 2 = 49г/моль.
Ответ: 49г/моль.
Задача № 16
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Эквивалентная масса гидроксида натрия равна М(NaOH)0/1 = 40г/моль.
Тогда
Ответ: 49г/моль.
Задача № 17
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Эквивалентная масса хлороводорода равна М(HCl) = 36,5/1 = 36,5г/моль.
Тогда
а) Находим эквивалентную массу вещества:
б) Находим эквивалентную массу соли:
Ответ: а) 58,4г/моль; б) 78,97 г/моль.
Определение эквивалентного объема водорода
Задача № 18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Если одно из веществ находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Ответ: 11,2л/моль.
Эквивалент, эквивалентная масса. Закон эквивалентов
Задача:
Определить эквивалентную массу марганца в 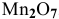
Решение:
По химической формуле определяем валентность марганца: 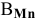
Задача:
Определить эквивалентную массу 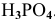
Решение:
Для кислот эквивалентная масса определяется по формуле
Так как число атомов водорода кислоты пн, участвующих в реакции, не указывается, в расчетной формуле принимается максимальное число атомов водорода в кислоте, способных участвовать в реакции: 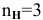
Задача:
Вычислить эквивалентную массу металла, зная, что его хлорид содержит 65,57 % хлора. Эквивалентная масса хлора равна 35,45 г/моль.
Решение:
Так как 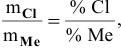
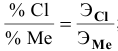
Задача:
5,2 г металла взаимодействуют с 3,5 г азота, образуя нитрид. Какой это металл, если его валентность равна 1, а валентность азота — 3?
Решение:
Согласно закону эквивалентов
Неизвестный металл — литий, с молярной массой, равной 6,9 г/моль.
Задача:
5 г алюминия, взаимодействуя с кислородом, образуют 9,44 г оксида алюминия. Найти эквивалентную массу алюминия и его валентность. Определить химическую формулу оксида алюминия.
Решение:
где
Химическая формула оксида алюминия — 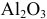
Задача:
Определенное количество металла взаимодействует с 1,78 г серы или с 8,89 г брома. Определить эквивалентную массу брома, если эквивалентная масса серы равна 16 г/моль.
Решение:
Так как количества эквивалентных масс реагирующих между собой веществ равны:
получаем:
или
откуда
Задача:
Какую валентность проявляет железо, если для растворения 5,58 г его потребовалось 7,3 г соляной кислоты? Какова формула образующегося хлорида железа?
Решение:
где 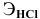
Формула образующегося хлорида — 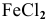
Задача:
Определить количества соляной, уксусной и серной (разбавленной) кислот, необходимые для растворения 10 г цинка (валентность цинка равна 2).
Решение:
Задача:
Составить уравнение реакции взаимодействия гидроксида натрия с ортофосфорной кислотой, если известно, что 8 г NaOH реагируют с 9,8 г фосфорной кислоты без остатка.
Решение:
Кислотность щелочи равна 1, поэтому эквивалентная масса NaOH будет следующей:
Так как основность фосфорной кислоты равна 3, то число атомов водорода, участвующих в реакции, может быть 1, 2 и 3. Для написания уравнения реакции необходимо определить число атомов водорода в фосфорной кислоте 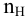
Уравнение химической реакции следующее:
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
Химический эквивалент является одним из основных понятий в химии. Эта характеристика вещества, несмотря на свою простоту, часто достаточно запутанна и вызывает ряд затруднений.
Содержание:
1 Химический эквивалент и фактор эквивалентности
1.1 Химический эквивалент в реакциях обмена
1.2 Химический эквивалент в окислительно-восстановительных реакциях
2 Молярная масса эквивалента
3 Химический эквивалент и количественный анализ. Закон эквивалентов
4 Химический эквивалент элемента и сложного вещества
В знаменитом толковом словаре русского языка С.И. Ожегова эквивалент трактуется как «нечто равноценное другому, вполне заменяющее его». Что это значит? Например, книга стоит 500 рублей. Таким образом, 500 рублей – это денежный эквивалент данной книги.
Понятие «эквивалент» в химии относится к реакциям окислительно-восстановительным, ионного обмена, используется при определении концентрации раствора, в реакциях электро-аналитических методов анализа.
Эквивалент является безразмерной величиной.
Химический эквивалент и фактор эквивалентности
Химический эквивалент в реакциях обмена
Разберемся с понятием «химический эквивалент» на примере реакции обмена.
Например, карбонат натрия Na2CO3 и соляная кислота HCl, взаимодействуя между собой, приведут к образованию разных продуктов реакции.
Здесь оба исходных вещества (Na2CO3 и HCl) реагируют друг с другом в соотношении 1:1, т.е. на одну частицу соли приходится одна частица кислоты. Это и есть эквивалентные количества реагирующих веществ. Химическим эквивалентом карбоната натрия в данном случае является одна частица Na2CO3, а эквивалентом соляной кислоты будет одна молекула HCl.
В другом случае оба вещества взаимодействуют иначе:
Исходные вещества реагируют в соотношениях 1:2. То есть с одной частицей соли взаимодействуют 2 молекулы кислоты. Что же здесь будет являться эквивалентом? При определении эквивалента принято сравнивать количество частиц исходного вещества с одним ионом (или атомом) водорода, с которым это исходное вещество может провзаимодействовать (или заместить) в реакции.
В данном случае ионы (атомы) водорода входят в состав соляной кислоты. Тогда в пересчете на одну молекулу HCl (или что то же самое, на один ион Н+), с ней будет реагировать только половина частицы (1/2 часть) Na2CO3. То есть соотношение реагирующих веществ будет 1/2:1. Таким образом, в данной реакции химическим эквивалентом соли является половина частицы Na2CO3. Химическим эквивалентом кислоты является одна молекула HCl.
Очевидно, что в реальности половины частицы Na2CO3 не существует. Поэтому говорят об условной частице вещества, когда определяют ее эквивалент.
Итак, химический эквивалент – это реальная или условная частица вещества, которая в данной химической реакции может прореагировать (или заместить) один атом (или ион) водорода или прореагировать с одним эквивалентом любого другого вещества.
Фактор эквивалентности ƒэкв – количественная характеристика эквивалента, он используется в расчетах.
Фактор эквивалентности показывает, какая доля частицы вещества прореагировала (заместила) в данной химической реакции один ион (атом) водорода.
Так, в первом случае, ƒэкв(Na2CO3)=1, а во втором – ƒэкв(Na2CO3)=1/2. Для соляной кислоты в обоих случаях ƒэкв(HCl)=1.
Рассмотрим другой пример реакции обмена: взаимодействие фосфорной кислоты и гидроксида калия. Определим ее эквивалент и фактор эквивалентности по отношению к одному эквиваленту гидроксида калия.
Фосфорная кислота H3PO4 является многоосновной кислотой. Для подобных кислот (двух- и трехосновных) необходимо учитывать стехиометрию конкретных реакций.
В данном случае одна молекула фосфорной кислоты реагирует с одной частицей гидроксида калия. Поэтому эквивалентом является одна молекула H3PO4. И тогда ее ƒэкв (H3PO4)=1.
А здесь одна молекула фосфорной кислоты реагирует с двумя частицами гидроксида калия. То есть в реакции участвует половина молекулы H3PO4. Это и есть ее эквивалент, который численно выражается фактором эквивалентности ƒэкв(H3PO4)=1/2.
Одна молекула H3PO4 реагирует с тремя частицами КОН. Таким образом, эквивалентом фосфорной кислоты здесь будет одна треть молекулы H3PO4. Тогда фактор эквивалентности ƒэкв(H3PO4)=1/3.
Определение эквивалента и фактора эквивалентности в реакциях обмена для оснований, солей также зависит от стехиометрии реакции.
Химический эквивалент в окислительно-восстановительных реакциях
В окислительно-восстановительных реакциях (ОВР), в отличие от реакций обмена, происходит переход электронов от одного вещества к другому, изменяются степени окисления окислителя и восстановителя. Именно эти процессы и важны при определении эквивалента и фактора эквивалентности в ОВР.
Рассмотрим примеры. Начнем с самого простого.
Взаимодействие водорода и кислорода с образованием воды – это окислительно-восстановительная реакция. В ней восстановителем является водород Н2, а окислителем – О2.
При определении эквивалентов в ОВР ориентируются на то, какая часть частицы принимает или отдает 1 (один) электрон.
Запишем еще раз каждую из полуреакций. Для восстановителя:
Одна молекула Н2 отдает 2ē. Тогда половина молекулы Н2 (а это один атом Н) отдаст 1ē. Следовательно, эквивалентом восстановителя в данной реакции будет половина (1/2 часть) молекулы Н2. И фактор эквивалентности ƒэкв(H2)=1/2.
Для окислителя:
Одна молекула О2 принимает 4ē. Тогда четверть этой молекулы (а это половина атома О) примет 1ē. Следовательно, эквивалентом окислителя в данной реакции будет 1/4 часть молекулы О2 (это условная частица, поскольку реально 1/4 часть молекулы О2 не существует). И фактор эквивалентности ƒэкв(О2)=1/4.
Рассмотрим еще один пример. Так, KMnO4 является сильным окислителем и в любых ОВР всегда проявляет только окислительные свойства. Эквивалент KMnO4 будет отличаться в зависимости от того, в какой ОВР участвует это вещество.
Реакция между сульфитом натрия и перманганатом калия протекает в кислой среде. Из полуреакции восстановления видим, что один ион MnO4— принимает 5ē для перехода в ион Mn2+. Тогда 1ē может принять условная частица, представляющая одну пятую часть (1/5) иона MnO4—. Таким образом, эквивалентом окислителя в данной реакции будет одна пятая часть (1/5) KMnO4. Для окислителя фактор эквивалентности составит ƒэкв(KMnO4)=1/5.
С тем же сульфитом натрия перманганат калия в нейтральной среде реагирует иначе.
Как ясно из приведенной полуреакции восстановления, одна третья часть (1/3) иона MnO4— принимает 1ē. Фактор эквивалентности окислителя в этом случае составит ƒэкв(KMnO4)=1/3.
Взаимодействие сульфита натрия и перманганата калия осуществляется и в щелочной среде:
В данном случае эквивалентом является одна частица KMnO4, поскольку, согласно полуреакции восстановления, речь идет о принятии 1ē. И фактор эквивалентности окислителя в таком случае составляет ƒэкв(KMnO4)=1.
Таким образом, в случае окислительно-восстановительных реакций эквивалентом является реальная или условная частица вещества, которая в данной ОВР эквивалентна 1 (одному) электрону. Эквивалент и фактор эквивалентности в ОВР не определяются стехиометрией реакции в отличие от реакций ионного обмена.
Молярная масса эквивалента
Молярная масса эквивалента (или эквивалентная масса) – это масса одного моля эквивалента вещества.
Обозначается следующим образом:
И выражается, как и молярная масса, в г/моль, поскольку фактор эквивалентности является безразмерной величиной.
Вернемся к примерам, рассмотренным выше.
В данной реакции ƒэкв (H3PO4)=1. Это в том числе означает, что фосфорная кислота вступает в реакцию в количестве 1 моль. Тогда масса 1 моль эквивалента этого вещества соответствует (и равна) его молярной массе: 98 г/моль. Можно сделать вывод, что в данном случае:
В другой реакции гидроксида калия и фосфорной кислоты:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/2. Тогда:
И в третьем случае:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/3. Тогда:
Как видим, в зависимости от стехиометрии реакции молярная масса эквивалента вещества будет принимать различные значения. Так, для фосфорной кислоты это 98 г/моль, 49г/моль и 32,66 г/моль. В этом заключается отличие молярной массы эквивалента от молярной массы вещества, которая всегда постоянна, не зависимо от типа реакции (обмена, ОВР) и ее стехиометрии.
Итак, молярная масса эквивалента равна произведению фактора эквивалентности и молярной массы вещества:
Химический эквивалент и количественный анализ. Закон эквивалентов
В количественном анализе широко применяются еще два понятия, связанных с химическим эквивалентом.
Количество вещества эквивалента – количество вещества, в котором частицами являются эквиваленты.
Единицей измерения является моль. Вычисляется по формуле:
Молярная концентрация эквивалента (или нормальная концентрация, Сн) представляет собой количество вещества эквивалента, содержащееся в одном литре (или дм3) раствора (моль/л, или моль/дм3).
Иногда запись единиц измерения нормальной концентрации моль/л, или моль/дм3, заменяют более простой записью: н. Например, 0,2 моль/л записывают как 0,2 н.
Если в 1 л (1дм3) раствора содержится 1 моль эквивалентов вещества, то такой раствор называется нормальным. Если содержится 0,1 моль – децинормальным, 0,01 моль – сантинормальным, 0,001 моль – миллинормальным и т.д.
Пример 1. Какова нормальная концентрация раствора H2C2O4∙2H2O, полученного растворением 1,73334 г ее в мерной колбе вместимостью 250 мл?
Пример 2. Какую массу KMnO4 следует взять для приготовления 2 л раствора с С(1/5KMnO4) = 0,02 моль/л?
Используя нормальные концентрации, легко посчитать, какие объемы веществ должны быть смешаны, чтобы те прореагировали полностью, т.е. без остатка. Либо, зная объемы прореагировавших без остатка веществ, можно определить их концентрации.
Согласно закону эквивалентов (И.В. Рихтер), утверждающему, что вещества реагируют между собой в строго определенных (эквивалентных) количествах:
Пример 3. Определите нормальную концентрацию раствора гидроксида калия, если на полное взаимодействие 15,00 мл его раствора израсходовано 18,70 мл раствора соляной кислоты с нормальной концентрацией 0,078моль/л.
Химический эквивалент элемента и молярная масса эквивалента сложного вещества
Если речь не идет о конкретной химической реакции, то посчитать эквивалент и эквивалентную массу элемента или сложного вещества можно, воспользовавшись несколькими способами. Приведем наиболее простые из них.
Химический эквивалент элемента
Химический эквивалент элемента представляет количество элемента, способное полностью соединяться с одним атомом (ионом) водорода или замещать столько же их в химических реакциях.
Так, в молекуле хлороводорода HCl на атом Н приходится один атом Cl. В связи с этим:
У сероводорода H2S 2 атомам Н соответствует 1 атом S. Следовательно, 1 атому Н будет соответствовать 1/2 атома S. И тогда:
Аммиак NH3 характеризуется тем, что в его молекуле 3 атома водорода соединяются с 1 атомом азота. В пересчете на один атом водорода это будет 1/3 атома азота. Поэтому:
Как не трудно заметить из приведенных примеров,
фактор эквивалентности для элементов равен единице, деленной на валентность элемента:
Молярная масса эквивалента сложного вещества
Основными классами сложных веществ являются оксиды, основания, кислоты и соли.
Поскольку не будем останавливаться на факторе эквивалентности в данном случае, молярную массу эквивалента обозначим упрощенно: Мэ.
Для оксидов рассчитывается по формуле:
Например:
Для оснований:
Например:
Для кислот:
Например:
Для солей:
Например:
Подведем итог.
Химический эквивалент – это частица вещества, реальная или условная. Количественным выражением эквивалента является фактор эквивалентности. Для определения эквивалентов веществ в реакции обмена необходимо учитывать ее стехиометрию, а в окислительно-восстановительной реакции – число отданных или принятых веществом электронов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Как найти эквивалент
Эквивалентом называется частица, которая химически равноценна (эквивалентна) в кислотно-основных реакциях одному иону водорода, а в реакциях окислительно-восстановительного типа — одному электрону. Эквивалент выражается числом без размерности, тогда как эквивалентная масса измеряется в г/моль.

Вам понадобится
- — калькулятор;
- — периодическая таблица
Инструкция
Чтобы можно было найти эквивалент того или иного вещества, вы должны использовать формулу: 1/z (какое-то вещество),где 1/z – фактор эквивалентности (fэ), то есть число, которое показывает, какая доля частицы вещества равноценна эквиваленту. Эта величина всегда меньше или равна единице. Проще говоря, фактор эквивалентности – это некий коэффициент, который записывается непосредственно перед формулой вещества при нахождении эквивалента. Например, вам надо найти эквивалент фосфорной кислоты при ее взаимодействии с гидроксидом натрия. Запишите уравнение реакции:2NaOH + H3PO4 = Na2HPO4 + 2H2OОтсюда видно, что на атомы натрия замещаются только два атома водорода, то есть кислота является двуосновной (в реакции участвуют 2 иона Н+). Таким образом, согласно определению, эквивалентом фосфорной кислоты будет условная частица ½ H3PO4.
Учтите, что эквивалент одного и того же вещества изменяется в зависимости типа реакции, в которую это вещество вступает. Кроме того, эквивалент элемента находится в зависимости от вида соединения, в состав которого входит. Возьмите те же вещества, что и в предыдущем случае, но реакция пусть пойдет по-другому:3NaOH + H3PO4 = Na 3PO4 + 3H2O.Здесь fэ(H3PO4) = 1/3, fэ(NaOH) =1. Следовательно, эквивалент фосфорной кислоты — частица 1/3 H3PO4, а эквивалент щелочи равен единице.
Для успешного нахождения эквивалентов различных веществ вам необходимо запомнить формулы для нахождения fэ в зависимости от типа химического соединения. Так для простых элементов fэ = 1/ валентность элемента. Пример: fэ ( H2SO4) = 1/6, а эквивалент серы в H2SO4 равен 6.Для солей — fэ = 1/n (мет.) — B(мет.) = 1/ n (к.о.) — B(к.о.), гдеn (мет.) – количество атомов металла,B(мет.) – валентность металла,n (к.о.) – количество кислотных остатков,B(к.о.) — валентность кислотного остатка и т.д.
Сложнее находить эквивалент вещества в реакциях окислительно-восстановительного типа, так как расчет вы будете вести по числу электронов, которые принимают участие в процессе восстановления или окисления. Дано задание найти эквивалент гидроксида марганца в реакции: 2Mn(OH)2 + 12NaOH + 5Cl2 = 2NaMnO4 + 10NaCl + 8H2OИз уравнения видно, что марганец отдает 5 электронов и переходит из Mn +2 в Mn +7. Значит, фактор эквивалентности Mn(OH)2 – 1/5, а эквивалент гидроксида равен 5.
Полезный совет
При расчете не забывайте о том, что эквивалентом может быть сама молекула или же какая-нибудь другая единица вещества.
Источники:
- эквивалент кислоты
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.