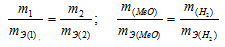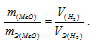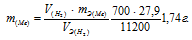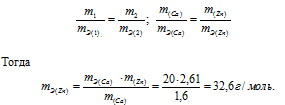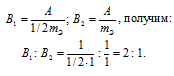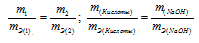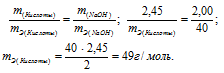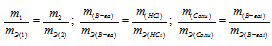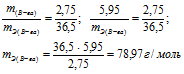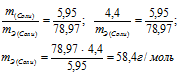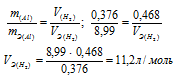Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.

Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!

Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Эквивалентный объем водорода
Max Админ. спросил 5 лет назад
Подскажите, чему равен эквивалентный объем водорода при нормальных условиях? Что такое эквивалентный объем? Входит ли водород в состав воздуха? Расскажите о способах получения водорода в промышленности.
1 ответ
Xumuk Админ. ответил 5 лет назад
Из закона постоянства состава следует, что элементы соединяются друг с другом в строго определенных соотношениях. Поэтому в химию были введены понятия эквивалента и эквивалентной массы.
В настоящее время эквивалентом элемента называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях эквивалент хлора, серы, азота, углерода равен соответственно 1 моль, ½ моль, 1/3 моль, ¼ моль.
Масса 1 эквивалента элемента называется его эквивалентной массой. Так, в приведенных выше примерах эквивалентные массы хлора, серы, азота, углерода соответственно равны 34,45 г/моль, 32/2 = 16 г/моль, 14/3 = 4,67 г/моль, 12/4 = 3 г/моль.
В 1811 г. итальянский физик Авогадро объяснил простые отношения между объемами газов, наблюдающиеся при химических реакциях установив закон: В равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул. Следствием из этого закона является утверждение, что один моль любого газа занимает объем, равный 22,4 л. Зная это можно определить эквивалентный объем водорода при нормальных условиях. Он будет равен 22,4/2 = 11,2 л.
Пожалуйста, зарегистрируйтесь или войдите, чтобы добавить ответ.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«РОСТОВСКИЙ ГОСУДАРСТВЕННЫЙ СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ»
Утверждено на заседании кафедры химии 17.11.2011 г.
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ Методические указания
по дисциплине «Химия» для бакалавров по направлениям:
«Строительство», «Стандартизация и метрология», «Товароведение», «Технология художественной обработки материалов», «Техносферная безопасность», «Эксплуатация транспортно-технических машин и комплексов», «Технология транспортных процессов» всех профилей дневного и заочного отделений
2
УДК 541.2
Химический эквивалент: методические указания по дисциплине «Химия» для бакалавров.– Ростов н/Д: Рост. гос. строит. ун-т, 2012. – 16 с.
Изложены сведения по определению эквивалентных масс простых и сложных соединений. Описана методика определения эквивалентной массы магния по объему вытесненного водорода.
Предназначены для бакалавров 1-го курса, обучающихся по направлениям «Строительство», «Стандартизация и метрология», «Товароведение», «Технология художественной обработки материалов», «Техносферная безопасность», «Эксплуатация транспортно-технических машин
икомплексов», «Технология транспортных процессов» всех профилей дневного
изаочного отделений.
Электронная версия находится в библиотеке, ауд. 224.
УДК 541.2
Составитель доц. М.А. Таутиева
Редактор Н.Е. Гладких Темплан 2012 г., поз. 76
__________________________________________________________________
Подписано в печать 6.12.11
Формат 60×84/16. Бумага белая. Ризограф. Уч.-изд.л. 0,7. Тираж 100 экз. Заказ
__________________________________________________________________
Редакционно-издательский центр Ростовского государственного строительного университета
344022, Ростов-на-Дону, ул. Социалистическая, 162
© Ростовский государственный строительный университет, 2012
3
Правила техники безопасности при выполнении лабораторной работы
«Определение химического эквивалента»
Все мероприятия по технике безопасности при проведении лабораторной работы сводятся к правильной работе с химическими
реактивами.
1.Перед началом лабораторных работ каждый студент должен ознакомиться с правилами техники безопасности и строго их выполнять.
2.Без разрешения преподавателя нельзя проводить никаких опытов,
не предусмотренных планом работы.
3.Во время работы не следует набирать кислоту при помощи пипетки, для этого рекомендуется использовать мерный цилиндр на 10 мл.
4.Присоединяя пробирку к прибору, соблюдать осторожность во избежание порезов.
Правила оформления лабораторной работы
1. Отчёт о выполнении лабораторной работы записывается в специальной лабораторной тетради, объём которой должен быть достаточным для оформления всех работ, включённых в настоящий практикум по общей химии.
Запрещается вести записи на отдельных листках и черновых тетрадях.
2. В лабораторной тетради записываются следующие данные:
а) дата;
б) номер и название работы;
в) название эксперимента;
г) схема и рисунок основного прибора;
д) химические формулы и расчеты эксперимента;
ж) наблюдение в ходе проведения опыта (интенсивность процесса,
условия его проведения, сопутствующие его явления;
выделение газа и т.д.);
4
з) выводы (таблицы, итоговые обобщения).
3. Всё оформление работы проводится во время занятий, по окончании которых студент предъявляет лабораторную тетрадь преподавателю на проверку.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Химический эквивалент представляет собой одну из важнейших характеристик химического элемента. Экспериментально установлено, что различные вещества реагируют друг с другом в определенных количественных соотношениях. Так, содержание водорода в воде составляет
11,11%, кислорода – 88,89 %. Это означает, что они реагируют между
собой в массовом соотношении 1: 8, а в молярном соотношении 2 : 1. Эти количества равноценны (эквивалентны) по отношению друг к другу.
Эквивалентом элемента ( Э ) называют такое его количество,
которое соединяется с 1 молем атомов водорода или замещает то же
количество атомов водорода в химических реакциях. Например, в
соединении водорода с кислородом – воде ( Н2О) – на 1 моль атомов
|
приходится, как видно из |
формулы |
соединения, |
моля атомов |
кислорода. |
|||||||||||
|
Следовательно, эквивалент |
кислорода равен |
моля атомов кислорода. |
В |
||||||||||||
|
соединении |
водорода |
с |
азотом |
NH3 – на |
1 моль атомов |
водорода |
|||||||||
|
приходится |
моля |
атомов |
азота, следовательно, эквивалент азота в этом |
||||||||||||
|
соединении равен |
моля атомов азота. |
||||||||||||||
|
При |
определении |
эквивалента |
элемента |
необязательно исходить |
из |
его соединения с водородом. Эквивалент можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен.
При расчетах используется эквивалентная масса Мэ – масса одного

5
эквивалента. Она имеет размерность г/экв. В приведенных выше
соединениях (Н2О, NH3) эквивалентные массы будут
|
Мэ (Н) = 1 г/экв, Мэ (О) = 16 : 2 = 8 г/экв, |
Мэ (N) = 14 : 3 = 4,67 г/экв. |
||||||
|
Поскольку эквивалент измеряется в молях, то часто используется |
|||||||
|
размерность г/моль. |
|||||||
|
Эквивалентная масса |
элемента связана |
с мольной (атомной) массой |
|||||
|
элемента. Она |
равна мольной (атомной) массе, деленной на валентность |
||||||
|
элемента в данном химическом соединении. |
|||||||
|
Мэ (элемента) = |
. |
||||||
|
Эквивалентная масса может быть переменной величиной, так как зависит |
|||||||
|
от валентности |
элемента в различных соединениях. Например, эквивалентная |
||||||
|
масса серы в разных соединениях: |
|||||||
|
а) сероводороде H2S Мэ (S) = 32 : 2 = 16 г/экв; |
|||||||
|
б) оксиде серы (IV) SO2 |
Мэ (S) = 32 : 4 = 8 г/экв; |
||||||
|
в) оксиде серы (VI) SO3 |
Мэ (S)= 32 : 6 = 5,3 г/экв. |
Понятие об эквивалентах и эквивалентной массе распространяется и на сложные соединения (оксиды, кислоты, основания, соли). Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним
эквивалентом любого другого элемента.
Эквивалентная масса сложного вещества может иметь различные значения в зависимости от характера реакции, в которую вступает данное
вещество, и от того, какой продукт при этом образуется.
Эквивалентная масса кислоты Мэ (кислоты) равна молярной массе кислоты,
деленной на основность кислоты (число атомов водорода, замещенных в
данной реакции на металл).
Мэ (кислоты) = .

6
Например, эквивалентная масса кислоты в реакции
H2SO4 + KOH = KHSO4 + H2O;
Мэ (Н2SO4) = = 98 г/экв,
а в реакции
H2SO4 + Mg = MgSO4
эквивалентная масса той же кислоты вдвое меньше, так как в этой реакции замещено два катиона водорода:
Мэ (H2SO4) = = 49 г/экв.
Эквивалентная масса основания Мэ(основания) равна молярной массе основания, деленной на кислотность этого основания (число гидроксогрупп,
замещенных на кислотный остаток).
Мэ (основания) = .
Например, эквивалентная масса основания Mg(OH)2 в реакции Mg(OH)2
+ HСl = MgOHCl + H2O;
Мэ (Мg(OH)2) = = 58 г/экв,
а в реакции
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
эквивалентная масса того же основания в два раза меньше
Мэ (Мg(OH)2) = = 29 г/экв.
Эквивалентная масса соли Мэ(соли) равна молярной массе соли, деленной на произведение валентности металла (ВМе) на число его атомов (n).
|
Мэ(соли) = |
. |
|||
|
Например, |
||||
|
Мэ (Na2SO4) = |
= 71 г/экв. |
|||
7
Эквивалентная масса оксида равна молярной массе оксида, деленной на произведение валентности элемента ( Вэл) на число его атомов (n).
|
Мэ (оксида) = |
. |
|||
|
Например, |
||||
|
Мэ (Al2O3) = |
= 17 г/экв. |
|||
Молярную массу эквивалента любого сложного соединения можно определить по сумме эквивалентных масс составляющих его частиц. Например:
а) молярная масса гидроксида натрия равна сумме молярных масс
эквивалентов металла и гидроксогруппы, т.е.
Мэ (основания) = Мэ (металла) + Мэ (гидроксогруппы);
Мэ (NaOH) = Mэ (Na+) + Mэ (OH—) = 23 + 17 = 40 г/экв ;
б) эквивалентная масса кислоты равна сумме эквивалентных масс
водорода и кислотных остатков
Мэ (кислоты) = Мэ (Н+) + Мэ (кислотного остатка);
Мэ (H2SO4) = Мэ (Н+) + Мэ (S ) = 1 + 48 = 49 г/экв;
в) эквивалентная масса соли равна сумме эквивалентных масс металла и
кислотного остатка
|
Мэ (соли) = Мэ (металла) + Мэ (кислотного остатка); |
|||||||
|
Мэ (Al2(SO4)3) = Мэ (Al3+) + Mэ (S |
) = |
+ |
= 57 г/экв; |
||||
|
г) эквивалентная масса оксида равна сумме эквивалентных масс |
|||||||
|
кислорода и элемента |
|||||||
|
Мэ (оксида) = Мэ (элемента) + Мэ (кислорода); |
|||||||
|
Мэ (МgO) = Mэ (Mg2+) + Mэ (О2-) = |
+ |
= 20 г/экв. |
|||||

|
8 |
|
|
Закон эквивалентов |
(Рихтер, 1792 г.) |
|
Химические элементы (сложные |
соединения) соединяются или |
замещают друг друга в весовом соотношении, равном отношению их эквивалентных масс
= или = ,
где m1 и m2 – массы реагирующих веществ (г, кг, %).
Если одно из веществ находится в газообразном состоянии, закон эквивалентов записывается следующим образом:
=,
где m1 и Мэ1 – масса и эквивалентная масса твердого или жидкого вещества;
V2 и Vэ2 – объем и молярный объем эквивалента газообразного вещества;
Vэ – молярный объем эквивалента газа (эквивалентный объем) при нормальных условиях. Как известно, моль любого газа при нормальных условиях занимает объем 22,4 л. Так как масса моля водорода равна 2 г, а масса эквивалента – 1 г, то эквивалентный объем водорода будет в два раза меньше
|
молярного, т.е. |
Vэ (Н) = 22,4 : 2 = 11,2 л/экв. |
|||
|
Молярная масса кислорода |
32 г/ моль соответствует объему 22,4 л. Т.к. |
|||
|
эквивалентная масса кислорода – |
8 г/экв, то его эквивалентный объем |
|||
|
Vэ (О) = 22,4 : 4 = 5,6 л/экв; |
||||
|
Vэ = |
. |
|||
Примеры решения задач
Пример 1. Элемент образует гидрид, где его массовая доля 75%.
Определите эквивалентную массу элемента.
Решение. Эквивалентом элемента называется такое его количество,
которое соединяется с одним молем атомов водорода или замещает его в химических реакциях. Массу одного моля эквивалента элемента называют

9
молярной массой эквивалента. Эта задача решается на основе закона эквивалентов, согласно которому химические элементы (сложные вещества)
соединяются между собой или замещают друг друга в количествах,
пропорциональных их молярным массам эквивалентов.
Вычислим массовую долю водорода в гидриде
(Э) = 100% — 75% = 25%.
Согласно закону эквивалентов m(Эл) / m(H) =MЭ(Эл) / MЭ(H) . При образовании 100 г гидрида 25 г водорода соединяются с 75 г элемента. Исходя из этого
MЭ(Эл) = 1 г/моль 75 г / 25 г = 3 г/моль.
Пример 2. При сгорании 15 г металла образуется 28,32 г оксида металла.
Вычислите эквивалентную массу металла.
Решение. Эквивалентная масса кислорода MЭ (О) = 8 г/моль. Масса кислорода в оксиде m (O) = 28,32 — 15,00 = 13,32 г. Тогда согласно закону эквивалентов:
MЭ(Ме) = МЭ(О) m(Me) / m (O) = 8 г/моль 15г / 13,32 г = 9 г/моль.
Пример 3. Рассчитайте молярную массу эквивалента металла, если
1,168 г его вытеснили из кислоты 438 мл водорода, измеренного при 17оС и давлении 98642 Па.
Решение. Приведем объем вытесненного водорода к нормальным условиям, воспользовавшись объединенным газовым уравнением
=,
V0 = P V Т0 / P0 Т = 98642 438 273 / 1,013 10 5 298 = 401,5 мл.
Эквивалентный объем водорода VЭ ( H2 ) = 11,2 л/моль при нормальных условиях, поэтому
m(Me) / V (H2) = MЭ (Ме) / VЭ (H2) ;
MЭ (Me) = 1,168 г 11,2 л/моль / 0,4015 л = 32,58 г/моль.

10
Пример 4. На нейтрализацию 0,471 г фосфористой кислоты израсходовано 0,644 г KOH. Вычислите молярную массу эквивалента кислоты.
Решение. Эквивалентная масса КОН равна ее молярной массе, так как основание содержит одну гидроксогруппу и составит MЭ (КОН) =56 г/моль.
Тогда согласно закону эквивалентов:
m (кислоты) / m (КОН) = MЭ (кислоты) / MЭ (КОН) ;
MЭ (кислоты) = 56 г/моль 0,471 г / 0, 644 г = 40, 96 г/моль.
2. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ
ЭКВИВАЛЕНТНЫХ МАСС
Экспериментально эквивалентные массы соединений могут быть определены несколькими способами:
а) метод прямого определения:
4Al + 3O2 = 2Al2O3;
=;
б) аналитический метод:
– эквивалентная масса определяется по данным анализа, когда известен
количественный состав соединения данного элемента с другим элементом,
эквивалентные масса или объем которого известны.
|
Например, известно, что в хлориде |
соответствующего металла |
|
|
содержится |
20,2 % ( по массе) металла, |
эквивалентная масса хлора |
35,5 г/экв. Нужно определить эквивалентную массу металла.
=, где m (Cl) = 100 – m (Ме);
в) электрохимический метод:
– химический эквивалент определяется на основе закона Фарадея,
согласно которому 96500 Кл электричества выделяют из электролита при электролизе один эквивалент вещества. Закон Фарадея выражается следующим
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение объема водорода
Задача № 11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Та как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 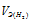
Тогда можно записать:
Отсюда:
Ответ: 1,74г.
Определение эквивалентной массы вещества
Задача № 12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Ответ: 32,6г/моль.
Определение отношения масс реагирующих веществ
Задача № 13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Формула сульфата имеет вид MeSO4, а дигидроортофосфата – MeH2PO4. Таким образом, на образование сульфата затрачивается две эквивалентные массы щёлочи, а на образование дигидроортофосфата – одна эквивалентная масса щёлочи. Так как H2SO4 с двумя эквивалентными массами щёлочи, то её эквивалентная масса в реакции нейтрализации равна М/2 г/моль, а фосфорная кислота реагирует с одной эквивалентной массой щёлочи, то её эквивалентная масса равна М/1г/моль. Отсюда, отношение мас этих кислот, с учётом, что их молекулярные массы равны будет иметь вид:
mH2SO4 : mH3PO4 = ½M : 1M = 1 : 2
Это можно подтвердить уравнениями реакций нейтрализации этих кислот с гидроксидом натрия:
H2SO4 +2NaOH = Na2SO4 + 2H2O;
H3PO4 + NaOH = NaH2PO4 +H2O.
Ответ: mH2SO4 : mH3PO4 = 1 : 2.
Задача № 14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Согласно закону эквивалентов 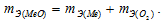
Таким образом, валентность меди в первом оксиде равна II, а во втором – I.
Ответ: 2 : 1.
Определение значения эквивалентной массы вещества
Задача № 15
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты.
Решение:
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Эквивалент (эквивалентная масса) кислоты равна мольной массе (М) делённой на число атомов водорода, замещённых в данной реакции на металл (на число вступающих в реакцию атомов водорода). Так как при взаимодействии ортофосфорной кислоты со щёлочью образовалась соль Na2HPO4, т.е. на натрий заместилось два атома водорода в кислоте H3PO4. Следовательно, эквивалентная масса ортофосфорной кислоты в реакции со щёлочью при образовании гидрофосфата натрия равна М/2 = М(H3PO4)/2 = 98/ 2 = 49г/моль.
Ответ: 49г/моль.
Задача № 16
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Эквивалентная масса гидроксида натрия равна М(NaOH)0/1 = 40г/моль.
Тогда
Ответ: 49г/моль.
Задача № 17
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Эквивалентная масса хлороводорода равна М(HCl) = 36,5/1 = 36,5г/моль.
Тогда
а) Находим эквивалентную массу вещества:
б) Находим эквивалентную массу соли:
Ответ: а) 58,4г/моль; б) 78,97 г/моль.
Определение эквивалентного объема водорода
Задача № 18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Если одно из веществ находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Ответ: 11,2л/моль.
КОМИТЕТ
ОБРАЗОВАНИЯ ГОРОДА КУРСКА
муниципальное
бюджетное общеобразовательное учреждение
«Средняя
общеобразовательная школа № 50
имени Юрия Алексеевича Гагарина»
305018,
г. Курск, ул. Серегина, д.12
тел. 38-34-14,
37-94-55. E – mail: kursk50@yandex.ru
МЕТОДИЧЕСКАЯ
РАЗРАБОТКА УРОКА ХИМИИ
в
8 классе. Факультатив.
Урок
— лекция
Тема
«Понятие эквивалент. Лекция № 1»
Выполнила:
Березанская
Юлия Александровна, учитель химии
Курск
2020
Цели:
·
углубление
знаний по химии;
·
развитие
способностей и интереса к химии;
·
развитие умений
самостоятельной добычи знаний;
·
профессиональная
ориентация учащихся.
Задачи:
Образовательные:
·
познакомить с понятиями
эквивалент, фактор эквивалентности, закон эквивалентов;
·
научить решать задачи,
используя для расчетов эквиваленты;
·
повторить и закрепить знания о
структурных формулах молекул веществ, валентности;
Воспитательные:
·
развивать настойчивость и
умение преодолевать трудности для достижения намеченной цели;
Развивающие:
·
формирование способностей
сравнительного анализа;
·
умение находить оптимальные
решения;
·
прививать интерес к нахождению
новых рациональных способов решения классических задач.
Тип урока: дистанционные образовательные технологии, вводный урок.
Вид урока: урок-лекция.
Межпредметные
связи: математика.
Педагогические
технологии: организация самостоятельной
деятельности школьников.
Результаты:
понимание учениками смысла понятий эквивалент, фактор эквивалентности, закон
эквивалентов. Умение применять расчеты с использованием эквивалентов в решении классических
задач.
Материалы: конспект лекции.
Ход урока.
Понятие эквивалент
современным школьникам не изучается, но использование эквивалента очень
облегчает решение многих задач.
Не
будем пока вводить новые понятия и определения. Рассмотрим рисунки:
Рис 1. Молекула воды. Рис.2.
Молекула аммиака. Рис. 3. Молекула метана
Хорошо видно, что в образовании одной
связи в молекуле воды (рис.1) участвует целая часть атома водорода и половина
(1/2 часть) атома кислорода, в молекуле аммиака (рис.2) в образовании одной
связи участвует один целый атом водорода и треть (1/3 часть) атома азота, в
молекуле метана (рис.3) в образовании одной связи участвует один целый атом
водорода и четверть (1/4 часть) атома углерода.
Рассмотрим дроби
1/2,1/3, 1/4. В знаменателе каждой дроби стоит число, по значению и смыслу- это
валентность атома: кислорода-II, азота-III, углерода-IV. Это число называется эквивалентным
числом, обозначают Z, а значение 1/ Z – называют фактором
эквивалентности. Он показывает долю атома, которая в реакциях
ионного обмена равноценна одному целому атому водорода (или доля атома, которая
участвует в образовании одной связи с одним атомом водорода).
Эквивалент-это
реальная или условная частица (или доля реальной частицы), которая в
кислотно-основных реакциях и реакциях ионного обмена равноценна одному иону
водорода Н+ или одному иону ОН—.
В
расчетах мы пользуемся массами эквивалентов или количеством вещества
эквивалентов.
Масса эквивалента–
это и есть масса доли атома, рассчитываем массу доли так: делим массу атома на эквивалентное
число (валентность атома в соединении).
Если молярную
массу эквивалента атома обозначить Мэкв, то получим формулу: Мэкв=
Или молярную массу
атома умножаем на фактор эквивалентности, что математически не меняет смысла
расчетов:
Мэкв=М*1/
Z
Разберем на примере молекул воды, аммиака,
метана:
Мэкв(О)=16г/моль *1/2=8г/моль, тогда масса
эквивалента кислорода 8 г/моль,
Мэкв(N)=14г/моль
*1/3=14/3 г/моль, тогда масса эквивалента азота 14/3 г/моль,
Мэкв(С)=12г/моль *1/4=3г/моль, тогда масса
эквивалента углерода 3 г/моль,
Мэкв(Н)=1г/моль*1/1=1г/моль, тогда масса
эквивалента водорода 1г/моль.
Введение
в химию понятия «эквивалент» произошло в конце 18 – начале 19 века. Понятие эквивалент
вытекает из закона постоянства состава:
элементы
соединяются друг с другом в строго определенных количественных соотношениях.
С
введением понятия «моль» как единицы количества вещества появилось
соответствующее
определение эквивалента.
Эквивалент
элемента – это такое его количество, которое
соединяется с одним молем атомов водорода или замещает то же количество атомов
водорода в химических реакциях.
Закон эквивалентов
сформулирован так:
массы (объемы)
реагирующих друг с другом веществ пропорциональны их эквивалентным массам
(объемам)
или можно
сформулировать кратко:
Вещества реагируют
и образуются согласно их эквивалентам.
Для реакции aA
+ bB
= cC
+dD
закон эквивалентных отношений выглядит так:
=
или
=
Как
видим, посчитать эквивалентные массы не сложно, а в расчетах не надо учитывать
коэффициенты.
Теперь рассмотрим задачу
4 из Пригласительного этапа олимпиады школьников Сириус:
Задание 4. Одно и
то же количество вещества металла реагирует с 1,68г кислорода и 26,67 г
галогена. Определите галоген, если известно, что валентность металла в оксиде и
галогениде одна и та же. В ответе запишите химический знак элемента.
Решение. По закону
эквивалентных отношений:
m(О2),
m(Hal2)
даны по условию, молярную массу эквивалента кислорода рсчитаем Mэкв(О)
=16/2=8, молярную массу галогена выразим и рассчитаем
г/моль
Зная молярную массу эквивалента галогена,
найдем молярную массу атома галогена: М=127*1=127г/моль, это йод
Ответ: I
Используя понятие эквивалент, можно решить
и задачу 11 этой же Олимпиады.
Задание 11. 22,1 г оксида металла,
известного человечеству с древности, полностью восстановили до простого
вещества, используя 3,36 л (н. у.) водорода. Определите металл, в ответе
запишите его порядковый номер.
Для
газообразных соединений пользуются эквивалентным объемом
Эквивалентный объем — это объем, который занимает 1 эквивалент
рассматриваемого газообразного вещества.
Измеряется эквивалентный объем в л/моль. Поскольку 1 эквивалент
водорода (атомарного) составляет половину 1 моля молекулярного водорода, то
эквивалентный объем водорода при нормальных условиях равен половине мольного
объема, т.е. 11,2 л/моль. Соответственно, эквивалентный объем кислорода равен
5,6 л/моль, так как эквивалент кислорода равен 1/4 моля (два атома, каждый с
валентностью II).
Закон
эквивалентных отношений с участием газообразных веществ можно записать так:
=
, где
-это объем газа, а
В оксидах: масса эквивалентов
оксида равна сумме эквивалентов металла и кислорода
Мэкв(МеО)=Мэкв(Ме)+Мэкв(О)
(эквиваленты
сложных веществ мы рассмотрим на следующем уроке)
Решение.
По закону эквивалентных отношений: =
, подставим в формулу и решим относительно Мэкв(Ме):
Мэкв(Ме)=
Мы получили эквивалентную массу металла, но по условию нам не дана
валентность металла, тогда рассуждаем, если металл одновалентный, то ищем в
таблице металл с массой 65,67, не находим. Если металл двухвалентный, то ищем
металл с массой 65,67*2=131,34:ксенон он-не металл. Дальше предполагаем
валентность три: 65,67*3=197. Это золото и полностью удовлетворяет условию
задачи.
Ответ: 79.
Для закрепления предлагаю решить подобные
задачи:
1. Расчитайте
молярную массу эквивалентов некоторого неметалла (неМе), если известно, что его
образец массой 1,0 г полностью сгорает в кислороде, масса которого также равна
1,0г. Назовите неметалл, если степень его окисления в оксиде равна +4.
Ответ: сера.
2. При
растворении в кислоте некоторого металла массой 1,8г выделилось 2,24л водорода.
Определите молярную массу эквивалентов этого металла.
Ответ: 9г/моль
Справочник
урока:
Закон постоянства
состава:
элементы
соединяются друг с другом в строго определенных количественных соотношениях.
Z — эквивалентное
число- валентность атома
1/ Z – фактором
эквивалентности- доля атома, которая участвует в
образовании одной связи с одним атомом водорода.
Эквивалент —это
реальная или условная частица (или доля реальной частицы), которая в
кислотно-основных реакциях и реакциях ионного обмена равноценна одному иону
водорода Н+ или одному иону ОН—.
Эквивалент
элемента – это такое его количество, которое
соединяется с одним молем атомов водорода или замещает то же количество атомов
водорода в химических реакциях.
Закон эквивалентов:
массы (объемы)
реагирующих друг с другом веществ пропорциональны их эквивалентным массам
(объемам)
или кратко: Вещества реагируют и образуются
согласно их эквивалентам.
Мэкв(А)=М(А)/Z, nэкв(А)=n(A)/Z
Закон эквивалентов:
вещества реагируют и образуются согласно их эквивалентам.
Для реакции aA + bB
= cC
+dD:
=
или
=
Эквивалентный объем — это объем, который занимает 1 эквивалент
рассматриваемого газообразного вещества.
Закон
эквивалентных отношений, если один из участников процесса- газ: 
В оксидах: масса
эквивалентов оксида равна сумме эквивалентов металла и кислорода
Мэкв(МеО)=Мэкв(Ме)+Мэкв(О)
На следующем уроке мы
рассмотрим эквиваленты сложных веществ: оксидов, кислот, оснований, солей,
рассмотрим способы решения задач на процентное содержание атомов с помощью
эквивалентов.
До встречи!