|
Посмотрим на гениальную таблицу «Периодическая система элементов» от русского ученого Дмитрия Менделеева. Таблица Дмитрия Менделеева весьма стройная и системная. Она отвечает на многие вопросы, в том числе и на заданный вами. Максимальное число электронов на энергетическом уровне: где n — номер энергетического уровня система выбрала этот ответ лучшим Вита75 8 лет назад Таблица Менделеева состоит из 8-ми столбцов, соответственно элементы в 1-ом столбце будут иметь по 1 электрону на внешнем слое , а в 8-ом по 8. Собственно количество электронов и определяет свойства элемента, (например щелчные металлы очень активны, а энертвые газы наоборот фактически не вступают ни в какие реакции). это связано с тем, что чем меньше электронов на внешнем слое тем их легче потерять, и труднее захватить свободный электрон при потере. Так же есть такие элементы как изотопы, которые при одинаковом количестве электронов на внешней оболочке имеют кординально разные свойства. (например дейтерий и тритий) оба имеют по 1-му электрону, но ядро дейтерия состоит из положительно заряженного протона и нейтрального нейтрона, он стабилен и относится скорее к водороду (тяжелый водород), а тритий, состоящий из протона и 2-ух нейтронов, радиактивен и по свойствам ближе к литию. В порироде не встречается из-за короткой живучести (период полураспада примерно 12 лет). Так к слову, есть такой изотоп кальция 48, имеется в виду что у него не 40 нейтронов в ядре как у обычного кальция у нас в костях, а 48, радиактивен, (в природе встречается крайне редко), нарабатывается в атомных реакторах, обстрелом нейтронами, несколько грамм за год. Служит для получения сверхтяжелых элементов (путем обстрела мишени из урана, плутония и т.д.). на данный момент самый дорогой элемент, 1 грамм стоит около 400000 евро. Чосик более года назад Для этого потребуется таблица Менделеева. В ней восемь групп, которые представлены как восемь столбиков. И как раз номер группы указывает, сколько электронов у элемента на последнем внешнем уровне. Например, берем водород — Н. Он относится к первой группе, идет первым. А мы знаем, что порядковый номер элемента совпадает с числом электронов на обиталях и с числом протонов в ядре. И у водорода на s-орбитали один электрон. Теперь берем литий — Li. Он также относится к первой группе, идет третьим. Его s-орбиталь заполнена, там два электрона. А последний, третий, находится на второй s-орбитали. Номер же периода указывается на число энергетических уровней. Литий относится ко второму периоду, потому у него два энергетических уровня. KritikSPb 4 года назад Чтобы определить, сколько электронов на внешнем энергетическом уровне, нужно открыть Периодическую таблицу Менделеева. В ней расположено 8 групп элементов. Номера группы и соответствуют количеству электронов на внешнем уровне. Например, элементы Гелий, аргон, железо, криптон, рутений, ксенон, осмий и радон принадлежат к восьмой группе, значит и электронов на внешнем уровне 8. У лития, натрия и калия — по одному электрону, у берилия, магния и кальция — 2, у алюминия — 3, у кремния и титана — по 4, у серы и хрома — по 6, у хлора и марганца — 7. Далее определяем электронные уровни элементов по аналогии. владсандрович более года назад Для решения данной задачи, нам просто необходимо, будет взглянуть в таблицу Менделеева. Она насчитывает в себе восемь групп. Они расположены в порядке восьми столбиков. Каждая группа имеет свой номер и этот самый номер как раз таки и говорит нам о том , сколько электронов имеет в себе тот или иной элемент, касательно его последнего внешнего уровня. Например железо относится к восьмой группе, а значит электронов на внешнем уровне оно имеет именно 8. Знаете ответ? |
Загрузить PDF
Загрузить PDF
Электронная конфигурация атома — это численное представление его электронных орбиталей. Электронные орбитали — это области различной формы, расположенные вокруг атомного ядра, в которых математически вероятно нахождение электрона. Электронная конфигурация помогает быстро и с легкостью сказать читателю, сколько электронных орбиталей есть у атома, а также определить количество электронов, находящихся на каждой орбитали. Прочитав эту статью, вы освоите метод составления электронных конфигураций.
-
1
Найдите атомный номер вашего атома. Каждый атом имеет определенное число электронов, связанных с ним. Найдите символ вашего атома в таблице Менделеева. Атомный номер — это целое положительное число, начинающееся от 1 (у водорода) и возрастающее на единицу у каждого последующего атома. Атомный номер — это число протонов в атоме, и, следовательно, это еще и число электронов атома с нулевым зарядом.
-
2
Определите заряд атома. Нейтральные атомы будут иметь столько же электронов, сколько показано в таблице Менделеева. Однако заряженные атомы будут иметь большее или меньшее число электронов — в зависимости от величины их заряда. Если вы работаете с заряженным атомом, добавляйте или вычитайте электроны следующим образом: добавляйте один электрон на каждый отрицательный заряд и вычитайте один на каждый положительный.
- Например, атом натрия с зарядом -1 будет иметь дополнительный электрон в добавок к своему базовому атомному числу 11. Иначе говоря, в сумме у атома будет 12 электронов.
- Если речь идет об атоме натрия с зарядом +1, от базового атомного числа 11 нужно отнять один электрон. Таким образом, у атома будет 10 электронов.
-
3
Запомните базовый список орбиталей. По мере того, как у атома увеличивается число электронов, они заполняют различные подуровни электронной оболочки атома согласно определенной последовательности. Каждый подуровень электронной оболочки, будучи заполненным, содержит четное число электронов. Имеются следующие подуровни:
- s-подуровень (любое число в электронной конфигурации, которое стоит перед буквой «s») содержит единственную орбиталь, и, согласно Принципу Паули, одна орбиталь может содержать максимум 2 электрона, следовательно, на каждом s-подуровне электронной оболочки может находиться 2 электрона.
- p-подуровень содержит 3 орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.
- g-, h-, i- и k-подуровни являются теоретическими. Атомы, содержащие электроны в этих орбиталях, неизвестны. g-подуровень содержит 9 орбиталей, поэтому теоретически в нем может быть 18 электронов. В h-подуровне может быть 11 орбиталей и максимум 22 электрона; в i-подуровне —13 орбиталей и максимум 26 электронов; в k-подуровне — 15 орбиталей и максимум 30 электронов.
- Запомните порядок орбиталей с помощью мнемонического приема:[1]
Sober Physicists Don’t Find Giraffes Hiding In Kitchens (трезвые физики не находят жирафов, скрывающихся на кухнях).
-
4
Разберитесь в записи электронной конфигурации. Электронные конфигурации записываются для того, чтобы четко отразить количество электронов на каждой орбитали. Орбитали записываются последовательно, причем количество атомов в каждой орбитали записывается как верхний индекс справа от названия орбитали. Завершенная электронная конфигурация имеет вид последовательности обозначений подуровней и верхних индексов.
- Вот, например, простейшая электронная конфигурация: 1s2 2s2 2p6. Эта конфигурация показывает, что на подуровне 1s имеется два электрона, два электрона — на подуровне 2s и шесть электронов на подуровне 2p. 2 + 2 + 6 = 10 электронов в сумме. Это электронная конфигурация нейтрального атома неона (атомный номер неона — 10).
-
5
Запомните порядок орбиталей. Имейте в виду, что электронные орбитали нумеруются в порядке возрастания номера электронной оболочки, но располагаются по возрастанию энергии. Например, заполненная орбиталь 4s2 имеет меньшую энергию (или менее подвижна), чем частично заполненная или заполненная 3d10, поэтому сначала записывается орбиталь 4s. Как только вы будете знать порядок орбиталей, вы сможете с легкостью заполнять их в соответствии с количеством электронов в атоме. Порядок заполнения орбиталей следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Электронная конфигурация атома, в котором заполнены все орбитали, будет иметь следующий вид: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d107p6
- Обратите внимание, что приведенная выше запись, когда заполнены все орбитали, является электронной конфигурацией элемента Uuo (унуноктия) 118, атома периодической системы с самым большим номером. Поэтому данная электронная конфигурация содержит все известные в наше время электронные подуровни нейтрально заряженного атома.
-
6
Заполняйте орбитали согласно количеству электронов в вашем атоме. Например, если мы хотим записать электронную конфигурацию нейтрального атома кальция, мы должны начать с поиска его атомного номера в таблице Менделеева. Его атомный номер — 20, поэтому мы напишем конфигурацию атома с 20 электронами согласно приведенному выше порядку.
- Заполняйте орбитали согласно приведенному выше порядку, пока не достигнете двадцатого электрона. На первой 1s орбитали будут находится два электрона, на 2s орбитали — также два, на 2p — шесть, на 3s — два, на 3p — 6, и на 4s — 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Иными словами, электронная конфигурация кальция имеет вид: 1s2 2s2 2p6 3s2 3p6 4s2.
- Обратите внимание: орбитали располагаются в порядке возрастания энергии. Например, когда вы уже готовы перейти на 4-й энергетический уровень, то сначала записывайте 4s орбиталь, а затем 3d. После четвертого энергетического уровня вы переходите на пятый, на котором повторяется такой же порядок. Это происходит только после третьего энергетического уровня.
-
7
Используйте таблицу Менделеева как визуальную подсказку. Вы, вероятно, уже заметили, что форма периодической системы соответствует порядку электронных подуровней в электронных конфигурациях. Например, атомы во второй колонке слева всегда заканчиваются на «s2«, а атомы на правом краю тонкой средней части оканчиваются на «d10» и т.д. Используйте периодическую систему как визуальное руководство к написанию конфигураций — как порядок, согласно которому вы добавляете к орбиталям соответствует вашему положению в таблице. Смотрите ниже:
- В частности, две самые левые колонки содержат атомы, чьи электронные конфигурации заканчиваются s-орбиталями, в правом блоке таблицы представлены атомы, чьи конфигурации заканчиваются p-орбиталями, а в нижней части атомы заканчиваются f-орбиталями.
- Например, когда вы записываете электронную конфигурацию хлора, размышляйте следующим образом: «Этот атом расположен в третьем ряду (или «периоде») таблицы Менделеева. Также он располагается в пятой группе орбитального блока p периодической системы. Поэтому, его электронная конфигурация будет заканчиваться на …3p5
- Обратите внимание: элементы в области орбиталей d и f таблицы характеризуются энергетическими уровнями, которые не соответствуют периоду, в котором они расположены. Например, первый ряд блока элементов с d-орбиталями соответствует 3d орбиталям, хотя и располагается в 4 периоде, а первый ряд элементов с f-орбиталями соответствует орбитали 4f, несмотря на то, что он находится в 6 периоде.
-
8
Выучите сокращения написания длинных электронных конфигураций. Атомы на правом краю периодической системы называются благородными газами. Эти элементы химически очень устойчивы. Чтобы сократить процесс написания длинных электронных конфигураций, просто записывайте в квадратных скобках химический символ ближайшего благородного газа с меньшим по сравнению с вашим атомом числом электронов, а затем продолжайте писать электронную конфигурацию последующих орбитальных уровней. Смотрите ниже:
- Чтобы понять эту концепцию, полезно будет написать пример конфигурации. Давайте напишем конфигурацию цинка (атомный номер 30), используя сокращение, включающее благородный газ. Полная конфигурация цинка выглядит так: 1s2 2s2 2p6 3s2 3p6 4s2 3d10. Однако мы видим, что 1s2 2s2 2p6 3s2 3p6 — это электронная конфигурация аргона, благородного газа. Просто замените часть записи электронной конфигурации цинка химическим символом аргона в квадратных скобках ([Ar].)
- Итак, электронная конфигурация цинка, записанная в сокращенном виде, имеет вид: [Ar]4s2 3d10.
- Учтите, если вы пишете электронную конфигурацию благородного газа, скажем, аргона, писать [Ar] нельзя! Нужно использовать сокращение благородного газа, стоящего перед этим элементом; для аргона это будет неон ([Ne]).
Реклама
-
1
Освойте периодическую таблицу ADOMAH. Данный метод записи электронной конфигурации не требует запоминания, однако требует наличия переделанной периодической таблицы, поскольку в традиционной таблице Менделеева, начиная с четвертого периода, номер периода не соответствует электронной оболочке. Найдите периодическую таблицу ADOMAH — особый тип периодической таблицы, разработанный ученым Валерием Циммерманом. Ее легко найти посредством короткого поиска в интернете.[2]
- В периодической таблице ADOMAH горизонтальные ряды представляют группы элементов, такие как галогены, инертные газы, щелочные металлы, щелочноземельные металлы и т.д. Вертикальные колонки соответствуют электронным уровням, а так называемые «каскады» (диагональные линии, соединяющие блоки s,p,d и f) соответствуют периодам.
- Гелий перемещен к водороду, поскольку оба этих элемента характеризуются орбиталью 1s. Блоки периодов (s,p,d и f) показаны с правой стороны, а номера уровней приведены в основании. Элементы представлены в прямоугольниках, пронумерованных от 1 до 120. Эти номера являются обычными атомными номерами, которые представляют общее количество электронов в нейтральном атоме.
-
2
Найдите ваш атом в таблице ADOMAH. Чтобы записать электронную конфигурацию элемента, найдите его символ в периодической таблице ADOMAH и вычеркните все элементы с большим атомным номером. Например, если вам нужно записать электронную конфигурацию эрбия (68), вычеркните все элементы от 69 до 120.
- Обратите внимание на номера от 1 до 8 в основании таблицы. Это номера электронных уровней, или номера колонок. Игнорируйте колонки, которые содержат только вычеркнутые элементы. Для эрбия остаются колонки с номерами 1,2,3,4,5 и 6.
-
3
Посчитайте орбитальные подуровни до вашего элемента. Смотря на символы блоков, приведенные справа от таблицы (s, p, d, and f), и на номера колонок, показанные в основании, игнорируйте диагональные линии между блоками и разбейте колонки на блоки-колонки, перечислив их по порядку снизу вверх. И снова игнорируйте блоки, в которых вычеркнуты все элементы. Запишите блоки-колонки, начиная от номера колонки, за которым следует символ блока, таким образом: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (для эрбия).
- Обратите внимание: Приведенная выше электронная конфигурация Er записана в порядке возрастания номера электронного подуровня. Ее можно также записать в порядке заполнения орбиталей. Для этого следуйте по каскадам снизу вверх, а не по колонкам, когда вы записываете блоки-колонки: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12.
-
4
Посчитайте электроны для каждого электронного подуровня. Подсчитайте элементы, в каждом блоке-колонке которые не были вычеркнуты, прикрепляя по одному электрону от каждого элемента, и запишите их количество рядом с символом блока для каждого блока-колонки таким образом: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12 5s2 5p6 6s2. В нашем примере это электронная конфигурация эрбия.
-
5
Учитывайте неправильные электронные конфигурации. Существует восемнадцать типичных исключений, относящихся к электронным конфигурациям атомов в состоянии с наименьшей энергией, также называемом основным энергетическим состоянием. Они не подчиняются общему правилу только по последним двум-трем положениям, занимаемым электронами. При этом действительная электронная конфигурация предполагает нахождение электронов в состоянии с более низкой энергией в сравнении со стандартной конфигурацией атома. К атомам-исключениям относятся:
- Cr (…, 3d5, 4s1); Cu (…, 3d10, 4s1); Nb (…, 4d4, 5s1); Mo (…, 4d5, 5s1); Ru (…, 4d7, 5s1); Rh (…, 4d8, 5s1); Pd (…, 4d10, 5s0); Ag (…, 4d10, 5s1); La (…, 5d1, 6s2); Ce (…, 4f1, 5d1, 6s2); Gd (…, 4f7, 5d1, 6s2); Au (…, 5d10, 6s1); Ac (…, 6d1, 7s2); Th (…, 6d2, 7s2); Pa (…, 5f2, 6d1, 7s2); U (…, 5f3, 6d1, 7s2); Np (…, 5f4, 6d1, 7s2) и Cm (…, 5f7, 6d1, 7s2).
Реклама
Советы
- Чтобы найти атомный номер атома, когда он записан в форме электронной конфигурации, просто сложите все числа, которые идут за буквами (s, p, d, и f). Это работает только для нейтральных атомов, если вы имеете дело с ионом, то ничего не получится — вам придется добавить или вычесть количество дополнительных или потерянных электронов.
- Число, идущее за буквой — это верхний индекс, не сделайте ошибку в контрольной.
- «Стабильности полузаполненного» подуровня не существует. Это упрощение. Любая стабильность, которая относится к «наполовину заполненным» подуровням, имеет место из-за того, что каждая орбиталь занята одним электроном, поэтому минимизируется отталкивание между электронами.
- Каждый атом стремится к стабильному состоянию, а самые стабильные конфигурации имеют заполненные подуровни s и p (s2 и p6). Такая конфигурация есть у благородных газов, поэтому они редко вступают в реакции и в таблице Менделеева расположены справа. Поэтому, если конфигурация заканчивается на 3p4, то для достижения стабильного состояния ей необходимо два электрона (чтобы потерять шесть, включая электроны s-подуровня, потребуется больше энергии, поэтому потерять четыре легче). А если конфигурация оканчивается на 4d3, то для достижения стабильного состояния ей необходимо потерять три электрона. Кроме того, полузаполненные подуровни (s1, p3, d5..) являются более стабильными, чем, например, p4 или p2; однако s2 и p6 будут еще более устойчивыми.
- Когда вы имеете дело с ионом, это значит, что количество протонов не равно количеству электронов. Заряд атома в этом случае будет изображен сверху справа (как правило) от химического символа. Поэтому атом сурьмы с зарядом +2 имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1. Обратите внимание, что 5p3 изменилось на 5p1. Будьте внимательны, когда конфигурация нейтрального атома заканчивается на подуровни, отличные от s и p. Когда вы забираете электроны, вы можете забрать их только с валентных орбиталей (s и p орбиталей). Поэтому, если конфигурация заканчивается на 4s2 3d7 и атом получает заряд +2, то конфигурация будет заканчиваться 4s0 3d7. Обратите внимание, что 3d7 не меняется, вместо этого теряются электроны s-орбитали.
- Существуют условия, когда электрон вынужден «перейти на более высокий энергетический уровень». Когда подуровню не хватает одного электрона до половинной или полной заполненности, заберите один электрон из ближайшего s или p- подуровня и переместите его на тот подуровень, которому необходим электрон.
- Имеется два варианта записи электронной конфигурации. Их можно записывать в порядке возрастания номеров энергетических уровней или в порядке заполнения электронных орбиталей, как было показано выше для эрбия.
- Также вы можете записывать электронную конфигурацию элемента, записав лишь валентную конфигурацию, которая представляет собой последний s и p подуровень. Таким образом, валентная конфигурация сурьмы будет иметь вид 5s2 5p3.
- Ионы не то же самое. С ними гораздо сложнее. Пропустите два уровня и действуйте по той же схеме в зависимости от того, где вы начали, и от того, насколько велико количество электронов.
Реклама
Об этой статье
Эту страницу просматривали 483 789 раз.
Была ли эта статья полезной?
Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень (электронный слой).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно (2n²), где (n )— его номер. Значит, на первом уровне может находиться не более (2) электронов, на втором — не более (8), на третьем — не более (18) и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
У следующих элементов второго периода электроны добавляются на второй уровень:
;
B5)2)3
;
C6)2)4
;
N7)2)5
;
O8)2)6
;
F9)2)7
;
Ne10)2)8
.
У неона второй электронный слой завершён, так как содержит (8) электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
;
Mg12)2)8)2
;
Al13)2)8)3
;
Si14)2)8)4
;
P15)2)8)5
;
S16)2)8)6
;
Cl17)2)8)7
;
Ar18)2)8)8
.
Максимальное количество электронов на третьем слое равно (18), но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более (8) электронов.
Обрати внимание!
На внешнем электронном слое не может быть более (8) электронов.
У элементов четвёртого периода начинается заполнение четвёртого энергетического уровня:
;
Ca20)2)8)8)2
.
Полностью четвёртый электронный слой заполняется, как и в малых периодах, у инертного газа криптона.
Электронная конфигурация атома
Электронная конфигурация атома — это формула, показывающая расположение электронов в атоме по уровням и
подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и
сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали
одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему.
Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может
превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину.
Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо
изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном
состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество
протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов — 16й элемент периодической
системы. Золото имеет 79 протонов — 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном
состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются
квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин «орбиталь», орбиталь — это волновая функция электрона,
грубо — это область, в которой электрон проводит 90% времени.
N — уровень
L — оболочка
Ml — номер орбитали
Ms — первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии,
облако принимает четыре основных формы: шар, гантели и другие две, более сложные.
В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой.
На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f)
орбиталей. Орбитальное квантовое число — это оболочка, на которой находятся
орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно
принимает значения 0,1,2 или 3.
На s-оболочке одна орбиталь (L=0) — два электрона
На p-оболочке три орбитали (L=1) — шесть электронов
На d-оболочке пять орбиталей (L=2) — десять электронов
На f-оболочке семь орбиталей (L=3) — четырнадцать электронов
Магнитное квантовое число ml
На p-оболочке находится три орбитали, они обозначаются цифрами
от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали «-1», «0» и «1».
Магнитное квантовое число обозначается буквой ml.
Внутри оболочки электронам легче
располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую
орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять
электронов заполняют оболочку принимая значения Ml=-2,Ml=-1,Ml=0,
Ml=1,Ml=2.
Спиновое квантовое число ms
Спин — это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число
имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с
противоположными спинами. Спиновое квантовое число обозначается ms
Главное квантовое число n
Главное квантовое число — это уровень энергии, на данный момент известны семь энергетических уровней,
каждый обозначается арабской цифрой: 1,2,3,…7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
Номер электрона
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой
позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне
распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0,
магнитное квантовое число может принять только одно значение, Ml=0 и спин будет равен +1/2.
Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут:
N=2, L=1, M=-1, спин 1/2.
Энергетические уровни с подуровнями для наглядности изображены ниже, сверху вниз расположены уровни
и цветом разделены подуровни:
| 1 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
| 8 | |||||||||||||||||||
| Таблица 1. Распределение электронов по энергетическим уровням |
Здесь, сверху-вниз показаны энергетические уровни (1-7), слева-направо разделены по группам электронные
подуровни (s,p,d,f), в каждой ячейке располагаются по два электрона в противоположных направлениях. Общий
принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного
и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то
сначала заполняется уровень с меньшим главным квантовым числом N.
У некоторых элементов имеются отклонения в формировании электронной конфигурации, а именно у
24Cr,
29Cu,
41Nb,
42Mo,
44Ru,
45Rh,
46Pd,
47Ag,
78Pt,
79Au
Элементы
Проверьте себя, составьте электронную конфигурацию для элементов #6, #11 и #17, затем проверьте себя по таблице ниже.
| № | Элемент | Название | Электронная конфигурация | Энергетических уровней |
|---|---|---|---|---|
| 1 | H | водород | 1s 1 | 1 |
| 2 | He | гелий | 1s 2 | 1 |
| 3 | Li | литий | 1s 22s 1 | 2 |
| 4 | Be | бериллий | 1s 22s 2 | 2 |
| 5 | B | бор | 1s 22s 22p 1 | 2 |
| 6 | C | углерод | 1s 22s 22p 2 | 2 |
| 7 | N | азот | 1s 22s 22p 3 | 2 |
| 8 | O | кислород | 1s 22s 22p 4 | 2 |
| 9 | F | фтор | 1s 22s 22p 5 | 2 |
| 10 | Ne | неон | 1s 22s 22p 6 | 2 |
| 11 | Na | натрий | 1s 22s 22p 63s 1 | 3 |
| 12 | Mg | магний | 1s 22s 22p 63s 2 | 3 |
| 13 | Al | алюминий | 1s 22s 22p 63s 23p1 | 3 |
| 14 | Si | кремний | 1s 22s 22p 63s 23p2 | 3 |
| 15 | P | фосфор | 1s 22s 22p 63s 23p3 | 3 |
| 16 | S | сера | 1s 22s 22p 63s 23p4 | 3 |
| 17 | Cl | хлор | 1s 22s 22p 63s 23p5 | 3 |
| 18 | Ar | аргон | 1s 22s 22p 63s 23p6 | 3 |
| 19 | K | калий | 1s 22s 22p 63s 23p64s 1 | 4 |
| 20 | Ca | кальций | 1s 22s 22p 63s 23p64s 2 | 4 |
| 21 | Sc | скандий | 1s 22s 22p 63s 23p64s 23d1 | 4 |
| 22 | Ti | титан | 1s 22s 22p 63s 23p64s 23d2 | 4 |
| 23 | V | ванадий | 1s 22s 22p 63s 23p64s 23d3 | 4 |
| 24 | Cr | хром | 1s 22s 22p 63s 23p64s 13d5 | 4 |
| 25 | Mn | марганец | 1s 22s 22p 63s 23p64s 23d5 | 4 |
| 26 | Fe | железо | 1s 22s 22p 63s 23p64s 23d6 | 4 |
| 27 | Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 | 4 |
| 28 | Ni | никель | 1s 22s 22p 63s 23p64s 23d8 | 4 |
| 29 | Cu | медь | 1s 22s 22p 63s 23p64s 13d10 | 4 |
| 30 | Zn | цинк | 1s 22s 22p 63s 23p64s 23d10 | 4 |
| 31 | Ga | галлий | 1s 22s 22p 63s 23p64s 23d104p1 | 4 |
| 32 | Ge | германий | 1s 22s 22p 63s 23p64s 23d104p2 | 4 |
| 33 | As | мышьяк | 1s 22s 22p 63s 23p64s 23d104p3 | 4 |
| 34 | Se | селен | 1s 22s 22p 63s 23p64s 23d104p4 | 4 |
| 35 | Br | бром | 1s 22s 22p 63s 23p64s 23d104p5 | 4 |
| 36 | Kr | криптон | 1s 22s 22p 63s 23p64s 23d104p6 | 4 |
| 37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 | 5 |
| 38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 | 5 |
| 39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 | 5 |
| 40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 | 5 |
| 41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 | 5 |
| 42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 | 5 |
| 43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 | 5 |
| 44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 | 5 |
| 45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 | 5 |
| 46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p64d10 | 5 |
| 47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 | 5 |
| 48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 | 5 |
| 49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 | 5 |
| 50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 | 5 |
| 51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s24d105p3 | 5 |
| 52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 | 5 |
| 53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 | 5 |
| 54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 | 5 |
| 55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 | 6 |
| 56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 | 6 |
| 57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 | 6 |
| 58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 | 6 |
| 59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 | 6 |
| 60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 | 6 |
| 61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 | 6 |
| 62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 | 6 |
| 63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 | 6 |
| 64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 | 6 |
| 65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 | 6 |
| 66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 | 6 |
| 67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 | 6 |
| 68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 | 6 |
| 68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 | 6 |
| 70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 | 6 |
| 71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 | 6 |
| 72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 | 6 |
| 73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 | 6 |
| 74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 | 6 |
| 75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 | 6 |
| 76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 | 6 |
| 77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 | 6 |
| 78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 | 6 |
| 79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 | 6 |
| 80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 | 6 |
| 81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 | 6 |
| 82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 | 6 |
| 83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 | 6 |
| 84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 | 6 |
| 85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 | 6 |
| 86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 | 6 |
| 87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 | 7 |
| 88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 | 7 |
| 89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 | 7 |
| 90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 | 7 |
| 91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 | 7 |
| 92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 | 7 |
| 93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 | 7 |
| 94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 | 7 |
| 95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 | 7 |
| 96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 | 7 |
| 97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 | 7 |
| 98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 | 7 |
| 99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 | 7 |
| 100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 | 7 |
| 101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 | 7 |
| 102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 | 7 |
| 103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 | 7 |
| 104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 | 7 |
| 105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 | 7 |
| 106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 | 7 |
| 107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 | 7 |
| 108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 | 7 |
| 109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 | 7 |
| 110 | Ds | дармштадтий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d8 | 7 |
| 111 | Rg | рентгений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d9 | 7 |
| 112 | Cn | коперниций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d10 | 7 |
| 113 | Nh | нихоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p1 | 7 |
| 114 | Fl | флеровий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p2 | 7 |
| 115 | Mc | московий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p3 | 7 |
| 116 | Lv | ливерморий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p4 | 7 |
| 117 | Ts | теннесcин | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p5 | 7 |
| 118 | Og | оганесон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p6 | 7 |
| Таблица 2. Электронная конфигурация атомов |
Если Вы хотите узнать, как составить электронную конфигурацию, обратитесь к статье
«как написать электронную конфигурацию»
Квантовые числа электронов в атомах
На этой странице вы узнаете:
- Чем общежития электронов отличаются от студенческих?
- В атомах химических элементов есть свои уровни комфортности?
- Химические элементы делятся на семейства? Это что, биология какая-то?
Сейчас в обществе все больше набирает оборот модный тренд — минималистичный образ жизни. Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.

Видимо, по такому принципу «живет» хорошо нам знакомый товарищ — водород. У него всего один электрон, который всегда на своем месте. А как быть, например, с атомом хлора, у которого их аж 17, ведь их надо содержать в порядке? Сейчас мы с вами узнаем, как располагаются электроны в электронной оболочке атома и многое другое.
Строение электронной оболочки атома
Представим, что электрон — это студент, а электронная оболочка атома — общежитие. Как будет жить наш студент в общежитии?
Разберемся сначала с «планом помещения».
- В нём есть отдельные комнаты, которые называются атомными орбиталями — в них могут проживать максимум 2 электрона.
- Несколько комнат объединяются в блок с общей кухней — их мы назовем энергетическими подуровнями.
- Этажи общежития — энергетические уровни. Определенный этаж содержит определенное количество блоков.
Таким образом, все электроны «живут» на энергетических уровнях-этажах, каждый из которых имеет энергетические подуровни-блоки со своими орбиталями-комнатами.
То, что мы видим с вами на рисунке — электронно-графическая формула для отдельных атомов химических элементов — это расположение всех его электронов на орбиталях.
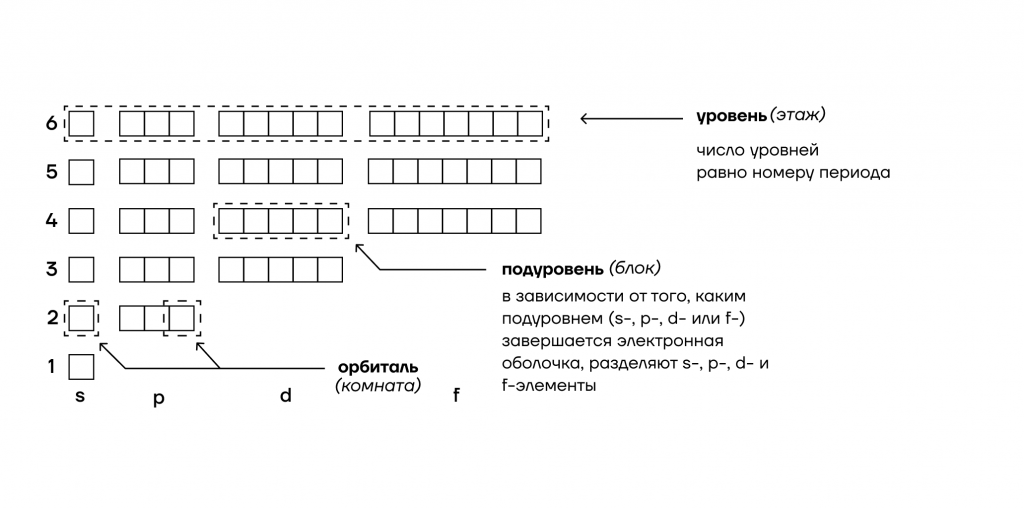
1. Энергетические уровни (этажи) имеют порядковую нумерацию. Причем на первом уровне располагается всего один подуровень (блок), на втором — два, на третьем — три, на четвертом и последующих — по 4.
2. Подуровни (блоки) обозначают в следующем порядке по мере отдаления от ядра: s (имеет одну орбиталь) → p (три орбитали) → d (пять орбиталей)→ f (семь орбиталей).
3. Орбиталь (комната) специального обозначения не имеет. Может содержать максимум 2 электрона (студента).
Как нам поможет Периодическая таблица химических элементов Д.И. Менделеева при заполнении схемы строения электронных оболочек атомов?
- Число электронов в атоме химического элемента равно его порядковому номеру в Периодической системе Д. И. Менделеева.
- Количество уровней совпадает с номером периода, в котором располагается элемент: 1, 2, 3…
- Количество электронов на внешнем энергетическом уровне для элементов главных (A) подгрупп можно также легко узнать — в какой группе по номеру расположен химический элемент, столько электронов и будет находиться на его внешнем уровне.
- Для элементов побочных подгрупп количество электронов на внешнем энергетическом уровне равно двум. Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
- Количество валентных электронов для элементов главных (A) подгрупп равно номеру группы, для элементов побочных подгрупп — числу электронов на внешнем энергетическом уровне и незаполненном предвнешнем подуровне.
Это можно использовать для проверки своих действий при распределении электронов по уровням.
Уже сейчас, используя полученную информацию, мы можем решить задание №2 ОГЭ по химии.
На приведенном рисунке изображена модель атома химического элемента.

Запишите в таблицу порядковый номер в Периодической системе (Х) химического элемента, модель атома которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе.
| X | Y |
Решение:
1) Порядковый номер химического элемента в Периодической системе можно определить по числу электронов в атоме. Сосчитав все электроны, получаем, что их 14 штук, следовательно, X — 14.
2) Номер группы Периодической системы, в которой расположен химический, элемент можно узнать по числу электронов на его внешнем электронном уровне. Сосчитав их, получим, что их 4 штуки, следовательно, Y — 4.
Ответ: 144
Электронная конфигурация атома
Для изображения строения электронных слоев атома (электронной конфигурации) пользуются условной записью.

Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз. Это называется принципом Паули.
Он гласит, что два электрона не могут иметь одинаковые спины. Спин — характеристика электрона, проще всего его можно представить как вращение электрона по часовой стрелке и против часовой, поэтому в ячейке они расположены в противоположном направлении (то есть +1/2 и -1/2).
При заполнении этих ячеек удобно пользоваться правилом Хунда (или правилом «трамвайного вагона»):
Ты приглядись, решив присесть,
К местам трамвайного вагона:
Когда ряды пустые есть,
Подсаживаться нет резона.
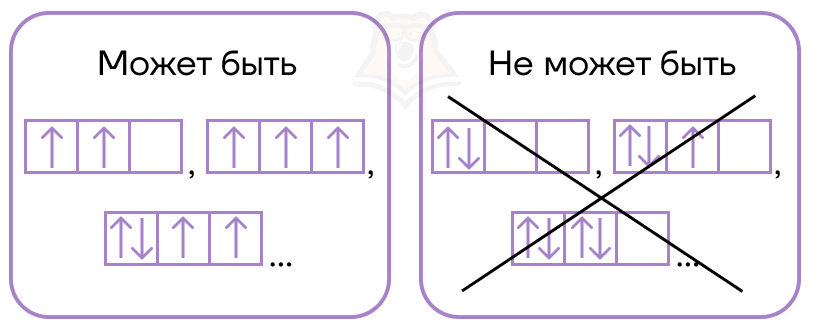
В нашем с вами примере студентов заселяют по одному в комнату пока это возможно.
Важное замечание: в комнате не больше двух студентов — атомная орбиталь вмещает максимально два электрона.
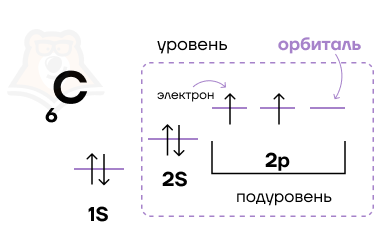
Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы:
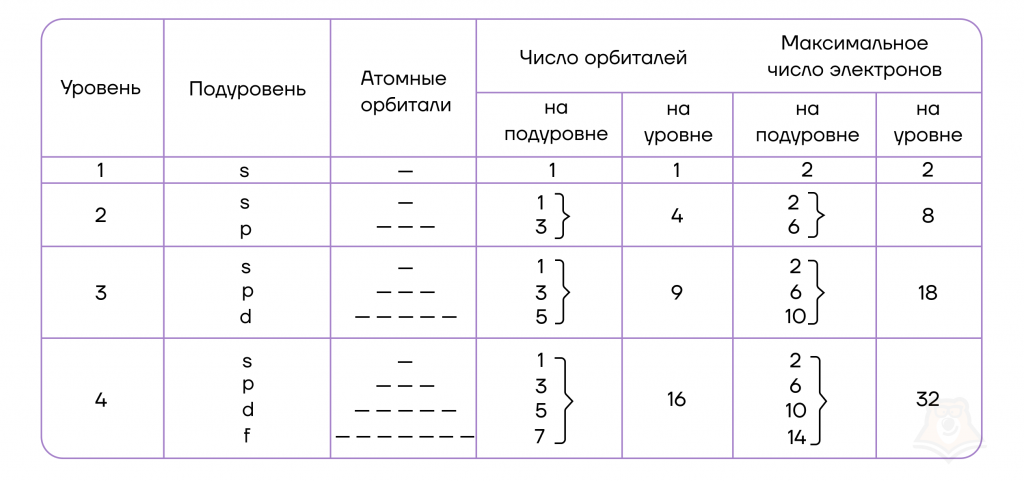
Да, проанализировав таблицу, мы увидим, что на s-подуровне (блоке) может находиться не больше двух электронов, на p-подуровне — не больше шести электронов, на d-подуровне — не больше десяти электронов, на f-подуровне — не больше четырнадцати электронов.
Электроны, как и студенты, стремятся занять более комфортные места, так система стремится к минимуму энергии. Порядок заполнения подуровней в атомах химических элементов следующий:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → …
Согласитесь, если студентам заселиться в блок вдвоем, им будет проще найти друг с другом общий язык, чем если бы их было в блоке четырнадцать.
Схематично порядок заполнения энергетических подуровней электронно-графической формулы представлен на картинке:

После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.

Потренируемся в написании электронной конфигурации на примере атомов хлора и титана.
Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме:
— четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены;
— четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне;
— всего двадцать два электрона (порядковый номер).
В соответствии с порядком заполнения орбиталей распределим электроны:
22Ti 1s22s22p63s23p64s23d2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше.
Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома хлора составлена верно.
К счастью, с биологией у атомов химических элементов мало общего, иначе, представьте, что в качестве домашнего питомца у вас был бы атом хлора, а в зоопарке бы показывали семью атомов золота. Что-то из области фантастики, не так ли?
Однако, да, химические элементы разделяют на семейства по строению их электронных оболочек. Таких семейств выделяют четыре:
— s-элементы — это элементы IA и IIA групп, в их атомах последний электрон занимает место на s-подуровне внешнего энергетического уровня;
— p-элементы — это элементы IIIA-VIIA групп, в их атомах последний электрон занимает место на p-подуровне внешнего энергетического уровня;
— d-элементы — это элементы побочных подгрупп, в их атомах последний электрон занимает место на d-подуровне предвнешнего энергетического уровня;
— f-элементы — это лантаноиды и актиноиды, 4f- и 5f-элементы соответственно, в их атомах последний электрон занимает место на f-подуровне предпредвнешнего энергетического уровня.
Таким образом, мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента.
Фактчек
- Электроны располагаются на электронных уровнях, причем их число определяется положением элемента в Периодической системе (по номеру периода).
- Энергетические уровни, в свою очередь, состоят из подуровней.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками.
- По принципу Паули на каждой атомной орбитали могут располагаться максимально два электрона, причем их спины должны быть противонаправлены.
- Электроны располагаются по подуровням так, чтобы энергия системы была минимальна.
- Химические элементы делятся на s-, p-, d- и f-семейства по тому, на какой подуровень пишем последний электрон при составлении электронной конфигурации атома.
Проверь себя
Задание 1.
Сколько электронов может максимально располагаться на орбитали?
- 1 электрон
- 2 электрона
- 3 электрона
- 4 электрона
Задание 2.
Как атомные подуровни заполняются электронами?
- в порядке увеличения их энергии
- в порядке уменьшения их энергии
- в периодическом порядке
Задание 3.
Сколько атомных орбиталей содержит d-подуровень?
- 1
- 3
- 5
- 7
Задание 4.
Какую форму имеет s-орбиталь?
- шара
- гантели
- эллипса
- нескольких гантелей
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.







