Тип 24 № 2200
i
Найдите электрохимические эквиваленты одновалентной и двухвалентной меди.
Спрятать решение
Решение.
Электрохимический эквивалент находим по формуле
Для одновалентной меди:
Для двухвалентной меди:
Ответ: 6,6 · 10-7 кг/Кл; 3,3 · 10-7 кг/Кл.
Источник: Гельфгат И. М. Сборник задач по физике для 10 класса, Х.: «Гимназия», 2001 (№ 14.27)
бюджетное
профессиональное образовательное учреждение Вологодской области «Череповецкий
металлургический колледж имени академика И.П. Бардина»
Для всех специальностей
Определение электрохимического эквивалента меди
Методические рекомендации и лабораторная работа по дисциплине «Физика» для
студентов I курса
Разработчик Изотова
Е.А.,
преподаватель
колледжа
Череповец
2017
Определение электрохимического эквивалента меди. Методические рекомендации и лабораторная
работа по дисциплине «Физика» для студентов I курса. /Разработчик
Изотова Е.А./ — Череповец: БПОУ ВО «ЧМК» Череповецкий
металлургический колледж, 2017. — 8 с.
РАССМОТРЕНО:
на заседании цикловой комиссии
«Математические и
естественнонаучные дисциплины»
« » 2017
г., протокол №
председатель ПЦК
__________________
И.А.Масыгина
(подпись)
Содержание
|
1 |
Цель работы …………………………………………………………………. |
4 |
|
2 |
Средства обучения …………….……………………………………………. |
4 |
|
3 |
Теоретические сведения и методические рекомендации |
4 |
|
4 |
Задание ……………………………………………………………………… |
5 |
|
5 |
Ход выполнения лабораторной работы …………………………………… |
6 |
|
6 |
Контрольные вопросы ……………………………………………………… |
7 |
|
7 |
Рекомендации по оформлению отчета по лабораторной |
7 |
|
Литература …………………………………………………………………… |
8 |
Лабораторная работа
Определение электрохимического эквивалента меди
1 Цель работы
Определить
электрохимический эквивалент меди при проведении электролиза раствора сульфата
меди.
2 Средства обучения
2.1 Лабораторное
оборудование: источник
постоянного тока, электролитическая ванна, раствор сульфата меди, медные
электроды, наждачная бумага, ключ, амперметр, соединительные провода, реостат.
2.2 Методические
рекомендации по выполнению лабораторной работы.
3 Теоретические сведения и методические рекомендации по выполнению лабораторной работы
Электролиты это вещества,
растворы или расплавы которых проводят электрический
ток. К электролитам относятся кислоты, основания и соли. Электролиз – это физико-химический окислительно-восстановительный
процесс, протекающий в растворах или расплавах электролитов под действием
электрического тока, заключающийся в выделении на электродах составных
частей растворённых веществ или других веществ — продуктов вторичных реакций на
электродах. Процесс на катоде K(-): катион принимает электроны и
восстанавливается. Процесс на аноде A(+): анион отдает электроны и
окисляется. Примером электролиза растворов может служить электролиз медного
купороса (рисунок 1), молекулы которого подвергаются электролитической диссоциации:
Рисунок 1-Электролиз
раствора сульфата меди.
Электролитическая диссоциация —
это процесс распада электролита на ионы при его растворении или плавлении.
Количественно электролиз описывается законами Фарадея:
1.
Масса
выделяющегося на электроде вещества пропорциональна количеству электричества,
протекающего через раствор:
(1)
где
k-электрохимический
эквивалент, , I— сила тока, протекающего
через раствор, А, t— время электролиза (с), q— количество электричества, Кл.
2.
Для выделения
на электроде 1 эквивалента любого вещества необходимо затратить одно и то же
количество электричества, равное числу
Фарадея: F
=NA.e= 96500 Кл /моль.
, (2)
где k-электрохимический
эквивалент, кг/Кл, М — молярная масса, кг/моль, n— валентность, F— число
Фарадея Кл/моль, – химический эквивалент, кг/моль.
Физический
смысл k
Электрохимический
эквивалент численно равен отношению массы иона к его заряду.
Электролиз
применяется в электрометаллургии для получения редких металлов, для
очистки металлов от примесей, в гальваностегии — покрытие одного металла тонким
слоем другого, в гальванопластике — получение копий рельефных деталей, в
медицине – электрофорез.
Электролиты подчиняются закону Ома. Сопротивление
электролитов при повышении температуры уменьшается, так как при повышении
температуры увеличивается доля молекул, распавшихся на ионы, и поэтому
увеличивается число ионов — носителей заряда.
4 Задание
4.1 Провести
электролиз раствора сульфата меди.
4.2 Определить
электрохимический эквивалент меди.
5 Ход выполнения
лабораторной работы
5.1 Зачистите наждачной бумагой медный
электрод и измерьте его массу с точностью до 0,01 г.
5.2 Соберите схему по рисунку 2.
Присоедините медные электроды к источнику постоянного тока (электрод с
известной массой — к катоду), опустите электроды в стакан с раствором сульфата
меди.
 |
Рисунок 2- Схема опыта.
5.3 Включите секундомер одновременно с
источником тока. Установите и поддерживайте силу тока 0,5 А в течение всего
времени электролиза (время электролиза 10 минут).
5.4 По окончании электролиза отключите
источник тока, отсоедините катод, промойте его в воде и высушите в потоке
теплого воздуха.
5.5 Охладите катод до комнатной
температуры и определите его массу после электролиза.
5.6 Результаты опыта и вычислений занесите в
таблицу.
Таблица 1-Результаты измерений и вычислений
|
Масса катода до опыта |
Масса катода после опыта |
Масса выделившейся меди |
Сила тока |
Время прохождения тока |
Электрохимический эквивалент |
Табличное значение электрохимического |
Абсолютная погрешность |
Относительная погрешность |
|
m1 |
m2 |
m |
I |
t |
k |
Kт |
Δk |
ε |
|
кг |
кг |
кг |
А |
с |
кг/Кл |
кг/Кл |
кг/Кл |
% |
5.7 Вычисления:
5.7.1 Вычислите массу
меди, выделившуюся на катоде:
5.7.2 Вычислите
электрохимический эквивалент по формуле
5.7.3 Вычислите абсолютную
погрешность электрохимического эквивалента меди
𝛥k=(для меди kт = 3,29.10-7 кг/Кл)
5.7.4Вычислите относительную
погрешность электрохимического эквивалента меди
ε
=
5.8 Сделайте вывод. В
выводе укажите истинное значение k в виде
и физический смысл электрохимического
эквивалента.
5.9 Ответьте на
контрольные вопросы.
6 Контрольные вопросы
6.1 Что
такое электролитическая диссоциация? Объясните причину возникновения заряженных
частиц в растворе электролита. Какие частицы являются носителями тока в
электролитах?
6.2 Какие
вещества называют электролитами? Приведите примеры.
6.3 Какой процесс называют
электролизом? Где применяется электролиз? Какие явления происходят на катоде при
подключении установки для электролиза к источнику питания? Какие явления
происходят на аноде?
6.4
Сформулируйте законы электролиза.
6.5Почему
с повышением температуры сопротивление электролита уменьшается?
7
Рекомендации по оформлению отчета по лабораторной работе
Отчет по работе оформляется в соответствии с
едиными требованиями, принятыми в колледже и должен включать:
·
вид работы;
·
название работы;
·
цель работы;
·
оборудование;
·
ход работы;
·
алгоритм выполнения
работы;
·
расчеты;
·
вывод.
Литература
1.
Дик Ю.И., Кабардин
О.Ф., Орлов В.А. и др. Руководство по проведению лабораторных работ
по физике для средних специальных учебных заведений. — М.: Просвещение, 2002.
2.
Электролитическая
диссоциация и гибридизация атомных орбиталей www.lyceum8.ru/himiya/7.htm
3.Учебники 10 класс›—10—klass—miakishev…
1.
Запишите уравнения процессов, протекающих
на аноде и катоде, а также суммарную
реакцию.
2.
Рассчитайте изменение массы катода в
результате эксперимента по формуле
∆mэксп
= mкон
– mнач
, г.
3.
Вычислите опытную величину электрохимического
эквивалента меди по уравнению
kЭ(опыт)
=
, г/Кл.
4.
Рассчитайте молярную
массу эквивалента меди по формуле (1)
МЭ(Cu) =
,
г/моль.
5.
Оцените теоретическую величину
электрохимического эквивалента меди
по уравнению (13)
kЭ(теор)
=
,
г/Кл.
6.
Вычислите относительную погрешность
каждого опыта
П
=
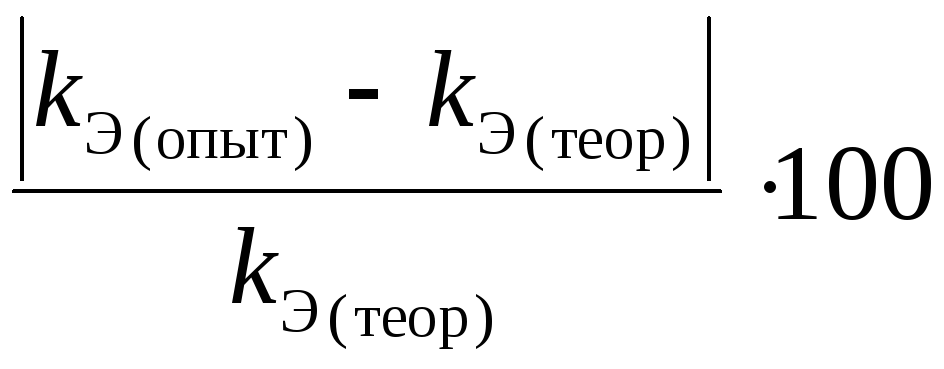
%
7.
Расчетные данные занесите в табл. 2,
заполните метрологическую карту средств
измерения и сформулируйте выводы.
Часть 2. Газометрический метод определения выхода продуктов электролиза по току
1.
Запишите уравнения процессов, протекающих
на аноде и катоде, а также суммарную
реакцию.
2.
Поскольку водород и кислород в эвдиометрах
собирают над водным раствором, то по
закону Дальтона измеренное при помощи
барометра давление в лаборатории Р
равно сумме давлений чистого водорода
Р
или кислорода Р
и насыщенного водяного пара Р
,
Па
,
Па
Тогда
расчет парциального давления водорода
и кислорода следует вести по формулам
,
Па
,
Па
Значения
при различных температурах приведены
в приложении 3.
3.
Определите объемы водорода и кислорода
при н.у., используя выражение объединенного
газового закона
V(Н2)
=,
см3
V(О2)
=,
см3
где
Т °
– температура при н.у., равная 273 К;
Р°
– парциальное давление при н.у., равное
101325 Па.; Т
– температура в лаборатории, К.
4.
Вычислите теоретические объёмы газов
при н.у. по закону Фарадея [формула (12)]
V(Н2)
=
,
см3
V(О2)
=
,
см3
где
—
эквивалентный объем водорода при н.у.,
который равен 11200 см3/моль;
—
эквивалентный объем кислорода при н.у.,
который равен 5600 см3/моль.
5.
Определите коэффициент выхода по току
для водорода и кислорода по формуле
(10)
%
%
6.
Расчетные данные внесити в таблицу 3,
заполните метрологическую карту средств
измерения и сформулируйте выводы.
Часть 3. Электрохимическое цинкование
1.
Запишите уравнения процессов, протекающих
на аноде и катоде, а также суммарную
реакцию.
2.
Рассчитайте изменение массы катода в
результате эксперимента по формуле
∆mэксп
= mкон
– mнач
, г.
3.
Вычислите
опытную величину электрохимического
эквивалента цинка по уравнению
kЭ(опыт)
=
, г/Кл.
4.
Рассчитайте молярную
массу эквивалента цинка по формуле (1)
МЭ(Zn) =
,
г/моль.
5.
Оцените теоретическую величину
электрохимического эквивалента цинка
по уравнению (13)
kЭ(теор)
=
,
г/Кл.
6.
Вычислите относительную погрешность
каждого опыта
П
=

%
7.
Вычислите теоретическую массу цинкового
покрытия по формуле (11)
∆mтеор
,
г.
8.
Коэффициент выхода по току для обоих
опытов рассчитайте по уравнению (10)
.
9.
Расчетные данные внести в табл. 4,
заполните метрологическую карту средств
измерения и сформулируйте выводы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
devinermstu
Вопрос по физике:
Определить электрохимический эквивалент меди, если на катоде за 10 мин отложилась медьмассой 0,317 г. Напряжение при электролизе 2,4 В, а сопротивление 1,5 Ом.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
colime788
M=kq
k=mq
q=It
I=UR
q= UtR
подставляем вместо q во вторую формулу
k=mRUt
k=0. 000317 кг * 1, 5 Ом 2, 4В* 600 с = 0. 03*10^{-5}
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Физика.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Физика — область естествознания: естественная наука о простейших и вместе с тем наиболее общих законах природы, о материи, её структуре и движении.
Перейти к контенту
Условие задачи:
Электрохимический эквивалент меди 3,3·10-7 кг/Кл. Сколько меди выделится на электроде при непрерывной работе электролитической ванны в течение 1 ч 40 мин с постоянным током 100 А?
Задача №7.3.26 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(k= 3,3 cdot 10^{-7}) кг/Кл, (t=1 ;ч ; 40 ; мин), (I=400) А, (m-?)
Решение задачи:
Чтобы найти массу выделившейся меди, воспользуемся первым законом Фарадея для электролиза:
[m = kIt]
Эта задача решается в одну формулу, поэтому нам осталось только правильно перевести все данные в условии величины в систему СИ, подставить в формулу и посчитать ответ:
[m = 3,3 cdot {10^{ – 7}} cdot 100 cdot 6000 = 0,198;кг = 198;г]
Ответ: 198 г.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
7.3.25 Определить массу меди, выделившейся из раствора медного купороса за 100 с, если сила тока
7.3.27 К источнику с ЭДС 200 В и внутренним сопротивлением 2 Ом подсоединены последовательно
7.4.1 По проводнику сопротивлением 20 Ом за 5 мин прошло количество электричества 300 Кл
( 4 оценки, среднее 4 из 5 )





