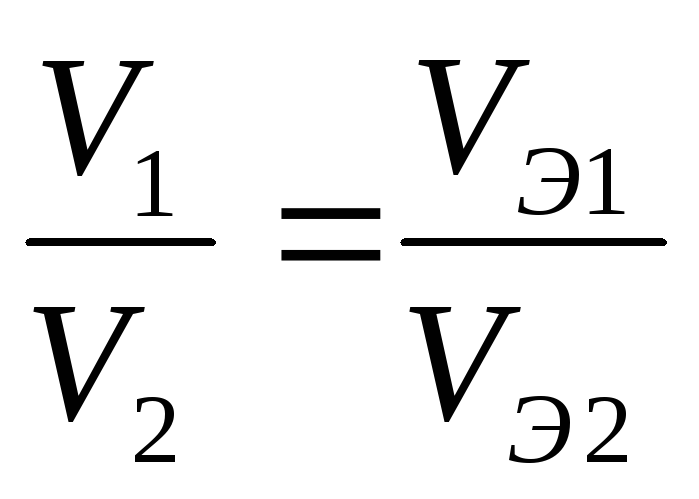2. Электрохимический эквивалент.
Электрохимический эквивалент представляет собой количество вещества, прореагировавшего в результате протекания единицы количества электричества.
Электрохимический эквивалент может быть получен расчетным путем, если известна электрохимическая реакция, т.е. исходные вещества и ее продукты. Уравнение для расчета электрохимического эквивалента выглядит следующим образом:

где М – молярная масса реагента, n – число электронов, участвующих в реакции, F – число или постоянная Фарадея: F = 96486 ≈96500 Кл/моль.
С количественной
стороны процесс электролиза впервые
был изучен в 30-х годах XIX века выдающимся
английским физиком Фарадеем, который
в результате своих исследований установил
следующие законы электролиза:
I
закон. Масса
образующегося при электролизе вещества
пропорциональна количеству прошедшего
через раствор электричества.
Этот закон вытекает
из сущности электролиза. Как уже
говорилось, в месте соприкосновения
металла с раствором происходит
электрохимический процесс – взаимодействие
ионов или молекул электролита с
электронами металла, так что
электролитическое образование вещества
является результатом этого процесса.
Ясно, что количество вещества, получающегося
у электрода, всегда будет пропорционально
числу прошедших по цепи электронов, т.
е. количеству электричества.
Количество вещества,
выделяющегося при прохождении через
электролит 1 кулона электричества,
называется электрохимическим эквивалентом
(Э).
где Q
– количество электричества, пропущенного
через раствор или расплав электролита:
Q
= I∙t,
где t
‑ время, в сек., I
‑ сила тока.
где МЭ
‑ молярная
масса эквивалента вещества, n
– число электронов в электродном
процессе. Таким образом:
Или, при выделении
газообразных веществ:
Измерениями
установлено, что количество электричества,
обусловливающее электрохимическое
превращение одного эквивалента вещества,
равно 96 485 (округленно 96 500) кулонам.
Величина 96 500 Кл/моль называется постоянной
Фарадея и обозначается буквой F.
II
закон. При
электролизе различных химических
соединений равные количества электричества
приводят к электрохимическому превращению
эквивалентных количеств веществ.
Следовательно,
для восстановления на катоде и окисления
на аноде одного моль-эквивалента любого
вещества необходимо затратить одно и
то же количество электричества, а именно
96500 кулонов.
1.11 Последовательность восстановления частиц на катоде и окисления на аноде
Руководствуясь
таблицей стандартных электродных
потенциалов металлов, можно указать
следующие случаи при электролизе водных
растворов электролитов:
1) На катоде легче
всего разряжаются катионы того металла,
которому отвечает наиболее положительный
потенциал. Так, например, из смеси
катионов Cu2+,
Ag+
и Zn2+
при достаточном напряжении на клеммах
электролизера вначале восстанавливаются
ионы серебра (φ0=+0.79
В), затем меди (φ0=+0.337
В) и, наконец, цинка (φ0=
–0.76 В).
2) Катионы металлов
со стандартным электродным потенциалом,
большим, чем у водорода, расположены в
ряду напряжений после него: Cu2+,
Hg22+,
Ag+,
Pt2+,
…, до Pt4+.
При электролизе они почти полностью
восстанавливаются на катоде и выделяются
в виде металла:
Men+
+ nē
→ Meo
3) Катионы металлов
с малой величиной стандартного
электродного потенциала (металлы начала
ряда напряжений Li+,
Na+,
K+,
Rb+,
… до Al3+
включительно). При электролизе на катоде
они не восстанавливаются, вместо них
восстанавливаются молекулы воды:
2H2O
+ 2ē → H2
+ 2OH—
4) Катионы металлов
со стандартным электродным потенциалом
меньшим, чем у водорода, но большим, чем
у алюминия (Mn2+,
Zn2+,
Cr3+,
Fe2+,
…, до H). При электролизе эти катионы,
характеризующиеся средними величинами
электроноакцепторной способности, на
катоде восстанавливаются одновременно
с молекулами воды:
Men+
+ nē → Meo
2H2O
+ 2ē → H2
+ 2OH—
Процессы, протекающие
на аноде, зависят как от электролита,
так и от материала (вещества), из которого
сделан анод. Нерастворимые аноды не
претерпевают окисления в ходе электролиза.
В определенных условиях роль нерастворимых
анодов могут выполнять Fe, Ni, Pb, Sn и др.
Растворимые аноды в процессе электролиза
могут окисляться (разрушаться) и
переходить в раствор в виде ионов. Они
изготовляются из меди, серебра, цинка,
кадмия, никеля и других металлов.
Растворимые аноды используют при
нанесении металлических покрытий на
изделие (катод).
На нерастворимом
аноде в процессе
электролиза происходит окисление
анионов или молекул воды.
1) На аноде легче
всего окисляются те ионы, у которых
стандартный электродный потенциал
меньше.
2) При электролизе
водных растворов бескислородных кислот
и их солей (кроме HF и фторидов) у анода
будут окисляться (разряжаться) анионы.
Так, например, при электролизе растворов
кислот и их солей (HI, HBr, HCl, H2S
или гидроксидов) на аноде будет окисляться
соответствующий ион передавать свои
электроны во внешнюю цепь электролизера:
2I–
– 2ē → I20
S2-
— 2ē → So
4OH–
– 4ē → 2H2O
+ O2
3) При электролизе
кислородсодержащих кислот и их солей
(SO42–,
NO3–,
PO43–
и т. п.) с максимальной степенью окисления
неметалла на аноде окисляются не анионы,
а молекулы воды с выделением кислорода,
так как потенциал окисления воды
значительно меньше, чем для таких анионов
2H2O
– 4ē
→ O2
+ 4H+
На растворимом
аноде в
процессе электролиза происходит
окисление материала, из которого
изготовлен анод
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
23.11.2019279.04 Кб0n1.doc
- #
- #
1 Найти электрохимический эквивалент натрия. Молярная масса натрия μ = 0,023 кг/моль, его валентность z=1. Постоянная Фарадея
Решение:
2 Цинковый анод массы m = 5 г поставлен в электролитическую ванну, через которую проходит ток I=2 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка
Решение:
3 Найти постоянную Фарадея, если при прохождении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота m = 5 г. Химический эквивалент золота А = 0,066 кг/моль.
Решение:
Согласно объединенному закону Фарадея
отсюда
4 Найти элементарный электрический заряд е, если масса вещества, численно равная химическому эквиваленту, содержит N0=NА/z атомов или молекул.
Решение:
Ионы в растворе электролита несут на себе число элементарных зарядов, равное валентности z. При выделении массы вещества, численно равной его химическому эквиваленту, через раствор проходит заряд, численно равный постоянной Фарадея, т. е.
Следовательно, элементарный заряд
5 Молярная масса серебра μ1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент . Найти электрохимический эквивалент золота k2, если молярная масса золота μ2 = 0,197 кг/моль, его валентность z2 = 3.
Решение:
По второму закону Фарадея имеем
отсюда электрохимический эквивалент золота
6 Найти массы веществ, выделившихся за время τ = 10 ч на катодах трех электролитических ванн, включенных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuSO4, NiSО4 и AgNО3. Плотность тока при электролизе j=40 А/м2, площадь катода в каждой ванне S= 500 см2. Электрохимические эквиваленты меди, никеля и серебра
Решение:
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ
7 При никелировании изделий в течение времени τ = 2 ч отложился слой никеля толщины l=0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля , его плотность
Решение:
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток I0=1,5А. Какую поправку надо внести в показание амперметра, если за время τ = 10 мин на катоде отложилась масса меди m= 0,316 г? Электрохимический эквивалент меди .
Решение:
По первому закону Фарадея m = kIτ, где I-ток в цепи; отсюда I=m/kτ=1,6 А, т.е. в показание амперметра надо внести поправку
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R= 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время τ = 5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра .
Решение:
По первому закону Фарадея m = klτ, где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kτ= 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения
10 Для серебрения ложек через раствор соли серебра в течение времени τ = 5 ч пропускается ток I=1,8 А. Катодом служат n=12 ложек, каждая из которых имеет площадь поверхности S=50 см2. Какой толщины слой серебра отложится на ложках? Молярная масса серебра μ = 0,108 кг/моль, его валентность z = 1 и плотность .
Решение:
Толщина слоя
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl2), во второй — раствор хлорного железа (FeCl3). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда . Молярные массы железа и хлора
.
Решение:
В первой ванне железо двухвалентно (z1=2), во второй — трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне
во второй ванне
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора
12 При электролизе раствора серной кислоты (CuSO4) расходуется мощность N=37 Вт. Найти со-противление электролита, если за время t = 50 мин выделяется масса водорода m = 0,3 г. Молярная масса водорода μ = 0,001 кг/моль, его валентность z=1.
Решение:
13 При электролитическом способе получения никеля на единицу массы расходуется Wm= 10 кВт·ч/кг электроэнергии. Электрохимический эквивалент никеля . При каком напряжении производится электролиз?
Решение:
14 Найти массу выделившейся меди, если для ее получения электролитическим способом затрачено W= 5 кВт·ч электроэнергии. Электролиз проводится при напряжении V=10 В, к.п.д. установки η = 75%. Электрохимический эквивалент меди .
Решение:
К.п.д. установки
где q-заряд, прошедший через ванну. Масса выделившейся меди m=kq; отсюда
15 Какой заряд проходит через раствор серной кислоты (CuSO4) за время τ = 10 с, если ток за это время равномерно возрастает от I1=0 до I2 = 4А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди .
Решение: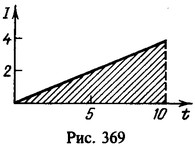
Заряд, протекший через раствор,
Нахождение заряда графическим путем показано на рис. 369. На графике зависимости тока от времени заштрихованная площадь численно равна заряду. Масса меди, выделившейся на катоде,
16 При рафинировании меди с помощью электролиза к последовательно включенным электролитическим ваннам, имеющим общее сопротивление R = 0,5 Ом, подведено напряжение V=10 В. Найти массу чистой меди, выделившейся на катодах ванны за время τ = 10 ч. Э.д.с. поляризации ε = 6 В. Электрохимический эквивалент меди .
Решение:
17 При электролизе воды через электролитическую ванну в течение времени τ = 25 мин шел ток I=20 А. Какова температура t выделившегося кислорода, если он находится в объеме V= 1 л под давлением р = 0,2 МПа? Молярная масса воды μ = 0,018 кг/моль. Электрохимический эквивалент кислорода .
Решение:
где R= 8,31 Дж/(молъ К)-газовая постоянная.
18 При электролитическом способе получения алюминия на единицу массы расходуется W1m = 50 кВт·ч/кг электроэнергии. Электролиз проводится при напряжении V1 = 16,2 В. Каким будет расход электроэнергии W2m на единицу массы при напряжении V2 = 8,1 В?
Решение:
Тип 24 № 2200
i
Найдите электрохимические эквиваленты одновалентной и двухвалентной меди.
Спрятать решение
Решение.
Электрохимический эквивалент находим по формуле
Для одновалентной меди:
Для двухвалентной меди:
Ответ: 6,6 · 10-7 кг/Кл; 3,3 · 10-7 кг/Кл.
Источник: Гельфгат И. М. Сборник задач по физике для 10 класса, Х.: «Гимназия», 2001 (№ 14.27)
или электролитический эквивалент. — Закон Фарадея (см. Электрохимия) устанавливает строгую зависимость между количеством электричества, прошедшим через раствор или сплав электролитов, и количеством разложенного током вещества. Согласно этому закону, при прохождении одного и того же гальванического тока через ряд вольтметров, количества веществ, выделившихся на электродах, должны быть в отношении их эквивалентных весов. Этим и пользуются для определения величины эквивалентов простых тел. Такие найденные электролизом величины можно назвать электрохимическим или электролитическим (Лотар Мейер) эквивалентом. По существу, они ничем не отличаются от химических эквивалентов; иначе был бы неверен закон Фарадея. Химическим же эквивалентом называют ту долю атомного веса элемента, которая может быть замещена в частице одним атомом водорода. Основным вольтметром при нахождении эквивалентов служит обыкновенно серебряный (см. Электрохимия фиг. 1). Это объясняется тем, что методы электролитического осаждения серебра разработаны лучше других и для серебра точнее всего известно соотношение между количеством прошедшего электричества и выделившегося вещества (см. Электрохимия). Методом электролиза водных растворов могут быть определены эквиваленты всех осаждаемых током металлов (см. Электрохимический анализ), а также водорода, кислорода и галоидов, кроме фтора. Должно подчеркнуть, что весовое количество осажденного током простого тела для атомов, образующих несколько форм соединений, т. е. с несколькими случаями валентности, будет зависеть от взятой для электролиза формы соединения. Практически этот случай имеет значение только для солей меди, железа и ртути. Медь, например, в солях закиси одноэквивалентна (Cu2Cl2), в солях окиси двуэквивалентна (Cu2Cl2). В расположенном ниже списке приведены валентность, обозначенная римской цифрой, атомный и эквивалентный вес простых тел, имеющих приложение при электролизе растворов. В этом списке за «эталон сравнения», т. е. за то число, к которому с возможной в настоящее время степенью точности отнесены атомные веса, принят атомный вес кислорода, равный 16.
——————————————————————————————————
| | Атомный вес | Эквивалентный вес |
|—————————————————————————————————-|
| Кислород II | 16 | 8 |
|—————————————————————————————————-|
| Серебро I | 107,93 | 107,93 |
|—————————————————————————————————-|
| Бром I | 79,96 | 79,96 |
|—————————————————————————————————-|
| Водород I | 1,008 | 1,008 |
|—————————————————————————————————-|
| Железо II | 56 | 28 |
|—————————————————————————————————-|
| Железо III | 56 | 18,67 |
|—————————————————————————————————-|
| Золото III | 197,2 | 65,73 |
|—————————————————————————————————-|
| Йод I | 126,85 | 126,85 |
|—————————————————————————————————-|
| Кадмий II | 112 | 56 |
|—————————————————————————————————-|
| Марганец II | 55 | 27,5 |
|—————————————————————————————————-|
| Медь I | 63,5 | 63,5 |
|—————————————————————————————————-|
| Медь II | — | 31,8 |
|—————————————————————————————————-|
| Никель II | 58,7 | 29,35 |
|—————————————————————————————————-|
| Олово II | 118,5 | 59,25 |
|—————————————————————————————————-|
| Платина IV | 194,8 | 48,7 |
|—————————————————————————————————-|
| Ртуть I | 200 | 200 |
|—————————————————————————————————-|
| Ртуть II | — | 100 |
|—————————————————————————————————-|
| Сурьма III | 120 | 40 |
|—————————————————————————————————-|
| Цинк II | 65,4 | 32,7 |
|—————————————————————————————————-|
| Хлор I | 35,45 | 35,45 |
——————————————————————————————————
Не должно думать, что этим списком исчерпывается разнообразие валентности и число выделяемых током простых тел. В ней приведены только величины, заведомо определяемые электролизом водных растворов. Электролиз расплавленных веществ не разработан настолько, чтобы служить для точного определения эквивалентного веса. Однако в электрохимической практике постоянно пользуются для расчетов эквивалентными весами, определенными химическим путем. Из этих величин особенно важное значение имеют эквивалент алюминия 9,03, при атомном весе 27,1, эквиваленты калия и натрия, совпадающие с их атомными весами, т. е. 39,15 и 23,05. В научной литературе иногда придают особое значение термину электрохимический эквивалент, обозначая им количество вещества, выделяющееся при прохождении одного кулона электричества, т. е. величину, равную для серебра, согласно новейшим исследованиям Рихардса и его учеников, 0,0011175 граммов, или для других простых тел, равную выше приведенным величинам для эквивалентов, деленным на 96580. От такого специального значения этого термина должно отказаться, чтобы избежать возможных недоразумений в количественном значении слова эквивалент. Очевидно, что можно взять любое весовое количество одного простого тела и найти эквивалентные ему количества других простых тел, но раз применяется слово эквивалент или какая-либо его определенная доля, должно считать приведенные выше в списке величины, а также и другие величины эквивалентов, применяемые в химии. В новейшей научной литературе часто встречается термин грамм-эквивалент. Невозможно допустить, чтобы в электрохимии он имел иное значение, чем в общей химии. Грамм-эквивалент для серебра будет 107,93 грамма, для алюминия 9,03 грамма и т. д., независимо от методов опредедения.
Вл. Кистяковский.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон.
1890—1907.