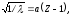Вероятно речь идёт о s-, p-, d- и f-элементах. Определить это очень просто. У s- элементов заполняются электронами s- орбитали, y p- элементов — p-орбитали и т.д. Посмотрите в Периодическую таблицу. Скажем, второй период. У элемента Li конфигурация внешнего электронного слоя 2s1, то есть на s-орбитали имеется один электрон. Значит, Li — это s-элемент. Далее стоит Be. У него s-орбиталь содержит на один электрон больше, чем у Li, то есть конфигурация Be — 2s2. Это тоже s-элемент. Следующие 6-элементов (от B до Ne) — это p-элементы. У них электроны заполняют уже не s-орбиталь как у Li и Be, а p-орбиталь. Каждый следующий атом, начиная с Be, имеет на p-орбитали на один электрон больше, чем предыдущий.
Третий период совершенно аналогичен второму. Сначала идут два s-элемента: Na и Mg, затем идут 6 p-элементов: Al — Ar.
Четвертый период начинается снова с двух s-элементов (K, Ca). Но в третьем периоде существует «вставка» из 10-ти d-элементов (от Sc до Zn). У них заполняются d-орбитали. А после цинка идут 6 p-элементов (Ga-Kr).
Пятый период аналогичен четвертому. А вот в шестом периоде возникает еще одна «вставка» из 14-ти f-элементов. Их называют Лантаноиды и обычно выносят за пределы таблицы. У лантаноидов заполняются электронами f-орбитали. Итак, шестой период, как и все предыдущие периоды начинается с двух s-элементов (Cs, Ba), затем идёт один d-элемент La, затем идёт вставка f-элементов (Лантаноиды), затем с Hf до Hg происходит заполнение d-орбиталей (это d-элементы) и заканчивается период шестью p-элементами (Tl — Rh).
Седьмой период был бы аналогичен шестому, если бы был закончен.
Если Вы заметили, количество элементов каждого семейства в одном периоде равно максимальному количеству электронов на соответствующих орбиталях. Например, s-электронов два, s-элементов в одном периоде два, p-электронов шесть, p-элементов тоже шесть в одном периоде, d-электронов 10, а f-электронов 14, такое же количество d- и f- элементов в каждом периоде.
В зависимости от того, какой подуровень
последним заполняется электронами, все
элементы делятся на четыре типа –
электронные семейства:
-
s
– элементы;
заполняется электронами s
– подуровень внешнего уровня. К ним
относятся первые два элемента каждого
периода. Валентными1являютсяs-электроны
внешнего уровня. -
p
– элементы;
заполняется электронами р – подуровень
внешнего уровня. Это последние шесть
элементов каждого периода (кроме I
и VII).
Валентными
являются s—
и p—
электроны внешнего уровня. -
d
– элементы; заполняется
электронами d
– подуровень второго снаружи уровня,
а на внешнем уровне – один или два
электрона (y
46Pd
– нуль). К ним относятся элементы
вставных декад больших периодов,
расположенных между s
– и p
– элементами (их также называют
переходными элементами). Валентными
являются s
– электроны внешнего уровня и d
– электроны предвнешнего уровня
(второго
снаружи). -
f
– элементы;
заполняется электронами f
– подуровень третьего снаружи уровня,
а на внешнем уровне остается два
электрона. Они расположены в 6 – м (4f
– элементы) и 7 – м (5f
– элементы) периодах периодической
системы. 4f
– элементы объединяют в семейство
лантаноидов, а 5f
– элементы – семейство актиноидов.
В периодической системе s – элементов
14, p – элементов 30, d – элементов 38, f –
элементов 28.
2.9. Понятие об электронных аналогах
Атомы элементов с одинаковым заполнением
внешнего энергетического уровня носят
название электронных аналогов.Например:
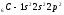
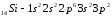
Элементы с одинаковым строением
внешнего и предвнешнего энергетических
уровней называют полными электронными
аналогами.Например:
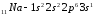
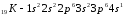
2.10. Периодический закон и периодическая система элементов д.И. Менделеева
Важнейшим событием химии в 19 веке было
открытие периодического закона, сделанное
в 1869 г. гениальным русским ученым Д.
И. Менделеевым. Периодический закон
в формулировке Д. И. Менделеева гласит:
“ свойства элементов, а потому и свойства
образуемых ими простых и сложных тел,
стоят в периодической зависимости от
их атомного веса”.
Графическим выражением этого закона
стала созданная им периодическая система
элементов.
В настоящее время известно несколько
сотен вариантов периодической системы
элементов, но все они в своей основе
содержат предложенные Менделеевым
принципы её построения. Наибольшее
распространение получили короткая
(восьмиклеточная) и длинная
(тридцатидвухклеточная) формы периодической
система элементов.
Развитие учения о строении атома вскрыло
глубокий физической смысл периодического
закона. Как было доказано, свойства
элементов зависят, прежде всего, от
заряда атомных ядер, который в свою
очередь определяет распределение
электронов на электронных оболочках
атомов. Основной характеристикой атома
является положительный заряд ядра,
численно равный порядковому номеру
элемента. В нейтральном атоме заряд
ядра и общее число электронов равны.
Распределением электронов на электронных
оболочках атомов определяются свойства
элементов и их соединений, положение
элемента в периодической системе.
Периодичность изменения свойств
химических элементов и их соединений
зависит от периодически повторяющейся
сходной структуры электронных оболочек
атомов.
В 1913 г. ученик Резерфорда английский
ученый Мозли, исследуя спектры лучей
Рентгена для различных элементов,
установил простое соотношение между
длиной волны рентгеновских лучей и
порядковым номером элемента (закон
Мозли):
Корень квадратный из величины, обратной
длине волны рентгеновских лучей,
испускаемых атомами различных элементов,
находится в линейной зависимости от
порядкового номера элемента, т. е.
где
– длина волны; Z
– порядковый номер элемента;
– постоянная, одинаковая для всех
элементов.
Из
уравнения следует, что, зная
и измерив ,
можно вычислить порядковый номер
элемента. Это экспериментальный метод
проверки правильности распределения
элементов в периодической системе по
возрастанию заряда ядра. Закон Мозли
показал, что Д.И. Менделеев правильно
расположил элементы в периодической
системе, позволил установить общее
число элементов в каждом периоде, а
главное, направил усилия ученых на
открытие предсказанных им элементов.
Вскоре несколько элементов было открыто
с помощью анализа рентгеновских спектров
(гафний, Z=72;
рений, Z=75
и др.).
Вместе с тем из закона
Мозли следует, что порядковый номер –
это не простая нумерация элементов, а
выражение конкретного внутреннего
свойства атома – величины элементарных
положительных зарядов ядра. Именно
положительный заряд ядра (а не атомная
масса) является главной характеристикой
атома.
В
свете современных представлений о
строении атома изменилась и формулировка
периодического закона: свойства
химических элементов, а также формы и
свойства их соединений находятся в
периодической зависимости от величины
заряда атомных ядер.
Перейти к контенту
Панель информации
-
Вход
-
Панель информации
-
Курсы
-
Календарь
-
Входящие
Закрыть
На этой странице вы узнаете:
- Чем общежития электронов отличаются от студенческих?
- В атомах химических элементов есть свои уровни комфортности?
- Химические элементы делятся на семейства? Это что, биология какая-то?
Сейчас в обществе все больше набирает оборот модный тренд — минималистичный образ жизни. Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.

Видимо, по такому принципу «живет» хорошо нам знакомый товарищ — водород. У него всего один электрон, который всегда на своем месте. А как быть, например, с атомом хлора, у которого их аж 17, ведь их надо содержать в порядке? Сейчас мы с вами узнаем, как располагаются электроны в электронной оболочке атома и многое другое.
Строение электронной оболочки атома
Представим, что электрон — это студент, а электронная оболочка атома — общежитие. Как будет жить наш студент в общежитии?
Разберемся сначала с «планом помещения».
- В нём есть отдельные комнаты, которые называются атомными орбиталями — в них могут проживать максимум 2 электрона.
- Несколько комнат объединяются в блок с общей кухней — их мы назовем энергетическими подуровнями.
- Этажи общежития — энергетические уровни. Определенный этаж содержит определенное количество блоков.
Таким образом, все электроны «живут» на энергетических уровнях-этажах, каждый из которых имеет энергетические подуровни-блоки со своими орбиталями-комнатами.
То, что мы видим с вами на рисунке — электронно-графическая формула для отдельных атомов химических элементов — это расположение всех его электронов на орбиталях.
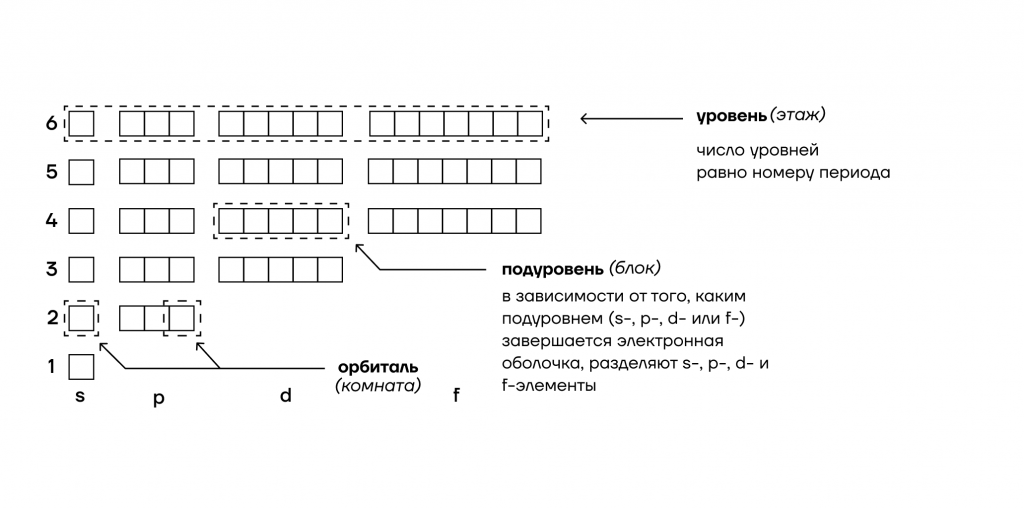
1. Энергетические уровни (этажи) имеют порядковую нумерацию. Причем на первом уровне располагается всего один подуровень (блок), на втором — два, на третьем — три, на четвертом и последующих — по 4.
2. Подуровни (блоки) обозначают в следующем порядке по мере отдаления от ядра: s (имеет одну орбиталь) → p (три орбитали) → d (пять орбиталей)→ f (семь орбиталей).
3. Орбиталь (комната) специального обозначения не имеет. Может содержать максимум 2 электрона (студента).
Как нам поможет Периодическая таблица химических элементов Д.И. Менделеева при заполнении схемы строения электронных оболочек атомов?
- Число электронов в атоме химического элемента равно его порядковому номеру в Периодической системе Д. И. Менделеева.
- Количество уровней совпадает с номером периода, в котором располагается элемент: 1, 2, 3…
- Количество электронов на внешнем энергетическом уровне для элементов главных (A) подгрупп можно также легко узнать — в какой группе по номеру расположен химический элемент, столько электронов и будет находиться на его внешнем уровне.
- Для элементов побочных подгрупп количество электронов на внешнем энергетическом уровне равно двум. Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
- Количество валентных электронов для элементов главных (A) подгрупп равно номеру группы, для элементов побочных подгрупп — числу электронов на внешнем энергетическом уровне и незаполненном предвнешнем подуровне.
Это можно использовать для проверки своих действий при распределении электронов по уровням.
Уже сейчас, используя полученную информацию, мы можем решить задание №2 ОГЭ по химии.
На приведенном рисунке изображена модель атома химического элемента.

Запишите в таблицу порядковый номер в Периодической системе (Х) химического элемента, модель атома которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе.
| X | Y |
Решение:
1) Порядковый номер химического элемента в Периодической системе можно определить по числу электронов в атоме. Сосчитав все электроны, получаем, что их 14 штук, следовательно, X — 14.
2) Номер группы Периодической системы, в которой расположен химический, элемент можно узнать по числу электронов на его внешнем электронном уровне. Сосчитав их, получим, что их 4 штуки, следовательно, Y — 4.
Ответ: 144
Электронная конфигурация атома
Для изображения строения электронных слоев атома (электронной конфигурации) пользуются условной записью.

Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз. Это называется принципом Паули.
Он гласит, что два электрона не могут иметь одинаковые спины. Спин — характеристика электрона, проще всего его можно представить как вращение электрона по часовой стрелке и против часовой, поэтому в ячейке они расположены в противоположном направлении (то есть +1/2 и -1/2).
При заполнении этих ячеек удобно пользоваться правилом Хунда (или правилом «трамвайного вагона»):
Ты приглядись, решив присесть,
К местам трамвайного вагона:
Когда ряды пустые есть,
Подсаживаться нет резона.
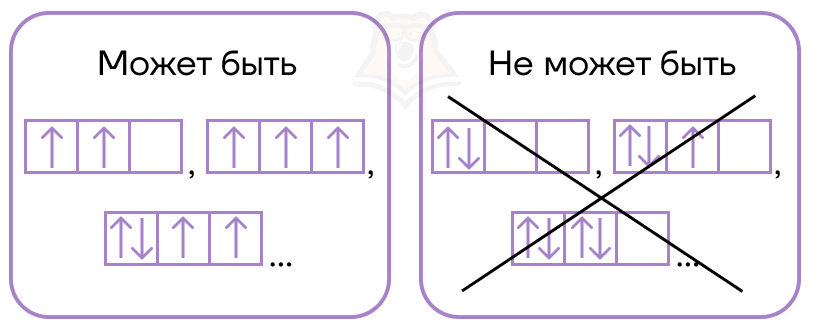
В нашем с вами примере студентов заселяют по одному в комнату пока это возможно.
Важное замечание: в комнате не больше двух студентов — атомная орбиталь вмещает максимально два электрона.
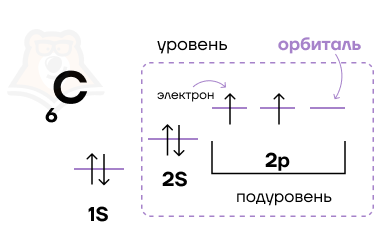
Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы:
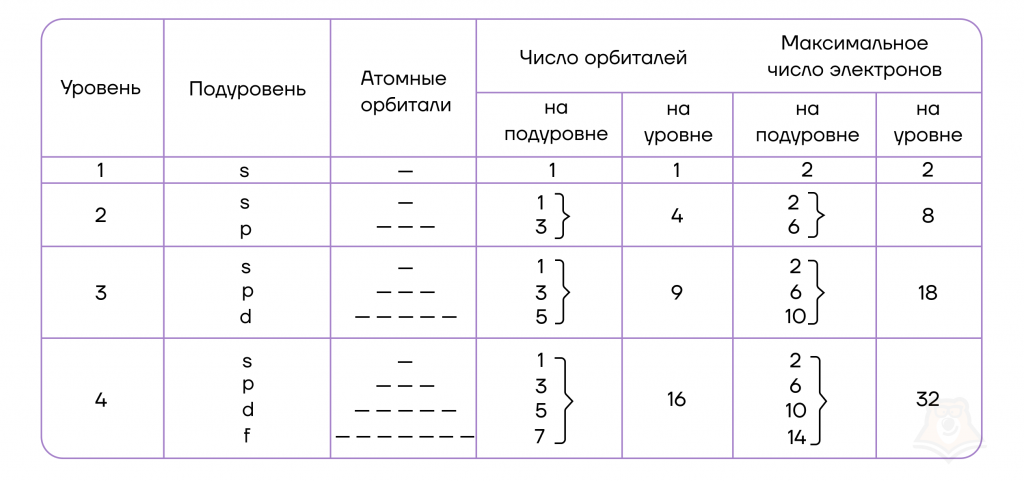
Да, проанализировав таблицу, мы увидим, что на s-подуровне (блоке) может находиться не больше двух электронов, на p-подуровне — не больше шести электронов, на d-подуровне — не больше десяти электронов, на f-подуровне — не больше четырнадцати электронов.
Электроны, как и студенты, стремятся занять более комфортные места, так система стремится к минимуму энергии. Порядок заполнения подуровней в атомах химических элементов следующий:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → …
Согласитесь, если студентам заселиться в блок вдвоем, им будет проще найти друг с другом общий язык, чем если бы их было в блоке четырнадцать.
Схематично порядок заполнения энергетических подуровней электронно-графической формулы представлен на картинке:

После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.

Потренируемся в написании электронной конфигурации на примере атомов хлора и титана.
Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме:
— четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены;
— четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне;
— всего двадцать два электрона (порядковый номер).
В соответствии с порядком заполнения орбиталей распределим электроны:
22Ti 1s22s22p63s23p64s23d2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше.
Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома хлора составлена верно.
К счастью, с биологией у атомов химических элементов мало общего, иначе, представьте, что в качестве домашнего питомца у вас был бы атом хлора, а в зоопарке бы показывали семью атомов золота. Что-то из области фантастики, не так ли?
Однако, да, химические элементы разделяют на семейства по строению их электронных оболочек. Таких семейств выделяют четыре:
— s-элементы — это элементы IA и IIA групп, в их атомах последний электрон занимает место на s-подуровне внешнего энергетического уровня;
— p-элементы — это элементы IIIA-VIIA групп, в их атомах последний электрон занимает место на p-подуровне внешнего энергетического уровня;
— d-элементы — это элементы побочных подгрупп, в их атомах последний электрон занимает место на d-подуровне предвнешнего энергетического уровня;
— f-элементы — это лантаноиды и актиноиды, 4f- и 5f-элементы соответственно, в их атомах последний электрон занимает место на f-подуровне предпредвнешнего энергетического уровня.
Таким образом, мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента.
Фактчек
- Электроны располагаются на электронных уровнях, причем их число определяется положением элемента в Периодической системе (по номеру периода).
- Энергетические уровни, в свою очередь, состоят из подуровней.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками.
- По принципу Паули на каждой атомной орбитали могут располагаться максимально два электрона, причем их спины должны быть противонаправлены.
- Электроны располагаются по подуровням так, чтобы энергия системы была минимальна.
- Химические элементы делятся на s-, p-, d- и f-семейства по тому, на какой подуровень пишем последний электрон при составлении электронной конфигурации атома.
Проверь себя
Задание 1.
Сколько электронов может максимально располагаться на орбитали?
- 1 электрон
- 2 электрона
- 3 электрона
- 4 электрона
Задание 2.
Как атомные подуровни заполняются электронами?
- в порядке увеличения их энергии
- в порядке уменьшения их энергии
- в периодическом порядке
Задание 3.
Сколько атомных орбиталей содержит d-подуровень?
- 1
- 3
- 5
- 7
Задание 4.
Какую форму имеет s-орбиталь?
- шара
- гантели
- эллипса
- нескольких гантелей
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.