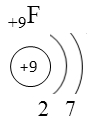Электронное строение атома фтора
Электронное строение нейтрального атома фтора в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме фтора.
F
+9
2
7
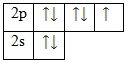
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме фтора.
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома фтора выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома фтора.
9F 1s2 2s2 2p5
Сокращённая электронная конфигурация атома фтора.
9F [He] 2s2 2p5
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома фтора.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 2s | 2 | 0 | 0 | +½ |
| -½ | ||||
| 2p | 2 | 1 | -1 | +½ |
| -½ | ||||
| 1 | +½ | |||
| -½ | ||||
| 2 | +½ |
F (фтор) — элемент с прядковым номером 9 в периодической системе.
Находится во II периоде. Температура плавления: -219.6 ℃. Плотность: 0.00158 г/см3.
Электронная формула атома фтора:
1s2 2s2 2p5
Сокращенная электронная конфигурация F:
[He] 2s2 2p5
Ниже приведена электронно-графическая схема атома фтора
Распределение электронов по энергетическим уровням в атоме F
1-й уровень (K): 2
2-й уровень (L): 7
Валентные электроны фтора
Количество валентных электронов в атоме фтора — 7.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 2 | 0 | 0 | +1/2 |
| s | 2 | 0 | 0 | -1/2 |
| p | 2 | 1 | -1 | +1/2 |
| p | 2 | 1 | 0 | +1/2 |
| p | 2 | 1 | 1 | +1/2 |
| p | 2 | 1 | -1 | -1/2 |
| p | 2 | 1 | 0 | -1/2 |
Степени окисления, которые может проявлять фтор: -1
Фтор в таблице менделеева занимает 9 место, в 2 периоде.
| Символ | F |
| Номер | 9 |
| Атомный вес | 18.9984032 |
| Латинское название | Fluorum |
| Русское название | Фтор |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема фтора
F: 1s2 2s2 2p5
Короткая запись:
F: [He]2s2 2p5
Одинаковую электронную конфигурацию имеют
атом фтора и
N-2, O-1
Порядок заполнения оболочек атома фтора (F) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Фтор имеет 9 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
5 электронов на 2p-подуровне
Степень окисления фтора
Атомы фтора в соединениях имеют степени окисления 0, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы фтора
Валентность F
Атомы фтора в соединениях проявляют валентность .
Валентность фтора характеризует способность атома F к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа F
Квантовые числа определяются последним электроном в конфигурации,
для атома F эти числа имеют значение N = 2, L = 1, Ml = 0, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения фтора
| Тип | Формула | Название |
|---|---|---|
| Минерал | CaF2 | Флюорит |
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации F:
Eo = 1681 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где F в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Содержание
- Строение атома фтора
- Общие сведения о строении атома фтора
- Электронное строение атома фтора
- Примеры решения задач
- Фтор, свойства атома, химические и физические свойства
- Фтор, свойства атома, химические и физические свойства.
- Атом и молекула фтора. Формула фтора. Строение атома фтора:
- Изотопы и модификации фтора:
- Свойства фтора (таблица): температура, плотность, давление и пр.:
Строение атома фтора
Общие сведения о строении атома фтора
Порядковый номер равен 9. Заряд ядра равен +9. Атомный вес – 18,998 а.е.м. Это единственный стабильный нуклид фтора.
Электронное строение атома фтора
Атом фтора имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы – VII (галогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 7 валентных электронов и до завершения внешнего энергетического уровня не хватает всего одного электрона. Обладает самой высокой окислительной способностью среди всех элементов Периодической системы.
Рис. 1. Условное изображение строения атома фтора.
Электронная конфигурация основного состояния записывается следующим образом:
Фтор – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
У фтора есть 3 пары спаренных электронов и один неспаренный электрон. Во всех своих соединениях фтор проявляет валентность I и степень окисления -1.
В результате взаимодействия фтор является акцептором электронов. В этом случае атом превращается в отрицательно заряженный ион (F — ):
Примеры решения задач
| Задание | Определите емкость подуровня, для которого магнитное квантовое число принимает пять значений. |
| Решение | Пять значений принимает магнитное квантовое число для d-подуровня. Емкость подуровня – это максимальное число электронов на подуровне. Число орбиталей на подуровне определяется по формуле: |
где l – орбитальное квантовое число. На каждой орбитали могут находиться два электрона. Для d-подуровня l=2, поэтому емкость d-подуровня равна:
Следовательно, d-подуровень максимально вмещает 10 электронов.
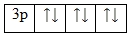
| Задание | Охарактеризуйте квантовыми числами все электроны, которые находятся на 3p-подуровне. |
| Решение | На p-подуровне 3-го уровня находится шесть электронов: |
Их можно охарактеризовать следующими квантовыми числами:
Источник
Фтор, свойства атома, химические и физические свойства
Фтор, свойства атома, химические и физические свойства.
18,998403163(6) 1s 2 2s 2 2p 5
Фтор — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 9. Расположен в 17-й группе (по старой классификации — главной подгруппе седьмой группы), втором периоде периодической системы.
Атом и молекула фтора. Формула фтора. Строение атома фтора:
Фтор (лат. Fluorum, от др.-греч. φθόρος — «разрушение, порча, вред») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением F и атомным номером 9. Расположен в 17-й группе (по старой классификации – главной подгруппе седьмой группы), втором периоде периодической системы.
Фтор самый лёгкий элемент периодической таблицы химических элементов Д. И. Менделеева из группы галогенов.
Фтор самый химически активный неметалл и сильнейший окислитель.
Фтор обозначается символом F.
Как простое вещество фтор при нормальных условиях представляет собой двухатомный газ бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор.
Молекула фтора двухатомна.
Химическая формула фтора F2.
Электронная конфигурация атома фтора 1s 2 2s 2 2p 5 . Потенциал ионизации (первый электрон) атома фтора равен 1681,05 кДж/моль (17,42282 (5) эВ).
Строение атома фтора. Атом фтора состоит из положительно заряженного ядра (+9), вокруг которого по двум оболочкам движется 9 электронов. При этом 2 электрона находятся на внутреннем уровне, а 7 электронов – на внешнем. Поскольку фтор расположен во втором периоде, оболочек всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлены s- и р-орбиталями. На внешнем энергетическом уровне атома фтора на 2s-орбитали находятся два спаренных электрона, на 2p-орбитали находятся четыре спаренных электрона и один неспаренный электрон. В свою очередь ядро атома фтора состоит из 9 протонов и 10 нейтронов. Фтор относится к элементам p-семейства.
Радиус атома фтора (вычисленный) составляет 42 пм.
Атомная масса атома фтора составляет 18,998403163(6) а. е. м.
Содержание фтора в земной коре составляет 0,054 %, в морской воде и океане – 0,00013 %.
Фтор очень ядовит.
Изотопы и модификации фтора:
Свойства фтора (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Фтор |
| 102 | Прежнее название | |
| 103 | Латинское название | Fluorum |
| 104 | Английское название | Fluorine |
| 105 | Символ | F |
| 106 | Атомный номер (номер в таблице) | 9 |
| 107 | Тип | Неметалл |
| 108 | Группа | Галоген |
| 109 | Открыт | Андре-Мари Ампер, Франция, 1810 г. |
| 110 | Год открытия | 1810 г. |
| 111 | Внешний вид и пр. | Газ бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Ядовит |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации фтора:
– α-фтор с простой моноклинной кристаллической решёткой, – β-фтор с простой кубической кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,054 % |
| 120 | Содержание в морях и океанах (по массе) | 0,00013 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,00004 % |
| 122 | Содержание в Солнце (по массе) | 0,00005 % |
| 123 | Содержание в метеоритах (по массе) | 0,0087 % |
| 124 | Содержание в организме человека (по массе) | 0,0037 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 18,998403163(6) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 5 |
| 203 | Электронная оболочка | K2 L7 M0 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 42 пм |
| 205 | Эмпирический радиус атома* | 50 пм |
| 206 | Ковалентный радиус* | 71 пм |
| 207 | Радиус иона (кристаллический) | F –
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса* | 147 пм |
| 209 | Электроны, Протоны, Нейтроны | 9 электронов, 9 протонов, 10 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 17-ая группа (по старой классификации – главная подгруппа 7-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, 0 |
| 302 | Валентность | I |
| 303 | Электроотрицательность | 3,98 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1681,05 кДж/моль (17,42282 (5) эВ) |
| 305 | Электродный потенциал | F2 + 2e – → 2F – , E o = +2,87 В |
| 306 | Энергия сродства атома к электрону | 328,1649(3) кДж/моль (3,4011898(24) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,001696 г/см 3 (при 0 °C и иных стандартных условиях , состояние вещества – газ),
1,505 г/см 3 (при температуре кипения -188,11 °C и иных стандартных условиях , состояние вещества – жидкость), 1,587 г/см³ (при -218 °C и иных стандартных условиях , состояние вещества – жидкость), 1,81 г/см 3 (при -225 °C и иных стандартных условиях , состояние вещества – твердое тело), 1,7 г/см 3 (при -228 °C и иных стандартных условиях , состояние вещества – твердое тело), 1,5 г/см 3 (при -273 °C и иных стандартных условиях , состояние вещества – твердое тело) |
| 402 | Температура плавления* | -219,67 °C (53,48 K, -363,41 °F) |
| 403 | Температура кипения* | -188,11 °C (85,03 K, -306,60 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 0,5104 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,51 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 31,34 Дж/(K·моль) |
| 411 | Молярный объём | 11,202 см³/моль |
| 412 | Теплопроводность | 0,02591 Вт/(м·К) (при стандартных условиях ),
0,028 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-фтор |
| 512 | Структура решётки | Простая моноклинная
|
| 513 | Параметры решётки | a = 5,478 Å, b = 3,27 Å, c = 7,265 Å, β = 102,088° |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | С12/с1 |
| 517 | Номер пространственной группы симметрии | 15 |
| 521 | Кристаллическая решётка #2 | β-фтор |
| 522 | Структура решётки | Простая кубическая
|
| 523 | Параметры решётки | a = 5,531 |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | |
| 527 | Номер пространственной группы симметрии | |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7782-41-4 |
205* Эмпирический радиус атома фтора согласно [3] составляет 73 пм.
206* Ковалентный радиус фтора согласно [1] и [3] составляет 64 пм и 72 пм соответственно.
208* Радиус Радиус Ван-дер-Ваальса согласно [1] составляет 135 пм.
401* Плотность фтора согласно [4] составляет 0,001693 г/см 3 (при 0 °C и иных стандартных условиях , состояние вещества – газ).
402* Температура плавления фтора согласно [3] и [4] составляет -219,62 °C (53,53 K, -363,32 °F) и -219,6 °C (53,55 K, -363,28 °F) соответственно.
403* Температура кипения фтора согласно [3] и [4] составляет -188,12 °C (85,03 K, -306,62 °F) и -188,13 °C (85,02 K, -306,63 °F) соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) фтора согласно [3] и [4] составляет 6,544 кДж/моль и 6,54 кДж/моль соответственно.
Источник
На чтение 12 мин Просмотров 3.5к. Опубликовано 28.04.2022
Фтор (F) — девятый и первый элемент периодической таблицы. Он также составляет группу-17. Фтор (F) является галогенным элементом. Его символ «F». Фтор участвует в образовании связей через валентные электроны. Это самый тяжелый галоген, и при нормальных условиях он существует в виде токсичного бледно-желтого двухатомного бензина. Можно объяснить его высокую способность притягивать электроны и небольшой размер его молекул. Это самый негативный элемент. Однако он реагирует со всеми элементами, кроме аргона и неона.
Содержание
- Истории
- Использование
- Положение фтора в периодической таблице.
- Влияние фтора на здоровье
- Воздействие фтора на окружающую среду
- Химия фтора и соединения
- Природное изобилие
- Изоляция фтора
- Биологическая роль
- Каковы валентные электроны фтора (F)?
- Какое количество электронов, протонов и нейтронов содержит F-атом?
- Как можно рассчитать количество валентных электронов в атоме фтора (F)?
- Расчет общего числа электронов во фторе (F)
- Фтор (F) должен иметь электронную конфигурацию
- Рассчитайте общее количество электронов и определите валентную оболочку
- Образование соединений фтора валентными электронами
- Какое число валентных электронов имеет ион фтора (F –)?
- Какова валентность фтора (F)?
- Факты
- Рекомендации:
Истории
Этот элемент искали ранние химики, которые много лет пытались изолировать его от различных фторидов. Немецкий химик Карл О. Кристи синтезировал фтор в 1986 году. Его результаты были опубликованы в журнале Inorganic Chemistry. Хотя фтор в природе не встречается в окружающей среде, в 2012 году ученые обнаружили его небольшое количество в антозоните, который является радиоактивным флюоритом.
Использование
До Второй мировой войны коммерческого производства не было. Разработка атомной бомбы и других проектов в области ядерной энергетики позволили производить большое количество фтора. Соли фтора (также известные как фториды) десятилетиями использовались для сварки и матирования стекла.
Этот элемент необходим для получения гексафторида урана. Он требуется атомной энергетике для разделения изотопов урана. Его также можно использовать для производства гексафторида серы, который является изоляционным газом в мощных электрических трансформаторах.
Фактически, фтор используется во многих фторсодержащих химикатах, включая растворители и высокотемпературные пластмассы, такие как тефлон (поли(тетрафторэтен), ПТФЭ). Тефлон, известный своими антипригарными свойствами, также используется в сковородах. Для травления стекол лампочек и подобных целей можно использовать плавиковую кислоту.
Положение фтора в периодической таблице.
Влияние фтора на здоровье
Фтор естественным образом содержится в небольших количествах в воде, воздухе и растениях. Фтор попадает в организм человека через питьевую воду, пищу и воздух. В очень небольших количествах фтор можно найти практически везде. Чай и моллюски могут содержать большое количество фтора.
Фтор жизненно важен для поддержания прочности наших костей. Фтор может защитить нас от кариеса, если мы используем зубную пасту два раза в день. Фтор может всасываться слишком часто, что может привести к кариесу, остеопорозу и повреждению почек, костей и нервов.
Воздействие фтора на окружающую среду
Фтор в воздухе осядет в осадок, если попадет в воду. Фтор, содержащийся в почве, прикрепляется к частицам почвы. Фтор не может быть разрушен в окружающей среде. Он может только изменить свою форму.
Растения могут накапливать фтор из почвы. Тип растения, тип почвы и количество фтора в почве влияют на количество фтора, поглощаемого растениями. Низкий уровень фтора может привести к повреждению листьев и снижению роста растений, чувствительных к фтору. Слишком много фтора, который представляет собой пшеница, поглощаемый из почвы корнями или поглощаемый листьями из атмосферы, может замедлить рост растений и снизить урожайность сельскохозяйственных культур. Абрикосы и кукуруза более восприимчивы.
Химия фтора и соединения
Токсичность ионов фтора
Фторид или бифторид (HF2) может проходить через организм в очень малых количествах. Нет никаких долгосрочных эффектов. Поэтому он используется в зубной пасте. Фторид и бифторид токсичны, если вы получаете более 100 мг. Даже небольшое количество может оказаться фатальным.
Состояния окисления
Фтор имеет чрезвычайно сильное сродство к электронам и имеет степень окисления -1. Когда он образует соединения.
Гексафторид урана
Гексафторид урана (UF6) представляет собой белую кристаллическую жидкость. Он используется для разделения изотопов U-235 и U-238. Его молекула имеет красивую восьмигранную форму. Он превращается в токсичный плотный газ при 56,5°С. Плавиковая кислота образуется при контакте с водой. В 1944 году это привело к гибели двух человек. Он содержит 686 000 тонн обедненного гексафторида урана. Это ошеломляющее количество хранится в стальных цилиндрах в Кентукки и Огайо. Их нужно будет убрать в 21 веке.
Гидрофтористая кислота
Плавиководородная кислота представляет собой раствор фтористого водорода с формулой HF. Это одно из самых популярных соединений фтора. Это опасно и очень агрессивно. Технически это слабая кислота. Это означает, что его Ка мала. Вы можете сделать это, смешав фторид кальция с серной кислотой. Это может быть очень опасно и может легко обжечься и проникнуть в кожу. Его можно нейтрализовать гидроксидом кальция.
Природное изобилие
Флюорит, плавиковый шпат и криолит являются наиболее популярными минералами фтора. Однако его можно найти и в других минералах. Это 13-й по распространенности элемент в земной коре. Фтор можно получить электролизом в безводных плавиковых кислотах раствора гидродифторида калия (KHF2) и гидродифторида калия.
| атомный номер | 9 |
|---|---|
| атомный вес | 18.998403163 |
| точка кипения | −188 ° C (−306 ° F) |
| температура плавления | −219,62 ° C (−363,32 ° F) |
| плотность (1 атм, 0 ° C или 32 ° F) | 1,696 г/л (0,226 унции/галлон) |
| степени окисления | −1 |
| электронная конфигурация. | 1 с 2 2 с 2 2 п 5 |
Изоляция фтора
Как известно, элементарный фтор может быть весьма опасен. Фтор можно «легко» получить электролизом раствора гидрофторида калия в безводной плавиковой кислоте. Чистую плавиковую кислоту использовать нельзя, так как она не проводит электричество. Ионы гидроксида превращаются в ионы кислорода. Комбинация гидродифторида калия с фтороводородом приводит к низким рабочим температурам 86,85°C, что снижает потребность в хорошей изоляции ячейки. Анод изготовлен из твердого, стойкого к коррозии углерода, а катоды электродной ячейки изготовлены из прочной стали. Газообразный фтор образуется после окончания процесса электролиза.
Биологическая роль
Фтор – необходимый для животных элемент, укрепляющий зубы и кости. Иногда в воду добавляют фтор. Считается, что фториды предотвращают кариес, если их концентрация в питьевой воде ниже 2 частей на миллион. Содержание фтора выше этого уровня может вызвать появление пятен на эмали детских зубов. Зубная паста также может содержать фтор. Фтор содержится в организме среднего человека в количестве 3 миллиграммов. Фтор может быть токсичным. Фтор из элементарного фтора может быть чрезвычайно токсичным.
Фтор (F) — неметаллический элемент. Фтор — элемент 17-й группы. Валентный электрон относится к числу электронов, оставшихся на последней орбите оболочки. Валентные электроны – это общее количество электронов, обнаруженных в оболочке, содержащей фтор после того, как она была преобразована в электронную конфигурацию. Свойства элемента определяются валентными электронами. Они также участвуют в образовании связей. Электронная конфигурация фтора показывает, что на последней оболочке (орбите) фтора семь электронов. На этом сайте есть статья, в которой объясняется электронная конфигурация фтора. При желании можно прочитать.
Какое количество электронов, протонов и нейтронов содержит F-атом?
Ядро можно найти в середине атома. Ядро является домом для протонов и нейтронов. Атомный номер фтора (F) равен 9. Число протонов называется атомным номером. Количество протонов во фторе равно девяти. Ядро содержит орбиту (или круговую оболочку), в которой находятся электроны, равные протонам. Атомы фтора содержат в общей сложности девять электронов.
Разница между числом атомов и числом атомных масс определяет число нейтронов в элементе. Это означает, что число нейтронов (n) = атомная масса (A) + атомный номер (Z).
Мы знаем, что атомный номер фтора (F) равен 9, а его атомное массовое число (около 19,9984) равно 19. Нейтрон (n) = 19 – 9 = 10. Фтор (F) имеет в общей сложности 10.
Валентность – это способность атома химического элемента образовывать определенное количество химических связей с другими атомами. Он принимает значения от 1 до 8 и не может быть равен 0. Он определяется количеством электронов атома, потраченных на образование химических связей с другим атомом. Валентность является реальной ценностью. Числовые значения валентности обозначены римскими цифрами (I,II,III,IV,V,VI,VII,VIII).
Как можно рассчитать количество валентных электронов в атоме фтора (F)?
Это шаги для определения валентного электрона. Одной из них является электронная конфигурация. Без электронной конфигурации невозможно определить валентность любого элемента. Легко определить валентность любого элемента, зная электронную конфигурацию. На этом сайте есть статья, объясняющая расположение электронов. Вы можете найти это здесь. Эта статья посвящена электронной конфигурации.
Однако можно идентифицировать валентные электроны, размещая электроны по принципу Бора. Теперь мы узнаем, как идентифицировать валентные электроны во фторе (F).
Расчет общего числа электронов во фторе (F)
Во-первых, мы должны знать количество электронов в атоме фтора (F). Вам нужно знать, сколько протонов содержится во фторе, чтобы определить число электронов. Чтобы узнать количество протонов, вы должны знать атомный номер элемента фтора.
Периодическая таблица необходима для определения атомного номера. Периодическая таблица содержит атомный номер для элементов фтора (F). Число протонов называется атомным номером. Ядро также содержит электроны, равные протонам.
Это означает, что теперь мы можем сказать, что число электронов в атомах фтора (F) равно 9. Атомный номер фтора (F) можно увидеть в периодической таблице. Общее количество электронов в атоме фтора (F) равно девяти.
Термины « степень окисления » и « валентность » могут не совпадать, но численно они почти идентичны. Условный заряд атома атома называется степенью окисления. Он может быть как положительным, так и отрицательным. Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.
Фтор (F) должен иметь электронную конфигурацию
Важный шаг 2 Этот шаг включает в себя расположение электронов во фторе. Общее число электронов в атомах фтора равно девяти. Электронная конфигурация фтора (F) показывает, что в K-оболочке два электрона, а в L-оболочке семь. Электронная конфигурация фтора (F) показывает, что первая оболочка (орбита) имеет два электрона, а вторая оболочка – семь. Электронная конфигурация фтора по суборбите может быть найдена как 1s 2 2s 2 2p 5 .
Рассчитайте общее количество электронов и определите валентную оболочку
Третий шаг — определение орбиты валентной оболочки. Валентная оболочка является последней оболочкой после электронной конфигурации. Валентный электрон — это общее количество электронов, находящихся на валентной оболочке. Электронная конфигурация фтора (F) показывает, что последняя оболочка фтора имеет семь (2s 2 2p 5 ) электронов. Таким образом, валентных электронов для фтора (F) семь.
- Валентность — числовая характеристика способности атомов данного элемента связываться с другими атомами.
- Валентность водорода постоянна и равна единице.
- Валентность кислорода также постоянна и равна двум.
- Валентность большинства других элементов непостоянна. Его можно определить по формулам их бинарных соединений с водородом или кислородом.
Образование соединений фтора валентными электронами
Через свои валентные электроны фтор участвует в образовании связей. Этот валентный электрон участвует в образовании связей с атомами других элементов. Атомы фтора создают связи, разделяя электроны и атомы водорода.
Электронная конфигурация водорода показывает, что водород имеет только один электрон. Разделяя электроны, один атом водорода (H) образует соединения фтороводорода (HF). Затем атом фтора завершает свою октаву и приобретает электронную конфигурацию неона.
Водород же приобретает электронную структуру гелия. Чтобы образовать соединение фтороводорода (HF) путем ковалентной связи, один атом фтора и один атом водорода делят электроны.
Какое число валентных электронов имеет ион фтора (F – )?
Электронная конфигурация показала, что конечная оболочка атома фтора (F) содержит семь электронов. Видно, что конечная оболочка (орбита) атома фтора содержит семь электронов после их расположения. В этом случае валентных электронов для фтора (F) семь. Это то, что мы знаем.
При образовании связи элементы с 5, 6 или 7 электронами получают электроны от содержащей их оболочки. Анионы — это элементы, которые принимают электроны для образования связей. Фтор (F) является примером анионного элемента.
Последняя оболочка принимает электроны при образовании связей фтора (F) и превращает их во фтор. Ион фтора (F – ), электронная конфигурация 1s 2 2s 2 2p 6 . Электронная конфигурация ионов фтора (F) показывает две оболочки (орбиту) и восемь электронов в последней оболочке.
Электронная конфигурация указывает на то, что фтор теперь находится в электронной конфигурации. В этом случае валентность ионов фтора равна -1. Валентные электроны фтора (F – ) имеют восемь электронов на оболочке, содержащей фтор.
Какова валентность фтора (F)?
Валентность (или валентность) — это способность атома элемента присоединяться к другому атому при образовании молекулы. Валентность — это количество неспаренных электронов, находящихся на последней орбитали элемента.
Электронная конфигурация фтора в возбужденном состоянии: F*(9) = 1s 2 2s 2 2p x 2 2p y 2 2p z 1 . Электронная конфигурация фтора указывает на наличие неспаренного электрона на последней орбитали фтора (2p z 1 ).
Таким образом, валентность фтора (F) равна 1.
Факты
- Фтор, имеющий атомный номер 9, является самым легким водородом. Фтор имеет стандартный атомный вес 18,9984. Это основано на фторе-19, который является его единственным естественным изотопа.
- Фтор является одним из наиболее активных и электроотрицательных химических элементов. Он не реагирует энергично с неоном, кислородом, гелием и аргоном.
- Джордж Гор смог выделить фтор с помощью электролитического метода в 1869 году. Однако эксперимент не удался, когда фтор вступал во взрывную реакцию с газообразным водородом. Анри Муассон получил Нобелевскую премию по химии в 1906 году за выделение фтора в 1886 году.
- F-19 — единственный стабильный изотоп фтора. Фтор-19, чувствительный к магнитным полям, используется в магнитно-резонансной томографии. Всего было синтезировано 17 радиоизотопов фтора. Их масса варьируется от 14 до 31.
- Фтор является 13-м наиболее распространенным элементом в земной коре. Фтор настолько реакционноспособен, что его нельзя найти в чистом виде, а можно найти только в соединениях.
- Фтор, хотя и довольно распространен на Земле, во Вселенной встречается очень редко. Считается, что он присутствует в концентрациях около 400 частей на миллиард.
- Фтор очень трудно хранить, потому что он очень реактивен. Например, плавиковая кислота (HF) настолько агрессивна, что может растворять стекло. Однако HF безопаснее чистого фтора, его легче транспортировать и использовать.
- Фтор можно использовать по-разному. Он содержится в виде фтора в зубной пасте и питьевой воде, в тефлоне (политетрафторэтилене), лекарствах, в том числе в химиотерапевтическом препарате 5-фторурациле, и плавиковой кислоте для травления. Он используется в качестве хладагента (хлорфторуглероды или CFC), в качестве топлива и для обогащения урана газом UF 6 . Фтор является несущественным элементом в питании животных и человека.
- При комнатной температуре и давлении чистый неметаллический элемент фтор представляет собой газ. Фтор представляет собой двухатомный элемент желтого цвета, который превращается из очень бледно-желтого двухатомного вещества (F 2 ) в ярко-желтую жидкость при температуре -188° по Цельсию (-307 по Фаренгейту).
Рекомендации:
- Беккер, С.; Мюллер, Б.Г. (1990). «Тетрафторид ванадия». Международное издание Angewandte Chemie на английском языке .
- Лиде, Дэвид Р. (2004). Справочник по химии и физике (84-е изд.).
- Барретт, CS; Мейер, Л.; Вассерман, Дж. (1967). «Фазовая диаграмма аргон-фтор».
- Эгеперс, Дж.; Моллард, П.; Девилье, Д.; Чемла, М .; Фарон, Р.; Романо, RE; Кью, JP (2000). «Соединения фтора, неорганические». Энциклопедия промышленной химии Ульмана .