Загрузить PDF
Загрузить PDF
В химии электроотрицательность — это способность атомов притягивать к себе электроны других атомов.[1]
Атом с высокой электроотрицательностью притягивает электроны сильно, а атом с низкой электроотрицательностью притягивает электроны слабо. Значения электроотрицательности используются при прогнозировании поведения различных атомов в химических соединениях.
-
1
Химические связи. Такие связи возникают, когда электроны в атомах взаимодействуют друг с другом, то есть два электрона (по одному из каждого атома) становятся общими.
- Описание причин взаимодействия электронов в атомах выходит за рамки данной статьи. Для получения подробной информации по этому вопросу прочитайте, например, эту статью.
-
2
Влияние электроотрицательности. Когда два атома притягивают электроны друг друга, то сила притяжения не является одинаковой. Атом с более высокой электроотрицательностью притягивает два электрона сильнее. Атом с очень высокой электроотрицательностью притягивает электроны с такой силой, что об общих электронах речь уже не идет.
- Например, в молекуле NaCl (хлорид натрия, обычная соль) атом хлора имеет достаточно высокую электроотрицательность, а атом натрия — довольно низкую. Таким образом, электроны притягиваются к атому хлора и отталкиваются от атомов натрия.
-
3
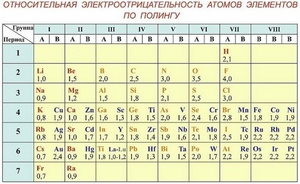
Таблица электроотрицательности. Эта таблица включает химические элементы, расположенные так же, как в таблице Менделеева, но для каждого элемента приведена электроотрицательность его атомов. Такую таблицу можно найти в учебниках по химии, справочных материалах и в сети.
-
Здесь вы найдете отличную таблицу электроотрицательности. Обратите внимание, что в ней используется шкала электроотрицательности по Полингу, которая наиболее распространен.[2]
Тем не менее существуют и другие способы вычисления электроотрицательности, об одном из которых будет рассказано ниже.
-
Здесь вы найдете отличную таблицу электроотрицательности. Обратите внимание, что в ней используется шкала электроотрицательности по Полингу, которая наиболее распространен.[2]
-
4
Тенденции электроотрицательности. Если у вас под рукой нет таблицы электроотрицательности, вы можете оценить электроотрицательность атома по расположению элемента в таблице Менделеева.
- Чем правее расположен элемент, тем больше электроотрицательность его атома.
- Чем выше расположен элемент, тем больше электроотрицательность его атома.
- Таким образом, атомы элементов, расположенных в правом верхнем углу таблицы Менделеева, имеют самые высокие электроотрицательности, а атомы элементов, расположенных в нижнем левом углу — самые низкие.
- В нашем примере NaCl можно сказать, что хлор имеет более высокую электроотрицательность, чем натрий, потому что хлор расположен правее натрия.
Реклама
-
1
Вычислите разницу между электроотрицательностями двух атомов, чтобы понять характеристики связи между ними. Для этого вычтите меньшую электроотрицательность из большей.
- Например, рассмотрим молекулу HF. Вычтите электроотрицательность водорода (2,1) из электроотрицательности фтора (4,0): 4,0 – 2,1 = 1,9.
-
2
Если разница меньше 0,5, то связь ковалентная неполярная, при которой электроны притягиваются практически с одинаковой силой. Такие связи образуются между двумя одинаковыми атомами. Неполярные связи, как правило, очень трудно разрушить.[3]
Все потому, что атомы делятся электронами, что делать их связь стабильной. Чтобы разрушить ее, нужно много энергии.[4]
- Например, молекула O2 имеет этот тип связи. Поскольку два атома кислорода имеют одинаковую электроотрицательность, разница между ними равна 0.
-
3
Если разница лежит в пределах 0,5 – 1,6, то связь ковалентная полярная. В этом случае один из двух атомов притягивает электроны сильнее и поэтому приобретает частичный отрицательный заряд, а второй — частичный положительный заряд. Такой дисбаланс в зарядах позволяет молекуле участвовать в некоторых реакциях.[5]
- Например, молекула H2O (вода) имеет такой тип связи. Атом О более электроотрицательный, чем два атома H, поэтому кислород притягивает электроны сильнее и приобретает частичный отрицательный заряд, а водород — частичный положительный заряд.
-
4
Если разница больше 2,0, то связь ионная. Это связь, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью, который приобретает отрицательный заряд, а атом с меньшей электроотрицательностью приобретает положительный заряд. Молекулы с такими связями хорошо реагируют с другими атомами и даже могут быть разрушены полярными атомами.
- Например, молекула NaCl (хлорид натрия) имеет такой тип связи. Атом хлора настолько электроотрицательный, что притягивает к себе оба электрона и приобретает отрицательный заряд, а атом натрия приобретает положительный заряд.
- NaCl может быть разрушен полярной молекулой, такой как H2O (вода). В молекуле воды водородная сторона молекулы положительна, а кислородная сторона отрицательна. Если смешать соль с водой, молекулы воды расщепят молекулы соли, в следствие чего она растворится.[6]
-
5
Если разница лежит в пределах 1,6 – 2,0, проверьте наличие металла. Если в молекуле присутствует атом металла, то связь ионная. Если в молекуле атомов металла нет, то связь полярная ковалентная.
- Металлы расположены слева и в центре таблицы Менделеева. В этой таблице металлы выделены.[7]
- В нашем примере HF разница между электроотрицательностями попадает в этот диапазон. Так как H и F не являются металлами, то связь полярная ковалентная.
Реклама
- Металлы расположены слева и в центре таблицы Менделеева. В этой таблице металлы выделены.[7]
-
1
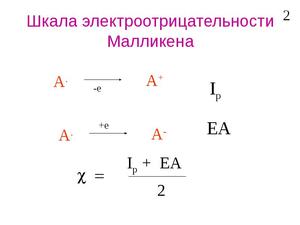
Найдите первую энергию ионизации атома. Шкала электроотрицательности по Малликену немного отличается от шкалы по Полингу, которая упоминалась выше. Первая энергия ионизации требуется для удаления одного атома из электрона.
- Значение такой энергии можно найти в справочниках по химии или в сети, например, здесь.[8]
- В качестве примера найдем электроотрицательность лития (Li). Его первая энергия ионизации равна 520 кДж/моль.
- Значение такой энергии можно найти в справочниках по химии или в сети, например, здесь.[8]
-
2
Найдите энергию сродства к электрону. Это энергия, выделяющаяся в процессе присоединения электрона к атому. Значение такой энергии можно найти в справочниках по химии или в сети, например, здесь.[9]
- Энергия сродства к электрону у лития равна 60 кДж/моль.
-
3
Воспользуйтесь уравнением электроотрицательности Малликена: ENMulliken = (1,97×10−3)(Ei+Eea) + 0,19.
- В нашем примере:
-
- ENMulliken = (1,97×10−3)(Ei+Eea) + 0,19
- ENMulliken = (1,97×10−3)(520 + 60) + 0,19
- ENMulliken = 1,143 + 0,19 = 1,333
-
Реклама
- В нашем примере:
Советы
- Кроме шкал по Полингу и Малликену, существуют шкалы электроотрицательности по Оллреду-Рочоу, Сандерсону, Аллену. Все они имеют свои собственные формулы для расчета электроотрицательности (некоторые из них довольно сложные).
- Электроотрицательность не имеет единиц измерения.
Реклама
Об этой статье
Эту страницу просматривали 88 647 раз.
Была ли эта статья полезной?
Все известные химические элементы можно разделить на металлы и неметаллы.
Металлы — элементы, атомы которых способны отдавать электроны.
Неметаллы — элементы, атомы которых могут принимать электроны.
При взаимодействии металла с неметаллом атом первого теряет электроны, а атом второго их присоединяет.
А что происходит, если взаимодействуют атомы двух неметаллов?
Сравним атомы серы и кислорода:
O8+8)2)6;
S16+16)2)8)6.
Радиус атома серы больше, валентные электроны слабее связаны с ядром. При образовании связи произойдёт сдвиг электронов от серы к кислороду.
Сравним атомы углерода и кислорода:
C6+6)2)4;
O8+8)2)6.
Заряд ядра атома кислорода больше, и притягивать к себе электроны он будет сильнее.
Значит, атомы разных неметаллов притягивают к себе электроны неодинаково.
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях называется электроотрицательностью (ЭО).
Так как общие электронные пары образуются валентными электронами, то можно сказать, что электроотрицательность — это способность атома притягивать к себе валентные электроны от других атомов.
Обрати внимание!
Чем больше электроотрицательность, тем сильнее у элемента выражены неметаллические свойства.
Шкала относительной электроотрицательности Полинга
Абсолютные значения ЭО — неудобные для работы числа. Поэтому обычно используют относительную электроотрицательность по шкале Полинга. За единицу в ней принята ЭО лития.
По шкале Полинга наиболее электроотрицательным среди элементов, способных образовывать соединения, является фтор, а наименее электроотрицательным — франций. ЭО франция равна (0,7), а ЭО фтора — (4). ЭО остальных элементов изменяются в пределах от (0,7) до (4).
Как правило, неметаллы имеют ЭО больше двух. У металлов значение ЭО меньше двух. Некоторые элементы (B,Si,Ge,As,Te) со значениями электроотрицательности, близкими к (2), способны проявлять промежуточные свойства.
Элементы с высокой и низкой электроотрицательностью считаются активными. С высокой — активные неметаллы, с низкой — активные металлы. У первых ЭО близка к (3)–(4), у вторых — к (1).
Изменение электроотрицательности в Периодической системе
С увеличением порядкового номера элементов ЭО изменяется периодически.
В периоде она растёт слева направо при накоплении электронов на внешнем слое.
В группе она убывает сверху вниз при увеличении числа электронных слоёв и увеличении атомных радиусов.
Наибольшей ЭО в каждом периоде обладают самые маленькие атомы с семью внешними электронами — атомы галогенов (инертные газы соединений не образуют).
Наименьшая ЭО в периоде у самого большого атома с одним внешним электроном — атома щелочного металла.
Обрати внимание!
Значения электроотрицательности элементов позволяют определить:
— заряды атомов в соединении;
— сдвиг электронов при образовании химической связи.
Установим, как происходит сдвиг электронов при взаимодействии атомов хлора и серы, cеры и кислорода.
Пример:
хлор и сера расположены в третьем периоде. Электроотрицательность по периоду возрастает слева направо. ЭО хлора больше ЭО серы, значит, электроны будут сдвинуты от серы к хлору. Заряд атома серы будет положительным, а хлора — отрицательным:
Проверим вывод по шкале Полинга. Электроотрицательность хлора равна (3), а электроотрицательность серы — (2,5). Хлор более электроотрицательный.
Пример:
кислород и сера расположены в шестой А группе. Электроотрицательность по группе сверху вниз уменьшается. ЭО кислорода больше ЭО серы, значит, электроны будут сдвинуты от серы к кислороду. Атом серы имеет положительный заряд, а кислорода — отрицательный:
По шкале Полинга электроотрицательность кислорода равна (3,5), а электроотрицательность серы — (2,5). Более электроотрицательный — кислород.
При сравнении ЭО элементов часто используют ряд электроотрицательности, расположив элементы в порядке убывания её значения:
.
Электроотрицательность — это характеристика атома, показывающая, насколько высока его способность притягивать к себе электроны. Когда химическая связь образована двумя разными элементами, электроны у одного из них всегда расположены более плотно, чем у другого. Тот атом, у которого электронная плотность выше, называется электроотрицательным, тот, у кого ниже — соответственно, электроположительным.
Содержание:
- Как определить электроотрицательность
- Самые высокие значения электроотрицательности
- Как определить валентные электроны
- Видео
Как определить электроотрицательность
Существует несколько шкал, ориентируясь на которые, можно определить электроотрицательность того или иного элемента. Попробуем их перечислить:
- Таблица Менделеева.
- Шкала Малликена.
- Шкала Полинга.
- Шкала Олреда-Рохова.
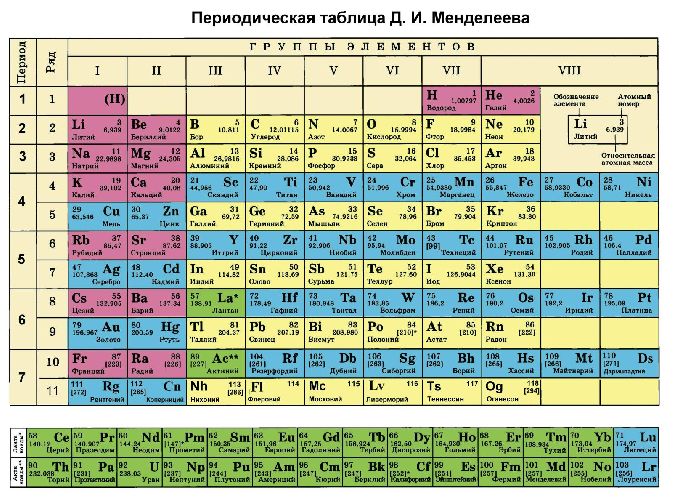
Чтобы определить параметр «электроотрицательность» по таблице Менделеева, нужно всего лишь знать, что наиболее электроотрицательные свойства имеют те элементы, которые располагаются вверху таблицы и в правой ее части. То есть, чем выше и правее элемент находится в таблице Менделеева, тем выше у него электроотрицательность и наоборот, чем ниже и левее — тем выше у него электроположительность.
Шкала Полинга — наиболее часто используемая таблица электроотрицательности. Названа она в честь американского химика Лайнуса Полинга, который впервые ввел понятие электроотрицательности. Согласно шкале Поллинга, электроотрицательность всех имеющихся в природе элементов лежит в интервале от 0,7 (таковой она является у щелочного металла франция) до 4,0 (у газа-галогена фтора). В таблице приводятся относительные и неточные величины.
Шкала Малликена рассматривает электроотрицательность как величину энергии связи между валентными электронами. Приводятся максимально точные расчеты.
Расположение элементов в каждой из таблиц является идентичным, несмотря на то, что методы определения отличаются друг от друга, и величины тоже.
Самые высокие значения электроотрицательности
Фтор, один из галогенов — это элемент, обладающий наивысшей электроотрицательностью, а точнее — 3,98. Его химическая активность невероятно высока, настолько, что химики называют его не иначе как «все разгрызающий».
Следом за фтором идет кислород. Электроотрицательность кислорода немного пониже — 3,44, но тоже достаточно высока.
Следом за ними (спускаясь все ниже по правой части таблицы Менделеева) идут:
- хлор (3,16);
- азот (3,04);
- бром (2,96);
- йод (2,66);
- ксенон (2,60);
- и так далее.
Большая часть неметаллов имеет электроотрицательность, колеблющуюся между значениями 2 и 3. У отличающихся наиболее высокой активностью металлов, от франция до бериллия, она колеблется от значения 0,7 до 1,57.
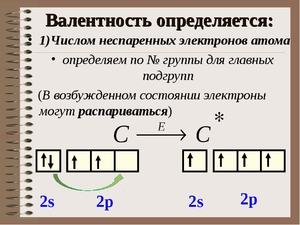
Как определить валентные электроны
Валентностью называют способность атома вступать во взаимодействие с другими атомами, образуя с ними определенные химические связи. Валентными электронами именуются электроны, непосредственно участвующие в образовании химической связи. Основными создателями, внесшими в теорию валентности наибольший вклад, являются русский ученый Бутлеров и немецкий ученый Кекуле. Электроны, которые принимают участие в образовании химической связи, называют валентными.
Атом, как мы все знаем из школьного курса, устроен таким образом, что довольно-таки напоминает по своему устройству Солнечную систему. В центре атома находится огромное ядро, чья масса чуть менее, чем полностью равняется массе всего атома, а вокруг него по орбиталям вращаются мелкие электроны, неодинаковые по своим внутренним характеристикам. Ядро атома окажется не таким уж и большим, если сравнить его размеры с длиной расстояния до орбиталей, по которым вращаются атомы. Чем дальше от ядра и чем ближе к внешней электронной оболочке находится электрон конкретно взятого атома, тем быстрее он вступает во взаимодействие с электронами других атомов.
Итак, перед нами таблица Менделеева. Найти на ней нужно третий период. Последовательно перебираем элементы главных подгрупп в нем. Существует правило, согласно которому валентность элемента определяется по номеру его группы и равняется количеству электронов на внешней оболочке его атома.
- У щелочного металла натрия на внешней оболочке всего только один электрон, принимающий участие в химической связи между элементами. Исходя из этого, мы определяем, что он одновалентен.
- У щелочноземельного металла на внешней оболочке уже два электрона. Это означает, что его валентность равна двум.
- У амфотерного металла алюминия ровно три электрона на внешней оболочке. Его валентность так же, как и у предыдущих элементов, соответствует этому числу.
- У кремния четыре электрона, он четырехвалентен.
- Фосфор может образовывать различные связи и иметь разные валентности, но высшая валентность фосфора равна пяти.
- Сера точно так же, как и фосфор, может иметь разные валентности, но высшая равняется шести.
- Возьмем хлор. Когда, к примеру, он состоит в молекуле соляной кислоты (HCl), он находится в одновалентном состоянии. А вот в молекуле хлорной кислоты (HClO4) он сразу же становится семивалентным.
Помимо главных, есть еще и побочные подгруппы. Когда дело касается их, учитываются еще и d-электроны на предыдущем подуровне. В таблице Менделеева все эти значения легко можно отыскать. Попробуем определить высшую валентность хрома. На внешнем уровне у хрома находится 1 электрон, на d-подуровне — 5. Следовательно, его высшая валентность равна 6. У марганца на внешнем уровне 2 электрона, на d-подуровне — 5. Значит, его высшая валентность — 7.
Все вышеописанное, за некоторыми исключениями, действительно для элементов всех других побочных подгрупп (помимо тех, в которые включены марганец и хром). Вот исключения:
- кобальт;
- платина;
- палладий;
- родий;
- иридий.
Видео
Это видео поможет вам лучше усвоить такое понятие, как электроотрицательность.
Download Article
Download Article
In chemistry, electronegativity is a measure of how strongly an atom attracts the electrons in a bond.[1]
An atom with high electronegativity attracts electrons strongly, while an atom with low electronegativity attracts them weakly. Electronegativity values are used to predict how different atoms will behave when bonded to each other, making this an important skill in basic chemistry.
-
1
Understand that chemical bonds occur when atoms share electrons. To understand electronegativity, it’s important first to understand what a «bond» is. Any two atoms in a molecule that are «connected» to each other on a molecular diagram are said to have a bond between them.[2]
This means that they share a set of two electrons with each atom contributing one electron to the bond.- The exact reasons for why atoms share electrons and bonds are a little beyond the scope of this article. If you want to learn more, try this article on the bond basics or WikiHow’s own How to Study the Nature of the Chemical Bond (Chemistry).
-
2
Understand how electronegativity affects the electrons in the bond. When two atoms share a set of two electrons in a bond, they don’t always share them equally. When one atom has a higher electronegativity than the atom it’s bonded to, it pulls the two electrons in the bond closer to itself. An atom with very high electronegativity may pull the electrons all the way to its side of the bond, barely sharing them at all with the other atom.[3]
- For example, in the molecule NaCl (sodium chloride), the chlorine atom has a fairly high electronegativity and the sodium has a fairly low one. Thus, the electrons will get pulled towards the chloride and away from the sodium.
Advertisement
-
3
Use an electronegativity table as a reference. An electronegativity table of the elements has the elements arranged exactly like in a periodic table, except that each atom is labeled with its electronegativity. These can be found in a variety of chemical textbooks and technical articles as well as online.
-
Here is a link to an excellent electronegativity table. Note that this uses the Pauling electronegativity scale, which is the most common.[4]
However, there are other ways to measure electronegativity, one of which will be shown below.
-
Here is a link to an excellent electronegativity table. Note that this uses the Pauling electronegativity scale, which is the most common.[4]
-
4
Remember electronegativity trends for easy estimations. If you don’t have an electronegativity table handy, you can still estimate the strength of an atom’s electronegativity compared to the strength of another element’s atom based on where it is located on a normal periodic table.[5]
Although you will not be able to calculate a number value, you can evaluate the difference between the electronegativities of 2 different elements. As a general rule:- An atom’s electronegativity gets higher as you move to the right in the periodic table.
- An atom’s electronegativity gets higher as you move up in the periodic table.
- Thus, the atoms in the top right have the highest electronegativities and the atoms in the bottom left have the lowest ones.
- For example, in the NaCl example from above, you can tell that chlorine has a higher electronegativity than sodium because it’s almost all the way in the top right. On the other hand, sodium is far to the left, making it one of the lower-ranking atoms.
Advertisement
-
1
Find the electronegativity difference between the two atoms. When two atoms are bonded together, the difference between their electronegativities can tell you about the qualities of their bond. Subtract the smaller electronegativity from the larger one to find the difference.
- For example, if we’re looking at the molecule HF, we would subtract the electronegativity of hydrogen (2.1) from fluorine (4.0). 4.0 — 2.1 = 1.9
-
2
If the difference is below about 0.5, the bond is nonpolar covalent. Here, the electrons are shared almost equally. These bonds don’t form molecules that have large charge differences on either end. Nonpolar bonds tend to be very difficult to break.[6]
This is because the atoms are sharing electrons, making their bond stable. It requires a lot of energy to break this bond.[7]
- For example, the molecule O2 has this type of bond. Since the two oxygens have the same electronegativity, the difference between them is 0.
-
3
If the difference is between 0.5-1.6, the bond is polar covalent. These bonds have more electrons at one end than the other. This makes the molecule a little more negative at the end with the electrons and a little more positive at the end without them. The charge imbalance in these bonds can allow the molecule to participate in certain special reactions, such as joining with another atom or molecule or pulling a molecule apart. This is because it’s still reactive.[8]
- A good example of this is the molecule H2O (water). The O is more electronegative than the two Hs, so it holds the electrons more tightly and makes the entire molecule partially negative at the O end and partially positive at the H ends.
-
4
If the difference is over 2.0, the bond is ionic. In these bonds, the electrons are completely at one end of the bond. The more electronegative atom gains a negative charge and the less electronegative atom gains a positive charge. These sorts of bonds allow their atoms to react well with other atoms and even be pulled apart by polar molecules.
- An example of this is NaCl (sodium chloride or salt). The chlorine is so electronegative that it pulls both electrons in the bond all the way towards itself, leaving sodium with a positive charge.
- NaCl can be broken apart by a polar molecule, such as H2O (water). In a water molecule, the hydrogen side of the molecule is positive, while the oxygen side is negative. When you mix the salt into the water, the water molecules break down the salt molecules, dissolving the salt.[9]
-
5
If the difference is between 1.6-2.0, check for a metal. If there is a metal in the bond, the bond is ionic. If there are only non-metals, the bond is polar covalent.
- Metals include most of the atoms on the left side and the middle of the periodic table. This page has a table that shows which elements are metals.[10]
- Our HF example from above falls in this range. Since H and F aren’t metals, they have a polar covalent bond.
- Metals include most of the atoms on the left side and the middle of the periodic table. This page has a table that shows which elements are metals.[10]
Advertisement
-
1
Find the first ionization energy of your atom. Mulliken electronegativity is a slightly different way of measuring electronegativity than is used in the Pauling table above. To find Mulliken electronegativity for a certain atom, find that atom’s first ionization energy. This is the energy required to make the atom discharge a single electron.
- This is something you’ll probably have to look up in chemistry reference materials. This site has a good table you may want to use (scroll down to find it).[11]
- As an example, let’s say that we’re trying to find the electronegativity of lithium (Li). In the table on the site above, we can see that its first ionization energy is 520 kJ/mol.
- This is something you’ll probably have to look up in chemistry reference materials. This site has a good table you may want to use (scroll down to find it).[11]
-
2
Find the electron affinity of the atom. This is a measure of the energy gained when an electron is added to an atom to form a negative ion. Again, this is something you’ll need to look up in reference material. This site has resources you may want to browse.[12]
- The electron affinity of lithium is 60 kJ mol-1.
-
3
Solve the Mulliken electronegativity equation. When you’re using kJ/mol as units for your energies, the equation for Mulliken electronegativity is ENMulliken = (1.97×10−3)(Ei+Eea) + 0.19. Plug your values into the equation and solve for ENMulliken.[13]
- In our example, we would solve like this:
-
- ENMulliken = (1.97×10−3)(Ei+Eea) + 0.19
- ENMulliken = (1.97×10−3)(520 + 60) + 0.19
- ENMulliken = 1.143 + 0.19 = 1.333
-
- In our example, we would solve like this:
Advertisement
Calculator, Practice Problems, and Answers
Add New Question
-
Question
When dipole movement is zero, will the compound be more or less stable?
Less stable; dipole movement gives the compounds more stability thanks to intramolecular resonance.
-
Question
What is the electronegativity of n-h?
The electronegativity of n-h is 3.194.
-
Question
What is electron affinity?
Skanda Prasad
Community Answer
Electron affinity is the amount of energy released or absorbed when an atom in gaseous state accepts an electron to form an anion (not necessarily an anion but yes it should accept an electron). If energy is released it is exothermic, if energy is absorbed, it is endothermic.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Electronegativity does not have units.
-
Besides the Pauling and Mulliken scales, other electronegativity scales include the Allred–Rochow scale, the Sanderson scale, and the Allen scale. These all have their own equations for calculating electronegativity (some of which can get quite complex).
Advertisement
References
About This Article
Article SummaryX
Electronegativity is a measure of how strongly an atom attracts electrons in a bond with another atom. To understand the nature of a bond between two atoms, look up the electronegativity of each atom on an electronegativity table or a periodic table that lists electronegativity. Keep in mind that electronegativity gets higher as you move up and to the right on the chart. Once you’ve found the electronegativity of each atom, subtract the smaller electronegativity from the larger one to find the difference. For instance, in a bonded pair of hydrogen and fluorine atoms, hydrogen has an electronegativity of 2.1, while fluorine has an electronegativity of 4.0. The difference between them is 1.9. In molecules where the difference is less than 0.5, the bond is nonpolar covalent. This is a strong type of bond that takes a lot of energy to break. If the difference is between 0.5 and 1.6, the bond is polar covalent. These bonds are imbalanced and make the resulting molecule more reactive than one with a nonpolar covalent bond. If the difference is greater than 2.0, the bond is ionic, which means that one atom has a positive charge and the other has a negative one. These types of bonds are easy to break, meaning the molecule is very reactive. For electronegativity differences between 1.6 and 2.0, the bond could be either polar covalent or ionic. If there’s a metal in the molecule, the bond is ionic. If both atoms are non-metals, the bond is polar covalent instead. To learn more about calculating electronegativity by using the Mulliken equation, scroll down!
Did this summary help you?
Thanks to all authors for creating a page that has been read 703,177 times.
Reader Success Stories
-
«I tend to get confused during my chem class and for homework there’s a worksheet with no explanation or…» more
Did this article help you?
Таблица электроотрицательности химических элементов

4.6
Средняя оценка: 4.6
Всего получено оценок: 451.
4.6
Средняя оценка: 4.6
Всего получено оценок: 451.
Выяснить активность простых веществ можно с помощью таблицы электроотрицательности химических элементов. Обозначается как χ. Подробнее о понятии активности читайте в нашей статье.
Что такое электроотрицательность
Свойство атома химического элемента притягивать к себе электроны других атомов называется электроотрицательностью. Впервые понятие ввёл Лайнус Полинг в первой половине ХХ века.
Все активные простые вещества можно разделить на две группы в соответствии с физическими и химическими свойствами:
- металлы;
- неметаллы.
Все металлы являются восстановителями. В реакциях они отдают электроны и обладают положительной степенью окисления. Неметаллы могут проявлять свойства восстановителей и окислителей в зависимости от значения электроотрицательности. Чем выше электроотрицательность, тем сильнее свойства окислителя.
Полинг составил шкалу электроотрицательности. В соответствии со шкалой Полинга наибольшей электроотрицательностью обладает фтор (4), наименьшей – франций (0,7). Это значит, что фтор является самым сильным окислителем и способен притягивать электроны большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдать, а не принять электроны.
Электроотрицательность является одним из главных факторов, определяющих тип и свойства образованной между атомами химической связи.
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. В соответствии со шкалой элементы со значением более двух являются окислителями и проявляют свойства типичного неметалла.
|
Номер элемента |
Элемент |
Символ |
Электроотрицательность |
|
87 |
Франций |
Fr |
0,79 |
|
55 |
Цезий |
Cs |
0,79 |
|
19 |
Калий |
K |
0,82 |
|
37 |
Рубидий |
Rb |
0,82 |
|
56 |
Барий |
Ba |
0,89 |
|
88 |
Радий |
Ra |
0,9 |
|
11 |
Натрий |
Na |
0,93 |
|
38 |
Стронций |
Sr |
0,95 |
|
3 |
Литий |
Li |
0,98 |
|
20 |
Кальций |
Ca |
1,0 |
|
57 |
Лантан |
La |
1,1 |
|
89 |
Актиний |
Ac |
1,1 |
|
70 |
Иттербий |
Yb |
1,1 |
|
58 |
Церий |
Ce |
1,12 |
|
59 |
Празеодим |
Pr |
1,13 |
|
61 |
Прометей |
Pm |
1,13 |
|
95 |
Америций |
Am |
1,13 |
|
60 |
Неодим |
Nd |
1,14 |
|
62 |
Самарий |
Sm |
1,17 |
|
64 |
Гадолиний |
Gd |
1,2 |
|
66 |
Диспрозий |
Dy |
1,22 |
|
39 |
Иттрий |
Y |
1,22 |
|
68 |
Эрбий |
Er |
1,24 |
|
69 |
Тулий |
Tm |
1,25 |
|
71 |
Лютеций |
Lu |
1,27 |
|
96 |
Кюрий |
Cm |
1,28 |
|
94 |
Плутоний |
Pu |
1,28 |
|
90 |
Торий |
Th |
1,3 |
|
97 |
Берклий |
Bk |
1,3 |
|
98 |
Калифорний |
Cf |
1,3 |
|
99 |
Эйнштейний |
Es |
1,3 |
|
100 |
Фермий |
Fm |
1,3 |
|
101 |
Менделевий |
Md |
1,3 |
|
102 |
Нобелий |
No |
1,3 |
|
12 |
Магний |
Mg |
1,31 |
|
40 |
Цирконий |
Zr |
1,33 |
|
93 |
Нептуний |
Np |
1,36 |
|
21 |
Скандий |
Sc |
1,36 |
|
92 |
Уран |
U |
1,38 |
|
73 |
Тантал |
Ta |
1,5 |
|
91 |
Протактиний |
Pa |
1,5 |
|
22 |
Титан |
Ti |
1,54 |
|
25 |
Марганец |
Mn |
1,55 |
|
4 |
Бериллий |
Be |
1,57 |
|
41 |
Ниобий |
Nb |
1,6 |
|
13 |
Алюминий |
Al |
1,61 |
|
81 |
Талий |
Tl |
1,62 |
|
30 |
Цинк |
Zn |
1,65 |
|
23 |
Ванадий |
V |
1,63 |
|
24 |
Хром |
Cr |
1,66 |
|
48 |
Кадмий |
Cd |
1,69 |
|
49 |
Индий |
In |
1,78 |
|
31 |
Галлий |
Ga |
1,81 |
|
26 |
Железо |
Fe |
1,83 |
|
82 |
Свинец |
Pb |
1,87 |
|
27 |
Кобальт |
Co |
1,88 |
|
29 |
Медь |
Cu |
1,9 |
|
75 |
Рений |
Re |
1,9 |
|
14 |
Кремний |
Si |
1,9 |
|
43 |
Технеций |
Tc |
1,9 |
|
28 |
Никель |
Ni |
1,91 |
|
47 |
Серебро |
Ag |
1,93 |
|
50 |
Олово |
Sn |
1,96 |
|
80 |
Ртуть |
Hg |
2 |
|
84 |
Полоний |
Po |
2 |
|
83 |
Висмут |
Bi |
2,02 |
|
5 |
Бор |
B |
2,04 |
|
51 |
Сурьма |
Sb |
2,05 |
|
42 |
Молибден |
Mo |
2,16 |
|
33 |
Мышьяк |
As |
2,18 |
|
15 |
Фосфор |
P |
2,19 |
|
1 |
Водород |
H |
2,2 |
|
77 |
Иридий |
Ir |
2,2 |
|
86 |
Радон |
Rn |
2,2 |
|
85 |
Астат |
At |
2,2 |
|
44 |
Рутений |
Ru |
2,2 |
|
46 |
Палладий |
Pd |
2,2 |
|
76 |
Осмий |
Os |
2,2 |
|
78 |
Платина |
Pt |
2,28 |
|
45 |
Родий |
Rh |
2,28 |
|
74 |
Вольфрам |
W |
2,36 |
|
79 |
Золото |
Au |
2,54 |
|
6 |
Углерод |
C |
2,55 |
|
34 |
Селен |
Se |
2,55 |
|
16 |
Сера |
S |
2,58 |
|
54 |
Ксенон |
Xe |
2,6 |
|
53 |
Йод |
I |
2,66 |
|
36 |
Криптон |
Kr |
2,96 |
|
7 |
Азот |
N |
3,04 |
|
17 |
Хлор |
Cl |
3,16 |
|
8 |
Кислород |
O |
3,44 |
|
9 |
Фтор |
F |
3,98 |
Вещества с электроотрицательностью два и меньше являются восстановителями и проявляют металлические свойства. Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
В ряде электроотрицательности металлические и восстановительные свойства увеличиваются справа налево, а окислительные и неметаллические свойства – слева направо.
Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
Что мы узнали?
Электроотрицательность показывает способность элементов отдавать или принимать электроны. Эта характеристика помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у конкретного элемента. Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Костенко
5/5
-
Александр Котков
5/5
-
Александр Котков
5/5
-
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 451.
А какая ваша оценка?