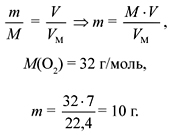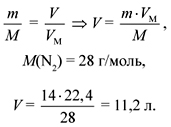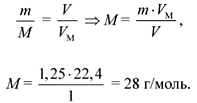В уроке 12 «Элементный анализ» из курса «Химия для чайников» рассмотрим анализ химического состава вещества; научимся определять эмпирическую формулу соединения; кроме того разберем кучу примеров на нахождение весовых процентов и формулы вещества. Данный урок потребует от вас знания, что из себя представляет молекулярная формула соединения, а так же общих сведений, изложенных в первой главе «Атомы, молекулы и ионы». Обязательно прочитайте о законе сохранения массы и энергии, потому что все уроки из данного раздела посвящены именно ему.
Содержание
- Анализ химического состава вещества
- Эмпирическая формула вещества
- Определение формулы вещества
Анализ химического состава вещества
Анализ химического состава вещества или элементный анализ выполняют так: сначала разлагают исходное химическое соединение на отдельные элементы, а затем измеряют их относительные количества, выраженных в граммах на 100 грамм исходного вещества, либо в весовых (массовых) процентах. На практике это можно проделать, например, с углеводородом — соединением, содержащим лишь атомы углерода C и водорода H. Если известное количество углеводорода сжечь в кислороде, то образуется CO2 (диоксид углерода) и H2O, количество которых нужно затем измерить.
Пример 1: При сжигании неизвестного углеводорода массой 25 г образуется 68,58 г CO2 и 56,15 г H2O. Сколько граммов углерода и водорода содержится в исходном образце?
Решение:
Атомная масса C равна 12,011 г/моль, а молекулярная масса CO2 равна 12,011 + 2×15,999 = 44,010 г/моль. Сначала найдем относительное содержание C в CO2:
- (12,011/44,010)×100 = 27,29% углерода
Если 27,29% CO2 представляют собой углерод, то количество углерода, содержащееся в 68,58 г CO2, равно
- 27,29%×68,58 г = 18,72 г углерода
Аналогичный расчет содержания H в воде дает
- (2×1,008/18,015)×100 = 11,19% водорода
- 11,19%×56,15 г = 6,283 г водорода
Проверка: 18,72 г + 6,283 г = 25,00 г
Пример 2: Сколько граммов C содержится в 100 г образца углеводорода, рассмотренного в примере 1?
Решение:
- (100 г / 25,0 г)×18,72 г углерода = 74,88 г углерода на 100 г образца
Пример 3: Каков состав (в весовых процентах) углеводорода, рассматриваемого в примере 1?
Решение:
- (18,72 г углерода / 25,00 г образца)×100% = 74,88% углерода
- (6,28 г водорода / 25,00 г образца)×100% = 25,12% водорода
Если нам известен состав вещества в весовых процентах, можно воспользоваться атомными массами входящих в него элементов и вычислить относительное число атомов каждого элемента в соединении.
Пример 4: Вычислите относительное число атомов C и H в соединении, рассматриваемом в примере 3.
Решение:
Такие вычисления легче проводить, исходя из 100,0 г вещества: тогда весовые проценты, в которых выражен элементный состав соединения, можно просто заменить на такое же число граммов соответствующих элементов (ср. примеры 3 и 2). Теперь разделим массу C и массу H на их атомные массы:
- 74,88 г углерода / 12,011 г/моль = 6,234 моля углерода
- 25,12 г водорода / 1,008 г/моль = 24,92 моля водорода
Таковы относительные количества молей C и H в неизвестном углеводороде, и вот тут-то мы убедимся, насколько удобно пользоваться представлением о моле. Полученные выше численные значения должны также выражать относительные количества атомов углерода и водорода в соединении, то есть на каждые 6,234 атома углерода в неизвестном углеводороде приходится 24,92 атома водорода. Если мы попытаемся найти общее кратное этих двух чисел, то окажется, что они находятся в соотношении 1:4. Разделив оба числа на меньшее из них (16,234), мы найдем, на каждый атом углерода приходится 24,92/6,234=3,997, т.е 4 атома водорода.
Пример 5: Жидкость содержит 11,19 вес.% водорода и 88,81 вес.% кислорода. Каковы относительные количества атомов водорода и кислорода в этой жидкости?
Решение:
Рассмотрим снова 100 г вещества и вычислим количество молей каждого элемента, входящего в его состав:
- 11,19 г водорода / 1,008 г/моль = 11,10 моля водорода
- 88,81 г кислорода / 15,999 г/моля = 5,551 моля кислорода
Разделим оба числа на меньшее из них, чтобы найти общее кратное и тогда мы получим, что на каждый атом кислорода приходится по два атома водорода.
Пример 6 решаем самостоятельно: Обычный лабораторный растворитель, углеводород, содержит 92,26 вес.% углерода и 7,74 вес.% водорода. Каковы относительные количества атомов углерода и водорода в этом соединении?
Ответ: на 1 атом углерода приходится по 1 атому водорода
Эмпирическая формула вещества
Одним лишь элементным анализом невозможно определить правильную молекулярную формулу соединения. Например, с результатами вычислений в примере 4 согласуется формула метана -CH4, но те же аналитические результаты могли бы согласоваться с молекулярными формулами C2H8, C3H12 или C4H16, если бы подобные молекулы существовали. Вещество в примере 5 может быть водой H2O, но могло бы иметь формулу H4O2 или еще более сложную, но кратную H2O.
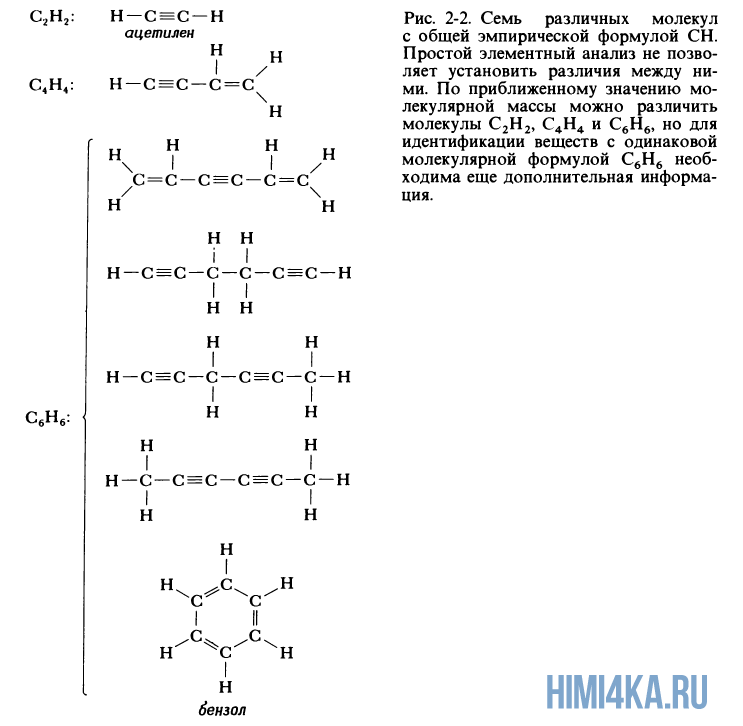
Химическая формула, указывающая относительные количества атомов каждого из элементов в соединении при помощи целых чисел, не имеющих общего кратного, называется эмпирической формулой соединения. Элементный анализ вещества приводит именно к эмпирической формуле соединения, а не к молекулярной формуле, которая может совпадать с эмпирической формулой, но может представлять собой ее целое кратное. Для метана и воды эмпирические формулы совпадают с молекулярными формулами CH4 и H2O. Например вещество из примера 6 имеет эмпирическую формулу CH, но молекулярная формула может представлять собой бензол С6H6, ацетилен C2H2 или любой из пяти других, менее распространенных углеводородов, молекулы которых изображены на рисунке 2-2.
Определение формулы вещества
Закрепим полученные знания заключительным примером:
Глюкоза содержит 40,00 вес.% углерода, 6,71 вес.% водорода и 53,29 вес.% кислорода. Каковы ее эмпирическая и молекулярная формулы, если из других экспериментов известно, что глюкоза имеет молекулярную массу, приблизительно равную 175 г/моль?
Решение:
Найдем сначала число молей каждого элемента, приходящихся на 100 г глюкозы:
- 40,00 г углерода / 12,011 г/моль = 3,330 моля углерода
- 6,71 г водорода / 1,008 г/моль = 6,66 моля водорода
- 53,29 г кислорода / 15,999 г/моль = 3,331 моля кислорода
Очевидно, что эмпирическая формула вещества должна иметь вид CH2O. Найденной эмпирической формуле глюкозы соответствует молекулярная масса
- 12,011 + (2×1,008) + 15,999 = 30,026 г/моль
Приближенная молекулярная масса из экспериментов почти в 6 раз превышает это значение, поэтому можно сделать вывод, что молекулярная формула глюкозы имеет вид C6H12O6.
Урока 12 «Элементный анализ» очень важный, поэтому если у вас возникли вопросы, пишите их в комментарии.
Загрузить PDF
Загрузить PDF
Эмпирическая формула химического соединения представляет собой простейшую запись его состава. Эмпирическую формулу вещества можно определить по массе каждого входящего в него элемента, по весовым процентам элементов или по молекулярной формуле соединения.
-
1
Посмотрите, что дано. Если дан элементный состав неизвестного соединения в процентах, а не в граммах, следует предположить, что имеется ровно 100,0 граммов этого вещества.
- Ниже приведена процедура определения эмпирической формулы в том случае, если элементный состав дан в процентах. Если состав неизвестного соединения дан в граммах, перейдите к разделу «Использование веса в граммах».
- Пример: определите эмпирическую формулу соединения, которое состоит из 29,3% Na (натрий), 41,1% S (сера) и 29,6% O (кислород).
-
2
Определим количество граммов каждого элемента. Если мы предположим, что имеется 100 граммов неизвестного соединения, то количество граммов каждого элемента соответствует его процентному содержанию.
- Пример: в 100 граммах неизвестного вещества содержится 29,3 г Na, 41,1 г S и 29,6 г O.
-
3
Переведите массу каждого элемента в моли. Массу каждого входящего в соединение элемента следует перевести в моли. Для этого массу необходимо умножить на 1 моль и разделить на атомный вес соответствующего элемента.
- Проще говоря, следует разделить массу каждого элемента на его атомный вес.
- Учтите также, что при данных расчетах необходимо брать не менее четырех значимых цифр.
-
Пример: для соединения, которое состоит из 29,3 г Na, 41,1 г S и 29,6 г O, получаем:
- 29,3 г Na * (1 моль Na / 22,99 г Na) = 1,274 моль Na
- 41,1 г S * (1 моль S / 32,06 г S) = 1,282 моль S
- 29,6 г O * (1 моль O / 16,00 г O) = 1,850 моль O
-
4
Разделите найденное число молей каждого элемента на наименьшее количество молей. Следует найти стехиометрическое соотношение между элементами — это означает, что необходимо вычислить относительные доли каждого элемента по сравнению с остальными элементами, входящими в состав соединения. Для этого разделите каждое количество молей на наименьшее число молей.
-
Пример: наименьшее число молей в данном соединении составляет 1,274 моль (количество молей Na, натрия).
- 1,274 моль Na / 1,274 моль = 1,000 Na
- 1,282 моль S / 1,274 моль = 1,006 S
- 1,850 моль O / 1,274 моль = 1,452 O
-
Пример: наименьшее число молей в данном соединении составляет 1,274 моль (количество молей Na, натрия).
-
5
Умножьте полученные величины на коэффициент так, чтобы получились близкие к целым числа. Соотношение молей каждого элемента может не равняться целому числу. Это не проблема в случае малых отклонений от целого числа, которые не превышают одну десятую. Однако в случае более значительных отклонений следует умножить эти величины на один и тот же множитель, чтобы они стали близки к целым числам.
- Если соответствующая величина для одного элемента близка к 0,5, умножьте каждое значение на 2. Схожим образом, если для одного элемента число близко к 0,25, умножьте каждую величину на 4.
-
Пример: поскольку количество кислорода (O) близко к 1,5, чтобы приблизить его к целому значению, необходимо умножить каждую величину на “2”.
- 1,000 Na * 2 = 2,000 Na
- 1,006 S * 2 = 2,012 S
- 1,452 O * 2 = 2,904 O
-
6
Округлите полученные величины до ближайших целых чисел. Даже после последнего шага количество молей каждого элемента может слегка отличаться от целого числа. Поскольку в эмпирических формулах не используются десятичные дроби, необходимо округлить каждое значение до ближайшего к нему целого числа.
-
Пример: для определенных на предыдущем шаге значений получаем:
- 2,000 Na можно записать как 2 Na;
- 2,012 S можно округлить до 2 S;
- 2,904 O можно округлить до 3 O.
-
Пример: для определенных на предыдущем шаге значений получаем:
-
7
Запишите окончательный ответ. Переведите соотношение элементов в стандартную запись, которая используется для эмпирических формул. Количество каждого элемента в молекуле соединения записывается в виде подстрочного числа справа от символа соответствующего элемента (в случае единицы это число опускается).
- Пример: если соединение состоит из 2 частей Na, 2 частей S и 3 частей O, его эмпирическая формула записывается следующим образом: Na2S2O3
Реклама
-
1
Убедитесь, что количество элементов дано в граммах. Если элементный состав неизвестного соединения дан в граммах, используйте приведенные ниже шаги.
- С другой стороны, если вместо граммов даны проценты, перейдите к разделу «Использование весовых процентов».
- Пример: определите эмпирическую формулу неизвестного соединения, которое состоит из 8,5 г Fe (железо) и 3,8 г O (кислород).
-
2
Переведите массу каждого элемента в моли. Чтобы определить долю каждого элемента в молекуле соединения, необходимо перевести количество каждого элемента из граммов в моли. Для этого разделите массу каждого элемента в граммах на его атомный вес.
- При более формальном подходе следует умножить массу в граммах на один моль и разделить на атомный вес.
- Учтите, что для достаточной точности атомный вес необходимо округлить до четырех значимых цифр.
-
Пример: для 8,5 г Fe и 3,8 г O получаем:
- 8,5 г Fe * (1 моль Fe / 55,85 г Fe) = 0,152 моль Fe
- 3,8 г O * (1 моль O / 16,00 г O) = 0,238 моль O
-
3
Разделите количество молей каждого элемента на наименьшее значение. Определите, как каждый элемент соотносится с другими элементами, входящими в данное соединение. Для этого необходимо найти минимальное количество молей и разделить на него число молей каждого элемента.
-
Пример: для нашего случая минимальное количество молей составляет 0,152 (количество Fe, железа).
- 0,152 моль Fe / 0,152 моль = 1,000 Fe
- 0,238 моль O / 0,152 моль = 1,566 O
-
Пример: для нашего случая минимальное количество молей составляет 0,152 (количество Fe, железа).
-
4
Умножьте полученные значения, чтобы найти числа, близкие к целым. Часто количество молей не равно целому числу. Если отклонение от целого числа не превышает одной десятой, такое число можно просто округлить до целого. Однако в случае более значительного отклонения следует умножить каждое значение на такой коэффициент, чтобы получились близкие к целым числа.
- Например, если количество одного элемента превышает целое число примерно на 0,25, умножьте все значения на 4. Если же отклонение составляет около 0,5, умножьте все величины на 2.
-
Пример: поскольку соотношение для кислорода составляет 1,566, необходимо умножить оба соотношения на 2.
- 1,000 Fe * 2 = 2,000 Fe
- 1,566 O * 2 = 3,132 O
-
5
Округлите ответ до ближайшего целого числа. После того как соотношения для всех элементов не будут отличаться от целых чисел более чем на одну десятую, округлите их.
- Пример: количество Fe можно записать как 2. Количество O можно округлить до 3.
-
6
Запишите ответ. Найденное соотношение элементов следует переписать в форме, принятой для эмпирических формул. Полученные целые числа (за исключением 1) необходимо записать в виде подстрочных символов справа от символа соответствующего элемента.
- Пример: для соединения 2 частей Fe и 3 частей O эмпирическая формула имеет следующий вид: Fe2O3
Реклама
-
1
Определите, можно ли сократить подстрочные числа. Если дана молекулярная формула неизвестного соединения и требуется определить эмпирическую формулу, проверьте, нельзя ли сократить количество атомов. Посмотрите на подстрочные числа возле каждого элемента. Если все они имеют общий делитель (отличный от 1), понадобится несколько шагов, чтобы определить эмпирическую формулу соединения.
- Пример: C8H16O8
- С другой стороны, если подстрочные числа не имеют общего делителя, молекулярная формула является эмпирической формулой.
- Пример: Fe3O2H7
-
2
Найдите наибольший общий делитель подстрочных чисел. Выпишите делители для каждого подстрочного числа и определите максимальный общий делитель.
-
Пример: соединение C8H16O8 имеет подстрочные числа «4» and «8».
- Число 8 имеет следующие делители: 1, 2, 4, 8
- Число 16 имеет следующие делители: 1, 2, 4, 8, 16
- Число 8 является наибольшим общим делителем.
-
Пример: соединение C8H16O8 имеет подстрочные числа «4» and «8».
-
3
Разделите каждое подстрочное число на наибольший общий делитель. Чтобы привести каждое подстрочное число к простейшей форме, необходимо разделить его на только что найденный наибольший общий делитель.
-
Пример: для C8H16O8 получаем:
- Делим подстрочное число 8 на наибольший общий делитель 8: 8 / 8 = 1
- Делим подстрочное число 16 на наибольший общий делитель 8: 16 / 8 = 2
-
Пример: для C8H16O8 получаем:
-
4
Запишите ответ. Замените первоначальные подстрочные числа их упрощенными значениями. Таким образом вы определите эмпирическую формулу соединения по его молекулярной формуле.
- Помните, что если подстрочное число равно 1, то его обычно не записывают.
- Пример: C8H16O8 = CH2O
Реклама
Об этой статье
Эту страницу просматривали 7903 раза.
Была ли эта статья полезной?
Значительный раздел
масс-спектрометрии составляет элементный
анализ твердых веществ.
Перед ионизацией переводят
эти вещества в атомарное состояние.
Для этого требуются достаточно высокие
затраты энергии и источники,
которые
обеспечивают одновременно атомизацию
и ионизацию твер-
дых веществ. Наиболее
растворенные источники ионизации:
искровой
электронный заряд, излучение
лазера, поток ускоренных первичных
ионов. В соответствии с ними и названия
анализа: искровая, лазерная и
ионная,
или масс-спектрометрия вторичных ионов.
Наибольшее число
определений проводится
методом искровой масс-спектрометрии.
Искровой разряд возбуждают
между двумя близко расположенны-
ми
(доли миллиметра) электродами, один из
которых (катод, иначе его
называют
зондом) изготовлен в виде тонкой иглы
из тугоплавкого ме-
талла, как правило,
из тантала (рис. 4.8).
Рис. 4.8. Схема возникновения
искрового разряда в вакууме: 1 – образец
(про-
водник), 2 – плазма, 3 – поток
электронов, 4 – зонд (тантал)
Анодом служит анализируемый
образец. Подводят ток высокого
напряжения
(десятки кВ). В межэлектродном пространстве
возникает
короткий искровой разряд.
При этом часть образца
разрушается, атомизируется и частично
ионизируется. После окончания разряда
из образовавшихся ионов фор-
мируют
пучок и ускоряют его по направлению к
масс-анализатору.
В связи с тем, что ионы могут
иметь разные энергетические состо-
яния,
для ослабления влияния разброса по
энергиям применяют масс-
спектрометры
с двойной фокусировкой, в которых пучок
ионов прохо-
дит через систему
электрических и магнитных полей
специальной кон-
фигурации.
Количественный анализ основан
на расшифровке положения линии
в
масс-спектре путем привязки к линиям
основного элемента или вве-
денного
внутреннего стандарта.
162
К достоинствам искровой
масс-спектрометрии можно отнести
вы-
сокую селективность и чувствительность
(предел обнаружения 10
-42
г).
Кроме того, это многоэлементный
метод, позволяющий одновременно
определять до 60–70 элементов.
В методе лазерной
масс-спектрометрии луч лазера, как
искра,
обеспечивает одновременно и
атомизацию и ионизацию вещества.
Ана-
литические характеристики близки
к характеристикам искровой
масс-
спектрометрии.
В масс-спектрометрии вторичных
ионов для ионизации вещества
используют
первичные ионы кислорода или других
веществ, которые
получают и разгоняют
в ионной пушке. Пучок этих ионов фокусируют
и бомбардируют ими анализируемый
образец. Этот метод удобен для
изучения
и локального анализа поверхности,
поскольку возникающий
при бомбардировке
кратер невелик, и ионы проникают в
исследуемое
вещество неглубоко.
Предел обнаружения
18
10 г.
4.4. Интерпретация масс-спектров
Масс-спектр может состоять
из нескольких типов ионов:
1. Молекулярный
ион. Первоначально образуется при
электрон-
ной и ряде других методов
ионизации. Имеет массу, равную массе
ис-
следуемой молекулы (за вычетом
массы одного электрона). При этом из
молекулы, находящейся в основном
(невозбужденном) электронном со-
стоянии,
возникает ион, находящийся в возбужденном
электронном со-
стоянии. Образование
молекулярного иона происходит в
соответствии с
принципом Франка-Кондона:
во время электронного перехода и
после-
дующей ионизации межъядерные
расстояния (и, следовательно, геомет-
рия)
в ионизируемой молекуле не изменяются.
Дает информацию о мас-
се молекулы, в
случае измерения точной массы или
анализа интенсив-
ности изотопных
линий – о брутто-формуле молекулы.
Молекулярный ион: имеет самую
большую массу m/z в спектре;
является
нечетноэлектронным; способен образовывать
важнейшие
фрагментные ионы с большой
массой за счет выброса реальных
нейтральных частиц; включает все
элементы, наличие которых можно
увидеть
по фрагментным ионам. Молекулярному
иону сопутствуют
«изотопные пики» –
пики ионов, имеющих массу большую, чем
моле-
кулярный ион. Изотопные пики, за
исключением бромсодержащих ве-
ществ,
существенно менее интенсивны, чем
молекулярный ион.
Хлор, бром, сера и кремний
легко детектируются благодаря
харак-
терной для каждого элемента
мультиплетности сигнала, зависящей от
природной распространенности изотопов
соответствующих элементов
163
(можно сразу определить какое
количество атомов указанных галогенов
находится в соединении). Если соединение
содержит четное число ато-
мов азота
или азота в составе нет, его молекулярная
масса четная; если
число атомов азота
нечетное, молекулярная масса тоже
нечетная (азот-
ное правило).
2. Перегруппировочные ионы.
Ионы, образующиеся из первона-
чальной
молекулы, путем перестройки ее геометрии.
Наиболее распро-
странена перегруппировка
Мак-Лафферти, условия протекания которой:
наличие гетероатома в молекуле;
наличие -системы (двойная связь);
водород
у -атома ( -положение по отношению к
группе С-Х, где Х –
гетероатом).
3. Фрагментные ионы. В силу
того, что при ионизации молеку-
лам
передается большое количество энергии
(до 70 эВ, прочность хими-
ческих связей
при этом порядка 10–20 эВ), молекулярный
ион может
претерпевать разрушение
через разрыв связей – фрагментацию в
разных
направлениях, обусловленных
исходным строением молекулы. Именно
процессы фрагментации дают возможность
проводить структурные
масс-спектрометрические
исследования. Для описания фрагментации
требуется знание электронных состояний
ионов разных типов и вероят-
ностей
перехода между этими состояниями.
Технически такое исследо-
вание
выполняется так: исследователь выбирает
интересующий его ион
и прослеживает
только его превращения, при необходимости
«накачи-
вая» его энергией. Такой метод
дает информацию о структуре изучае-
мого
иона. Опираясь на закономерности
фрагментации, например орга-
нических
соединений, можно определить примерный
класс анализируе-
мого соединения или
крупного фрагмента анализируемого
соединения,
что существенно упрощает
задачу по установлению структуры.
4. Многозарядные ионы.
Многозарядные ионы – ионы, имеющие
заряд больший, чем 1. Соответственно,
отношение m/z у них кратно
меньше,
чем у однозарядного иона, и возможно
появление нецелочис-
ленных масс. В
экспериментальных условиях вероятность
получения
многозарядных ионов невелика
(за исключением метода электроспрей-
ионизации),
хотя для соединений некоторых классов,
таких, как арома-
тические, образование
двухзарядных ионов довольно частое
явление.
Условием стабилизации
многозарядного иона является максимальное
разделение зарядов, происходящее,
например, в молекулах конденсиро-
ванных
ароматических соединений.
5. Метастабильные ионы – ионы,
претерпевающие распад на ион
и
нейтральную частицу и имеющие время
жизни 10
-6
–10
-5
с. Время жиз-
ни метастабильных ионов
короче, чем время пролета через
масс-
анализатор. В результате
зарегистрированное детектором соотношение
164
массы к заряду изменяется,
что приводит к образованию слабого
уши-
ренного (размытого) пика, при этом
максимум пика, как правило, соот-
ветствует
нецелочисленным значениям массовых
чисел. Регистрация в
масс-спектре
метабильного иона позволяет доказать
протекание кон-
кретной реакции,
связывающей «родительский» и «дочерний»
ионы.
Для интерпретации масс-спектра
необходимо:
изучить всю имеющуюся
информацию о веществе (спектраль-
ную, химическую, историю
появления данного образца). Отметить
все
параметры съемки масс-спектра.
Проверить значения m/z;
используя изотопные пики,
вывести элементный состав всех
фрагментов, для которых это возможно,
подсчитать их степень ненасы-
щенности.
Использовать масс-спектрометрию высокого
разрешения для
определения элементного
состава фрагментов;
провести тест на молекулярный
ион (максимальное значение
m/z,
нечетно-электронность, выбросы нейтральных
частиц);
отметить важнейшие
нечетно-электронные ионы, обусловлен-
ные
перегруппировочными процессами;
изучить общий вид спектра
(стабильность молекулярного
иона,
лабильность связей и т. д.);
приписать возможные структуры
сериям ионов с низкой мас-
сой, важнейшим
первичным нейтральным фрагментам, а
также вторич-
ным (по спектрам
метастабильных ионов и активации
соударением),
важнейшим характеристическим
ионам;
постулировать структуру
молекулы (тест по реальному спек-
тру
идентифицированного вещества из базы
данных, например, по спек-
трам близких
структур, по спектру, предсказанному
теоретически).
Основным инструментом для
расшифровки результатов
масс-
спектрометрического анализа
являются библиотеки масс-спектральных
данных (например, NIST 07, NIST 08 – библиотеки
масс-спектральных
данных, созданные
и поддерживаемые Национальным институтом
стан-
дартизации и технологии США,
около 300000 масс-спектров;
WILEY 07 –
библиотека масс-спектральных данных
Мак-Лафферти,
около 450000 масс-спектров).
Контрольные вопросы
1. Какую зависимость называют
масс-спектром вещества?
2. На чем
основан масс-спектрометрический анализ?
3. Какие свойства ионов приводят к их
разделению в масс-
спектрометре?
4. На чем
основан качественный масс-спектрометрический
анализ?
165
5. На чем основан количественный
масс-спектрометрический анализ?
6.
Каковы области практического применения,
достоинства и недо-
статки масс-спектрометрического
метода?
7. Информация, получаемая
масс-спектрометрическим методом.
8.
Методы ионизации.
9. Принципиальная
схема масс-спектрометра.
10. Основные
характеристики масс-спектрометров.
11. Виды масс-анализаторов.
12. В чем
состоит различие между статическими и
динамическими
ализаторами?
13. Как происходит
разделение ионов по массам в квадрупольном
ана-
лизаторе?
14. Алгоритм
действия для интерпретации масс-спектра.
Тестовые вопросы к главе 4
1. В процессе масс-спектрометрических
измерений ионизацию (1),
разделение
ионов (2) и детектирование (3) проводят в
следующей
последовательности:
a)
1, 2, 3;
b) 2, 3, 1;
c) 3, 2, 1;
d) 3, 1, 2.
2. Масс-спектр – это
зависимость:
a) массы иона от длины волны
излучения;
b) количества полученных
ионов от отношения их массы к заря-
ду;
c) количества полученных
ионов от отношения их заряда к массе;
d) массы полученных ионов от их
количества.
3. Молекулярную массу
исследуемого вещества методом масс-
спектрометрии определяют по
величине m/z для:
a) наиболее интенсивного
сигнала;
b) наименее интенсивного
сигнала;
c) молекулярного иона;
d)
суммы всех образующихся ионов.
4. Ионизацию, разделение
ионов и детектирование в масс-
спектрометрии обычно проводят
при следующих условиях:
a) высокое
давление;
166
b) нормальное давление и
комнатная температура;
c) нормальное
давление и высокая температура;
d)
глубокий вакуум.
5. В качестве детектора
в масс-спектрометрах используют:
a) термопару;
b) счѐтчик
Гейгера;
c) линейку фотодиодов;
d)
электронный умножитель.
6. Бесполевая труба
длиной от 25 см до 1,5 м является составной
ча-
стью масс-анализатора:
a)
квадрупольного;
b) циклотронно-резонансного;
c) времяпролѐтного;
d) ионной ловушки.
7. Не существует
масс-анализатора:
a) квадрупольного;
b)
времяпролѐтного;
c) циклотронно-резонансного;
d) плазменного.
167
Соседние файлы в предмете Металлургия
- #
- #
- #
- #
- #
- #
- #
- #
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. См. № 13, 18, 23/2007;
6, 8, 10,
13/2008
Глава 8.
Расчеты по химическим формулам и уравнениям
Задачи по химии являются превосходной
«гимнастикой» для ума, поскольку позволяют
ученику развивать логическое мышление,
составлять и реализовывать план решения задачи,
а параллельно повторять те или иные разделы
химической науки. Все задачи, которые
предлагаются для решения, можно разделить на две
группы:
• задачи, которые решаются по
стандартной формуле;
• задачи, которые решаются по уравнению
реакции.
Рассмотрим сначала основные расчетные
понятия.
8.1. Основные расчетные понятия
Как известно, количества реагирующих
простых и сложных веществ и смесей обычно
измеряют в граммах, литрах, миллилитрах. Данные в
этих случаях записывают так:
m(NаС1) = 5 г,
V(р-ра) = 10 мл,
V(СO2) = 50 л
и т.д.
Однако при расчетах по уравнениям
реакций этих понятий оказывается недостаточно.
Дело в том, что в каждой химической реакции
участвуют определенные частицы (атомы, молекулы,
ионы), масса которых различна. И поэтому даже
для простейших химических реакций, например:
С + О2 = СО2,
нельзя утверждать, что 1 г углерода
полностью прореагирует с 1 г кислорода.
Посмотрите в таблицу Менделеева: атомные массы
этих химических элементов разные! Каким же
образом выполняется расчет по химическим
уравнениям?
Поскольку в химических реакциях
участвуют частицы (молекулы, атомы, ионы), то
основным расчетным понятием является моль
– величина, при помощи которой можно определить
число частиц.
1 моль любого вещества содержит 6•1023
частиц (молекул, атомов, ионов).
Например, 1 моль А1 содержит 6•1023
атомов алюминия; 1 моль НС1 содержит 6•1023 молекул
хлороводорода.
Число молей (?) реагирующих веществ
определяют по коэффициентам в уравнении
химической реакции, например:
Задание 8.1. Допишите уравнения
реакций, расставьте коэффициенты и подпишите под
химическими формулами число молей реагирующих
веществ:
NаOН + Н3РО4 —>
……………………………. ;
Аl + НСl —>
……..……………………………. ;
P + O2 —>
………………..……………………. .
Каким образом можно определить массу
или объем реагирующих веществ, зная их
количества (в молях)?
Для определения массы используют
величину «молярная масса»:
где М – молярная масса, г/моль; m
– масса, г; –
количество вещества, моль.
Молярная масса равна массе вещества
количеством 1 моль, т.е. молярная масса это
масса всех 6•1023 молекул (атомов, ионов).
Молярная масса (М) совпадает по величине с
относительной атомной (Аr) или
молекулярной (Мr) массой вещества,
которые легко определяются по таблице
Менделеева.
Так, относительная атомная масса (Аr)
натрия указана в таблице Менделеева:
Аr(Nа) = 22,990 23.
Это безразмерная величина.
Задание 8.2. Определите по таблице
Менделеева:
Аr(Cl), Аr(Mg), Аr(Pb).
Относительная молекулярная масса (Мr)
вещества равна сумме относительных атомных масс
атомов всех элементов, входящих в состав этого
вещества. При подсчете ее значения относительные
атомные массы рекомендуется округлять (обычно до
целых чисел), например:
Мr(O2) = 2•Аr(O) =
2•16 = 32,
Мr(Н2SO4) = 2•Ar(Н)
+ Ar(S) + 4•Ar(О) = 2•1 + 32 + 4•16 = 98.
Это безразмерные величины.
Задание 8.3. Рассчитайте
относительные молекулярные массы веществ:
Н3РО4, СuSO4, NаОН, KСl.
Теперь несложно определить массы
реагирующих веществ.
Задача 1. Определить массу железа
количеством 0,5 моль.
Решение
Из формулы находим:
m = M•,
M(Fe) = 56 г/моль, = 0,5 моль,
m = 56 (г/моль)•0,5 (моль) = 28 г.
Ответ. 28 г.
Задача 2. Определить количество
вещества Сu(NO3)2 массой 300 г.
Решение
Из формулы находим:
= m :
M,
M(Cu(NO3)2) = 64 + 2•(14 + 3•16) = 188
г/моль,
(Cu(NO3)2)
= 300 (г) : 188 (г/моль) = 1,6 моль.
Ответ. 1,6 моль.
8.2. Задачи, решаемые по стандартным
формулам
В ходе решения таких задач
рекомендуется придерживаться а л г о р и т м а:
– внимательно прочитать условие задачи
и выяснить, что у вас спрашивают;– написать соответствующую формулу и
проанализировать ее;– найти числовые значения требуемых
величин, каждый раз записывая вначале формулу, а
затем расчет, учитывая размерность величин.
8.2.1. Задачи по теме «Газы»
Известно, что вещества при нормальных
условиях (н. у.) могут находиться в трех
агрегатных состояниях: твердом, жидком,
газообразном. В твердом и жидком состояниях
между молекулами (атомами) вещества имеются
довольно сильные взаимодействия, в результате
чего частицы находятся на небольших расстояниях
друг от друга (рис. 1, см. с. 16).
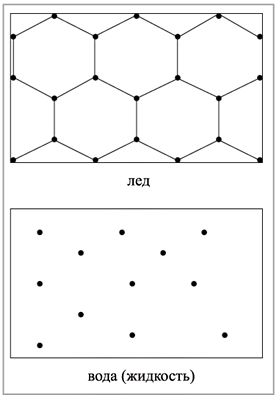 |
Рис. 1. Строение твердой и
|
В газах расстояния между
частицами очень велики и силы взаимодействия
ничтожны (рис. 2,
см. с. 16), поэтому V любого газа всегда >> V
жидкости, если их массы примерно равны и
условия опыта одинаковы.
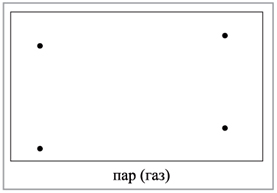 |
Рис. 2. Строение газообразного
|
Равные объемы любых газов
содержат одинаковое число молекул. Это
формулировка закона Авогадро.
Следствие этого закона: 1 моль любого
газа при нормальных условиях (н.у.) занимает объем
22,4 литра.
Эта величина (22,4 л/моль) является молярным
объемом газа (VМ):
VМ = V/= 22,4 л/моль, (1)
где VM – молярный объем газа,
л/моль, V – объем газа, л, – количество вещества газа, моль.
Таким образом, зная массу газа, можно
определить:
Но для того же газа из формулы (1)
имеем:
Отсюда для любого газа выполняется
соотношение:
Задача 3. Какую массу имеет
кислород объемом 7 л?
Дано:
V(O2) = 7 л.
Найти:
m(O2) = ?
Решение
Ответ. 10 г.
Задача 4. Какой объем занимает
азот массой 14 г?
Дано:
m(N2) = 14 г.
Найти:
V(N2) = ?
Решение
Ответ. 11,2 л.
Задача 5. Чему равна молярная
масса газа, 1 л которого имеет массу 1,25 г?
Дано:
V(X) = 1 л,
m(X) = 1,25 г.
Найти:
M(X) = ?
Решение
Ответ. Молярная масса неизвестного
газа (Х) 28 г/моль.
Пользуясь этими формулами, можно
рассчитать объем, массу, молярную массу газа,
например:
Известно, что
где –
плотность газа (г/л).
Поэтому:
М(газа) = •VM. (3)
П о м н и т е! Эти формулы можно
использовать лишь тогда, когда данные задачи
(плотность газа, его объем) измерены при н.у.: 273 K, 1
атм.
Из формулы (3) вытекает понятие об относительной
плотности газов (Dx). Эта величина
равна отношению плотностей двух газов:
где 1
и М1 – плотность и молярная масса
одного газа, 2
и М2 – плотность и молярная масса
другого газа.
где D2 – относительная
плотность 1-го газа по 2-му газу.
Относительная плотность газа
показывает, во сколько раз данный газ тяжелее
(или легче) второго газа.
Пользуясь этой формулой, можно легко
определить молярную массу данного газа:
М1 = D2•M2.
Задача 6. Определить молярную
массу газа, если:
а) плотность его равна 1,25 г/л;
б) плотность его по кислороду равна 0,75.
Решение
а) М = •VM,
M = 1,25 (г/л)•22,4 (л/моль) = 28 г/моль;
б) М = D(О2)•М(О2) ,
где D(О2) – плотность по кислороду, т.е. D(О2)
= 0,75, M(O2) = 32 г/моль,
М = 0,75•32 = 24 г/моль.
Ответ. а) 28 г/моль; б) 24 г/моль.
8.2.2. Задачи по теме «Способы
выражения концентрации растворов»
Для того чтобы определить массовую долю
растворенного вещества, нужно воспользоваться
формулой:
Ответ может быть дан в долях единицы,
например: = 0,15,
или в процентах: %
= 15%.
Задача 7. В 200 г воды растворили
16 г сахара. Определить (сахара) в полученном растворе.
Решение
В данном случае масса раствора
неизвестна. Но:
m(р-ра) = m(воды) + m(сахара),
m(воды) = 200 г, m(сахара) = 16 г,
m(р-ра) = 200 + 16 = 216 г,
(сахара)
= 16/216 = 0,074 (7,4 %).
Ответ. Массовая доля сахара
в полученном растворе равна 7,4%.
Задача 8. В 300 мл раствора ( = 1,2 г/мл) содержится
72 г NаОН. Определить (NаОН) в этом растворе.
Решение
В этом случае масса раствора неизвестна,
но известен объем. Найдем массу раствора:
m(р-ра) = •V = 1,2•300 = 360 г,
Ответ. 20%.
Пользуясь формулой (4), нетрудно
рассчитать и массу раствора, и массу
растворенного вещества. Но при этом следует
учитывать, что обычно в задачах упоминается о
«5%-м растворе», «16%-м растворе» и т.д., т.е. массовая
доля вещества выражена в процентах. В этом
случае легко сделать перевод:
в 5%-м растворе (в-ва) = 0,05,
в 16%-м растворе (в-ва)= 0,16 и т.д.
Зная массовую долю вещества в растворе,
можно определить:
m(в-ва) = (в-ва)•m(р-ра), (5)
Задача 9. Сколько граммов соли и
воды нужно взять для приготовления 350 мл 12%-го
раствора
( = 1,1 г/мл)?
Решение
Из формулы (5):
m(в-ва) = (в-ва)•m(р-ра),
(в-ва) =
12%, т.е. 0,12,
m(р-ра) = •V = 1,1•350 = 385 г,
m(в-ва) = 0,12•385 = 46,2 г,
m(воды) = m(р-ра) – m(в-ва) = 385 –
46,2 = 338,8 г.
Ответ. Необходимо взять
46,2 г соли и 338,8 г воды.
Задача 10. Сколько граммов 8%-го
раствора можно приготовить, имея 64 г NaCl?
Решение
По условию (в-ва) = 8%, т.е. 0,08, следовательно:
m(р-ра) = 64/0,08= 800 г.
Ответ. Можно приготовить 800 г
8%-го раствора.
Такие задачи можно решать, составляя
пропорции. При этом следует знать, что массовая
доля
(в %) вещества показывает, сколько граммов
вещества растворено в 100 граммах раствора.
Например, дан 5%-й раствор. Это значит, что
5 г вещества растворено в 100 граммах раствора.
Задача 11. Сколько мл 15%-го
раствора ( = 1,1 г/мл)
можно приготовить из 22,5 г вещества?
Решение
По условию % = 15 %, следовательно:
15 г вещества – 100 г раствора,
22,5 г вещества – х г раствора;
Зная массу раствора и плотность, найдем
его объем:
Ответ. 136,4 мл 15%-го раствора.
О б р а т и т е в н и м а н и е!
В пропорции в одном столбце должны совпадать и
размерность, и наименование компонента, о
котором идет речь.
8.2.3. Задачи по теме «Количественный
состав вещества»
Количественный состав вещества, как и
количественный состав раствора, выражают при
помощи массовых долей химических элементов в
нем:
(элемента)
= m (элемента)/m (в-ва).
Поскольку масса вещества в условии
задачи, как правило, не указывается, применяем
уже опробованный способ.
Пусть количество вещества равно 1 моль,
тогда:
m(в-ва) = •М = М,
т.к. количество вещества равно 1 моль.
m(элемента) = n•М(элемента),
где n – число атомов этого
химического элемента в веществе.
Получаем:
Задача 12. Определить массовую
долю азота в нитрате аммония.
Решение
Поскольку в молекуле NH4NO3 два
атома азота, а Мr(NH4NO3) = 80, то
(N) =
2•14/80 = 0,35 (35%).
Ответ. (N) = 35%.
Зная массовые доли химических элементов
в веществе (элементный состав), можно определять
молекулярную формулу неизвестного вещества.
Продолжение следует