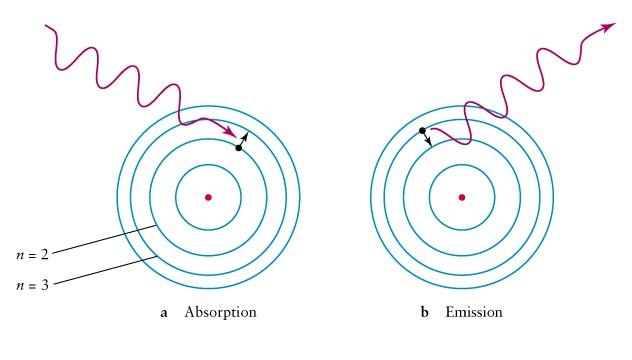
Теория
Бора водородоподобных атомов.
Нильс
Бор создал теорию строения атома,
способную объяснить опыты Резерфорда
и спектр излучения паров водорода.
Спектр
характеризует распределение интенсивности
излучения по шкале частот (или по шкале
длин волн).

Постулаты
Бора.
1-й
постулат:
электрон
в атоме может двигаться только по
определенным стационарным орбитам,
находясь на которых, он не излучает и
не поглощает энергию. Момент импульса
электрона на этих орбитах кратен
постоянной Планка:
, (1)
me
– масса электрона,
— скорость электрона на орбите с номером
n,
rn
– радиус орбиты с номером n,
n
=1,2,3,….
Дж·с
– постоянная Планка.
2-й
постулат:
при
переходе электрона с одной стационарной
орбиты на другую излучается или
поглощается фотон, энергия которого
.
(2)
E
n1
и
E
n2
— энергия электрона в состоянии 1 и 2
(т.е. на орбитах 1 и 2),
— частота электромагнитных волн,
—
постоянная Планка.
Радиус
орбиты электрона в атоме водорода.
1-й
постулат Бора,
.
Выразим
скорость электрона:
.
(3)
Рассмотрим
круговые электронные орбиты. На электрон
с зарядом —e
со стороны ядра с зарядом +e
действует сила Кулона F,
сообщая электрону нормальное ускорение,
.
По
2-му закону Ньютона,
.
(4)
Сократим
и подставим скорость из (3):
.
Отсюда

Радиус
первой орбиты электрона (n
= 1), называется радиусом
Бора
,
=
0.53·10-10
м.
Радиус
орбиты электрона в атоме водорода
,
n
=1,2,3,…. – номер орбиты.
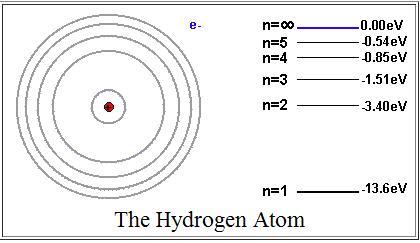
Энергия
электрона в атоме водорода.
Энергия
электрона представляет собой сумму
кинетической энергии
и
потенциальной
.
и
.
Потенциальная
энергия – это энергия электрона с
зарядом
в электрическом поле ядра. Из уравнения
(4) видно, что
.
Тогда
на n
–ой
орбите энергия электрона равна
=
=.
Т.е.
кинетическая энергия электрона равна
полной энергии, взятой со знаком «-».
Также
полную энергию можно записать через
потенциальную:
=
, или
.
Подставим
.
Тогда
=
.
Энергия
на первой орбите (на первом энергетическом
уровне) равна
=
= -13,6 эВ.
Величину
=
13,6 эВ = 2,18∙10-18
Дж
называют
энергией ионизации
(эта энергия необходима, чтобы перевести
электрон, находящийся на первом уровне,
в свободное состояние, т.е. чтобы
ионизовать атом). Окончательно, энергия
электрона на n
–ом
энергетическом уровне (на n
–ой
орбите) записывается как
=
.
Спектр излучения водорода.
Энергия
излучаемого или поглощаемого кванта:
.
Частота
,
длина волны,
— скорость света в вакууме.
=
+
=
,
=
.
=
—
формула Бальмера,
определяет
длины волн в спектре атома водорода.
=
1,1∙107
м-1
— постоянная Ридберга.
и
— номера энергетических состояний
(номера орбит) электрона.
Переходы
электрона с возбужденных энергетических
состояний на основной энергетический
уровень (
= 1) сопровождаются излучением в УФ
области
спектра (серия линий Лаймана),
переходы
на уровень с
= 2 приводят к линиям в
видимой области
(серия Бальмера),
переходы
на уровень с
= 3, 4, 5, … приводят излучению в ИК
области.
Теория
Бора не смогла объяснить строение
сложных атомов. Для объяснения поведения
микрочастиц была развита квантовая
механика.
Она
основана на том, что любая микрочастица,
наряду с корпускулярными, обладает
также волновыми свойствами (гипотеза
де Бройля).
Для
фотона, импульс
.
По
аналогии с фотоном, любую микрочастицу
можно рассматривать как волну с длиной
волны
,
—
длина волны де Бройля.
Гипотеза
де Бройля подтверждена экспериментально
наблюдением дифракции электронов, а
затем и протонов.
Принцип
неопределенностей.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Решая совместно уравнения
(2),
(5), (9), получим выражение для полной
энергии электрона в атоме водорода:
| (10) |
Уравнение (10) определяет разрешенные
значения энергии электрона в атоме
водорода. Число n
принимает целые значения n =
1,2,3, …¥ .
Таким образом, энергия электрона в атоме
водорода может иметь не любые значения,
а только дискретный набор значений,
определяемых числом n,
или, как говорят, энергия электрона квантуется.
Подставляя значения
массы и
заряда электрона, постоянных 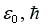
уравнение (10) и выражая энергию в электронвольтах
(эВ) (1эВ = 1,6.10-19
Дж), получим
формулу
| (11) |
Энергия основного состояния
(при n
= 1), равна E1=
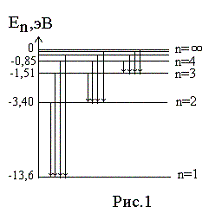
— 13,6 эВ. На рис. 1
приведена диаграмма энергетических
уровней электрона в атоме водорода, на
которой горизонтальными прямыми
отмечены разрешенные значения энергии.
Все состояния с величиной n= 1 … ¥ являются
связанными. При увеличении числа n
энергетические уровни сближаются все
больше и больше. При n ® ¥ E ®
0.
Энергетические состояния с энергией E ³
0
соответствуют тому, что электрон
становится свободным (не связанным с
ядром).
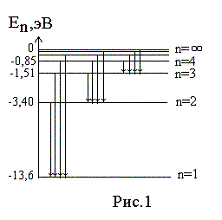
энергетических уровней (рис.1) позволяет
дать несколько важных определений.
Энергия возбуждения Евоз
– это энергия, которую необходимо
сообщить электрону, чтобы он из
основного состояния (n = 1)
перешел в возбужденное. Например, Евоз
= 10,2 эВ – энергия, необходимая для
перехода электрона в состояние,
соответствующее n =
2 (первое возбужденное состояние).
Энергия ионизации Еион
– энергия, необходимая для отрыва
электрона, находящегося в основном
состоянии (n
= 1), от ядра, т.е. для перевода электрона
на уровень с n = ¥ .
Для атома водорода энергия ионизации
равна 13,6 эВ.
Согласно постулату Бора, при
переходе электрона из одного состояния (с
большей энергией) в другое (с меньшей
энергией) испускается фотон, частота
которого определяется формулой (8).
Учитывая выражение (10) для энергии
электрона в атоме, получим выражение для
частот испускаемых фотонов:
| (12) |
или, соответственно, для длин
волн испускаемых фотонов:
| (13) |
где Ry =
1,0974.107
м–1
– так называемая постоянная Ридберга.
Таким образом, модель атома Н.Бора
объясняет дискретный (линейчатый)
характер спектра испускания атома
водорода.
Спектральные
серии атома водорода
На диаграмме энергетических уровней (рис.1)
показаны возможные переходы электрона с
верхних уровней на нижние. При каждом
таком переходе излучается фотон с
частотой, определяемой формулой (12), или
длиной волны, определяемой формулой (13).
Переходы электрона с различных верхних
уровней на определенный нижний образуют
так называемые спектральные серии
атома водорода. Так, все переходы из
состояний с n
= 2, 3, 4, … в
состояние с n
= 1 образуют так называемую серию
Лаймана (ультрафиолетовое излучение).
Все длины волн этой серии лежат в
ультрафиолетовой области шкалы
электромагнитных волн. Переходы из
состояний с n
= 3, 4, 5, … в состояние с n
= 2 образуют серию Бальмера (видимый
свет). Переходы из состояний с n
= 4, 5, 6, … в состояние с n
= 3 образуют серию Пашена (инфракрасное
излучение). Длины волн всех остальных
серий (переходы на уровни с n
= 4, 5, и т.д.) лежат в инфракрасной области
спектра электромагнитного излучения.
Квантовые постулаты Бора – это два основных допущения, введённые Н.Бором для объяснения устойчивости атома и спектральных закономерностей (в рамках модели атома Резерфорда).
Планетарная модель атома Резерфорда позволила объяснить результаты опытов по рассеянию α-частиц вещества, но она не способна объяснить факт существования атома и его устойчивость.
В соответствии с планетарной моделью электроны атома должны двигаться вокруг неподвижного ядра. Двигаясь вокруг ядра с центростремительным ускорением под действием силы притяжения к ядру, электрон должен, как и всякий ускоренно движущийся электрический заряд, излучать электромагнитные волны с частотой, равной частоте обращения электрона вокруг ядра.
Энергия электрона в атоме должна при этом непрерывно уменьшаться за счёт излучения. Сам электрон должен с каждым оборотом приближаться по спирали к ядру и упасть на него под действием электрической силы притяжения. При этом атом потеряет всю электронную оболочку, а также присущие ему физические и химические свойства. Кроме того, атом должен потерять спектр излучения частоты, то есть атом должен давать излучение с непрерывным (сплошным) спектром частот.
Эти результаты, полученные с помощью классической механики и электродинамики, находятся в резком противоречии с опытом, который показывает, что
- Атомы являются весьма устойчивыми системами и в невозбуждённом состоянии могут существовать неограниченно долго, не излучая при этом электромагнитные волны
- Спектр излучения атома является линейчатым (дискретным) – образованным из отдельных линий (от латинского discretus – прерывистый, состоящий из отдельных значений)
Всё это свидетельствует о том, что законы классический физики применить к электронам в атомах нельзя, поэтому необходимы новые представления о механизме излучения и поглощения атомами электромагнитных волн. В основе современной теории атома лежитквантовая механика – теория, устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов), а также связь величин, которые характеризуют частицы и системы, с физическими величинами, измеряемыми опытным путём.
В 1913 году датский физик Нильс Бор (1885 – 1962) ввёл идеи квантовой теории в ядерную модель атома Резерфорда и разработал теорию атома водорода, которая подтвердилась всеми известными тогда опытами. Бор сформулировал в виде постулатов основные положения новой теории, которые налагали лишь некоторые ограничения на допускаемые классической физикой движения. Однако последовательной теории атома Бор не дал. Впоследствии теория Бора была включена как частный случай в квантовую механику. В основе теории Бора лежат два постулата.
Первый постулат Бора: постулат стационарных состояний
Атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определённая энергия En. В стационарном состоянии атом не излучает.
Второй постулат Бора: правило частотe
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний:
hvkn = Ek — En
Частота излучения равна:
vkn = (Ek — En) / h = (Ek / h) — (En / h)
Или, длина волны излучения λ равна:
1 / λkn = (1 / hc) (Ek — En)
Где h – постоянная Планка, с – скорость света в вакууме.
Если Ek > En, то происходит излучение фотона, если Ek < En, то происходит поглощение фотона, при котором атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. Таким образом, для каждого атома имеется ряд строго определённых дискретных значений энергии, которыми он может обладать. Физические величины, например энергия и импульс, которые могут принимать лишь дискретные (квантовые) значения, носят название квантованные физические величины (квантование физических величин). При этом энергетические уровни атома – это возможные значения энергии атома.
Правило квантования орбит позволяет определить радиусы стационарных орбит:
mvnrn = nh’
где n = 1, 2, 3…, m – масса электрона, rn – радиус n-ой орбиты, vn – скорость электрона на этой орбите.
Число n – положительное число, которое называется главное квантовое число.
Величина (mvn)rn – момент импульса электрона.
h’ – это величина, которая равна:
h’ = h/2π = 1,05445887•10-34 Дж•с
где h – постоянная Планка.
Главное квантовое число указывает номер орбиты, по которой может обращаться электрон.
Свои постулаты Н.Бор применил для построения теории простейшей атомной системы – атома водорода, состоящего из ядра – протона, и одного электрона. Эта теория также применима для водородоподобных ионов, то есть атомов с зарядом ядра Ze и потерявших все электроны, кроме одного (например, Li2+, Be3+ и т.п.). В предположении, что электрон движется по круговой орбите, постулаты Бора позволяют найти радиусы rn стационарных, возможных орбит электрона. На электрон действует кулоновская сила:
Fk = (1 / 4πε0) (ε2 / rn2)
Где е – модуль заряда электрона, равный заряду ядра, ε0 = 8,85418782 * 10-12 Ф/м – электрическая постоянная в единицах СИ.
Кулоновская сила сообщает электрону на орбите центростремительное ускорение:
aцс = (vn2) / rn
Согласно второму закону Ньютона:
Fk = maцс
Поэтому
(mvn2) / rn = e2 / (4πε0rn2)
Или
mvn2rn = e2 / (4πε0)
Используя правило квантования орбит mvnrn = nh’, можно получить выражения для возможных радиусов орбит. Исключая скорость vn из предыдущего выражения, получим:
rn = 4πε0n2h’ / me2 (так как h’ = h / 2π)
Таким образом, радиусы орбит электрона в атоме водорода прямо пропорциональны квадратам главного квантового числа n.
Наименьший радиус орбит при n = 1, то есть радиус первой орбиты в атоме водорода равен:
r1 = 4πε0h’ / me2 = 0,528 * 10-10 м = 0,528 Å
Радиус первой орбиты в атоме водорода носит название первый Боровский радиус и служит единицей длины в атомной физике.
Полная энергия Е электрона в атоме водорода, согласно механике Ньютона, равна сумме кинетической энергии Еk и потенциальной энергии П взаимодействия электрона с ядром:
E = Еk — П = (mvn2 / 2) — (e2 / 4πε0rn)
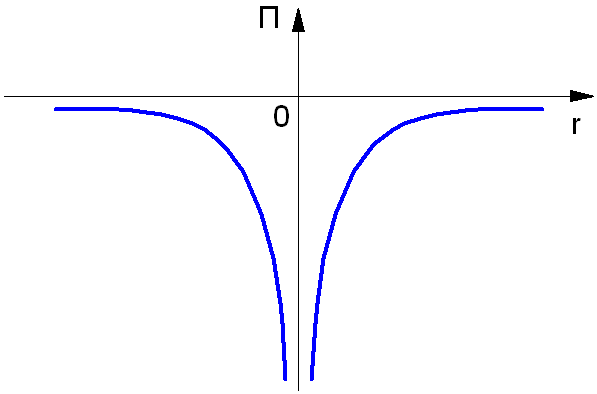
Потенциальная энергия электрона в атоме отрицательна:
П = — (e2 / 4πε0rn)
Так как нулевой уровень отсчёта берётся на бесконечности (рис. 1.3), а по мере приближения электрона к ядру его потенциальная энергия уменьшается. Взаимодействующие частицы – ядро и электрон – имеют заряды противоположных знаков.
Рис. 1.3. Потенциальная энергия электрона в атоме.
Подставляя значение скорости
vn2 = — e2 / 4πε0mrn
в выражение полной энергии, получим:
E = (m / 2) (e2 / 4πε0mrn) — (e2 / 4πε0rn)
Подставляя в эту формулу выражение для радиусов орбит, получим энергетические уровни электрона в атоме водорода (значения энергий стационарных состояний атома):
En = -(1 /(4πε0)2) me4 / 2h’2n2 = — (me4 / 8h2ε02) * (1 / n2), n = 1,2,3…
Энергия Еn электрона в атоме водорода зависит от главного квантового числа n, которое определяет энергетические уровни электрона в атоме водорода.
Основное энергетическое состояние атома (нормальное состояние атома) – это энергетический уровень при n = 1.
Значение энергии, соответствующее первому (низшему) энергетическому уровню в атоме водорода равно:
E1 = -(1 /(4πε0)2) me4 / 2h’2λ = -2,485 * 10-19 Дж = -13,53 эВ
В этом состоянии атом может находиться сколько угодно долго. Для того чтобы ионизировать атом водорода, ему нужно сообщить энергию 13,53 эВ, которая называется энергия ионизации.
Энергетические уровни при n > 1 – это возбуждённые энергетические состояния (возбуждённые состояния атома). Возбуждённое состояние атома является менее устойчивым, чем основное состояние. Время жизни атома в этом состоянии имеет порядок 10-8 секунд. За это время электрон успевает совершить около ста миллионов оборотов вокруг ядра.
При переходе электрона с удалённой от ядра стационарной k-орбиты на ближайшую n-ую орбиту атом излучает фотон, энергия которогоhvnk согласно второму постулату Бора определяется:
hvkn = Ek — En = -(1 / (4πε0)2) * (me4 / 2h’2) * [(1 / n2) — (1 / k2)] = (me4 / 8h2ε02) * [(1 / n2) — (1 / k2)]
Частота излучения атома водорода:
vkn = (1 / (4πε0)2) * (me4 / h’3) * [(1 / n2) — (1 / k2)] = R[(1 / n2) — (1 / k2)]
Где
R = (me4 / (4πε0)2) * 4πh’3) = (me4 / 8h3ε02) = 3,288 * 1015 c-1— постоянная Ридберга
Постоянная Ридберга определяется через постоянную Планка, массу и заряд электрона.
Длина волны излучения определяется соотношением:
1 / λnk = vnk / c = (me4 / 8ε02h3c) * [(1 / n2) — (1 / k2)] = Rc[(1 / n2) — (1 / k2)]
Где
Rc = R / c = 1,0974 * 107 м-1 — также постоянная Ридберга
с = 3*108 м/с – скорость света в вакууме.
Теоретическое значение R совпадает с экспериментальным значением, полученным из спектроскопических измерений.
Энергия обычно измеряется в электронвольтах (эВ). Электронвольт– это значение энергии, которую приобретает электрон, пройдя ускоряющую разность потенциалов в 1 В:
1 эВ = 1,6 * 10-19 Кл * 1В = 1,6 * 10-19 Дж
2018-07-04
Определить энергию электрона атома водорода в стационарном состоянии, для которого волновая функция $psi(r) = A(1 + + ar)e^{ — alpha r}$, где $A, a$ и $alpha$ — некоторые постоянные.
Решение:
Уравнение Шредингера для задачи в гауссовских единицах
$nabla^{2} psi + frac{2m}{ hbar^{2} } left ( E + frac{e^{2} }{r} right ) psi = 0$
В единицах СИ получаем $(e^{2} / 4 pi epsilon_{0})$ для $e^{2}$.
Подставим $psi = frac{ xi (r) }{r}$. Тогда $xi^{ prime prime} + frac{2m}{ hbar^{2} } left ( E + frac{e^{2} }{r} right ) xi = 0$ (1)
Что дает $xi = r psi = Ar(1 + ar)e^{ — alpha r}$
$xi^{ prime} = A(1 + 2ar)e^{- alpha r} — alpha Ar (1 + ar)e^{ — alpha r}$
$xi^{ prime prime} = alpha^{2} Ar (1 + ar) e^{ — alpha r} — 2 alpha A (1 + 2ar)e^{ — alpha r} + 2 aA e^{ — alpha r}$
Подстановка в (1) дает условие
$alpha^{2} (r + ar^{2}) — 2 alpha (1 + 2ar) + 2a + frac{2m}{ hbar^{2} } (Er + e^{2}) cdot (1 + ar) = 0$
Приравнивая коэффициенты при $r^{2}, r$ и постоянном члене нулю, получим
$2a — 2 alpha + frac{2me^{2} }{ hbar^{2} } = 0$ (2)
$a alpha^{2} + frac{2m}{ hbar^{2} } Ea = 0$ (3)
$alpha^{2} = 2a alpha + frac{2m}{ hbar^{2} }(E + e^{2}a ) = 0$ (4)
Из (3) либо $a = 0$, или $E = — frac{ hbar^{2} alpha^{2} }{2m}$
В первом случае $alpha = frac{me^{2} }{ hbar^{2} }, E = — frac{ hbar^{2} }{2m} alpha^{2} = — frac{me^{4} }{2 hbar^{2} }$
это состояние является основным состоянием.
Во втором случае $a = alpha — frac{me^{2} }{ hbar^{2} }, alpha = frac{1}{2} frac{me^{2} }{ hbar^{2} }$
$E = — frac{me^{4} }{8 hbar^{2} }$ и $a = — frac{1}{2} frac{me^{2} }{ hbar^{2} }$
Состояние один равно $n = 2$ (2s).