и энергии
нулевых колебаний осциллятора
Некоторые задачи
квантовой механики могут быть решены
или поняты на качественном уровне, если
использовать различные комбинации
законов классической физики и соотношения
неопределенностей Гейзенберга.
Пример 1. Оценим
энергию основного состояния атома
водорода.
Основным
состоянием атома водорода является
состояние с наименьшей энергией (1 –
энергетический уровень).
Полная механическая
энергия атома водорода равна сумме
кинетической энергии вращающегося
электрона вокруг ядра и потенциальной
энергии взаимодействия электрона с
ядром, т. е.
W
= Wк
+ Wр,
где
Wк
=
p2/(2m)
– кинетическая энергия вращающегося
электрона вокруг ядра;
Wр
=
–qe2/(40r)
– потенциальная энергия взаимодействия
электрона с ядром.
При
допущении неопределенности положения
электрона в пределах радиуса его орбиты,
т. е. r
r
и неопределенность импульса в пределах
самого импульса, т. е. р
р.
Тогда на
основании соотношений неопределенностей
Гейзенберга имеем
r
р
h
/(4)
или
по порядку величины р
h
/2
r.
Если
возьмем равенство
р
= h
/(2r)
и
подставим в формулу кинетической
энергии, то полная энергия атома водорода
W
= h2/(42m
r2)
– qe2/(40r).
Теперь
перейдем к условию минимума, т. к. нас
интересует состояние с наименьшей
энергией:
dW/dr
= – h2/(42m
r3)
+ qe2/(40r2)
= 0.
Корень
этого уравнения, соответствующий
минимуму полной энергии W,
равен
r1
= 0h2
/ (m
qe2).
В
квантовой механике, полученное значение
r1
называют
радиусом первой боровской орбиты.
После вычисления получим r1 510 11 м. Для энергии основного состояния атома водорода получим
W1
= –
m
qe4
/ (8202h2).
W1
= –
13,6 эВ
или
W1
= –
2,176 10
18Дж.
Пример 2. Энергия
нулевых колебаний одномерного
гармонического
осциллятора.
В
качестве одномерного гармонического
осциллятора рассмотрим колебания груза
на пружине (пружинный маятник), который
характеризуется потенциальной энергией
Wр
=
k
x2
/
2,
представляющий
собой, параболическую потенциальную
яму.
Для
оценки минимально возможной полной
энергии осциллятора применим соотношения
неопределенностей Гейзенберга.
Полная
механическая энергия данного осциллятора
W
= Wк
+ Wр,
где
Wк
=
pх2
/
(2m)
– кинетическая энергия осциллятора;
Wр
=
k
x2
/
2.
Следовательно,
W
= pх2
/
(2m)
+ k
x2
/
2.
Согласно
классической механике минимум полной
энергии W
= 0 соответствует х
= 0 и рх
=
0, т. е. пружинный маятник неподвижен.
При
рассмотрении квантового случая должны
учесть, что одновременно точные значения
координаты (х)
и проекции импульса на ось х (рх)
указать
невозможно.
Согласно, принципа
неопределенностей Гейзенберга, имеем
х
рх
h
/(4).
Если
положим, что х
х ; рх
рх
или
по порядку величины х
рх
h
/ (2),
т. е. рх
h
/(2x).
При
переходе к равенству рх
= h
/(2x)
для полной энергии осциллятора будем
иметь
W
= h2
/(82mx2)
+ k
x2
/
2.
Перейдем
к условию минимума энергии:
dW
/dx
= – h2
/(42mx3)
+ k
x
= 0.
Корень
этого уравнения запишем в виде
.
Тогда
минимальное значение полной энергии
рассматриваемого квантового осциллятора
W0
= h
/(2).
или
W0
= h,
где
– собственная
круговая частота осциллятора;
= 2.
Данная
оценка отличается от точного значения
только численным множителем 1/2.
Полная
энергия квантового осциллятора
называется энергией нулевых колебаний
гармонического осциллятора.
Энергия — основное состояние — атом
Cтраница 1
Энергия основного состояния атома обычно принимается равной нулю. Если желательно показать тонкую структуру, отдельные фрагменты диаграммы можно увеличить.
[1]
Энергия основного состояния атома водорода заслуживает подробного обсуждения. Основываясь на законах классической механики, следует ожидать, что электрон проводит как можно больше времени в окрестности ядра, поскольку при этом его потенциальная энергия минимальна. Идеальным положением электрона с этой точки зрения является контакт с ядром. На самом же деле в основном состоянии атома водорода электрон, находящийся на ls — орбитали, хотя и распределен в области, близкой к ядру, вовсе не ограничен этой областью. Что отталкивает электрон от ядра. Классический ответ гласит: Причиной отталкивания является угловой момент электрона и сопутствующая центробежная сила. Это предположение и было положено в основу модели Бора. Однако, поскольку с s — орбиталью не связан никакой угловой момент, такое объяснение нельзя считать приемлемым.
[2]
Определите энергию основного состояния атома, образованного из электрона и позитрона, которые связаны между собой силами кулоновского притяжения.
[3]
Дж-моль — 1 выше энергии основного состояния атома углерода.
[4]
Ридберга, равная fi о — энергия основного состояния атома.
[5]
Ридбергом называется единица энергии, равная энергии основного состояния атома водорода, взятой с обратным знаком.
[6]
Полученное выражение ( 3) представляет приближенное значение энергии основного состояния атома водорода, находящегося в слабом электрическом поле.
[7]
Для того чтобы проиллюстрировать использование таких уравнений, вычислим энергию основного состояния атома водорода.
[8]
Здесь Ev — энергия, соответствующая потолку валентной зоны, а Еа — энергия основного состояния акцепторного атома.
[10]
Указанная ошибка несколько больше ( хотя имеет тот же порядок величины) соответствующей ошибки в энергии основного состояния атома гелия.
[11]
Вариационные методы, развитые в работах Ритца, Хиллерааса и других, были с успехом использованы для нахождения энергий основных состояний атомов.
[12]
А, Е ( МА) и Е ( Мв) — энергии электронных конфигураций А и В, усредненные с весом по всем мульти-плетам, возникающим для этих конфигураций, и взятые относительно энергии основного состояния атома. Усреднение по мульти-плетам, очевидно, следует проводить в соответствии с количеством микросостояний, принадлежащих данному мультиплету.
[13]
Пусть оба атома находятся в основных состояниях. Полная энергия системы не будет равна удвоенной энергии основного состояния атома водорода. К), которая зависит от расстояния R. Только в случае очень большого К эта энергия будет равна нулю.
[15]
Страницы:
1
2
Решая совместно уравнения
(2),
(5), (9), получим выражение для полной
энергии электрона в атоме водорода:
| (10) |
Уравнение (10) определяет разрешенные
значения энергии электрона в атоме
водорода. Число n
принимает целые значения n =
1,2,3, …¥ .
Таким образом, энергия электрона в атоме
водорода может иметь не любые значения,
а только дискретный набор значений,
определяемых числом n,
или, как говорят, энергия электрона квантуется.
Подставляя значения
массы и
заряда электрона, постоянных 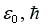
уравнение (10) и выражая энергию в электронвольтах
(эВ) (1эВ = 1,6.10-19
Дж), получим
формулу
| (11) |
Энергия основного состояния
(при n
= 1), равна E1=
— 13,6 эВ. На рис. 1
приведена диаграмма энергетических
уровней электрона в атоме водорода, на
которой горизонтальными прямыми
отмечены разрешенные значения энергии.
Все состояния с величиной n= 1 … ¥ являются
связанными. При увеличении числа n
энергетические уровни сближаются все
больше и больше. При n ® ¥ E ®
0.
Энергетические состояния с энергией E ³
0
соответствуют тому, что электрон
становится свободным (не связанным с
ядром).
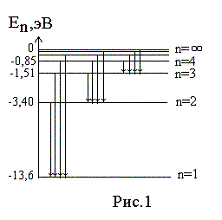
энергетических уровней (рис.1) позволяет
дать несколько важных определений.
Энергия возбуждения Евоз
– это энергия, которую необходимо
сообщить электрону, чтобы он из
основного состояния (n = 1)
перешел в возбужденное. Например, Евоз
= 10,2 эВ – энергия, необходимая для
перехода электрона в состояние,
соответствующее n =
2 (первое возбужденное состояние).
Энергия ионизации Еион
– энергия, необходимая для отрыва
электрона, находящегося в основном
состоянии (n
= 1), от ядра, т.е. для перевода электрона
на уровень с n = ¥ .
Для атома водорода энергия ионизации
равна 13,6 эВ.
Согласно постулату Бора, при
переходе электрона из одного состояния (с
большей энергией) в другое (с меньшей
энергией) испускается фотон, частота
которого определяется формулой (8).
Учитывая выражение (10) для энергии
электрона в атоме, получим выражение для
частот испускаемых фотонов:
| (12) |
или, соответственно, для длин
волн испускаемых фотонов:
| (13) |
где Ry =
1,0974.107
м–1
– так называемая постоянная Ридберга.
Таким образом, модель атома Н.Бора
объясняет дискретный (линейчатый)
характер спектра испускания атома
водорода.
Спектральные
серии атома водорода
На диаграмме энергетических уровней (рис.1)
показаны возможные переходы электрона с
верхних уровней на нижние. При каждом
таком переходе излучается фотон с
частотой, определяемой формулой (12), или
длиной волны, определяемой формулой (13).
Переходы электрона с различных верхних
уровней на определенный нижний образуют
так называемые спектральные серии
атома водорода. Так, все переходы из
состояний с n
= 2, 3, 4, … в
состояние с n
= 1 образуют так называемую серию
Лаймана (ультрафиолетовое излучение).
Все длины волн этой серии лежат в
ультрафиолетовой области шкалы
электромагнитных волн. Переходы из
состояний с n
= 3, 4, 5, … в состояние с n
= 2 образуют серию Бальмера (видимый
свет). Переходы из состояний с n
= 4, 5, 6, … в состояние с n
= 3 образуют серию Пашена (инфракрасное
излучение). Длины волн всех остальных
серий (переходы на уровни с n
= 4, 5, и т.д.) лежат в инфракрасной области
спектра электромагнитного излучения.
