Home
/ Учебник ОБЩАЯ ХИМИЯ / Глава 3. Молекула / * Энергия молекулы водорода
* Энергия молекулы водорода
Молекула водорода состоит из двух атомов водорода. При образовании молекулы два электрона, которые до этого времени принадлежали к двум различным атомам водорода, начинают вращаться в плоскости, перпендикулярной к оси, соединяющей ядра (рисунок 3.4).
При образовании ковалентной химической связи за счет перехода электронов от одного атома к внешней оболочке другого происходит выделение энергии. Данное выделение энергии можно объяснить сродством атомов водорода по отношению к электрону. Это соответствует формуле 0.72 эВ х 2, где 0,72 эВ есть энергия сродства одного атома водорода по отношению к одному электрону.
Одновременно при образовании связи электроны и ядра приближаются друг к другу, что приводит к потере энергии. Согласно опытным данным, межъядерное расстояние в молекуле водорода составляет 0.74Å. Соответственно, потеря энергии, происходящая за счет взаимного отталкивания ядер, составляет около 9 эВ.
То есть в соответствии с этим расчетом, молекула водорода не может быть стабильной.
Рисунок 3.4 Силы притяжения и отталкивания в молекуле AB
Рассчитаем энергию молекулы водорода так, как мы это делали для атома: энергия молекулы также приравнивается к сумме ее электронных энергий.
Согласно этой модели (рисунок 3.4), электроны вращаются вокруг точки Е в плоскости, перпендикулярной к оси, соединяющей ядра А и В. Силы притяжения электронов к ядрам направлены перпендикулярно к плоскости круга, в котором электроны вращаются и где они взаимно уравновешивают друг друга. Их взаимное действие, таким образом, равно нулю. Задача о вычислении энергии молекулы водорода сводится к вопросу об определении энергии гелиеподобного атома (атома с двумя электронами).
Мы показали (см. монографию), что для этого расчета необходимо знать ядерный заряд, так как энергия гелиеподобного атома определяется по формуле:
EHe = 13,6 .(Z — 0.25)2 • 2 (3.4.1)
Следует отметить, что в точке Е нет реального положительного заряда. Электроны притягиваются к этой точке за счет сил F11, которые являются проекциями сил F1 на оси DC.
Данные силы идентичны тем силам, которые удерживают электроны на орбите гелиеподобного атома с зарядом Z. Эти силы предотвращают разрыв электронов из-за взаимного отталкивания F3 и центробежных сил, то есть 2F11 = F3+F4, где F3 есть силы межэлектронного отталкивания и F4 — центробежные силы.
В данном случае, как и всегда, мы используем систему вычислений, предложенную Бором для расчета атомарных систем. Энергия системы и линейные параметры в этих расчетах определяются посредством сравнения зарядов и расстояний (радиусов) с энергией электрона и радиусом орбиты в атоме водорода. Заряд электрона принят за единицу заряда, а радиус атома водорода (0,529Å) выступает в качестве единицы длины. Единичная сила в данном случае есть сила взаимодействия протона с электроном в атоме водорода, расстояние между которыми составляет 0,529 Å.
Таким образом, ядерный заряд может иметь сходство с зарядом Ze, поскольку заряд протона равен заряду электрона. С учетом всех принятых обозначений, определим эффективный заряд Z в точке E молекулы водорода (см. рисунок).
Электроны здесь расположены в точках C и D, а ядра (протоны) — в точках А и В. Точка Е находится в центре, вокруг которого вращаются электроны в плоскости, перпендикулярной по отношению к нему, как это изображено на рисунке. Силы притяжения электронов к ядрам обозначены на рисунке как F1, силы отталкивания между ядрами — как F2, силы отталкивания между электронами — как F3.
Проекции F1 на оси CD обозначены как F11, проекции F1 на оси AB — как F111.
Свойства молекул водорода не изменяются с течением времени, поэтому расстояния между электронами и ядрами являются постоянными. То есть, силы F1, притягивающие ядро F111 , есть равные силы межъядерного отталкивания. Силы F111, действующие на электроны, также равны по той же причине. Эти силы действуют на электроны C и D в противоположных направлениях и являются равными по величине, т. е. их результирующая сила равняется нулю. То же самое относится к силам 2F11 и F3+F4.
Теперь обозначим радиус орбиты электрона как а (EC = а), расстояние между ядрами как 2b (AB = 2, b), расстояние между электроном и ядром как с (AC = с), а половину силы, притягивающей электрон к точке Е, как F5. Таким образом, мы получаем:
F5 = F11 + F11 = 2F11 (3.4.2)
С другой стороны, поскольку силы, действующие на каждый электрон, равны силам в водородоподобных атомах с радиусом а и зарядом Ze, получаем:
F5 = Ze2/a2 (3.4.3)
Если подставить значение F5 в уравнение 3.4.2, мы получаем:
Ze2/a2 = 2F11 (3.4.4)
т. е. для того чтобы определить Z и энергию молекулы водорода, надо решить это уравнение.
F11, как уже отмечалось, является проекцией F1 на ось CD. Согласно тригонометрии:
F11 = F1 x cos ∠ ECB (3.4.5)
Тогда cos∠ECB = EC/CB, или, в соответствии с принятыми обозначениями, EC = a и BC = c , следовательно, cos∠ECB = a/c. Согласно теореме Пифагора и принятым обозначениям, EB = b:
Cos ∠ECB = a/(a2+b2)0.5 = a(a2+b2)-0.5
Подставляя значение cos ∠ ECB в уравнение 3.4.5, получаем:
F11 = F1 x a(a2+b2)-0.5
В соответствии с принятыми обозначениями, BC = c
F1 = e2/c2 (3.4.6 ),
поскольку положительный заряд в точке B равен 1.
Подставляя значение F1 из этого уравнения, получаем:
F11 = e2/c2 x a(a2+b2)-0.5 ; то есть, c2 = a2+b2
Таким образом, мы получаем теорему Пифагора:
F11 = e2a(a2+b2)-0.5/(a2+b2)= e2a(a2+b2)-1.5
Подставляя значение F11 из данного уравнения к уравнению 6.1.4, получаем:
Ze2/a2 = 2e2a(a2+b2)-1.5
Умножая обе части этого уравнения на a2 и деля их на e2, получаем:
Z = 2a3(a2+b2)-1.5
Теперь делим и умножаем значение в скобках на а:
Z = 2a3 • a-3(1+b2/a2)-1.5 = 2[1+(b/a)2]-1.5 (3.4.7).
То есть, для того чтобы определить значение b, мы должны определить значение b/a, для которого мы будем использовать следующее уравнение.
В соответствии с рис. 3.4, 2F111 = F2 или, согласно тригонометрии и рис. 6.1, F111 = F1 cos ∠ CBE, поскольку в соответствии с законами тригонометрии и теоремой Пифагора, cos ∠ CBE = b/(a2+b2)1.5
Тогда, используя закон Кулона, получим:
F111 = [e2/(a2+b2)] • b/(a2+b2)0.5 = e2b/(a2+b2)1.5 (3.4.8)
С другой стороны, согласно модели и законом Кулона:
2F111= e2/4b2, то есть, 2e2b/(a2+b2)1.5 = e2/4b2
Теперь умножим обе части уравнения на следующее 4(a2+b2)(a2+b2)0.5 / b e2 и мы получаем:
e24(a2+b2)(a2+b2)0.5 / 4 b2 b e2 == 2e2 • b • 4(a2+b2)(a2+b2) / (a2+b2)0.5(a2+b2)0.5 • b • e2.
Таким образом, мы имеем: (a2+b2)(a2+b2)0.5 / b3 = 8.
Квадрат обеих частей уравнения дает нам:
(a2+b2)2 • (a2+b2) / b6 = 64 или: (a2+b2)3 / b6 = 64.
По извлечении кубического корня в обеих частях уравнения, имеем:
(a2 + b2)/b2 = 4 или a2/b2 + 1 = 4; a2/b2 = 3; a/b = 30,5 (3.4-8a)
Подставляя значения b/a = 1/30.5 в уравнение 3.4.7, мы получаем:
Z = 2(1+1/30.5)-1.5 = 2(1,333)-1.5 = 1,299
Подставляя значение Z в уравнении 3.4.1, мы, наконец, определяем значение энергии молекулы водорода (EH2), которое составляет:
EH2=1 317 кДж/моль.•2•(1,299-0.25)2 =1,317 • 2 • (1,049)2 = 2 898 кДж/моль.
Вычисляя энергию молекулы водорода, мы получили данные, позволяющие нам рассчитать геометрические параметры молекулы.
Суммарный заряд, действующий на электроны, равен 1.049 единиц протона. Таким образом, радиус перехода электрона на 1.049 меньше, чем у атома водорода, который в свою очередь равен 0.529Å.
Соответственно, радиус орбиты (круга), по которой связывающие электроны вращаются в молекуле водорода, равен 0.504 Å (0.529/1.049 = 0.504). Поскольку расстояние между ядрами равно 2b, и при этом b равно a/30.5, расстояние между ядрами составляет (0.504 • 2/30,5) = 0.582 Å.
Расстояние между ядрами и электронами определяется теоремой Пифагора и составляет (0.5042 + 0.2912)0.5 = 0.582Å.
Масштабно увеличенные значения расстояний a, b, и c позволяют нам представить фактический размер молекулы водорода, изображенной на рис. 3.4.
Эти значения дают нам возможность определить энергию молекулы водорода, не обращаясь к расчету посредством теоремы вириала.
Потенциальная энергия молекулы водорода рассчитывается с помощью сравнения ее с атомом водорода, потенциальная энергия которого равна 2 634 кДж/моль. Атомы водорода (электроны и протоны которого заряжены с одинаковыми абсолютными величинами и имеют противоположные значения) притягиваются друг к другу и находятся на расстоянии 0.529Å. Потенциальная энергия вычисляется по формуле: E = q1q2 / R, где q1 и q2 есть заряды в частицах, а R — расстояние между ними.
В атомах и молекулах положительные и отрицательные заряды равны по значению, как и в атоме водорода. Именно поэтому энергия их кулоновского взаимодействия является обратно пропорциональной только по отношению к расстоянию между зарядами в молекулах и атомах водорода.
Суммарная потенциальная энергия молекулы водорода равна разнице между энергией притяжения электронов к ядрам и межэлектронной, межъядерной энергией отталкивания. Энергия притяжения составляет:
Eприт = 2 634 • 0.529 • 4 / 0.582 = 9 577 кДж/моль.
Энергия отталкивания равна:
Eотт = 2 634.0.529 / 0.582 +2 634 0.529 / 1.008 = 3 776 кДж/моль.
Разница между энергией притяжения (которая определяет стабильность молекулы) и энергией отталкивания равняется 9 577 — 3 776 = 5801 кДж/моль. Энергия притяжения электронов к ядрам для двух атомов водорода составляет 2 634 х2 = 5 268 кДж/моль. То есть, увеличение энергии притяжения (например, потенциальной энергии) при образовании молекулы составляет 5 801 — 5 268 = 533 кДж/моль. Значит, ядра в молекуле связаны с электронами прочнее, и для того, чтобы расщепить молекулу на атомы, требуется больше энергии.
Это было доказано экспериментально. Чтобы расщепить молекулу водорода на атомы, необходимо нагреть ее до температуры свыше 3000 С°.
Суммарная энергия молекулы водорода равна разнице между кинетической и потенциальной энергиями электронов. Согласно теореме вириала, кинетическая энергия равна половине потенциальной энергии системы, в которой действуют только кулоновские силы. Соответственно, суммарная энергия равна половине потенциальной энергии.
Таким образом, суммарная энергия молекулы водорода составляет 5 801/2 = 2900 кДж/моль. Суммарная энергия двух атомов водорода, как указано выше, равна 2 634 кДж/моль. Значит, энергия, выделяющаяся при формировании молекулы водорода из атомов водорода, составляет 2 900 — 2 634 = 266 кДж/моль.
В ходе наших расчетов, основывающихся на уравновешивающих силах, мы пришли к выводу, что энергия молекулы водорода составляет 2 898 кДж/моль и что потенциальная энергия равняется 5 800 кДж/моль. В соответствии с теоремой вириала, суммарная энергия молекулы водорода составляет 5,800/2 = 2,900 кДж/моль. Значения суммарной энергии, рассчитанные с использованием обоих методов, совпадают, тем самым доказывая, что в молекуле имеют место только обыкновенные кулоновские взаимодействия.
Таким образом, электроны двигаются в молекулах с большей скоростью, чем в атомах, хотя в первом случае они активней притягиваются к ядрам. Выделение энергии, которое происходит за счет большего притяжения электронов к ядрам, в два раза больше, чем потеря энергии, вызванная увеличением кинетической энергии электронов. Образование молекул сопровождается выделением энергии, что и объясняет их устойчивость при комнатной температуре (≈ 20°C).
Поскольку процесс образования молекулы протекает с выделением энергии, для того, чтобы расщепить молекулу на атомы, т. е. осуществить обратный процесс, необходимо, чтобы молекулы получили некоторое количество энергии, которое можно рассчитать согласно схеме в разделе.
Строение молекулы.Химическая связь >>
Ковалентная связь >>
Модель молекулы водорода >>
Энергия молекулы водорода
Энергия иона водорода Н2+ >>
Другой способ определения энергии молекулы водорода >>
Выводы >>
Найти энергию связи атома водорода.
Энергию Ео можно найти в простой модели Бора , с массой электрона $m_e$ и зарядом электрона e
$E_0=-frac{m_ee^4}{8h^2varepsilon_0^2}$ (в системе СИ),
где h — постоянная Планка, $m_e$— масса электрона, e — заряд электрона,
$varepsilon_0$ — электрическая постоянная.
После подстановки значений в формулу (1) получаем, величина E0 (энергия связи атома водорода в основном состоянии) равна 13,62323824 эВ = 2,182700518·10−18 Дж.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,985 -
разное
16,906
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Пример. Энергия и длина связи в молекуле водорода, определенные экспериментально и рассчитанные с учетом различных факторов:
|
Энергия связи, |
Длина связи, Ǻ |
|
|
Эксперимент………………………………… |
4,747 |
0,741 |
|
Функции |
0,25 |
0,9 |
|
Функции |
3,14 |
0,869 |
|
С |
3,76 |
0,743 |
|
С |
4,02 |
0,749 |
|
С |
4,10 |
0,740 |
|
13 |
4,72 |
0,740 |
|
50 |
4,7467 |
0,74127 |
На основе
представлений, выработанных при расчете
молекулы водорода, сформулированы
основные
принципы (постулаты)
метода
валентных связей,
позволяющие описывать образование
ковалентной химической связи в более
сложных молекулах:
-
Единичная
химическая связь образуется общей
парой электронов с противоположными
(антипараллельными) спинами. -
Общая электронная
пара локализована (сосредоточена) между
атомами в направлении максимального
перекрывания атомных орбиталей. -
Энергия
связи определяется только силами
электростатического взаимодействия
электронов и ядер и зависит от величины
перекрывания орбиталей.
Таким
образом, число связей (валентность),
которые может образовывать атом,
определяется числом неспаренных
электронов на внешнем энергетическом
уровне атома в основном или возбужденном
состоянии. Ковалентная связь обладает
свойством насыщенности
(атом
может образовывать ограниченное число
единичных ковалентных связей). Ковалентная
химическая связь обладает свойством
направленности
(расположение в пространстве общей
электронной пары определяется
пространственной ориентацией атомных
валентных орбиталей). Атомы взаимно
располагаются таким образом, чтобы
перекрывание валентных орбиталей было
максимальным. Из двух связей та прочнее,
где перекрывание валентных орбиталей
больше.
2.2.2.Кратные связи.- и-связи
Единичная
химическая связь представляет собой
общую электронную пару, локализованную
в области перекрывания валентных атомных
орбиталей, что приводит к образованию
области повышенной электронной плотности,
расположенной между ядрами атомов.
Если
область повышенной электронной плотности
располагается симметрично линии,
проходящей через ядра взаимодействующих
атомов (линии связи), то такой тип связи
называется -связью.
Она принципиально может образовываться
в результате перекрывания любого типа
атомных орбиталей (рис. 2.5).
H2
(H 1s1)
Cl2
(Cl 3s23p5)
HF (H1s1;
F 2s22p5)
Рис. 2.14.
Схема образования-связи
Примечание.
Волновые
функции, описывающие атомные орбитали,
могут иметь области положительных и
отрицательных значений – знак функции.
Функция, описывающая s-орбиталь,
во всей области пространства положительна
(рис. 2.6, а).
Функции, описывающие p—
и d—
орбитали, имеют узловые точки (точки в
которых функция обращается в ноль). При
переходе через узловую точку волновая
функция меняет свой знак на противоположный,
то есть имеются области орбиталей с
отрицательным и положительным знаком
волновых функций (рис. 2.6, б,
в).
Область
повышенной электронной плотности
(образование связи) возникает в том
случае, если перекрываются электронные
орбитали, функции которых имеют одинаковый
знак. Поэтому, например, перекрывание
s
и py
или
pz
(направление
оси x
совпадает с линией связи) не приводит
к образованию химической связи (рис.
2.6, г).
Связь образуется при перекрывании s-
и положительной части px-орбиталей
(рис. 2.6, д).
г)+ py
s
+x
Рис.
2.15.
Области орбиталей с отрицательным и
положительным знаком
волновых функций
Поскольку
-связь
обладает цилиндрической симметрией,
то поворот атомов относительно друг
друга вокруг линии связи не приводит к
изменению распределения электронной
плотности. Поэтому оба атома могут
свободно вращаться вокруг оси, совпадающей
с линией связи, не разрывая и не деформируя
-связь.
Электроны,
имеющие сложную симметрию орбиталей
(p—
и d-орбитали),
могут образовывать связь в результате
перекрывания орбиталей в двух областях
над и под линией связи. Такой тип связи
называется -связью
(рис. 2.7).
Энергия
-связи
меньше, чем энергия -связи,
так как перекрывание орбиталей по -типу
меньше, чем по -типу.
-связь
не обладает цилиндрической симметрией
относительно линии связи, поэтому
вращение атомов вокруг линии связи
исключено, что объясняет существование
цис- и транс-изомеров.
Рис.
2.16.
Схема образования -связи
При
образовании химической связи между
двумя атомами в первую очередь образуется
-связь.
Во многих случаях она будет единственной,
но если атомы имеют дополнительно
неспаренные р-электроны,
то кроме -связи
может образоваться одна или две -связи,
которые будут располагаться во взаимно
перпендикулярных плоскостях. В этом
случае говорят о кратности
связи
– двойная связь (-
и одна -связь)
или тройная связь (-
и две -связи),
которые образованны соответственно
двумя или тремя электронными парами
(рис. 2.8).
Рис. 2.17.
Схема образования кратных связей:py-py– одна-связь,px-px,pz-pz– две-связи
С
увеличением кратности связи увеличивается
энергия связи и уменьшается ее длина.
Соседние файлы в папке ОСН.ОБЩ.ХИМ
- #
- #
- #
Решая совместно уравнения
(2),
(5), (9), получим выражение для полной
энергии электрона в атоме водорода:
| (10) |
Уравнение (10) определяет разрешенные
значения энергии электрона в атоме
водорода. Число n
принимает целые значения n =
1,2,3, …¥ .
Таким образом, энергия электрона в атоме
водорода может иметь не любые значения,
а только дискретный набор значений,
определяемых числом n,
или, как говорят, энергия электрона квантуется.
Подставляя значения
массы и
заряда электрона, постоянных 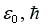
уравнение (10) и выражая энергию в электронвольтах
(эВ) (1эВ = 1,6.10-19
Дж), получим
формулу
| (11) |
Энергия основного состояния
(при n
= 1), равна E1=
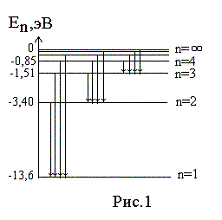
— 13,6 эВ. На рис. 1
приведена диаграмма энергетических
уровней электрона в атоме водорода, на
которой горизонтальными прямыми
отмечены разрешенные значения энергии.
Все состояния с величиной n= 1 … ¥ являются
связанными. При увеличении числа n
энергетические уровни сближаются все
больше и больше. При n ® ¥ E ®
0.
Энергетические состояния с энергией E ³
0
соответствуют тому, что электрон
становится свободным (не связанным с
ядром).
энергетических уровней (рис.1) позволяет
дать несколько важных определений.
Энергия возбуждения Евоз
– это энергия, которую необходимо
сообщить электрону, чтобы он из
основного состояния (n = 1)
перешел в возбужденное. Например, Евоз
= 10,2 эВ – энергия, необходимая для
перехода электрона в состояние,
соответствующее n =
2 (первое возбужденное состояние).
Энергия ионизации Еион
– энергия, необходимая для отрыва
электрона, находящегося в основном
состоянии (n
= 1), от ядра, т.е. для перевода электрона
на уровень с n = ¥ .
Для атома водорода энергия ионизации
равна 13,6 эВ.
Согласно постулату Бора, при
переходе электрона из одного состояния (с
большей энергией) в другое (с меньшей
энергией) испускается фотон, частота
которого определяется формулой (8).
Учитывая выражение (10) для энергии
электрона в атоме, получим выражение для
частот испускаемых фотонов:
| (12) |
или, соответственно, для длин
волн испускаемых фотонов:
| (13) |
где Ry =
1,0974.107
м–1
– так называемая постоянная Ридберга.
Таким образом, модель атома Н.Бора
объясняет дискретный (линейчатый)
характер спектра испускания атома
водорода.
Спектральные
серии атома водорода
На диаграмме энергетических уровней (рис.1)
показаны возможные переходы электрона с
верхних уровней на нижние. При каждом
таком переходе излучается фотон с
частотой, определяемой формулой (12), или
длиной волны, определяемой формулой (13).
Переходы электрона с различных верхних
уровней на определенный нижний образуют
так называемые спектральные серии
атома водорода. Так, все переходы из
состояний с n
= 2, 3, 4, … в
состояние с n
= 1 образуют так называемую серию
Лаймана (ультрафиолетовое излучение).
Все длины волн этой серии лежат в
ультрафиолетовой области шкалы
электромагнитных волн. Переходы из
состояний с n
= 3, 4, 5, … в состояние с n
= 2 образуют серию Бальмера (видимый
свет). Переходы из состояний с n
= 4, 5, 6, … в состояние с n
= 3 образуют серию Пашена (инфракрасное
излучение). Длины волн всех остальных
серий (переходы на уровни с n
= 4, 5, и т.д.) лежат в инфракрасной области
спектра электромагнитного излучения.









