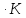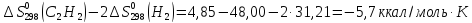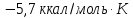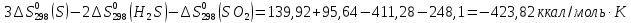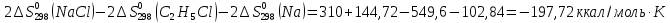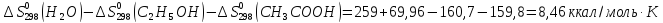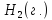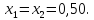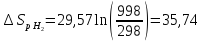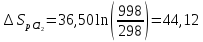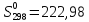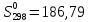Решение
Энтропия системы является функцией ее состояния, определенная с точностью до произвольной постоянной.
Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии
[ Delta {{S}_{1to 2}}={{S}_{2}}-{{S}_{1}}=intlimits_{1}^{2}{frac{delta Q}{T}}=intlimits_{1}^{2}{frac{dU+delta A}{T}},(1) ]
Таким образом, по формуле (1) можно определить энтропию лишь с точностью до аддитивной постоянной, т.е. начало энтропии произвольно. Физический смысл имеет лишь разность энтропий.
Найдем изменения энтропии
[ begin{align}
& dU=frac{m}{M}{{C}_{V}}dT, \
& p=frac{m}{M}Rfrac{T}{V},(Уравнение.Менделеева-Клапейрона) \
& delta A=pcdot dV=frac{m}{M}frac{RT}{V}dV, \
end{align} ]
Подставляем в (1)
[ begin{align}
& Delta S=frac{m}{M}{{C}_{V}}intlimits_{{{T}_{1}}}^{{{T}_{2}}}{frac{dT}{T}}+frac{m}{M}Rintlimits_{{{V}_{1}}}^{{{V}_{2}}}{frac{dV}{V}}=frac{m}{M}{{C}_{V}}ln frac{{{T}_{2}}}{{{T}_{1}}}+frac{m}{M}Rln frac{{{V}_{2}}}{{{V}_{1}}}, \
& {{C}_{V}}=frac{i}{2}R(i=5), \
& Delta S=frac{8cdot {{10}^{-3}}}{32cdot {{10}^{-3}}}frac{5}{2}8,31cdot ln frac{573}{357}+frac{8cdot {{10}^{-3}}}{32cdot {{10}^{-3}}}8,31cdot ln frac{40cdot {{10}^{-3}}}{10cdot {{10}^{-3}}}=frac{8cdot {{10}^{-3}}}{32cdot {{10}^{-3}}}8,31(frac{5}{2}ln frac{573}{357}+ln frac{40}{10})= \
& =2,0775(2,5ln1.60542+ln4)=5,338approx 5,4 frac{Дж}{К}. \
end{align} ]
Ответ: 5,4 Дж/К.
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УЧРЕЖДЕНИЕ
ОБРАЗОВАНИЯ
«МОГИЛЕВСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
им. А.А. КУЛЕШОВА»
А.В. Клебанов
М.А. Бандюк
РЕШЕБНИК ПО
ФИЗИЧЕСКОЙ ХИМИИ.
ВТОРОЙ ЗАКОН
ТЕРМОДИНАМИКИ
Методическая
разработка
МОГИЛЕВ
2012
СОДЕРЖАНИЕ
-
ВТОРОЙ
ЗАКОН ТЕРМОДИНАМИКИ..ИЗМЕНЕНИЕ
ЭНТРОПИИ………………………………………………..3 -
ХАРАКТЕРИСТИЧЕСКИЕ
ФУНКЦИИ……………………………………………….105
ИЗМЕНЕНИЕ
ЭНТРОПИИ
1. Энтальпия
плавления льда при 00С
равна 6012 Дж/моль. Чему равна энтропия
плавления льда? Найти энтропию льда при
00С,
если энтропия воды при этой температуре
равна 63,34 Дж/моль∙К.
Решение.
ΔSпл.=
=22,01
ΔSльда=ΔSводы-ΔSпл.=63,34-22,01=41,33
Дж/моль∙К
Ответ:
41,33 Дж/моль∙К
2. Энторопия
жидкого ацетона при температуре кипения
56,20С
равна 213,31 Дж/моль∙К. Энтальпия испарения
ацетона 29090 Дж/моль. Найти энтропию
парообразного ацетона при температуре
56,20С
и давлении 1 атм.
Решение.
ΔSисп.=
Ответ:
3.
Диоксид углерода CO2
сублимирует при температуре -78,50С
и давлении 1 атм. Энтальпия сублимации
25230 Дж/моль. Чему равна энтропия сублимации?
Решение.
ΔSсубл.=
Ответ:
4.
Серое олово при
температуре 130С
обратимо превращается в белое олова.
Энтальпия превращения 20,92 Дж/моль. Чему
равна энтропия превращения?
Решение.
ΔSпревр.=
Ответ:
5.
При температуре
95,50С
и давлении 1 атм. Ромбическая сера
обратимо превращается в моноклинную.
Энтальпия превращения 450 Дж/моль. Чему
равна энтропия моноклинной серы, если
энтропия ромбической серы при этой
температуре 36,73 Дж/моль∙К
Решение.
ΔSпревр.=
=1,22 Дж/моль∙К
Ответ:
1,22 Дж/моль∙К
6.
Молярная энтропия водорода при 250С
и 1 атм. Равна 130,62 Дж/моль∙К. Чему равна
энтропия водорода при 1000С
и 1 атм. , если теплоёмкость Ср(г)=28,85
Дж/моль∙К?
Решение.
ΔS=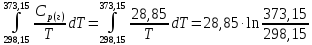
6,47 Дж/моль∙К
ΔS1000C=
ΔS250C+
ΔS=130,52+6,47=136,99
Дж/моль∙К
Ответ:
136,99 Дж/моль∙К
7.
Энтропия CO
при 25
и 1атм. равна 197,55 Дж/моль∙К. Чему равна
энтропия CO
при 200
и 50 атм., предполагая, что CO
является идеальным газом?
Решение.
ΔS=Cvln
Дж/моль∙К
ΔS200=
ΔS+
ΔS25=9,59+197,55=207,1
Дж/моль∙К
Ответ:
207,1 Дж/моль∙К
8.
Один моля кислорода расширяется до
десятикратного увеличения объёма и
одновременно охлаждается от 127 до 27
Чему равно изменение энтропии, если
теплоёмкость Ср(г)=29,2
Дж/моль∙К
Решение:
ΔS=Cрln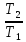
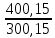
Дж/моль∙К
Ответ:
8,39 Дж/моль∙К
9.
Энтропия NH3
при 25
и 1 атм. равна 192,66 Дж/моль∙К. Зависимость
теплоёмкости Ср
от температуры выражается уравнением:
Ср(г)=
29,80+25,48∙10-3T-1,67∙105T-2
Дж/моль∙К.
Чему равна энтропия аммиака при 500
и 10 атм.?
Решение.
ΔS=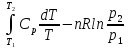
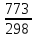
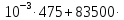

ΔS=39,699-8,314∙ln
ΔS500=
ΔS+
ΔS25=20,55+192,66=213,21
Ответ:
213,21 Дж/моль∙К
10.
Найти изменение энтропии при переходе
двух молей кислорода от объёма 30 л под
давлением 3 атм. к объёму 15 л под давлением2
атм. Считать кислород идеальным газом.
Решение.
ΔS=n
( Cp
ln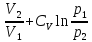

Ответ:
-23,49 Дж/моль∙К
11.
Один моль идеального газа, занимающий
объём 26 л, подвергается изотермическому
расширению. Изменение энтропии 40
Дж/моль∙К. Каков конечный объём газа?
Решение:
ΔS=R
ln
40=8,314ln
ln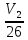
V2=3191
л
Ответ:
3191 л
12.
11,2 л азота нагревают от 0 до 100
и одновременно уменьшают давление от
1 до 0,01 атм. Найти изменение энтропии,
считая азот идеальным газом.
Решение.
ΔS=n
( Cp
ln
n(N2)=
моль
ΔS=0,5
Ответ:
Дж/моль∙К
13.
Один моль двухатомного идеального газа
находится при 200
и 5 атм. В результате нагревания и сжатия
газа температура стала 500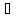
давление равно 10 атм. Найти изменение
энтропии газа.
Решение.
ΔS=nCp
ln
ΔS=3,5∙8,314ln
Ответ:
Дж/моль∙К
14.
Вычислить изменение энтропии при
нагревании одного моля CdS
от -120
до 0°С, если
зависимость мольной теплоемкости от
температуры выражается уравнением
Ср=54,0+3,8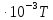
Решение.
Изменение энтропии
рассчитывается по формуле
Ответ:
15. При
охлаждении 12 л кислорода от 200 до -40 °С
давление повышается от
до 6,0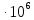

Рассчитать изменение энтропии, если
= 29,2
Дж/моль
(считать кислород идеальным газом).
Решение.
Находим число молей
кислорода из уравнения состояния
идеального газа:
n=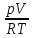
Поскольку в процессе
меняется и давление и температура,
Дж/моль∙К
Ответ:
Дж/моль∙К
16. Определить
изменение энтропии при
превращении
2 г воды в пар при изменении температуры
от 0 до 150°С и давлении I
ат, если скрытая удельная теплота
парообразования воды 2,255 кДж/г, мольная
теплоемкость пара при постоянном
давлении
Ср=30,13+11,3
103Т,
Дж/моль
жидкой воды
75,30 Дж/моль
Решение.
Общее изменение
энтропии складывается из трех составляющих:
1) нагревание
жидкой воды от 0 до 100°С;
2) переход
жидкой воды в пар при 100°С;
3) нагревание
водяного пара от 100 до 150°С.
Для первой стадии
изменение энтропии рассчитывается по
формуле
где n
— количество молей воды. Учитывая, что
Ср
является постоянной
Изменение энтропии
на второй стадии определяется но формуле
Изменение энтропии
на третьей стадии рассчитывается
по формуле
Общее изменение
энтропии равно:
Ответ:
17.
Найти изменение энтропии при нагревании
1 моля кадмия от 25 до 7270С,
если температура плавления 3210С
и энтальпия плавления 6109 Дж/моль.
Теплоёмкость кристаллического и жидкого
кадмия Ср(кр)=22,22+0,0123T
Дж/моль∙К, Ср(ж)=29,83
Дж/моль∙К
Решение.
25
727

S1
S3

Cd(ж.)
321
S2
321
ΔS1=22,22
ΔS2=
ΔS3=29,83
ΔS= ΔS1+
ΔS2+
ΔS3=18,96-10,28+15,53=44,78
Дж/моль∙К
Ответ:
44,78 Дж/моль∙К
18.
Энтропия кристаллического хлорида
натрия равна 72,13 Дж/моль∙К при Т=298,15 К
и Р=1 атм. Найти энтропию расплавленной
соли при температуре 850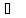
если температура плавления 800
энтальпия плавления 31,0 Дж/моль∙К.
Теплоёмкость NaCl
в твёрдом и жидком состоянии равна:
Ср(кр)=
49,94+16,32∙10-3T
Дж/моль∙К
Ср(ж)=66,53
Дж/моль∙К
Решение.
298,150K
8500С

(кр) NaCl(расп.)

NaCl(пл.)
8000С
8000С
ΔS1=49,94
Дж/моль ∙К
ΔS2=
Дж/моль ∙К
ΔS3=66,53
Дж/моль∙К
ΔS850=ΔSNaCl+
ΔS1+
ΔS2+
ΔS3=72,13+71,49+28,89+3,03=175,53
Дж/моль∙К
Ответ:
175,53 Дж/моль∙К
19.
Вычислите изменение энтропии при
нагревании 1 моля твёрдого брома от
температуры плавления -7,32 до 100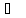
если энтальпия плавления 10544 Дж/моль,
энтальпия испарения 30710 Дж/моль,
температура кипения 59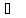
Теплоёмкость брома в жидком и парообразном
состоянии равна:
Ср(ж)=
75,71 Дж/моль∙К
Ср(г)=
37,20+0,71∙10-3T-1,19∙105T-2Дж/моль∙К
Решение.
265,60K
2730K
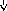
Br(тв.)

Br(тв.)
3320K
3320K
ΔSпл.=
Дж/моль∙К
ΔS1=75,71
ΔS2=
Дж/моль∙К
ΔS3=37,20
ΔS=16,91+92,46+4,135=113,51
Дж/моль∙К
Ответ:
113,51 Дж/моль∙К
20.
Энтропия жидкого бензола при 25
и 1 атм. равна 173,26 Дж/моль∙К. Найти
энтропию газообразного бензола при
500
и 1 атм. , если энтальпия испарения бензола
при температуре кипения 80,1
равна 30752 Дж/моль. Теплоёмкость жидкого
и газообразного бензола выражается
уравнениями:
Ср(ж)=
59,50+255,0 ∙10-3T
Дж/моль∙К
Ср(г)=
-21,09+400,1∙10-3T-169,9∙10-6T-2
Дж/моль∙К
Решение.
ΔSисп.(500)=
ΔS(ж)=59,50∙
ln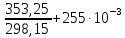
ΔS(г)=
-21б09∙ ln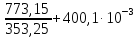
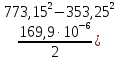
ΔS=173,26+87,05+24,16+111,282=395,752
Дж/моль∙ К
Ответ:
395,752 Дж/моль∙ К
21.
Вычислить
изменение энтропии системы и окружающей
среды при изотермическом затвердевании
1 моля меди, переохлаждённой ниже
температуры плавления на 180 градусов.
Температура плавления меди 1356 К, энтальпия
плавления Δпл.H1356
K=12970
Дж/моль. Теплоёмкость твердой и жидкой
меди: Ср=22.64+6,28∙
Дж/моль∙ К
Ср=
31,38 Дж/моль∙ К
Решение.
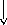
K
Cu(ж) Cu(кр)
1356
Cu(ж) Cu(кр)
T=1082,85-180=902,85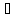
K
ΔS1=31,38
ln
Дж/моль∙ К
ΔS2=-
Дж/моль∙ К
ΔS3=22,64
ln
Дж/моль∙ К
ΔSобщ=
ΔS1+
ΔS2+
ΔS3=4,469+(-9,565)+(-4,355)=-9,45
Дж/моль∙ К
ΔSсреда=
Q=-12970+((22,64∙(-180)+3,14∙
ΔSсреда=
ΔSобщ=10,91-9,45=1,46
Дж/моль∙ К
Ответ:
1,46 Дж/моль∙ К
22.
Рассчитать разность между мольными
энтропиями твёрдой и жидкой ртути при
температуре -50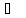
Температура плавления ртути -39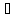
энтальпия плавления при этой температуре
2340 Дж/моль. Теплоёмкость жидкой и твёрдой
ртути равна: Ср(кр)=29,71+6,69∙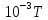
Дж/моль∙ К
Ср(ж)=
26,9 Дж/моль∙ К
Решение.
ΔS1=26,9
ln
Дж/моль∙ К
ΔS2=-
Дж/моль∙ К
ΔS3=29,71
ln
Дж/моль∙ К
ΔS=-1,5-9,99+1,29=-10,20
Дж/моль∙ К
Ответ:
-10,20 Дж/моль∙ К
23.
Два сосуда объёмом 1 л каждый соединены
трубкой с краном. В одном находится
водород при 1 атм. и 20
в другом – гелий при 3 атм. и 100
. Найти изменение энтропии системы
после открытия крана и достижения
равновесной температуры, если стенки
сосудов и трубки теплоизолированные
от окружающей среды, Газы считать
идеальными.
Решение.
ΔS=nRln
Ответ:
24. Вычислите
изменение энтропии при плавлении 5 молей
бензола, если
температура плавления бензола равна
278.68 К, а теплота плавления 2,351 ккал/моль.
Решение.
Плавление бензола
— фазовый переход, протекающий при
постоянной температуре. Изменение
энтропии при переходе 5 молей
вещества из
твердого в жидкое состояние определим,
используя формулу
Ответ:
25.
Определите изменение энтропии при
превращении 2 г
воды в пар при
изменении температуры от 0 до 100
и давлении 1 атм.,
если скрытая
удельная теплота парообразования воды
равна 2,255 кДж/г.
Мольная
изобарическая
теплоемкость жидкой воды в рассматриваемом
температурном интервале постоянна и
равна 75,30Дж/(моль
К).
Решение.
Изменение энтропии
системы в рассматриваемом температурном
интервале происходит в результате
течения следующих процессов: а) нагревания
воды от 0

100
в изобарических
условиях; б) испарения воды при температуре
кипения в изотермических условиях.
Следовательно, суммарное изменение
энтропии AS
равно сумме
изменений энтропии в процессах а) и б):
А)
Б)
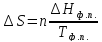
Ответ:
26.
Определите изменение энтропии при
нагреве I
моля Аl
от 25 до 600
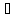
если для него
в этом интервале теплоёмкость зависит
от температуры следующим образом: Ср
= 20,945 + 0,010728Т.
(Дж/(моль К)).
Решение.
Для нагревания
вещества при постоянном давлении:
Ответ:
27. Определите
изменение энтропии при плавлении меди
массой 63,5 г, если теплота плавления меди
равна 12980 Дж/моль. а температура плавления
меди 1083 °С.
Решение.
n(Сu)=
ΔS=n
Ответ: 9,57
Дж
28.
Вычислите изменение энтропии при
плавлении свинца массой 100 г, если
температура плавления свинца 327,4 °С, а
теплота плавления 5485 Дж/моль.
Решение.
m(Pb)=100
г
Tпл=327,4
Qпл=5485
Дж/моль
n(Pb)=
Ответ:
29.
В двух сосудах одинаковой вместимости
находится: в первом — азот массой 2,8 г,
во втором аргон массой 4 г. Определите
изменение энтропии при диффузии,
возникающей в результате соединения
сосудов с газами. Температура и давление
постоянны.
Решение.
n(Ar)=
n(
ΔS=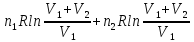
Ответ:
30.
Найдите изменение энтропии в процессе
обратимого изотермического сжатия 1
моля кислорода от 1,013

10,13
Решение.
ΔS=nRln
Ответ:
31.
Вода массой 100 г при 25 °С превращена в
пар с температурой 150 °С и давлением
1,013
Па. Вычислите изменение энтропии этого
перехода, если удельная теплота испарения
воды при 100
равна 2257 Дж/ г, удельная теплоемкость
воды — 4,187 Дж/(г
а удельная теплоемкость водяного пара
при давлении 1,013

Па равна 1,968 Дж/(г
Решение.
Δ
Ответ:
32.
Найдите изменение энтропии при переходе
3 молей кислорода от объема 0,0336 м3
под давлением 2,026
Па к объему 0,0672 м3
под давлением 1,013
105
Па. Молярная теплоемкость кислорода
Ср
равна 29,37 Дж/(моль
температура постоянна.
Решение.
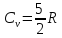
ΔS=n
Ответ:
33.
Определите разность энтропии 1г воды
при 0 и 100
(давление нормальное), считая теплоемкость
воды постоянной и равной 4,19 Дж/(г
Решение.
Ответ:
34.
Определите изменение энтропии при
охлаждении 5 молей алюминия от 0
до -100 °С. Средняя массовая
теплоемкость
алюминия в указанном интервале
температур 0,8129 Дж/(г
Решение.
Ответ:
35.
Чему равно изменение энтропии 1 моля
нафталина при нагревании от 0 до 80,4 °С
(температура плавления), если теплота
плавления 149,6 Дж/г, а средняя массовая
теплоемкость кристаллического нафталина
1,315 Дж/(г
Решение.
ΔS=
Ответ:
36.
Рассчитайте суммарное изменение энтропии
при нагревании 1 моля бензола от
температуры плавления (5,49 °С) до полного
испарения при температуре кипения (80,2
°С). Теплота плавления бензола 126,54 Дж/г,
теплота парообразования 396 Дж/г, массовая
теплоемкость бензола 1,94 Дж/(г
Решение.
ΔS=
ΔS=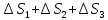
Дж/(моль
Ответ:
159,2 Дж/(моль
37.
В 0,30 кг жидкого
ацетона поместили серебряную ложку
массой 53 г. Определите энтропию системы
при 25
Решение.
Находим значения
стандартных энтропий: для жидкого
ацетона
Дж/моль ∙К и для
серебра
Дж/моль ∙К. Молярные массы равны:
ацетона-0,058 и серебра-0,108 кг/моль.
По полученным данным:
Энтропия 0,30 кг
ацетона-
Дж/К
Энтропия серебряной
ложки-
Дж/К
Отсюда энтропия
всей системы:
Дж/К
Ответ:
Дж/К
38.
Вычислите
изменение энтропии в процессе затвердения
1 моль переохлажденного бензола при 268
К, если при 278 К
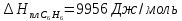
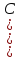
,

P=const=1,01∙
Па
Решение.
Этот процесс
необратим, поэтому мысленно проводим
его обратимо в три стадии
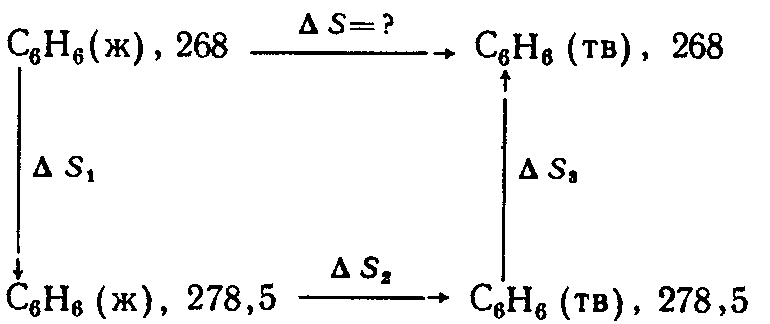
Тогда
Вычисляем
и
по уравнению (VII,5),
а
-по уравнению (VII.14).
Тогда
Ответ:
39.
Вычислить
энтропию хлорид серебра при 870 К.
Решение.
Согласно уравнению
(VII.
15)
Выписываем из
справочника необходимые данные
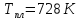
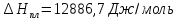
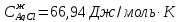
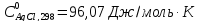

Подставляем
числа в уравнение
После интегрирования
получаем
Приращение энтропии
AgCl
за счёт нагревания составит
(
и
Ответ:
40.
В одном из
сосудов одинаковой вместимости 3 м3
находится 28 кг азота, а в другом 32 кг
кислорода при одной и той же температуре.
Вычислите изменение энтропии при
диффузии в результате соприкосновения
содержимого этих сосудов. Принять
кислород и азот идеальными газами.
Решение.
моль
моль
Дж/моль
Ответ:
Дж/моль
41.
Определите ΔS
для изобарического нагревания 1 моля
азота от 300 до 10000
К. Ср
= 6,4492 + 1,4125 · 10-3
Т – 0,807 · 10-7
Т2.
Решение.
ΔS=
кал·0К-1·моль-1.
Ответ:
кал·0К-1·моль-1.
42.
Нормальная температура кипения бензола
равно
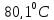
Оцените мольную теплоту испарения
бензола при этой температуре.
Решение.
Используя правило
Трутона ΔН пар
/Ткип≈21
получим
ΔНпар≈Ткип·21=353·21=7400
Экспериментально
значение равно 7220 кал.
Ответ:
7400
43. Найти
изменение энтропии при превращении
двух молей льда, взятых при О°С р
= 1 атм, в пар при
200 °С и 3 атм. Теплота плавления льда
равна 332,2 Дж∙г-1,
теплота парообразования при 100 °С равна
2259 Дж∙г-1.
Удельная теплоемкость пара равна 1,87
Дж∙г-1
∙К-1,
воды — 4,184 Дж∙г-1
∙К-1
.
Решение.
Дж∙К-1
Дж∙К-1
Дж∙К-1
Дж∙К-1

Ответ:

306,32 Дж∙К-1.
44.
В одном из сосудов емкостью 0,1м3
находится кислород, в другом емкостью
0.4 м3
.В обоих сосудах температура 17е
С и давление 1,013∙105
н/м2.
Найти изменение
энтропии при взаимной диффузии газов
из одного сосуда в другой при Р
и Т=const.
Считать оба газа идеальными.
Решение.
Изменение энтропии
определяем по формуле. Число молей
каждого газа находим из уравнения
Менделеева — Клапейрона
ΔS=2,3∙8,314
Ответ:
45.
Вычислить изменение энтропии в
процессе
изотермного расширения 2 моль
метана от
=101,3∙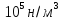
=1,013∙
Газ
считать идеальным.
Решение.
По формуле (111,6) при
Т=const
находим
ΔS=-2∙8,314∙2,3lg
Ответ:
46. Рассчитать
мольную энтропию окиси углерода при
200° С и 50,67∙105
н/м2,
если энтропия
при 25° С и
1,013∙105
н/м2
равна 197,9
дж/град∙моль,
а зависимость
мольной теплоемкости от температуры
выражается уравнением
СР
= 28,41+4,10∙10-3T
— 0,46∙105T2
дж/моль∙
град.
Решение.
Дж/моль∙К
Ответ:
Дж/моль∙К
47. Найти
изменение энтропии при нагревании I
г∙атом
кадмия от 25
до 727°С, если температура плавления
321°С и теплота плавления равна 6109
дж/г∙атом
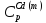
22,22+ 12,30∙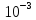
дж/моль∙град;

= 29,83 дж/моль∙град.
Решение.
ΔS1=22,22
ΔS2=
ΔS3=29,83
ΔS= ΔS1+
ΔS2+
ΔS3=18,96-10,28+15,53=
44,78 Дж/моль∙К
Ответ:
44,78 Дж/моль∙К
48.
Какому конечному
объему отвечает изменение энтропии,
равное 38,28 дж/моль∙град,
если 1 моль
идеального
газа, занимающий в данных условиях 0,02
м3,
изотермически
расширяется.
Решение.
ΔS=nRln
38,28=1∙8,314ln
л
Ответ: 2
м3
49.Насколько
изменится энтропия в процессе
изотермического расширения
10 г
криптона от
объема 0,05 м3
и давления 1,013∙105
н/м2
до объема 0,2 м3
и давления 0,2133∙105
н/м2
?.
Решение.
n(Kr)=0,1193
моль
Ответ:
50. Найти
изменение энтропии при изотермическом
сжатии 1 моль
паров бензола
при 80°С от 0,4053∙105
до 1,013∙105
н/м2
с последующей
конденсацией в охлаждением жидкого
бензола до 60°С. Нормальная температура
кипения бензола 80°С; мольная теплота
испарения бензола 30,88 кдж/моль;
удельная
теплоемкость жидкого бензола 1,799
дж/г∙град.
Решение.
Дж/моль∙град
Дж/моль∙град
Дж/моль∙град
Дж/моль∙град
Ответ:
Дж/моль∙град
51. Определить
изменение энтропии в процессе сжижения
1 моль
метана, если
начальная температура равна 25°С, а
конечная 111,8° К. Мольная теплота испарения
метана при 111,8° К равна 8234,0 дж/моль
и мольная
теплоемкость

дж/моль∙град.
Вычислить
работу сжижения метана, приняв к. п.
д. равным 10%.
Решение.
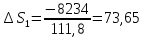
дж/моль∙град
дж/моль∙град
A=-143,11
Ответ:-108,75;
-143,11
52. Рассчитать-изменение
энтропии 1 моль
бензола при
переходе из жидкого состояния при 25°С
в пар при 100°С, если теплота испарения
бензола 393,3 дж/г
и температура кипения бензола 80,2°С,
мольная теплоемкость жидкого бензола
равна Ср
(ж) = 136,1 дж/моль∙град,
а мольная
теплоемкость паров бензола
Ср(г) = — 33,90 +
471,87∙
-298,34∙
+ 70,84∙
дж/моль∙град.
Решение.
Δ
Δ
ΔS= Δ
Ответ: 107
53. Вычислить
возрастание энтропии 1 моль
брома Вr2.
взятого при температуре плавления
—7,32°С, и переходе его из твердого
состояния в пар при температуре кипения
61,55°С; мольная теплоемкость жидкого
брома
Ср(ж) = 0,4477 дж/г∙град;
теплота
плавления 67,72 дж/г;
теплота
испарения 182,8 дж/г.
Решение.
Δ
Δ
Δ
ΔS= Δ
Ответ:
54.
Определить увеличение энтропии 1 моля
кристаллического магния при нагревании
от 300 до 800 К при постоянном давлении,
если теплоёмкость магния равна Ср(кр)=
22,3+10,64∙10-3T-0,42∙105T-2,
Дж/моль∙К
Решение.
ΔS=
(
Дж/моль∙К
Ответ:
Дж/моль∙К
55.
Определить увеличение энтропии 1 моля
азота при нагревании от 25 до 10000С:
а) при постоянном давлении; б) при
постоянном объёме. Зависимость
теплоёмкости от температуры выражается
уравнением Ср=27,88+4,27∙10-3T
Дж/моль∙К
Решение.
А)ΔS=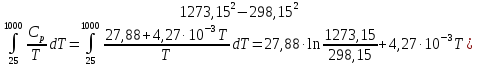
Дж/моль∙К
Б) Cp—Cv=R
Cv=
Cp-R=27,88+4,27∙10-3T-8,314=19,566+4,27∙10-3T
ΔS=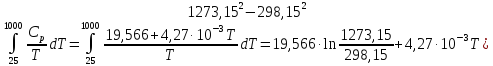
Дж/моль∙К
Ответ:
44,64 Дж/моль∙К; 32,56 Дж/моль∙К
56.
Как изменится энтропия 1 моля гелия при
нагревании его от 20 до 70 °С, если
объем газа при этом изменится от 24 до
28,1 л?
Решение.
ΔS=n
Ответ:
57.
Средняя массовая теплоемкость железа
в пределах температур 0 — 200 °С равна
0.486 Дж/(г
Определите изменение энтропии при
нагревании 1 кг железа oт
100 до 150 °С.
Решение.
Ответ:
58.
Вычислите изменение энтропии при
нагревании 1 кг свинца от температуры
его плавления (327,4 °С) до 800
Теплота
плавления свинца 24,8 кДж/кг, а теплоемкость
жидкого свинца в интервале температур
327 — 1000 °С равна
0,1415 кДж/(кг
Решение.
ΔS=
Ответ:
59.
Вычислите изменение энтропии при
нагревании 16кг О2
от 273 до 373К:
1) при постоянном
объёме;
2) при постоянном
давлении.
Считать кислород
идеальным газом
Решение.
1) при постоянном
объёме
n(О2)=16000/32=500
(моль)
ΔS=(5/2)∙n∙R∙
ln(T2/T1);
ΔS=5/2∙500∙8,314∙
ln(373/273)=3243,6
Дж/К.
-
при постоянном
давлении
ΔS=(5/2)∙n∙R∙
ln(T2/T1)+R;
ΔS=(5/2)∙500∙8,314∙ln(373/273)+8,314=4539,4
Дж/К.
Ответ:
3243,6; 4539,4 Дж/К.
60.
Рассчитайте изменение энтропии при
нагревании 58,82 кг В2О3
от 298 до 700К, теплоемкость В2О3
Ср0=36,5525+106,345*10-3Т
Дж/(моль*К).
Решение.
n(В2О3)=58820/70=840,3
(моль)
ST=∫T1T2(Ср(T)/T)dT=∫700298=(36,5525+106,345∙103/T/T)dT=840,3∙(36,5525ln(700/298)+106,345∙10-3∙840,3(700-298))=26230,2622+35923,40481=62153,7
Дж/К.
Ответ:
62153,7 Дж/К.
61.
Бромбензол кипит при 429,8К, его теплота
парообразования при этой температуре
241,9∙103
Дж/кг. Рассчитайте изменение энтропии
при испарении 10 кг бромбензола.
Решение.
n(C6H5Br)=10/157=0,0637
моль,
S=0,0637∙241,9∙103∙ln(429,8/273)=6993,4
(Дж/К)
Ответ:
6993,4 (Дж/К)
62.
Вычислите изменение энтропии при
охлаждении 12∙10-3
кг (12 г)
кислорода от 290 до 233К и одновременном
повышении давления от 1,01∙105
до 60,6∙105
Па, если Ср=32,9 Дж/(моль∙К).
Решение.
n(О2)=12/32=0,375
моль;
S1=0,375∙32,9∙ln(233/290)=-2,7
Дж/(моль∙К)
S2=0,375∙32,9∙ln(60,6∙105
/1,01 ∙105)=50,51
Дж/(моль∙К)
S=50,51-
2,7=47,81 Дж/(моль∙К)
Ответ:
47,81 Дж/(моль∙К).
63.
Рассчитать изменение энтропии в процессе
нагревания 1 моля ртути от -77°С до 25 °С.
Теплота плавления ртути при t
= -38,9 °С равна 11,58 Дж
удельная теплоемкость твердой ртути
Ст
= 0,138 Дж

жидкой ртути
Сж
= 0,140 — 2,86
-6Т
Дж

.Атомный вес ртути равен 200,6.
Решение.
Дж

Дж

Дж

Дж

Ответ:

= 21,56 Дж

64. Определить
изменение энтропии, если 0,0112 м3
азота нагреваются от 0 до 50°С.
Одновременно давление уменьшается от
1,013∙105
до 1,013∙103
н/м2.
Теплоемкость
равна 29,29 дж/моль∙град.
Решение.
n=p 1V
1/RT
1=0,499
моль
Ответ:
65. Как
изменится энтропия при нагревании 1
моль
хлорида натрия
от 25°С до 1073° К, если температура его
плавления 800°С, удельная теплота плавления
516,7 дж/г.
Мольная
теплоемкость
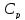
= 45,96+ 16,32∙
дж/моль∙град.
Решение.
Δ
Δ
Ответ:
66. Найти
изменение энтропии при нагревании 1
моль
ацетона от 25
до 100°С, если удельная теплоту испарения
ацетона равна 514,6 дж/г,
температура
кипения равна 56°С, мольные теплоемкости
жидкого ацетона
СР(ж)=
125 дж/моль∙град,
паров ацетона
Ср(г) = 22,47 + 201,8∙
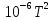
Решение.
Δ
ΔS= Δ
Ответ:
67. Рассчитать
изменение энтропии при нагревании 2
моль
метанола от
25 до 100°С, если удельная теплота испарения
СН3ОН
1100,4 дж/г,
температура
кипения 64,7°
С, мольные теплоемкости жидкого метанола
СР(ж)
= 81,56 дж/моль∙град
и паров метанола
СР(г)=
15,28+ 105,2∙10 -3T—31,04∙
дж/моль∙град.
Решение.
дж/моль∙град.
Ответ:
дж/моль∙град.
68. Определить
изменение энтропии при нагревании 1
моль
этанола от 25
до 100°С, если удельная теплота испарения
С2Н5ОН
863,6 дж/г,
температура
кипения 78,3°С, мольные теплоемкости
жидкого этанола
СР(ж)=
111,4 дж/моль∙град,
и паров этанола
Ср(г)= 19,07 +
212,7∙10-3T-108,6∙10-6
+ 21,9∙
дж/моль∙град.
Решение.
Δ
ΔS= Δ
Ответ:
69. Найти
изменение энтропии при нагревании 1
моль
толуола от 25
до 150°С, если удельная теплота испарения
толуола 347,3 дж/г,
температура
кипения 110,6°С, мольные теплоемкости
жидкого толуола СР(ж)
= 166 дж/моль∙град
и паров толуола
СР
(г) = — 33,88
+557,0∙10-3T-342,4∙10-6
дж/моль∙град.
Решение.
Ответ:
70. Как
изменится энтропия при нагревании I
моль
моноклинной
серы от 25 до 200°С, если удельная теплота
плавления моноклинной серы 45,19 дж/г,
температура
плавления 119,3°С, мольные теплоемкости
жидкой серы
СР
(ж) = 35,73 +1,17∙
— 3,305 • 105
дж/моль∙град
и твердой серы
СР(т)
= 23,64 дж/моль∙град.
Решение
Δ
Δ
Δ
Δ
Ответ:
71.
Определить
изменение энтропии 1 моль
хлорида натрия
при нагревании от 20 до 850° С, если известно,
что мольная теплоемкость твердого
хлорида натрия составляет
Ср(т) = 45,94+
16,32∙10-3T
дж/моль∙град
и
для жидкого
соединения СР(ж)
= 66,53 дж/моль∙град;
теплота плавления
31,0 кдж/моль;
температура
плавления 800° С.
Решение
Ответ:
72.
Рассчитать прирост энтропии при смешении
250 см3
азота с 500 см3
кислорода при 1067 гПа и 27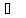
Чему равнялась бы работа при обратном
смешении газов?
Решение.
ΔSсмеси=-R
n(N2)=
n(O2)=
ϕ(N2)=
ϕ(O2)=
ΔSсмеси=-8,314∙(0,0107∙ln0,333+0,0214∙ln0,667)=0,17
Дж/моль
Ответ:
0,17 Дж/моль
73.
Вычислить изменение энтропии при
смешении 10 л водорода с 5 л метана, если
исходные газы и образующаяся смесь
газов находятся при 25
и 100 гПа.
Решение.
р =100 гПа=100
Па
25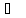
К
V(CH4)=5л=0,005
м3
V(H2)=10л=0,01
м3
n(H2)=
n(CH4)=
ϕ(H2)=
ϕ(CH4)=
ΔSсмеси=-R
ΔSсмеси=-8,314∙(0,04∙ln0,667+0,02∙ln0,333)=-8,314∙(-0,038)=0,32
Дж/моль
Ответ:
0,32 Дж/моль
74.
Вычислить изменение энтропии при
разделения 1 моль воздуха при 1 атм. на
чистые кислород и азот. Принять, что в
воздухе 21% об. Кислорода и 79% об. азота.
Решение.
ΔS=n1Rln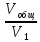
ΔS=0,21∙8,314ln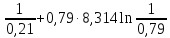
Дж/моль∙ К
Ответ:
-4,27 Дж/моль∙ К
75.
Рассчитайте
изменение энтропии при смешивании 1
моля водорода с 1 молем азота при н.у.
Решение.
V
при н.у.=11,2 дм3
ΔS=
Ответ:
76.
В двух сообщающихся сосудах, разделенных
перегородкой, находится 1 моль азота и
2 моль кислорода. Перегородку вынимают,
газы смешиваются. Рассчитайте изменение
энтропии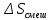
если исходные температуры и давления
одинаковы, а объёмы различны;
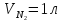
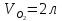
давление смеси равно исходному давлению
газа.
Решение.
Процесс смешения
газов необратим, и изменение энтропии
выражается неравенством

Но если необратимый и обратимый процессы
проводятся в одних и тех же граничных
условиях, то
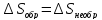
Всякий необратимый процесс можно
мысленно провести обратимо в несколько
стадий в тех же граничных условиях и
подсчитать энтропию для каждой обратимой
стадии. Тогда сумма изменений энтропии
этих стадий будет равна изменению
энтропии необратимого процесса. В данной
задаче общее изменение энтропии можно
заменить суммой изменения энтропий за
счёт расширения каждого из газов по
отдельности, т. е. принять, что
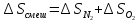
Согласно уравнению
(
Ответ:
77.
Смешали 1 моль
аргона, взятого при
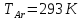
с 2 моль азота, взятого при
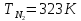
Исходные давления компонентов и конечное
давление смеси одинаковы. Вычислите
температурную составляющую энтропии
смешения. Теплоёмкость аргона

Дж/моль
и азота
Решение.
Процесс смешения
газов необратим, поэтому вычисляем
общее приращение энтропии системы как
сумму изменений энтропий компонентов
за счёт увеличения температуры и за
счёт уменьшения давления т.е.
Слагаемое
является температурной составляющей
общего приращения энтропии в результате
смешения. Согласно уравнению
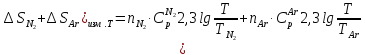
T-конечная
температура смеси, вычисляется по
уравнению теплового баланса
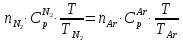
Где
и

молей аргона и азота. Подставляем числа
в уравнение:
29,4∙2(323-T)=20,8∙1(T-293)
После преобразования
уравнения и вычислений находим T=315
K.
Подставляем числа в уравнение
Ответ:
78.
Рассчитайте изменение энтропии в
процессе смешения 5 кг воды Т1=353К
с 10 кг воды при Т2=290К.
теплоемкость воды считать постоянной
и равной 4,2 Дж/(моль∙К).
Решение.
n(Н2О)=
5000/18=278 моль;
n(Н2О)=10000/18=556
моль;
278∙4,4∙(Т- Т1)=
556∙4,2∙( Т2-Т);
3502,8Т=1089370,8;
Т=311К
S=556∙4,2∙ln(311/290)
+ 278∙4,4∙ln(311/353)=163,3-148=
15,3 Дж/(моль∙К).
Ответ:
15,3 Дж/(моль∙К).
79.
Определите
изменение энтропии при смешении 1 моль
аргона, взятого при TAr
= 293 К и
= 1,0133 • 105
Па с 2 моль азота, находящегося при

1,0133
Па и
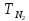
323 К. Давление смеси равно Рсм
= 1,0133∙105
Па. Принять аргон и азот идеальными
газами, а теплоемкость каждого газа
— величиной, постоянной в указанном
интервале температур и равной для азота
Сv
= 20,935 Дж/(моль∙К),
для аргона Сv=
12,561 Дж/(моль∙К).
Решение.
nRT=pV
1∙8,314∙293=1,0133∙105∙V1
V1=0,02
м3
2∙8,314∙323=1,0133∙105∙V2
V2=0,05
м3
Дж/моль
Ответ: 15,341
Дж/моль
80.
Определить
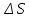
смешивания 1 моля азота с 3 молями
кислорода при
и общем конечном давлении 1 атм. Начальное
давление каждого газа 1 атм.
Решение.
Где Х1
– мольная доля азота, а Х2
– мольная доля кислорода.
Ответ:
81.при
давлении 2 атм занимают объем 30 л, до
давления 1 атм и объема 100 л. Изобарная
теплоемкость водорода Ср
при этих условиях равна 29,3 Дж∙моль1∙К-1.
Решение.
Ответ:
ΔS
= 41,74 Дж∙К-1
82.
2 моля N2
и 1 моль O2,
находящиеся при 27 °С и 1 атм, смешиваются.
После этого газовая смесь нагревается
до 827 °С и сжимается до 5 атм. Найти
изменение энтропии системы, если средние
мольные теплоемкости (Сp)
N2
и 02
равны, соответственно, 29,58 и 32,97
Дж∙моль-1∙К-1.
Решение.
Дж ∙К-1
Дж ∙К-1
Дж ∙К-1
Дж ∙К-1
Ответ:
ΔS
= 95,40 Дж ∙К-1
83. Вычислить
изменение энтропии при смешении 0,0001 м3
кислорода с
0,0004 м3
азота при
постоянной температуре 17° С и давлении
1,013∙105
н/м2.
Решение.
ΔS=
Ответ:
84. Смешаны
0,002 м3
гелия и 0,002 м3
аргона при 27°С и 1,013∙105
н/м2
каждый. После
изотермного смешения полученная
газовая смесь нагрета до 327°С при
постоянном объеме. Вычислить общее
возрастание энтропии, учитывая, что
мольная теплоемкость обоих газов
одинакова и равна
Cv(г)=
12,55 дж/моль∙град.
Решение.
ΔS1=
ΔS2=0,08
ΔS=2,3
Ответ: 2,3
85. Вычислить
изменение энтропии при разделении I
моль
воздуха при
1,013∙105
н/м2
на чистые
кислород и азот (принять состав воздуха
21 об. % кислорода и 79
об. % азота).
Решение.
V(воздуха)=1л
V(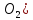
л
V(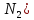
л
ΔS=
Ответ:
86. Рассчитать
энтропию реакции 2H2(г)+CO(г)→CH3OH(г)
при температурах 298,15 и 1000К, используя
абсолютные энтропии соединений при
Т=298,15 и р=1атм.:S0сн3OH=239,76
Дж/моль∙ К, S0H2=130,52
Дж/моль∙ К, S0СО=197,55
Дж/моль∙ К.
Зависимость
теплоёмкости от температуры выражается
уравнениями:
Ср(CH3OH)=
Ср(H2)=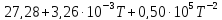
Ср(CO)=
Решение.
ΔS298,15=239,76-2∙130,52-197,55=-218,83
Дж/ К
ΔS1000=-218,83+
Ответ: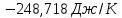
-218,83 Дж/ К
87. Рассчитайте
энтропию реакции CaCO3(кр)→CaO(кр)+CO2(г)
при температурах 298,15 и 1200 К, используя
абсолютные энтропии соединений при
Т=298,15 и р=1атм.:
S0CaO=38,07
Дж/моль∙К, S0CO2=213,66
Дж/моль∙К, S0CaCO3=91,71
Дж/моль∙К. Зависимость теплоёмкости
соединений от температуры следующая:
Ср(CaO)=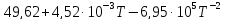
Ср(CO2)=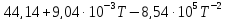
Ср(CaCO3)=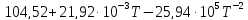
Решение.
ΔS298,15=213,66+38,07-91,71=160,02Дж/К
ΔS1200=ΔS298,15+
Ответ: 160,02Дж/К;
88.
Рассчитать энтропию реакции
2NaHCO3(кр)→Na2CO3(кр)+H2O(г)+CO2(г)
при температурах 298,15 и 500К на основании
абсолютных энтропий веществ при Т=298,15К
и р=1атм.:
S0Na2CO3=138,80
Дж/моль∙К, S0H2O=188,72
Дж/моль∙К, S0CO2=213,66
Дж/моль∙К, S0NaHCO3=102,10
Дж/моль∙К. Теплоёкость участников
реакции равна: Ср(Na2CO3)=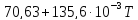
Ср(H2O)=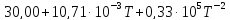
Ср(CO2)=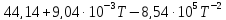
Ср(NaHCO3)=
Дж/моль
Решение.
ΔS298,15=213,66+188,72+138,8-2
ΔS500=336,98
Ответ: 336,98Дж/К;
89.
Энтальпия плавления льда при 0
равна -6013 Дж/моль. Теплоёмкость Ср
льда и воды соответственно равна 37,24 и
75,30 Дж/моль∙ К. Найти изменение энтальпии
и энтропии для процесса:

(ж; -10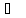
1 атм.) H2O
(кр; -10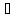
1 атм.)
Решение.

H2O(ж)
-10
H2O(ж)
ΔS1=Cp∙ln
Дж/моль∙ К
ΔS2=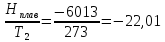
К
ΔS3=
Cp∙ln
Дж/моль∙ К
ΔSобщ=
ΔS1+
ΔS2+
ΔS3=-1,39-22,01+2,8=-20,59
Дж/моль∙ К
ΔH=Cp(T2-T1)=37,24(0-10)=-372,4
ΔH2=-6013
ΔH3=75,30∙10=753
ΔH=-372-6013+753=-5632
Ответ:
-20,59 Дж/моль∙ К; -5632
90. Вычислите
изменение энтропии для реакции С2Н2+
2Н2
= C2H6
в стандартных
условиях при температуре 298 К.
Решение.
Энтропия — функция
состояния системы, ее изменение
определяется разностью значений
абсолютных энтропии продуктов реакции
и исходных веществ (с учетом
стехиометрических
коэффициентов), и
справочнике
находим значения абсолютных энтропии
участников реакции при температуре
298 К:
|
С2H2 |
H2 |
C2H6 |
|
|
|
48,00 |
31,21 |
54,85 |

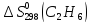
Ответ:
91.
Вычислите изменение энтропии

при стандартных условиях для реакций:
2H2S+S02=2H2O(ж)
+ 3S;
Zn + H2S04
= ZnS04
+ Н2;
СН4
+ 202
= СО2
+ 2Н20(пар)
Решение.
2H2S+S02=2H2O(ж)
+ 3S
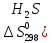
дж/моль∙град
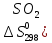
дж/моль∙град
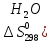
дж/моль∙град
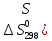
дж/моль∙град
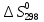
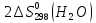
Zn
+ H2S04
= ZnS04
+ Н2
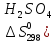
дж/моль∙град
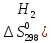
дж/моль∙град
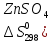
дж/моль∙град
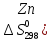
дж/моль∙град
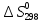

СН4
+ 202
= СО2
+ 2Н20(пар)
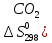
дж/моль∙град

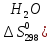
дж/моль∙град
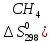
дж/моль∙град
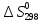

Ответ: (-423,82;
56,71; -5,17 (Дж/К)
92.
Вычислите изменение энтропии

при стандартных условиях для реакций:
2С2Н5С1
+ 2Na
= С4Н10
+ 2NaCI,
2CH3OH
= CH3-O-CH3
+ Н20(ж),
С2Н5ОН
+ СНзСООН = Н3СООС2Н5
+ Н20(ж).
Решение.
2С2Н5С1
+ 2Na
= С4Н10
+ 2NaCI
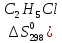
дж/моль∙град


дж/моль∙град

дж/моль∙град
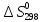
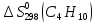
С2Н5ОН
+ СНзСООН = Н3СООС2Н5
+ Н20(ж).
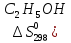
дж/моль∙град
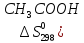
дж/моль∙град
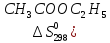
дж/моль∙град
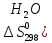
дж/моль∙град
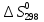
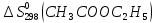
Ответ: (-197,72;
8,40 (Дж/К))
93.
Газообразные водород и хлор при 25
поступают в реактор синтеза хлороводорода,
где взаимодействуют при 725
по реакции:
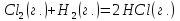
Определите изменение энтропии системы,
начиная с момента поступления газов в
реактор, если их объёмный расход одинаков.
Решение.
Процесс состоит из
трёх стадий: смешения исходных веществ,
нагревания их до 725
и химического превращения. В соответствии
с этим, изменение энтропии системы
включает энтропии: смешения (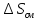
изобарического нагревания компонентов
(
и реакции (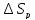
Исходная смесь
состоит из 1 моль
и 1 моль

следовательно, молярные доли компонентов
перед началом реакции одинаковы и равны:
Отсюда имеем:
Дж/К
Определяем изменение
энтропии при изобарном нагревании
компонентов системы по отдельности:
Для
—
Дж/К
Для
—
Дж/К
где 29,57 и 36,50 — значения
изобарных теплоёмкостей водорода и
хлора.
Изменение энтропии
системы на стадии химического превращения
определяем по закону Гесса.
Для водорода —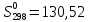
∙К
Для хлора —
Дж/моль ∙К
Для хлороводорода
—
Дж/моль ∙К
Отсюда, воспользовавшись
следствием закона Гесса, имеем:
Дж/К
Cуммируя
результаты расчётов для всех трёх стадий
процесса, имеем:
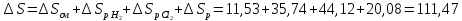
Ответ:

Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
кислород
Внешний вид:
бесцветн. газ
Кристаллические модификации, цвет растворов и паров:

Брутто-формула (система Хилла): O2
Формула в виде текста: O2
Молекулярная масса (в а.е.м.): 32
Температура плавления (в °C): -219
Температура кипения (в °C): -183
Растворимость (в г/100 г или характеристика):
ацетон: 0,367 (10°C)
ацетон: 0,0309 (20°C)
ацетон: 0,0277 (25°C)
бензол: 0,027 (25°C)
вода: 0,00699 (0°C)
вода: 0,00543 (10°C)
вода: 0,00443 (20°C)
вода: 0,00404 (25°C)
вода: 0,00373 (30°C)
вода: 0,0033 (40°C)
вода: 0,00299 (50°C)
вода: 0,00252 (80°C)
вода: 0,00246 (100°C)
метанол: 0,04 (10°C)
метанол: 0,0339 (20°C)
метанол: 0,0313 (25°C)
этанол: 0,0204 (20°C)
Способы получения:
1. Разложением хлората калия при нагревании (катализаторы: диоксид марганца, триоксид железа, триоксид дихрома).
2. Ректификацией жидкого воздуха.
3. Электролиз воды (с растворенными серной кислотой или едким натром).
4. Термическим разложением перманганата калия.
5. Реакцией перманганата калия с перекисью водорода.
6. Разложение перекиси натрия водой в присутствии солей кобальта.
7. Для особо чистого. Электролиз сернокислого раствора хромата калия.
Природные и антропогенные источники:
Содержание в атмосферном воздухе 23 об% (общая масса 1 200 000 000 000 000 тонн), в составе литосферы в общем 50 вес%.
Содержание в атмосфере Солнца 0,03 ат%.
Плотность:
0,001429 (20°C, г/см3)
1,14 (-183°C, г/см3)
1,27 (-219°C, г/см3)
Давление паров (в мм.рт.ст.):
1 (-219°C)
10 (-210,7°C)
100 (-198,7°C)
Диэлектрическая проницаемость:
1,000486 (25°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
0,0192 (0°C)
0,0218 (50°C)
0,0244 (100°C)
0,029 (200°C)
0,0369 (400°C)
Удельная теплоемкость при постоянном давлении (в Дж/г·K):
0,911 (15°C)
0,9125 (100°C)
0,915 (200°C)
0,926 (400°C)
0,938 (600°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (г)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (г)
Стандартная энтропия образования S (298 К, Дж/моль·K):
205,04 (г)
Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
29,35 (г)
Энтальпия плавления ΔHпл (кДж/моль):
0,446
Энтальпия кипения ΔHкип (кДж/моль):
6,828
Аналитические
Критическая температура (в °C):
-118,37
Критическое давление (в МПа):
5,08
Критическая плотность (в г/см3):
0,41
Применение:
Для газовой сварки. Для дыхания при заболеваниях легких. Для выжигания руд. Окислитель реактивного топлива.
История:

Дополнительная информация:
Растворяется в титане и платине. Поддерживает горение древесины, горючих газов, водорода.
- «Энциклопедия для детей» т.17: Химия, М.:Аванта+, 2004 стр. 232-233
- Гурвич Я.А. «Справочник молодого аппаратчика-химика» М.:Химия, 1991 стр. 50
- Некрасов Б.В. «Основы общей химии» т.1 М.:Химия, 1973 стр. 47-49
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 72-73
Источники информации:
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- КИСЛОРОД — химическая энциклопедия
- Кислород — фармацевтический справочник
- Кислород — лекарственные препараты


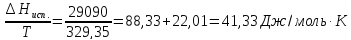
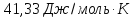

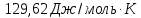
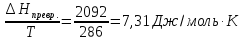

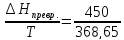


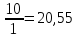
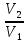
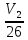
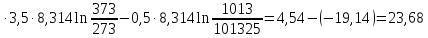
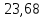
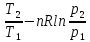
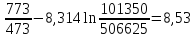
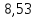

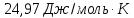
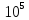
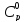
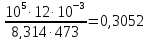
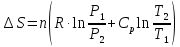
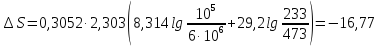
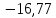

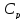

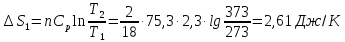
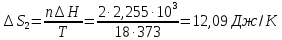






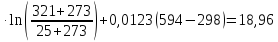
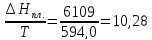
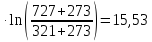
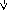
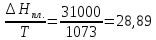
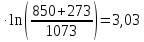
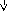
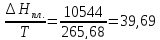
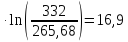
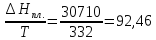

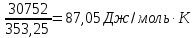


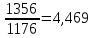
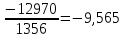
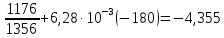
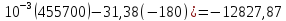
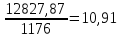

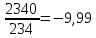


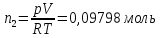
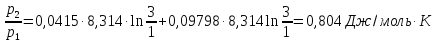
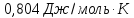
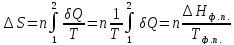

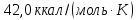

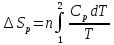
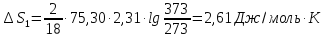
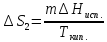
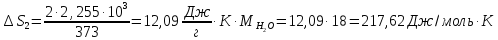

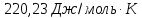
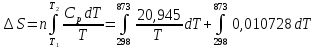

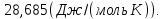
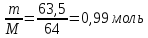

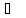
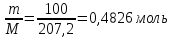
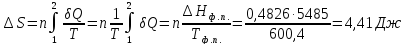
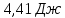

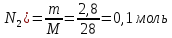
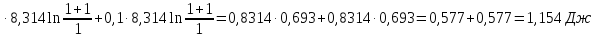
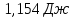
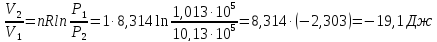
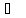
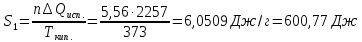
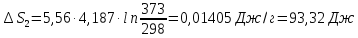
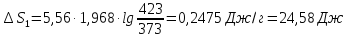
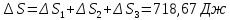
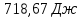

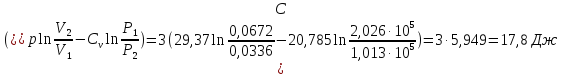

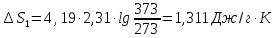

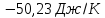
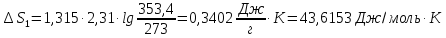
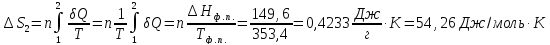
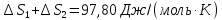
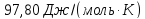
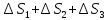
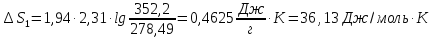
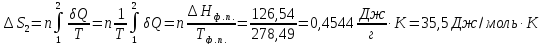
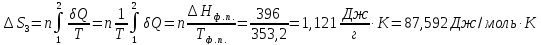
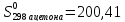
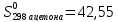

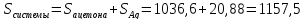
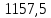
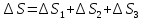

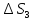
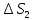
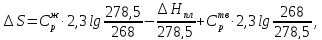
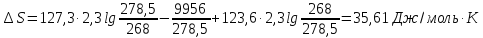
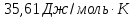
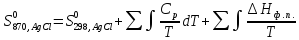
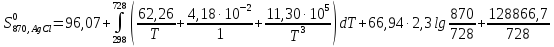


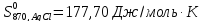
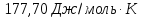
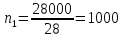
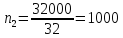
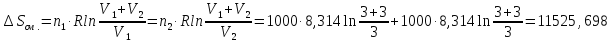
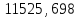
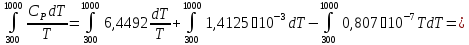
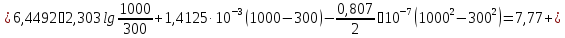
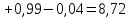

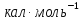
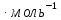
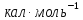
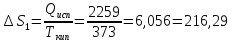
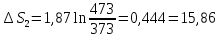
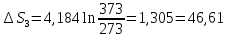
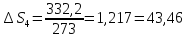
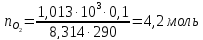
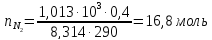
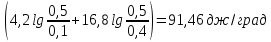
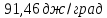

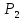
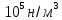
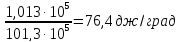
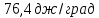
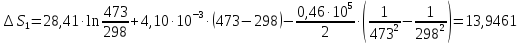
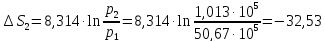
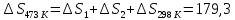
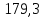
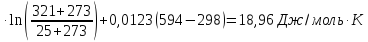
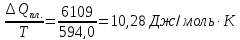

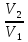
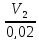

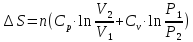
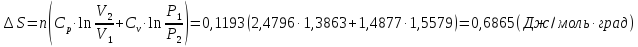
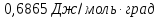
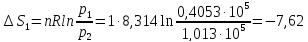
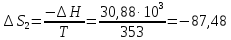
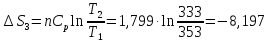

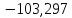

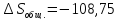

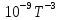
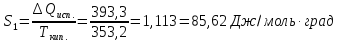

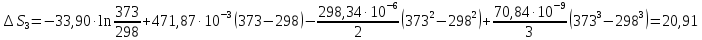

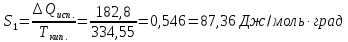
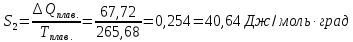

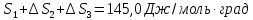
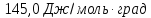
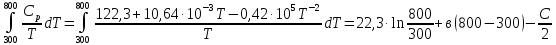
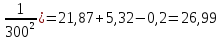
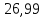
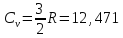
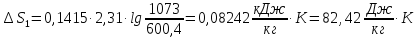
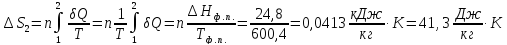
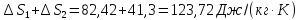
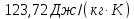
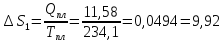
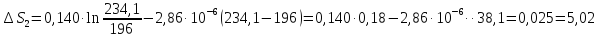
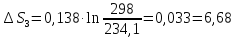
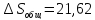
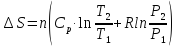

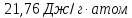
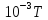
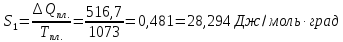
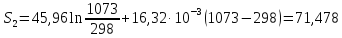

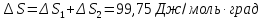
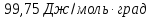
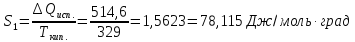
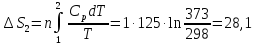


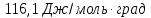
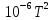
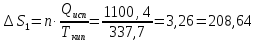
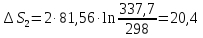
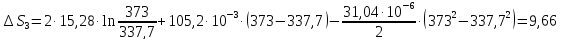
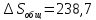






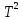
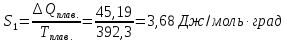
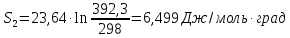

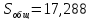



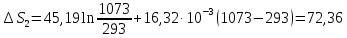
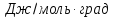
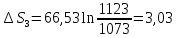


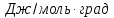
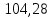

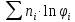
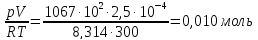
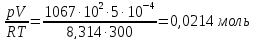
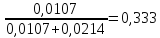
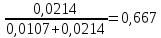
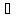
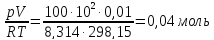
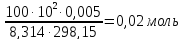
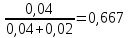
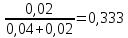



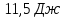
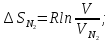
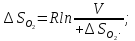
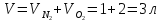
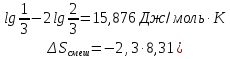

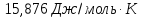
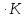
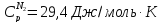



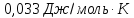
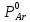
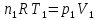

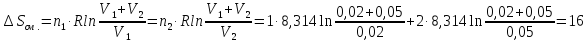
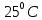
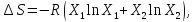
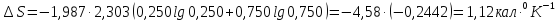
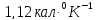
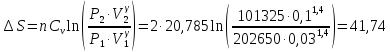
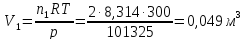

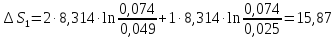
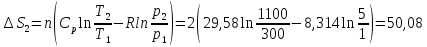
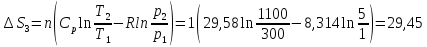
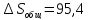
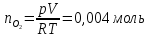

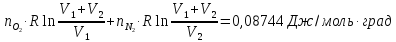

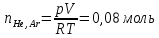
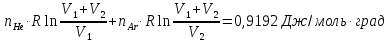
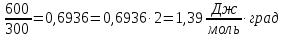
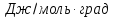
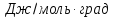
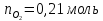
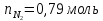
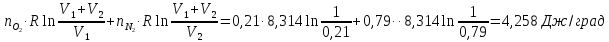



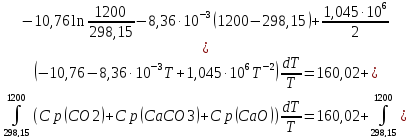

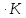
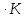
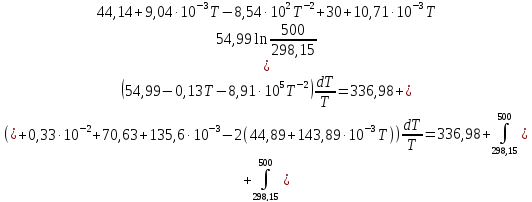
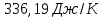
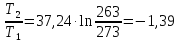
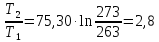
 ,ккал/моль
,ккал/моль