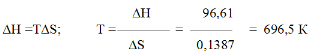Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Понятие энтропии
Абсолютная энтропия веществ и изменение энтропии в процессах
Стандартная энтропия
Стандартная энтропия образования
Энергия Гиббса
Стандартная энергия Гиббса образования
Энтальпийный, энтропийный фактор и направление процесса
Примеры решения задач
Задачи для самостоятельного решения
Понятие энтропии
Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
ΔS = S(прод.) – S(исх.)
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак S реакции можно оценить по изменению объема системы ΔV в результате процесса. Знак ΔV определяется по изменению количества вещества газообразных реагентов Δnг. Так, для реакции
CaCO3(к) = CaO(к) + CO2(г)
(Δnг = 1) ΔV > 0, значит, ΔS > 0.
Для реакции:
С(графит) + 2Н2(г) = СН4(г)
(Δnг = -1) ΔV < 0, следовательно и ΔS < 0.
Стандартная энтропия
Величины энтропии принято относить к стандартному состоянию. Чаще всего значения S рассматриваются при Р = 101,325 кПа (1 атм) и температуре Т = 298,15 К (25оС). Энтропия в этом случае обозначается Sо298 и называется стандартной энтропией при Т = 298,15 К. Следует подчеркнуть, что энтропия вещества S (Sо) увеличивается при повышении температуры.
Стандартная энтропия образования
Стандартная энтропия образования ΔSоf,298 (или ΔSообр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
Энергия Гиббса
Энергия Гиббса G – функция состояния системы. Энергия Гиббса равна:
G = Н – ТS.
Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение δG в результате протекания процесса.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (ΔG < 0). При достижении равновесия в системе ΔG = 0.
Стандартная энергия Гиббса образования
Стандартная энергия Гиббса образования δGоf,298 (или δGообр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, δGоf,298 = 0.
Энтальпийный, энтропийный фактор и направление процесса
Проанализируем уравнение ΔGоТ = ΔНоТ — ΔТSоТ. При низких температурах ТΔSоТ мало. Поэтому знак ΔGоТ определяется в основном значением ΔНоТ (энтальпийный фактор). При высоких температурах ТΔSоТ – большая величина, знак Δ GоТ определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (ΔНоТ) и энтропийного (ТΔSоТ) факторов существует четыре варианта процессов.
-
-
- Если ΔНоТ < 0, ΔSоТ > 0, то ΔGоТ < 0 всегда (процесс может протекать самопроизвольно при любой температуре).
- Если ΔНоТ > 0, ΔSоТ < 0, то ΔGоТ > 0 всегда (процесс не протекает ни при какой температуре).
- Если ΔНоТ < 0, ΔSоТ < 0, то ΔGоТ < 0 при Т < ΔНо/ΔSо (процесс идет при низкой температуре за счет энтальпийного фактора).
- Если ΔНоТ > 0, ΔSоТ > 0, то ΔGоТ < 0 при Т > ΔНо/ ΔSо (процесс идет при высокой температуре за счет энтропийного фактора).
-
Примеры решения задач
Задача 1. Используя термодинамические справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
4NH3(г) + 5O2(г) = 4NО(г) + 6H2O(ж)
Объяснить знак и величину ΔSо.
Решение. Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | NH3(г) | O2(г) | NО(г) | H2O(ж) |
| Sо298,
Дж/(моль·К) |
192,66 | 205,04 | 210,64 | 69,95 |
ΔSох.р.,298 = 4Sо298(NО(г) ) + 6Sо298(H2O(ж)) — 4Sо298(NH3(г)) — 5Sо298(O2(г)) = 4× 210,64 + 6× 69,95 — 4× 192,66 — 5× 205,04 = — 533,58 Дж/К
В данной реакции ΔV < 0 (Δnг = — 5), следовательно и ΔSoх.р.,298 < 0, что и подтверждено расчетом.
Задача 2. Используя справочные термодинамические данные, рассчитать стандартную энтропию образования NH4NO3(к). Отличается ли стандартная энтропия образования NH4NO3(к) от стандартной энтропии этого соединения?
Решение. Стандартной энтропии образования NH4NO3 отвечает изменение энтропии в процессе:
N(г) + 2H2(г) + 3/2O2(г) = NH4NO3(к); δSоf,298(NH4NO3(к)) = ?
Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2(г) | H2(г) | O2(г) | NH4NO3(к) |
| Sо298,
Дж/(моль·К) |
191,50 | 130,52 | 205,04 | 151,04 |
ΔSох.р.,298 = ΔSоf,298(NH4NO3(к)) = Sо298(NH4NO3(к)) — Sо298(N2(г)) — 2Sо298(H2(г)) – 3/2Sо298(O2(г)) = 151,04–191,50 —— 2× 130,52–3/2× 205,04 = — 609,06 Дж/(моль·К).
Стандартная энтропия образования NH4NO3(к), равная — 609,06 Дж/(моль·К), отличается от стандартной энтропии нитрата аммония Sо298(NH4NO3(к)) = +151,04 Дж/(моль·К) и по величине, и по знаку. Следует помнить, что стандартные энтропии веществ Sо298 всегда больше нуля, в то время как величины ΔS0f,298, как правило, знакопеременны.
Задача 3. Изменение энергии Гиббса реакции:
2Н2(г) + О2(г) = 2 Н2О(ж)
равно δGо298= –474,46 кДж. Не проводя термодинамические расчеты, определить, за счет какого фактора (энтальпийного или энтропийного) протекает эта реакция при 298 К и как будет влиять повышение температуры на протекание этой реакции.
Решение. Поскольку протекание рассматриваемой реакции сопровождается существенным уменьшением объема (из 67,2 л (н.у.) исходных веществ образуется 36 мл жидкой воды), изменение энтропии реакции ΔSо<0. Поскольку ΔGо298 реакции меньше нуля, то она может протекать при температуре 298 К только за счет энтальпийного фактора. Повышение температуры уменьшает равновесный выход воды, поскольку ТΔSо<0.
Задача 4. Используя справочные термодинамические данные, определить может ли при 298,15 К самопроизвольно протекать реакция:
С4Н10(г) = 2С2Н4(г) + Н2(г)
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | С4Н10(г) | С2Н4(г) | Н2(г) |
| ΔGоf,298× , кДж/моль | — 17,19 | 68,14 | 0 |
| Sо298, Дж/(моль·К) | 310,12 | 219,45 | 130,52 |
ΔGох.р.,298 = 2ΔGоf,298(С2Н4(г)) + ΔGоf,298(Н2(г)) — ΔGоf,298(С4Н10(г)) = 2× 68,14 + 17,19 = 153,47 кДж.
ΔGох.р.,298 > 0, следовательно, при Т = 298,15 К реакция самопроизвольно протекать не будет.
ΔSох.р.,298 = 2Sо298(С2Н4(г)) + Sо298(Н2(г)) — Sо298(С4Н10(г)) = 2× 219,45 + 130,52 – 310,12 = +259,30 Дж/К.
Поскольку ΔSох.р.,298 > 0, то при температуре Т>ΔНо/ΔSо величина ΔGох.р.,298 станет величиной отрицательной и процесс сможет протекать самопроизвольно.
Задача 5. Пользуясь справочными данными по ΔGоf,298 и Sо298, определите ΔHо298 реакции:
N2O(г) + 3H2(г) = N2H4(г) + H2O(ж)
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2O(г) | H2(г) | N2H4(г) | H2O(ж) |
| ΔGоf,298, кДж/моль | 104,12 | 0 | 159,10 | -237,23 |
| Sо298, Дж/(моль·К) | 219,83 | 130,52 | 238,50 | 69,95 |
ΔGох.р.,298 = ΔGоf,298(N2H4(г)) + ΔGоf,298(H2O(ж)) – ΔGоf,298(N2O(г)) – 3ΔGоf,298(H2(г)) = 159,10 + (–237,23) – 104,12 – 0 = –182,25 кДж.
ΔSох.р.,298 = Sо298(N2H4(г)) + Sо298(H2O(ж)) – Sо298(N2O(г)) — 3Sо298(H2(г)) = 238,50 + 69,95 – 219,83 –3× 130,52 = –302,94 Дж/К.
ΔGо298 = ΔНо298 – ТΔSо298. Подставляя в это уравнение величины ΔНо298 и ТΔSо298, получаем:
ΔНо298 = –182,25× 103 + 298·(–302,94) = –272526,12 Дж = – 272,53 кДж.
Следует подчеркнуть, что поскольку ΔSо298 выражена в Дж/(моль× К), то при проведении расчетов ΔG0298 необходимо также выразить в Дж или величину ΔS0298 представить в кДж/(мольK).
Задачи для самостоятельного решения
1. Используя справочные данные, определите стандартную энтропию образования ΔSоf,298 NaHCO3(к).
2. Выберите процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
а) NO(г) + 1/2O2(г) = NO2(г);
б) N2(г) + 2O2(г) = 2NO2(г);
в) 1/2N2(г) + O2(г) = NO2(г);
г) N(г) + O2(г) = NO2(г).
3. Используя справочные данные, вычислите при 298,15 К изменение энтропии в реакции:
2NH4NO3(к) = 2N2(г) + 4H2O(г) + О2(г).
Объясните знак и величину ΔSº реакции.
-
- .
|
δSох.р.,298 =1040,84 Дж/К. В данной реакции δV > 0 (D nг = 7), |
4. Используя справочные данные, определите принципиальную возможность протекания реакции при 298,15 К:
NiO(к) + C(графит) = Ni(к) + CO(г)
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
|
ΔGох.р.,298 = 74,45 кДж > 0, следовательно, при Т = 298,15 К |
5. Рассчитайте стандартную энергию Гиббса образования ΔGоf,298 C2H5OH(ж), используя справочные данные о величинах ΔНоf,298 и Sо298.
6. Используя справочные данные, определите стандартную энтропию образования ΔSоf,298 K2Cr2O7(к).
7. На основе расчетов термодинамических величин покажите, чем эффективнее восстанавливать при 298 К Cr2O3(к) до металла — алюминием или магнием:
1) Cr2O3(к) + 3Mg(к) = 3MgO(к) + 2Cr(к); ΔGо1;
2) Cr2O3(к) + 2Al(к) = Al2O3(к) + 2Cr(к); ΔGо2.
|
ΔGо1=-648,9 кДж; ΔGо2=-523,3 кДж. |
8. Используя справочными данными по величинам Sо298, определите возможность самопроизвольного протекания в изолированной системе при 298 К процесса:
KClO3(к) = KCl(к) + 3/2O2(к)
|
ΔSо298=247,1 Дж/К. |
9. Используя справочные данные, вычислите при 298 К изменение энтропии в процессе:
Н2(г) + 1/2О2(г) = Н2О(г)
10. На основе справочных данных оценить температуру восстановления WO3(к) водородом:
WO3(к) + 3H2(г) = W(к) + 3H2O(г).
Энтропия
– абсолютная величина (приведена в
таблицах). Значение энтропии 1 моля
вещества в его стандартном состоянии
называется стандартной энтропией S
[Дж/моль*К]
S
растет при растворении твердого вещества
S
газа падает при растворении
S
тем больше, чем сложнее химический
состав соединения.
S
тем больше, чем больше молекулярная
масса
S
растет при повышении температуры
S
тем больше, чем больше объём.
Энтропия
образования вещества
– энтропия реакции образования 1 моля
данного вещества из простых веществ,
являющихся стандартными состояниями
элементов
8.Энтропия
химической реакции. Процессы,
сопровождающиеся увеличением и
уменьшением энтропии (примеры). Расчет
энтропии химической реакции (на
конкретном примере)
Энтропия
химической реакции
– разность энтропий образования
продуктов реакции и исходных веществ
S
растет при растворении твердого вещества
S
газа падает при растворении
S
тем больше, чем сложнее химический
состав соединения.
S
тем больше, чем больше молекулярная
масса
S
растет при повышении температуры
S
тем больше, чем больше объём.
9.Энергия
Гиббса. Стандартная энергия Гиббса
образования вещества. Стандартная
энергия Гиббса химической реакции.
Расчет стандартной энергии Гиббса
химической реакции (на конкретном
примере)
Энергия
Гиббса образования простого вещества,
являющегося стандартным состоянием
элемента, принимается равной 0 при любой
температуре.
Стандартная
энергия Гиббса образования вещества
( ) – это
изменение энергии Гиббса при образовании
1 моль вещества в его стандартном
состоянии из составляющих его простых
веществ, являющихся стандартными
состояниями соответствующих элементов.
10.Зависимость
энергии Гиббса химической реакции от
температуры. (энтальпийный и энтропийный
факторы процесса). Энергия Гиббса и
самопроизвольность процесса.
Иногда
один из факторов полностью преобладает
над другим.
Энтальпийный
фактор –
определяющий для процессов, протекающих
в твердой фазе, т.к. S
обычно мала.
Энтропийный
фактор
преобладает когда S
очень велика из-за образования большого
количества газов или растворов.
Условия
самопроизвольности и несамопроизвольности
протекания процессов
11.Термодинамическая
активность вещества. Расчет энергии
Гиббса образования вещества с учетом
его термодинамической активности.
Какие выводы можно сделать по закону
и величине G
и G
Термодинамическая
активность
– это величина, характеризующая
отклонение термодинамических свойств
в конкретной системе от его свойств в
стандартном состоянии.
-
Безразмерна
-
Активность
вещества в стандартном состоянии равна
1 -
Активность
газа равна его парциальному давлению
(атм) -
Активность
растворенных веществ или ионов ~С
(моль/л)
-
∆G<0
– реакция самопроизвольна. -
∆G
зависит от активности всех участников
реакции -
При
равновесии ∆G=0 -
∆G<0,
значит можно получить полезную работу
∆G>0,
значит необходимо затратить работу
12.Химическое
равновесие. Условия химического
равновесия. Константа равновесия
химической реакции. Термодинамический
вывод констант равновесия.
Химическое
равновесие
– состояние, не изменяющееся во времени,
в котором реакционная смесь содержит
как исходные вещества, так и продукты
реакции.
Условия химического
равновесия:
-
В
системе должны протекать, причем с
достаточно большой скоростью, как
прямой, так и обратный процессы, т.е.
неизменность состояния системы во
времени должна быть результатом
равенства скоростей прямого и обратного
процесса, а не их отсутствия. -
Система
должна быть закрытой или изолированной,
т.е. вещество не должно уходить во
внешнюю среду или поступать оттуда в
систему -
Неизменность
во времени должна поддерживаться без
какого-либо внешнего воздействия на
систему -
Состояние
системы должно быть одинаковым при
подходе к нему как со стороны исходных
веществ, так и со стороны продуктов. -
При
изменении внешних условий (t,
p,
активностей участников)
Константа
равновесия
– отношение произведения активностей
продуктов реакции к произведению
активностей исходных веществ в степенях,
соответствующих стехиометрическим
коэффициентам.
13.Скорость
химической реакции. Средняя и истинная
скорость. Методы экспериментального
определения скорости химических
реакций. (конкретный пример). Простые
и сложные реакции. Особенности
гетерогенных процессов.
Скорость
химической реакции
– основная кинетическая характеристика,
показывающая изменение концентрации
вещества в единицу времени (для гомогенной
реакции):
Скорость
реакции –
изменение количества вещества в единице
объема, в единицу времени, рассчитанное
на единицу его стехиометрического
коэффициента
Скорость
гетерогенной реакции
– изменение количества вещества в
единицу времени на единицу поверхности
Средняя
скорость –
скорость реакции за промежуток времени
∆T
Истинная
скорость –
скорость реакции за бесконечно малый
промежуток времени ∆T,
равная отношению бесконечно малого
приращении функции С к бесконечно
малому приращению аргумента Т – это
производная функции по данному аргументу,
следовательно истинная скорость –
производная концентрации вещества по
времени.
Гетерогенная
реакция:
подвод реагентов к границе раздела;
химическая реакция (кинетическое
уравнение), отвод продуктов реакции.
Скорость
зависит от:
природы реагентов, концентрации
реагирующих веществ, температуры,
присутствия катализатора.
Простые
(элементарные) реакции
– это реакции, протекающие как
непосредственно превращение исходных
веществ в продукты реакции, без
образования каких-либо промежуточных
веществ. Для таких реакций порядок
совпадает со стехиометрическими
коэффициентами.
Сложные
реакции –
это реакции, включающие в себя несколько
промежуточных стадий
14.Зависимость
скорости химической реакции от
концентрации. Основной закон химической
кинетики. Кинетическое уравнение и
порядок реакции. Экспериментальное
определение порядка реакции (конкретный
пример)
Основной
закон химической кинетики (закон
действующих масс):
скорость реакции пропорциональна
произведению концентраций реагирующих
веществ, взятых в степенях, называемых
порядками реакции по соответствующим
веществам.
Кинетическое
уравнение
– математическое выражение основного
закона химической кинетики.
Порядок
реакции определяется экспериментально
Общий
порядок реакции
– сумма всех показателей степеней при
концентрациях реагентов
Метод
изолирования Оствальда
15.Влияние
температуры на скорость химической
реакции. Причины влияния. Уравнение
Аррениуса. Энергетический профиль
реакции. Экспериментальное определение
энергии активации химической реакции
(конкретный пример)
Скорость
большинства химических реакций
возрастает с повышением температуры,
т.к. увеличивается число активных
молекул (имеющих достаточную энергию
для того, чтобы вступить в реакцию)
Уравнение
Аррениуса:
Еа
– энергия активации –
это минимальная избыточная энергия,
которую необходимо иметь реагирующим
молекулам для того, чтобы они могли
вступить в химическую реакцию.
16.Катализ.
Влияние катализатора на скорость
химической реакции. Причины влияния.
Гомогенный и гетерогенный катали.
Автокатализ. Ферментативный катализ.
Примеры практического использования
катализаторов для изменения скорости
реакции. Ингибирование реакции.
Катализ
– это явление
ускорения химических реакций под
действием малых количеств веществ
(катализаторов), которые сами в процессе
реакции не расходуются и после ее
окончания остаются неизменными.
Реакция
с катализатором идет с существенно
меньшими энергетическими затратами,
поэтому каталитическая реакция идет
существенно быстрее при той же
температуре. В данном примере энергия
переходного состояния больше энергии
переходного состояния [ ], и именно
она определяет энергию активации и
скорость протекания каталитической
реакции в целом.
Гомогенный
катализ –
катализатор и участники реакции
находятся в одной фазе. (кислоты,
основания, растворы солей)
Гетерогенный
катализ –
катализатор и участник реакции находятся
в разных фазах и разделены поверхностью
раздела (Металл, оксиды)
Автокаталитическая
реакция –
реакция, ускоряющаяся под действием
образующихся в процессе реакций веществ
Ферменты
(биокатализаторы)
– ускоряют химические процессы,
протекающие в живых организмах.
Активный
центр –
место, где протекает биокатализ
(несколько аминокислотных остатков).
Ферменты
очень специфичны.
Ингибиторы
– вещества, понижающие скорость
химической реакции.
Ингибирование
не связано с повышением Еа.
Разрушает
или связывает активные частицы,
являющиеся промежуточными веществами
(например, свободные радикалы)
Применение
катализаторов:
-
Гидрирование
растительного масла – маргарин -
Получение
пластмасс -
Переработка
нефти
17.Обратимые
химические реакции. Скорость обратимых
химических реакций. Кинетическое
описание химического равновесия. Связь
константы равновесия обратимой реакции
с константами скоростей прямого и
обратного процессов.
Обратимые
реакции –
протекающие одновременно в двух
противоположных направлениях (прямом
и обратном)
По
ходу процесса скорость прямой реакции
постепенно убывает из-за расходования
исходных веществ, в то время, как скорость
обратной возрастает благодаря накоплению
продуктов.
При
равенстве скоростей прямой и обратной
реакций концентрации участников
перестают меняться, и устанавливается
равновесие.
Кинетическим
условием химического равновесия
является равенство скоростей прямой
и обратной реакции.
Константа
равновесия
— отношения произведения равновесных
концентраций продуктов реакции,
возведенных в степени, равные их
стехиометрическим коэффициентам к
произведению концентраций исходных
веществ, также в степенях их
стехиометрических коэффициентов.
Является постоянной для данной
температуры величиной.
Скорость
обратимой реакции определяется как
разность скоростей прямой и обратной
реакции.
Принцип
независимости:
если в системе протекает несколько
реакций, то каждая из них подчиняется
основному закону химической кинетики
и протекает независимо от других
реакций.
18.Смещение
химического равновесия при изменении
внешних условий. Принцип Ле-Шателье.
Термодинамическая и кинетическая
трактовка.
Смещение
химического равновесия
– это изменение относительных количеств
участников реакции (реагентов и
продуктов), вызванное действием внешних
условий (t,
C)
Принцип
Ле-Шателье:
если на систему, находящуюся в равновесии
оказывается внешнее воздействие,
смещающее это равновесие, то данное
равновесие смещается в сторону,
ослабляющую это воздействие до тех
пор, пока нарастающее в системе
противодействие не станет равным
оказываемому воздействию.
Термодинамическая
трактовка:
-
Изменение
исходных активностей (концентраций)
реагентов и продуктов реакции.
-
Не
изменяет константу равновесия, т.к. ∆G
не зависит от исходных активностей
(С) участников реакции, а значит, от них
не зависит константа равновесия -
Изменяет
равновесные а(С) реагентов и продуктов,
поэтому равновесие смещается.
-
Изменение
температуры реакции
-
Изменяет
константу равновесия, т.к. ∆G
зависит от t
-
Изменяет
равновесные а(С) реагентов и продуктов
реакции.
-
Участие
катализатора
-
Не
изменяет константу равновесия реакции -
Не
изменяет а(С) реагентов и продуктов
реакции
Кинетическая
трактовка:
-
Изменение
а(С)
-
не
изменяет константу равновесия, т.к.
константа прямой и обратной реакции
не зависят от изменения а(С) -
изменяет
равновесные а(С) реагентов и продуктов
реакции.
-
Изменение
температуры
-
Изменяет
константу равновесия, т.к. константа
прямой и обратной реакции зависят от
температуры -
Изменяет
равновесные а(С) продуктов и реагентов
Константа
равновесия экзотермической реакции
при повышении температуры уменьшается.
Участие
катализатора не смещает химическое
равновесие.
19.Фазовые
равновесия. Диаграммы состояния
однокомпонентных систем (на примере
йода и воды)
Фазовые
равновесия
– равновесия, возникающие при взаимном
превращении различных фаз вещества;
плавлении, кипении, сублимации, изменении
кристаллической структуры и т.д..
Сведения
о фазовых равновесиях вещества отражаются
на диаграммах состояния
Однофазная
область –
область, в пределах которой устойчива
определенная фаза данного вещества (2
степени свободы)
Двухфазные
состояния
однокомпонентных систем имеют одну
степень свободы.
Тройная
точка –
точка соприкосновения трех однофазных
областей (не имеет степеней свобод)
Правило
фаз:
20.Растворы:
твердые, жидкие, газообразные. Общие
закономерности образования растворов.
Способы выражения их состава.
Растворимость. Насыщенные и перенасыщенные
растворы. Влияние температуры и давления
на растворимость веществ.
Раствор
– однофазная гомогенная система
переменного состава из двух или более
компонентов.
-
Твердые
-
Газообразные
-
Жидкие
Общие
закономерности образования растворов:
-
Разрушение
структуры чистого растворяемого
вещества с образованием частиц, в виде
которых оно находится в растворе
(молекул или ионов) -
Образование
раствора при взаимодействии этих
частиц с растворителем. Частицы
растворенного вещества образуют
соединения с молекулами растворителя,
которые носят общее название сольватов
(гидратов). Поэтому вторая стадия
называется сольватацией (гидратацией)
Растворимость
компонентов:
Растворимость
– максимальное количество вещества,
которое может растворяться при заданной
температуре.
Влияние
температуры на растворимость веществ:
-
Растворение
большинства газообразных веществ в
воде уменьшается при росте температуры,
т.к. это процесс экзотермический -
Чаще
всего растворение твердых веществ
сопровождается поглощением теплоты,
т.е. при росте температуры растворимость
растет
Влияние
давления на растворимость веществ:
Закон
Рауля: над
всеми жидкими растворами давление
насыщенного пары растворителя меньше,
чем под соответствующими чистыми
растворителями. Относительно давление
пара растворителя над идеальным
раствором равно мольной доле растворенного
вещества
21.Коллигативные
свойства растворов. Осмос, причина его
возникновения, осмотическое давление.
Биологическая роль осмоса. Диализ.
Коллигативные
свойства растворов
– это свойства, зависящие от природы
растворителя и числа частиц растворенность
вещества, но почти не зависящие от
природы последнего.
-
Понижение
давления пара растворителя над раствором -
Понижение
температуры при кристаллизации раствора -
Повышение
температуры кипения раствора -
Возникновение
осмотического давления
Если
раствор и растворитель или два раствора
разделить полупроницаемой мембраной
(проницаемость для молекул растворителя),
то растворитель может самопроизвольно
переходить через нее из разбавленного
раствора или чистого растворителя в
более концентрированный раствор. Это
явление называется осмосом.
Осмотическое
давление и осмос играют важную роль в
биологических процессах.
-
Мембрана
эритроцита пропускает воду, кислород
и некоторые вещества. -
Участвует
в переносе питательных веществ в
клетках растений
Диализ
– это разделение растворенных веществ
с разными молекулярными массами с
помощью полупроницаемых мембран.
22.Образование
растворов электролитов. Электролитическая
диссоциация. Энтальпии гидратации
ионов. Сильные и слабые электролиты.
Образование
растворов электролитов.
-
Разрушение
структуры исходного вещества с
образованием свободных ионов в газовой
фазе.
Кристаллогидраты
образованы гидратированными ионами
Чем
ниже полярность растворителя, тем
меньше его способность гидратировать
ионы.
Электролитическая
диссоциация
– процесс распада электролита на ионы
при растворении его в полярном
растворителе или при плавлении
Электролиты
– проводят электрический ток за счет
движения ионов.
Слабые
электролиты
– степень диссоциации крайне мала.
В
растворах слабых электролитов диссоциация
практически полностью обратима, в них
присутствует как ионы, так и молекулы
растворенного вещества
Сильные
— полностью распадаются на ионы.
23.Равновесие
диссоциации у растворов слабых
электролитов. Степень диссоциации и
константа диссоциации слабого
электролита. Влияние концентрации и
температуры на степень диссоциации
слабого электролита.
Равновесие,
устанавливающееся при диссоциации
слабого электролита, описывается
константой
диссоциации.
Степень
диссоциации ( )
– количественная характеристика
процесса диссоциации в растворе
определенной концентрации.
Соотношение
между константой диссоциации и степенью
диссоциации слабого электролита:
При
степени диссоциации много меньше 1,
можно принять, что
Равновесие
диссоциации подчиняется принципу
Ле-Шателье.
Повышение
концентрации исходного вещества смещает
равновесие в сторону продуктов.
Влияние
температуры на равновесие (степень)
диссоциации слабого электролита
определяется энтальпией этого процесса
(у большинства ∆Н мала) поэтому константа
диссоциации и степень диссоциации
слабо зависят от температуры.
Вычисление значений энтальпии, энтропии и энергии Гиббса химических реакций
Изменение энтропии для химических процессов
Задача 55.
Вычислите изменение энтропии для химических процессов, протекающих по уравнениям:
a) 2NO(г) + O2(г) = 2NO2(г);
б) 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж).
Решение:
Согласно 3-му следствию из закона Гесса, изменение энтропии химического процесса (ΔS°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
∆S°(х.р.)= ∑S°(обр.прод.) — ∑S°(обр.исх.).
a) 2NO(г) + O2(г) = 2NO2(г)
Для этой реакции составaим уравнение расчета изменения энтропии в стандартных условиях:
ΔS° = [2 · S°NO2(г)] – [2 · S°NO(г) + S°O2(г)].
По табличным данным установим значения энтропий (S°) участников процесса (Дж/моль·К):
S°NO2(г) = 240,2; S°NO(г) = 210,6; S°O2(г) = 205,0.
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
ΔS° = (2 · 240,2) – [(2 · 210,6) + 205,0] = -145,8 Дж/(моль·К).
Заметим при этом, что отрицательное значение изменения энтропии (убывание энтропии) свидетельствует о невозможности осуществления указанного процесса самопроизвольно в стандартных условиях.
б) 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж).
Для этой реакции составим уравнение расчета изменения энтропии в стандартных условиях:
ΔS° = [2 · S0SO2(г) + 2 · S0H2O(ж)] – [2 · S0H2S(г) + 3S°O2(г)].
По табличным данным установим значения энтропий (S0) участников процесса (Дж/моль·К):
S°SO2(г) = 248,1; S°H2O(ж) = 70,1; S°H2S(г) = 205,7; S°O2(г) = 205,0.
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
ΔS° = [(2 · 248,1) + (2 .70,1)] – [(2 · 205,7) + (3 · 205,0)] = -390,0 Дж/(моль·К).
Таким образом, отрицательное значение изменения энтропии (убывание энтропии) свидетельствует о невозможности осуществления указанного процесса самопроизвольно в стандартных условиях.
Вычисление энтальпии реакции
Задача 56.
Экспериментально установлено, что при взаимодействии 2,3 г натрия с водой выделяется 14,0 кДж теплоты. Вычислите энтальпию реакции.
Решение:
m(NaOH) = 2,3 г;
М(NaOH) = 46 г/моль;
Q = 14,0 кДж.
Уравнение реакции:
2,3 г 14,0 кДж
2Na + 2H2O = 2NaOH + H2; ΔH = ?
2* 43 г
Вычисляем
энтальпию реакции из пропорции, получим:
2,3 г — 14,0 кДж
46 г —- х кДж
х = (46 . 14)/2,3 = 280 кДж.
ΔH = 280 кДж.
Можно проверить, используя табличные данные и следствие из закона Гесса, получим:
∆H°(Н2О) = -285,8 кДж;
∆H°(NaOH) = -425,6 кДж.
∆H° = [2∆H°(NaOH) — 2∆H°(Н2О)] = 2(-425,6) — 2(-285,8) = 280 кДж.
Задача 57.
1. Определить энтальпию образования CaHPO4(к), если термохимическое уравнение реакции имеет вид:
2Ca(OH)2(к) + P2O5(к) = 2CaHPO4(к) + H2O(г); ∆H = –1587 кДж.
Решение:
∆H°Cа(OН)2(к) = -985,1 кДж/моль;
∆H°Р2О5(к) = -1507,2 кДж/моль;
∆H°Н2О(г) = -241,81 кДж/моль;
∆H°CаНРО4(к) = ?
Согласно 2-му следствию из закона Гесса, изменение энтальпии химического процесса (ΔН°) определяется как разность сумм энттльпий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтальпии реакции получим:
∆Н(х.р.) = ∑∆Н(обр.прод.) — ∑∆Н(обр.исх.).
Тогда
∆H° = [2∆H°CаНРО4(к) + ∆H°Н2О(г)] — 2[∆H°Cа(OН)2(к) + ∆H°Р2О5(к)];
∆H° = [2x + ∆H°Н2О(г)] — 2[∆H°Cа(OН)2(к) + ∆H°Р2О5(к)];
–1587 = 2х + (-241,81) + [2(-985,1) + 1507,2];
–1587 = 2х + 3235,59;
х = -23713 кДж/моль.
Ответ: ∆H°CаНРО4(к) = -23713 кДж/моль.
Р.S. Слишком большое расхождение с табличными данными (-1808,6 кДж/моль) указывает на то, что ∆H° = –1587 кДж, указанное значение в условии задачи, иное (-381,6 кДж/моль).
Определение температуры наступления равновесия реакции
Задача 58.
При какой температуре наступит равновесие системы: CO(г) + 2H2(г) = CH3OH(ж)?
Решение:
∆H°CO(г) = -110,52 кДж/моль;
∆H°CH3OH(ж) = -238,9 кДж/моль;
S°(СО) = 197,55 Дж/моль . К;
S°(Н2) = 130,52 Дж/моль . К;
S°(СН3ОН) = 126,78 Дж/моль . К.
1. Находим ∆H°х.р. для данной системы.
Согласно 2-му следствию из закона Гесса, изменение энтропии химического процесса (ΔН°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
∆H°х.р. = ∑∆H°(прод.) — ∑∆H°(исходн.).
Тогда
∆H°х.р. = ∆H°CH3OH(ж) – [∆H°CO(г) + ∆H°H2(г)];
∆H°х.р. = -238,9 – (-110,52) + 0,0 = -128,38 кДж/моль.
2. Находим ∆S°х.р. для данной системы
Согласно 3-му следствию из закона Гесса, изменение энтропии химического процесса (ΔS°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
∆S°(х.р.)= ∑S°(обр.прод.) — ∑S°(обр.исх.).
Тогда
∆S°х.р. = S°CH3OH — S°CO – S°H2;
∆S°х.р. = 129,78 – 197,55 – 130,52 =
= -331,81 Дж/(моль . К) = -0,33181 кДж/(моль . К).
3. Находим температуру равновесия системы
Для расчета температуры равновесия системы используем формулу: ∆G° = ∆H° — T∆S°.
В состоянии равновесия системы ∆G° = 0.
В этом случае — 0 = ∆H° — T∆S°.
Тогда
∆H° = T∆S°
Отсюда
Т = ∆H/∆S° = -128,38 кДж/моль/-0,33181 кДж/(моль . К) =
= 386,9 К.
Ответ: равновесие системы наступит при 386,9 К.
Определение направления химической реакции
Задача 59.
Дано уравнение: Fe2O3 + 2Al = Al2O3 + 2Fe. Вычислить тепловой эффект реакции, изменение стандартной энергии Гиббса при температуре 25 °С. В каком направлении будет протекать данная реакция?
Решение:
∆H°Fe2O3(к) = -822 кДж/моль;
∆H°Аl2O3(к) = -1675,7 кДж/моль;
S°Fe2O3(к) = 87 Дж/(моль . K);
S°Al2O3(к) = 50,9 Дж/(моль . K);
S°Fe(к) = 164,4 Дж/(моль . K);
S°Al(к) = 27,15 Дж/(моль . K).
1. Расчет энтальпии реакции получим:
∆Н(х.р.) = ∑∆Н(обр.прод.) — ∑∆Н(обр.исх.);
∆Н(х.р.) = [∆Н°Al2O3(к)] – [∆Н°Fe2O3(к)];
∆Н(х.р.) = (-1675,7) — [-822] = –853,7 кДж.
2. Расчет энтропии реакции получим:
∆S°(х.р.)= ∑S°(обр.прод.) — ∑S°(обр.исх.);
∆S°(х.р.) = [S°Al2O3(к) + S°Fe(к)] — [S°Fe2O3(к) + S°Al(к)];
∆S°(х.р.) = (50,9 + 164,4) – (87 + 27,15) = 101,15 Дж/(моль·К) = 0,10115 Дж/(моль·К).
Переведем температуру из шкалы Цельсия в шкалу Кельвина: Т = 273 + 25 = 298 К. Для расчета ∆G°(298) воспользуемся уравнением:
∆G°(298) = ∆H° – T∆S°;
∆G°(298) = –853,7 – 298·(0,10115) = -883,8427 кДж.
Таким образом,∆G°(500) < 0, поэтому самопроизвольное протекание данного процесса при 25 °С возможно, то данная реакция может протекать в стандартных условиях.
Ответ: ∆Н(х.р.) = –853,7 кДж; ∆G°(298) = -883,8427 кДж.
Расчет энергии Гиббса реакции образования беспорядочного клубка лизин
Задача 60.
В отсутствии денатурирующих агентов константа равновесия Кр реакции образования беспорядочного клубка лизина при 298 К и рН = 7 равна 7,8. Рассчитать ∆G°298 и оценить биологический аспект полученной величины.
Решение:
Рассчитаем ∆G°298 из формулы ∆G° = –RTlnK, получим:
∆rG°298 = –RTlnK = -[8,314 Дж/(моль . К) . 298 K . ln7,8] = -(8,314 . 298 . ln7,8) = -(8,314 . 298 . 2,054) = -5089 Дж/моль.
Так как ∆G° имеет отрицательное значение, (∆G° < 0), то реакция протекает самопроизвольно в прямом направлении. Значит, реакция образования беспорядочного клубка лизина будет происходить при 298 К и рН = 7.
Если ∆G° равно нулю (∆G° = 0), то реакция находится в равновесном состоянии.
Если ∆G° положительно (∆G° > 0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
Екатерина Владимировна Мосина
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Понятие энтропии ввел Р. Клаузиус в 1865 г.
Энтропия – функция состояния
Для того чтобы выяснить в чем состоит физический смысл энтропии, рассмотрим изотермический процесс и приведенное количество теплоты в этом процессе на очень малом участке этого процесса -$frac{delta Q}{T}$, где $delta Q$ – количество теплоты, которое получает тело, $T$ – температура тела.
Приведенное количество теплоты, которое сообщается телу в любом обратимом круговом процессе:
$oint {frac{delta Q}{T}=0left( 1 right).}$
Равенство нулю левой части выражения (1), который берут по замкнутому контуру, означает, что отношение δQ/T – это полный дифференциал некоторой функции состояния системы, которая не зависит от формы пути перехода системы из начального состояния в конечное.
Введем следующее обозначение:
$frac{delta Q}{T}=dSleft( 2 right)$.
Определение 1
Энтропией ($S$) называют функцию состояния, дифференциал которой равен приведенному количеству тепла на малом участке термодинамического процесса, которое передано системе в этом процессе.
Для обратимых процессов изменение энтропии равно нулю:
$Delta S=0left( 3 right)$.
Если выполняется необратимый процесс, то энтропия системы увеличивается:
$Delta S$>$0, left( 4 right)$.
Все реальные процессы являются необратимыми, поэтому в реальности энтропия изолированной системы способна только расти. Она становится максимальной в состоянии термодинамического равновесия.
Замечание 1
Формулы (3) и (4) выполняются только в том случае, если система замкнута. В том случае, если термодинамическая система может обмениваться теплом с внешней средой, то поведение энтропии может быть любым.
«Энтропия простыми словами с формулами» 👇
Неравенство Клаузиуса
Выражения (3) и (4) объединяются в неравенство, которое называется неравенством Клаузиуса:
$Delta Sge left( 5 right)$.
Неравенство Клаузиуса означает, что для замкнутой системы энтропия способна увеличиваться (если процесс необратим), или не изменяется (процесс обратим).
Неравенство Клаузиуса является математической записью второго начала термодинамики.
Знак изменения энтропии указывает направление течения процесса в обратимом процессе.
Во всех ординарных термодинамических системах при стремлении температуры к бесконечности, внутренняя энергия системы безгранично растет. Абсолютная температура при равновесных процессах может только большей нуля, следовательно, если система подвергается нагреву, то:
$dS$>$0.$
При уменьшении температуры системы имеем:
$dS$
Изменение энтропии в равновесном процессе
Допустим, что термодинамическая система совершает равновесный переход из состояния 1 в состояние 2, тогда изменение энтропии найдем как:
$Delta S=S_{2}-S_{1}=intlimits_1^2 {frac{delta Q}{T}=intlimits_1^2{frac{dU+delta A}{T}left( 6 right),} }$
где $dU$ – изменение внутренней энергии в рассматриваемом процессе; $delta A$ – работа, выполняемая в этом процессе.
Выражение (6) способно определить энтропию с точностью до аддитивной константы. Это означает то, что физическим смыслом обладает не энтропия, а ее разность.
$S=intlimits_{обр} {frac{delta Q}{T}+const, left( 7 right).}$
Свойства энтропии
Замечание 2
Энтропия – аддитивная величина. Это означает, что энтропию системы можно найти как сумму энтропий тел, которые эту систему образуют.
Свойство аддитивности имеют:
- масса;
- внутренняя энергия;
- количество теплоты.
Аддитивными не являются:
- объем,
- температура,
- давление.
Определение 2
Термодинамический процесс, в котором энтропия остается постоянной, называется изоэнтропийным процессом.
Так, при обратимом адиабатном процессе мы имеем:
$delta Q=0to S=const.$
Энтропия однородной термодинамической системы – это функция пары независимых параметров, характеризующих ее состояние, например, $ p,V$ или $ T,V$ при $ m=const$.
В этой связи можно записать, что:
$left( V,T right)=intlimits_0^T {C_{V}frac{dT}{T}+S_{01, }left( 8right).}$
или
$Sleft( p,T right)=intlimits_0^T {C_{p}frac{dT}{T}+S_{02, }left( 9right),}$
где $intlimits_0^T {C_{V}frac{dT}{T},}$ – находят для обратимого изобарного процесса; $intlimits_0^T {C_{p}frac{dT}{T}}$ – вычисляют для обратимого изохорного процесса, при изменении температуры от 0К до $T$; $C_V$ – теплоемкость изохорного процесса; $C_p$ – теплоемкость при изобарном процессе; $S_{01 }=S(V,0)$ ; $S_{02 }=S(p,0).$
Статистический смысл энтропии
Допустим, что энтропия в обратимом процессе претерпевает изменения под воздействием внешних условий, которые оказывают влияние на систему. Механизм действия этих условий на энтропию можно сформулировать так:
- Внешние условия определяют микросостояния, которые доступны системе, а также их количество.
- В рамках доступных для системы микросостояний, она приходит в состояние равновесия.
- Энтропия получает соответствующее значение. Получается, что величина энтропии идет за изменением внешних условий, принимая наибольшую величину, совместимую с внешними условиями.
Глубокий смысл энтропии раскрывается в статистической физике. Энтропия связана с термодинамической вероятностью состояния системы.
Определение 3
Термодинамическая вероятность ($W$) – количество способов, реализации данного состояния термодинамической системы. Или иначе, это число микросостояний, реализующих данное макросостояние.
Термодинамическая вероятность всегда больше или равна единице.
Энтропия системы и термодинамическая вероятность связаны между собой формулой Больцмана:
$S=k ln(W) (10),$
где $k$ – постоянная Больцмана.
- Формула (10) означает, что энтропия определена натуральным логарифмом количества микросостояний, которые реализуют рассматриваемое макросостояние.
- Согласно формуле Больцмана, энтропия – это мера вероятности состояния термодинамической системы.
- Говорят, что энтропия – мера беспорядка системы. Это статистическая интерпретация энтропии. Большее количество микросостояний, которое осуществляет макросостояние, соответствует большей энтропии.
- Если система находится в состоянии термодинамического равновесия, что соответствует наиболее вероятному состоянию системы, количество микросостояний наибольшее, энтропия в этом случае максимальна.
- Поскольку при необратимых процессах энтропия увеличивается, при статистическом толковании это значит, процессы в замкнутой системе проходят в направлении роста количества микросостояний. Это означает, что процессы идут от менее вероятных к более вероятным, до достижения вероятностью максимальной величины.
Замечание 3
Все статистические законы справедливы для систем, которые составлены из огромного количества частиц. Но эти законы могут нарушаться с небольшим числом частиц. Для систем с малым количеством частиц возможны флуктуации, это значит, что энтропия и термодинамическая вероятность состояний замкнутой системы на некотором временном отрезке могут убывать, а не расти или не изменяться.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Энергетика химических процессов
Общая химия. Учебное пособие — Таирова А.Р., Кузнецов А.И. — 2005
- 5.1. Общие понятия
- 5.2. Внутренняя энергия. Первый закон термодинамики
- 5.3. Энтальпия системы. Тепловые эффекты химических реакций
- 5.4. Термохимические расчеты
- 5.5. Химическое сродство. Энтропия химических реакций. Энергия Гиббса
- 5.6. Второй и третий законы термодинамики
Глава 5 . Энергетика химических процессов
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях.
5.1. Общие понятия. При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакция. Состояние системы характеризуется термодинамическими параметрами (р, Т, с и др.). При изменении параметров меняется и состояние системы. В термодинамике свойства системы рассматриваются при ее равновесном состоянии. Термодинамическое состояние системы называют равновесным в том случае, когда его термодинамические параметры одинаковы во всех точках системы и не изменяются самопроизвольно (без затраты работы) во времени. Термодинамика изучает переходы системы из одного состояния в другое. Но переходы должны осуществляться при термодинамическом равновесии с окружающей средой, т.е. очень медленно, а в идеале — бесконечно медленно. При этом могут изменяться все параметры состояния системы, либо некоторые параметры остаются без изменения. Если процессы перехода системы происходят при постоянстве каких-то параметров системы, то они называются:
а) изобарическими (р = const);
б) изохорическими (Т= const);
в) изотермическими (Т = const);
г) изобарно-изотермическими (р,T — const) и т.д.
Термодинамика изучает возможность или невозможность самопроизвольного перехода системы из одного состояния в другое и энергетические эффекты этих переходов. Скорость и механизм процессов перехода — это области химической кинетики.
5.2. Внутренняя энергия. Первый закон термодинамики. При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а те, которые сопровождаются поглощением теплоты, — эндотермическими. Теплота реакции является, таким образом, мерой изменения свойств системы, и знание ее может иметь большое значение при определении условий протекания той или иной реакции.
При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы — закона сохранения материи. Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии и на совершение работы А:
Q = ∆U + A
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики:
Q = ∆U + W
Уравнение означает, что теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой.
Внутренняя энергия системы U — это общий ее запас, включающий энергию поступательного и вращательного движений молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия — полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение внутренней энергии U веществ неизвестно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, т.е. ее изменение однозначно определяется начальным и конечным состояниями системы и не зависит от пути перехода, по которому протекает процесс:
U=U2-U1,
где: U — изменение внутренней энергии системы при переходе из начального состояния U1 в конечное U2. Если U2 > U1, то U> 0.
Если U2< U1, то U< 0.
5.3. Энтальпия системы. Тепловые эффекты химических реакций. Теплота Q и работа A функциями состояния не являются, ибо они служат формами передачи энергии и связаны с процессом, а не с состоянием системы. При химических реакциях А — это работа против внешнего давления, т.е. в первом приближении
А = рV,
где V — изменение объема системы (V2 – V1).
Так как большинство химических реакций проходит при постоянном давлении, то для изобарно-изотермического процесса (р = const, Т= const) теплота Qp будет равна:
Qp = ∆U + p∆V,
Qp= (U2 – U1) + p(V2 – V1)
Qp = (U2 + pV2) – (U1 + pV1)
Сумму U+ pV обозначим через Н, тогда
Qp = H2 – H1 = ∆H
Величину Н называют энтальпией. Таким образом, теплота при р=const и Т=const приобретает свойство функции состояния и не зависит от пути, по которому протекает процесс. Отсюда теплота реакции Qp в изобарно-изотермическом процессе равна изменению энтальпии системы Н (если единственным видом работы является работа расширения):
Qp = ∆H
Энтальпия, как и внутренняя энергия, является функцией состояния: ее изменение (H) определяется только начальным и конечным состояниями системы и не зависит от пути перехода. Нетрудно видеть, что теплота реакции в изохорно-изотермическом процессе (V= const; Т = const), при котором V=0, равна изменению внутренней энергии системы:
Qv = ∆U
Теплоты химических процессов, протекающих при р, Т=const и V, Т=const, называют тепловыми эффектами.
При экзотермических реакциях энтальпия системы уменьшается и Н < 0 (Н2 < H1), а при эндотермических энтальпия системы увеличивается и Н > 0 (Н2 > Н1). В дальнейшем тепловые эффекты всюду выражаются через H.
5.4. Термохимические расчеты. Термохимические расчеты основаны на законе Гесса, позволяющее рассчитать энтальпию химической реакции: тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект реакции (Нx.p.) равен сумме теплот образования Нобр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции:
∆Hx.p. = ∑∆Hобрпрод — ∑∆Hобрисх (1)
Пример 1. При взаимодействии кристаллов хлорида фосфора (V) с парами воды образуется жидкий РОС13 и хлороводород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции.
Решение. Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp, равные изменению энтальпии системы Н. Значение Н приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно.
Если в результате реакции выделяется теплота, то Н < 0. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
PCl5(к) + H2O(г) = POCl3(ж) + 2HCl(г); ∆Hx.p.= -111,4 кДж
Таблица 15.
Стандартные теплоты (энтальпии) образования
некоторых веществ
| Вещество | Состояние | кДж/моль | Вещество | Состояние | кДж/моль |
| С2Н2 | г | +226,75 | СО | г | -110,52 |
| CS2 | г | +115,28 | СН3ОН | г | -201,17 |
| NO | г | +90,37 | С2Н5OН | г | -235,31 |
| С6Н6 | г | +82,93 | H2O | г | -241,83 |
| С2Н4 | г | +52,28 | Н2О | ж | -285,84 |
| H2S | г | -20,15 | NH4C1 | к | -315,39 |
| NН3 | г | -46,19 | СО2 | г | -393,51 |
| СН4 | г | -74,85 | Fе2О3 | к | -822,10 |
| С2Н6 | г | -84,67 | TiO2 | к | -943,90 |
| НС1 | г | -92,31 | Са(ОН)2 | к | -986,50 |
| А12O3 | к | -1669,80 |
Пример 2. Реакция горения этана выражается уравнением:
С2Н6(г) + 31/2О2= 2СО2(г)+3Н2О(ж); ∆Hх.р.= -1559,87 кДж
Вычислите теплоту образования этана, если известны теплоты образования СO2(г) и Н2O(ж) (см. табл. 15).
Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях.
Обычно теплоту образования относят к стандартному состоянию, т.е. 25° С (298 К) и 1,013105 Па и обозначают через.Так как тепловой эффект с температурой изменяется незначительно, то в дальнейшем индексы опускаются и тепловой эффект обозначается через Н. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид
2С(графит)+3Н2(г) = С2Н6(г); ∆H = ?
исходя из следующих данных:
а) С2Н6(г) + 31/2О2(г)=2СО2(г)+3Н2О(ж); ∆H =-1559,87 кДж
б) 2С(графит)+О2(г)= СО2(г); ∆H =-393,51 кДж
в) Н2(г)+ 1/2О2=Н2О(ж); ∆H =-285,84 кДж
На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) — на 3, а затем сумму этих уравнений вычитают из уравнения (а):
С2Н6 + 31/2О2-2С-2О2-3Н2—3/2О2=2СО2+3Н2О-2СО2-3Н2О
∆H =-1559,87-2(-393,51)-3(-285,84)= +84,67 кДж;
∆H =-1559,87+787,02+857,52;
С2Н6=2С+3Н2; ∆H = +84,67 кДж
Так как теплота образования равна теплоте разложения с обратным знаком, то .
К тому же результату придем, если для решения задачи применить вывод из закона Гесса:
∆Hх.р. =2∆Hсо2+3∆Hн2о-∆Hс2н6-31/2∆Hо2
Учитывая, что теплоты образования простых веществ условно приняты равными нулю
∆Hс2н6=2∆Hсо2+3∆Hн2о-∆Hх.р.
∆Hс2н6=2(-393,51)+3(-258,84)+1559,87=-84,67;
∆Hобрс2н6(г)=-84,67 кДж
Пример 3. Реакция горения этилового спирта выражается термохимическим уравнением
С2Н5ОН(ж)+3О2(г)=2СО2(г)+3Н2О(ж); ∆H=?
Вычислите тепловой эффект реакции, если известно, что молярная теплота парообразования С2Н5OН(ж) равна +42,36 кДж, а теплоты образования С2Н5OН(г), СO2(г), Н2O(ж) см. табл. 15.
Решение. Для определения Н реакции необходимо знать теплоту образования С2Н5OН(ж). Последнюю находим из данных:
С2Н5ОН(ж) = С2Н5ОН(г); ∆H = + 42,36 кДж
+42,36 = — 235,31- ∆Hс2н5он (ж);
∆Hс2н5он (ж) = — 235,31-42,36 = -277,67 кДж
Вычисляем H реакции, применяя следствие из закона Гесса:
∆Hх.р.=2(-393,51)+3(-285,84)+277,67=-1366,87 кДж
5.5. Химическое сродство. Энтропия химических реакций. Энергия Гиббса. Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты.
Реакция, идущая при данной температуре с выделением теплоты, при другой температуре проходит с поглощением теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации), к уменьшению Н; с другой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением, а вторая — с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией.
Энтропия S, так же как внутренняя энергия U, энтальпия Н, объем V и др., является свойством вещества, пропорциональным его количеству. S, U, H, V обладают аддитивными свойствами, т.е. при соприкосновении системы суммируются. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п.— ведут к уменьшению энтропии. Энтропия является функцией состояния, т.е. ее изменение зависит только от начального (S1) и конечного (S2) состояний и не зависит от пути процесса:
Так как энтропия увеличивается с повышением температуры, то можно считать, что мера беспорядка равна TS. Энтропия выражается в Дж/(моль.К).
Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS). При р = const и Т = const общую движущую силу процесса, которую обозначают G, можно найти из соотношения
∆G=(H2-H1)-(TS2-TS1); ∆G=∆H-T∆S
где: величина G называется изобарно-изотермическим потенциалом или энергией Гиббса.
Мерой химического сродства является убыль энергии Гиббса (G), которая зависит от природы вещества, его количества и температуры.
Энергия Гиббса является функцией состояния, поэтому
∆Gx.p.=∑ ∆Goбpпрод-∑∆Goбpисх (3)
Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и, в частности, в сторону уменьшения G. Если G < 0, процесс принципиально осуществим; если G>0, процесс самопроизвольно проходить не может. Чем меньше G, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором G = 0 и H= TS.
Из соотношения G = H – TS видно, что самопроизвольно могут протекать и процессы, для которых H>0 (эндотермические). Это возможно, когда S>0, но |TS| > |H| и тогда G<0. С другой стороны, экзотермические реакции (H<0) самопроизвольно не протекают, если при S<0 окажется, что G>0.
5.6. Второй и третий законы термодинамики. Для систем, которые не обмениваются с окружающей средой ни энергией, ни веществом (изолированные системы), второй закон термодинамики имеет следующую формулировку: в изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии: AS > 0.
Второй закон термодинамики имеет статистический характер, т.е.
справедлив лишь для систем, состоящих из очень большого числа
частиц.
Однако, если в системе протекает химическая реакция, то система обменивается энергией с окружающей средой, т.е. не является изолированной. Химические реакции обычно сопровождаются изменением как энтропии, так и энтальпии.
В отличие от других термодинамических функций, можно определить не только изменение, но абсолютное значение энтропии. Это вытекает из высказанного в 1911 г. М. Планком постулата, согласно которому «при абсолютном нуле энтропия идеального кристалла равна нулю». Этот постулат получил название третьего закона термодинамики.
Пример 1. В каком состоянии энтропия 1 моль вещества больше при одинаковой температуре: в кристаллическом или парообразном?
Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше объема 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре.
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе
СН4(г)+СО2 ↔ 2СО(г)+2Н2(г)
Решение. ВычислимΔG0298 прямой реакции. Значения ΔG0298соответствующих веществ приведены в табл. 16. Зная, что ΔG есть функция состояния и что ΔG для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим ΔG0298процесса:
∆G0298 = 2 (-137,27) +2 (0) — (-50,79-394,38) = +170,63 кДж
То, что ΔG0298> 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов равном 1,013 ∙ 105 Па (760 мм рт. ст. = 1 атм).
Таблица 16
Стандартная энергия Гиббса образования ΔG0298некоторых веществ
| Вещество | Состояние | ΔG0298, кДж/моль | Вещество | Состояние | ΔG0298, кДж/моль |
| ВаСО3 | к | -1138,8 | FeO | к | -244,3 |
| СаСО3 | к | -1128,75 | Н2О | ж | -237,19 |
| Fе3O4 | к | -1014,2 | Н2O | г | -228,59 |
| ВеСО3 | к | -944,75 | PbO2 | к | -219,0 |
| СаО | к | -604,2 | СО | г | -137,27 |
| ВеО | к | -581,61 | СН4 | г | -50,79 |
| NaF | к | -541,0 | NO2 | г | +51,84 |
| ВаО | к | -528,4 | NO | г | +86,69 |
| СО2 | г | -394,38 | C2H2 | г | +209,20 |
| NaCl | к | -384,03 | |||
| ZnO | к | -318,2 |
Таблица17
Стандартные абсолютные энтропии ΔS0298 некоторых веществ
| Вещество | Состояние | ΔS0298, Дж/(моль.К) | вещество | Состояние | ΔS0298,Дж/(моль.К) |
| С | Алмаз | 2,44 | Н2O | г | 188,72 |
| С | Графит | 5,69 | N2 | г | 191,49 |
| Fe | к | 27,2 | NН3 | г | 192,50 |
| Ti | к | 30,7 | СО | г | 197,91 |
| S | Ромб | 31,9 | с2H2 | г | 200,82 |
| TiO2 | к | 50,3 | O2 | г | 205,03 |
| FeO | к | 54,0 | H2S | г | 205,64 |
| H2O | ж | 69,94 | NO | г | 210,20 |
| Fе2О3 | к | 89,96 | CO2 | г | 213,65 |
| NH4C1 | к | 94,5 | C2H4 | г | 219,45 |
| СН3ОН | ж | 126,8 | Cl2 | г | 222,95 |
| Н2 | г | 130,59 | NO2 | г | 240,46 |
| Fе3O4 | к | 146,4 | РС13 | г | 311,66 |
| СН4 | г | 186,19 | PCl5 | г | 352,71 |
| НС1 | г | 186,68 |
Пример 3. На основании стандартных теплот образования (см. табл. 15) и абсолютных стандартных энтропий веществ (табл.17) вычислите ΔS0298 реакции, протекающей по уравнению
СО(г)+Н2О(ж)=СО2(г)+Н2(г)
Решение. ∆G0 = ∆H0 — TS0; ∆H и ∆S – функции состояния, поэтому
∆Н0х.р.=∑ ∆Н0прод — ∑ ∆Н0исх ; ∆S0x.p.= ∑S0прод — ∑ S0 исх
∆Н0х.р.=(-393,51+0) – (110,52 – 285,84) = +2,85 кДж
∆S0x.p.=(213,65+130,59)-(197,91+69,94) = +76,39 = 0,07639 кДж/(моль∙К);
∆G0= +2,85 – 298 ∙ 0,07639 = — 19,91 кДж
Пример 4. Реакция восстановления Fе2О3 водородом протекает по уравнению
Fe2O3(к)+3H2(г) = 2Fe(к)+3H2O(г) ; ∆Н=+96,61 кДж
Возможна ли эта реакция при стандартных условиях, если изменение энтропии S=0,1387 кДж/(мольК)? При какой температуре начнется восстановление Fе2О3?
Решение. Вычисляем ∆G0 реакции:
∆G = ∆Н-Т∆S = 96,61 – 298 ∙ 0,1387 = +55,28 кДж
Так как ∆G > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой∆G=0:
Следовательно, при температуре 696,5 К начнется реакция восстановления Fе2О3 Иногда эту температуру называют температурой начала реакции.
Пример 5. Вычислите ∆H0, ∆S и ∆G0 реакции, протекающей по уравнению
Fe2O3(к) + 3C = 2Fe + 3CO
Возможна ли реакция восстановления Fе2О3 углеродом при 500 и 1000 К?
Решение. ∆H0xp и ∆S0xp находим из соотношений (1) и (2) (см. разделы «Энергетика химических процессов. Термохимические расчеты» и «Химическое сродство»):
∆Н0x.p.= [3(-110,52)+2 ∙ 0] – [- 822,10 + 3 ∙ 0] = -331,56+822,10 = +490,54 кДж
∆S0x.p.=(2 ∙ 27,2+3 ∙ 197,91) – (89,96+3 ∙ 5,69) = 541,1 Дж/(моль ∙ К)
Энергию Гиббса при соответствующих температурах находим из соотношения
Так как ∆G500>0, a ∆G1000<0, то восстановление Fе2О3 возможно при 1000 К и невозможно при 500 К.