Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атом кислорода в спиртах находится в состоянии sp3-гибридизации.
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78оС).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде.
Этанол смешивается с водой в любых соотношениях.
Изомерия спиртов
Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.
Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат:
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир:
4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
Например, этанол окисляется оксидом меди до уксусного альдегида
Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
Например, уравнение сгорания этанола:
C2H5OH + 3O2 = 2CO2 + 3H2O
5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
Например, при дегидрировании этанола образуется этаналь
Получение этанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
Например, при гидрировании этаналя образуется этанол
4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
| Этанол | |
|---|---|
 |
|
 |
|
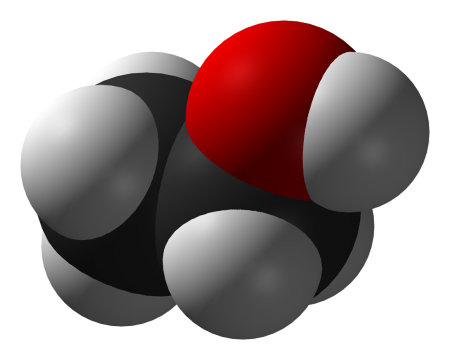 |
|
| Систематическое наименование |
Этанол |
| Традиционные названия | Этиловый спирт |
| Хим. формула | C2H5OH |
| Рац. формула | СH3СH2OH |
| Состояние | жидкость |
| Молярная масса | 46,069 г/моль |
| Плотность | 0,7893 г/см³ |
| Поверхностное натяжение | 22,39×10−3 Н/м при 20 °C Н/м |
| Энергия ионизации | 10,47 ± 0,01 эВ |
| Т. плав. | -114,3 °C |
| Т. кип. | +78,4 °C |
| Т. всп. | 13 °C |
| Т. свспл. | +363 °C |
| Пр. взрв. | 3,28 — 18,95 % |
| Тройная точка | -114,3 °C, ? Па |
| Кр. точка | +241 °C, 63 бар |
| Мол. теплоёмк. | 112,4 Дж/(моль·К) |
| Энтальпия образования | −234,8 кДж/моль |
| Давление пара | 44 ± 1 мм рт.ст. и 58 гПа |
| pKa | 15,9 |
| Растворимость в воде | неограничена |
| Показатель преломления | 1,3611 |
| Дипольный момент | (газ) 1,69 Д |
| ГОСТ | ГОСТ 17299-78 ГОСТ Р 55878-2013 ГОСТ 18300-87 ГОСТ 5962-2013 ГОСТ Р 51999-2002 ГОСТ Р 52574-2006 |
| Рег. номер CAS | 64-17-5 |
| PubChem | 702 |
| Рег. номер EINECS | 200-578-6 |
| SMILES |
CCO |
| InChI |
1S/C2H6O/c1-2-3/h3H,2H2,1H3 LFQSCWFLJHTTHZ-UHFFFAOYSA-N |
| Кодекс Алиментариус | E1510 |
| RTECS | KQ6300000 |
| ChEBI | 16236 |
| Номер ООН | 1170 |
| ChemSpider | 682 |
| ЛД50 | 10 300 мг/кг |
| Токсичность |
метаболит, малотоксичен |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Этанол (этиловый спирт, метилкарбинол, винный спирт или алкоголь, часто в просторечии просто «спирт») — одноатомный спирт с формулой C2H5OH (эмпирическая формула C2H6O), рациональная формула: CH3-CH2-OH, аббревиатура EtOH, второй представитель гомологического ряда одноатомных спиртов, при стандартных условиях летучая, горючая, бесцветная прозрачная жидкость.
Действующий компонент алкогольных напитков является депрессантом — психоактивным веществом, угнетающим центральную нервную систему человека.
Этиловый спирт также используется как топливо, в качестве растворителя, как наполнитель в спиртовых термометрах и как дезинфицирующее средство (или как компонент его).
Содержание
- 1 Получение
- 1.1 Брожение
- 1.1.1 Промышленное производство спирта из биологического сырья
- 1.1.2 Гидролизное производство
- 1.2 Гидратация этилена
- 1.3 Очистка этанола
- 1.4 Абсолютный спирт
- 1.1 Брожение
- 2 Свойства
- 2.1 Физические свойства
- 2.2 Химические свойства
- 2.3 Пожароопасные свойства
- 3 Применение
- 3.1 Топливо
- 3.2 Химическая промышленность
- 3.3 Медицина
- 3.4 Парфюмерия и косметика
- 3.5 Пищевая промышленность
- 3.6 Прочее
- 4 Мировое производство этанола
- 5 Применение этанола в качестве автомобильного топлива
- 5.1 Автомобильный парк, работающий на этаноле
- 5.2 Экономичность
- 5.3 Экологические аспекты
- 6 Безопасность и регулирование
- 7 Действие этанола на организм человека
- 8 Виды и марки этанола
- 9 Этимология названий
- 9.1 Этимология термина «этанол»
- 9.2 Этимология названия «алкоголь»
- 9.3 Этимология слова «спирт»
Получение
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена).
Брожение
См. также: Биоэтанол § Брожение
Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала картофеля, риса, кукурузы. Источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её результат можно выразить уравнением:
-
- C6H12O6 → 2C2H5OH + 2CO2
Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путём дистилляции.
Для получения этанола этим способом наиболее часто используют различные штаммы дрожжей вида Saccharomyces cerevisiae, в качестве питательной среды предварительно обработанные древесные опилки и/или раствор, полученный из них.
Промышленное производство спирта из биологического сырья
Современная промышленная технология получения этилового спирта из пищевого сырья включает следующие стадии:
- Подготовка и измельчение крахмалистого сырья — зерна (прежде всего — ржи, пшеницы), картофеля, кукурузы, яблок и т. п.
- Ферментация. На этой стадии происходит ферментативное расщепление крахмала до сбраживаемых сахаров. Для этих целей применяются рекомбинантные препараты альфа-амилазы, полученные биоинженерным путём — глюкамилаза, амилосубтилин.
- Брожение. Благодаря сбраживанию дрожжами сахаров происходит накопление в браге спирта.
- Брагоректификация. Осуществляется на разгонных колоннах.
Отходами бродильного производства являются углекислый газ, барда, эфиро-альдегидная фракция, сивушный спирт и сивушные масла.
Спирт, поступающий из брагоректификационной установки (БРУ), не является безводным, содержание этанола в нём до 95,6 %. В зависимости от содержания в нём посторонних примесей, его разделяют на следующие категории:
- Альфа
- Люкс
- Экстра
- базис
- высшей очистки
- 1 сорт
Производительность современного спиртового завода составляет около 30 000—100 000 литров спирта в сутки.
Гидролизное производство
Основная статья: Гидролизный спирт
В промышленных масштабах этиловый спирт получают из сырья, содержащего целлюлозу (древесина, солома), которую предварительно гидролизуют. Образовавшуюся при этом смесь пентоз и гексоз подвергают спиртовому брожению. В странах Западной Европы и Америки эта технология не получила распространения, но в СССР (ныне в России) существовала развитая промышленность кормовых гидролизных дрожжей и гидролизного этанола.
Гидратация этилена
В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
- прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
-
- CH2 = CH2 + H2O → C2H5OH
- гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа):
-
- CH2 = CH2 + H2SO4 → CH3CH2OSO2OH
-
- CH3CH2OSO2OH + H2O → CH3CH2OH + H2SO4
Эта реакция осложняется параллельной реакцией образования диэтилового эфира.
Очистка этанола
Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95,6 % (мас.); эта неразделимая перегонкой азеотропная смесь содержит 4,4 % воды (мас.) и имеет температуру кипения 78,15 °C.
Перегонка освобождает этанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт
Абсолютный спирт — этиловый спирт, практически не содержащий воды. Он кипит при температуре 78,39 °C, в то время как спирт-ректификат, содержащий не менее 4,43 % воды, кипит при 78,15 °C. Получают перегонкой водного спирта, содержащего бензол, и другими способами, например, спирт обрабатывают веществами, реагирующими с водой или поглощающими воду, такими, как негашёная известь CaO или прокалённый медный купорос CuSO4.
Свойства
Физические свойства
В обычных условиях представляет собой бесцветную, легкоподвижную, летучую жидкость с характерным запахом и сладковато-жгучим вкусом.
Плотность этилового спирта 0,7905 г/см3 при 20 °C, он легче воды.
Является хорошим растворителем многих органических веществ и некоторых неорганических солей.
Физические свойства абсолютированного этанола (100 %) немного отличаются от свойств спирта-ректификата с концентрацией 95,57 %. Их свойства почти одинаковы, но численные величины различаются на 0,1—0,01 %.
| Молекулярная масса | 46,069 а. е. м. |
| Температура плавления | −114,15 °C |
| Температура кипения | 78,39 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | Смешивается в произвольных отношениях с бензолом, водой, глицерином, диэтиловым эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом |
| Показатель преломления | Показатель преломления (для D-линии натрия) 1,3611 (при 20 °C) (температурный коэффициент показателя преломления −4,0⋅10−4/°C, почти постоянный в интервале температур 10—30 °C) |
| Стандартная энтальпия образования ΔH | −234,8 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 281,38 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 1,197 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 4,81 кДж/моль |
| Энтальпия кипения ΔHкип | 839,3 кДж/моль |
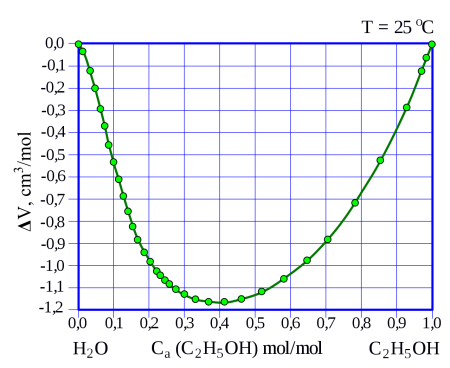
Уменьшение объёма смеси при смешивании этанола с водой при разных мольных долях этанола в растворе. При мольной доле в 40 % снижение объёма максимально.
Смесь по массе 95,57 % этанола и 4,43 % воды является азеотропной, т. е. не разделяется при перегонке, кипит при нормальном давлении при температуре 78,174 °C, в то время как абсолютированный этанол имеет более высокую точку кипения 78,39 °C.
С водой этанол смешивается в произвольном отношении, при смешивании наблюдается значительное, до нескольких процентов уменьшение объёма смеси относительно исходного суммарного объёма чистых веществ, например, при смешивании 50 мл этанола с 50 мл воды образуется 97 мл раствора. Также смешивание сопровождается некоторым нагревом смеси.
Абсолютный этанол затвердевает при температуре −114,5 °C. Температура плавления смесей этанола с водой уменьшается при увеличении концентрации этанола в растворе и достигает минимума при массовой концентрации этанола в воде равной 93,5 % — эвтектики этанол-вода, имеющей температуру плавления −118 °C. При низких температурах, ниже −20 °С водный раствор этанола (96 %) практически не испаряется и превращается в вязкую жидкость. При −70 °C он становится ещё более вязким и по текучести напоминает густой мёд.
Химические свойства
Анимация трёхмерной модели молекулы этанола
Типичный представитель одноатомных спиртов.
Горюч. Легко воспламеняется. При достаточном доступе воздуха горит (за счёт его кислорода) светлым голубоватым пламенем, образуя терминальные продукты окисления — диоксид углерода и воду:
-
- C2H5OH + 3O2 → 2CO2 + 3H2O
Ещё энергичнее эта реакция протекает в атмосфере чистого кислорода.
При определённых условиях (температура, давление, катализаторы) возможно и контролируемое окисление (как элементным кислородом, так и многими другими окислителями) до ацетальдегида, уксусной кислоты, щавелевой кислоты и некоторых других продуктов, например:
- 3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
Обладает слабо выраженными кислотными свойствами, в частности, подобно кислотам взаимодействует со щелочными металлами, а также магнием, алюминием и их гидридами, выделяя при этом водород и образуя солеподобные этилаты, являющиеся типичными представителями алкоголятов:
-
- 2C2H5OH + 2K → 2C2H5OK + H2
-
- C2H5OH + NaH → C2H5ONa + H2
Обратимо реагирует с карбоновыми и некоторыми неорганическими кислородсодержащими кислотами с образованием сложных эфиров:
-
- C2H5OH + RCOOH ⇄ RCOOC2H5 + H2O
-
- C2H5OH + HNO2 ⇄ C2H5ONO + H2O
С галогеноводородами (HCl, HBr, HI) вступает в обратимые реакции нуклеофильного замещения:
-
- C2H5OH + HX ⇄ C2H5X + H2O
Без катализаторов реакция с HCl идет относительно медленно; значительно быстрее — в присутствии хлорида цинка и некоторых других кислот Льюиса.
Вместо галогеноводородов для замещения гидроксильной группы на галоген могут быть использованы галогениды и галогеноксиды фосфора, тионилхлорид и некоторые другие реагенты, например:
-
- 3C2H5OH + PCl3 → 3C2H5Cl + H3PO3
Сам этанол также обладает нуклеофильными свойствами. В частности, он относительно легко присоединяется по активированным кратным связям, например:
-
- C2H5OH + CH2 = CHCN → C2H5OCH2CH2CN
реагирует с альдегидами с образованием полуацеталей и ацеталей:
-
- C2H5OH + RCHO → RCH(OH)OC2H5
-
- C2H5OH + RCH(OH)OC2H5 → RCH(OC2H5)2 + H2O
При умеренном (не выше 120 °C) нагревании с концентрированной серной кислотой или другими водоотнимающими средствами кислотного характера образует диэтиловый эфир:
-
- 2C2H5OH → C2H5OC2H5
При более сильном нагревании с серной кислотой, а также при пропускании паров над нагретым до 350÷500 °C оксидом алюминия происходит более глубокая дегидратация. При этом образуется этилен:
-
- C2H5OH → CH2 = CH2 + H2O
При использовании катализаторов, содержащих наряду с оксидом алюминия высокодисперсное серебро и другие компоненты, процесс дегидратации может быть совмещён с контролируемым окислением этилена элементным кислородом, в результате чего с удовлетворительным выходом удается реализовать одностадийный процесс получения окиси этилена:
-
- 2C2H5OH + O2 → 2C2H4O + 2H2O
В присутствии катализатора, содержащего оксиды алюминия, кремния, цинка и магния, претерпевает серию сложных превращений с образованием в качестве основного продукта бутадиена (реакция Лебедева):
-
- 2C2H5OH → CH2 = CH — CH = CH2 + 2H2O + O2
В 1932 году на основе этой реакции в СССР было организовано первое в мире крупнотоннажное производство синтетического каучука.
В слабощелочной среде образует иодоформ:
-
- C2H5OHA + 4I2 + 6NaHCO3 → CHI3 + HCOONa + 5NaI + 5H2O + 6CO2
Эта реакция имеет некоторое значение для качественного и количественного определения этанола в отсутствии других веществ, дающих подобную реакцию.
Пожароопасные свойства
Легковоспламеняющаяся бесцветная жидкость; давление насыщенного пара, кПа: lg p = 7.81158-1918.508/(252.125+t) при температуре от −31 до 78°С; теплота сгорания — 1408 кДж/моль; теплота образования −239,4 кДж/моль; температура вспышки 13°С (в закрытом тигле), 16°С (в открытом тигле); температура воспламенения 18°С; температура самовоспламенения 400°С; концентрационные пределы распространения пламени 3,6—17,7 % объёма; температурные пределы распространения пламени: нижний 11°С, верхний 41°С; минимальная флегматизирующая концентрация, % объёма: CO2 — 29.5, H2O — 35.7, N2 — 46; максимальное давление взрыва 682 кПа; максимальная скорость нарастания давления 15,8 МПа/с; скорость выгорания 0,037 кг/(м2•с); максимальная нормальная скорость распространения пламени — 0,556 м/с; минимальная энергия зажигания — 0,246 МДж; минимальное взрывоопасное содержание кислорода 11,1 % объёма.
Применение
Топливо
Первым использовал этанол в качестве моторного топлива Генри Форд, который в 1880 г. создал первый автомобиль, работающий на этаноле. Возможность использования спиртов в качестве моторного топлива была показана также в 1902 г., когда на конкурсе в Париже были выставлены более 70 карбюраторных двигателей, работающих на этаноле и смесях этанола с бензином.
Этанол может использоваться как топливо, в т. ч. для ракетных двигателей (так, 75%-й водный этанол использовался в качестве топлива в первой в мире серийной баллистической ракете — немецкой «Фау-2» и ранних советских ракетах конструкции Королёва — от Р-1 до Р-5), двигателей внутреннего сгорания, бытовых, походных и лабораторных нагревательных приборов (т. н. «спиртовок»), грелок для туристов и военнослужащих (каталитическое автоокисление на платиновом катализаторе). Ограниченно (в силу своей гигроскопичности) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов — Этил-трет-бутилового эфира, более независимого от ископаемой органики, чем МТБЭ.
Химическая промышленность
- служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
- широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
- является компонентом антифризов и стеклоомывателей;
- в бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
Медицина
В медицине этиловый спирт в первую очередь используется как растворитель, экстрагент и антисептик
См. также: Медицинский антисептический раствор
- по своему действию этиловый спирт можно отнести к антисептикам;
- как обеззараживающее и подсушивающее средство, наружно;
- подсушивающие и дубящие свойства 97%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
- растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.;
- консервант настоек и экстрактов (минимальная концентрация 18 %);
- пеногаситель при подаче кислорода, искусственной вентиляции лёгких;
- в согревающих компрессах;
- для физического охлаждения при лихорадке (для растирания);
- компонент общей анестезии в ситуации дефицита медикаментозных средств;
- как пеногаситель при отёке лёгких в виде ингаляции 33 % раствора;
- этанол является противоядием при отравлении некоторыми токсичными спиртами, такими, как метанол и этиленгликоль. Его действие обусловлено тем, что фермент алкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного (почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола — формальдегида и муравьиной кислоты, для этиленгликоля — щавелевой кислоты).
Парфюмерия и косметика
Является универсальным растворителем различных веществ и основным компонентом духов, одеколонов, аэрозолей и т. п. Входит в состав разнообразных средств, включая зубные пасты, шампуни, средства для душа, и т. д.
Пищевая промышленность
Наряду с водой, является основным компонентом спиртных напитков (водка, вино, джин, пиво и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1—3 % этанола (в крепком до 4,5 %), в квасе — от 0,5 до 1,2 %.
Растворитель для пищевых ароматизаторов. Может быть использован как консервант для хлебобулочных изделий, а также в кондитерской промышленности.
Зарегистрирован в качестве пищевой добавки E1510.
Энергетическая ценность этанола — 7,1 ккал/г.
Прочее
Применяется для фиксирования и консервирования биологических препаратов.
Мировое производство этанола
Производство этанола по странам, млн литров.
| Страна | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 |
|---|---|---|---|---|---|---|---|
| США | 13 362 | 16 117 | 19 946 | 24 565 | 34 776 | 40 068 | 45 360 |
| Бразилия | 15 078 | 15 978 | 16 977 | 18 972,58 | 24 464,9 | — | — |
| Евросоюз | — | — | — | 2 155,73 | 2 773 | — | — |
| Китай | 3 643 | 3 795 | 3 845 | 1 837,08 | 1 897,18 | — | — |
| Индия | 1 746 | 1 697 | 1 897 | 199,58 | 249,48 | — | — |
| Франция | 827 | 907 | 948 | — | — | — | — |
| Германия | 268 | 430 | 764 | — | — | — | — |
| Россия | 760 | 860 | 608 | 609 | 536 | 517 | 700 |
| ЮАР | 415 | 389 | 387 | — | — | — | — |
| Великобритания | 400 | 351 | 279 | — | — | — | — |
| Испания | 298 | 298 | 463 | — | — | — | — |
| Таиланд | 279 | 298 | 352 | 299,37 | 339,4 | — | — |
| Колумбия | — | — | 279 | 283,12 | 299,37 | — | — |
| Весь мир: | 40 710 | 45 927 | 50 989 | 49 524,42 | 65 527,05 | — | — |
Применение этанола в качестве автомобильного топлива
Основная статья: Биоэтанол
Топливный этанол делится на биоэтанол и этанол, полученный другими методами (из отходов пластмасс, синтезированный из газа и т. п.).
Биоэтанол — это жидкое этанолсодержащее топливо, получаемое специальными заводами из крахмал-, целлюлозно- или сахаросодержащего сырья по системе укороченной дистилляции (позволяет получать качество, достаточное для использования в качестве топлива). Содержит метанол и сивушные масла, что делает его совершенно непригодным для питья. Применяется в чистом виде (точнее в виде азеотропа 96,6 %), а чаще в смеси с бензином (так называемый газохол) или дизельным топливом. Производство и использование биоэтанола увеличивается в большинстве стран мира, как более экологичная и возобновляемая альтернатива нефти.
Полноценно использовать биоэтанол способны лишь автомобили с соответствующим двигателем или с универсальным Flex-Fuel (способен потреблять смеси бензин/этанол с любым соотношением). Бензиновый двигатель способен потреблять бензин с добавкой этанола не более 30 %, возможно также переоборудование обычного бензинового двигателя, но это экономически нецелесообразно.
Проблемой является недостаточная смешиваемость бензина и дизельного топлива с этанолом, из-за чего последний нередко выслаивается (при низких температурах всегда). Особенно эта проблема актуальна для России. Решения этой проблемы на данный момент не найдено.
Преимуществом смесей этанола с другими видами топлива перед «чистым» этанолом является лучшая зажигаемость, благодаря низкому содержанию влаги, тогда как «чистый» этанол (марка E100, с практическим содержанием C2H5OH 96,6 %) является неразделяемым дистилляцией азеотропом. Разделение же иными способами невыгодно. При добавлении этанола к бензину или дизелю происходит выслаивание воды.
В разных странах действуют следующие государственные программы применения этанола и содержащих его смесей на транспорте с двигателями внутреннего сгорания:
| Страна | Требования |
|---|---|
| Бразилия | 22—25 % этанола в бензине, 2 % в дизельном топливе, доступны высокоэтанольные марки (E85, E100), их процент на рынке плавно увеличивают. Основной источник — сахарный тростник. Около 45 % мирового производства. |
| США | На США приходится 44,7 % мирового производства топливного спирта. Внедряются марки смеси этанола и бензина (E85, E10). Предполагается ввести 20 % к 2020 году. |
| Венесуэла | 10 % этанола в бензине. |
| Евросоюз | До ~6 % добавляется в обязательном порядке, внедряются этанольные марки E10 и выше. |
| Китай | Производит ежегодно 3 млн тонн к 2010 году. |
| Аргентина | Обязательна 5 % добавка этанола в любых марках бензина, внедряются марки с большим содержанием. |
| Таиланд | 5 % этанола является минимальным допустимым содержанием в бензине. |
| Украина | Законодательно установлено содержание 5 % этанола в бензине с 2013, и 7 % с 2014 года. На заправках широко продается топливо с содержанием биоэтанола от 30 до 37,2 % |
| Колумбия | 10%-я смесь в больших городах к сентябрю 2005 года. |
| Канада | 5%-я смесь с сентября 2010 года |
| Япония | Разрешено 3%-е содержание этанола в бензине и менее. |
| Индия | 20 % биотоплив к 2017 году. Сейчас 5 %. Производится из самого различного сырья, в частности из древесной стружки. |
| Австралия | Этанола в бензине не более 10 %, марка E10. |
| Индонезия | 10 % спирта в бензине. |
| Филиппины | E10 постепенно внедряется. |
| Ирландия | Марки E5-E10 достаточно широко применяются и продолжат внедряться. |
| Дания | Аналогично Ирландии. |
| Чили | Разрешено 2 % содержание этанола в автомобильном топливе. |
| Мексика | 3,2 % биотоплива в автомобильном топливе к 2012 году обязательно. В Америке самая неохотно внедряющая биотопливо страна. |
В США «Энергетический билль», подписанный президентом Бушем в августе 2005 года, предусматривает производство к 2012 году ежегодно 30 миллиардов литров этанола из зерна и 3,8 миллиардов литров из целлюлозы (стебли кукурузы, рисовая солома, отходы лесной промышленности).
Внедрение производства биотоплива является затратным процессом, однако дает экономике преимущества впоследствии. Так, например, строительство завода по производству этанола мощностью 40 млн галлонов даёт экономике (на примере США):
- 142 млн долл. инвестиций во время строительства;
- 41 рабочее место на заводе, плюс 694 рабочих места во всей экономике;
- Увеличивает местные цены на зерновые на 5—10 центов за бушель;
- Увеличивает доходы местных домохозяйств на 19,6 млн долл. ежегодно;
- Приносит в среднем 1,2 млн долларов налогов;
- Доходность инвестиций 13,3 % годовых.
В 2006 г. этаноловая индустрия дала экономике США:
- 160231 новых рабочих мест во всех секторах, включая 20000 рабочих мест в строительстве;
- Увеличила доходы домохозяйств на $6,7 миллиарда;
- Принесла $2,7 млрд федеральных налогов и $2,3 млрд местных налогов.
В 2006 году в США было переработано в этанол 2,15 миллиарда бушелей кукурузы, что составляет 20,5 % годового производства кукурузы. Этанол стал третьим по величине потребителем кукурузы после животноводства и экспорта. На этанол перерабатывается 15 % урожая сорго США.
Производство барды этаноловой промышленностью США, метрических тонн в сухом весе.
| 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2020 прогноз |
|---|---|---|---|---|---|---|---|---|
| 2,3 млн. | 2,7 млн. | 3,1 млн | 3,6 млн. | 5,8 млн. | 7,3 млн. | 9,0 млн. | 12 млн. | 20 млн. |
Барда является вторичным кормовым сырьём, а также может быть использована для получения биогаза.
Автомобильный парк, работающий на этаноле
Смесь этанола с бензином обозначается буквой Е. Цифрой у буквы Е обозначается процентное содержание этанола. Е85 означает смесь из 85 % этанола и 15 % бензина.
Смеси до 20 % содержания этанола могут применяться на любом автомобиле. Однако некоторые производители автомобилей ограничивают гарантию при использовании смеси с содержанием более 10 % этанола. Смеси, содержащие более 20 % этанола, во многих случаях требуют внесения изменения в систему зажигания автомобиля.
Автопроизводители выпускают автомобили, способные работать и на бензине, и на Е85. Такие автомобили называются «Flex-Fuel». В Бразилии такие автомобили называют «гибридными». В русском языке названия нет. Большинство современных автомобилей либо изначально поддерживают использование такого топлива, либо опционально, по соответствующему запросу.
В 2005 году в США более 5 млн автомобилей имели гибридные двигатели. В конце 2006 г. в США эксплуатировалось 6 млн автомобилей с такими двигателями. Общий автопарк составляет 230 млн автомобилей.
1200 заправочных станций продают Е85 (май 2007). Всего в США автомобильное топливо продают около 170 000 заправочных станций.
В Бразилии около 29 000 заправочных станций продают этанол.
Экономичность
Себестоимость бразильского этанола (около 0,19 долларов США за литр в 2006 г.) делает его использование экономически выгодным.
Экологические аспекты
Биоэтанол как топливо часто называют «нейтральным» в качестве источника парниковых газов. Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующем сгорании выделяется столько же CO2, сколько до этого было взято из атмосферы использованными для его производства растениями. Однако ректификация этанола требует дополнительных затрат энергии, вырабатываемой одним из «традиционных» способов (в том числе и сжиганием ископаемого топлива).
В 2006 году применение этанола в США позволило сократить выбросы около 8 млн тонн парниковых газов (в CO2 эквиваленте), что примерно равно годовым выхлопам 1,21 млн автомобилей.
Безопасность и регулирование
- Этанол — горючее вещество, смесь его паров с воздухом взрывоопасна.
- Спирт этиловый синтетический, технический и пищевой, непригодный для производства алкогольной продукции, входит в список ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации.
- С 2005 года розничная продажа спирта в России запрещена (за исключением районов Крайнего Севера).
- О налогообложении питьевого спирта см. Алкогольные напитки — Акциз
Действие этанола на организм человека
Основные статьи: Токсикология этанола, Алкоголизм
В биохимии этанола существенную роль играет тот факт, что он образует растворы в широком диапазоне пропорций как с водой, так и с жирами. Является побочным продуктом метаболизма глюкозы, в крови здорового человека может содержаться до 0,01% эндогенного этанола.
В зависимости от дозы, концентрации, пути попадания в организм и длительности воздействия этанол также может обладать наркотическим и токсическим действием. Под наркотическим действием обозначается его способность вызвать кому, ступор, нечувствительность к боли, угнетение функций ЦНС, алкогольное возбуждение, привыкание, а также его наркозное действие. Под действием этанола происходит выделение эндорфинов в прилежащем ядре (Nucleus accumbens), у страдающих алкоголизмом также в орбитофронтальной коре (поле 10). Тем не менее с юридической точки зрения этиловый спирт наркотиком не признан, так как это вещество не включено в международный список контролируемых веществ конвенции ООН 1988 года. В определённых дозах к массе тела и концентрациях приводит к острому отравлению и смерти (смертельная разовая доза — 4—12 граммов этанола на килограмм массы тела).
Основной метаболит этанола ацетальдегид является токсичным, мутагенным и канцерогенным веществом. Существуют доказательства канцерогенности ацетальдегида в экспериментах на животных; кроме того, ацетальдегид повреждает ДНК.
Длительное употребление этанола может вызвать такие заболевания, как цирроз печени, гастрит, некротизирующий панкреатит, язва желудка, рак груди, рак желудка и рак пищевода (то есть является канцерогеном), гемолитическая анемия, артериальная гипертензия, инсульт, стать причиной внезапной смерти людей, страдающих ишемической болезнью сердца; может вызвать серьёзные нарушения обмена веществ. Алкоголь может увеличить риск рождения ребёнка с врождёнными аномалиями нервной системы и обусловить задержку роста.
Употребление этанола может вызвать оксидативное повреждение нейронов головного мозга, а также их гибель вследствие повреждения гемато-энцефалического барьера.
Злоупотребление алкогольными напитками может привести к клинической депрессии и алкоголизму.
Приём алкогольных напитков на фоне приёма лекарств очень нежелателен, так как алкоголь извращает действие лекарственных средств и вследствие этого становится опасен для жизни человека. Отрицательное влияние алкогольных напитков на результаты фармакотерапии многообразно и зависит от различных факторов: индивидуальных свойств больного, его чувствительности, тяжести заболевания, но во всех случаях у пациентов, принимающих лекарства и потребляющих алкоголь, эффективность фармакотерапии ослабляется, а порой и сводится на нет.
Этанол может в небольших количествах синтезироваться в просвете желудочно-кишечного тракта в результате процессов ферментации углеводной пищи микроорганизмами (условный эндогенный алкоголь). Существование биохимических реакций с синтезом этанола в тканях организма человека (истинно эндогенный алкоголь) полагается возможным, но не доказано к настоящему моменту. Количество эндогенного алкоголя редко превышает 0,18 промилле, что находится на границе чувствительности самых современных приборов. Обычный алкотестер такие количества определить не может.
Виды и марки этанола
- Ректификат (точнее, спирт-ректификат) — это очищенный путём ректификации этиловый спирт, содержит 95,57 %, химическая формула C2H5OH.
- Спирт этиловый абсолютированный — содержание спирта >99,9 %.
- Спирт медицинский — содержание спирта 96,4—97 %.
Этимология названий
Для обозначения данного вещества используется несколько наименований. Технически наиболее правильным является термин этанол или этиловый спирт. Однако значительное распространение получили названия алкоголь, винный спирт или просто спирт, хотя спирты, или алкоголи — это более широкий класс веществ.
Этимология термина «этанол»
Названия этанол и этиловый спирт указывают на то, что данное соединение содержит в своей основе этил — радикал этана. При этом слово спирт (суффикс -ол) в названии указывает на содержание гидроксильной группы (-OH), характерной для спиртов.
Этимология названия «алкоголь»
Название алкоголь происходит от араб. الكحل аль-кухуль, означающего мелкий порошок, полученный возгонкой, порошкообразная сурьма, порошок для подкрашивания век. В средневековой латыни словом лат. alcohol обозначали порошки, дистиллированную воду.
В русский язык слово «алкоголь» пришло через его немецкий вариант нем. alkohol. Однако в русском языке сохранился в виде архаизма, по всей видимости, и омоним слова «алкоголь» в значении «мелкий порошок».
Этимология слова «спирт»
Наименование этанола винный спирт произошло от лат. spiritus vini (дух вина). В русский язык слово «спирт» пришло через английский его вариант англ. spirit.
В английском языке слово «спирт» в данном значении использовалось уже в середине XIII века, и только начиная с 1610 года слово «спирт» стало употребляться алхимиками для обозначения летучих веществ, что соответствует основному значению слова «spiritus» (испарения) в латинском языке. К 1670-м годам значение слова сузилось до «жидкостей с высоким процентным содержанием алкоголя», а летучие жидкости получили название эфиров.
См. также Этимология названия в статье «Спирты».
|
Спирты |
|
|---|---|
| (0°) |
Метанол |
| Первичные спирты (1°) |
Этанол · Пропанол · н-Бутанол · Изобутанол · Амиловый спирт · Гексанол · Гептанол · Жирные спирты: Октанол (C8) · Нонанол (C9) · Деканол (C10) · Ундеканол (C11) · Додеканол (C12) · Тетрадеканол (C14) · Цетиловый спирт (C16) |
| Вторичные спирты (2°) |
Изопропиловый спирт · втор-Бутанол · Гексан-2-ол |
| Третичные спирты (3°) |
трет-Бутанол · 2-Метилбутан-2-ол |
|
Алкогольные напитки |
|
|---|---|
| Высокоалкогольные (66—96 %) |
|
| Крепкие (31—65 %) |
|
| Среднеалкогольные (9—30 %) |
|
| Слабоалкогольные (1,5—8 %) |
|
определение. Токсикологическое
значение метаболизм.
Этиловый спирт C2H5OH
(этанол) – бесцветная летучая жидкость
с характерным запахом, жгучая на вкус.
Этиловый спирт горит синеватым пламенем,
смешивается во всех отношениях с водой,
диэтиловым эфиром и многими другими
органическими растворителями.
Действие на организм и токсичность.
Этиловый спирт может поступать в
организм несколькими путями: при приеме
внутрь, при внутривенном введении, а
также через легкие в виде паров с
вдыхаемым воздухом.
Поступивший в организм этиловый спирт
действует на кору головного мозга. При
этом наступает опьянение с характерным
алкогольным «возбуждением». Это
возбуждение не является результатом
усиления возбудительного процесса, а
возникает из-за ослабления процесса
торможения. Таким образом, под влиянием
алкоголя проявляется преобладание
процессов возбуждения над процессами
торможения. В больших дозах этиловый
спирт вызывает угнетение функций
как спинного, так и продолговатого
мозга. При этом может наступить состояние
длительного глубокого наркоза с
потерей рефлексов и угнетением жизненно
важных центров. Под влиянием этилового
спирта может наступить смерть в результате
паралича дыхательного центра.
О токсичности этилового спирта
свидетельствует наличие случаев
острых отравлений этим спиртом. В
последнее десятилетие острые отравления
этиловым спиртом занимают первое место
(около 60%) среди отравлений другими
токсическими веществами. Алкоголь
не только вызывает острые отравления,
но и способствует скоропостижной смерти
от других заболеваний (прежде всего, от
заболеваний сердечно-сосудистой
системы).
Степень токсичности этилового спирта
зависит от дозы, концентрации его в
напитках, от наличия в них сивушных
масел и других примесей, прибавляемых
для придания напиткам определенного
запаха и вкуса. Ориентировочно смертельной
дозой для человека считается 6—8 мл
чистого этилового спирта на 1 кг массы
тела. В пересчете на всю массу тела это
составляет 200—300 мл этилового спирта.
Однако эта доза может изменяться в
зависимости от чувствительности к
этиловому спирту, условий его приема
(крепость напитков, наполненность
желудка пищей) и т. д. У одних лиц смерть
может наступить после приема 100— 150 г
чистого этилового спирта, в то время
как у других лиц смерть не наступает и
после приема 600—800 г этого спирта.
Длительное злоупотребление этиловым
спиртом приводит к хроническому
отравлению (алкоголизму). Повторные
приемы алкоголя приводят к развитию
привыкания, в результате которого
малые дозы этого спирта перестают
вызывать прежнее эйфорическое состояние.
Чтобы вызвать эйфорическое состояние,
таким лицам со временем требуется
повышенная доза этилового спирта.
Одновременно с привыканием вырабатывается
пристрастие, а затем развивается
алкогольная зависимость (алкоголизм),
которая характеризуется тягостными
переживаниями без употребления
алкоголя и сильным желанием повторных
его приемов.
Метаболизм: в основном протекает в
печени при участии фермента
алкагольдегидрогеназы, где образуется
ацетальдегид, далее при участии другой
группы ферментов ацетальдегид распадается
до углекислого газа и воды.
Изолирование
Метод дистилляции с водяным паром.
Качественное обнаружение и количественное
определение
Качественные реакции:
-
йодоформная проба – в щелочной среде
образуется йодоформ:
C2H5OH
+ 4J2
+ 6KOH = CHJ3
+ 5KJ + HCOOK + 5H2O
-
реакция образования сложных эфиров:
С2H5OH
+ CH3COOH
= CH3COOC2H5
+ H2O
в присутствии водоотнимающего
средства – концентрированной серной
кислоты
Приобретает ароматический запах
Количественное определение (см. вопрос
№ 35).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Чтобы поделиться, нажимайте
Постановка опытов и текст – к.п.н. Павел Беспалов.
Физические свойства спиртов
Одноатомные спирты, содержащие в своем составе до десяти атомов углерода, в обычных условиях — жидкости. Спирты, в составе которых 11 атомов углерода и более — твердые тела. Этиловый, бутиловый и изоамиловый спирт – жидкости.
Посмотрим, как спирты растворяются в воде. В три пробирки нальем по нескольку миллилитров спиртов и прибавим к ним подкрашенную воду. Спирты имеют плотность меньше единицы, поэтому они образуют верхний слой. При взбалтывании пробирок происходит полное растворение этилового спирта, частично растворяется бутиловый спирт, почти не растворяется изоамиловый спирт. Краситель из водного раствора переходит в спирты. С повышением молекулярной массы и увеличением углеводородного радикала растворимость спиртов в воде уменьшается.
Оборудование: пробирки, штатив для пробирок, стаканы.
Техника безопасности. Соблюдать правила работы с огнеопасными жидкостями.
Взаимодействие этилового спирта с бромоводородом
Спирты взаимодействуют с галогеноводородами. В прибор для получения галоидоалканов наливаем смесь этилового спирта с концентрированной серной кислотой. Прибавим к смеси вначале несколько капель воды, а затем – бромид натрия. В верхнюю часть прибора, холодильник, нальем воды и добавим кусочки льда. Нагреем колбу. Через некоторое время начинается реакция. Бромид натрия реагирует с серной кислотой с образованием бромоводорода.
NaBr + H2SO4 = NaHSO4 + HBr
Бромоводород реагирует с этиловым спиртом с образованием бромэтана.
HBr +С2Н5ОН = C2H5Br + H2O
Бромэтан — легкокипящая жидкость. Бромэтан испаряется, пары поступают в холодильник, где бромэтан конденсируется. Капли бромэтана падают в приемник. На дне приемника собирается тяжелая маслянистая жидкость – бромэтан.
Оборудование: прибор для получения галоидоалканов, штатив, шпатель, горелка, стакан, мерная пробирка
Техника безопасности. Соблюдать правила работы с огнеопасными жидкостями и кислотами.
Взаимодействие этилового спирта с металлическим натрием
При взаимодействии спиртов с натрием образуются газообразный водород и соответствующие алкоголяты натрия. Приготовим пробирки с метиловым, этиловым и бутиловым спиртами. Опустим в пробирку с метиловым спиртом кусочек металлического натрия. Начинается энергичная реакция. Натрий плавится, выделяется водород.
2СН3ОН + 2 Na = 2 CH3ONa + H2
Опустим натрий в пробирку с этиловым спиртом. Реакция идет немного медленней. Выделяющийся водород можно поджечь. По окончании реакции выделим этилат натрия. Для этого опустим в пробирку стеклянную палочку и подержим ее над пламенем горелки. Избыток спирта испаряется. На палочке остается белый налет этилата натрия.
2С2Н5ОН + 2 Na = 2 C2H5ONa + H2
В пробирке с бутиловым спиртом реакция с натрием идет еще медленнее.
2С4Н9ОН + 2 Na = 2 C4H9ONa + H2
Итак, с удлинением и разветвлением углеводородного радикала скорость реакции спиртов с натрием уменьшается.
Оборудование: штатив для пробирок, пробирки, пинцет, скальпель, фильтровальная бумага.
Техника безопасности. Соблюдать правила работы с огнеопасными жидкостями и щелочными металлами.
Горение спиртов
Нальем понемногу этилового, бутилового и изоамилового спиртов в фарфоровые чашки. Поднесем к чашкам горящую лучину. Этиловый спирт быстро загорается и горит голубоватым, слабосветящимся пламенем. Бутиловый спирт горит светящимся пламенем. Труднее загорается изоамиловый спирт, он горит коптящим пламенем. С увеличением молекулярной массы одноатомных спиртов повышается температура кипения и возрастает светимость их пламени.
С2Н5ОН + 3О2 = 2СО2 + 3 Н2О
С4Н9ОН + 6О2 = 4СО2 + 5 Н2О
2С5Н11ОН + 15О2 = 10СО2 + 12 Н2О
Оборудование: огнезащитная прокладка, фарфоровые чашки, лучина.
Техника безопасности. Соблюдать правила работы с огнеопасными жидкостями.
Каталитическое окисление этанола
Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III). В фарфоровую чашку поместим кусочек ваты, смоченный спиртом. Подожжем вату. Осторожно насыпаем на горящую вату оксид хрома. Пламя гаснет. Но оксид хрома начинает раскаляться. Реакция окисления спирта протекает с выделением энергии. Продукт реакции окисления спирта — уксусный альдегид.
2СН3-СН2-ОН + О2 = 2CH3 —COH + 2H2O
Оборудование: фарфоровая чашка, шпатель.
Техника безопасности. Соблюдать правила работы с огнеопасными жидкостями и концентрированными кислотами. После демонстрации осторожно разбавить содержимое чашки водой, нейтрализовать щелочью.
Качественная реакция на этанол
Чувствительной реакцией на этиловый спирт является так называемая йодоформная проба: образование характерного желтоватого осадка йодоформа при действии на спирт йода и щелочи. Этой реакцией можно установить наличие спирта в воде даже при концентрации 0,05%. Отберем пробу раствора и добавим раствор Люголя. Раствор Люголя содержит иод (1 часть иода, 2 части иодида калия, 17 частей стерильной дистиллированной воды). При охлаждении раствора появляется желтая взвесь йодоформа, при высоких концентрациях спирта выпадает желтый осадок йодоформа.
С2Н5ОН + 6 NaОН + 4 I2 = CHI3 +HCOONa + 5 NaI + H2O
Оборудование: пробирки, зажим пробирочный, горелка.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Окисление этанола (тест на алкоголь)
Реакцию окисления спиртов сильными окислителями используют для установления факта алкогольного опъянения.
Приготовим трубку для определения алкоголя. Для этого разотрем в ступке хромовый ангидрид (оксид хрома (VI)) с небольшим количеством серной кислоты. Получается паста красного цвета. Нанесем пастой полосу на стенках трубки. Трубку соединим с прибором, подающим смесь воздуха с парами этилового спирта. Через некоторое время красная полоса в трубке зеленеет. Спирт окисляется в уксусный альдегид, а окислитель оксид хрома превращается в сульфат хрома (III), имеющий зеленую окраску.
K2Cr2O7 + 3 C2H5OH + 4 H2SO4 = 3 CH3COH + Cr2(SO4)3 + K2SO4 + 7H2O
Оборудование: фарфоровая чашка и ступка, трубка стеклянная, резиновые трубки, газометр или аспиратор
Техника безопасности. Соблюдать правила работы с огнеопасными жидкостями.
Окисление этилового спирта кристаллическим перманганатом калия
Очень энергично протекает реакция этилового спирта с перманганатом калия в присутствии концентрированной серной кислоты. В стеклянный цилиндр наливаем серную кислоту. Осторожно, по стенке приливаем этиловый спирт. Образуются два слоя жидкости. Сверху — этиловый спирт, снизу — серная кислота. В цилиндр бросаем немного кристаллического перманганата калия. Через некоторое время на границе раздела спирта и кислоты возникают вспышки и слышатся щелчки. При попадании кристаллов перманганата калия в серную кислоту образуется марганцевый ангидрид (оксид марганца (VII)) — очень сильный окислитель. Он взаимодействует с этиловым спиртом. При этом образуется уксусный альдегид.
СН3-СН2-ОН + [О] = CH3 —COH + H2O
Оборудование: цилиндр, шпатель.
Техника безопасности. Соблюдать правила работы с огнеопасными жидкостями и концентрированными кислотами. После демонстрации осторожно разбавить содержимое водой, нейтрализовать щелочью.
Окисление этилового спирта оксидом меди (II)
В прибор для окисления спиртов нальем немного этилового спирта. Присоединим к газоотводной трубке прибор для подачи воздуха. Раскалим в горелке медную спираль и поместим ее в прибор. Подадим в прибор ток воздуха. Медная спираль в приборе продолжает быть раскаленной, так как начинается окисление спирта. Продукт окисления спирта — уксусный альдегид.
СН3-СН2-ОН + СuO = CH3 —COH + Cu + H2O
Альдегид обнаруживаем, пропуская через фуксинсернистую кислоту выходящие из прибора газы. Под действием альдегида фуксинсернистая кислота приобретает фиолетовую окраску. Покажем, что медная спираль раскалена. Извлечем спираль из прибора и поднесем к ней спичку. Спичка загорается. Мы убедились в том, что при окислении одноатомных спиртов образуются альдегиды.
Оборудование: прибор для окисления спирта, резиновые трубки, горелка, газометр или аспиратор.
Техника безопасности. Соблюдать правила работы с огнеопасными жидкостями и нагревательными приборами.
Окисление этилового спирта раствором перманганата калия
Спирты легко окисляются раствором перманганата калия. В пробирку с этиловым спиртом прильем немного подкисленного раствора перманганата калия. Осторожно подогреем пробирку. Раствор постепенно обесцвечивается. В данных условиях этиловый спирт окисляется, превращаясь в уксусный альдегид.
СН3-СН2-ОН + [О] = CH3 —COH + H2O
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с огнеопасными жидкостями и нагревательными приборами.