1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Как определить уксусную кислоту
Уксусная, или этановая кислота – это органическое соединение класса одноосновных карбоновых кислот. Производные данного вещества называются ацетатами. В разведенном виде кислота имеется практически на каждой кухне в качестве столового 6 % или 9 % уксуса. Его используют для приготовления разнообразных салатов, маринадов, кондитерских изделий, а также при консервировании овощей.

Вам понадобится
- — пробирки;
- — трубка-холодильник;
- — индикаторы;
- — уксусная кислота;
- — изопентиловый спирт;
- — серная кислота;
- — гидроксид натрия;
- — хлорид железа (III).
Инструкция
Основным признаком, по которому можно определить, что в емкости находится уксусная кислота, является характерный запах уксуса. Чтобы ощутить запах, откройте склянку и сделайте над ней несколько поступательных движений воздуха ладонью к себе. Ни в коем случае нельзя нюхать летучую жидкость, низко наклонившись над емкостью, так как это может привести к ожогу слизистых оболочек дыхательных путей.
Все соединения класса кислот имеют в своем составе атомы водорода, которые в водном растворе и обусловливают кислые свойства. Поэтому данное вещество можно определить с помощью индикаторов. Для этого возьмите 4 пробирки, налейте в каждую по 1 мл кислоты и опустите в них индикаторы (прилейте, если они в виде растворов). Лакмус в кислой среде становится красным, фенолфталеин свою окраску не меняет, а метиловый оранжевый приобретает насыщенный розово-красный цвет. В 4 пробирку опустите универсальный индикатор, который станет в растворе фиолетово-красным цветом. Сравните окраску по шкале, которая имеется в каждой упаковке и увидите, что она соответствует кислой среде.
Проведите реакцию на наличие ацетат-иона. Для этого возьмите пробирку, налейте в нее 2 мл разбавленной уксусной кислоты, добавьте 1 мл гидроксида натрия. Получится растворимая соль — ацетат натрия. Теперь добавьте к полученной смеси несколько капель раствора хлорида железа (III) – появится красная окраска. Нагрейте смесь, после чего в результате реакции гидролиза выпадет бурый осадок. Это свидетельствует о наличие ацетат-ионов.
Возьмите пробирку, поместите в нее 2 мл исследуемого вещества, добавьте 2 мл изопентилового спирта. Прилейте в смесь 1 мл концентрированной серной кислоты. Закройте пробирку трубкой-холодильником и нагрейте смесь. В результате взаимодействия появляется приятный запах груши за счет образования сложного эфира.
Обратите внимание
При выполнении работы соблюдайте правила техники безопасности.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Химические свойства уксусной кислоты

4.2
Средняя оценка: 4.2
Всего получено оценок: 691.
4.2
Средняя оценка: 4.2
Всего получено оценок: 691.
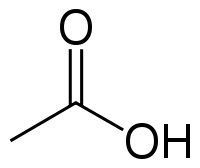
Этановая или уксусная кислота – это слабая карбоновая кислота, которая широко применяется в промышленности. Химические свойства уксусной кислоты определяет карбоксильная группа COOH.
Физические свойства
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см3;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Получение
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.
Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Химические свойства
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
|
Взаимодействие |
Что образуется |
Пример |
|
С металлами |
Соль, водород |
Mg + 2CH3COOH → (CH3COO)2Mg + H2 |
|
С оксидами |
Соль, вода |
CaO + 2CH3COOH → (CH3COO)2Ca + H2O |
|
С основаниями |
Соль, вода |
CH3COOH + NaOH → CH3COONa + H2O |
|
С солью |
Соль, углекислый газ, вода |
2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O |
|
С неметаллами (реакция замещения) |
Органическая и неорганическая кислоты |
– CH3COOH + Cl2 → CH2ClCOOH (хлоруксусная кислота) + HCl; – CH3COOH + F2 → CH2FCOOH (фторуксусная кислота) + HF; – CH3COOH + I2 → CH2ICOOH (иодуксусная кислота) + HI |
|
С кислородом (реакция окисления) |
Углекислый газ и вода |
CH3COOH + 2O2 → 2CO2 + 2H2O |
Эфиры и соли, которые образует уксусная кислота, называются ацетатами.
Применение
Уксусная кислота широко применяется в различных отраслях:
- в фармацевтике – входит в состав лекарственных препаратов;
- в химической промышленности – используется для производства ацетона, красителей, ацетилцеллюлозы;
- в пищевой промышленности – применяется для консервации и вкуса;
- в лёгкой промышленности – используется для закрепления краски на ткани.
Уксусная кислота является пищевой добавкой под маркировкой Е260.
Что мы узнали?
CH3COOH – уксусная кислота, получаемая из ацетальдегида, метанола, н-бутана. Это бесцветная жидкость с кислым вкусом и резким запахом. Из разбавленной уксусной кислоты производят уксус. Кислота обладает слабыми кислотными свойствами и реагирует с металлами, неметаллами, оксидами, основаниями, солями, кислородом. Уксусная кислота широко применяется в фармацевтике, пищевой, химической и лёгкой промышленности.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Балабан
5/5
-
Елизавета Маркова
5/5
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 691.
А какая ваша оценка?
Этановая кислота
- Этановая кислота
-
Уксусная кислота Общие Систематическое наименование уксусная кислота Химическая формула CH3COOH Отн. молек. масса 60,05 а. е. м. Молярная масса 60,05 г/моль Физические свойства Плотность вещества 1,0492 (20 °C) г/см³ Состояние (ст. усл.) бесцветная жидкость Термические свойства Температура плавления 16,75 °C Температура кипения 118.1 °C Молярная теплоёмкость (ст. усл.) 123,4 (ж) Дж/(моль·К) Энтальпия (ст. усл.) −487 (ж) кДж/моль Химические свойства pKa 4,75 (25 °C, вода) Растворимость в воде неограничено смешивается г/100 мл Классификация номер CAS 64-19-7 У́ксусная кислота (эта́новая кислота), CH3COOH — слабая, предельная одноосно́вная карбоновая кислота.
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 Производные уксусной кислоты
- 6 Ссылки
Физические свойства
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается с многими растворителями; в уксусной кислоте хорошо растворимы органические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров.
- Порог восприятия запаха в воздухе (мг/л) = 0,4
- Показатель преломления (для D-линии натрия): 1,372 (20 °C)
- Давление паров (в мм. рт. ст.):
- 10 (17,1 °C)
- 40 (42,4 °C)
- 100 (62,2 °C)
- 400 (98,1 °C)
- 560 (109 °C)
- 1520 (143,5 °C)
- 3800 (180,3 °C)
- Диэлектрическая проницаемость: 6,15 (20 °C)
- Дипольный момент молекулы (в дебаях): 1,74 (20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (25,2 °C); 0,79 (50 °C)
- Поверхностное натяжение: 27,8 мН/м (20 °C)
- Удельная теплоемкость при постоянном давлении: 2,01 Дж/г·K (17 °C)
- Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfG0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: 38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
- Критическая температура: 321,6 °C
- Критическое давление: 5,79 МПа
- Образует азеотропные смеси:
-
- с четыреххлористым углеродом — tкип 76,5 °C, массовая доля уксусной кислоты 3 %;
- с циклогексаном — tкип 81,8 °C, массовая доля уксусной кислоты 6,3 %;
- с бензолом — tкип 88,05 °C, массовая доля уксусной кислоты 2 %;
- с толуолом — tкип 104,9 °C, массовая доля уксусной кислоты 34 %;
- с гептаном — tкип 91,9 °C, массовая доля уксусной кислоты 33 %;
- с трихлорэтиленом — tкип 86,5 °C, массовая доля уксусной кислоты 4 %;
- с этилбензолом — tкип 114,65 °C, массовая доля уксусной кислоты 66 %;
- с о-ксилолом — tкип 116 °C, массовая доля уксусной кислоты 76 %;
- с п-ксилолом — tкип 115,25 °C, массовая доля уксусной кислоты 72 %;
- с бромоформом — tкип 118 °C, массовая доля уксусной кислоты 83 %.
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип 88 °C);
- с водой и бутилацетатом (tкип 89 °C).
-
Получение
- Уксусную кислоту можно получить окислением ацетальдегида кислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50–60 °С:
2 CH3CHO + O2 → 2 CH3COOH
- В промышленности её получают из метанола и оксида углерода (II) по реакции:
CH3OH + CO → CH3COOH Катализаторами служат соединения Rh (процесс фирмы Monsanto) или Ir (процесс фирмы BP).
- По другому методу уксусную кислоту получают при окислении н-бутана при температуре 200 °C и давлении 50 атм в присутствии кобальтового катализатора(Реакция Эмануэля).
2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O
Старые способы — карбонилирование метанола на кобальтовых катализаторах (бутана (этилена (Wacker) вытеснены как неконкурентоспособные.
- Биохимическое производство уксусной кислоты брожением (уксуснокислое брожение). В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), а также кислород. В качестве вспомогательных веществ — ферменты уксуснокислых бактерий или грибков (дрожжи). В этом процессе этанол биокаталитически окисляется до уксусной кислоты:
СН3СН2ОН + О2 → СН3СООН + Н2О
Химические свойства
- Диссоциация
Уксусная кислота диссоциирует по уравнению CH3COOH → CH3COO− + H+
- Кислотные свойства
Уксусная кислота проявляет кислотные свойства. Она взаимодействует с активными металлами,образуя соли — ацетаты:
Mg(тв) + 2CH3COOH → (CH3COO)2Mg + H2
- Реакции по α-углеродному атому.
Водородные атомы у α-углерода более подвижны, чем другие атомы водорода в цепи, что приводит к возможности их замещения, например, на атом галогена:
CH3COOH + Cl2 → CH2ClCOOH + HCl
Эта реакция будет протекать до тех пор, пока не получится трихлоруксусная кислота (CCl3COOH)
Применение
70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-6 % — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Производные уксусной кислоты
Соли и эфиры уксусной кислоты называют ацетатами.
Ссылки
- Уксусная кислота
Одноосновные предельные карбоновые кислоты
С0 Муравьиная С1 — С5 Уксусная (С1) · Пропионовая (С2) · Масляная (С3) · Валериановая (С4) · Капроновая (С5) С6 — С10 Энантовая (С6) · Каприловая (С7) · Пеларгоновая (С8) · Каприновая (С9) · Ундециловая (С10) С11 — С15 Лауриновая (С11) · Тридекановая (С12) · Миристиновая (С13) · Пентадекановая (С14) · Пальмитиновая (С15) С16 — С20 Маргариновая (С16) · Стеариновая (С17) · Нонадекановая (С18) · Арахиновая (С19) · Генэйкозановая (С20) С21 и более Бегеновая (С21) · Лигноцериновая (С23)
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Этановая кислота» в других словарях:
-
этановая кислота — метанкарбоновая кислота, уксусная кислота … Cловарь химических синонимов I
-
этановая кислота — см. Уксусная кислота … Большой медицинский словарь
-
метанкарбоновая кислота — этановая кислота, уксусная кислота … Cловарь химических синонимов I
-
уксусная кислота — этановая кислота, метанкарбоновая кислота … Cловарь химических синонимов I
-
Жирная кислота — Жирные кислоты (алифатические кислоты) многочисленная группа исключительно неразветвлённых одноосновных карбоновых кислот с открытой цепью. Название определяется, во первых, химическими свойствами данной группы веществ основанными на присутствии… … Википедия
-
уксусная кислота — (acidum aceticum; син. этановая кислота) природная предельная монокарбоновая кислота, являющаяся в организме исходным продуктом биосинтеза многих веществ, напр. жирных кислот, стероидов, стеринов, терпенов; входит в состав ацетилкоэнзима А … Большой медицинский словарь
-
У́ксусная кислота́ — (acidum aceticum; син. этановая кислота) природная предельная монокарбоновая кислота, являющаяся в организме исходным продуктом биосинтеза многих веществ, например жирных кислот, стероидов, стеринов, терпенов; входит в состав ацетилкоэнзима А … Медицинская энциклопедия
-
Метил-гуанидо-уксусная кислота — Креатин, C4H9N3O2 2 (метилгуанидино) этановая кислота, Mr=131.13 g/mol Креатин азотсодержащая карбоновая кислота, которая встречается у позвоночных. Участвует в энергетическом обмене в мышечных и нервных клетках. Креатин был выделен в 1832 году… … Википедия
-
Ацидум ацетикум — Acidum aceticum, Уксусная кислота — СН3СООН уксусная (этановая) кислота.Смешивается с водой, спиртом во всех соотношениях. Получается при уксуснокислом брожении спиртовых жидкостей.Изготовление на химических фабриках. Приготовление гомеопатических разведений по § 5а. Употребляемые… … Справочник по гомеопатии
-
УКСУСНАЯ КИСЛОТА — (этановая к та) CH3COOH, мол. м. 60,05; бесцв. прозрачная жидкость с резким запахом. Для безводной ( ледяной ) т. пл. 16,64 0C, т. кип. 117,8 0C; 1,0492; 1,3715; р крит57,85 кПа, t крит 321,6 0C, 11,83 мПа … Химическая энциклопедия
Характеристика и свойства уксусной кислоты
Уксусная кислота (или этановая) – органическое химическое соединение, относящееся к карбоновым кислотам (в состав их формулы входит карбоксильная группа – COOH). Это вещество известно человечеству с древних времен. Без нее невозможно производство многих пищевых продуктов и получение органических веществ.
Общая характеристика, формула
Химическая формула вещества СН3СООН. При нормальных условиях это бесцветная жидкость, обладающая резким характерным запахом и кислым вкусом. Попадание концентрированного вещества на слизистые оболочки вызывает химический ожог. «Ледяная» уксусная кислота 99 процентов обладает высокой гигроскопичностью, т.е. она способна поглощать водяной пар из атмосферного воздуха.
В уксусе могут растворяться не только жидкости, но и газы. Например, в нем растворяются фтороводород HF, хлористый водород HCl и бромистый водород HBr.
Соли рассматриваемого химического вещества называются ацетатами. Такое же наименование имеют и сложные эфиры. В качестве пищевой добавки применяется раствор уксусной кислоты с концентрацией 3 – 9%. В составе уксусной кислоты не может быть никаких примесей.
См. публикации по теме:
- Применение уксусной кислоты
- Уксусная кислота как пищевая добавка Е260
История открытия уксусной кислоты
Рассматриваемое вещество известно человеку с первобытных времен. СН3СООН образуется при скисании вина (отсюда и другое название – винный уксус). Впервые химические свойства уксуса описано в Древней Греции в 3 веке до н.э. В то время это вещество применялось для получения красителей. В Древнем Риме большой популярностью пользовался так называемый свинцовый сахар – ацетат свинца. Эта соль была причиной хронических отравлений и болезней римской аристократии.
Химическое строение уксуса впервые начал исследовать французский химик Дюма: он опубликовал труд о замещении атома водорода в органических соединениях атомом хлора. Так он получил хлоруксусную кислоту.
В середине 19 века немецкий химик А. Кольбе синтезировал уксус путем хлорирования сероуглерода CS2 до тетрахлометана CCl4, который путем пиролиза превращался в тетрахлорэтилен C2Cl4. Дальнейшее воздействие хлором водного раствора тетрахлорэтилена дало возможность получить трихлоруксусную кислоту. После электролитического восстановления ученый получил СН3СООН.
Еще в начале ХХ века значительное количество уксуса проводилось путем перегонки древесины.
Получение и производство
На ранних этапах развития индустрии вещество уксусная кислота получали путем окисления бутана и ацетатальдегида. Этот альдегид окислялся в присутствии катализатора ацетата марганца при высоком давлении и температуре. Реакция имела такой вид: 2СН3СНО + О2→2СН3СООН.
Окисление же бутана проходило при высоком давлении и в присутствии катализатора ацетата кобальта. Реакция имела такой вид: 2С4Н10 + 5О2→ 2СН3СООН.
В результате подорожания нефти (а рассмотренные способы базировались на окислении продуктов ее крекинга) сделали такие химические реакции экономически невыгодными. Более совершенный способ получения уксусной кислоты – это каталитическое карбонилирование метанола (древесного спирта) путем воздействия на него окисью углерода. Реакция имеет такой вид: СН3СОН + СО → СН3СООН. Катализатором служит йодистая соль кобальта.
С 1970 г. компания Монсанто предложила использовать в качестве катализатора родиевые соли. В результате производство уксусной кислоты заметно возросло.
В процессе биохимического производства применяется окисление этилового спирта микроорганизмами. Реакция проходит при участии фермента алькогольдегидрогеназы.
Также пищевую добавку уксусную кислоту можно получить путем окисления этилового спирта: С2Н5ОН + О2→ СН3СООН + Н2О.
Химические и физические свойства
Физические свойства уксусной кислоты следующие:
- в стандартном состоянии это жидкость, не имеющая цвета, с резким запахом;
- замерзает при температуре около 17 градусов, при этом образуются бесцветные кристаллы;
- смешивается с водой в любых соотношениях;
- гигроскопична;
- температура кипения – 118 градусов;
- температура вспышки – 39 градусов, самовоспламенения – 463.
В следующих примерах показаны кислотные свойства уксусной кислоты.
- Взаимодействие с металлами: Mg + 2CH3COOH → (CH3COO)2Mg + H2; 6СН3СООН + 2Fe → 2Fe(CH3CОО)3+3Н2.
- Реакция с оксидами металлов: CaO + 2CH3COOH → (CH3COO)2Ca + H2O.
- Взаимодействие с щелочами: CH3COOH + КOH → CH3COOК + H2O.
- Взаимодействие с солями: 2CH3COOH + Na2CO3→ 2CH3COONa + CO2 + H2O.
- Реакция замещения с галогенами: CH3COOH + Cl2→CH2ClCOOH + HCl; CH3COOH + F2 → CH2FCOOH + HF.
- Окисление кислородом: CH3COOH + 2O2→ 2CO2 + 2H2O.
- Взаимодействие с аммиаком: СН3СООН + NH3→CH3COONH4.
- Реакция со спиртами: СН3СООН + С2Н5ОН → СН3СООС2Н5 + 2Н2О. Эта реакция протекает в присутствии катализатора –серной кислоты.
Качественной реакцией на наличие ацетатов является их взаимодействие с сильными кислотами. Уксус вытесняется из водных растворов солей. При этом появляется характерный запах.
Хранение и транспортировка
Промышленная уксусная кислота наливается в транспортную тару (оцинкованные металлические бочки или канистры из полимерных материалов). В магазины раствор поступает в стеклянных или пластиковых бутылках с навинчивающимися крышками или пробками.
Хранить это вещество нужно в плотно закрытой таре в помещениях, которые специально приспособленные для хранения воспламеняющихся веществ. Места хранения уксусной кислоты должны быть защищенными от попадания прямых солнечных лучей и осадков.
Класс опасности уксусной кислоты – 8: едкие и коррозийные вещества.
Перевозку нужно осуществлять в цистернах из нержавеющей стали. Они не должны иметь нижнего слива. Наливные отверстия, люки оборудуются герметичными резиновыми, полиэтиленовыми прокладками, которые предотвращают расплескивание жидкости в процессе перевозки.
ООО «Эверест» осуществляет оптовые поставки уксусной ледяной (этановой) кислоты по выгодным ценам. Подробнее по телефону: +7 (812) 448-47-55.