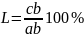Понятия фазового и химического состава иногда путают.
Люди, не знакомые с металловедением, считают, что для получения какой-либо металлической детали достаточно знать химический состав. Известны случаи, когда изготавливали ответственные детали только по химсоставу, и они быстро выходили из строя. Причина в том, что элементы в сплаве не просто смешаны между собой. При создании и обработке сплава химические элементы должны сформировать определенную структуру, которая и определяет свойства сплава. Эта структура состоит из фаз.
Напомним. Фаза – это однородная часть сплава, имеющая одинаковый состав, свойства, кристаллическое строение, границу раздела, при переходе через которую свойства меняются скачком.
Можно сказать, что:
Элементный (химический) состав – это перечень элементов, из которых сплав состоит.
Фазовый состав – это перечень фаз, которые есть в данном сплаве. Фазы состоят из элементов, входящих в элементный состав сплава. Элементы распределены по фазам неравномерно.
На основании знания химического состава и используя диаграмму состояния соответствующего сплава можно определить, какие фазы могут быть в сплаве данного состава.
Структуры (и материалы) бывают однофазные и многофазные. Однофазные материалы – это чистые металлы, химические соединения, твердые растворы.
Если рассматривать чистый металл, то ясно, что его элементный состав совпадает с фазовым. Элемент один и фаза одна. Например, на рисунке 1,а показана структура литого висмута – чистого вещества. Структура дендритная. Или феррит (рис.1,б), имеющий зеренную структуру; это пример твердого раствора.
Рисунок 1. Структура висмута (а) и феррита (б).
Как правило, сплавы имеют несколько фаз. Например, серый чугун с ферритной матрицей (рис. 2,а); фазы две – феррит и графит. Или кислородная медь (рис.2,б); 2 фазы – медь и закись меди Cu2O(куприт).
Рисунок 2. Двухфазные структуры: ферритный чугун (а) и кислородная медь (б).
Если мы имеем дело со сталью, то возможны варианты, при которых химический состав будет один и тот же, а фазовый – нет.
На рисунке 3 показана структура доэвтектоидной стали 45 (0,45% С), т.е. состав – железо и углерод. После нормализации структура – феррит и перлит (рис.3,а). Фазовый состав после нормализации – феррит и цементит, т.е. 2 фазы (как известно перлит не фаза, а структурная составляющая, состоящая из двух фаз – феррита и цементита). После закалки (рис.3,б) структура — мартенсит и остаточный аустенит – также 2 фазы, но принципиально иные.
Рисунок 3. Структура стали 45 после нормализации (а), закалки (б).
Структуры закалки в различных материалах могут быть похожи (рис.4). Мартенсит в стали и в чугуне выглядит приблизительно одинаково, хотя у этих двух сплавов совершенно разный состав, в особенности по углероду.
Рисунок 4. Мартенсит в стали 20 (а) и в чугуне (б).
Половинчатый чугун тоже имеет состав железо+углерод, но фаз в нем три: графит, цементит (свободный и в составе перлита), феррит (рис.5).
Рисунок 5. Структура половинчатого чугуна.
Возможны варианты, когда сплавы с разным химическим составом имеют один и тот же фазовый состав. На рисунке 6 показаны структуры силуминов АК12 и АК21. Эти сплавы различаются, в основном, содержанием кремния. В сплаве АК12 кремния 10-13% (т.е. практически эвтектический сплав), в сплаве АК21 — 20-22% Si (заэвтектический сплав). Структура обоих сплавов состоит из эвтектики и включений кремния. Только в сплаве АК21 кремний – избыточный, а в сплаве АК12 избыточный кремний появился в результате неравновесной кристаллизации.
Рисунок 6. Структура силуминов: а – АК21, б – АК12
Примером сплава с одинаковым фазовым составом и одинаковым химическим является эвтектоидная сталь (рис.7). Как известно, при 0,8% углерода в стали возможно существование только одной структуры — перлита. В зависимости от режима термической обработки он может быть пластинчатым или зернистым, т.е. иметь формы, совершенно разные морфологически.
Рисунок 7. Зернистый перлит (а) и пластинчатый перлит (б).
Изменением фазового состава (при неизменном химическом) можно управлять. Это можно проиллюстрировать на фото из статьи «Как увидеть аустенит» (рис.8). После плазменной резки структура стали в поверхностной зоне «1» — мартенсит, далее в зоне «2» — феррит+аустенит, в зоне «3» — зернистый перлит. Формирование этих структур зависит от температуры нагрева и скорости охлаждения. Поверхность нагрелась в наибольшей степени и в результате быстрого охлаждения «на массу» здесь сформировался мартенсит. В зоне «2» остаточный аустенит застабилизировался из-за давления мартенсита поверхностного слоя вследствие объемного эффекта мартенситного превращения. В зоне «3» температуры хватило на перевод в аустенитное состояние, реализовалось некоторое подобие отжига на зернистый перлит. Ну а элементный (химический) состав во всех трех зонах одинаковый!
Рисунок 8. Панорама изменения структуры в зоне плазменного реза; углеродистая сталь.
Прекрасной иллюстрацией одинакового фазового состава при разном химическом может служить диаграмма состояния железо-углерод (как, впрочем, и диаграммы других систем). Для каждой фазовой области набор фаз постоянный (потому и называется фазовой областью), а их состав и количество зависит от количества углерода (рис.8). Например, область существования феррита и цементита: с увеличением количества углерода изменяется количество фаз, но не их состав. В области существования аустенита фаза одна — аустенит, но при увеличении концентрации углерода изменяется его состав.
Рис.8. Фазовые области диаграммы состояния железо-углерод.
-
Правило фаз (закон Гиббса) и правило определения состава и количества фаз (правило отрезков).
Процесс
кристаллизации сплавов и связанные с
ним многие закономерности строения
описываются с помощью диаграммы
состояния
(ДГ)
– графическое изображение состояния
сплавов (фазовый состав и структура, в
зависимости от элементов и температуры).
ДГ
определяют устойчивые равновесные
состояния сплавов, обладающие при
данных условиях миниальной свободной
энергией. Строят их экспериментальными
методами, одним из которых является
термический
анализ,
с помощью которого получают кривые
охлаждения (кристаллизации) и точки
перегиба кривых называют критическими
точками. Они
соответветвтсвуют температурам, при
которых в сплавах начивают/заканчиваются
какие-либо фазовые превращения.
Для
построения диаграмм состояния и снятия
кривых охлаждения берут большое
количество сплавов с разной концентрацией
компонентов.
Зависимость
существования устойчивых фаз, отвечающая
условиям равновесия, описывается
условием
Гиббса:
,
где с – число степеней свободы,
к
– число компонент, ф – число фаз.
2
– число внешних факторов (Т, Р)
П
од
числом «с» (вариантностью системы),
понимается возможность изменения
температуры, давления и концентрации
без изменения числа фаз, находящихся в
равновесии.
Применяя
правило фаз Гиббса к металлам, можно во
множестве случаев принять изменяющимся
только один внешний фактор – температуру,
так как давление мало влияет на фазовые
превращения.
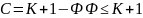
Если
максимальное число фаз: с = 0 (при Т =
константа).
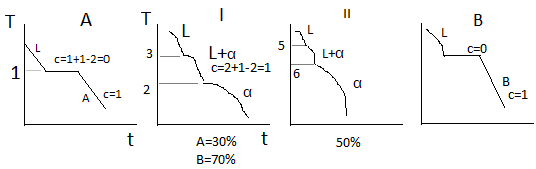
Диаграмма
состояния сплавов, имеющих неограниченную
растворимость в жидком, твёрдом состоянии.
Правило отрезков.
Верхняя
линяя на диаграмме 1-3-5-6 – линия начала
кристаллизации – Ликвидус. Линия 1-2-4-6
– линия окончания кристаллизации –
линия Солидус. Выше линии Ликвидус
существует только жидкая фаза L.
Между линиями ликвидус и солиус идёт
процесс кристаллизации и в равновесии
находятся 2 фазы, т.е.число степеней
свободы с=2+1-2=1. Ниже линии солидус – все
сплавы однофазны и состоят из α-твёрдого
раствора. Такую диаграмму состояния
имеют следующие сплавы: Cu-Ni,
Cu-Pt,
Au-Ag,
Fe-Va,
Fe-Ni,
Mo-W.
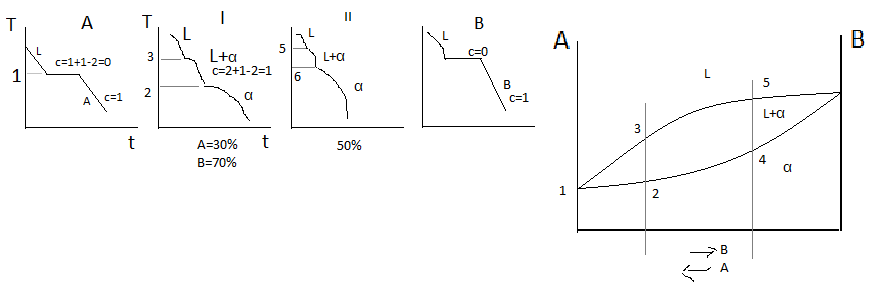
Р
ассмотрим
более подробно процесс кристаллизации
сплава 50% А 50% В. Кристаллизация начинается
при температуре T1,
когда из жидкого раствора выделяются
первые кристаллы α-твёрдого раствора.
Ниже температуры T1
сплав 2х фазный (L+α).
В процессе кристаллизации твёрдых
растворов состав твёрдой и жидкой фазы
меняется. Каждой температуре соответствует
определённое количество и концентрация
фаз. В реальных условиях или при быстром
охлаждении не успевает произойти
выравнивание концентрации в твёрдом
растворе. Даже в пределах 1-го кристалла
будет наблюдаться неоднородный химический
состав. Первые кристаллы α-твёрдого
раствора обогащены компонентом В, а
далее всё время меняется соотношение
А и В. И последние кристаллы будут
содержать больше компонента А.
И
так,
для определения количественного
соотношения фаз, находящихся в равновесии
при данной температуре, пользуются
правилом
отрезков
(рычага).
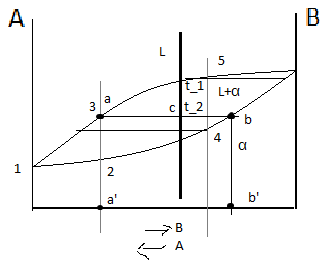
Правило
отрезков
позволяет определить:
Состав
фаз или концентрацию компонентов в
соответствующих фазах. Для этого точки
пересечения коноды с линиями диаграммы
переносятся на ось концентрации, т.е.
конода параллельна линии концентрации.
Конода – линия, соединяющая состав фаз,
находящихся в равновесии. a’
– состав жидкой фазы, b’
– состав α-твёрдого раствора. Количество
фаз:
.
Если точка, показывающая состав при
данной температуре, т.е. линия ниже линии
ликвидуса и выше линии солидуса, а её
состав соответствует исходному составу.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В процессе кристаллизации изменяются и концентрация фаз (поэтому состав жидкости изменяется), и количество каждой фазы (при кристаллизации количество твердой фазы увеличивается, а жидкой уменьшается). В любой точке диаграммы, когда в сплаве одновременно существуют две фазы, можно определить количество обеих фаз и их концентрацию. По диаграмме состояния можно также установить, является ли образующаяся кристаллическая фаза твердым раствором, химическим соединением или чистым компонентом. Для этого служит так называемое правило рычага, или правило отрезков.
Первое положение правила отрезков формулируется следующим образом. Чтобы определить концентрации компонентов в фазах, через данную точку, характеризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область; проекции точек пересечения на ось концентраций показывают составы фаз.
Рассмотрим диаграмму (рис. 4.3), аналогичную диаграмме Pb – Sb. В точке а, показывающей состояние сплава К при температуре t1, сплав состоит из кристаллов В и жидкости. Выше точки l сплав находится в однофазном состоянии, и концентрация компонентов в этой фазе (т.е. в жидкости) определяется проекцией точки l. При охлаждении из сплава выделяются кристаллы В, и состав жидкости изменяется в сторону увеличения в ней компонента А.
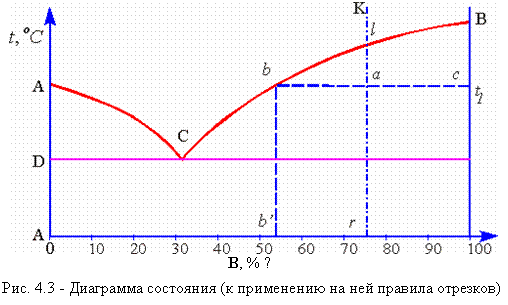 4.3 — Диаграмма состояния (к применению на ней правила отрезков) «> |
При температуре t1 концентрация компонента В в жидкости определяется проекцией точки b; это максимальное количество компонента В, которое может содержать жидкость при t1. По достижении температуры солидус жидкость принимает концентрацию точки С. Следовательно, при охлаждении сплава К. концентрация жидкости меняется по кривой lС. Выделяющиеся кристаллы В имеют постоянный состав – это чистый компонент В, концентрация которого лежит на вертикальной оси ВВ.
Следовательно, для сплава К при температуре t1 составы обеих фаз определяются проекциями точек b и с, так как эти точки находятся на пересечении горизонтальной линии проходящей через точку а, с линиями диаграммы.
Количество этих фаз также можно определить c помощью второго положения правила отрезков. Для того чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию. Отрезки этой линии между заданной точкой и точками, определяющими составы фаз, обратно пропорциональны количествам этих фаз.
Например: при t1
количество жидкой фазы ас/bc .100 %
количество твердой фазы ba/bc .100 %