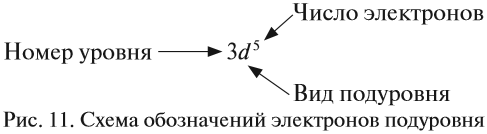
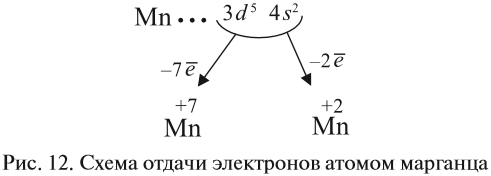
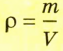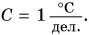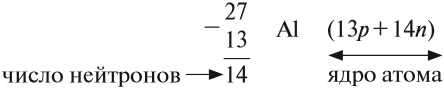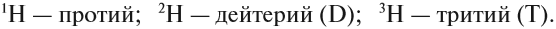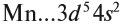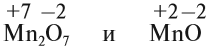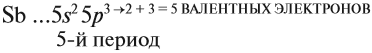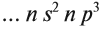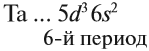Виды тел в физике
В зависимости от того, из чего состоят физические тела, различают несколько их видов. Так, они бывают:
- твёрдыми;
- жидкими;
- газообразными.
В первом случае в их составе — твёрдые вещества, и они имеют определённую форму. Можно привести такие примеры физических тел: песчинка, валун, автомобиль, стол. В окружающем человека мире их множество — как природные, так и рукотворные. Последние называются предметами.
Второй вид — жидкие объекты, например, вода в стакане. Их характерная черта состоит в том, что они не имеют собственной формы и принимают очертания предмета, внутри которого находятся. Так, жидкость в стакане будет иметь одну форму, в аквариуме или бензобаке — другую.
Третий вид — газообразные. Для них характерно то, что при отсутствии ограничений они свободно распространяются в окружающей среде. Их очертания (форма), как и во втором случае, определяются границами внешнего твёрдого объекта (ёмкости). В отличие от жидких, в соответствии со свойствами газов, они заполняют весь доступный объём.
Принципиальная разница в свойствах
Твёрдые, жидкие и газообразные тела обладают значительными отличиями. С точки зрения физики, они вызваны разным строением веществ, из которых эти объекты состоят, и разной степенью притяжения их молекул. Так, твёрдые вещества бывают:
- Кристаллическими — расположение молекул или атомов (ионов) в них строго упорядочено.
- Аморфными — не имеют определённого порядка расположения.
- Высокомолекулярными, в которых положение атомов в молекулах определено, но сами молекулы располагаются в веществе хаотично.
Частицы в твёрдом веществе и, соответственно, твёрдом физическом объекте, сильно притягиваются друг к другу и находятся в постоянном движении. В жидкости притяжение слабее, но все же его достаточно для того, чтобы такие вещества сохраняли свою структуру, но не хватает для удержания формы жидких веществ, поэтому под действием силы тяжести жидкости принимают форму сосуда.
Связь между структурными частицами в газах ещё более слабая. Молекулы (атомы) в них расположены на расстоянии, значительно превышающем собственный размер частиц. Поэтому газы можно сильно сжать, но формы они не имеют, заполняя весь предоставленный объём.
Свойства веществ определяют характеристики состоящих или изготовленных из них объектов.
Текучесть как свойство
Несмотря на значительные отличия, у твёрдых и жидких тел есть и сходные свойства. Существуют так называемые мягкие объекты, занимающие промежуточное положение и обладающие свойствами и одних, и других. Например, характерную для жидкостей текучесть могут показывать и твёрдые объекты или вещества, такие как сапожный вар, лёд, даже некоторые металлы. Последние демонстрируют свойства жидкостей при воздействии высокого давления.
Так, если соединить два металлических куска в необходимой последовательности, можно под высоким давлением получить прочное соединение — они как бы спаяются в единое целое. Интересно, что нагревать их до температуры плавления для этого не потребуется. Таким методом на основе диффузии (взаимного проникновения частиц) получают некоторые металлические сплавы.
Простые и составные
Применяется ещё одна классификация, в зависимости от того, имеются ли в телах составные части. Так, составным называют такое из них, которое имеет неоднородное строение и представляет собой комбинацию (соединение) нескольких простых, считающихся однородными. Такая классификация была принята для проведения упрощённых расчётов при работе с физическими телами, в которых не учитываются изменения внутреннего состояния реальных объектов, а также разрушения вследствие приложенной извне силы.
Например, человека, при изучении его путём теоретических исследований в качестве физического объекта, корректно рассматривать, как совокупность простых форм — цилиндров, шаров (если пренебречь тем, что любое человеческое тело имеет полости).
Тела и вещества
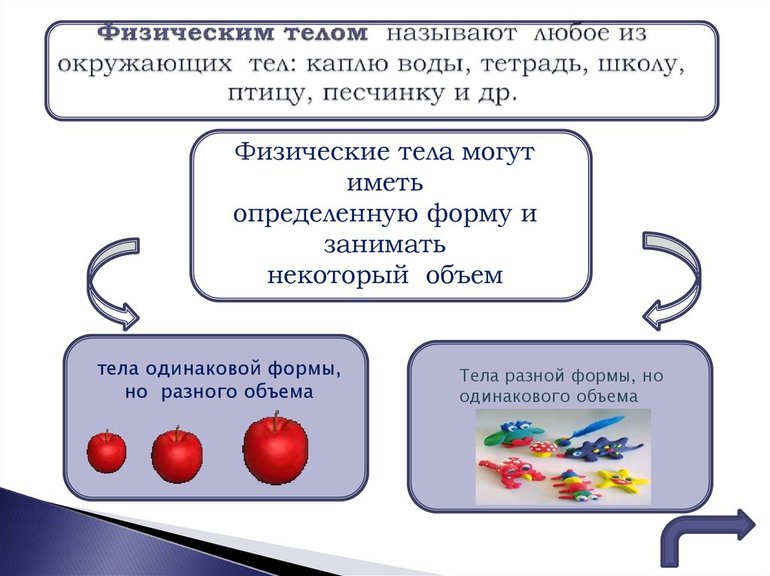
Из определения физического тела следует, что обозначаться этим термином могут абсолютно все предметы вокруг, созданные как человеком, так и природой. Кристаллики соли, предметы мебели и оргтехники, воздух в воздушном шаре, вода в стакане — все они имеют признаки физических тел: определённый объём и массу, размеры и т. д.
Все физические объекты состоят из различных веществ. Чтобы разобраться, что в физике понимают под термином «физическое тело», необходимо различать эти понятия. Слово «вещество» — название качественного проявления материи. В физике его рассматривают как форму материи, не имеющую заряда и обладающую массой покоя. С точки зрения химии, вещество — вид материи, состоящий из молекул, ионов или атомов, обладающий определёнными химическими свойствами, а значит, и вступающий в те или иные химические реакции. Изучать вещества в рамках соответствующих задач могут как физика, так и химия.
Вещество образует физический объект, занимая определённое свободное пространство. Так, золото — это вещество, а золотое кольцо — тело. Другой пример: вода является веществом, а её капля или вода в ёмкости — тело.
Принятые в науке приближения
В современной физике в определённых случаях рассматривают некие абстрактные тела с идеальными характеристиками. Это прежде всего касается механики. В этом разделе рассматривается движение идеальных физических точек, которые не имеют массы и прочих физических свойств. Для поставленных задач эти величины не имеют значения, ими можно пренебречь.
При расчётах также нередко используется абстрактное понятие абсолютно твёрдого тела. Отличаться от обычных оно будет отсутствием смещения центра массы и неподверженностью любым деформациям.
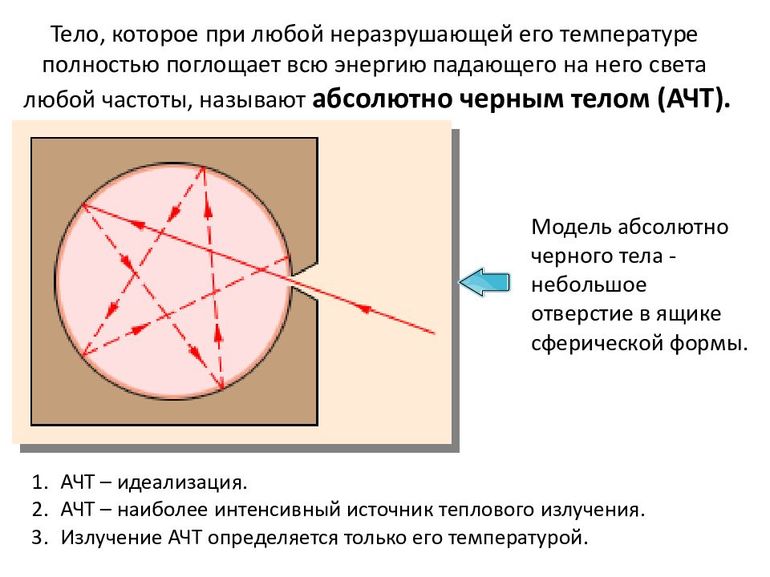
Абсолютно чёрное тело — ещё одна абстракция, используемая в термодинамике. Под ней понимают объект, который способен поглотить абсолютно любое электромагнитное излучение, достигшее его поверхности. Стоит отметить, что оно само может испускать излучение, если таковы условия задачи, и визуально может быть не только чёрным. То, каким будет спектр его излучения, связано только с температурой абсолютно чёрного объекта.
Ещё одно приближение: любой рассматриваемый в физической задаче предмет по умолчанию считается шарообразным, если его форма не имеет значения.
Природные явления и тела
Возникновение физической науки связано именно с необходимостью исследования поведения физических объектов и их взаимодействия между собой, а также с природными явлениями. Так, создание рукотворных предметов особой конструкции способно задержать движение природной стихии во время шторма, защитить от ураганов. Катастрофические последствия землетрясений для людей преодолеваются путём проектирования и возведения строений особой формы, обладающих определёнными свойствами.
Другой пример: создание автомобиля особой конструкции, позволяющей уменьшить его повреждения при контакте с другими твёрдыми объектами во время автокатастрофы. Всё это стало возможным, благодаря изучению закономерностей взаимодействия физических объектов (тел) между собой, с природными и другими явлениями.
Пройти этот сложный путь физика смогла за много столетий и самые значительные открытия, несомненно, ещё впереди.
Еще статьи по физике:
- 5 теорий мультивселенной
Содержание:
Строение вещества:
Из чего состоят вещества? Насколько малыми являются наименьшие частички вещества? Существует ли отличие между молекулами одного и того же вещества? Можно ли сосчитать молекулы в булавочной головке? Эти и другие вопросы мы обсудим подробнее и вместе найдем ответы.
Различия атома и молекулы
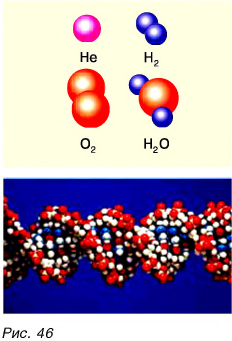
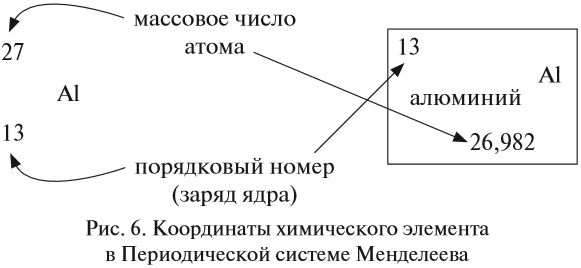
Из предыдущего курса «Природоведение* вы уже знаете, что все вещества состоят из мелких частичек — молекул и атомов. Вы также знаете, что первичные составные части вещества — атомы — имеют специальные названия и символы для обозначения каждого из видов атомов. Например: водород (Н), ртуть (Hg), кислород (О), углерод (С). Атомы разных видов отличаются друг от друга по своим химическим свойствам и массе. С физической величиной под названием «масса* вы уже познакомились в § 9. Что такое «химические свойства*, вы узнаете из курса химии.
По положению на 2005 год науке известны только 116 различных видов атомов. «Не может быть,— возразите вы.— Как это, только 116? Каждый из нас с легкостью перечислит 200—300, а может быть, и больше различных веществ*. Да, действительно, в мире существуют миллионы разных веществ. Как же соединить существование только 116 различных видов атомов с миллионами разных веществ? Дело в том, что вещества по большей части состоят из молекул.
Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов.
Ситуация с разными веществами очень похожа на составление тысяч разных слов из «только» 32 различных букв алфавита. В этом сравнении каждая буква — это, так сказать, отдельный атом, а каждое слово соответствует молекуле, т.е. определенному веществу.
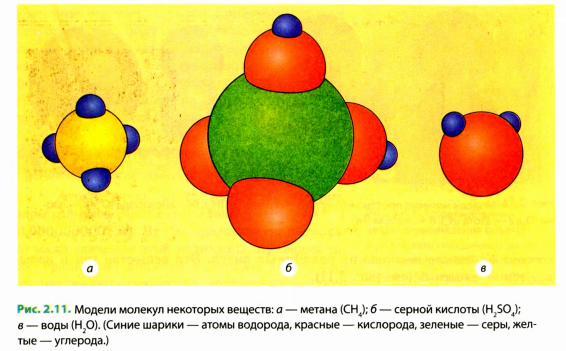
На рис. 2.11, а вы аидите схематическое изображение молекулы метана, состоящей из пяти атомов: четырех атомов водорода и одного атома углерода. Пользуясь нашей аналогией,— это слово из пяти букв. На рис. 2.11, б приведена схема более сложной молекулы серной кислоты, состоящей из семи атомов. Аналог этой молекулы — слово из семи букв. Из приведенных примеров понятно, что каждая новая молекула (новая комбинация атомов) соответствует новому веществу.
Простые и сложные вещества
Продолжим нашу аналогию сравнения веществ со словами. Вы, наверное, знаете, что рядом с обычными словами, состоящими из нескольких разных букв, мы иногда произносим и слова с использованием только одной буквы (например,
Совершенно очевидно, что слов, состоящих из нескольких букв, намного больше, чем слов из одной буквы. Так же и с веществами. Чаще всего в повседневной жизни мы сталкиваемся с веществами, молекулы которых состоят из атомов нескольких различных видов. Эти вещества так и называются — сложные (см. рис. 2.11).
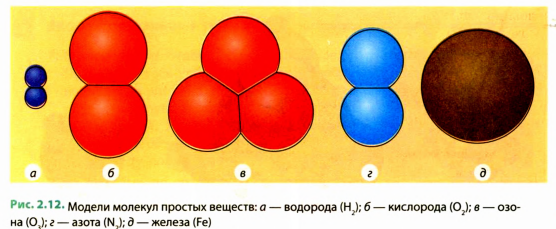
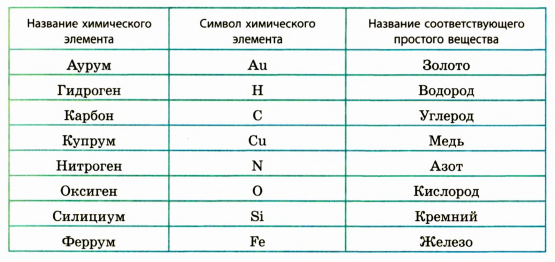
Напомним, что в научной литературе во избежание путаницы применяются разные названия для простых веществ и для химических элементов, из которых эти вещества состоят. Примеры названий простых веществ и соответствующих им химических элементов приведены в таблице.
Наличие промежутков между молекулами
После того как мы познакомились с наименьшими частичками вещества, давайте вспомним некоторые сведения о строении вещества.
В результате проведенных исследований ученые выяснили, что меж ду молекулами (атомами) существуют промежутки. Этот вывод ученых можно легко подтвердить довольно простым опытом. Если смешать 100 мл воды и 100 мл спирта, то объем смеси будет меньше, чем 200 мл. Дело в том, что при смешивании двух жидкостей молекулы воды попадают в промежутки между молекулами спирта. Приведенный опыт можно смоделировать, например, с помощью пшена и гороха (рис. 2.13). Наполните стакан до
половины пшеном, а потом прибавьте столько же гороха. Вы получите двухслойную композицию и полностью заполненный стакан. Аккуратно перемешайте эту композицию, и вы увидите, что объем смеси будет меньшим, чем исходный — часть пшена разместилась в пустотах между горошинами.
Размеры атомов
Атомы очень малы. Выяснено, что раз меры атомов приблизительно равны 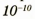
О размерах атомов также можно судить из такого примера. Если бы все люди нашей планеты проводили всю жизнь, занимаясь только счетом, то все вместе они смогли бы сосчитать атомы только в одной булавочной головке.
Строение атома
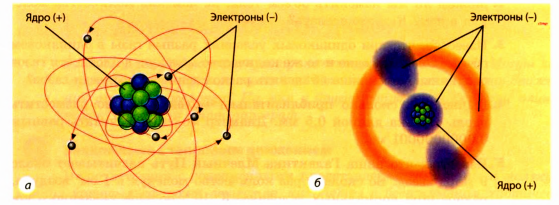
Опыты показали, что атом имеет сложную структуру. Он представляет собой положительно заряженное ядро, окруженное облаком легких частичек — электронов, имеющих отрицательный заряд (рис. 2.14). Масса ядра
Рис. 2.14. Модели атома: а — планетарная модель: в центре атома — ядро, вокруг ядра вращаются электроны; 6 — современная: электроны как бы «размазаны» по орбиталям — некоторым частям пространства, окружающего ядро. Для наглядности расстояние от ядра до электронов показано в 2—3 раза больше, чем диаметр ядра. На самом деле это расстояние превышает размеры ядра в 100000 раз незначительно отличается от массы атома. Масса же электронов в сравнении с ядром очень мала.
Конечно, приведенные в этом параграфе данные — это только незначительная часть современных сведений об атомах и молекулах. С некоторыми другими их свойствами вы познакомитесь в следующих параграфах, кое о чем узнаете в старших классах.
Итоги:
Все вещества состоят из мелких частичек — молекул или атомов. Между молекулами (атомами) существуют промежутки.
Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов. Атом имеет сложную структуру и представляет собой положительно заряженное ядро, окруженное облаком легких частичек — электронов, имеющих отрицательный заряд.
Строение вещества
Вокруг нас существует множество физических тел — и все они отличаются друг от друга, в частности, веществом, из которого состоят, и массой.
Атомы
Тела состоят из вещества. Вопрос о строении вещества интересовал ученых еще в глубокой древности.
Одни ученые считали, что вещество можно делить на меньшие части бесконечно. Например, говорили они, каплю воды можно дробить сколько угодно, но и самые малые капли все равно остаются каплями воды! И предела такому делению не видно, из чего эти ученые делали вывод, что такого предела не существует.
Другие же ученые, в числе которых был древнегреческий философ Демокрит, живший в 5-м веке до нашей эры, проявили большую проницательность. Демокрит утверждал, что вещество состоит из крошечных неделимых частиц, настолько малых, что их даже не видно. Например, вода, высыхая, не исчезает, а дробится на мельчайшие, невидимые глазом частицы. Демокрит назвал неделимые частицы вещества «атомами»1.
Так Демокрит, опережая свое время на тысячелетия, высказал гениальную мысль: существовать может даже то, что нс видно глазом! Свое предположение о строении вещества Демокрит выразил знаменитыми словами: «в мире есть только атомы и пустота».
Но лишь через две с половиной тысячи лет, в 19-м веке, ученые получили первые опытные подтверждения атомного строения вещества.
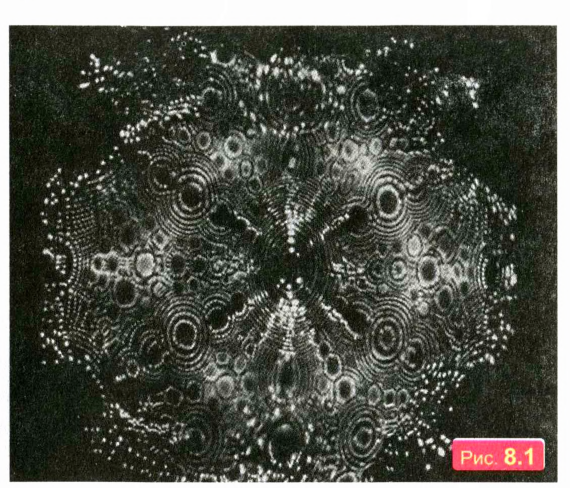
В 20-м веке наука достигла уровня, когда ученые смогли увидеть атомы. На рис. 8.1 вы видите фотографию по верхности острия иглы (из тугоплавкого металла вольфрама), сделанную с помощью специального микроскопа, роль пучков света в котором играли пучки заряженных частиц. Кружки — это изображения отдельных атомов вольфрама!
В многочисленных опытах установлено, что все окружающие нас тела состоят из атомов.
Из атомов состоят и наши собственные тела! Это долгое время казалось непостижимым: как живые существа могут состоять из неживых атомов? Сегодня ответ на этот вопрос уже найден: выяснилось, что строение живых тел очень сильно отличается от строения неживых тел. Об этом мы расскажем в разделе «Хочешь узнать больше?».
Ученым известно сегодня более 100 различных типов атомов. Массы всех атомов приближенно кратны массе самого легкого атома — атома водорода1. Например, масса следующего по массе атома — атома гелия примерно в 4 раза больше массы атома водорода, а масса атома углерода примерно в 12 раз больше массы атома водорода.
Мы не случайно упомянули об углероде: в качестве атомной единицы массы (ее обозначают а. е. м.) принята именно 1/12 массы атома углерода. Например, масса атома водорода равна I а. е. м., масса атома гелия — 4 а. е. м., масса атома кислорода — 16 а. е. м., а масса атома железа — 56 а. е. м.
Молекулы
На достаточно малых расстояниях атомы притягиваются друг к другу, благодаря чему атомы объединяются в молекулы.
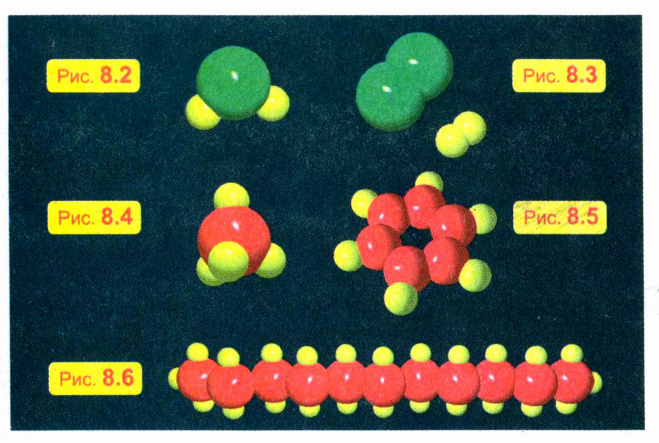
Так, молекула воды состоит из одного атома кислорода и двух атомов водорода. На рис. 8.2 показана модель молекулы воды: атом кислорода условно обозначен зеленым цветом, а атом водорода — желтым. Рядом на рис. 8.3 вы видите модели молекул кислорода и водорода: каждая из них состоит из двух одинаковых атомов.
На рис. 8.4 изображена модель молекулы метана — вещества, которое входит в состав природного газа. Эта молекула состоит из одного атома углерода и четырех атомов водорода. Атомы углерода часто образуют как бы своеобразный «остов» для построения больших молекул. Например, на рис. 8.5 изображена модель «кольцевой» молекулы бензола, в состав которой входят 6 атомов углерода и 6 атомов водорода, а на рис. 8.6 — модель молекулы, состоящей из нескольких десятков атомов.
Среди огромного многообразия молекул, построенных на основе атомов углерода, есть и состоящие из миллионов атомов! Это как раз молекулы, входящие в состав живых существ, в том числе и нас с вами. О таких молекулах мы расскажем в разделе «Хочешь узнать больше?».
Свойства вещества определяются типом его молекул, то есть молекула является мельчайшей частицей данного вещества.
Например, вода состоит из молекул, в состав которых входят атомы водорода и кислорода, но при комнатной температуре вода — жидкость, а водород и кислород — газы.
Ученым сегодня известно несколько миллионов типов молекул. И каждый тип молекул соответствует определенному веществу со своими свойствами.
Размеры молекул и атомов
ПОСТАВИМ ОПЫТ
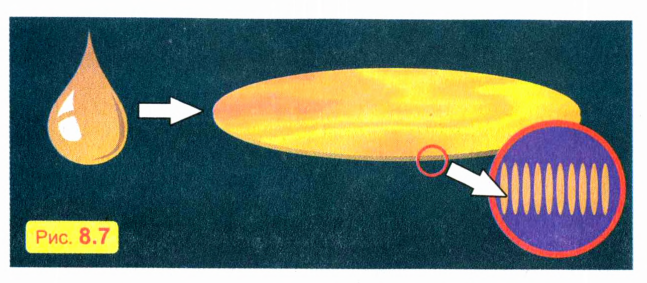
Капнем на поверхность воды капельку масла (лучше взять оливковое масло). Масло растечется по поверхности воды очень тонким слоем. Однако толщина масляной пленки не может быть меньше размера молекулы масла. Это и определяет максимальную площадь пленки (рис. 8.7). Так, опыты показывают, что капелька оливкового масла объемом 1 мм3 растекается по площади не более 1 м2.
Зная объем капельки и площадь масляной пленки, можно оценить длину молекулы масла (эти молекулы имеют удлиненную форму и располагаются на поверхности воды перпендикулярно поверхности). Если из капельки объемом 1 мм3 образуется масляная пленка площадью 1 м2, значит, толщина пленки, равная примерно длине молекулы масла, составляет около 1 нанометра (нм), то есть одной миллиардной части метра! Учтите, что молекула масла состоит из многих атомов.
Наименьшая молекула — одноатомная молекула гелия (около 0,2 нм). Размер молекулы воды, состоящей из двух атомов водорода и одного атома кислорода, немного больше: около 0,3 нм.
Итак, характерной длиной в мире атомов и молекул является 0,1 нм.
Чтобы вы смогли представить размеры молекул, приведем сравнения.
- В одной чайной ложке воды содержится примерно столько же молекул воды, сколько чайных ложек воды содержится в Мировом океане (то есть во всех морях и океанах Земли вместе взятых). Значит, чтобы пересчитать молекулы воды в чайной ложке, нужно было бы потратить столько же времени, сколько для того, чтобы вычерпать чайной ложечкой весь Мировой океан!
- Атом водорода примерно во столько раз меньше сливы, во сколько раз сама слива меньше земного шара. Представьте себе, что огромная Земля состоит вся из слив, — и вы получите некоторое представление о том, как сама слива состоит из атомов!
Живые молекулы
Все живые существа состоят из огромных, чрезвычайно сложно устроенных молекул.
Например, в каждом существе есть особые молекулы, в которых последовательностью атомов «записана» вся так называемая «наследственная информация» — подобно тому, как в книге буквами набран текст.
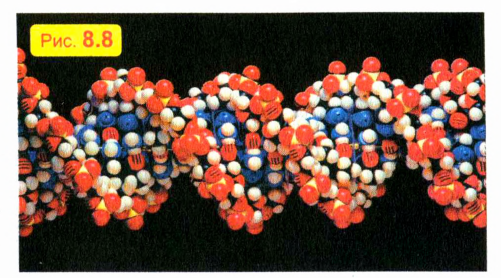
Только благодаря невероятно тонкой и точной «работе» таких молекул ребенок похож на своих родителей: котенок — на кошку, а слоненок — на слона. Модель короткого фрагмента такой «наследственной» молекулы показана на рис. 8.8. Эти молекулы свернуты в длиннейшие спирали. Чтобы дать вам представление о числе и длине этих молекул, скажем только, что если бы «наследственные» молекулы, содержащиеся в организме одного человека, выстроить в один ряд, то их общая длина была бы в сто раз больше расстояния от Земли до Солнца!
Молекулы, из которых состоят живые существа, часто называют биологическими. Строение и взаимодействие биологических молекул напоминают строение и работу сложных механизмов. Для изучения структуры и действия биологических молекул физика и биология, объединившись, породили новую науку — биофизику. Эта наука изучает строение живых организмов, используя методы не только физики и биологии, но и других наук, например химии и информатики.
Действительно ли атом неделим
В начале 20-го века ученые смогли проникнуть и вглубь атома. Английский ученый Эрнест Резерфорд, «обстреливая» атомы пучками быстрых частиц, установил, что некоторые из этих частиц при столкновении с атомами «отскакивают» назад! Объяснить это можно было только тем, что внутри атома существует крошечное атомное ядро, в котором сосредоточена практически вся масса атома.
Расчеты, сделанные Резерфордом, показали, что размеры атомного ядра примерно в сто тысяч раз меньше размеров атома. То есть, если атом увеличить до размеров цирковой арены, то атомное ядро было бы «маковым зернышком» посреди арены!
Так что Демокрит, утверждавший, что в природе есть только атомы и пустота, недооценил «роль» пустоты: оказалось, что и атомы «наполнены» в основном пустотой!
Ядро имеет положительный электрический заряд, а вокруг ядра движутся очень легкие отрицательно заряженные частицы — электроны. Это напоминает Солнечную систему. Сходство атома с Солнечной системой усиливается еще и тем, что почти вся масса Солнечной системы сосредоточена в Солнце: масса всех планет, вместе взятых, составляет около одной тысячной части массы Солнца.
Исходя из этого, Резерфорд предложил «планетарную» модель атома, согласно которой электроны в атоме движутся вокруг атомного ядра подобно тому, как планеты движутся вокруг Солнца. Однако затем выяснилось, что движение электронов происходит совершенно по другим законам, чем движение планет. Подробнее об этом вы узнаете из курса физики следующих классов.
Таким образом, оказалось, что атом делим: он состоит из атомного ядра и электронов. Сразу же возник вопрос: является ли неделимым атомное ядро?
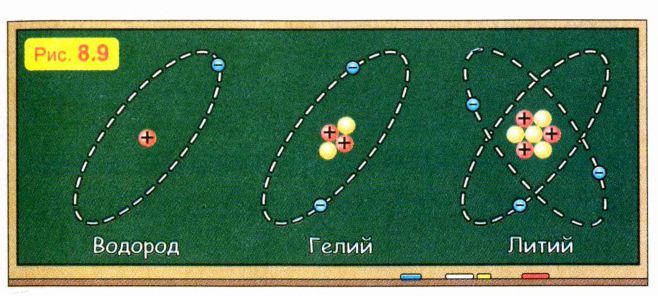
В последующих опытах (в том числе поставленных тем же Резерфордом) выяснилось, что ядро атома состоит из частиц двух типов — положительно заряженных протонов и нейтронов, не имеющих электрического заряда. Массы протона и нейтрона оказались приблизительно одинаковыми. Это объяснило, почему массы всех атомов приближенно кратны массе атома водорода: ядро атома водорода состоит из одного протона, а ядра всех других атомов состоят из частиц примерно равной массы, как из одинаковых «кирпичиков».
На рис. 8.9 схематически изображено строение простейших атомов — атомов водорода, гелия и лития.
Однако на этом путешествие «вглубь материи» не остановилось: во второй половине 20-го века ученые открыли, что протон и нейтрон — также составные частицы! Подробнее об этом вы тоже узнаете из курса физики следующих классов.
Броуновское движение
В начале 19-го века английский ботаник Роберт Броун, наблюдая в микроскоп крошечные частицы цветочной пыльцы, взвешенные в воде, сделал удивительное открытие. Он увидел, что частицы пыльцы пребывают в «вечной пляске», непрестанно хаотически двигаясь.
Ученый предположил, что частицы пыльцы движутся потому, что они живые, и повторил опыт с растолченными в мельчайшую пыль кусочками камня. Но и частички камня «плясали без устали»! Это движение, которое назвали броуновским, оставалось загадкой в течение 50 лет. Только в конце 19-го века ученые пришли к выводу, что оно обусловлено бомбардировкой этих частиц молекулами воды. Если частица очень мала, удары молекул воды по ней с разных сторон не компенсируют друг друга, что и вызывает непрестанное хаотическое движение частицы.
На рис. 9.1 приведена сделанная с помощью микроскопа фотография, которая хорошо иллюстрирует хаотичность движения броуновских частиц. На этой фотографии отрезками соединены последовательные положения частицы через 1 мин.
Броуновское движение является опытным подтверждением молекулярного строения вещества и движения молекул.
Броуновское движение играет роль «мостика» между макромиром — миром наблюдаемых непосредственно тел — и микромиром — миром молекул и атомов.
С какими скоростями движутся молекулы
Скорости молекул ученые вычислили теоретически в конце 19-го века. Результат оказался поразительным: согласно расчетам, в окружающем нас воздухе молекулы носятся со скоростями артиллерийских снарядов — сотни метров в секунду!
Такие скорости молекул показались некоторым ученым неправдоподобно большими, вследствие чего они ставили под сомнение существование молекул. Однако в начале 20-го века скорости молекул удалось измерить на опыте, и опыт подтвердил теоретические выводы. Согласно расчетам, подтвержденным опытами, с повышением температуры скорость хаотического движения молекул увеличивается.
Почему же мы не ощущаем своей кожей «обстрела» молекулами, движущимися с такими огромными скоростями? Дело в том, что массы молекул чрезвычайно малы, а их удары — очень частые. И поэтому «барабанная дробь» быстрых ударов крошечных молекул проявляет себя как постоянное давление воздуха. Как показывают опыты, при комнатной температуре атомы и молекулы в жидкостях и твердых телах движутся также со скоростями артиллерийских снарядов.
Диффузия
ПОСТАВИМ ОПЫТ
Капнем каплю духов в одном конце комнаты. Через некоторое время запах духов распространится по всей комнате. Как вы догадались, это означает, что молекулы ароматических веществ, входящие в состав духов, «разлетелись» по всей комнате, то есть произошло проникновение молекул одного вещества в другое.
Диффузией называют обусловленное движением молекул взаимное проникновение частиц одного вещества в другое.
Почему же молекулы ароматических веществ не долетели до нас практически мгновенно, раз они движутся со скоростями артиллерийских снарядов? Дело в том, что при своем движении эти молекулы многократно сталкиваются с молекулами, из которых состоит воздух, поэтому их траектории похожи на траектории движения броуновских частиц. Распространению запахов способствуют потоки воздуха.
Диффузия является опытным подтверждением движения молекул.
Диффузия происходит также в жидкостях и даже в твердых телах.
ПОСТАВИМ ОПЫТ
Капните в чашку с водой каплю чернил или йода. Вы увидите, что благодаря диффузии капля «ветвится» и постепенно «тает», придавая слабую окраску всей воде (рис. 9.2—9.4).
Диффузия в жидкостях происходит значительно медленнее, чем в газах, хотя в жидкостях молекулы движутся примерно с такими же скоростями, как и в газах. Дело в том, что в отличие от газов, где молекулы расположены на довольно больших расстояниях друг от друга (в несколько раз больше размеров самих молекул), в жидкостях молекулы расположены практически вплотную. И поэтому в и процессе диффузии одним молекулам приходится как бы «проталкиваться» сквозь плотную «толпу» других молекул. Это и замедляет процесс диффузии. Схематически процесс диффузии в жидкостях изображен на рис. 9.5—9.7.
Обнаружить диффузию в твердых телах намного труднее, чем в жидкостях и газах. Но все-таки можно. Например, был поставлен такой опыт. Под пресс положили отполированные пластины золота и свинца, и через несколько лет в свинце удалось обнаружить атомы золота, а в золоте — атомы свинца: атомы одной пластины проникли в другую пластину вследствие диффузии. Чем же объясняется столь медленная диффузия в твердых телах? Дело в том, что молекулы или атомы твердых веществ расположены обычно не только вплотную, но еще и «стройными рядами». Чтобы «протиснуться» даже сквозь один такой ряд, молекуле приходится предпринимать миллионы «попыток»! В результате скорость диффузии в твердых телах очень мала.
Взаимодействие молекул
О взаимодействии молекул свидетельствует уже само существование жидкостей и твердых тел.
Притяжение молекул
Если бы молекулы не притягивались друг к другу, жидкости и твердые тела сразу распались бы на отдельные молекулы, превратившись в газы: газообразное состояние вещества как раз и соответствует сравнительно слабому взаимодействию молекул.
Молекулы разных тел также притягиваются друг к другу: этим можно объяснить, например, действие клея.
ПОСТАВИМ ОПЫТ
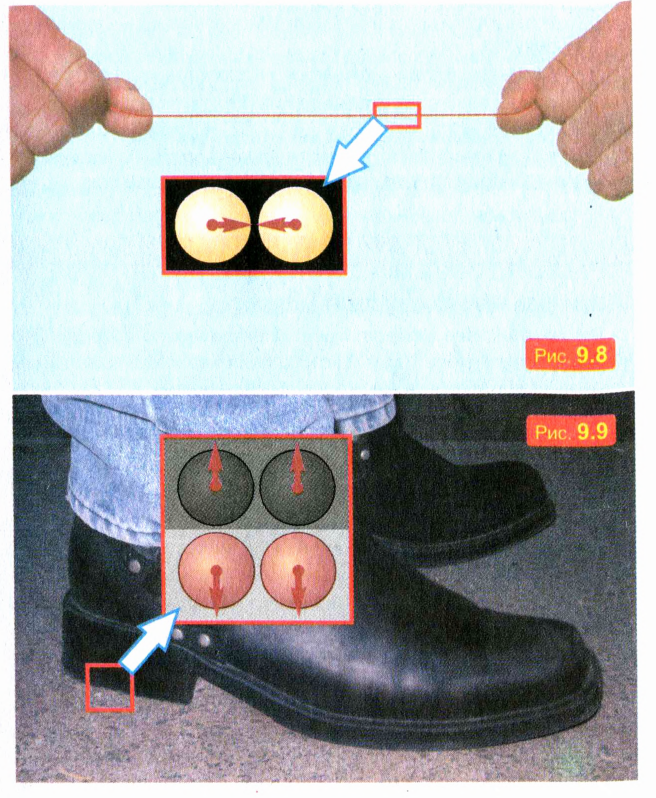
Чтобы получить представление о величине сил притяжения между молекулами, попробуйте разорвать руками капроновую нить сечением 1 мм2. Вряд ли вам удастся это сделать, хотя усилиям всего вашего тела «противостоят» силы притяжения крошечных молекул в малом сечении проволоки или нити. Эти силы схематически показаны на рис. 9.8.
Отталкивание молекул
Если бы молекулы только притягивались, нельзя было бы понять, почему жидкости и твердые тела практически несжимаемы, то есть сильно «противятся» уменьшению их объема.
Это их свойство можно объяснить отталкиванием молекул. Отталкивание молекул обусловливает также взаимодействие твердых тел при непосредственном контакте, когда тела _ «упираются» друг в друга. Например, вы не проваливаетесь сквозь пол потому, что молекулы ваших подошв отталкиваются от молекул, из которых состоит пол. Эти силы отталкивания схематически изображены на рис. 9.9. Таким образом, мы можем сделать вывод, что молекулы взаимодействуют друг с другом: на очень малых расстояниях молекулы отталкиваются, а на несколько больших — притягиваются.
Когда расстояния между молекулами намного больше их размеров, молекулы почти совсем не взаимодействуют.
Основные положения молекулярно-кинетической теории
Исходя из описанных выше наблюдений и опытов, можно сформулировать следующие положения:
- все вещества состоят из мельчайших частиц — атомов и молекул;
- частицы вещества хаотически и непрестанно движутся;
- частицы вещества взаимодействуют друг с другом.
Эти положения лежат в основе молекулярно-кинетической теории — современного учения о строении вещества.
Природа взаимодействия молекул
Взаимодействие молекул имеет электрическую природу. Это взаимодействие носит довольно сложный характер, поэтому мы ограничимся тут только некоторыми пояснениями.
Отталкивание молекул на очень малых расстояниях обусловлено тем, что, когда молекулы расположены вплотную друг к другу, основную роль играет взаимодействие «внешних частей» их атомов, то есть электронов. Электроны заряжены отрицательно, а одноименно заряженные частицы отталкиваются. При увеличении расстояния между молекулами основную роль начинает играть притяжение между положительно заряженными ядрами атомов, входящих в состав одной молекулы, и отрицательно заряженными электронами, входящими в состав атомов другой молекулы. Поэтому отталкивание молекул сменяется их притяжением.
Сложный характер взаимодействия молекул удалось понять только в 20-м веке, когда физики создали квантовую механику — науку о движении и взаимодействии мельчайших частиц вещества. Об основных ее положениях вы узнаете из курса физики старших классов.
Почему движение молекул никогда не прекращается
Движение молекул разительно отличается от движения окружающих нас предметов. Движение предметов, как вы уже знаете, из-за трения замедляется и наконец прекращается. А вот движение молекул не прекращается никогда. Почему же не останавливаются из-за трения молекулы? Дело в том, что вследствие трения механическое движение превращается в хаотическое (тепловое) движение молекул — ведь в результате трения тела нагреваются. Но самим молекулам «передать» энергию своего движения уже некуда — они движутся в пустоте, сталкиваясь только друг с другом. В результате столкновений молекул их энергия только перераспределяется между ними. Вечное движение крошечных молекул сходно в этом смысле с вечным движением огромных планет: планеты, как и молекулы, движутся в пустоте, и поэтому их механическая энергия остается практически неизменной в течение миллионов лет.
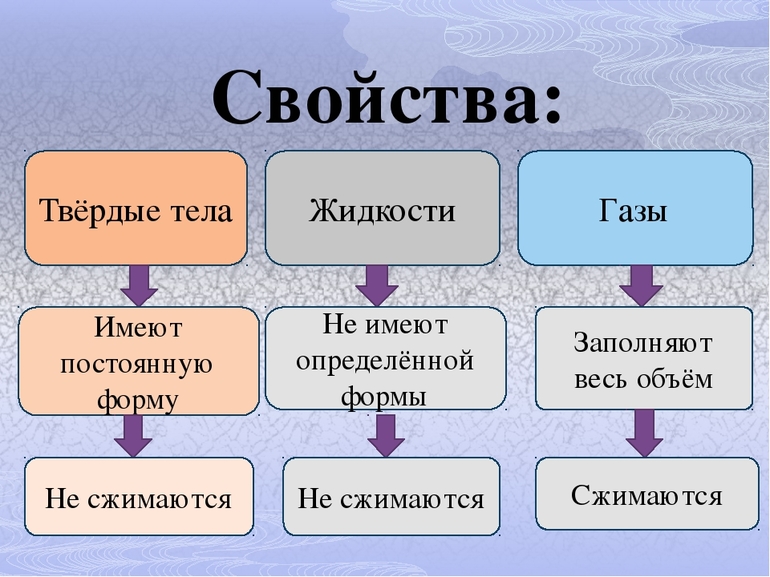
Газы
Как вы уже знаете, вещество может находиться в трех состояниях: твердом, жидком и газообразном. Эти состояния вещества называют агрегатными состояниями.
Свойство газов
В этом параграфе мы опишем опыты и наблюдения над газами, а затем расскажем о молекулярном строении газов, которым обусловлены их свойства. Наглядным примером газа является окружающий нас воздух. Мы живем «на дне» огромного воздушного океана глубиной в десятки километров. Это атмосфера. На рис. 10.1 вы видите сделанную из космоса фотографию атмосферы Земли.
Воздух состоит в основном из двух газов — азота (около 80 %) и кислорода (около 20 %). Все живые существа дышат кислородом, находящимся в воздухе (рыбы дышат воздухом, растворенным в воде). Поэтому о чем-то крайне нужном часто говорят: «нужен как воздух».
Воздух кажется нам очень легким. Но и он имеет вес, причем немалый: на каждый квадратный сантиметр поверхности Земли атмосферный воздух давит с силой, равной весу килограммовой гири. Например, на поверхность стола площадью 1 м2 воздух давит с силой, равной примерно весу груженого самосвала (рис. 10.2)! Стол «выдерживает» силу давления воздуха потому, что примерно с такой же силой воздух давит и на нижнюю поверхность стола. О том, что воздух давит и снизу, свидетельствуют воздушные шары (рис. 10.3): они держатся в воздухе только потому, что воздух давит на них снизу с большей силой, чем сверху!
Воздух давит и на поверхность тел живых существ. И не расплющивает он их потому, что ткани их тел оказывают сопротивление воздуху (рис. 10.4).
Давление воздуха вы будете изучать в следующем учебном году. Вы можете «почувствовать» воздух, подставив лицо или руку ветру. На восходящих потоках воздуха парят птицы и дельтапланы (рис. 10.5).
Человек начал использовать силу ветра еще в древности: именно с ее помощью он путешествовал по морям и океанам, открывая и заселяя новые земли (рис. 10.6).
Силу ветра использовали также в ветряных мельницах, а сегодня используют в ветровых электростанциях. Так что «пустой» стакан или тем более «пустая» комната не так уж пусты! Например, масса воздуха в комнате средних размеров примерно равна массе взрослого человека (рис. 10.7).
ПОСТАВИМ ОПЫТ
Погрузите банку вверх дном в воду: вы увидите, что вода не заполняет «пустую» банку (рис. 10.8)! Это происходит потому, что в банке остался воздух. Наклоните банку, и вы увидите, как он выходит из банки пузырьками. Отличительная особенность газов состоит в том, что газ занимает весь предоставленный ему объем.
Именно поэтому, например, мяч при надувании наполняется воздухом равномерно во всем объеме.
Может возникнуть вопрос: если газ занимает весь предоставленный ему объем, то почему атмосфера Земли не «разлетается»? Дело в том, что атмосферу удерживает довольно большая сила притяжения Земли. А вот, например, Луна не «смогла» удержать свою атмосферу, так как ее сила притяжения намного меньше.
ПОСТАВИМ ОПЫТ
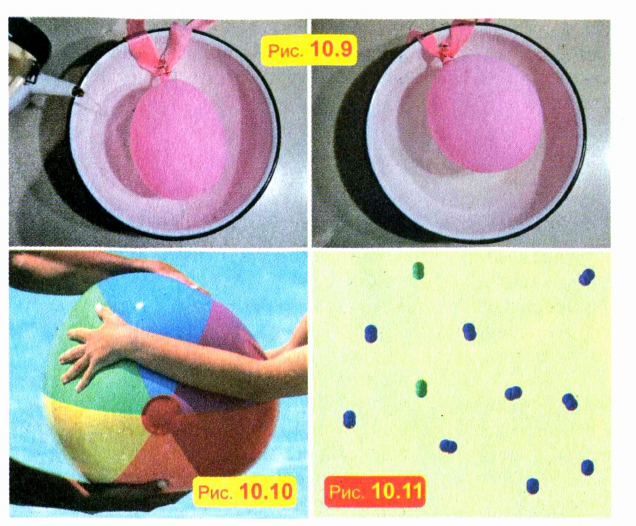
Положите слабо надутый воздушный шарик в кастрюлю и налейте в нее горячую воду. Шарик надуется, хотя масса заключенного в шарике воздуха не увеличилась (рис. 10.9). Это можно объяснить тем, что газы при нагревании расширяются.
При нагревании на тысячу градусов объем газа увеличивается в несколько раз! Способность газа многократно увеличивать свой объем при нагревании используют в тепловых двигателях: нагретый газ толкает поршень, движение которого передается, например, колесам автомобиля. Как мы увидим далее, жидкости и твердые тела при нагревании также расширяются, но значительно меньше, чем газы.
ПОСТАВИМ ОПЫТ
Попробуйте сжать руками какой-либо твердый предмет, скажем, кусок дерева или кирпич. Вряд ли вам это удастся.
Не удастся вам сжать и кожаный мяч, полностью наполненный водой. А вот слабо надутый мяч или шар сжать очень легко (рис. 10.10). Таким образом, в отличие от твердых и жидких тел, газы легко сжимаемы.
Молекулярное строение газов
Сжимаемость газов объясняется тем, что молекулы в газах расположены не вплотную. Например, в окружающем нас воздухе расстояния между молекулами примерно в 10 раз больше размеров молекул. Молекулярное строение газа схематически показано на рис. 10.11.
Находясь «вдали» друг от друга, молекулы газов практически не взаимодействуют друг с другом. Вследствие столкновений движение молекул газа носит хаотический характер. Поэтому газ и заполняет весь предоставленный ему объем.
Жидкости
Самая распространенная на Земле жидкость — вода, хотя, как мы увидим, она обладает некоторыми исключительными свойствами.
ПОСТАВИМ ОПЫТ
Налейте воду в любой сосуд — вода «послушно» примет форму этого сосуда (рис. 11.1).
Этот опыт показывает, что жидкость принимает форму сосуда, в котором она находится.
Обусловлено это тем, что жидкость обладает текучестью, то есть очень легко изменяет свою форму под действием внешних сил. На жидкость в сосуде действуют сила тяжести и давят стенки сосуда — вот почему жидкость и принимает форму сосуда.
Но говорить, что «жидкость не имеет своей формы», все-таки нельзя! Мы расскажем об этом в разделе «Хочешь узнать больше?».
Свойства жидкостей
Легко изменяя свою форму, жидкость в то же время «упорно» противится сжатию, то есть уменьшению объема. Однажды поставили такой опыт. Толстостенную свинцовую сферу через небольшое отверстие заполнили водой, запаяли отверстие и подвергли сферу очень сильному сжатию. И что же получилось? Вода не сжалась, а просочилась сквозь металл: на поверхности свинцовой сферы выступили капли воды!
Этот и подобные ему опыты показывают, что жидкости обладают малой сжимаемостью.
Это жидкости существенно отличаются от легкосжимаемых газов. Можно сказать, что жидкость по своим свойствам напоминает песок: изменить форму песка очень легко, но изменить объем данной массы песка — трудно. Это сходство жидкости с песком, как мы скоро увидим, обусловлено молекулярным строением жидкости.
Объем жидкости трудно не только уменьшить — его настолько же трудно и увеличить. Другими словами, жидкость сохраняет свой объем (при постоянной температуре). Поэтому в отличие от газа жидкость не обязательно занимает весь объем сосуда: например, воду в стакан можно налить до половины (а вот наполнить стакан газом «до половины» невозможно). На границе с воздухом жидкость образует свободную поверхность.
ПОСТАВИМ ОПЫТ
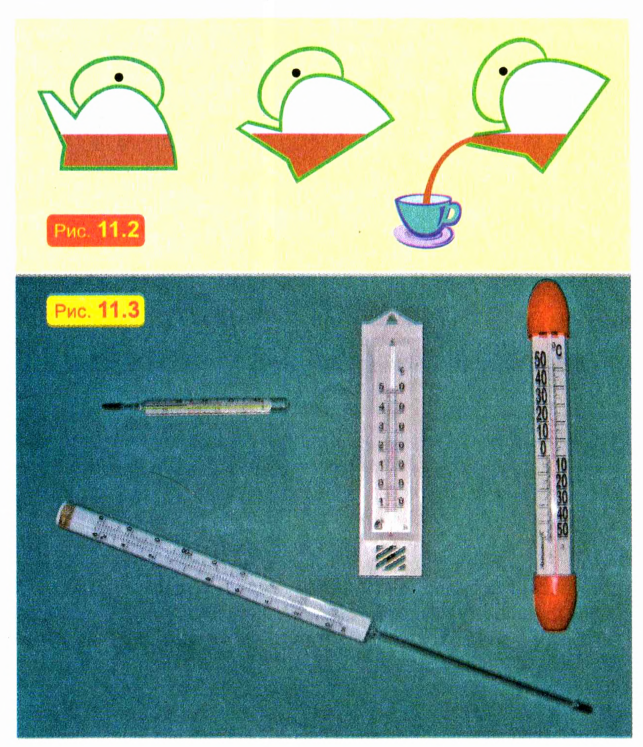
Налейте в стакан воду до половины и медленно наклоните стакан. Вы увидите, что поверхность воды остается горизонтальной. Это обусловлено текучестью жидкости: под действием силы тяжести вода стремится занять как можно более низкое положение. Именно по этой причине вода и выливается из наклоненного сосуда (рис. 11.2).
При нагревании жидкости расширяются — значительно меньше, чем газы, но значительно больше, чем твердые тела. Это используют, в частности, при изготовлении жидкостных термометров — приборов для измерения температуры (рис. 11.3).
Поскольку жидкость при нагревании расширяется сильнее, чем твердая «оболочка» термометра, высота столба жидкости вследствие нагревания увеличивается. А чтобы увеличение объема было заметнее, термометр сконструирован так, что жидкость поднимается внутри тонкой трубки. Однако не все жидкости и не всегда при нагревании расширяются! Важным исключением является самая распространенная на Земле жидкость — вода. О ее «поведении» при нагревании мы расскажем в разделе «Хочешь узнать больше?».
Молекулярное строение жидкостей
Схематически расположение молекул в жидкости показано на рис. 11.4.
Молекулы в жидкости расположены вплотную друг к другу, но в этом расположении нет определенного порядка.
Как видно, расположение молекул в жидкости напоминает расположение песчинок в куче песка. Этим и обусловлено упомянутое выше сходство жидкости с песком.
Молекулы жидкости хаотически движутся, но их движение сильно ограничено молекулами-«соседями». Поэтому движение молекул жидкости напоминает движение людей в толпе: молекулы «толкаются», время от времени меняясь местами друг с другом. Именно эти «перескоки» и сообщают жидкости текучесть. Когда на жидкость действуют внешние силы, «перескоки» молекул в одном направлении происходят чаще, чем в других направлениях, вследствие чего форма жидкости изменяется. А поскольку эти «перескоки» происходят очень часто, форма жидкости меняется настолько быстро, что мы говорим: жидкость течет.
Плотность вещества
Тела, состоящие из одинакового вещества, могут иметь различные массы: например, масса воды в полном ведре примерно в 50 раз больше массы воды в полном стакане. И объем воды в ведре примерно в 50 раз больше объема воды в стакане.
Для всех тел, состоящих из одинакового вещества, отношение массы к объему одинаково.
Отношение массы т однородного образца данного вещества к его объему V называют плотностью 
Плотность является характеристикой вещества, а нс конкретного тела. Единицей плотности в SI является 1 кг/м3. Плотность воды равна 1000 кг/м3, а плотность воздуха — примерно 1,3 кг/м3, то есть почти в 770 раз меньше. Плотность воды намного больше плотности воздуха из-за того, что в жидкости, в отличие от газа, молекулы расположены вплотную.
Почему капли круглые
Утверждение, что жидкость «не имеет своей формы», а всегда принимает форму сосуда, не совсем правильно.
ПОСТАВИМ ОПЫТ
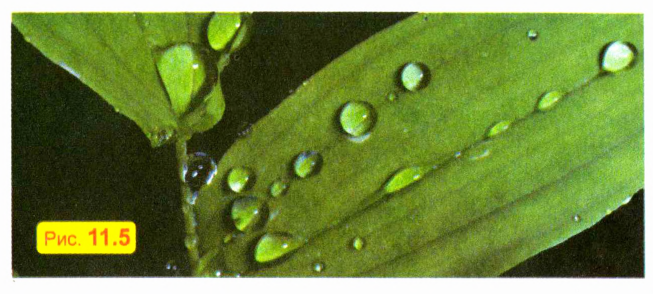
Капните водой на тарелку, смазанную любым жиром (например, сливочным или растительным маслом). Вы увидите, что капли не растекаются, а сохраняют примерно шарообразную форму. Такую же форму имеют и капельки росы на траве и листьях (рис. 11.5). Это обусловлено тем, что жидкость стремится уменьшить площадь своей поверхности, а из всех тел с заданным объемом наименьшую площадь поверхности имеет шар.
При «земных» условиях сила тяжести и давление стенок сосуда «заставляют» жидкость принять форму сосуда. А для малой капли основную роль играет стремление жидкости уменьшить площадь поверхности.
Почему зимой реки и озера не промерзают до дна
Удивительным свойством воды, отличающим ее от других жидкостей, является то, что при нагревании от О °C до 4 °C вода не расширяется, а сжимается, вследствие чего плотность воды максимальна при температуре 4 °C. Благодаря этому зимой «тяжелая» вода с температурой 4 °C опускается на дно рек и озер. Вот почему реки и озера в средних широтах редко промерзают зимой до дна (если они не слишком мелкие). А от этого радость не только рыбам, но и рыбакам — любителям подледного лова.
Твердые тела
Как вы уже знаете, твердые тела сохраняют объем и форму.
Свойства твердых тел
Твердые тела сильно отличаются по своим свойствам.
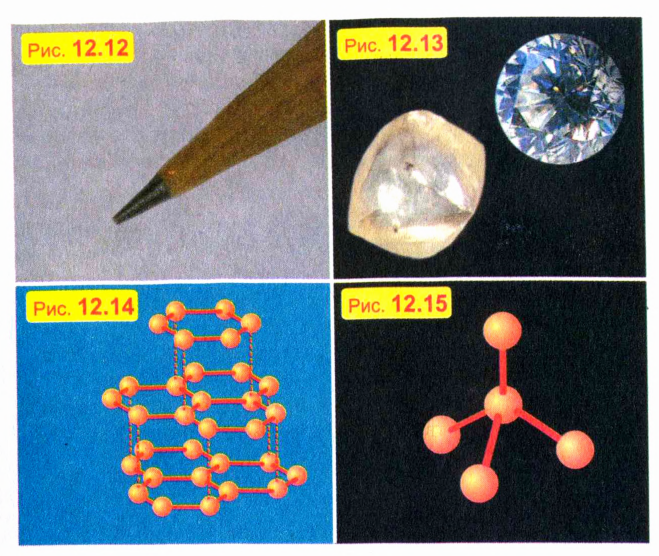
Во-первых, они отличаются друг от друга твердостью. Например, хорошо известна мягкость графита, из которого делают стержни карандашей. Но есть и «по-настоящему» твердые тела, например стекло или чугун. «Чемпионом» же по твердости считаю! алмаз: он оставляет царапины на любом другом теле. Поэтому из алмаза изготовляют особо твердые режущие инструменты.
Во-вторых, твердые тела отличаются друг от друга хрупкостью. Так, стеклянный стакан — хрупкое тело: при ударе он разрушается. А свинцовый брусок — пластичное тело: при ударе он лишь изменяет форму.
Расширение твердых тел при нагревании
ПОСТАВИМ ОПЫТ
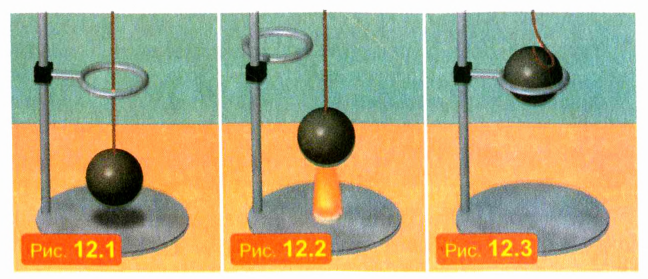
Возьмем металлические шар и кольцо, размеры которых подогнаны так, что при одинаковой температуре шар проходит сквозь кольцо почти без зазора (рис. 12.1). Нагреем шар (рис. 12.2). Мы увидим, что нагретый шар не проходит сквозь кольцо (рис. 12.3). Обусловлено это тем, что твердые тела при нагревании расширяются.
Твердые тела при нагревании расширяются значительно меньше, чем жидкости и газы. Например, стальной метровый стержень при нагревании на 1 °C удлиняется примерно на одну сотую долю миллиметра.
Однако если бы строители и инженеры не учитывали теплового расширения материалов, то это приводило бы к разрушению зданий, мостов и дорог, а также к обрывам линий электропередач! Так, пролет моста при нагревании может удлиниться на несколько сантиметров. Вы, наверное, замечали, что провода линий электропередач заметно провисают, особенно летом (рис. 12.4). Объяснить это провисание очень просто: если бы летом провода были натянутыми, то зимой они просто порвались бы!
Например, в кристалле поваренной соли атомы натрия и хлора строго чередуются, располагаясь в вершинах куба, — поэтому кристаллы соли и имеют форму куба. А в кристалле льда молекулы воды располагаются в вершинах шестиугольников — вот почему узор всех снежинок имеет шестиугольный «каркас». На рис. 12.7 схематически изображена кристаллическая решетка поваренной соли, а на рис. 12.8 — кристаллическая решетка льда.
Кристаллы
Есть два типа твердых тел — кристаллические и аморфные. Рассмотрим сначала кристаллические тела, которые часто называют кристаллами. Примерами кристаллов являются знакомые вам поваренная соль и сахар.
ПОСТАВИМ ОПЫТ
Рассмотрите через увеличительное стекло кристаллики соли или сахара: у них ровные, будто специально срезанные, грани. Можно вырастить и большой кристалл: на рис. 12.5 изображен такой кристалл соли. Очень красивы снежинки (рис. 12.6), являющиеся кристалликами льда. Но как бы ни были разнообразны снежинки, в основе их узора всегда лежит правильный шестиугольник! Правильная форма кристаллов обусловлена тем, что атомы или молекулы в кристаллах расположены упорядоченно, образуя кристаллическую решетку.
Аморфные тела
С аморфными телами вы также встречаетесь каждый день: например, аморфными телами являются стеклянные предметы (рис. 12.9). Аморфные тела обладают текучестью, но значительно меньшей, чем жидкости. Текучесть аморфных тел возрастает с повышением температуры, благодаря чему, например, из капли нагретого стекла можно «выдувать» стеклянные сосуды, подобно тому как выдувают мыльные пузыри. На рис. 12.10 изображена капля «полужидкого» стекла.
Опыты показывают, что стекло обладает некоторой текучестью даже при комнатной температуре. Это подтверждают, в частности, наблюдения за окнами старинных зданий: оконные стекла в них за много лет «оплыли», став толще внизу. Текучесть аморфных тел обусловлена тем, что в аморфных телах нет кристаллической решетки.
На рис. 12.11 схематически изображено молекулярное строение аморфного тела. Оно напоминает молекулярное строение жидкости, поэтому аморфные тела занимают промежуточное положение между жидкостями и кристаллами. Из-за отсутствия кристаллической решетки атомы или молекулы в аморфных телах время от времени «перескакивают» из одного положения в другое. Этим объясняется текучесть аморфных тел: когда на аморфное тело действуют внешние силы, «перескоки» молекул в одном направлении происходят чаще, чем в других, в результате чего форма тела постепенно изменяется1.
Почему графит мягкий, а алмаз твердый
Свойства кристалла зависят не только от типа атомов, но и от типа кристаллической решетки.
Трудно поверить, например, что мягкий черный графит, из которого делают стержни карандашей (рис. 12.12), и твердый прозрачный алмаз (рис. 12.13) состоят из одинаковых атомов — атомов углерода. Почему же тогда эти два вещества так отличаются по своим свойствам?
Дело в том, что кристаллическая решетка графита имеет слоистую структуру, причем соседние слои слабо связаны друг с другом (рис. 12.14). Поэтому слои легко отделяются друг от друга, чем и объясняется мягкость графита. В кристаллической же решетке алмаза все атомы сильно связаны со своими ближайшими соседями (рис. 12.15). Именно эта жесткая связь атомов и обусловливает уникальную твердость алмаза.
Жидкие кристаллы
Во второй половине 20-го века начали активно изучать и применять искусственно созданные вещества, которые объединяют свойства жидкостей и кристаллов. Их назвали жидкими кристаллами.
Широкое применение жидких кристаллов обусловлено тем, что они очень чувствительны к изменению внешних условий: например, даже при небольшом изменении температуры или давления они могут изменять свой цвет. Благодаря этому жидкие кристаллы широко применяют в разных приборах — например, в жидкокристаллических медицинских термометрах. Особенно широко применяют жидкие кристаллы для изготовления разных дисплеев — от часов и мобильных телефонов до компьютеров и телевизоров.
В расположении молекул жидких кристаллов есть определенная упорядоченность, поэтому эти вещества называют жидкими кристаллами. Но они не имеют кристаллической решетки, поэтому эти вещества называют жидкими кристаллами.
Например, молекулы жидких кристаллов часто имеют удлиненную форму — длина молекулы может в десять и более раз превышать ее «толщину». Причем эти удлиненные молекулы сориентированы одинаково (например, расположены преимущественно вертикально), но центры молекул расположены хаотически. На рис. 12.16 схематично изображено молекулярное строение такого жидкого кристалла.
Итоги
Дискретное строение вещества
Другого ничего в природе нет. Ни здесь, ни там, в космических глубинах: Все — от песчинок малых до планет — Из элементов состоит единых. С. Щипачев
О каких элементах идет речь в вышеприведенных строках из стихотворения «Читая Менделеева»?
Все тела состоят из каких-либо веществ: ручка — из пластмассы, карандаш — из древесины и графита.
Вещества обладают различными, только им присущими свойствами: цветом, запахом, плотностью, текучестью и др. А что общего у всех веществ?
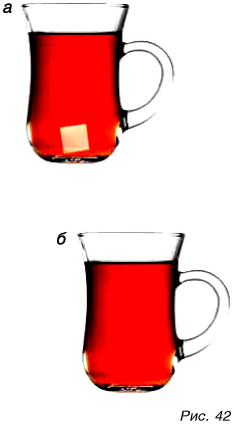
Проведем опыт. В кружку с чаем положим кусочек сахара (рис. 42, а) и размешаем. Крупинки сахара стали невидимыми (рис. 42, б), а чай сладким. Значит, сахар не исчез. Он остался в чае. Но почему крупинки не видны? Они распались на мельчайшие частицы, не видимые глазом.
Мельчайшие частицы вещества, способные существовать самостоятельно и сохраняющие основные свойства вещества, называются молекулами.
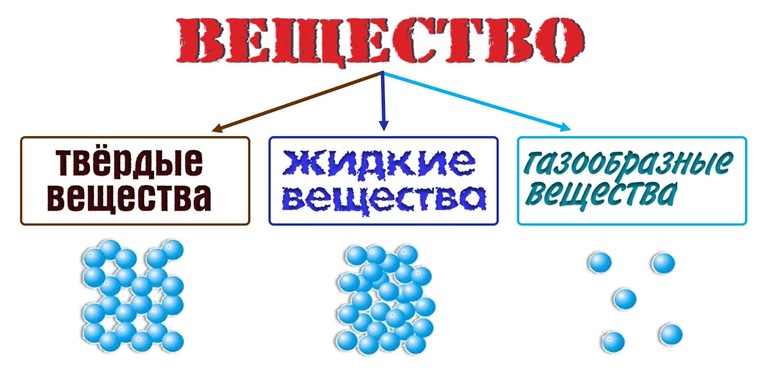
Не только сахар, но и все другие вещества состоят из мельчайших частиц, т. е. имеют дискретное (прерывистое) строение. Разные вещества состоят из различных молекул, поэтому и свойства их отличаются.
Гипотеза о дискретном строении вещества была выдвинута греческим философом Демокритом (рис. 43) около 25 веков тому назад. Легенда рассказывает, что однажды Демокрит сидел на камне у моря, держал в руке яблоко и размышлял: «Если я сейчас это яблоко разрежу пополам, у меня останется половина яблока; если я затем эту половину снова разрежу на две части — останется четверть яблока; но если я и дальше буду продолжать такое деление, то не приведет ли это к тому, что оставшаяся часть уже не будет обладать свойствами яблока?» Демокрит пришел к выводу, что предел делению существует, и назвал эту последнюю, уже неразрезаемую, неделимую частицу атомом (от греч. atomos — неделимый).
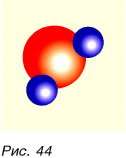
Из атомов состоят молекулы. Некоторые вещества состоят только из атомов. На рисунке 44 изображена модель молекулы воды 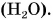
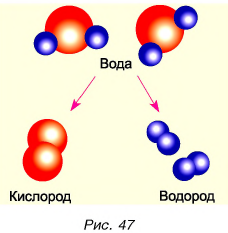
Молекулы вещества можно разделить на атомы. Атомы, соединяясь с другими атомами, образуют новые вещества с новыми свойствами. Например, вода под действием электрического тока может превратиться в газы: водород и кислород (рис. 47). Их свойства отличаются от свойств воды.
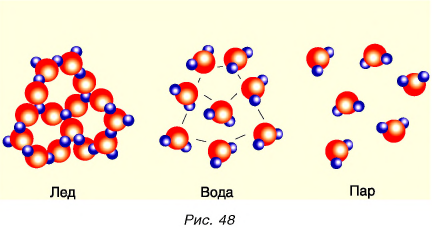
При нагревании вода переходит в газ (пар), при охлаждении — в лед. И пар, и вода, и лед состоят из одинаковых молекул (рис. 48).
Однако молекулы по-разному взаимодействуют друг с другом, поэтому свойства льда, воды и пара разные.
Дискретное строение вещества подтверждают многие из наблюдаемых нами в повседневной жизни явлений. К ним относится возможность существования вещества (например, 
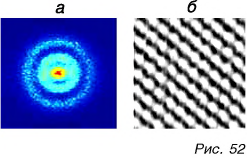
Наблюдать дискретное строение вещества стало возможным после того, как ученые создали микроскопы с высочайшей степенью увеличения. На рисунке 52, а представлена фотография атома водорода, а на рисунке 52, б — структуры поверхности графита. Данные фотографии были получены с помощью самых современных микроскопов при очень высоком увеличении.
Для любознательных:
Представим себе, что мы нанизали па воображаемую нить все молекулы, находящиеся в 
Есть вещества, молекулы которых во много раз больше по массе и числу атомов, чем, например, молекула воды. Масса молекулы некоторых белковых веществ примерно в 1 000 000 раз больше массы молекулы воды.
Молекула гемоглобина (вещества крови, которое переносит кислород) состоит из 1400 атомов, что примерно в 467 раз больше числа атомов в молекуле воды.
Главные выводы:
- По современным представлениям, вещество имеет прерывистое (дискретное) строение.
- Молекулы — мельчайшие частицы вещества, способные существовать самостоятельно и сохраняющие основные свойства вещества.
- Молекулы состоят из атомов.
Тепловое движение частиц
Мы уже знаем, что все вещества состоят из мельчайших частиц — атомов, молекул. Как ведут себя частицы вещества?
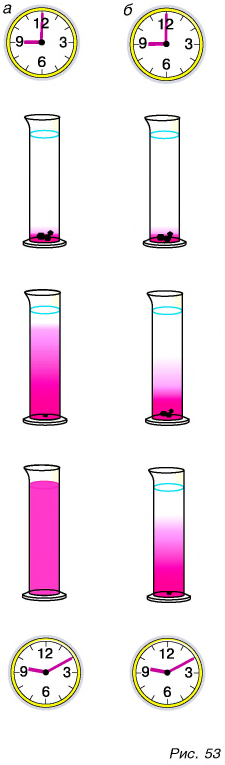
Для получения ответа проведем опыт. В стаканы с холодной и теплой водой бросим по 3 кристаллика марганцовки (перманганата калия) (рис. 53). Уже через несколько минут мы увидим, как вода постепенно окрашиваете,я в розовый цвет. Причем в теплой воде окрашивание идет быстрее (рис. 53, а), чем в холодной (рис. 53, б). О чем говорят результаты опыта?
- Розовый цвет воды указывает на то, что марганцовка растворяется в воде.
- Окрашивание идет по всем направлениям, значит, частицы марганцовки и воды сталкиваются между собой и движутся беспорядочно (хаотически).
- Окрашивание воды в стакане с теплой водой идет быстрее. Это означает, что в теплой воде хаотическое движение и столкновения частиц более интенсивны, чем в холодной.
- Перемешивание веществ, проникновение их друг в друга указывает па то, что между частицами есть расстояния.
Явление взаимного проникновения веществ друг в друга называют диффузией.
Беспорядочное движение частиц вещества, зависящее от степени нагретости вещества, называют тепловым.
Хаотически движутся молекулы в газах. Движение молекул в жидкостях и твердых телах отличается от их движения в газах, но тоже хаотично. Доказательство тому — диффузия. Сидя в своей комнате, мы очень быстро по запаху пищи определяем, что готовит мама на кухне. Распространение запахов — это пример диффузии.
В газах она идет быстрее, чем в жидкостях. Например, если всыпать в стакан с водой ложку соли, то через некоторое время соль растворится, и вода станет соленой. Но на это потребуется время (20—30 мин). Очень медленно идет диффузия в твердых телах. Нужны годы, чтобы частицы одного твердого тела проникли в другое.
Для любознательных:
Следует отметить огромную роль диффузии в природе и технике.
В неживой природе это непрерывное перемешивание газов в земной атмосфере, не позволяющее более тяжелым газам собираться в низинах. Это минерализация воды, т. е. растворение в ней различных неорганических (минеральных) веществ. Чистая, без этих веществ (дистиллированная), вода совершенно безвкусна и мало полезна. Важна диффузия при переносе питательных веществ и кислорода в растениях и других организмах. Путем диффузии осуществляется газообмен в легких и тканях животных. Кислород, содержащийся в воздухе, поступает в кровь, которая доставляет его к клеткам. Углекислый газ из клеток выделяется в кровь, а затем в окружающую среду.
В технике диффузия используется для получения металлов с заданными свойствами. В первую очередь это стали и сплавы алюминия, широко применяемые в авиации. На диффузии основаны процессы пайки, сварки (см. рис.), склеивания материалов и др. С другими доказательствами хаотического движения частиц вы познакомитесь в 8-м и 10-м классах.
Главные выводы:
- Частицы вещества находятся в непрерывном хаотическом движении.
- Интенсивность теплового движения частиц вещества тем больше, чем выше температура.
- Явлением диффузии подтверждается хаотическое движение частиц и наличие расстояний между ними.
Для любознательных:
Рассматривая под микроскопом пыльцу растений в воде, английский ботаник Роберт Броун (1773—1858) обнаружил беспорядочное и непрерывное движение ее частиц. Не зная, как объяснить увиденное, ученый решил, что частицы пыльцы живые. Броун провел опыт, взяв вместо пыльцы мелко истолченную глину. Все повторилось, как и в случае с пыльцой. Частички покрупнее двигались медленно, реже меняя направление движения. Мелкие частички двигались быстро, беспорядочно меняя направление движения. Кроме того, исследуя данное явление, Броун обнаружил, что в горячей воде частички движутся быстрее, чем в холодной.
Ученый так и не смог объяснить причину физического явления, которое позже получило название броуновского движения. Но, несмотря на это, ботаник Броун прочно вошел в историю физики.
Позже причина броуновского движения была точно установлена. Молекулы жидкости, двигаясь хаотично, ударяются со всех сторон о броуновскую частицу. Различное число ударов с разных сторон заставляет частицы непрерывно и беспорядочно двигаться.
Броуновское движение экспериментально подтверждает реальность существования молекул и их тепловое движение.
- Заказать решение задач по физике
Взаимодействие частиц вещества
Почему многие твердые тела обладают такой большой прочностью? На стальном тросе, диаметр которого составляет всего 25 мм, можно поднять целый тепловоз. Очень трудно разделить на куски камень. Объяснить перечисленные факты можно взаимным притяжением частиц, из которых состоят твердые тела.
Молекулы (атомы) в твердых веществах притягиваются друг к другу.
Но почему тогда части разбитого стеклянного стакана нельзя без клея соединить в одно целое? В то же время куски пластилина легко соединяются в один кусок. Проделайте опыт с пластилином самостоятельно.
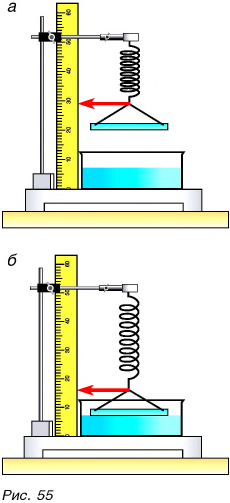
Объяснить эти факты можно, предположив, что притяжение молекул (атомов) проявляется лишь на малых расстояниях между ними. Действительно, если нагреть стеклянные куски до такой степени, чтобы стекло стало мягким (рис. 54), и прижать их друг к другу, они слипнутся в одно целое.
Притягиваются друг к другу и молекулы в жидкостях. Чтобы доказать это утверждение, проведем такой опыт. Подвесим на пружине чистую стеклянную пластинку и отметим положение нижнего конца пружины указателем (рис. 55, а). Поднесем к пластинке сосуд с водой до соприкосновения ее с поверхностью воды, после чего будем опускать сосуд до отрыва пластинки. Растяжение пружины увеличится (рис. 55, б), что указывает на притяжение частиц жидкости (воды) в сосуде и на поверхности стеклянной пластины.
А вот молекулы (атомы) газа практически не притягиваются друг к другу. Дело в том, что в газах частицы находятся на больших расстояниях, чем в жидкостях и твердых телах. Притяжение на этих расстояниях ничтожно мало. Поэтому молекулы газа разлетаются по всему предоставленному газу объему. Например, запах духов из открытого флакона распространяется по всей комнате.
А есть ли между молекулами отталкивание? Проведите такой опыт. Возьмите сплошной резиновый мячик и попробуйте его сжать (рис. 56, а). Легко ли это сделать? Стоит только перестать сжимать мячик, как он тут же восстанавливает свою форму (рис. 56, б). Значит, между частицами резины существует отталкивание. Именно отталкивание частиц затрудняло сжатие мячика, оно же восстановило его первоначальную форму.
Очень важно понять, что притяжение и отталкивание частиц вещества проявляются лишь на малых расстояниях между частицами, т. е. в твердых телах и жидкостях.
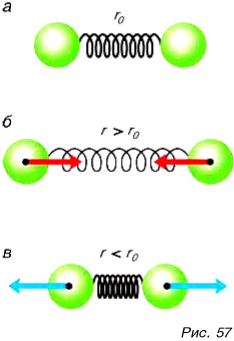
Взаимодействие двух молекул условно можно сравнить со взаимодействием двух шариков, скрепленных пружиной (рис. 57, а). При расстоянии 
Хотя эта модель весьма наглядна, тем не менее она имеет недостаток: на больших расстояниях притяжение, создаваемое пружиной, становится все сильнее. У молекул же, как мы отмечали ранее, оно практически исчезает.
Таким образом, на одних расстояниях (при отдалении частиц) преобладает притяжение, а на других (при сближении частиц) — отталкивание.
Главные выводы
- Частицы твердых веществ и жидкостей (атомы, молекулы) испытывают взаимное притяжение и взаимное отталкивание.
- При сближении частиц твердых веществ и жидкостей преобладает взаимное отталкивание, при удалении на небольшое расстояние — взаимное притяжение.
- У газов взаимодействием частиц можно пренебречь.
Газообразное, жидкое и твердое состояние вещества
Притяжение и отталкивание частиц определяют их взаимное расположение в веществе. А от расположения частиц существенно зависят свойства веществ.
Так, глядя на прозрачный очень твердый алмаз (бриллиант) (рис. 58, а) и на мягкий черный графит (из него изготавливают стержни карандашей) (рис. 58, б), мы не догадываемся, что оба вещества состоят из совершенно одинаковых атомов углерода. Просто в графите эти атомы расположены иначе, чем в алмазе.
Заметим, что на рисунках показаны не сами атомы, а их модели — шарики. В действительности никаких соединительных стержней или проволочек между частицами нет. Это условное изображение расположения атомов в веществе.
Взаимодействие частиц вещества приводит к тому, что оно может находиться в трех состояниях: твердом, жидком и газообразном. Например, лед, вода, пар (см. рис. 48). В трех состояниях может находиться любое вещество, но для этого нужны определенные условия: необходимые давление, температура. Например, кислород в воздухе — газ, но при охлаждении до температуры ниже -193 °С он превращается в жидкость, а при температуре -219 °С кислород — твердое вещество. Железо при нормальном давлении и комнатной температуре находится в твердом состоянии. При температуре выше 1539 °С оно становится жидким, а при температуре выше 3050 °С — газообразным. Жидкая ртуть, используемая в медицинских термометрах, при охлаждении до температуры ниже -39 °С становится твердой. При температуре выше 357 °С ртуть превращается в пар (газ).
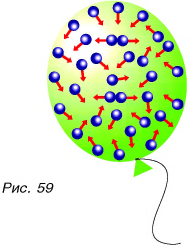
Какими свойствами обладают вещества в различных состояниях? Начнем с газов, в которых поведение молекул напоминает движение пчел в рое (рис. 59). Однако пчелы в рое самостоятельно изменяют направление движения и практически не сталкиваются друг с другом. А для молекул в газе такие столкновения не только неизбежны, но происходят практически непрерывно. В результате этих столкновений направления и значения скорости движения молекул изменяются.
Результатом такого движения и отсутствия взаимодействия частиц при движении является то, что газ не сохраняет ни объема, ни формы, а занимает весь предоставленный ему объем. Каждый из вас посчитает сущей нелепицей утверждения вроде «Воздух занимает половину объема этой комнаты» или «Я накачал воздух в две трети объема мяча». Воздух, как и любой газ, занимает весь объем комнаты и весь объем мяча.
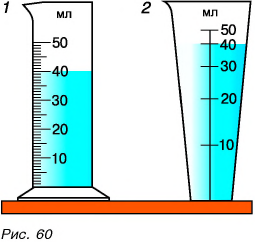
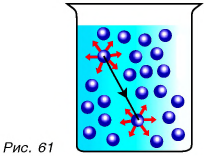
А какие свойства имеют жидкости? Для ответа на вопрос проведем опыт. Перельем воду из мензурки 1 в мензурку 2 (рис. 60). Форма жидкости изменилась, но объем остался тем же. Молекулы не разлетелись по всему объему, как это было бы в случае с газом. Значит, взаимное притяжение молекул жидкости существует, но оно жестко не удерживает соседние молекулы. Они колеблются и перескакивают из одного места в другое (рис. 61), чем и объясняется текучесть жидкостей.
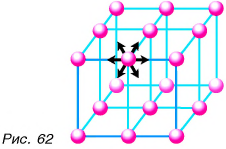
Наиболее сильным является взаимодействие частиц в твердом теле. Оно не дает возможности частицам разойтись. Частицы лишь совершают хаотические колебательные движения около определенных положений (рис. 62). Поэтому твердые тела сохраняют и объем, и форму. Сплошной резиновый мяч будет сохранять форму шара и объем, куда бы его ни поместили: в банку, на стол и т. д.
Главные выводы:
- Из-за хаотичности движения и отсутствия взаимодействия частиц при движении газы занимают весь предоставленный им объем.
- Сохранение объема жидкостями говорит о наличии сил притяжения между их частицами.
- Сохранение формы твердыми телами указывает на то, что притяжение их частиц сильнее, чем частиц жидкости.
Тепловое расширение
Из предыдущих параграфов вам известно, что все вещества состоят из частиц (атомов, молекул и др.). Эти частицы непрерывно хаотически движутся. При нагревании вещества движение его частиц становится более быстрым. Увеличиваются расстояния между частицами, что приводит к увеличению размеров тела.
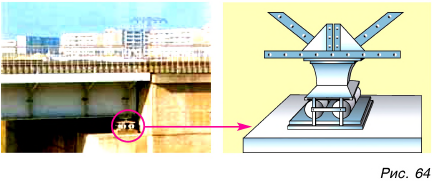
Изменение размеров тела при его нагревании называется тепловым расширением. Тепловое расширение твердых тел легко подтвердить опытом. Стальной шарик, свободно проходящий через кольцо (рис. 63, а)у после нагревания на спиртовке (рис. 63, б) расширяется и застревает в кольце (рис. 63, в). После охлаждения шарик вновь свободно проходит через кольцо. Из опыта следует, что размеры твердого тела при нагревании увеличиваются, а при охлаждении — уменьшаются.
Тепловое расширение различных твердых тел неодинаково. При тепловом расширении твердых тел появляются огромные силы, которые могут разрушать мосты, изгибать железнодорожные рельсы, разрывать провода. Чтобы этого не случилось, при конструировании того или иного сооружения учитывается тепловое расширение. Несущие детали мостов ставят на катки, способные передвигаться при изменениях длины моста зимой и летом (рис. 64). Рельсы на стыках имеют зазор (рис. 65). Провода линий не натягивают сильно (рис. 66), чтобы зимой, сокращаясь, они не разорвались.
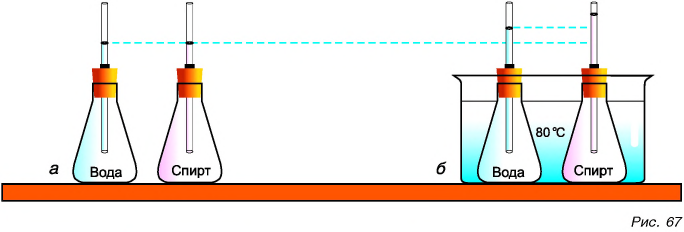
А расширяются ли при нагревании жидкости? Тепловое расширение жидкостей тоже можно подтвердить на опыте. В одинаковые колбы нальем: в одну — воду, а в другую — такой же объем спирта. Колбы закроем пробками с трубками. Начальные уровни воды и спирта в трубках отметим резиновыми кольцами (рис. 67, а). Поставим колбы в сосуд с горячей водой. Уровень воды в трубках станет выше (рис. 67, б). Жидкости при нагревании расширяются. Но уровень в трубке колбы со спиртом выше, чем в трубке колбы с водой. Значит, спирт расширяется больше. Следовательно, тепловое расширение разных жидкостей, как и твердых веществ, неодинаково.
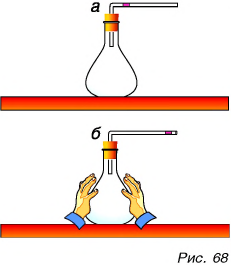
А испытывают ли тепловое расширение газы? Ответим на данный вопрос с помощью опыта. Закроем колбу с воздухом пробкой с изогнутой трубкой. В трубке (рис. 68, а) находится капля жидкости. Достаточно приблизить руки к колбе, как капля начинает перемешаться вправо (рис. 68, б). Это подтверждает тепловое расширение воздуха при его даже незначительном нагревании. Причем, что очень важно, все газы, в отличие от твердых веществ и жидкостей, при нагревании расширяются одинаково.
Для любознательных:
Нельзя после горячего чая сразу пить холодную воду или есть мороженое. Резкое изменение температуры приводит к появлению трещин на эмали зубов. Это объясняется тем, что основное вещество зуба — дентин — и покрывающая зуб эмаль при одном и том же изменении температуры расширяются неодинаково.
Главные выводы:
- Газы, жидкости и твердые тела при нагревании расширяются.
- Тепловое расширение у разных жидкостей и у разных твердых тел неодинаково.
- При увеличении температуры все газы расширяются одинаково.
Измерение температуры
Каждое утро, собираясь на работу или в школу, мы спрашиваем: «Какая на улице температура?», понимая под этим, насколько теплый или холодный наружный воздух.
Что такое температура? Как ее измерить? Достаточно ли для этого наших ощущений тепла и холода?
Температура определяет степень нагретости тела.
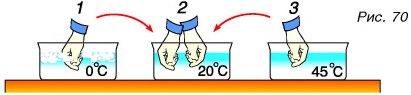
Проведем опыт. Нальем в три сосуда воду разной температуры (рис. 70). Опустим правую руку в сосуд 1 с холодной водой, а левую — в сосуд 3 с горячей водой. Через 2—3 мин обе руки опустим в сосуд 2. По ощущениям правой руки вода в сосуде 2 — теплая, а по ощущениям левой — холодная. Ото говорит о том, что наши ощущения субъективны. Для объективной оценки степени нагретости тела, т. е. его температуры (обозначается буквой t), служит измерительный прибор термометр.
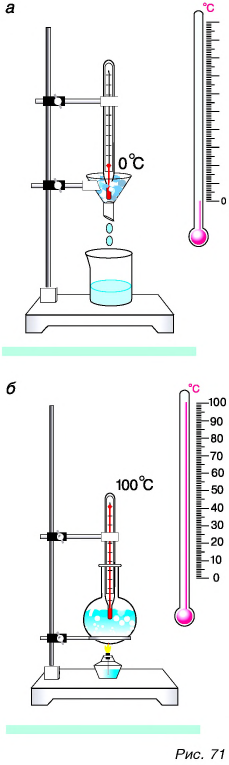
Устройство и действие самого простого термометра было основано на тепловом расширении вещества. Термометр представлял собой стеклянный баллончик, соединенный с тонкой трубкой (капилляром). Баллончик заполнялся ртутью или подкрашенным спиртом. Для изготовления шкалы определялись положения уровней жидкости в трубке при опускании баллончика в тающий снег или лед (рис. 71, а) и кипящую воду (рис. 71, б).
Положение уровня жидкости в трубке, когда баллончик был в тающем льде, принималось за нулевое, а температура тающего льда — за нуль градусов.
Второму положению уровня соответствовала температура кипящей воды, принятая за 100 градусов. Длина столбика между 0 и 100 градусами делилась на 100 равных частей (см. рис. 71, б). Одно деление означало один градус. Такая шкала впервые была предложена шведским ученым А. Цельсием в 1742 г. Поэтому она называется шкалой Цельсия, а единица шкалы — градусом Цельсия (°С).
Именно такая шкала у бытовых термометров (рис. 72, а, б). Особенности в строении имеет медицинский термометр (рис. 72, в). Так как им измеряют температуру тела человека, то цена деления его шкалы 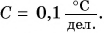
Шкала медицинского термометра имеет нижний и верхний пределы: 35 °С и 42 °С. Вы, очевидно, сами догадались, почему па шкале нет обозначений температуры ниже 35 °С и выше 42 °С. При таких температурах тела человек гибнет. Нормальной для здорового человека считается температура 36,6 °С.
Баллончик медицинского термометра заполняется ртутью. Вблизи баллончика трубка имеет сужение, что не позволяет ртути после того, как измерение закончено и термометр остыл, вернуться назад в баллончик. Этого можно достичь только с помощью резкого встряхивания термометра.
В последнее время все чаще используются цифровые термометры (рис. 73). Они более удобны и безопасны, чем ртутные.
Главные выводы:
- Температура определяет степень нагретости тела.
- Для объективной оценки температуры служит термометр.
- Термометр основан на тепловом расширении вещества.
- Бытовые термометры в нашей республике имеют шкалу Цельсия.
- Физическое тело и вещество в физике
- Плотность и единицы плотности в физике
- Движение молекул в физике в газах, жидкостях и твёрдых телах
- Скорость движения молекул газа
- Закон сохранения и превращения механической энергии
- Работа, мощность и энергия
- Движение и силы
- Давление в физике
ТЕОРИЯ
СТРОЕНИЯ ФИЗИЧЕСКИХ ОБЪЕКТОВ И ЕЁ ПРИЛОЖЕНИЯ
А.И.БОЛУТЕНКО
E—mail: bolutenko@mail.ru Физика Главная
1. Состояние знаний о строении физических объектов.
Успехи физики и химии велики: создана
теория строения атома, разработана теория строения молекул. Теоретическая
физика разработала молекулярно-кинетическую теорию строения вещества, углубив
её физической кинетикой, статистической механикой и термодинамикой. Но, если
посмотреть на неживую природу, окружающую каждого человека, нельзя увидеть ни
атомов, ни молекул. Вокруг нас находятся физические объекты природы, состояние
материи которых разительно отличается между собой: существуют твёрдые тела,
жидкости и газы.
Для понимания сущности явлений, свойств
физических объектов и процессов, происходящих в них при изменении внешних
условий, теоретические достижения науки должны отвечать на целый ряд вопросов,
входящих в компетенцию теоретической физики:
1. Что такое энергия,
теплота, свет, электрический ток, как образуются радиоволны?
2. Как происходит нагревание
и охлаждение тел, термическое расширение, теплопередача?
3. Как излучается и
поглощается теплота, как происходит плавление твёрдых тел, как затвердевают
жидкости?
4. Какова физика процесса
перехода вещества в другое агрегатное состояние?
5. Чем определяется прочность
твёрдых тел и вязкость расплавов?
6. Что такое поверхностное
натяжение, как происходит сфероидизация жидкостей?
7. Какие свойства поверхности
конденсированного тела, почему прочность тонких волокон велика?
Как же отвечают на эти вопросы
молекулярно-кинетическая теория и квнтомеханическая теория строения атома?
2. Интерпретация физических явлений, строения и
свойств физических объектов.
Как обстоит дело в физике с пониманием
вопросов строения физических тел и объяснением их свойств? Рассмотрим, как
молекулярно-кинетическая теория и квантомеханическая теория строения атома
объясняют сущность физических явлений, строение физических объектов и их
свойства.
2.1. Физические явления: энергия, теплота, свет,
электрический ток, радиоволны.
2.1.1. Энергия.
Энергия – действие,
деятельность, сила, мощь, скалярная физическая величина, являющаяся единой мерой различных форм движения и
взаимодействия материи, мерой перехода движения материи из
одних форм в другие. С фундаментальной точки зрения, энергия представляет собой
один из трёх (энергия, импульс, момент импульса) аддитивных интегралов движения (то есть сохраняющуюся
при движении величину), связанный, согласно теореме
Нётер, с однородностью времени.
Таким образом, введение понятия энергии как физической величины целесообразно
только в том случае, если рассматриваемая физическая система однородна во
времени [1].
2.1.2. Теплота.
Энергия, которую получает или теряет тело
в процессе теплообмена с окружающей средой, называется количеством теплоты или просто теплотой. Теплота – это одна из
основных термодинамических
величин в классической феноменологической термодинамике
[2].
Другие источники считают, что
теплота – кинетическая часть внутренней
энергии вещества, определяемая интенсивным хаотическим движением молекул и
атомов, из которых это вещество состоит. Мерой интенсивности движения молекул
является температура. Количество теплоты, которым обладает тело при данной
температуре, зависит от его массы [3]. Или же теплота – энергия, передаваемая от более нагретого
тела менее нагретому при непосредственном соприкосновении или излучением [4].
2.1.3. Свет.
Квантовая теория света: свет представляет
поток своеобразных частиц материи, так называемых квантов, или фотонов.
Эйнштейн доказал, что фотоны обладают не только некоторой энергией, которую они
уносят от светящегося тела, но и (соответственно этой энергии) некоторой
массой, а значит и весом, как это вытекало из новой теории тяготения,
установленной Эйнштейном на основе теории относительности [5].
2.1.4. Электрический ток.
Электрический ток – направленное
движение заряженных частиц в электрическом поле. Заряженными частицами могут
являться электроны или ионы (заряженные атомы) [6].
2.1.5. Радиоволна.
Радиоволны – электромагнитное излучение с длинами волн в
электромагнитном спектре длиннее инфракрасного излучения. Радиоволны имеют
частоту от 3 кГц до 3000 ГГц, и соответствующую длину волны от 100 километров
до 0,1 миллиметра. Как и все другие электромагнитные волны, радиоволны
распространяются со скоростью света. Естественными источниками радиоволн
являются молнии и астрономические объекты. Искусственно созданные радиоволны
используются для стационарной и мобильной радиосвязи, радиовещания,
радиолокации и других навигационных систем [7].
2.2. Свойства физических объектов и процессы, происходящие
в них при изменении внешних условий.
2.2.1. Нагревание.
Нагрев – искусственный или естественный
процесс повышения температуры материала (тела) либо за счёт внутренней энергии,
либо за счёт подведения к нему энергии извне. Нагрев
тела происходит за счёт увеличения скорости движения либо колебаний
молекул и атомов, составляющих его. Движение молекул
и атомов в разных телах происходит по-разному. Нагрев газов – молекулы газов беспорядочно
движутся с большими скоростями (сотни м/с) по всему объему газа. Сталкиваясь,
они отскакивают друг от друга, изменяя величину и направление скоростей.
Нагрев жидкостей
– молекулы жидкости колеблются около равновесных положений (так как расположены
почти вплотную друг к другу) и сравнительно редко перескакивают из одного
равновесного положения в другое. Движение молекул в жидкостях является менее
свободным, чем в газах, но более свободным, чем в твердых телах. В твёрдых
телах частицы колеблются около положения равновесия. С ростом температуры
скорость частиц увеличивается, поэтому хаотическое движение частиц принято
называть тепловым [8].
2.2.2. Охлаждение.
Охлаждение, как и нагрев, основано на
теплообмене – это самопроизвольный переход тепла от тела с большей температурой
к телу с меньшей температурой [9].
2.2.3. Тепловое
расширение.
Тепловое
расширение –
изменение линейных размеров и формы тела при изменении его температуры. Количественно
тепловое расширение жидкостей и газов при постоянном давлении характеризуется изобарным коэффициентом
расширения (объёмным коэффициентом теплового расширения). Для
характеристики теплового расширения твёрдых тел дополнительно вводят
коэффициент линейного теплового расширения. Если в твердом теле основным
механизмом расширения и других тепловых эффектов является увеличение амплитуды
колебаний кристаллической решетки, то в случае жидкости – это уменьшение числа
ближайших соседей, которое характеризует ближний порядок. Кристалл обладает как
дальним, так и ближним порядком, жидкость – только ближним, газ – никаким.
Кристалл сохраняет и объем, и форму, жидкость – только объем, а газ не имеет ни
фиксированного объёма, ни формы [10].
2.2.4. Теплопередача.
Теплопередача – физический процесс передачи тепловой
энергии от более горячего тела к менее горячему, либо
непосредственно (при контакте), или через разделяющую (тела или среды)
перегородку из какого-либо материала. Когда физические тела одной системы
находятся при разной температуре, то происходит передача тепловой энергии, или
теплопередача от одного тела к другому до наступления термодинамического равновесия. Самопроизвольная передача тепла всегда происходит от более горячего тела к менее
горячему, что является следствием второго
закона термодинамики [11].
2.2.5. Излучение и поглощение тепла.
Пока в науке нет объяснения процесса
излучения и поглощения тепла. И не может быть достойного ответа. Непонятно, как
могут колебания частиц на Солнце привести в колебание частицы всех физических
объектов на Земле?
2.2.6. Плавление.
Плавление – это процесс перехода тела из
кристаллического твёрдого состояния в жидкое, то есть переход вещества из
одного агрегатного состояния в другое. Плавление происходит с поглощением теплоты плавления и является фазовым
переходом первого рода, которое сопровождается скачкообразным изменением
теплоёмкости в конкретной для каждого вещества температурной точке превращения
– температура плавления. Способность плавиться
относится к физическим свойствам вещества [12].
В работе [13] отмечается, что исследование
процесса плавления во всех деталях представляется весьма важным для выявления
особенностей жидкого состояния. Но теории плавления в настоящее время нет.
2.2.7. Затвердевание.
Кристаллизация (затвердевание)
вещества – переход
вещества из жидкого состояния в твёрдое. Чтобы началась кристаллизация
расплавленного тела, оно должно остыть до определённой температуры.
Температура, при которой вещество отвердевает (кристаллизуется) называют
температурой отвердевания или кристаллизации. Опыт показывает, что вещества
отвердевают при той же температуре, при которой плавятся [14].
2.2.8. Переход в другое агрегатное состояние.
Агрегатное состояние вещества – состояние одного и того же вещества в
определённом интервале температур и давлений, характеризующееся определёнными,
неизменными в пределах указанных интервалов, качественными свойствами:
способностью (твёрдое тело) или неспособностью (жидкость, газ, плазма)
сохранять объём и форму, наличием или отсутствием дальнего (твёрдое
тело) и ближнего порядка (жидкость), и другими свойствами.
Традиционно выделяют три агрегатных состояния: твёрдое тело, жидкость и газ
[15].
2.2.9. Прочность.
Прочность
(в физике и материаловедении) – свойство материала сопротивляться разрушению под действием внутренних напряжений,
возникающих под воздействием внешних сил [16].
2.2.10. Поверхностное натяжение.
Поверхностное натяжение – термодинамическая характеристика
поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического
образования единицы площади этой поверхности раздела при условии, что
температура, объём системы и химические
потенциалы всех компонентов в обеих
фазах остаются постоянными. Поверхностное натяжение имеет двойной физический
смысл – энергетический (термодинамический) и силовой (механический).
Энергетическое (термодинамическое) определение: поверхностное натяжение – это
удельная работа увеличения поверхности при её растяжении при условии
постоянства температуры. Силовое (механическое) определение: поверхностное
натяжение – это сила, действующая на единицу длины линии, которая ограничивает
поверхность жидкости [17].
2.2.11. Прочность тонких волокон.
Молекулярно-кинетическая теория не
объясняет феномен высокой прочности тонких волокон.
2.2.12. Сфероидизация жидкости.
Молекулярно-кинетическая теория не в
состоянии предложить модель сфероидизации жидкости.
2.2.13. Вязкость.
Вязкость (внутреннее
трение) – одно из явлений переноса, свойство текучих тел (жидкостей и газов)
оказывать сопротивление перемещению одной их части относительно другой. В
результате работа, затрачиваемая на
это перемещение, рассеивается в виде тепла. Механизм внутреннего трения в
жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят
импульс из одного слоя в другой, что приводит к выравниванию скоростей – это
описывается введением силы трения [18].
2.2.14. Физика поверхности.
Молекулярно-кинетическая теория не
рассматривает теорию физики поверхности.
2.3. Состояние теоретической физики по интерпретации
физических явлений, процессов и свойств материи.
На протяжении развития цивилизации
человечество интересовало, как же устроена природа. Долгий путь познания многих
поколений учёных привёл к созданию молекулярно-кинетической теории [19]. МКТ декларировала свои возможности в
объяснении строения физических объектов. Основные положения теории гласили:
вещества состоят из мельчайших частиц (молекул, атомов, ионов), частицы
находятся в непрерывном хаотическом движении, частицы соударяются друг с другом
как абсолютно упругие тела, и в более новой трактовке – частицы взаимно
притягиваются и отталкиваются. Однако, на вопрос о том, как устроена материя, в
МКТ нет даже намёка.
Собранные вместе объяснения физических
явлений, процессов и свойств физических объектов вызывают сожаление о печальном
состоянии теоретической физики. Все объяснения – нищета физической науки. Стало
ясно, что наука заблудилась в дебрях прошлого. Если бы наука свято сберегала
первое представление о явлениях и свойствах природы, до сих пор Земля была бы
плоской и лежала на трёх китах, а Солнце вращалось бы вокруг Земли. С
появлением новых знаний старые представления о природе должны уступать место
более верным, что и является сутью науки – постепенное движение вперёд к
истине. Но так случается не всегда. И это не совсем радостное событие произошло
с молекулярно-кинетической теорией строения материи.
Дальнейшее развитие МКТ привело к тому,
что физики её даже не вспоминают. Но на базе МКТ развились такие направления
теоретической физики, как физическая кинетика, статистическая механика,
термодинамика.
Несостоятельность
молекулярно-кинетической теории очевидна, но отказаться от неё теоретическая
физика не в состоянии, потому что рухнут, как ложные, ветви молекулярной
физики: физическая кинетика, статистическая механика и термодинамика, которые
возникли на базе МКТ.
Реальность сурово опровергает
пустоту МКТ, а теоретической физике всё равно: поёт всё ту же песнь о частицах,
из которых устроено вещество, и об их беспорядочном тепловом движении.
3. Несостоятельность молекулярно-кинетической теории.
Даже неудобно включать вышеприведенные
перлы физических определений в научную статью. Но что имеем, то имеем. Это
теоретическая физика начала 21 столетия. Мягко говоря, такая интерпретация
физических явлений, процессов и свойств физических объектов слабо похожа на
науку. Ведь каждая хозяйка знает, что нагрев – это повышение температуры.
Близкое знакомство с достижениями
молекулярно-кинетической теории и квантомеханической теорией строения атома
показало, что теоретическая физика ничего не знает об основных физических
явлениях, относящихся к строению материи, ни о процессах, происходящих с
физическими объектами при изменении внешних условий, ни об их физических
свойствах.
Странно, что теоретическая физика в 21
веке ещё не разработала теорию строения вещества, теорию теплоты, теории
излучения и поглощения тепла,
теорию теплопередачи и ещё
многое другое. Да и могла разработать, так как молекулярно-кинетическая теория,
на базе которой развивается теоретическая физика, держит физиков в плену
далёкого прошлого.
Как же так могло случиться, почему мощные
научные силы физиков-теоретиков всего мира оказались перед неразрешимыми проблемами?
Такой застой в физике произошёл в связи с использованием для развития
теоретической физики абсолютно абсурдной молекулярно-кинетической теории
строения материи и выдуманной теорией строения атома.
Но, как указывалось выше, отказаться от МКТ
физики никак не могут, потому что на базе молекулярно-кинетической теории
возникли физическая кинетика, статистическая механика и термодинамика, которые
вместе с МКТ должны будут пойти на свалку истории науки.
Молекулярно-кинетическая теория – такое
околонаучное невежество, что даже и осуждать её не хочется. Как говорят:
лежачего не бьют. Но это такой лежачий, который закрыл все дороги в будущее,
заполонил все школьные и университетские учебники и стал преградой для истины,
которая упорно изгоняется. Ложь МКТ внедряется в головы подрастающих поколений
и является большим злом. Рассмотрим с этих позиций, что же такое
молекулярно-кинетическое учение?
Физики тверды в своём упорстве
игнорировать МКТ, за прошедшие более ста лет её триумфального шествия серьёзно
задержали развитие науки: ни один журнал, великий и не очень, не принимал к
публикации статей, противоречащих ложной теории. Реакционная роль МКТ очевидна.
Молекулярно-кинетическая
теория вошла в противоречие с другими науками, которые не приняли ложных
представлений физики о беспорядочном движении частиц в физических объектах и
шли своим путём. В химии МКТ фактически отвергала химическую связь, в механике
– прочность твёрдых тел, в кристаллографии – кристаллические решётки минералов.
Другие науки также не восприняли молекулярно-кинетической теории. Молекулярная
биология, не обращая внимания на МКТ, разрабатывает строение и структуру
биологических объектов, геология – структуры и текстуры горных пород.
Нет однозначной формулировки основных положений
молекулярно-кинетической теории. Вместо того, чтобы отказаться от изживших себя
из-за несостоятельности положений, заменяют их другими, которые вступают в
конфликт с представлениями о кинетическом движении частиц в физических телах.
Молекулярно-кинетическая теория в корне антинаучна. Направления исследований,
возникших на базе МКТ: статистическая физика, кинетическая механика и
термодинамика являются продолжением тупикового развития физики. Если в основу
этих антинаучных направлений заложены ошибочные постулаты, ожидать научного
прогресса от деятельности приверженцев МКТ бессмысленно.
Есть хорошая поговорка: коней на переправе
не меняют. Но физики заменили, и нельзя найти авторства, коль изменение не
удостоено Нобелевской премии. Если создана молекулярно-кинетическая теория, то
изменять произвольно её положения недопустимо. Однако, если сильно хочется, то
можно. Третье положение гипотезы, в котором постулируется притяжение и
отталкивание частиц, тем самым отвергает положение о хаотическом движении
частиц.
Возможно, математический аппарат развития
МКТ имеет смысл, но не в отношении строения физических объектов. Наука движется
вперёд через открытие истин и через ряд ошибок, но ошибки надо признавать и
отбрасывать, а не вводить в ранг неопровержимых фактов. Такой огромной ошибкой
в физике является молекулярно-кинетическая теория, которая ложна и антинаучна.
Странно, что современная физика признала такие три положения МКТ как подарок из
19 века.
Классическая механика по отношению к
объектам, имеющим электрический заряд, неприменима. Если тела, не имеющие
заряда, могут иметь хаотическое движение и соударения между собой, можно
согласиться, что в этом есть какая-то логика. Но, если положение о
взаимодействии частиц как абсолютно упругих шаров вдруг было изменено на
взаимодействие заряженных частиц, заряды должны немедленно вступить во
взаимодействие и создать устойчивое физическое поле, не оставляя никаких надежд
на кинетику.
Только физика осталась до сих пор в ложных
представлениях МКТ. Ни одна другая наука не приняла постулата о хаотическом
движении частиц.
Химия, минералогия,
кристаллография, геология, физика стекла твёрдо уверены, что структура
физических объектов строго определена.
Как доказательство непрерывного
хаотического движения частиц в физических объектах было использовано
броуновское движение. Трудно понять, как А.Эйнштейн мог возвести глупость
броуновского движения, применительно к строению материи [20], в ранг теории, что отбросило теоретическую физику далеко
назад. Из этого глухого тупика физика не может выйти до сих пор и далее заходит
в невообразимые лабиринты. Чем интенсивнее идёт развитие ложного направления,
тем труднее из него выйти.
Совместить несовместимое невозможно. Ещё
Пушкин знал, что нельзя запрячь в одну упряжку коня и трепетную лань, но это
сделали физики, соединив два мира: макромир и микромир. Хотя представителям
других наук казалось, что физика – это серьёзно!
Невероятно, как на такое махровое
невежество, как броуновское движение – результат кинетического движения частиц
в теле, могла опираться, казалось бы, одна из величайших наук, как на постулат
молекулярно-кинетической теории. Броуновское движение частиц построило мнимый
мост между макромиром и микромиром и сводится к простой задаче: с какой скоростью
должен разогнаться воробей, чтоб сбить с ног быка и отбросить в сторону на
несколько метров?
Трагическая ошибка А.Эйнштейна по
созданию в 1905 году теории броуновского движения привела к печальным
последствиям: в физике восторжествовала ложная молекулярно-кинетическая теория
и задержала развитие науки. МКТ по своей сути реакционная, все научные журналы,
свято оберегая ложь, закрывали путь истине. Ошибки теоретической физики увели в
сторону от столбовой дороги развития науки и отбросили истинную науку назад
более, чем на столетие.
Как доказательство правильности положений
МКТ приводится диффузия. Но несмешивающиеся жидкости – опровержение
механического процесса диффузии. Диффузия – физико-химический процесс,
обусловленный созданием двумя жидкостями смеси, имеющей более низкую
потенциальную энергию. Несмешивающиеся жидкости полностью опровергают
молекулярно-кинетическую теорию, которая является выдумкой физиков.
Если на заре создания
молекулярно-кинетическая теория носила характер научности, то в настоящее время
все её положения в любых редакциях выглядят смехотворно:
1. Молекулы и атомы названы
частицами, так что же движется?
2. Если хаотическое движение
может быть в каких-то процессах с частицами макротел, то в микромире такое
утверждение не выдерживает никакой критики, и даже нет парламентских выражений,
чтоб дать ему определение.
Физические объекты, имеющие
заряд, не могут вести себя хаотически.
3. Частицы – как упругие
шары, это неуместная выдумка.
Молекулярно-кинетическое учение имеет
превратное представление о теплоте. Незнание сущности теплоты привело к
созданию абсурдной теории.
В газах, жидкостях и твёрдых
телах между молекулами и атомами никаких соударений нет. Каждое физическое тело
в любом состоянии имеет устойчивую структуру, отличающуюся прочностью связей. В
газах прочность связей настолько мала, и, кажется, что в газах нет структуры. В
жидкостях прочность межмолекулярных связей возрастает, а в твёрдых телах
приобретает значительные величины.
Совершенно ясно, что физическая наука
заблудилась в дебрях прошлого. Реальность сурово опровергает пустоту науки, а
теоретическая физика и дальше держится за частицы и их беспорядочное тепловое
движение.
Все три положения и доказательства их
правильности не выдерживают никакой критики. Первое положение
молекулярно-кинетической теории гласит, что все объекты физического тела
являются частицами. Сложно понять, взаимодействуют между собой электроны, ядра
атомов, сами атомы или молекулы? Второе положение говорит, что все частицы
находятся в тепловом хаотическом движении. Хаотического движения в природе не
бывает, хаос может быть только на мусорной свалке. Посмотрите на звёздное небо,
и станет ясно, что природа мудрее физиков. Если третье положение считает, что
частицы взаимодействуют как упругие шары, это, мягко говоря, так далеко от
истины, что даже нет аргументов для возражения.
Итак, молекулярно-кинетическая теория
является не научной теорией, а просто выдумкой физиков-теоретиков. Прискорбно,
что в своё время антинаучность МКТ не была признана, а, наоборот, возведена в
ранг единственно верной теории. Всё дальнейшее развитие
молекулярно-кинетической теории, построенной на ложных постулатах, также
является некорректным. Это – предмет тренировки ума. Сейчас физики стыдливо даже
не хотят упоминать о МКТ.
Молекулярно-кинетическая теория занимается
частностями строения материи, не создав общей теории строения физических тел.
Не представляя общего принципа устройства природных объектов, физика ушла в
умозаключениях в мелкие подробности. Одевают в броню формул процессы, которых
не существует в природе. Если теория верна, она неподвластна времени.
Теоретическая физика зашла в глухой тупик и не желает из него выбираться.
Молекулярно-кинетическая теория описывает,
как ведут себя частицы тела при нагревании, но ничего не сообщает о положении
частиц в пространстве, т.е. обходит стороной строение физических объектов.
Хаотическое движение частиц в
газах, жидкостях и твёрдых телах равносильно отсутствию стабильной структуры,
что соответствует полному отсутствию химической связи частиц. Если относительно
газов и жидкостей ещё можно дискутировать, то твёрдые тела при хаотическом
движении частиц не должны иметь прочности и быть подобными на сыпучие
материалы, например, кварцевый песок. Если бы молекулы газа были в хаотическом
движении, не было бы прочности связи между ними. Тогда б ни птица, ни самолёт
не смогли бы оторваться от земли
По существующим представлениям физики теория
поверхности не может объяснить поверхностное натяжение, сфероидизацию капли, не
поддавалась решению задача о высокой прочности тонких волокон. Только новая
теория физики поверхности позволила разобраться в сущности вопроса, хотя
высокая прочность волокон была проблемой физики твёрдого тела [21].
3.1. Выводы.
1. Во всех физических
объектах нет никакого теплового движения. В зависимости от внешних условий
изменяется состояние атома. Атом переходит на такой уровень потенциальной
энергии, который обеспечивает устойчивую структуру для данных внешних условий.
2. Каждый физический объект
образует устойчивое физическое поле, имеющее наименьшую потенциальную энергию.
Никакой кинетики в понимании молекулярно-кинетической теории в физических
объектах нет и быть не может. Положения МКТ – просто бесперспективная выдумка
физиков.
3. Теоретическая физика
нынешнего дня – мир иллюзий. Она заблудилась на задворках 19 века.
Молекулярно-кинетическая теория не способна объяснить ни одного
физико-механического свойства физических тел, раскрыть их сущность.
Теоретическая физика должна давать не феноменологическое описание явления, а
объяснять физику процесса.
4. Молекулярно-кинетическая
теория и созданные на её базе ветви теоретической физики занимаются
математическим описанием процессов, не существующих в природе. Успешное решение
любых проблем в этом направлении не даёт и грана пользы для науки и практики.
5. Путь науки – путь проб и
ошибок. Но, если произошла ошибка, её надо признать и исправить, а не
усугублять положение дел. Физики завели науку о строении и свойствах материи в
глухой тупик, из которого не видно выхода.
6. Несостоятельность
молекулярно-кинетической теории налицо, но физики, сдерживаемые большими
авторитетами, не пожелали отряхнуть наслоения лжи и пойти вперёд к истине, а
начали развивать, такие же, ложные ветви теоретической физики. МКТ и развитая
на её основе теоретическая физика даже не пытаются входить в реальность.
7. Конечно, сейчас каждому
неортодоксальному физику ясно, что МКТ – ложь, физики стыдливо умалчивают о
ней. Однако, на базе МКТ, в которой главным положением является кинетическое
тепловое движение частиц, возникли новые направления физики. Но, если
фундамент, на котором базируется физическая кинетика, статистическая механика и
термодинамика не соответствует действительности, нельзя полагать, что эти
направления физики являются истинными, хотя они шикарно одеты в броню формул.
8. Возможно, математический
аппарат, применяемый для описания не существующих в природе процессов, и
применим в иных случаях, но в вопросе строения физических объектов он
совершенно бесполезен.
4. Теория строения физических объектов. Коллективная
химическая связь.
Как же устроен окружающий микромир
макрообъектов в его разнообразии физических объектов, находящихся в состоянии
газов, жидкостей и твёрдых тел, а также в физическом взаимодействии их между
собой?
4.1. Аморфные тела.
Школьный учебник физики учит, что наряду с
кристаллическими телами есть тела аморфные. Классическим представителем аморфных
тел является стекло, которое считается переохлаждённой жидкостью.
Понятие «аморфный» означает «лишённый
формы». Аморфные тела противопоставляются кристаллам, иными словами, твёрдые
тела, у которых отсутствует дальний порядок, называют аморфными. При нагревании
аморфные твёрдые тела постепенно переходят в жидкости.
Стеклообразование происходит при таком
наборе атомов, когда их заряды при температуре плавления и давлении в 1
атмосферу образуют именно стеклообразную структуру. Для однокомпонентных
кварцевых стёкол переход из кристаллического состояния можно считать изоморфным
состоянием кварца – стеклообразным. Для многокомпонентных стёкол стеклообразное
состояние является формой существования материи.
Стекло – это такое сочетание или искусственная
смесь анионов и катионов, которая при расплавлении не может создать
кристаллическую структуру, атомы вынуждены образовывать то соседство, которое
возможно, и образуют наиболее стабильную в естественных земных условиях
стеклообразную структуру, характеризующуюся различными по силе химическими
связями, определяющими природу стеклообразного состояния.
Аморфного состояния с присущими ему
неестественными свойствами бесформенности в природе просто не существует. Любое
твёрдое тело с любой структурой – это единственно возможная ситуация структуры
в данных условиях. Аморфность же предполагает из одного и того же расплава при
одних и тех же условиях получать различные конечные продукты.
Вещества, которые в настоящее время
считаются аморфными, следует отнести к классу полиморфных кристаллических
веществ с неопределённым составом кристаллов, в которых существует целый ряд
химических связей, различных по силе [22].
Представления физики о наличии в природе
аморфных тел глубоко ошибочно. Абсолютно все физические объекты природы и
синтезированные материалы имеют строго определённую структуру, обладающую
минимальной потенциальной энергией при данных параметрах внешней среды [23].
4.2. Стекло – твёрдое тело.
В связи с невозможностью точного сбалансирования
электрических зарядов ионов в стёклах, как и в кристаллических телах, имеются
несовершенства структуры. Однако, стёкла являются твёрдыми телами не со
случайной, а с постоянной структурой, соответствующей определённому химическому
составу. Получение воспроизводимости экспериментальных данных по плотности и
другим физико-химическим свойствам указывает на закономерности в образовании
структуры стёкол [23].
Стекло является стабильной формой
существования твёрдых тел. Набор атомов, заданный химическим составом стекла,
может образовывать систему с наименьшей энергией, то есть образуется
стеклообразная структура с минимальным потенциалом.
Стекло – не переохлаждённая жидкость, а
структура, состоящая из такого набора атомов, который не может составить
упорядоченного кристаллического соединения в силу распределения зарядов атомов.
Положение атомов компонентов, входящих в стекло, характеризуется их
электрическими зарядами. Именно электрический заряд атомов расставляет их в
определённом порядке. Все ионы в структуре стекла находятся в узлах равновесия.
Это есть узлы стеклообразной решётки. Располагаться в междоузлиях ионы не
могут, так как для ионов в структуре таковых не существует – где в данный
момент находится ион, там находится и узел. Любому состоянию вещества должны
соответствовать определённые условия (или наоборот). Такими условиями являются
температура, давление и гравитационное поле.
Итак, стекло – не переохлаждённая
жидкость, а вполне естественная самостоятельная стеклообразная структура,
необходимое объективное состояние вещества, проявляющееся уже в расплавах [22].
4.3. Общая форма существования материи.
На примере стеклообразного состояний
разработана теория строения жидкости, твёрдого тела, а также теория фазовых
переходов из одного агрегатного состояния в другое.
Итак, как же устроены газы, жидкости и
твёрдые тела? Так же, как и стекло: атомы в физических объектах расставляет по
местам физическое поле, при этом образуется коллективная химическая связь. Все
физические объекты, независимо от агрегатного состояния, в котором находятся,
имеют единый принцип построения структуры: микрообъекты, составляющие тело,
занимают свои места в силовом физическом поле. Такое строение физических
объектов относится как к чистым веществам, так и к их смесям.
Структура всех физических объектов строго
определена и изменяется с изменением внешних параметров: температуры и
давления. Аморфных тел в природе не существует, строение каждого физического
объекта строго определено. Природа рациональна, хаос может сделать только
человек руками или разумом. Стекло – такое сочетание или искусственная смесь
атомов, образующих закономерно построенную стеклообразную структуру в
соответствии с их зарядами, наиболее стабильную в естественных земных условиях,
характеризующуюся дискретным набором различных по силе химических связей,
определяющих природу стеклообразного состояния, и представляющее упорядоченную
систему, обладающее переменной структурой и приведенным дальним порядком.
Стеклообразное состояние является наиболее общей формой существования материи в
виде твёрдых тел. Кристаллическое состояние – частный
случай стеклообразного [22].
Все физические объекты имеют универсальное
строение: газы, жидкости и твёрдые тела. Они построены из атомов и молекул,
имеющих электрический заряд, и поэтому создают ту единственную структуру,
которая соответствует минимуму потенциальной энергии и максимуму прочности
химических связей. Каждое из агрегатных состояний вещества, которое оно имеет в
обычных условиях, можно за счёт внешних условий перевести в иное состояние.
Классическим примером таких агрегатных состояний является вода. Но так же, как
и воду, из любого агрегатного состояния вещества можно получить другое
состояние путём нагревания или охлаждения в сочетании с давлением [24].
4.4. Стабильная структура физических объектов.
Стекло – стабильная структура, состоящая
из такого набора атомов, который не может составить упорядоченного
кристаллического соединения в силу распределения зарядов атомов. Как и стёкла,
все физические объекты также образуют стабильную структуру, обладающую
различными физическими и механическими свойствами. Изменить структуру тел могут
внешние воздействия: температура и давление, положительное и отрицательное.
При некоторой температуре в массе вещества
имеется равновесие атомов согласно их электрического заряда, и фактически
нельзя сказать, что данному аниону принадлежит именно этот катион. Любой ион
уравновешивает своим электрическим полем все заряды, координирующие с ним. При
этом основная часть заряда идёт на взаимодействие с первой координирующей
сферой, на следующие сферы воздействие заряда очень резко уменьшается.
Одинаковые заряды в различных катионах неравнозначны. Имеет значение ионный
радиус катиона и количество экранирующих его элементов [23].
4.5. Принципы построения физических полей.
Структура расплава при стеклообразовании
представляет динамическую систему, где каждый атом постоянно находится в движении.
Результат этого движения определяется коллективным взаимодействием атомов всей
системы не по законам геометрии, а по законам физики. В первую очередь
структура стекла определяется тем набором атомов, который входит в её состав, а
также размерами этих атомов, которые располагаются в определённом порядке
благодаря электростатическому полю в системе. На образование структуры стекла
оказывают влияние также внешнее давление и гравитационное поле [22].
Характер химических связей окислов,
входящих в состав стекла, не сохраняется. Благодаря этому и образуются стёкла.
Ничего беспорядочного в любой структуре нет, так как каждая структура состоит
из ионов, имеющих электрический заряд. Именно заряды ионов уже в расплаве
расставляют их в таком порядке, в котором все элементы системы находятся в
динамическом равновесии – снижение температуры расплава соответственно изменяет
расстановку ионов для сохранения равновесия. То есть ионы занимают позиции с
наименьшей потенциальной энергией и наибольшей силой химических связей между
ними. В связи с таким представлением и в твёрдом стекле ионы находятся в строго
определённом порядке, о чём свидетельствует воспроизводимость физико-химических
свойств стёкол конкретного химического состава из различных варок, не говоря уже
о промышленном производстве стеклоизделий [25].
В каждом конкретном случае структура
стекла является не просто случайной, а строго определённой. Набор атомов,
входящих в состав стекла, выстраивает оптимальную в энергетическом аспекте
структуру. То есть, любое стекло имеет дальний порядок, и благодаря различному
химическому составу только ему присущее строение, где входящие в состав его
атомы строят стеклообразную решётку на принципах химической связи.
Внутренняя энергия веществ
есть функция размещения атомов: чем большее число связей, образованных каждым
атомом, и чем ближе атомы расположены друг к другу, тем меньше внутренняя
энергия. По таким же принципам строится структура всех физических объектов в
любом агрегатном состоянии [22].
Несомненно, что жидкость отражает
структуру твёрдого тела, из которой оно образуется. Но, таким же образом, и
твёрдое тело указывает на структуру расплава. Стёкла обычно образуются только
из высоковязких расплавов. Почему же для стеклообразования необходим вязкий расплав
в отличие от расплавов, образующих кристаллы? Очевидно, что уже в расплаве
заложена структура будущего твёрдого тела. Поэтому все расплавы нельзя считать
идентичными. Стёкла образуются из расплавов не благодаря их высокой вязкости и
фиксации высокотемпературной структуры, а, наоборот, вязкость расплава большая
в связи с тем, что это расплав стеклообразного вещества.
Наиболее сложным, и в то же время
основополагающим в вопросе понимания образования стёкол из кристаллических
веществ, является переход в стеклообразное состояние чистых окислов, то есть
получение однокомпонентных стёкол. Очевидно, что образование стекла из
кристаллического вещества связано с перестройкой структуры – перемещениями
атомов в кристаллической решётке и образованием структуры стекла.
Возможность получения кварцевого стекла из
кремнезёма указывает на способность химических связей кремний – кислород в
кремнекислородных тетраэдрах кварца изменять свои параметры. Такая способность
целого ряда окислов к изменению параметров кристаллической решётки при
расплавлении как раз определяет возможность технического получения стекла.
При расплавлении кремнезёма атомы
кислорода в кремнекислородных тетраэдрах занимают новые положения, которые
соответствуют минимумам энергии в данном состоянии. При охлаждении расплава
кремнезёма атомы уже не могут образовывать первоначальную кристаллическую
структуру и затвердевают в виде стекла. Это указывает на отсутствие внешних
условий при охлаждении, способствующих образованию правильной кристаллической
решётки. Низкое давление ведёт к снижению плотности упаковки системы, и она
переходит в стеклообразное состояние.
Переход ряда окислов после расплавления
при атмосферном давлении в стеклообразное состояние указывает на их
нестабильность в данных условиях. Стабильными веществами при давлении 1
атмосфера в условиях гравитационного поля Земли можно считать лишь такие,
которые при затвердевании из расплава образуют свою первоначальную структуру.
Отличие атомного состава и невозможность
построения регулярной структурной сетки в системе приводит к отсутствию
ближнего порядка в системе векторов, то есть вектора имеют различную величину и
направление. Однако, в системе, независимо от направления, есть вектора,
одинаковые по модулю. Это дискретные уровни структуры стекла по силе связи. При
нагревании последовательный разрыв уровней связей по их силе приводит к
совершенно новой системе с иными уровнями сил связей. Атомы, входящие в состав
стекла, расположены в структуре не статистически, а строят стеклообразную
решётку на принципах химической связи [22].
Принципы построения физических полей тел
во всех агрегатных состояниях универсальны и подобны физическим полям
стеклообразного состояния.
4.6. Электронейтральность. Коллективная химическая
связь. Роль эфира в формировании структуры и свойств физических объектов.
Развитие химии привело к созданию теории
строения молекул. Но единичная молекула ещё не определяет строения физического
объекта. В работе [23] ещё в1977 году для
описания строения стекла введено понятие коллективной химической связи. В
процессе варки стекла из отдельных сырьевых компонентов, в конце концов,
образуется стекломасса с определённым набором атомов. Каждый атом, имея свой
электрический заряд, вступает во взаимодействие с другими, в результате
образуется физическое поле с учётом гравитационной составляющей, что и является
структурой твёрдого тела. Структура стекла должна быть равновесной для каждой
температуры. В подвижном маловязком расплаве образуется структура с наименьшей
потенциальной энергией. В застывшем стекле нет никаких движений структурных
единиц. Нет движущих сил и достаточной энергии, чтобы атом мог совершить
переход (скачёк) в другое положение.
Электрически нейтральные молекулы,
собранные вместе, не смогут обеспечить прочность твёрдого тела, вязкости
жидкости, текучести газа.
Макромоделью такого
представления может быть любой сыпучий материал.
В массивных телах вступает в
силу коллективная химическая связь, под влиянием воздействия силового
электромагнитного гравитационного поля (эфира) происходит деформация молекул
для обеспечения устойчивого состояния с минимальной потенциальной энергией.
Каждая молекула теряет электрическую нейтральность и образует прочные
межмолекулярные силы благодаря взаимодействию электромагнитного поля
физического объекта и гравитационного поля. Это положение является
универсальным и относится ко всем агрегатным состояниям: твёрдым телам,
жидкостям и газам.
Любое вещество или смеси веществ в
твёрдом, жидком и газообразном состоянии образуют устойчивое электрическое поле
согласно электрических зарядов атомов и электронов. В этом физическом поле
каждый атом занимает оптимальное положение с минимальной потенциальной
энергией. В физическом объекте нет внутренних сил, способных хоть на малейшее
расстояние сдвинуть какой-либо атом структуры со своего положения. Такое
состояние физического объекта является результатом коллективной химической
связи.
Независимо от типа химической связи
согласно теории строения молекул, при синтезе физического объекта немедленно
возникает коллективная химическая связь. В коллективной химической связи
положение атомов в молекуле значительно отличается от теоретических
представлений строения молекулы. Коллективная химическая связь во
взаимодействии с гравитационным полем (эфиром) определяет все свойства
физического объекта.
Есть ли в стекле химические соединения? В
нормальных условиях для кристаллических веществ химическое соединение всегда
определённо. Химическое соединение – это возможность взаимного сосуществования
атомов, способных прочно удерживаться друг возле друга. С этой точки зрения в
стекле есть химические соединения, но они неопределённого состава.
Что же удерживает все атомы стекла в
едином блоке? Такой силой является коллективная химическая связь. Силами,
приводящими к монолиту, к единой большой «молекуле» являются силы
неуравновешивания электрического заряда в каждом элементарном объёме стекла.
Это неуравновешивание происходит в связи с асимметрией структуры из-за
соответствующего набора атомов. Различия по силе химической связи в твёрдом
теле как раз и определяют природу стеклообразного состояния [23].
При некоторой температуре в массе вещества
имеется равновесие атомов согласно их заряда, и фактически нельзя сказать, что
данному аниону принадлежит именно этот катион. Любой ион уравновешивает своим
электрическим полем все заряды, координирующие с ним. При этом основная часть
заряда идёт на взаимодействие с первой координирующей сферой, на следующие
сферы воздействие заряда очень резко уменьшается. Одинаковые заряды в различных
катионах неравнозначны. Имеет значение ионный радиус катиона и количество
экранирующих его элементов [22].
Положения атомов компонентов, входящих в стекло,
характеризуется их электрическими свойствами. Именно электрические заряды
атомов расставляют их в определённом порядке, чтобы система была электрически
нейтральна, и все атомы в ней имели наименьший потенциал и наибольшую силу
связи. Образуется коллективная химическая связь, о которой уже упоминалось
выше. Нельзя согласиться с тем, что катионы модификаторов находятся в пустотах
между анионами и распределены статистически, образуя аморфную структуру.
Структура стекла строится по тем же принципам, что и кристаллов, это общие
законы строения твёрдых тел. В работе [26, стр. 253] говорится, что любой
ионный кристалл по своей структуре представляет собой правильно чередующееся
расположение положительных и отрицательных ионов. Между этими ионами действуют
силы притяжения и отталкивания, равновесие между которыми и определяет
фактически существующие в кристалле межионные расстояния. В кристаллах с ионной
связью [27] ионы расположены периодически и вокруг каждого отрицательного иона
находится несколько положительных, а вокруг положительных несколько
отрицательных. Устойчивость того или иного типа координации в структуре [28]
определяется таким взаимным расположением, которое исключает соприкосновение
одинаковых и, стало быть, одноимённо заряженных ионов.
Атомы в любом физическом объекте, твёрдых
телах, жидкостях и газах, а также их смесях стремятся занять положение с
минимальной потенциальной энергией и максимальной прочностью связей между ними.
В массивном теле имеется равновесное положение атомов согласно их заряда,
который определяет силу взаимодействия атома со всем окружением. Фактически
нельзя сказать, что данному аниону принадлежит именно этот катион. Поэтому
можно считать, что любой ион уравновешивает все заряды, координирующие с
рассматриваемым ионом, хотя основная часть заряда идёт именно на это
взаимодействие, а дальше на взаимодействие с зарядами второй сферы и так далее.
Это взаимодействие и является ответственным за прочность вещества. Если каждый
ион взаимодействует со многими, то можно сказать, что валентность элемента –
величина статистическая. Благодаря такому взаимодействию образуется
коллективная химическая связь во всех физических объектах [22].
Любое тело, в том числе и стекло, –
равновесная силовая структура, в которой каждый атом (ион) имеет свои
индивидуальные силовые характеристики и как можно лучше организовывает
сосуществование с ближними и не совсем ближними соседями [25].
Атом – неделимая частица. Электроны атома
движутся по предопределённым орбитам, их ведёт магнитное поле ядра [29]. Атом
априори не может спонтанно передавать свои электроны другим атомам (ионная
связь). При этом атомы доноры и акцепторы должны терять признаки и становиться
совсем иными элементами. Также атомы не могут объединять свои электроны.
Изменение орбиты атома невозможно (ковалентная связь). Ещё более фантастической
выглядит металлическая химическая связь: никогда, ни при каких обстоятельствах,
электроны спонтанно не начнут покидать свои атомы и прогуливаться в межатомном
пространстве.
Абсолютно все физические объекты устроены
так, как стекло в расплавах (жидкости) и в твёрдых телах. Аналогичное
устройство имеют и газы. Основой строения всех физических тел, элементарных
химических веществ и их смесей, является коллективная химическая связь. Атомы в
любой структуре создают физическое поле и располагаются в соответствии своих
электрических зарядов, фактически не создавая молекул. Стехиометрический состав
физического объекта можно считать формулой вещества в привычном для химии виде.
Устройство всех физических объектов
универсально. В жизни мы привыкли видеть физические объекты природы при
нормальных условиях температуры и давления в обычных пределах в виде газов,
жидкостей и твёрдых тел. В ряде случаев можно, даже в быту, наблюдать переход материи
из одного состояния в другое. Наиболее характерным веществом, способным
находиться в бытовых условиях в трёх состояниях материи, является вода в виде
жидкости, пара и льда. Так же, как и вода, и другие физические объекты могут
иметь различные агрегатные состояния в зависимости от внешних условий:
температуры и давления. Каждый физический объект можно перевести в любое
агрегатное состояние.
В силовом электрическом поле физического
объекта принцип построения структуры – создание конструкции с минимальной
потенциальной энергией. Так устроены элементарные вещества и их смеси. Смеси
могут быть разнообразными: твёрдое тело – твёрдое тело, твёрдое тело – жидкость
(структурная), жидкость – жидкость, жидкость – твёрдое тело, жидкость – газ,
газ – газ, газ – жидкость и так далее. Примерами таких объектов являются горные
породы, сплавы металлов, растворы, морская вода (растворённые газы и соли),
воздух (смесь газов), влажный воздух (газ и вода).
Все тела в любом агрегатном состоянии
имеют строго определённую структуру с минимумом потенциальной энергии.
Физическое поле определяет структуру любого объекта и чутко реагирует на
изменение внешних условий: изменяется потенциальная энергия объекта, а вместе с
ней расположение атомов структуры вплоть до перехода в иное агрегатное
состояние.
5. Интерпретация физических явлений, процессов и
свойств на основе строения материи по принципу коллективной химической связи и
теории строения атома.
Строение вещества неразрывно связано со
строением атома: зная функции атома и его реакцию на изменение внешних условий,
можно понять, как устроены физические объекты.
5.1. Физические явления.
5.1.1. Энергия.
Существуют два вида энергии: в состоянии
покоя и в движении – потенциальная энергия и кинетическая энергия. Потенциальная
энергия физического объекта – его внутренняя энергия, уровень потенциальной
энергии определяется высотой электронов над ядром. Кинетическая энергия –
энергия в движении в виде электромагнитных волн как средство передачи энергии
от одного физического объекта к другому. Кинетическая энергия атомов –
электромагнитные волны, которые могут преобразовываться в другие виды энергии:
теплоту, свет, радиоволны, электричество и др. Электромагнитные волны возникают
только при разности потенциалов состояния между физическими объектами.
Внутренняя энергия физических объектов спонтанно переходит от горячего тела к
холодному посредством излучения энергии.
Энергия присуща каждому физическому телу
(объекту). Подпитка внутренней энергии физических объектов происходит за счёт
внешних источников: солнечной энергии, тепловой энергии сжигания топлива или
внутренней энергии других тел. Внешние источники пополнения тел энергией могут
быть временными (сжигание топлива, пища для фауны) или постоянными (энергия
Солнца, питание для флоры). При разности потенциалов потенциальная энергия
объекта превращается в кинетическую и через электромагнитное излучение
переходит к объекту с меньшей потенциальной энергией. Таким образом, энергия
может быть в покое (потенциальная энергия) и в движении (кинетическая энергия).
Электромагнитная волна – способ передачи
потенциальной энергии путём превращения её в кинетическую от одного атома
другому, имеющему меньшую потенциальную энергию, посредством колебательного
контура электронов. Электрон формирует и излучает электромагнитные волны.
Поглощающий электрон своим колебательным контуром принимает электромагнитные
волны, часть кинетической энергии превращает в свою потенциальную, остальную
энергию передаёт дальше соседнему атому при наличии разности потенциалов
состояния. Единственным средством передачи энергии тепловой, световой,
ультрафиолетового излучения, электрического тока и, тем более, радиоволн,
является электромагнитные волны [29].
5.1.2. Теплота и свет.
Излучение и поглощение энергии атомом –
универсальное назначение электронов. Теплота и свет имеют общую природу с
излучением энергии. В распространении электромагнитных волн особое место
занимают свет и теплота. В природе понятия «теплота» и «свет» отсутствуют. Свет
и теплота – категории не физические, а физиологические.
Свет – видимая часть спектра
электромагнитных колебаний, которые способны ощутить только те представители
фауны, которые имеют глаза. Свет – абстрактное понятие для человека, который
потерял зрение.
Теплота – часть спектра электромагнитных
колебаний в инфракрасном диапазоне. Теплота – свойство органов осязания
представителей фауны и флоры. Теплота – уровень потенциальной энергии тела,
который определяется положением орбит электронов над ядром атомов. Мерой
потенциального состояния тела служит температура, введённая человеком для
оценки внутренней энергии тела.
Теплота – понятие относительное. Всегда
тёплым будет тело, которое излучает энергию в окружающую среду, и, наоборот,
холодным, которое поглощает энергию. Таким образом, теплота – состояние, в котором тело излучает энергию.
Свет и теплота не нуждаются в отдельных теориях – это излучение энергии
посредством электромагнитных волн [29].
5.1.3. Электрический ток.
Из школьного учебника известно, что электрический ток
– направленное движение электронов. Но это совершенно не так! Электрон в
электрической цепи не может переносить энергию, единственный способ переноса
энергии любого вида – через электромагнитные волны. Процесс передачи энергии
универсальный – через колебательный контур электронов. Электрон поглощает
энергию на полуволне вращения вокруг собственной оси, а на следующей полуволне
излучает энергию соседнему электрону.
Электрический ток – передача импульсов
волновой энергии со скоростью света от электрона электрону при наличии разности
потенциалов, точно, как и в случае передачи тепловой энергии. Электроны
передают энергию дискретно в виде электромагнитных волн, как и при любом обмене
энергией между физическими объектами.
Длина волны электрического тока 6000
километров. Как же передаёт такую длинную волну колебательный контур электрона?
На каждом обороте электрона вокруг оси передаётся дискретно фрагмент волны
электрического тока. Так как дискретные отрезки волны передаются разными
электронами со сдвигом во времени, передаваемая электромагнитная волна
воспринимается как непрерывная. Какую волну выдаёт электрогенератор, точно
такую волну передаёт линия электропередач потребителю. Если бы ток был движением
электронов, как бы образовалась волна у потребителя через сотни километров от
источника энергии, чтобы ток был переменным [29]?
5.1.4. Радиоволна.
Даже название «радиоволна» и практика
применения радиовещания и радиосвязи убедительно утверждают, что передача
энергии проводным или беспроводным
способом реализуется волнами электромагнитных колебаний.
Генерация и передача
радиоволн до антенны аналогична генерации и передачи электрического тока: волны
передаются по проводнику посредством поглощения и излучения энергии
колебательным контуром электронов отдельными импульсами. Колебательные контуры
электронов антенны излучают волны в пространство, как в пределах Земли, так и в
космос.
Излучение радиоволн происходит только с
поверхностного слоя антенны – чем больше поверхность антенны – тем мощней
сигнал. Это же положение справедливо и для принимающей антенны [29].
5.2. Тепловые процессы.
5.2.1. Излучение и поглощение тепла.
Излучение и поглощение энергии – процессы
взаимосвязанные. В случае появления разности потенциалов состояния синхронно
изменяется мощность вращающего электромагнитного поля ядра: при получении
энергии радиус силовых линий увеличивается, электроны ускоряются, их
кинетическая энергия переходит в потенциальную. Электроны работают как
резонаторы – получают электромагнитные колебания и повышают свою потенциальную
энергию. Процесс поглощения и излучения энергии – единый процесс. Каждый
электрон атома при наличии разности потенциалов после поглощения энергии
излучает её. Из-за разности потенциалов состояния потенциальная энергия
электронов переходит в кинетическую энергию путём электромагнитного излучения,
поглощается электронами с меньшей потенциальной энергией и превращается в
потенциальную энергию.
Функция электронов – принимать или
излучать электромагнитные волны. В электроне длится непрерывный процесс
получения и передачи энергии. При излучении энергии на каждом обороте электрона
вокруг собственной оси образуется полная волна: одна полуволна – получение
энергии резонатором электрона, вторая полуволна – передача энергии осциллятором
электрона. При поглощении энергии идёт противоположный процесс. Резонатор и
осциллятор электрона является одним и тем же колебательным контуром. Вращение
электрона в режиме получения и передачи энергии как раз и определяет волновую
сущность процесса передачи энергии и описывается синусоидой.
Ядро атома и электроны имеют одну и ту же
угловую скорость. На каждом обороте ядра вокруг оси изменяется мощность его
вращающего электромагнитного поля: удаление силовых линий от ядра при
поглощении энергии и приближение силовых линий к ядру при излучении энергии.
При поглощении энергии электрон ускоряется в связи с постепенным переходом на
орбиту большего радиуса и его потенциальная энергия увеличивается. Ядро атома
образует вращающее поле таким образом, что каждому протону соответствуют свои
силовые линии электромагнитного поля. По самой интенсивной, генеральной силовой
линии и движется электрон. При излучении энергии электрон замедляется и
постепенно переходит на более низкую орбиту, а его потенциальная энергия его
уменьшается. Такой цикл электрон совершает за один оборот вокруг собственной
оси. Процессы поглощения и излучения энергии состоят из импульсов полуволн, то
есть имеют дискретный характер. Направление передачи энергии всегда единое: от
тела с большей температурой к телу с меньшей температурой, или, что
равносильно, от атомов с большей потенциальной энергией к атомам с меньшей
потенциальной энергией.
Каждый электрон половину оборота вокруг оси
поглощает (излучает) энергию, а вторую половин оборота излучает (поглощает) её.
Передача энергии от одного электрона другому осуществляется дискретно –
полуволнами. Полуволна энергии, которая излучается электроном, состоит из
электромагнитных волн всех диапазонов, которые соответствуют химическому
составу и температуре излучающего объекта. Такая же вторая полуволна энергии
поглощается другим электроном.
Электроны горячего тела излучают не
конкретную электромагнитную волну, а импульсы энергии, в который входят все
волны излучающего объекта, состав которых определяется температурой излучения и
химическим составом. Если частота электромагнитных волн излучения больше
частоты вращения атома вокруг собственной оси, в импульс полуволны энергии
входит количество излучаемых волн, равное соотношению частоты волны и частоты
вращения атома вокруг оси. Если частота передаваемой волны меньше частоты
вращения атома вокруг оси, волна передаётся дискретными отрезками. Так как
дискретные отрезки волны передаются разными электронами со сдвигом во времени,
поглощаемая волна воспринимается как непрерывная [29].
5.2.2. Теплопередача.
Если температура всех тел в замкнутом
пространстве равна, не происходит процессов излучения и поглощения энергии
между ними. Это означает, что электроны на орбитах атомов не излучают. Но
только стоит появиться нагретому телу, например, включить электрическую
лампочку или утюг, немедленно возникает разность потенциалов состояния и
появляется тепловой поток. Неукоснительное свойство физических объектов –
выравнивание потенциалов состояния. Горячее тело излучает энергию, окружающая
среда поглощает её. Передача энергии от одного физического объекта другому
осуществляется единственным универсальным способом – через электромагнитные
волны.
Что
же происходит с телами, окружающими источник энергии и самим источником? За
счёт подведённой энергии электроны источника излучения работают как генераторы
излучения, а электроны тел окружающей среды – как приёмники излучения. Процесс
теплопередачи идёт до тех пор, пока есть разность потенциалов состояния, то
есть до выравнивания температур.
Физические объекты излучают и поглощают
энергию только поверхностью. Излучение и поглощение энергии возможно на границе
раздела между телами или внутри тела между соседними атомами при наличии
градиента температур. Чем больше поверхность излучающего или поглощающего тела,
тем интенсивнее идёт процесс.
Какова физика процессов передачи энергии в
массивных телах? Процесс излучения энергии складывается из процессов излучения
и поглощения энергии между соседними слоями атомов и теле. Электроны служат
только трансляторами энергии. При излучении энергии электроны наружного слоя
тела при вращении вокруг собственной оси на первой полуволне излучают
электромагнитные волны, а на второй полуволне поглощают энергию от электронов
рядом лежащего атома, чтобы на следующей полуволне снова излучить её. Излучение
и поглощение энергии происходит на границе двух атомных слоёв физического тела,
имеющих различные потенциалы состояния, т.е. при наличии разности потенциалов
или, что равносильно, разности температур. Так, за слоем слой, продолжается
процесс излучения горячего тела через акты излучения – поглощения до
выравнивания потенциалов состояния. По мере остывания тела уменьшается мощность
излучаемой энергии и изменяется спектр волн электромагнитных колебаний.
Таким же образом происходит поглощение
энергии, только в этом случае часть энергии идёт на выравнивание потенциалов
состояния. Каждый электрон тела периодически поглощает и излучает энергию.
Иначе не прогреется весь объём нагреваемого тела. Когда от источника тепла
нагревается первый слой атомов, он начинает излучать энергию второму слою и
т.д. Таким образом, за слоем слой тело прогревается, пока имеется источник
нагревания. Волновой состав поглощённой и излученной энергии идентичен.
Внутренняя энергия атома изменяется аналогово [29].
5.2.3. Нагревание и охлаждение.
Для понимания вопроса стабильности
вещества надо определиться с условиями. Важна не только температура при
остывании расплава, но ещё внешнее давление и гравитационное поле Земли.
Наиболее точно ответить на вопрос стабильности стекла могут однокомпонентные
стёкла, когда нет иных компонентов, маскирующих истину.
Стабильным в естественных условиях можно
считать вещество, которое при нагревании или охлаждении возвращается в
первоначальное состояние. Если нагревать кристаллический кварц до расплавления,
образуется расплав, который затвердевает в виде кварцевого стекла. Возвратить
кварцевое стекло в кристаллическое состояние невозможно. Та же картина с борным
и фосфорным ангидридами, боратные и фосфатные стёкла вообще не кристаллизуются.
Из этого следует, что при естественных
условиях любой расплав при охлаждении всегда переходит в энергетически выгодное
состояние с наименьшей потенциальной энергией системы. При этом структуру
твёрдого тела характеризует не плотность упаковки атомов [30], а межатомные
силы, которые создают устойчивую оптимальную атомную структуру [31].
Стекло уже в расплаве стекло. В расплаве
стёкол имеется целый ряд установившихся жёстких химических связей. В расплаве
кристалла все связи разорваны, и изменения температуры выше температуры
ликвидуса изменяет только внутреннюю энергию системы атомов. Изменение же
температуры расплава стекла приводит к значительному изменению вязкости за счёт
разрыва или восстановления химических связей.
Неупорядоченность структуры стёкол
приводит к существованию в стекле непрерывно набора связей по силе и монотонному
изменении свойств. В стекле существует дискретный спектр связей по их силе. При
этом, связи не обязательно должны быть идентичными по структуре, а только по
силе связи (в т.ч. и по структуре). Тогда при охлаждении расплава
восстанавливается химические связи определённой силы. Это восстановление связей
аналогично кристаллообразованию при охлаждении расплава [23].
Температура твёрдого тела складывается из
температуры его атомов (ионов). Рассмотрим отдельно взятый атом с одним
электроном – атом водорода. Если к этому атому подводить тепло, нет сил, в
результате действия которых атом начнёт совершать тепловые колебания, то есть
изменять своё местонахождение. Но атом отреагирует на подвод к нему внешней
энергии: электрон в атоме возбудится и перейдёт из основного уровня при
комнатной температуре с наименьшей энергией на более высокий энергетический
уровень. При дальнейшем подводе тепла повторится такой переход, и электрон
перейдёт на ещё более высокий уровень. При охлаждении атома идёт обратный процесс.
Таким образом, нагревание тела – процесс,
при котором электроны составляющих его атомов или ионов из всех атомных
оболочек устойчивого состояния, соответствующего минимально возможному значению
его энергии, переходят на более высокие атомные уровни.
Температура тела определяется состоянием
атомных уровней атомов или ионов, входящих в его структуру. Или, что идентично,
чем более высокие атомные уровни занимают электроны в атомах (ионах) тела, тем
выше его температура.
При переходе электронов на более высокие
уровни увеличиваются геометрические размеры атомов, что приводит к уменьшению
силы химических связей между всеми структурными элементами тела и отдалению их
друг от друга. При нагревании любых тел расстояния между центрами атомов увеличивается,
а ослабление химических связей приводит к снижению механической прочности
нагретых твёрдых тел (например: ковка металлов). Хотя расстояние между центрами
атомов при нагревании увеличивается, но при этом расстояния между атомами
уменьшается. Такое предположение хорошо согласуется с повышение
электросопротивления металлов с увеличением их температуры.
Таким образом, при нагревании твёрдых тел
увеличиваются геометрические размеры атомов, и в связи с ослаблением химических
связей растёт расстояние между центрами соседних атомов (ионов), что приводит к
их тепловому расширению [32].
5.2.4. Тепловое
расширение.
В отличие от существующих представлений в
работе [32] показано, что тепловое расширение тел происходит в связи с
увеличением геометрических размеров атомов (ионов) и увеличением расстояния
между их центрами.
Высказано мнение, что исследование
зависимости коэффициента термического расширения стёкол от химического состава
бесперспективны, так как аргументом функции свойство является структура стекла,
а не его химический состав.
С позиций, отличных от общепринятых
представлений о сущности стеклообразного состояния, объяснены скачки на
температурной зависимости коэффициента термического расширения стёкол.
Показано, что исследования температурной зависимости физических свойств
материалов следует проводить при непрерывной автоматической записи параметра,
иначе утратится самая важная составляющая информации [32].
Природа термического расширения любых тел
заключается в повышении энергетических уровней орбит атомов (ионов) за счёт
подведения внешнего тепла. При нагревании тела электроны переходят на более
высокие уровни, при этом увеличиваются размеры атомов (ионов) и уменьшается
сила химических связей между соседними атомами, что приводит к удлинению связей
и росту объёма любых тел при нагревании.
5.3. Фазовые переходы.
5.3.1. Агрегатные состояния.
Рассмотрим характерные признаки твёрдого
тела. Под твёрдыми телами понимаются вещества, которые обладают некоторой жёсткостью
по отношению к сдвигу [33]. Обычно твёрдые вещества имеют кристаллическую
структуру. Твёрдые тела в отличие от жидкостей имеют высокую прочность
химических связей. Жёсткостью химических связей обусловливается сопротивление
твёрдого тела внешним нагрузкам и обеспечивается его твёрдость. Жидкость не
может сопротивляться большим сдвиговым нагрузкам.
Таким образом, сопротивление тела
сдвиговым нагрузкам зависит от силы химических связей, то есть определяется
химическим составом. В свою очередь, при заданном составе сила химических
связей в теле определяется внешними параметрами. Такими параметрами являются
температура и давление. В зависимости от природы атомов, составляющих тело,
сопротивление сдвиговым нагрузкам при некоторых фиксированных температуре и
давлении будет разным. Какая величина напряжений на сдвиг должна быть границей
между твёрдым телом и жидкостью?
Несомненно, температура и давление могут
приводить к изменению агрегатного состояния вещества, поэтому следует
рассматривать тела в нормальных условиях. Подразделение тел на твёрдые и жидкие
не может быть сделано корректно по величине сдвигающих напряжений. Основным
критерием для определения агрегатного состояния тела может быть механизм
разрыва или трансформации химических связей под нагрузкой. Следует
рассматривать не только твёрдые и жидкие тела, а все возможные промежуточные
состояния. Твёрдое тело может быть упругим, упруго-пластичным, пластичным.
Жидкость представляет собой вязкое тело, при этом она может быть упруго-вязкой.
Истинно упругим твёрдым телом следует называть такое тело, которое при
действии нагрузки имеет только упругие деформации, то есть в нём отсутствует
механизм необратимого переключения химических связей до момента разрушения.
Научные представления о стекле как о жидкости не имеют под собой реальных
оснований. Факты свидетельствуют, что стекло нельзя считать вязкой жидкостью.
Если стекло обладает свойствами твёрдого тела, то оно – не переохлаждённая
жидкость, а твёрдое тело, так как свойства тел являются отражением их
структуры. Основываясь на отсутствии пластических деформаций при нормальных
условиях и высокой прочности на сжатие, стёкла следует считать упругими
твёрдыми телами [34].
Любому состоянию вещества должны
соответствовать определённые условия (или наоборот). Такими условиями являются
температура, давление и гравитационное поле. Каким образом может
кристаллический кварц перейти в кварцевое стекло? Конечно, причиной является не
переохлаждение, а переход в состояние структуры, соответствующей определённым
температуре и давлению. Кварцевое стекло сколько угодно долго может сохранять
своё состояние. При плавлении кварца происходят изменения в структуре, и
плотность изменяется с 2,65 г/см3 у кварца до 2,21 г/см3
у кварцевого стекла. Как раз эти изменения и приводят к стеклообразному
состоянию кварца. Итак, стекло – естественная самостоятельная стеклообразная
структура, необходимое объективное состояние вещества, проявляющееся уже в
расплавах.
Агрегатное состояние вещества
определяется, прежде всего, внутренним строением. Газообразное, жидкое и
твёрдое агрегатные состояния вещества характеризуется уровнем потенциальной
энергии атомов. Каждое вещество или смеси веществ способны существовать в любом
агрегатном состоянии.
5.3.2. Плавление.
Конечно, твёрдое тело имеет
непосредственную генетическую связь с расплавом, из которого оно образовалось.
Но именно благодаря различиям в структуре, возникающим с ростом температуры при
сохранении того же химического состава, и происходит плавление. Поэтому нельзя
проводить аналогию в структуре твёрдых тел и их расплавов. Структурные
представления о расплаве можно создать, приняв в качестве модели
деформированное твёрдое тело [35].
У кристаллических тел при нагревании
химические связи между ионами ослабляются, а при расплавлении разрушаются
полностью. Для кристаллических тел температура плавления – постоянная величина.
Но для стёкол картина совсем иная. Каждая группа кристаллов плавится при своей
характеристической температуре. По мере возрастания температуры постепенно
образуется жидкая фаза. Соотношение «жидкая фаза/структурные группы» и
определяет вязкость стекла [24].
5.3.3. Затвердевание.
Стабильным состоянием при данном давлении
и температуре в условиях гравитационного поля Земли является то, в которое
возвращается система из расплава. При нагревании кристаллического кварца он
через другие модификации переходит в кварцевое стекло. Следовательно,
стабильным состоянием кварца при атмосферном давлении является стеклообразное,
а все остальные модификации менее стабильны. Переход кристаллов кварца при
расплавлении в стеклообразное состояние в условиях атмосферного давления
является необратимым. Это свидетельствует о стабильности стекла в
термодинамическом понимании. Предположение, что кристаллическое состояние
обладает минимумом потенциальной энергии, положенное в основу представлений о
метастабильности стекла, оказалось некорректным. Кристаллическое состояние не
всегда термодинамически стабильно. Наряду со стабильными кристаллами возможно
существование и других стабильных структур, к которым относятся стёкла.
Стабильность стекла естественно вытекает из представлений о нём, как не
переохлаждённом состоянии вещества [31].
5.3.4. Вязкость.
Объяснение температурного изменения вязкости
стёкол и зависимости её от химического состава просто и естественно вытекает из
предлагаемой модели. Стекло представляет собой продукт с дискретным набором
химических связей с различной периодичностью дискретности и числом одинаковых
связей в каждом уровне. Вязкость стёкол характеризуется количеством разорванных
связей при данной температуре. В каркасе стекла есть связи, разрыв которых ещё
не может привести к вязкому течению. Это самые слабые связи. При повышении
температуры постепенно разрываются всё новые дискретные уровни химических
связей, ослабляются и перестраиваются оставшиеся. При нагревании стекло
представляет гетерогенную систему жидкость – твёрдое тело. После разрыва всех
химических связей расплав стекла представляет собой одну фазу – жидкую.
Разнообразие хода температурных
зависимостей вязкости различных по химическому составу стёкол связана с
индивидуальным набором в каждом стекле дискретных уровней по силе связи [23].
Текучесть стекольного расплава
осуществляется за счёт разрыва слабых связей ионов, которые находятся в
состоянии термической диссоциации, и их восстановления в новом положении.
Вязкость стекольного расплава определяется количеством образовавшихся
обособленных структурных групп, находящихся в расплаве низкотемпературных
структурных групп. По мере снижения температуры и кристаллизации дискретного
ряда более низкотемпературных структурных групп вязкость расплава увеличивается
вплоть до полного затвердевания. Ход кривой вязкости стёкол в зависимости от
состава определяется температурами образования структурных групп и их
количеством в расплаве, с понижением температуры жидкой фазы становится меньше,
и вязкость в низкотемпературном интервале будет возрастать аномально.
Стекло – структура, которая состоит из
поликристаллов неопределённого состава, имеющих различную векторную ориентацию
и отличающихся по силе химической связи, что предопределяет их различную
температуру плавления. Различие структурных единиц по силе химических связей
как раз и определяет высокую вязкость стекла уже в расплаве. Жидкость отражает
структуру будущего твёрдого тела. По вязкости расплава сразу видно: при полном
охлаждении получится кристалл или стекло.
Никаких перегруппировок атомов при
твердении расплавов стёкол нет. Уже в расплаве согласно зарядам ионов
образуется единственно возможная структура по их местоположению относительно
друг друга. Вязкость расплава стекла при температуре варки обусловливается
наличием в жидкой фазе высокотемпературных структурных элементов. При
охлаждении расплава структурных групп становится больше, а расплава всё меньше.
Поэтому вязкость стекла при снижении температуры стремительно нарастает. С
момента, когда сомкнутся структурные группы, стекло становится упруго-вязким.
Высокотемпературные структурные группы
(поликристаллы) находятся в текучем расплаве низкотемпературных структурных
групп. Дальнейшее снижение температуры приводит к появлению целого ряда других
структурных групп – кристаллов неопределённого состава. В процессе охлаждения
расплава относительное количество жидкой фазы уменьшается. Процесс продолжается
до тех пор, пока все структурные группы обособлены в текучем расплаве. В это
время охлаждающийся расплав по мере образования следующих структурных групп
повышает вязкость, но остаётся текучим.
При дальнейшем образовании дискретного
ряда структурных групп некоторые из них смыкаются и образуют начало
структурного скелета. Другие структурные группы, имеющие более низкую
температуру плавления, ещё находятся в диссоциированном состоянии и представляют
собой жидкую фазу. В это время расплав стекла ещё вязко-текучий. Последующее
снижение температуры приводит к смыканию структурных групп, у которых
образовались прочные химические связи, расплав становится вязко-упругим. При
дальнейшем охлаждении образуется горячеломкое твёрдое тело. Когда установятся
прочные химические связи у всех структурных групп, образуется горячее твёрдое
тело, которое является стеклом. При нагревании холодного стекла до расплавления
процесс идёт в обратном направлении.
Таким образом, текучесть стекольного
расплава осуществляется за счёт разрыва слабых связей ионов, которые находятся
в состоянии термической диссоциации, и их восстановления в новом положении.
Вязкость стекольного расплава определяется количеством образовавшихся
обособленных структурных групп, находящихся в расплаве (жидкой фазе)
низкотемпературных структурных групп. По мере снижения температуры и
кристаллизации дискретного ряда более низкотемпературных структурных групп
вязкость расплава увеличивается вплоть до полного затвердевания [24].
5.4. Свойства физических объектов.
5.4.1. Физика поверхности.
Общепринятым представлением о физике
поверхности является положение о повышенной энергии поверхностного слоя вещества.
Но это не так. Объяснить явление поверхностного натяжения с таких позиций
невозможно. Понимание факта высокой прочности тонкого стеклянного волокна стало
проблемой физики твёрдого тела [21]. Причиной трудностей интерпретации явлений
в поверхностном слое стала некорректная теория поверхности конденсированных
тел.
Разработанная модель предлагает
диаметрально противоположную предпосылку – конденсированная система обладает
поверхностным сгущением плотности, что эквивалентно поверхностному понижению
энергии.
Рассмотрим атомный механизм образования
новых поверхностей при разрушении твёрдых тел и жидкостей. Прочность всех тел
определяется силами межатомного взаимодействия. Чем меньше расстояния между
атомами в структуре материала, тем прочнее связи между ними. Это связано с тем,
что при взаимодействии зарядов атомов между собой с уменьшением расстояния
выделяется больше энергии.
При разрушении системы по некоторой
атомной плоскости устанавливается новое равновесное состояние. Хотя атомы, оказавшиеся
на поверхности, имеют меньшую координацию, они освободившимися атомными связями
вступают во взаимодействие со своими соседями. Поэтому атомные ряды, лежащие
ниже, должны противодействовать интенсивному взаимодействию поверхностных
атомов. В результате такого межмолекулярного силового взаимодействия система
переходит в состояние всестороннего сжатия. Так как в системе нет внешних
сжимающих сил, то силами, приводящими к всестороннему сжатию поверхности,
являются межмолекулярные силы внутреннего объёма. Такое взаимодействие
поверхностного слоя и внутреннего объёма приводит к появлению напряжений
растяжения в объёме. Расстояния между атомами внутреннего объёма при этом
увеличиваются [36].
Из анализа внутренней энергии при
разрушении и сфероидизации системы следует, что:
а) структурная внутренняя энергия системы
не может увеличиваться за счёт внесенной в систему энергии;
б) поверхностный слой любой системы всегда
имеет более низкую энергию, чем её объём;
в) пониженная структурная энергия
поверхностного слоя создаёт в системе напряжённое состояние всестороннего
сжатия и реализует возможность сфероидизации систем с пониженной жёсткостью;
г) понижение структурной энергии
поверхностного слоя в системе при образовании новых поверхностей за счёт самой
системы приводит к градиенту энергии, то есть делает систему анизотропной по
экстенсивным параметрам;
д) в связи с пониженной энергией
поверхностный слой конденсированного тела имеет более высокую прочность;
е) поверхностно-активные вещества
способствуют повышению энергии поверхностного слоя и снижению его прочности;
ж) система должна своими внутренними
силами отреагировать на то воздействие, которое к ней приложено;
з) не может быть одновременно в
поверхностном слое или объёме вещества сгущения энергии и плотности вещества:
чем выше плотность, тем меньше энергия и выше прочность [36].
5.4.2. Поверхностное натяжение.
Пониженная энергия поверхностного слоя
приводит к всестороннему сжатию тела [36]. В твёрдых телах поверхностный слой
находится в напряжённом состоянии. Особый интерес вызывает знание толщины
поверхностного слоя, то есть глубины действия поверхностных сил. По работе [37]
толщина поверхностного слоя твёрдого тела в результате взаимодействия частиц
оценивается в 0,1-1,0 нм. Для того, чтобы стабильно сохранялось равновесие
между напряжениями сжатия поверхности и растяжения внутренней части, для
цилиндрического тела в сечении площадь поверхностного слоя должна быть равна
площади внутренней части [38].
Поверхностный слой любого
конденсированного тела находится в сжатом состоянии.
5.4.3. Сфероидизация жидкости.
Если напряжения на сдвиг в
конденсированном теле выше тех, которые может создать поверхностный слой за
счёт взаимодействия его атомов с атомами внутренних слоёв, то при разрушении
геометрическая форма частей тела остаётся без изменения. В противном случае
поверхность конденсированных тел (жидкостей, вязких и вязко-упругих тел)
принимает минимальную величину. Именно силы всестороннего сжатия приводят к
уменьшению поверхности системы и сфероидизации [36].
5.4.4. Прочность.
Для разрушения тел, то есть удаления
атомов на расстояния, при которых прекращается взаимодействие между ними, необходимо
совершить над системой работу. Это значит, что нужно преодолеть межатомные силы
взаимодействия в поверхностном слое и внутренней части тела [38].Работа есть
форма передачи энергии системе. Если система имеет высокую внутреннею энергию,
её межмолекулярные связи могут быть разрушены при меньших удельных напряжениях,
чем у системы с низкой внутренней энергией. Внутренняя энергия системы
представляет меру её прочности.
Заметим, что чем ниже энергия системы, тем
меньше расстояния между атомами. Это значит, что в случае сгущения плотности в
некотором объёме системы в этом же объёме будет отрицательное сгущение энергии,
то есть энергия будет ниже. В случае сгущения энергии плотность этого объёма
системы будет меньшей. Одновременного сгущения энергии и плотности быть не
может [36].
Прочность на растяжение массивного стекла
мала. Для стекла она составляет 25,6-27,5 кг/мм2. При этом прочность
поверхностного слоя стекла на растяжение чрезвычайно велика и составляет
1955-1974 кг/мм2. Высокая прочность поверхностного слоя определяет
высокую прочность стеклянного волокна на растяжение. На прочность массивных
образцов высокая прочность поверхностного слоя не оказывает существенного
влияния [39].
Дискретное распределение
химических связей в стекле по их силе определяет прочность стекла на
растяжение. Прочность стекла характеризуется прочностью наиболее сильных
связей. Наличие в стекле связей с различной прочностью предопределяет, что
стекло – материал с низкой прочностью на растяжение [40].
В зависимости от строения атомов в
структуре стекла и взаимодействия с соседними атомами связь каждой пары атомов
характеризуется жёсткостью и допустимым относительным удлинением, которые
определяют силу связи [41]. Пары атомов, имеющие одинаковые относительные удлинения
при растяжении, образуют уровни по силе связи.
Когда разрываются самые слабые связи,
система немедленно реагирует на этот факт. Разрыв связей в системе, находящейся
в равновесии, ведёт к изменению местоположения остальных атомов – система деформируется
для сохранения устойчивости. Дальнейшее повышение растягивающей нагрузки
приводит к разрыву следующего уровня связей, и так далее, пока не произойдет
полный разрыв тела. Таким образом, по мере нарастания нагрузки происходит
последовательный разрыв связей, имеющих допустимые разрывные напряжения меньше
создаваемых действующей силой и инерционной составляющей разорвавшихся связей.
Нагрузка мгновенно перераспределяется на оставшиеся связи.
Как происходит элементарный акт разрыва
химической связи? При приложении растягивающей нагрузки происходит диссоциация
слабых связей с малым допустимым удлинением. Нагрузку после разрыва слабых
связей несут сильные связи с максимально допустимыми относительными
удлинениями. Если образец из стекла не доводить до разрушения, то после снятия
нагрузки диссоциированные химические связи ассоциируют.
После последовательного разрыва ряда
уровней связей по их силе при наступлении перегрузки связей, оставшихся ещё
целыми в некоторый момент времени, происходит мгновенное взрывоподобное их
разрушение. Механизм разрушения химических связей стекла предопределяет его
низкую прочность на растяжение [40].
5.4.5. Прочность тонких волокон.
Уже на протяжении длительного времени
решается вопрос повышенной прочности тонких стеклянных волокон. По мере
развития представления о прочности волокон носили противоречивый характер. До
сих пор не ясна сущность явления повышенной удельной прочности тонких
стеклянных волокон (и тонких волокон и плёнок вообще) [38].
В работе [36] показано, что представления
о повышенной энергии поверхностного слоя ошибочны. Поверхностный слой любого
конденсированного тела имеет более низкую энергию, чем его объём. Для разрыва
поверхностного слоя стеклянного волокна требуется повышенная энергия, то есть
удельная прочность поверхностного слоя выше прочности внутренней части.
Поверхность при разрушении твёрдых тел
играет большую роль, но гипотезы прочности волокон не учитывают влияния
поверхности. Хотя прочность поверхностного слоя выше, поверхность при
разрушении массивных твёрдых тел не может дать большого вклада в повышение
прочности. Но коренным образом положение меняется в микротелах: вклад
повышенной прочности поверхностного слоя при разрыве волокна может стать
значительным. Так как прочность поверхностного слоя твёрдого тела в нормальных
условиях всегда больше прочности внутренней части, то увеличение относительной
доли площади поверхностного слоя в поперечном сечении увеличивает прочность
тела. Ответственной за высокую прочность гипотетических бездефектных тонких
стеклянных и других волокон (и тонких плёнок) является только поверхностная
энергия. Прочность тонких волокон не может служить критерием для оценки
прочности структуры массивного стекла, которая определяется удельной прочностью
внутренней части [38].
Из представлений Гиббса [42] и других
авторов [37, 43, 44], считающих, что поверхностный слой конденсированных тел
имеет сгущение энергии, нельзя объяснить сверхвысокой прочности тонких волокон.
Поэтому высокая прочность стеклянных волокон по сравнению с массивным стеклом
стала проблемой физики твёрдого тела [21].
Высокая прочность тонких волокон связана с
повышенной прочностью поверхностного слоя.
6. Заключение.
1. Теоретическая физика
оторвалась от реальности и ушла в мир мистификации как в
молекулярно-кинетической теории, так и в её дочерних ветвях.
2. МКТ – антинаучное
направление теоретической физики. Ложная интерпретация строения материи, а
также её свойств преподаётся в средней и высшей школах, что наносит
непоправимый урон для будущего науки. Преподавать ложь – безнравственно.
3. МКТ и возникшие на её базе
физическая кинетика, статистическая механика и термодинамика не имеют под собой
научной базы и должны уйти из науки как ложные направления теоретической
физики.
4. Предложена альтернативная
теория строения материи на основе представлений о коллективной химической связи
во взаимодействии с гравитационным полем (эфиром), которая совместно с теорией
строения атома [29] объясняет сущность физических явлений, процессов и свойств
материи.
ССЫЛКИ НА ИСТОЧНИКИ
1..https://ru.wikipedia.org/wiki/%D0%AD%D0%BD%D0%B5%D1%80%D0%B3%D0%B8%D1%8F
2..https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BF%D0%BB%D0%BE%D1%82%D0%B0
3. http://encyclopaedia.biga.ru/enc/science_and_technology/TEPLOTA.html
4..http://ru.teplowiki.org/wiki/%D0%A2%D0%B5%D0%BF%D0%BB%D0%BE%D1%82%D0%B0
5. Мякишев Г.Я., Буховцев
Б.Б., Чаругин В.М. Физика. 11 класс, 2014.
6. http://tel-spb.ru/current/
7..https://ru.wikipedia.org/wiki/%D0%A0%D0%B0%D0%B4%D0%B8%D0%BE%D0%B2%D0%BE%D0%BB%D0%BD%D1%8B
8..https://ru.wikipedia.org/wiki/%D0%9D%D0%B0%D0%B3%D1%80%D0%B5%D0%B2
9. http://morozmedia.narod.ru/documents/ohlazhdenie.htm
10..https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BF%D0%BB%D0%BE%D0%B2%D0%BE%D0%B5_%D1%80%D0%B0%D1%81%D1%88%D0%B8%D1%80%D0%B5%D0%BD%D0%B8%D0%B5
11..https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BF%D0%BB%D0%BE%D0%BF%D0%B5%D1%80%D0%B5%D0%B4%D0%B0%D1%87%D0%B0
12.. https://ru.wikipedia.org/wiki/%D0%9F%D0%BB%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5
13. http://sci.sernam.ru/book_water.php?id=39
14. http://tepka.ru/fizika_8/13.html
15..https://ru.wikipedia.org/wiki/%D0%90%D0%B3%D1%80%D0%B5%D0%B3%D0%B0%D1%82%D0%BD%D0%BE%D0%B5_%D1%81%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%B8%D0%B5
16. https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%87%D0%BD%D0%BE%D1%81%D1%82%D1%8C
17..https://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D0%B2%D0%B5%D1%80%D1%85%D0%BD%D0%BE%D1%81%D1%82%D0%BD%D0%BE%D0%B5_%D0%BD%D0%B0%D1%82%D1%8F%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5
18. https://ru.wikipedia.org/wiki/%D0%92%D1%8F%D0%B7%D0%BA%D0%BE%D1%81%D1%82%D1%8C
19..https://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BA%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%82%D0%B5%D0%BE%D1%80
20. http://biofile.ru/his/27718.html
21. В.П.Пух. Прочность и
разрушение стекла, 23. Наука, Л., 1973.
22. А.И.Болутенко. Научные гипотезы. Физика стекла,
гип. 7, 1979.
23. А.И.Болутенко. Научные гипотезы. Физика стекла,
гип. 1, 1977.
24. А.И.Болутенко. Научные гипотезы. Физика стекла,
гип. 9, 2012.
25. А.И.Болутенко. Научные гипотезы. Физика стекла,
гип. 8, 2012.
26. Ч.Уэрт, Р.Томсон. Физика
твёрдого тела, 103. Мир, М., 1969.
27. Н.М.Павлушкин. Основы
технологии ситаллов, 19. Стройиздат, М., 1970.
28. Н.А.Торопов, Л.Н.Булак. Кристаллография
и минералогия, 67. Стройиздат, Л., 1972.
29. А.И.Болутенко. Научные гипотезы. Физика. гип. 2,
2016.
30. А.И.Болутенко. Научные гипотезы. Физика стекла,
ст. 6, 2011.
31. А.И.Болутенко. Научные гипотезы. Физика стекла,
ст. 11, 2011.
32. А.И.Болутенко. Научные гипотезы. Физика стекла,
гип. 11, 2012.
33. Р.Пайерлс. Квантовая
теория твёрдых тел, 259. Изд. иностр лит., М., 1956.
34. А.И.Болутенко. Научные гипотезы. Физика стекла,
ст. 12, 1978.
35. А.И.Болутенко. Научные гипотезы. Физика стекла,
ст. 9, 1976.
36. А.И.Болутенко. Научные гипотезы. Физика стекла,
гип. 3, 1978.
37. В.Д.Кузнецов.
Поверхностная энергия твёрдых тел, 220. ГИТТЛ, М., 1954.
38. А.И.Болутенко. Научные гипотезы. Физика стекла,
гип. 4, 1978.
39. А.И.Болутенко. Научные гипотезы. Физика стекла, гип.
6, 2012.
40. А.И.Болутенко. Научные гипотезы. Физика стекла,
гип. 5, 1979.
41. А.И.Болутенко. Научные гипотезы. Физика стекла,
ст. 14, 1979.
42. Дж.В.Гиббс.
Термодинамические работы. ГИТТЛ, М.-Л., 1950.
43. А.А.Берлин, В.Е.Басин.
Основы адгезии полимеров, 391. Химия, М., 1974.
44. Н.Н.Круглицкий. Основы
физико-химической механики, ч. 1, 263. Вища школа, Киев, 1975.
9.10.2016
Вспомните:
- что такое атом;
- из чего состоит атом;
- изменяется ли атом в химических реакциях?
АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Содержание
- Структура Периодической системы Менделеева
- Ядро атома. Изотопы
- Распределение электронов в поле ядра атома
- Строение атома и свойства элементов
- Выводы
Структура Периодической системы Менделеева
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
- номер периода;
- номер группы;
- вид подгруппы.
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
- 1-й период — Н, Не — 2 элемента;
- 2-й период — Li…Nе — 8 элементов;
- 3-й период — Na…Аr — 8 элементов.
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
- 4-й период (2 ряда) — К…Кr — 18 элементов;
- 6-й период (3 ряда) — Сs…Rn — 32 элемента. В этот период входит ряд лантаноидов.
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
- период;
- группу;
- подгруппу;
- порядковый номер.
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
- в 4-м периоде, VI группе, побочной подгруппе;
- в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать эти сведения об элементе со строением его атома?
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
- Протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1.
- Нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
- 3-м периоде, VII группе, главной подгруппе;
- 4-м периоде, IV группе, побочной подгруппе;
- 5-м периоде, I группе, главной подгруппе.
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь.
Для того,чтобы ответить на этот вопрос, нужно понять:
- Что происходит с атомом в ходе химических процессов;
- Что такое «химический элемент».
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
* Слово «изотоп» означает по смыслу «одно место», т. е. все изотопы данного химического элемента находятся в одной клетке ПСХЭ.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
Химический элемент «кислород» также представлен тремя природными изотопами:
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Если разные вещества содержат атомы одного и того же химического элемента, это не означает, что эти вещества имеют одни те же свойства. Например, химический элемент «хлор» в виде атомарного хлора Cl• разрушает метан, а также атмосферный озон. Тот же элемент в виде молекулярного хлора Cl2 ядовит, активно реагирует с водой, многими металлами, а ионы хлора (химический элемент — тот же!) в составе NaCl химически инертен, а с биологической точки зрения не только безвреден, но и полезен для нас. Эти ионы являются макроэлементами нашей пищи, которые входят в состав крови, желудочного сока. Суточная потребность — до 6 граммов.
Но вернемся к описанию строения атома.
Распределение электронов в поле ядра атома
Как известно, ядро атома в химических процессах не меняется. А что меняется? Общее число электронов и распределение электронов. Общее число электронов определить несложно: оно равно порядковому номеру, т. е. заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (рис. 7).
Задание 3.5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
- на первом энергетическом уровне не более 2 электронов;
- на втором энергетическом уровне не более 8 электронов;
- на третьем энергетическом уровне не более 18 электронов.
ЗАПОМНИТЕ ЭТИ ЧИСЛА!
Они показывают, что, например, на втором энергетическом уровне может находиться 2 или 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило – число внешних электронов равно:
- для элементов главных подгрупп — номеру группы;
- для элементов побочных подгрупп — оно не может быть больше двух (рис. 8).
Например:
Задание 3.6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень.
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Задание 3.8. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Вывод сделайте, определив положение элемента в Периодической системе химических элементов и число электронов на внешнем уровне.
Для того чтобы составить распределение электрона по остальным уровням и подуровням, следует воспользоваться следующим АЛГОРИТМОМ:
- Определить общее число электронов в атоме (по порядковому номеру).
- Определить число энергетических уровней (по номеру периода).
- Определить число внешних электронов (по виду подгруппы и номеру группы).
- Указать число электронов на всех уровнях, кроме предпоследнего.
- Рассчитать число электронов на предпоследнем уровне.
Например, согласно пунктам 1…4 для атома марганца определено:
Получили распределение электронов в атоме марганца (рис. 9):
Задание 3.9. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните.
Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
- первый уровень состоит из одного s-подуровня;
- второй уровень состоит из двух подуровней: s и р и т. д.
На каждом подуровне может находиться строго ограниченное число электронов:
- на s-подуровне — не больше 2ē;
- на р-подуровне — не больше 6ē;
- на d-подуровне — не больше 10ē.
Подуровни одного уровня заполняются в строго определённом порядке:
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня и т. д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца (рис. 10).
В целом электронная конфигурация атома марганца выглядит так:
Здесь и далее приняты обозначения (рис. 11).
Задание 3.10. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того чтобы определять свойства этих химических элементов!
Для этого следует помнить: в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершённом d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:
или сокращённо:
Строение атома и свойства элементов
Мы получили краткую электронную формулу атома марганца, которая отражает распределение его валентных электронов. Что можно определить по этой формуле?
1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона.
2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов.
3. Какие электроны и сколько их будет отдавать атом марганца? Ответы:
- два внешних электрона (они дальше всех от ядра и слабее притягиваются им);
- семь (2+5) валентных электронов (так как в этом случае на третьем уровне атома останется восемь электронов, т. е. образуется завершённый уже внешний уровень).
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 12).
Полученные условные заряды атома называются степенью окисления.
Рассматривая строение атомов кислорода и водорода и рассуждая аналогично, можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
Вопрос. С каким из этих химических элементов может образовывать соединения марганец, если учесть полученные выше степени окисления его?
Только с кислородом, так как его атом имеет противоположную по заряду (знаку) степень окисления. В этом случае несложно составить формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
Строение атома марганца подсказывает, что большей степени окисления, чем +7, у марганца быть не может, так как в этом случае пришлось бы затрагивать устойчивый, теперь уже завершённый предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 — высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, так как, во-первых, у него на внешнем уровне шесть электронов и, во-вторых, его символ находится в главной подгруппе выше линии В — At. Поэтому его атом может и принимать (до завершения внешнего уровня, и отдавать электроны. В результате, в отличие от металлов, неметалл теллур может проявлять низшую степень окисления (–2) и образовывать летучие водородные соединения с водородом (Н2Те). Высшая степень окисления атома теллура (+6), как и у металлов соответствует номеру группы и, находясь в этой степени окисления, теллур образует высший оксид ТеО3.
Задание 3.11. Изобразить электронные конфигурации атомов Nа, Rb, Сl, I, Si, Sn. Определить свойства этих химических элементов, формулы их простейших соединений (с кислородом и с водородом).
Сделаем выводы.
- В химических реакциях участвуют только валентные электроны, которые могут находиться только на последних двух уровнях.
- Атомы металлов могут только отдавать эти электроны (все или несколько), принимая положительные степени окисления.
- Атомы неметаллов могут принимать (недостающие до восьми) электроны, получая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), принимая при этом положительные степени окисления.
Возникает вопрос: как составить краткую электронную формулу (распределение валентных электронов), сразу, не составляя длинных электронных конфигураций? Для этого нужно помнить несколько простых правил.
1. Номер периода соответствует числу энергетических уровней у атомов химических элементов этого периода.
2. Номер группы, как правило, совпадает с числом валентных электронов, (исключение составляют только подгруппы меди и железа).
3. Подгруппа (главная или побочная) включает химические элементы, у которых имеется одинаковое распределение валентных электронов, причём в атомах элементов главной и побочной подгруппы электроны распределяются по-разному.
3.1. У элементов главных подгрупп все валентные электроны находятся на внешнем уровне, например:
V группа, главная → 5 валентных электронов
Поэтому для всех химических элементов главной подгруппы пятой группы (пять валентных электронов) распределение этих электронов следующее:
3.2. У элементов побочных подгрупп число внешних электронов не превышает двух, например:
5 валентных электронов ← V группа, побочная → 2 электрона на внешнем уровне*.
* За счёт «провала электрона» число внешних электронов может быть меньше. Но число валентных электронов при этом не меняется, поэтому свойства элемента будут такими же. Эти случаи рассмотрены в Самоучителе второго уровня, часть 1.
Для большинства химических элементов побочных подгрупп, у которых на внешнем энергетическом уровне два электрона, остальные (N – 2) валентные электроны будут находиться на d-подуровне предвнешнего уровня (N – номер группы), например:
Вопрос. Для элементов какой группы составлена такая запись?
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше «предсказание» сбылось.
Сравним теперь свойства химических элементов одной подгруппы, например:
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону — это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, сделаем вывод: какой элемент — Nа или Rb — легче отдает внешний электрон? Какой из них является более активным металлом? Очевидно, рубидий, так как его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, так как возрастает радиус атома и валентные электроны слабее притягиваются к ядру.
Сравним свойства:
Оба химических элемента — неметаллы, так как до завершения внешнего уровня не хватает одного электрона, и эти атомы будут активно притягивать недостающий электрон. При этом, чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счёт чего происходит притяжение электрона? За счёт положительного заряда ядра атома. Но в таком случае чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
Сделаем вывод, у какого элемента сильнее выражены неметаллические свойства: у хлора или у йода? Очевидно, у хлора, так как его валентные электроны ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, так как возрастает радиус атома и все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова:
На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в Периодической системе находятся по разные стороны от линии, соединяющей бор и астат (см. правило в уроке 2.1.). Поэтому:
- у кремния, символ которого находится выше линии В–At, сильнее проявляются неметаллические свойства;
- у олова, символ которого находится ниже линии В–At, сильнее проявляются металлические свойства;
Почему? Потому что в атоме олова четыре валентных электрона находятся так далеко от ядра, что присоединение недостающих четырех электронов затруднено, в то время как отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причём первый (приём электронов) — преобладает.
Выводы:
- чем меньше электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства;
- чем больше внешних электронов в атоме, чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
Сравним строение атомов и свойства химических элементов одного периода:
Вопрос. О каком периоде и каких элементах идёт речь?
Видно, что металлические свойства убывают, так как увеличивается число внешних электронов, а неметаллические свойства — возрастают. Если речь идёт о большом периоде, где большинство элементов имеет 2 электрона на внешнем уровне (элементы побочных подгрупп), то в этом случае главной причиной убывания металлических свойств в периоде является уменьшение радиуса атома. Дело в том, что за счёт увеличения заряда ядра в периоде увеличивается сила притяжения электронов к нему и уменьшается радиус атома:
Сравните: r (Ca) = 0,197 нм и r (Zn) = 0,139 нм
Вопрос. Какой из металлов более активен?
Основываясь на этих и других выводах, сформулированных в этой главе, можно для любого химического элемента Периодической системы составить алгоритм описания свойств химического элемента по его положению в Периодической системе.
1. Составить схему строения атома, т. е. определить состав ядра, распределение электронов по энергетическим уровням и подуровням:
- определить общее число электронов в атоме (по порядковому номеру);
- определить число энергетических уровней (по номеру периода);
- определить число внешних электронов (по виду подгруппы и номеру группы);
- указать число электронов на всех энергетических уровнях, кроме предпоследнего;
- рассчитать число электронов на предпоследнем уровне.
2. Определить число валентных электронов и число внешних электронов.
3. Определить, какие свойства — металла или неметалла — сильнее проявляются у данного химического элемента (по положению в ПСХЭ).
4. Определить число отдаваемых (принимаемых) электронов.
5. Определить высшую и низшую степени окисления химического элемента.
6. Составить для этих степеней окисления химические формулы простейших соединений с кислородом и водородом.
7. Определить характер оксида (см. урок 2.1.) и составить уравнения его реакции с водой.
8. Для указанных (пункт 6) веществ составить уравнения характерных реакций (см. урок 2).
Задание 3.13. Составить по данной схеме описания атомов серы, селена, кальция и стронция и свойства этих химических элементов. Какие общие свойства имеют их оксиды? Гидроксиды?
Если вы выполнили упражнения 3.11 и 3.12, то легко заметить, что не только атомы элементов одной подгруппы, но и их соединения имеют общие свойства и похожий состав. Это отражено в Периодическом законе Менделеева: Свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от ЗАРЯДА ЯДЕР ИХ АТОМОВ.
Физический смысл Периодического закона ясен: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.
Выводы
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.
Тип кристаллической решётки вещества определяет его физические свойства.
Особенности строения разных типов кристаллических решёток и характерных физических свойств веществ представлены в таблице.
|
Тип кристал-лической решётки |
Частицы в узлах решётки |
Связь между частицами |
Прочность связи |
Физические свойства |
|
Молекулярная |
Молекулы |
Межмолеку- лярное взаимодействие |
Слабая |
Низкие температуры плавления и кипения (летучие и легкоплавкие). Иногда имеют запах. Невысокая твёрдость и прочность. Разная растворимость в воде (зависит от полярности молекул) |
|
Атомная |
Атомы |
Ковалентная |
Очень прочная |
Очень высокие температуры плавления и кипения (нелетучие и тугоплавкие). Очень твёрдые и прочные. Не имеют запаха. Не растворяются в воде и в других растворителях |
|
Ионная |
Катионы и анионы |
Ионная |
Прочная |
Высокие температуры плавления и кипения (нелетучие и тугоплавкие). Твёрдые, но непрочные, хрупкие. Не имеют запаха. В твёрдом состоянии не проводят электрический ток, а в расплавах и водных растворах — проводят |
|
Металлическая |
Катионы |
Металлическая |
Разной прочности |
Температуры плавления и кипения разные. Имеют характерный металлический блеск. Ковкие, пластичные. Характерна высокая электро- и теплопроводность |
Сравним физические свойства веществ с разными типами кристаллических решёток.
Атомные кристаллы — самые твёрдые и прочные, так как атомы, расположенные в их узлах, соединены ковалентными связями.
Вещества с ионными кристаллическими решётками — твёрдые при обычных условиях, но непрочные, хрупкие. При механическом воздействии одинаковые ионы начинают расталкиваться и кристалл разрушается.
Металлы отличаются ковкостью и пластичностью. При ударе металл не разрушается, а сплющивается, так как вместе со слоями ионов и атомов смещаются и свободные электроны.
У самых непрочных веществ — молекулярные кристаллические решётки. Многие из них при обычных условиях являются газами и жидкостями.
Температуры плавления и кипения
У металлов температуры плавления и кипения зависят от размера атомов и числа валентных электронов, а также от строения кристаллической решётки. Поэтому разброс в значениях очень большой. Например, температура плавления ртути равна
−38,8°C
, а вольфрама —
+3448°C
.
Среди веществ с молекулярной решёткой легче плавятся и кипят вещества, молекулы которых неполярные. У веществ с ионной и атомной решётками температуры плавления и кипения высокие (у атомных выше, чем у ионных).
В таблице приведены температуры плавления веществ с разными кристаллическими решётками.
|
Вещество |
Строение |
Температура плавления |
| Кислород O2 |
Молекулярная решётка, неполярные молекулы |
(-218 °C) |
| Оксид азота((II)) NO |
Молекулярная решётка, полярные молекулы |
(-164 °C) |
| Оксид магния MgO |
Ионная решётка |
(+2825 °C) |
| Алмаз (C) |
Атомная решётка |
(+3700 °C) |
Вещества с атомной кристаллической решёткой в воде не растворяются.
Хорошо растворяются в воде вещества с ионной кристаллической решёткой (щёлочи, многие соли).
Молекулярные вещества растворяются, если их молекулы полярные (хлороводород, аммиак, сернистый газ). Высокая растворимость — у веществ, образующих водородные связи (метанол, этанол, глицерин, серная, азотная, муравьиная, уксусная кислоты и т. д.).
Молекулярные вещества с неполярными молекулами растворяются в воде плохо (водород, кислород, азот, метан и т. д.).
Высокая электропроводность у металлов (за счёт свободных электронов).
Ионные вещества проводят электрический ток в расплавах и водных растворах, в твёрдом состоянии они неэлектропроводны.
Запах может быть только у молекулярных веществ.