Аминокислоты

4
Средняя оценка: 4
Всего получено оценок: 841.
4
Средняя оценка: 4
Всего получено оценок: 841.
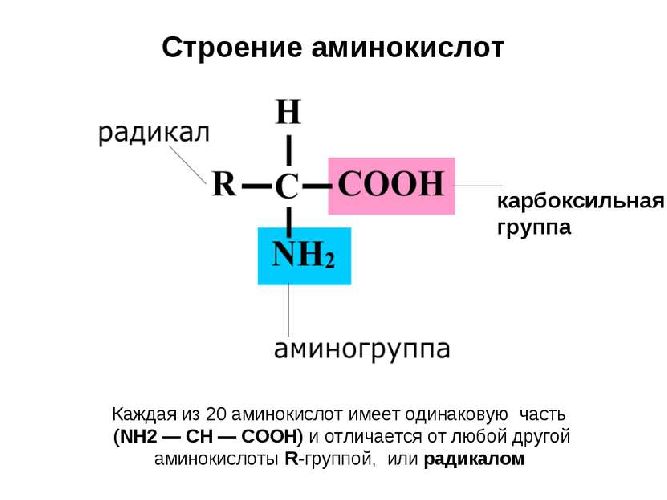
Органические вещества, в молекуле которых содержатся карбоксильные и аминные группы, называются аминокислотами или аминокарбоновыми кислотами. Это жизненно важные соединения, являющиеся основой построения живых организмов.
Строение
Аминокислота – мономер, состоящий из азота, водорода, углерода и кислорода. Также к аминокислоте могут присоединяться не углеводородные радикалы, например, сера или фосфор.
Условная общая формула аминокислот – NH2-R-COOH, где R – двухвалентный радикал. При этом аминогрупп в одной молекуле может быть несколько.
С химической точки зрения аминокислоты – производные карбоновых кислот, в молекуле которых атомы водорода заменены аминогруппами.
Виды
Аминокислоты классифицируются по нескольким признакам. Классификация по трём признакам представлена в таблице.
|
Признак |
Вид |
Описание |
Пример |
|
По расположению аминных и карбоксильных групп относительно друг друга |
α-аминокислоты |
Содержат один атом углерода между функциональными группами |
Аланин |
|
β-, γ-, δ-, ε- и другие аминокислоты |
Содержат несколько атомов углерода между функциональными группами |
β-аминопропионовая кислота (два атома между группами), ε-аминокапроновая кислота (пять атомов) |
|
|
По изменяемой части (радикалу) |
Алифатические (жирные) |
Не содержат ароматических связей. Бывают линейными и циклическими |
Лизин, серин, треонин, аргинин |
|
Ароматические |
Содержат бензольное кольцо |
Фенилаланин, триптофан, тирозин |
|
|
Гетероциклические |
Содержат гетероатом – радикал, не являющийся углеродом или водородом |
Триптофан, гистидин, пролин |
|
|
Иминокислоты |
Содержат иминогруппу NH |
Пролин, оксипролин |
|
|
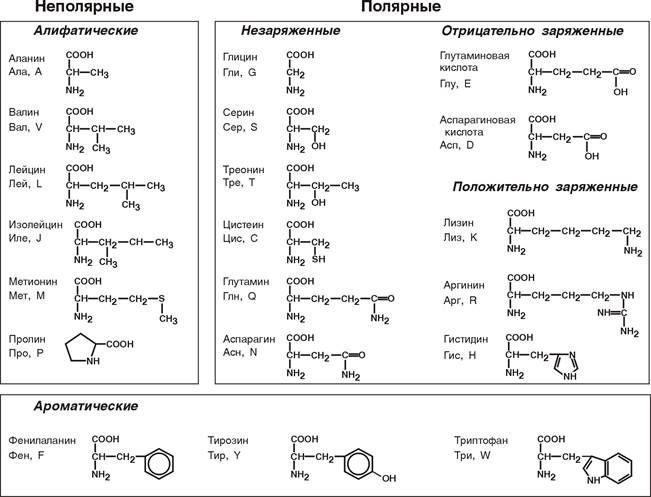
По физико-химическим свойствам |
Неполярные (гидрофобные) |
Не взаимодействуют с водой |
Глицин, валин, лейцин, пролин |
|
Полярные (гидрофильные) |
Взаимодействуют с водой. Подразделяются на незаряженные, положительно и отрицательно заряженные |
Лизин, серин, аспартат, глутамат, глутамин |
Названия формируются из структурных или тривиальных наименований карбоновых кислот с приставкой «амино-». Цифры показывают, где располагается аминогруппа. Также используются тривиальные названия, заканчивающиеся на «-ин». Например, 2-аминобутановая или α-аминомасляная кислота.
Свойства
Аминокислоты отличаются физическими свойствами от других органических кислот. Все соединения класса – кристаллические вещества, хорошо растворимые в воде, но плохо растворимые в органических растворителях. Они плавятся при высоких температурах, имеют сладковатый вкус и легко образуют соли.
Аминокислоты являются амфотерными соединениями. Благодаря наличию карбоксильной группы -СООН проявляют свойства кислот. Аминогруппа -NH2 обуславливает основные свойства.
Химические свойства соединений:
- горение:
4NH2CH2COOH + 13O2 → 8CO2 + 10H2O + 2N2;
- гидролиз:
NH2CH2COOH + H2O ↔ NH3CH2COOH + OH;
- реакция с раствором щёлочи:
NH2CH2COOH + NaOH → NH2CH2COO-Na + H2O;
- реакция с раствором кислоты:
2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4;
- этерификация:
NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O.
Из аминокислотных мономеров образуются длинные полимеры – белки. Один белок может включать несколько разных аминокислот. Например, содержащийся в молоке белок казеин состоит из тирозина, лизина, валина, пролина и ряда других аминокислот. В зависимости от строения белки выполняют различные функции в организме.
Что мы узнали?
Из урока химии 10 класса узнали, что такое аминокислоты, какие вещества содержат, как классифицируются. Аминокислоты включают две функциональные группы – аминогруппу -NH2 и карбоксильную группу -COOH. Наличие двух групп обуславливает амфотерность аминокислот: соединения обладают свойствами оснований и кислот. Аминокислоты делятся по нескольким признакам и отличаются количеством аминогрупп, наличием или отсутствием бензольного кольца, присутствием гетероатома, взаимодействием с водой.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4
Средняя оценка: 4
Всего получено оценок: 841.
А какая ваша оценка?
8 мая 2022
В закладки
Обсудить
Жалоба
Формулы аминокислот
20 формул.
Аминокислоты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O) и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
aminokisloti.docx
Аминокислоты: понятие, свойства
Определение
Аминокислоты – это кристаллические вещества с высокой температурой плавления и сладковатым вкусом. Они хорошо растворяются в воде, но плохо растворяются в органических растворителях. Аминогруппа обуславливает основные свойства аминокислот, карбоксильная группа – кислотные свойства.
Аминокислоты являются неотъемлемой частью процесса, связанного с биосинтезом белка.
Характерное свойство белка — это его способность к расщеплению на аминокислоты внутри пищеварительной системы в организме.
Количество основных пептидов в природе насчитывает около 200 наименований. Однако, для правильного построения биологической составляющей организма, необходимо только 20 самых основных из них.
Классификация аминокислот и их назначение
В биологии установлена основная классификация аминокислот, которая подразделяется на две группы:
- Заменимые группы аминокислот.
Определение
Аминокислоты, которые можно заменить – это четко выраженная группа аминокислот, которые попадают в организм путем употребления продуктов питания.
Так же они могут образоваться внутри организма человека и любых других веществ.
К заменимым аминокислотам относится следующие показатели:
- Аланин – это измеритель огромного количества белковой составляющей, участвует в процессе гликогенолиза, тем самым преобразовывая в глюкозу в печени человека. Является основным регулятором пищеварительных процессов в организме.
- Аргинин – это аминокислота, особенностью которой является процесс синтеза в организме взрослого человека. В организме ребенка она не образуется. Входит в состав процесса системы синтеза, который связан с гормональным ростом. Является единственным веществом в организме, которое имеет способность взаимодействовать с азотом. Оказывает существенное воздействие на рост мышечной массы, путем снижения массы жира в теле.
- Аспарагин – это составной пептид, который необходим для азотного обмена. Взаимодействуя с основными ферментами имеет способность отщеплять аммониак и преобразовываться в кислоту.
- Аспаргиновая кислота. Дает возможность для восстановления при нарушении работы, связанной с нервной системой и работой сердечно-сосудистой системы.
- Гистидин – необходим для лечения болезней, связанных с кишечником, а также для профилактического лечения при заболевании СПИДом. Является показателем снижения факторов, которые связаны с внешними воздействиями.
- Глицин. Необходим в первую очередь как компонент успокоительного действия. Иными словами, служит как нейромедиатор.
- Глутомин – это аминокислота, которая входит в состав гемоглобина. Активно стимулирует процесс обмена в центральной нервной системе человека.
- Глютаминовая кислота –это кислота, которая оказывает непосредственное воздействие на работу всей нервной системы.
- Пролин –это аминокислота, входящая в состав всех протеинов в организме, максимальное его количество содержится в эластине и коллагенах.
- Серин – это компонент аминокислот, который входит в состав нейронов головного мозга человека и отвечает частично за его работу. Способствует выработке и затрате энергии. Его образование происходит при помощи глицина.
- Тирозин, встречается в тканевых клетках животных и растений. Может преобразовываться из фенилаланина.
- Цистеин, главный компонент, который можно встретить в составе кератина. Включен в состав антиоксидантов, может образовываться из ксилина.
Нет времени решать самому?
Наши эксперты помогут!
- Незаменимые.
Определение
Незаменимые аминокислоты — это группа аминокислот, которые не обладают характерной особенностью синтеза в организме человека.
Организм способен получать данные аминокислоты, только через пищу в процессе потребления.
К незаменимым аминокислотам относятся следующие виды ферментов:
- Валин, является кислотой, повышающей координацию при активной работе мышечной части тела. Дает возможность нормализовать активную работу организма. Особенно это характерно для резких смен температуры воздуха.
- Изолейцин. Является естественным компонентом, который обогащает мышцы тела силой и энергией.
- Лейцин. Основной регулятор всех метаболических процессов, которые происходят в организме человека. Его функция заключается в строительстве структуры белка. Как и первые две аминокислоты относится к комплексу BCAA. Данные вещества оказывают существенное воздействие на повышение объема мышечной массы. Контролируют уровень содержания гомеостаза при высоких физических нагрузках.
- Лизин. Повышает скорость процесса регенерации тканей, образует необходимые организму гормоны, ферменты и разного вида антитела. Повышает прочность и надежность работы сосудов. Является составной частью коллагена.
- Метионин. Контролирует уровень жира в организме, тем самым уменьшает его содержание в печени.
- Треонин. Служит укрепляющим эффектом для сухожилий и благоприятно оказывает действие на зубную эмаль.
- Триптофан. Компонент регулирующий за психически-эмоциональное состояние человека. Оказывает значительное воздействие при лечении расстройств психики у человека.
- Фениалалнин. Регулятор правильной деятельности микрочастиц в коже человека. Значительно понижение или сводит до минимума пигментацию. Приводит в норму водно-солевой баланс для самых жизненно важных участков кожи.
Также, в некоторых случаях, возможно выделение третьей группы: условно заменимых аминокислот.
В зависимости от кислотно-основных свойств, которые основаны на строении радикала, аминокислоты принято разделять на четыре основные группы
- Неполярные или гидрофобные.
- Полярные незаряженные.
- Полярные, которые заряжены отражательными частицами, при pH=7.
- Полярные, положительно заряженные частицы при pH=7.
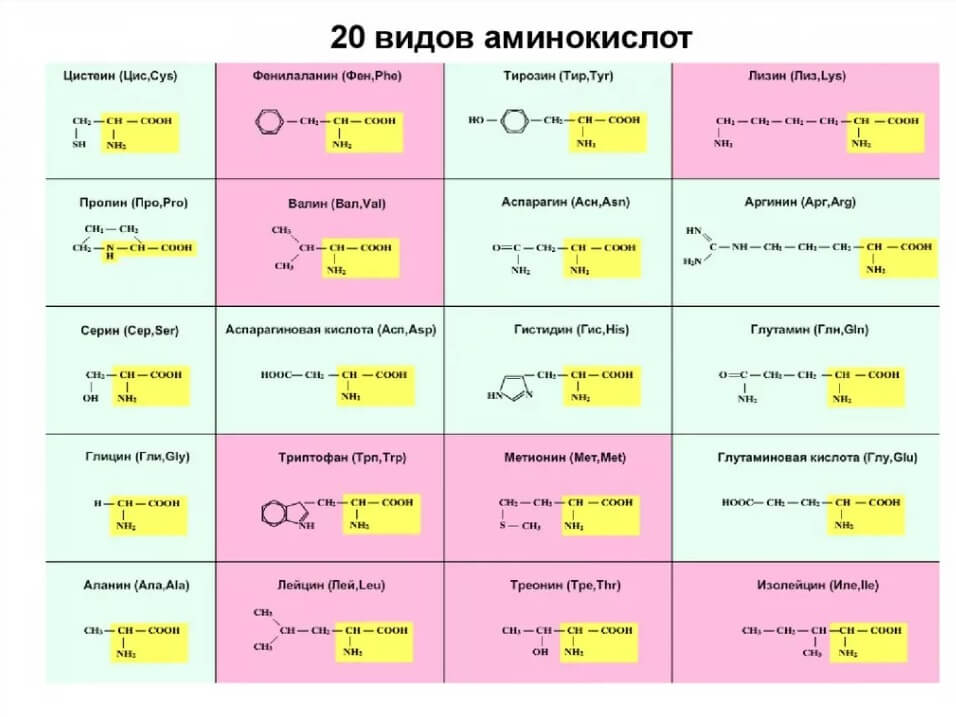
Структурные формулы и наименования аминокислот
Важнейшие аминокислоты, необходимы для правильной жизнедеятельности организма
| Наименование формулы | Научное химическое название | Аббревиатура или сокращенное название остатка аминокислоты |
| Алифатические | ||
|---|---|---|
| Н- | Глицин | Gly |
| СН3— | Аланин | Ala |
| (СН3)2СН- | Валин* | Val |
| (СН3)2СНСН2— | Лейцин* | Leu |
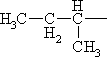 |
Изолейцин* | Ile |
| Содержащие основную группу OH компонентов. | ||
| НОСН2— | Серин | Ser |
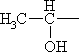 |
Треонин* | Thr |
| Имеющие в своем составе СООН группу | ||
| НООССН2— | Аспарагиновая кислота | Asp |
| НООССН2СН2— | Глутаминовая кислота | Glu |
| Имеющие в составе СОNH2 | ||
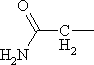 |
Аспарагин | Asn |
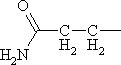 |
Глутамин | Gln |
| Содержащие NH2 | ||
| H2N(CH2)3CH2— | Лизин* | Lys |
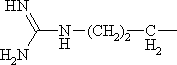 |
Аргинин | Arg |
| HSCH2— | Цистеин | Cys |
| СH3SСН2CH2— | Метионин* | Met |
| Акрилосодержашие | ||
| С6Н5СН2— | Фенилаланин* | Phe |
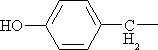 |
Тирозин | Tyr |
| Гиторилосодержащие аминокислоты | ||
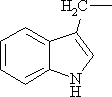 |
Триптофан* | Trp |
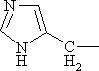 |
Гистидин | His |
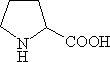 (полная формула) (полная формула) |
Пролин | Pro |
Избыток и недостаток аминокислот в организме
Большинство видов аминокислот оказывают существенное воздействие на метаболизм в организме человека. Благодаря аминокислотам в организм поступает необходимое количество энергии, позволяющая образовывать химические реакции, которые основаны на дыхательных способностях, психоэмоциональных качествах и многих других. Некоторые аминокислоты содержатся непосредственно только в продуктах питания.
Низкий уровень аминокислот в организме человека, может привести к следующим характерным симптомам:
- плохое самочувствие;
- отставшие аппетита и непереносимость пищи;
- высокий уровень утомляемости и низкая активность;
- нарушение гомеостаза;
- постоянная сонливость;
- нестабильное нервно-психическое состояние.
В случае, когда в организме низкий уровень хотя бы одной аминокислоты, может произойти существенное ухудшение здоровья.
Когда в организме перенасыщение аминокислот, то может произойти сбой работы. И у человека возникают симптомы, которые характерны в большей степени пищевому отравлению.
Для нормальной работы организма следует всегда тщательно следить за своим питание, контролировать уровень белка. Четко составлять и планировать свой рацион питания, включая в него все необходимые продукты, которые содержат важные для организма аминокислоты.
Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин
NH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) | 
цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) | NH2-CH(CH2C6H5)-COOH
фенилаланин _________________________________ тирозин |
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOH
глутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOH
лизин |
Номенклатура аминокислот
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Физические свойства аминокислот
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
Получение аминокислот
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):
Химические свойства аминокислот
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
1. Кислотно-основные свойства аминокислот
Аминокислоты — это амфотерные соединения.
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:
1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с кислотами:
2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
Например, глицин взаимодействует с азотистой кислотой:
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
Например, глицин взаимодействует с этиловым спиртом:
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
Например, глицин взаимодействует с гидроксидом бария при нагревании:
Например, глицин разлагается при нагревании:
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Например, глицин реагирует с аланином с образованием дипептида (глицилаланин):
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Органические вещества образуют
гомологические ряды, которые имеют
общие формулы.
Это позволяет:
-
выражать молярную массу через число n
M(CnH2n
+ 2) = 12 ∙
n + 1 ∙
(2n +2) = 14n + 2;
-
приравнивать молярную массу, выраженную
через n, к истинной молярной
массе и находить n. -
составлять уравнения реакций в общем
виде и производить по ним вычисления.
При решении таких задач нужно знать и
использовать общие формулы гомологических
рядов:
-
алканы – СnH2n
+ 2 -
алкены и циклоалканы – CnH2n
-
алкины и алкадиены – CnH2n
– 2 -
арены – CnH2n
– 6 -
моногалогеналканы – CnH2n
+ 1Г -
дигалогеналканы – CnH2nГ2
-
фенолы – CnH2n
– 7OH -
предельные одноатомные спирты – CnH2n
+ 1OH, R
– COH -
альдегиды – CnH2n
+ 1 COH, R
– COH -
предельные карбоновые кислоты – CnH2n
+ 1COOH, R
– COOH -
сложные эфиры – R1
– COOR2 -
первичные амины – CnH2n
+ 1NH2,
R – NH2
вторичные амины – R1
– NH – R2
третичные амины – R1
– N – R2
R3
14. аминокислоты – CnH2n(NH2)COOH
Рассмотрим возможные варианты задач
на вывод формул органических веществ
по общим формулам.
-
Вывод формул по известной массовой доле элемента в веществе.
Порядок решения:
-
Написать общую формулу и выразить
молекулярную массу вещества через
число n; -
Подставить данные в формулу ω(Эл)
= Аr (Эл) ∙
индекс / Мr; -
Решить уравнение с одним неизвестным,
найти число n.
Задача № 1.
Определить формулу аминокислоты,
если известно, что она содержит 15,73 %
азота.
Дано: Решение:
ω
(N)
= 15,73 % 1. Oбщая формула
аминокислот:
CnH2n(NH2)COOH
М.Ф. = ?
2. Выразим через
n молекулярную массу:
Мr(CnH2n(NH2)COOH)
= 12n + 2n + 16 + 45 = 14n + 61.
3. Подставим данные
в формулу: 0,1573 = 14 ∙ 1 / 14n
+ 61.
2,2022n + 9,5953 = 14.
2,2022n = 4,4047
n = 2 Ответ:
C2H4(NH2)COOH.
Задача № 2.
Массовая доля водорода в алкане
составляет 0,1579. Найти формулу алкана.
Ответ: С8Н18.
Задача № 3.
Массовая доля углерода в алкине 87,8 %.
Определить формулу алкина.
Ответ: С6Н10.
Задача № 4.
Массовая доля кислорода в аминокислоте
равна 35,95 %. Найти молекулярную формулу
аминокислот.
Ответ: C2H4(NH2)COOH.
Задача № 5.
Массовая доля хлора в монохлоралкане
равна 55,04 %. Найти формулу моно —
хлоралкана.
Ответ: C2H5Cl.
2. Вывод формул по известным данным для нахождения истинной молярной массы
(плотности, относительной плотности,
массе и объёму).
-
Найти истинную молярную массу по
формулам: = m
/ V
М = ∙ Vm
М = D2 ∙
M2
2. Выразить молярную массу через
n и приравнять её к
истинной.
3. Решить уравнение с одним
неизвестным, найти число n.
Задача № 1.
Пары одного из монобромалканов в 68,5
раз тяжелее водорода. Найти формулу
монобромалкана.
Дано:
D
H2
= 68,5 Решение:
1. Общая формула
монобромалканов – CnH2n+1Br;
М.Ф. = ? 2. Найдём истинную молярную
массу:
M = DH2
∙ 2 = 68,5 ∙ 2 = 137 (г/моль);
3. Выразим М через n:
M(CnH2n
+ 1Br) = 12n + 2n + 1 + 80 = 14n
+ 81
Приравняем: 14n
+ 81 = 137
14n
= 56
n
= 4
Ответ: С4H9Br.
Задача № 2.
Плотность газообразного алкина равна
2,41 г/л. Найти его молекулярную формулу.
Ответ: С7Н12.
Задача № 3.
Относительная плотность паров альдегида
по воздуху равна 1,517. Найти его молекулярную
формулу.
Ответ: СН3СОН.
Задача № 4.
Относительная плотность паров первичного
амина по кислороду – 2,719.
Определить его молекулярную формулу.
Ответ: C5H11NH2.
Задача № 5.
Найти молекулярную формулу алкина,
если 5,6 л его имеют массу 10 г.
Ответ: С3Н4.
3. Вывод формул по уравнениям
реакций в общем виде, если известны
данные для двух веществ.
Порядок решения:
-
Составить уравнение реакции в общем
виде. -
Выразить молярные массы неизвестных
веществ через число n. -
Найти количества двух веществ по
формулам:
= m /M
= V
/ Vm
4. Составить уравнение, приравняв
найденные количества веществ с
учётом соотношения числа моль этих
веществ по уравнению (определяют по
коэффициентам).
5. Решить уравнение с одним
неизвестным, найти число n
и записать формулу.
Задача № 1.
При взаимодействии предельного
одноатомного спирта массой 3 г с избытком
натрия было получено 0,56 л водорода.
Определить формулу спирта.
Дано:
m
спирта = 3г Решение:
V(H2)
= 0,56л 1. Напишем уравнение реакции
в общем виде:
2
CnH2n
+ 1 OH + 2Na
H2
+ 2CnH2nONa
М.Ф. = ?
2 моль 1
моль
2. Выразим
молярную массу спирта через число n:
M(CnH2n
+ 1OH) = 12n
+ 2n + 1 + 16 + 1 = 14n
+ 18(г/моль).
3. Найдём количества
веществ:
(СnH2n
+ 1OH) = m
/ M = 3г / 14n
+ 18г/моль =
= 3 / 14n
+ 18 моль
(Н2) = V
/ Vm
= 0,56л / 22,4г/моль =
0,025 моль.
4. Из уравнения
реакции видно, что
(СnH2n
+ 1OH) = 2 ∙ (H2)
5. Cоставим
уравнение: 3 / 14n
+ 18 = 2 ∙ 0,025
n = 3
Ответ: С3Н7ОН.
Задача № 2.
При сгорании 13,2г алкана образовалось
20,16л углекислого газа. Найти формулу
алкана.
Дано:
m
алкана = 13,2г Решение:
V(CO2)
= 20,16л 1. Напишем уравнение реакции
горения в общем виде:
CnH2n
+ 2 + (3n
+ 1 / 2)O2
nCO2
+ (n + 1)H2O
М.Ф. = ? 1 моль
n
моль
2. Выразим молярную
массу алкана через n:
M(CnH2n
+ 2) = 12n + 2n
+ 2 = 14n + 2г/моль
3. Найдём количества
веществ:
(CnH2n
+ 2) = m /M
= 13,2г / (14n +
2)г/моль =
= 13,2 / 14n
+ 2 моль
(CO2)
= V / Vm
= 20,16 / 22,4г/моль = 0,9 моль
4. Из уравнения
реакции видно, что:
n ∙
(CnH2n
+ 2) = (CO2)
5. Составим
уравнение: n ∙ 13,2 / 14n
+ 2 = 0,9
n = 3
Ответ: С3Н8.
Задача № 3.
При взаимодействии 2,9г неизвестного
альдегида с аммиачным раствором оксида
серебра получается 10,8г металла. Определить
формулу альдегида.
Ответ: С3Н6О.
Задача № 4.
В результате реакции предельного
одноатомного спирта с 18,25г хлороводорода
получили органический продукт массой
46,25г и воду. Определить молекулярную
формулу спирта.
Ответ: С4Н9ОН.
Задача № 5.
Для сжигания 5,8г алкана потребовалось
14,56л (н.у.) кислорода. Определить формулу
алкана.
Ответ: С4Н10.
Задача № 6.
К 10,5г алкена присоединяют 5,6л бромоводорода
(н.у.).
Найти формулу алкена.
Ответ: С3Н6.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
12.02.2015398.43 Кб285.pdf
- #
- #
- #
- #
- #
- #
- #
- #