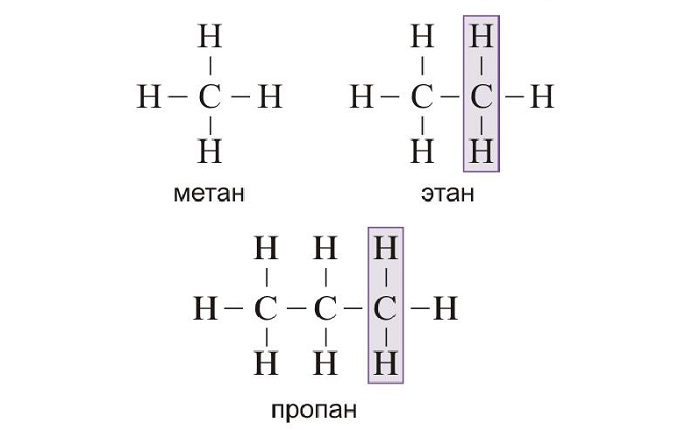
При изучении органической химии, отличающейся сложностью своих закономерностей, первое и основное, что следует понять — свойства и законы гомологических рядов.
Гомология, гомологи, гомологический ряд — определения и примеры
Гомология — химическое явление, при котором соединения отличаются друг от друга на определённое количество групп, обладают сходной характеристикой и проявляют похожие свойства.
Гомологический ряд — последовательность однотипных органических соединений, каждое из последующих имеет с предыдущим определённую гомологическую разность. При этом свойства веществ, состоящих в рядах, то есть гомологов, изменяются с определённой закономерностью.
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
-
этин — C2H2;
-
пропин — C3H4;
-
бутин — C4H6;
-
пентин — C5H8 и т. д.
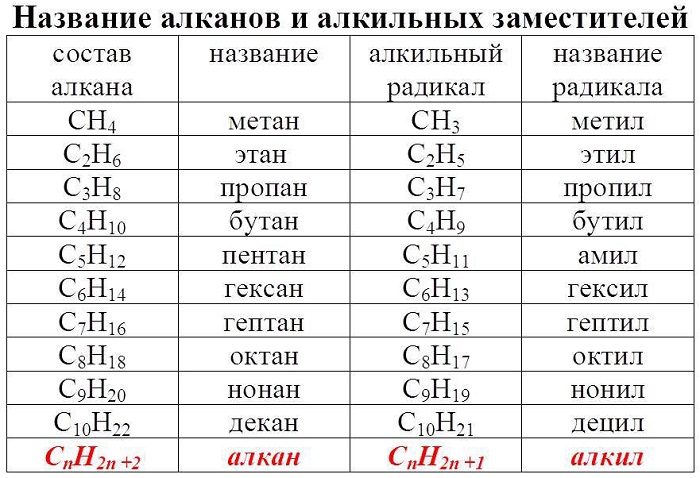
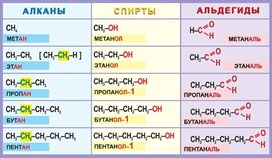
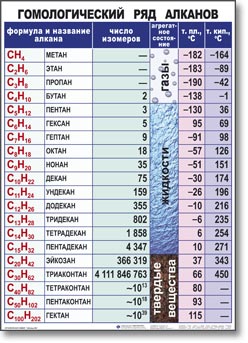
Гомологический ряд алканов в таблице
Алканы — ациклические предельные углеводороды:
-
всеобщая формула алканов — СnH2n+2;
-
названия веществ имеют суффикс -ан-.
Алканы обладают следующими свойствами:
-
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
-
нерастворимы в воде, но могут растворяться в неполярных растворителях;
-
используются в промышленности (метан — топливо, пропан — автомобильное топливо, бутан — сырье для производства каучука, пропан и бутан — балонные газы).
|
Метан |
СН4 |
|
Этан |
С2Н6 |
|
Пропан |
С3Н8 |
|
Бутан |
С4Н10 |
|
Пентан |
С5Н12 |
|
Гексан |
С6Н14 |
При изучении алканов стоит обращать внимание на их изомеры. Например, структурным изомером бутана является метилпропан, а пентана — метилбутан.
Алканы могут вступать в следующие реакции:
-
Горение в кислороде: СН4 + 2О2 = СО2 + 2Н2О.
-
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
-
Разложение при высокой температуре: СН4 = C + 2H2.
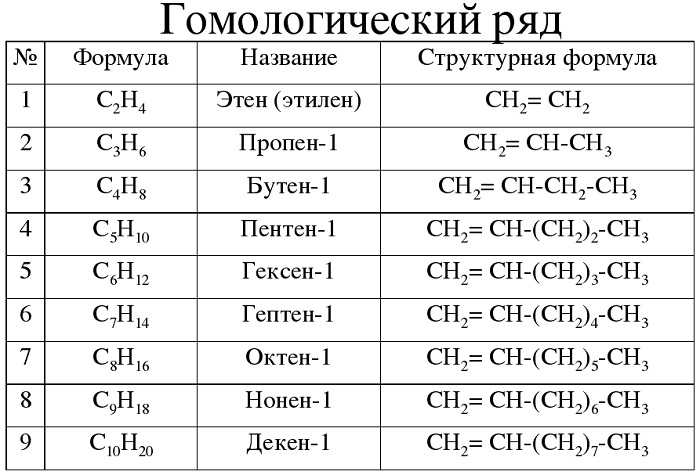
Гомологический ряд алкенов в таблице
Алкены — углеводороды, имеющие ациклический непредельный характер.
Краткая характеристика:
-
общая формула — CnH2n;
-
имеют суффикс -ен-.
Алкены обладают следующими свойствами:
-
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
-
имеют очень высокую температуру плавления и кипения;
-
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
|
Этилен |
C2H4 |
|
Пропен |
C3H6 |
|
Бутен |
C4H8 |
|
Пентен |
C5H10 |
|
Гексен |
C6H12 |
Алкены участвуют в следующих химических реакциях:
-
Горение в кислороде: C2H4 + 3O2 = 2CO2 + H2O.
-
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
-
Присоединение к водороду (гидрирование): CH2=CH-CH3 + H2 = CH3-CH2-CH3.
-
Гидратация (присоединение к воде): CH2=CH2 + H2O = CH3-CH2OH.
-
Полимеризация: nCH2=CH2 = (-CH2-CH2-) * n.
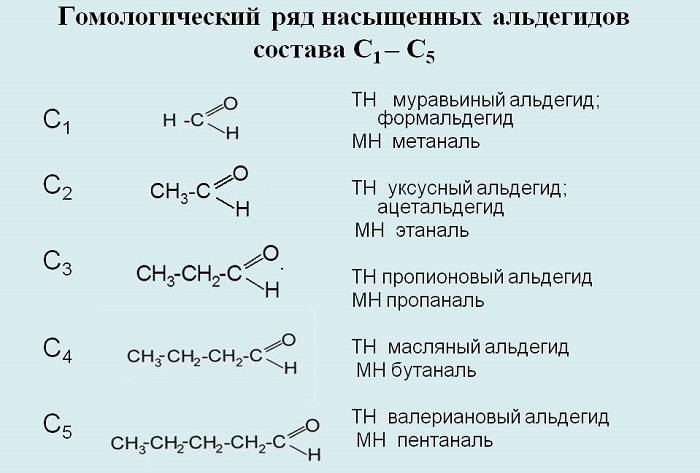
Гомологический ряд альдегидов
Альдегиды — органические вещества, имеющие в своём составе группу -CHO.
Делятся на насыщенные и алифатические насыщенные, общая молекулярная формула первых — СnH2nO, вторых — СnH2n+1CHO соответственно.
Названия составляются с помощью суффикса -аль-.
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
-
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
-
Присоединение спиртов: CH3-CH = O + C2H5OH = CH3-CH(OH)-O-C2H5.
-
Присоединение аминов: C6H5CH = O + H2NC6H5 = C6H5CH = NC6H5 + H2O.
-
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
-
низшие представители класса имеют резкий запах;
-
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
-
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.
Предельными (насыщенными) углеводородами называются углеводороды, в молекулах которых атомы углерода связаны между собой простой связью, причём все единицы валентности, не затраченные на связь между атомами углерода, насыщены атомами водорода.
Если рассматривать углеводороды ряда метана, то нетрудно заметить, что каждый последующий углеводород можно произвести от соответствующего предыдущего замещением одного атома водорода группой CH3 (метил). Таким образом, состав молекулы последующего углеводорода увеличивается на группу CH2.
Ряд химических соединений одного структурного типа, отличающихся друг от друга на одну или несколько структурных единиц (обычно на группу CH2), называется гомологическим рядом, а каждый из углеводов – членом гомологического ряда или гомологом. Если расположить гомологи в порядке возрастания их относительной молекулярной массы, они образуют гомологический ряд.
Группа CH2 называется гомологической разностью или гомологической разницей. Общая формула предельных углеводородов CnH2n + 2, где n – число атомов углерода в молекуле.
Если от молекулы углеводорода отнять атом водорода, то остаток молекулы с открытой связью называется углеводородным радикалом (обозначается буквой R). В свободном виде радикалы из-за большой реакционной способности не существуют.
Явление гомологии – существование рядов органических соединений, в которых формула любых двух соседей ряда отличается на одну и ту же группу (чаще всего CH2). Физико-химические свойства соединений изменяются по ходу гомологического ряда. В органической химии в основе понятие гомология основывается на фундаментальном положении о том, что химические и физические свойства соединения обусловлены структурой его молекул: эти свойства определяются и функциональными группами соединения, и его углеродным скелетом.
При отсутствии изомерии в случае подобия углеродных скелетов соединений формулу гомологичных соединений можно записать как X–(СН2)n–Y, соединения с различным числом n метиленовых звеньев являются гомологами и принадлежат к одному классу соединений. Итак, соединения-гомологи принадлежат к одному классу соединений, а свойства ближайших гомологов наиболее близки.
В гомологических рядах наблюдается определённая закономерное изменение свойств от младших членов ряда к старшим, но такая закономерность соблюдается не всегда, в некоторых случаях она может нарушаться. Чаще всего это происходит в начале ряда, потому что образуются водородные связи при наличии функциональных групп, способных к их образованию.
Примером гомологического ряда может служить ряд предельных углеводородов (алканов). Простейший его представитель – метан СН4. Гомологами метана являются: этан C2H6; пропан C3H8; бутан C4H10; пентан C5H12; гексан C6H14, гептан C7H16, октан – С8Н18, нонан – С9Н20, декан – С10Н22, ундекан – С11Н24, нодекан – С12Н26, тридекан – С13Н28, тетрадекан – С14Н30, пентадекан – С15Н32, эйкозан – С20Н42, пентакозан – С25Н52, триаконтан – С30Н62, тетраконтан – С40Н82, гектан – С100Н202.
Остались вопросы? Не знаете, что такое гомологический ряд?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© devblog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Остались вопросы?
Задайте свой вопрос и получите ответ от профессионального преподавателя.
Прежде чем анализировать, как составлять изомеры предельных углеводородов, выявим особенности данного класса органических веществ.
Насыщенные углеводороды
В органической химии выделяется множество классов CxHy. У каждого есть своя общая формула, гомологический ряд, качественные реакции, применение. Для насыщенных углеводородов класса алканов характерны одинарные (сигма) связи. Общая формула данного класса органических веществ CnH2n+2. Этим объясняются основные химические свойства: замещение, горение, окисление. Для парафинов не характерны присоединение, так как связи в молекулах этих углеводородов одинарные.
Изомерия
Такое явление, как изомерия объясняет многообразие органических веществ. Под изомерией принято понимать явление, при котором существует несколько органических соединений, имеющих одинаковый количественный состав (число атомов в молекуле), но различное расположение их в молекуле. Получаемые вещества называют изомерами. Они могут быть представителями нескольких классов углеводородов, а потому отличаются химическими свойствами. Разное соединение в молекуле алканов атомов С приводит к возникновению структурной изомерии. Как составлять изомеры алканов? Существует определенный алгоритм, согласно которому можно изобразить структурные изомеры данного класса органических веществ. Появляется подобная возможность только с четырех углеродных атомов, то есть, с молекулы бутана С4Н10.
Разновидности изомерии
Для того чтобы понять, как составлять формулы изомеров, важно иметь представление о ее видах. При наличии внутри молекулы одинаковых атомов в равном количестве, располагающихся в пространстве в разном порядке, идет речь о пространственной изомерии. Иначе ее называют стереоизомерией. В подобной ситуации применения одних только структурных формул будет явно недостаточно, потребуется использование специальных проекционных или пространственных формул. Предельные углеводороды, начиная с H3C–СН3 (этана), имеют различные пространственные конфигурации. Это обусловлено вращением внутри молекулы по связи С–С. Именно простая σ-связь создает конформационную (поворотную) изомерию.
Структурная изомерия парафинов
Поговорим о том, как составлять изомеры алканов. Класс имеет структурную изомерию, то есть, атом углерода образует разные цепи. Иначе возможность изменения положения в цепи атомов углерода называют изомерией углеродного скелета.
Изомеры гептана
Итак, как оставлять изомеры для вещества, имеющего состав C7H16? Для начала можно расположить все атомы углерода в одну длинную цепочку, добавить для каждого определенное число атомов С. Сколько? Учитывая, что валентность углерода равна четырем, у крайних атомов будет по три атома водорода, а у внутренних – по два. Полученная молекула имеет линейное строение, такой углеводород называют н – гептаном. Буква «н» подразумевает прямой углеродный скелет в данном углеводороде.
Теперь меняем расположение углеродных атомов, «укорачивая» при этом прямую углеродную цепочку в C7H16. Составить изомеры можно в развернутом либо сокращенном структурном виде. Рассмотрим второй вариант. Сначала один атом С расположим в виде радикала метил в разных положениях.
Данный изомер гептана имеет следующее химическое название: 2-метилгексан. Теперь «передвигаем» радикал к следующему углеродному атому. Полученный предельный углеводород называется: 3-метилгексан.
Если мы будем далее передвигать радикал, нумерация будет начинаться с правой стороны (ближе к началу располагается углеводородный радикал), то есть, мы получим такой изомер, который у нас уже есть. Поэтому думая над тем, как составлять формулы изомеров для исходного вещества, попробуем сделать скелет еще «короче».
Оставшиеся два углерода можно представить в виде двух свободных радикалов — метил.
Расположим сначала их у разных углеродов, входящих в главную цепь. Назовем полученный изомер -2,3 диметилпентан.
Теперь оставим один радикал на том же месте, а второй перенесем к следующему углеродному атому главной цепи. Данное вещество называется 2,4 диметилпентан.
Теперь расположим углеводородные радикалы у одного углеродного атома. Сначала у второго, получим 2,2 диметилпентан. Затем у третьего, получив 3,3 диметилпентан.
Теперь оставляем в основной цепи четыре атома углерода, оставшиеся три используем в качестве радикалов метил. Располагаем их следующим образом: два у второго атома С, один – у третьего углерода. Называем полученный изомер: 2,2, 3 триметилбутан.
На примере гептана мы разобрали, как правильно составлять изомеры для предельных углеводородов. На фото представлены примеры структурных изомеров для бутена6 его хлорпроизводных.
Алкены
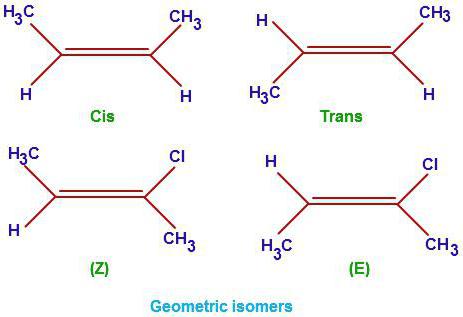
Данный класс органических веществ имеет общую формулу CnH2n. Помимо насыщенных связей С-С в данном классе есть также двойная связь. Именно она определяет основные свойства данного ряда. Поговорим о том, как оставлять изомеры алкенов. Попробуем выявить их отличия от предельных углеводородов. Помимо изомерии главной цепи (структурные формулы) для представителей данного класса органических углеводородов также характерны еще три разновидности изомеров: геометрические (цис- и трансформы), положения кратной связи, а также межклассовая изомерия (с циклоалканами).
Изомеры C6H12
Попробуем выяснить, как составить изомеры c6h12, учитывая тот факт, что вещество с данной формулой может принадлежать сразу к двум классам органических веществ: алкенам, циклоалканам.
Для начала подумаем, как составлять изомеры алкенов, если есть двойная связь в молекуле. Ставим прямую углеродную цепочку, поставим кратную связь после первого углеродного атома. Попробуем не только составить изомеры с6н12, но и назвать вещества. Данное вещество — гексен – 1. Цифрой указывается положение в молекуле двойной связи. При ее передвижении по углеродной цепочке, получаем гексен -2, а также гексен — 3
Теперь порассуждаем, как составлять изомеры для данной формулы, меняя количество атомов в главной цепи.
Для начала укоротим углеродный скелет на один углеродный атом, его будет рассматривать в качестве радикала метил. Двойную связь оставим после первого атома С. Полученный изомер по систематической номенклатуре будет иметь следующее название: 2 метилпентен – 1. Теперь передвигаем углеводородный радикал по главной цепи, оставив положение двойной связи неизменным. Данный непредельный углеводород разветвленного строения называют 3 метилпентен -1.
Возможен без изменения основной цепи и положения двойной связи еще один изомер: 4 метилпентен -1.
Для состава C6H12 можно попробовать переместить двойную связь из первого во второе положение, не преобразуя саму главную цепочку. Радикал при этом будет передвигать по углеродному скелету, начиная со второго атома С. Данный изомер имеет название 2 метилпентен-2. Кроме того, можно поместить радикал CH3 третьего атома углерода получив при этом 3 метилпентен-2
Если поместить радикал у четвертого углерода атома в данной цепи, образуется еще одно новое вещество непредельный углеводород с извилистым углеродным скелетом – 4 метилпентен-2.
При дальнейшем сокращении числа С в главной цепи, можно получить еще один изомер.
Двойную связь оставим после первого углеродного атома, а два радикала поставим к третьему атому С основной цепи, получаем 3,3 диметилутен-1.
Теперь поставим радикалы у соседних углеродных атомов, не меняя положения двойной связи, получим 2,3 диметилбутен-1. Попробуем, не меняя размер главной цепи, передвинуть двойную связь во второе положение. Радикалы при этом мы может поставить только у 2 и 3 атомов С, получив 2,3 диметилбутен-2.
Других структурных изомеров для данного алкена нет, любые попытки их придумать приведут к нарушению теории строения органических веществ А. М. Бутлерова.
Пространственные изомеры C6H12
Теперь выясним, как составлять изомеры и гомологи с точки зрения пространственной изомерии. Важно понимать, что цис- и трансформы алкенов возможны только для положения двойной связи 2 и 3.
При нахождении в одной плоскости углеводородных радикалов, образуется цис – измер гексена -2, а при расположении радикалов в разных плоскостях, транс-форма гексена – 2.
Межклассовые изомеры C6H12
Рассуждая над тем, как составлять изомеры и гомологи, нельзя забывать и о таком варианте, как межклассовая изомерия. Для непредельных углеводородов ряда этилена, имеющих общую формулу CnH2n, такими изомерами являются циклоалканы. Особенностью данного класса углеводородов является наличие циклической (замкнутой) структуры при насыщенных одинарных связях между атомами углерода. Можно составить формулы циклогексана, метилциклопентана, диметилциклобутана, триметилциклопропана.
Заключение
Органическая химия многогранна, загадочна. Количество органических веществ превышает в сотни раз число неорганических соединений. Данный факт легко объясняется существованием такого уникального явления, как изомерия. Если в одном гомологическом ряду располагаются сходные по свойствам и строению вещества, то при изменении положения атомов углерода в цепи, появляются новые соединения, названные изомерами. Только после появления теории химического строения органических веществ удалось классифицировать все углеводороды, понять специфику каждого класса. Одно из положений данной теории, непосредственно касается явления изомерии. Великий русский химик сумел понять, объяснить, доказать, что именно от расположения углеродных атомов зависят химические свойства вещества, его реакционаня активность, практическое применение. Если сравнивать количество изомеров, образуемых предельными алканами и непредельными алкенами, лидируют, безусловно, алкены. Объясняется это тем, что в их молекулах есть двойная связь. Именно она позволяет этому классу органических веществ образовывать не только алкены разного вида и строения, но и вести речь о меклассовой изомерии с циклоалканами.
Оглавление
Алгоритм 1. Составление названия
углеводородов по систематической номенклатуре
Алгоритм 2.
Составление изомеров и гомологов для органического вещества
Алгоритм 3.
Составление названия производных углеводородов по систематической номенклатуре
Алгоритм 4.
Составление названия аминов и аминокислот по систематической номенклатуре
Алгоритм 5.
Решение расчетных задач на вывод молекулярной формулы вещества по массовым
долям элементов
Алгоритм 6.
Вычисление массы вещества по известной массе другого вещества, участвующего в
реакции.
Алгоритм 7.
Решение задач на выход продукта реакции
Алгоритм
8
— Расчёты по термохимическим уравнениям (ТХУ)
Алгоритм 1. Составление названия
углеводородов по систематической номенклатуре
Задание
1. Назвать вещество
по систематической номенклатуре:
Решение
1. Выбрать
главную цепь (наиболее длинная цепь углеродных атомов):
2. Пронумеровать
атомы углерода в главной цепи с того конца, к которому ближе стоит
заместитель (углеводородный радикал – ответвление главной цепи):
Если присутствуют кратные связи (С=С, С=С), то нумерация
цепи начинается с того края, к которому ближе кратная связь.
3. Последовательно
назвать:
1) номер
углеродного атома, с которым связан радикал (ответвление)
2) назвать
сам радикал (СН3 – метил, С2Н5 – этил);
Если
радикалов несколько, то перечисляем цифры, в случае одинаковых радикалов,
поставив перед названием радикала приставку -ди, -три и т.д.;
Если
радикалы разные, то называем сначала старший радикал (метил), а потом остальные
по старшинству.
3) углеводород,
которому соответствует длинная цепь: (см. гомологический ряд алканов –
приложение 1)
Если
есть кратные связи, то меняем суффикс –ан, на -ен (в случае двойной связи),
на ин (в случае тройной связи), на –диен (в случае двух двойных связей)
4. В
нашем примере получаем название, которое записываем в одну строчку:
2-метилбутан
Алгоритм 2. Составление изомеров и
гомологов для органического вещества
Алгоритм 2.1. Составление формул
изомеров
Задание. Составить формулы изомеров пентана С5Н12.
Решение
1.
Записать углеродные скелеты изомеров, уменьшая число атомов углерода в
основной цепи, таким образом разветвляя углеродную цепь:
2.
Расставить атомы водорода и представить структурные формулы в сокращенном
виде:
Алгоритм 2.2. Составление формул
гомологов
Задание. Составить формулы двух гомологов для вещества, имеющего
строение:
Решение
1.
Составляя формулы гомологов, увеличиваем или уменьшаем число групп СН2 в
основной цепи, сохраняя строение (разветвление).
Приведены
два низших гомолога:
Алгоритм 3. Составление названия производных
углеводородов по систематической номенклатуре
Задание
1. Назвать вещество
по систематической номенклатуре:
СН3
– СН – СН2 – СН2 – ОН
СН3
Решение
1. Выбрать
главную цепь (наиболее длинная цепь углеродных атомов):
СН3
– СН – СН2 – СН2 – ОН
СН3
2. Пронумеровать
атомы углерода в главной цепи с того конца, к которому ближе стоит функциональная
группа (названия функциональных групп – смотри в приложении 2):
С4Н3
– С3Н – С2Н2 – С1Н2
– ОН
СН3
3. Последовательно
назвать:
1) номер
углеродного атома, с которым связан радикал (ответвление)
2) назвать
сам радикал (СН3 – метил, С2Н5 – этил);
Для
спиртов принято устанавливать цифрой после суффикса функциональной группы –
номер атома углерода, при котором расположена функциональная группа.
Если
радикалов несколько, то перечисляем цифры, в случае одинаковых радикалов,
поставив перед названием радикала приставку -ди, -три и т.д.;
Если
радикалы разные, то называем сначала старший радикал (метил), а потом
остальные по старшинству.
3) углеводород,
которому соответствует длинная цепь: (см. гомологический ряд алканов –
приложение 1)
4. В
нашем примере получаем название, которое записываем в одну строчку:
3-метилбутанол-1
Алгоритм 4. Составление названия аминов
и аминокислот по систематической номенклатуре
Задание
1. Назвать вещество
по систематической номенклатуре:
СН3 – СН – СН – СН2 – СООН
СН3 NH3
Решение
1. Выбрать
главную цепь (наиболее длинная цепь углеродных атомов):
СН3 – СН – СН – СН2 – СООН
СН3 NH3
2. Пронумеровать
атомы углерода в главной цепи с того конца, к которому ближе стоит функциональная
группа (если амин – то ориентируемся на аминогруппу, если кислота, то на
карбоксильную группу):
С5Н3 – С4Н – С3Н2
– С2Н2 – С1ООН
СН3 NH3
3. Последовательно
назвать:
1) номер
углеродного атома, с которым связан радикал (ответвление)
2) назвать
сам радикал (СН3 – метил, С2Н5 – этил);
Для
спиртов принято устанавливать цифрой после суффикса функциональной группы –
номер атома углерода, при котором расположена функциональная группа.
Если
радикалов несколько, то перечисляем цифры, в случае одинаковых радикалов,
поставив перед названием радикала приставку -ди, -три и т.д.;
Если
радикалы разные, то называем сначала старший радикал (метил), а потом
остальные по старшинству.
3) углеводород,
которому соответствует длинная цепь: (см. гомологический ряд алканов –
приложение 1)
Если
2 карбоксильные группы, то указать суффикс – ди (диовая кислота), если 2
аминогруппы, то указать цифры аминогруппы и приставку – ди (2,3-диамин-).
4. В
нашем примере получаем название, которое записываем в одну строчку:
3-амино,3-метилпентановая
кислота
Алгоритм 5. Решение расчетных задач на
вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества,
содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества
по азоту равна 1,57.
Решение
1. Записать условие
задачи.
2. Вычислить
относительную молекулярную массу Mr(CхHy)
по относительной плотности:
1.
3. Найти индексы х и y по
отношению :
2.
4. Записать простейшую
формулу: С3Н8.
Проверка: Мr(C3H8)
= 44, следовательно, C3H8 – истинная формула.
Задача
2. При сжигании 5,6
л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.)
углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна
1,875 г. Найти его молекулярную формулу.
Решение
1.
Записать условие задачи.
2.
Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m =
42 г, M = 42 г/моль.
3.
Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4.
Найти количества веществ воды и водорода:
(H2O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5.
Найти сумму масс углерода и водорода:
m(C)
+ m(H) = 0,75•12 +1,5•1 = 10,5 г.
6.
Найти массу сожженного вещества:
Следовательно,
вещество содержит только углерод и водород.
7.
Найти простейшую формулу углеводорода CхHy:
(C) :
(H)
= 0,75 : 1,5 = 1 : 2,
следовательно,
простейшая формула – СН2.
8.
Найти истинную формулу углеводорода:
Mr(CH2)
= 14,
Mr(в—ва) : Mr(CH2)
= 42 : 14 = 3,
следовательно,
истинная формула – С3Н6.
Алгоритм 6. Вычисление массы вещества
по известной массе другого вещества, участвующего в реакции.
Пример. Вычислите
массу оксида меди (I), если
в реакцию с кислородом вступает медь массой 19,2г.
|
Последовательность выполнения действий |
Оформление задачи |
|
1. |
Дано: m(Cu)=19,2г Найти: m(Cu2O)=? |
|
2. |
4 Cu + O2 = 2 Cu2O |
|
3. |
М(Cu)=64г/моль М |
|
4. дана |
|
|
5. |
|
|
6. составим |
|
|
7. Посчитаем массу искомого вещества по формуле. Запишем ответ |
m(Cu2O)= 0,15 моль * 144гмоль = 21,6 г Ответ: |
Алгоритм 7. Решение задач на выход
продукта реакции
Алгоритмы решения
задач трёх типов на выход продукта реакции:
А. Определение
выхода продукта в % от теоретически возможного.
1. Запишите уравнение
химической реакции и расставьте коэффициенты.
2. Под формулами
веществ напишите количество вещества согласно коэффициентам.
3. Практически
полученная масса известна.
4. Определите
теоретическую массу.
5. Определите выход
продукта реакции (%), отнеся практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Б. Расчет массы
продукта реакции, если известен выход продукта.
1. Запишите “дано” и
“найти”, запишите уравнение, расставьте коэффициенты.
2. Найдите
теоретическое количество вещества для исходных веществ. n =
3. Найдите
теоретическое количество вещества продукта реакции, согласно коэффициентам.
4. Вычислите
теоретические массу или объем продукта реакции.
m = M * n
или V = Vm * n
5. Вычислите
практические массу или объем продукта реакции (умножьте массу теоретическую или
объем теоретический на долю выхода).
В. Расчет массы
исходного вещества, если известны масса продукта реакции и выход продукта.
1. По известному
практическому объёму или массе, найдите теоретический объём или массу
(используя долю выхода продукта).
2. Найдите
теоретическое количество вещества для продукта.
3. Найдите
теоретическое количество вещества для исходного вещества, согласно
коэффициентам.
4. С помощью теоретического
количества вещества найдите массу или объем исходных веществ в реакции.
Алгоритм 8 — Расчёты по термохимическим уравнениям (ТХУ)
Задача 3.
При сжигании
магния массой 3г выделяется 75,15кДж теплоты. Составьте термохимическое
уравнение реакции горения магния.
Алгоритм
решения
1. Составим
химическое уравнение реакции горения магния:
2Mg + O2 =
2MgO
2. Вычислим
количество вещества магния:
3. Над
формулами веществ надпишем ν(Mg) и 75,15 кДж, а
под формулой – соотношение, отображаемое уравнением реакции
4. Решая
пропорцию, находим тепловой эффект (Q = х)
реакции:
Ответ:
термохимическое уравнение имеет вид: 2Mg + O2 =
2MgO +
1202,4кДж
Для начала я хотел бы уточнить, правильно ли Вы всё написали формулу (правый конец) в задании 1. Дело в том, что если это у Вас формула гексанола (спирта- пентанола) то должно быть написано: CH3-CH2-CH2-CH2-CH2-OH, а если это формула гексаналя (альдегида), то должно быть написано CH3-CH2-CH2-CH2-CH2-CHO. Формулы альдегидов спишутся с окончанием (-CHO), а не (-COH). По крайней мере когда учился я, было принято писать именно так. Но, возможно, что сейчас принято писать так, как Вы написали. Спорить не буду.
Далее, в задании 2 Вы видимо, пытались написать формулу какого-то из изомеров пентанола (пентанола-2 или пентанола-3). Но в этом случае, у того атома углерода, к которому Вы хотели присоединить гидроксильную группу, нужно было убрать один из атомов водорода. А так у Вас получилось, в одной строке написана формула пентана, а в следующей просто свободно болтающаяся группировка ОН.
Поскольку этот редактор не позволяет правильно отобразить структурные формулы, следует поступать так, писать и группу ОН в той же строке, но взять её в скобки, т.е. написать так: CH2-CH2-CH(ОН)-CH2-CH3 или CH2-CH(ОН)-CH2-CH2-CH3.
Теперь по существу вопроса. Гомологи, это вещества, формулы которых отличаются на несколько групп СН2, и изомеры — вещества с той же общей (брутто-) формулой, но различающиеся строением.
Следуя этому определению, берем формулу данного Вам соединения,т.е.
1) CH3-CH2-CH2-CH2-CH2-COH и «убираем» из них по одной группе СН2, получаем 5 гомологов:
CH3-CH2-CH2-CH2-COH; CH3-CH2-CH2-COH; CH3-CH2-COH; CH3-COH; Н-COH.
Можно и наоборот, добавлять группы СН2:
CH3-CH2-CH2-CH2-CH2-CH2-COH; CH3-CH2-CH2-CH2-CH2-CH2-CH2-COH и так далее, пока не надоест.
А для написания формул изомеров проще всего где-нибудь в формуле «вырезать» группу СН2 и вставить её в какую-нибудь С-Н связь в другом месте: например вот так:
CH3-CH2-CH2-CH(CH3)-COH; CH3-CH2-CH(CH3)-CH2-COH; CH3-CH(CH3)-CH2-CH2-COH.
2) CH2-CH(ОН)-CH2-CH2-CH3 или CH2-CH2-CH(ОН)-CH2-CH3. По сути, я уже написал Вам два изомера, различающиеся положением гидроксильной группы.
Вот ещё один: 2) CH2-CH2-CH2-CH2-CH2-ОН.
Можно наделать и изомеров по приведённой в задании 1 схеме, т.е. «вырезать группу СН2 и вставить её в другом месте. Ну с гомологами, я думаю, справитесь.
3) CH3-CH=CH-CH=CH-CH3
С гомологами в этом задании вместо СН3 написать Н, или наоборот, добавить где-нибудь группы СН2.
С изомерами чуть сложнее.
Для этого соединения возможны:
изомеры положения двойной связи, т.е. CH2=CH-CH2-CH=CH-CH3;
структурные изомеры CH3-C(СН3)=CH-CH=CH2; CH3-CH=C(СН3)-CH=CH2; CH3-CH=CH-C(СН3)=CH2, а также цис-транс-изомеры.
Если попытаться изобразить формулу более похожей на реальную, CH3-CH=CH-CH=CH-CH3, то фрагмент двойной связи должен быть изображен примерно так: >С=С<, т.е. в строчку только
сам фрагмент >С=С< (правда их здесь два, но это не имеет принципиального значения). А те заместители, которые присоединены к этому фрагменту, должны изображаться на концах «чёрточек», т.е. чуть выше или чуть ниже основной строки. Тогда получатся цис- транс- изомеры ) с расположением фрагментов, отличных от атомов водорода (а можно считать и по атомам водорода) по разные стороны от основной линии, или оба вверх (оба вниз), или один вверх, а другой вниз. Но увы, изобразить в этом редакторе невозможно,хотя Вы легко начертите ручкой на листе бумаги.