Как научиться писать формулу карбоната
При выполнении заданий по химии, которые включают в себя тестирование, решение расчетных задач, практическую работу или лабораторный опыт могут понадобиться умения и навыки при написании формул солей. Таблица растворимости, в которой указаны значения зарядов ионов металлов и кислотных остатков, а также знание принципа ее использования поможет верно написать формулы и других веществ.

Вам понадобится
- — таблица растворимости солей, кислот, оснований
Инструкция
Карбонаты – это соли, состоящие из атомов металла и кислотного остатка, который имеет один атом углерода и три атома кислорода — СO3. Соли могут быть как средними — карбонаты, так и кислыми — гидрокарбонаты. Чтобы правильно написать формулу, необходимо воспользоваться таблицей растворимости кислот, солей и оснований, являющейся справочным материалом на всех видах контроля, включая даже ЕГЭ по химии.
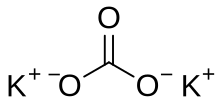
Карбонат-ион имеет заряд 2-. Чтобы формула соли была написана правильно, найдите, какой заряд имеет металл, который входит в состав карбоната. В любом случае, суммарное число положительных зарядов ионов должно равняться суммарному числу отрицательных. При этом необходимо обязательно учитывать индексы, стоящие внизу справа от химического символа. Значение заряда иона и индекса, стоящего у этого же иона, перемножаются.
Пример № 1. Напишите формулу карбоната калия.
В таблице растворимости посмотрите на кислотный остаток и на металл, входящий в состав соли. Кислотный остаток — СO3 имеет заряд 2-, а ион калия имеет заряд + (считается +1, но единица не пишется).
Напишите формулу, учитывая, что металл всегда стоит на первом месте: КСO3.
Если сравнить количество зарядов, то отрицательных получилось два (2-), а положительных только один (+). Значит, в формуле должно быть 2 атома калия, которые дадут два положительных заряда (2+), так как значение заряда и индекса перемножается. Следовательно, и молекула будет электронейтральна: К2СO3. Полученная соль называется карбонат калия.
Пример № 2. Напишите формулу карбоната кальция.
Кислотный остаток тот же, то есть — СO3 с зарядом (2-). В таблице растворимости найдите металл кальций и его заряд, который равен 2+ . Напишите формулу, имеющую вид: СаСO3. В итоге получилось одинаковое количество отрицательных (2-) и положительных 2(+) зарядов. Следовательно, формула написана правильно, так как в целом она электронейтральна. Полученная соль называется карбонат кальция, она знакома как мел или известняк.
Пример № 3. Напишите формулу гидрокарбоната калия.
Гидрокарбонат-иона в таблице растворимости нет, а потому следует запомнить, что он имеет вид — НСO3 и у него заряд, равный (-). Ион калия имеет противоположный заряд (+), поэтому формула будет выглядеть таким образом:
КНСO3.
Полученное соединение называется гидрокарбонат калия, которое представляет собой кислую соль.
Видео по теме
Источники:
- карбонат кальция формула
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Физические свойства
Карбонат калия K2CO3 — соль щелочного металла калия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается. Очень хорошо растворяется в воде.
Относительная молекулярная масса Mr = 138,20; относительная плотность для тв. и ж. состояния d = 2,428; tпл = 891º C;
Способ получения
1. Карбонат калия можно получить путем взаимодействия при комнатной температуре пероксида калия и влажного углекислого газа. В результате реакции образуется карбонат калия и кислород:
4KO2 + 2CO2 = 2K2CO3 + 3O2
2. В результате взаимодействия пероксида калия и угарного газа при 50º С образуется карбонат калия и кислород:
2KO2 + CO = K2CO3 + O2
3. При взаимодействии концентрированного гидроксида калия и углекислого газа образуется карбонат калия и вода:
2KOH + СO2 = K2СO3 + H2O
4. Взаимодействуя с углеродом (графитом) при 30º С надпероксид калия карбонат калия и углекислый газ:
4KO2 + 3C = 2K2CO3 + CO2
5. Разлагаясь при температуре 100 — 400 ºС гидрокарбонат калия образует карбонат калия, углекислый газ и воду:
2KHCO3 = K2CO3 + CO2 + H2O
6. В результате реакции между гидрокарбонатом калия и гидроксидом калия образуется карбонат калия и вода:
KHCO3 + KOH = K2CO3 + H2O
Качественная реакция
Качественная реакция на карбонат калия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат калия образует хлорид калия, углекислый газ и воду:
K2CO3 + 2HCl = 2KCl + CO2↑ + H2O
2. Взаимодействуя с серной кислотой, карбонат калия образует углекислый газ и воду, а также сульфат калия:
K2CO3 + H2SO4 = 2K2SO4 + CO2↑ +H2O.
Химические свойства
1. Карбонат калия может реагировать с простыми веществами:
С хлором, бромом и йодом концентрированный и горячий раствор карбоната калия реагирует с образованием хлорида, бромида или йодида калия, хлората, бромата или йодата калия и углекислого газа:
K2CO3 + 3Cl2 = 5KCl + KClO3 + 3CO2↑
K2CO3 + 3Br2 = 5KBr + KBrO3 + 3CO2↑
K2CO3 + 3I2 = 5KI + KIO3 + 3CO2↑
2. Карбонат калия вступает в реакцию со многими сложными веществами:
2.1. Насыщенный карбонат калия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната калия:
K2CO3 + H2O + CO2 ↔ 2KHCO3↓
2.2. Карбонат калия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида калия и осадка карбоната кальция:
K2CO3 + Ca(OH)2 = 2KOH + CaCO3↓
2.3. Карбонат калия способен реагировать с кислотами:
2.3.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат калия образует хлорид калия, углекислый газ и воду:
K2CO3 + 2HCl = 2KCl + CO2↑ +H2O
2.3.2. В результате реакции между насыщенным карбонатом калия и концентрированной и холодной хлорной кислотой образуется осадок хлорат калия, вода и газ углекислый газ:
K2CO3 + 2HClO4 = 2KClO4↓ + H2O + CO2↑
2.3.3. Взаимодействуя с разбавленной фосфорной кислотой концентрированный раствор карбоната калия образует фосфат калия, воду и углекислый газ:
3K2CO3 + 2H3PO4 = 2K3PO4 + 3H2O + 3CO2↑
2.3.4. Карбонат калия взаимодействует с плавиковой кислотой. В результате реакции образуется фторид калия, вода и углекислый газ, если кислота разбавленная:
K2CO3 + 2HF = 2KF + H2O + CO2↑,
а если кислота концентрированная, то образуется гидрофторид калия, вода и углекислый газ:
K2CO3 + 4HF = 2K(HF2) + H2O + CO2↑
2.5. Концентрированный раствор карбоната калия взаимодействует с оксидом серы. При этом образуются карбонат калия и углекислый газ:
K2CO3 + SO2 = K2SO3 + CO2↑.
From Wikipedia, the free encyclopedia
|
|
|
|

|
|
| Names | |
|---|---|
| IUPAC name
Potassium carbonate |
|
| Other names
Carbonate of potash, dipotassium carbonate, sub-carbonate of potash, pearl ash, potash, salt of tartar, salt of wormwood. |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.008.665 |
| E number | E501(i) (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K 2CO 3 |
| Molar mass | 138.205 g/mol |
| Appearance | White, hygroscopic solid |
| Density | 2.43 g/cm3 |
| Melting point | 891 °C (1,636 °F; 1,164 K) |
| Boiling point | Decomposes |
|
Solubility in water |
110.3 g/100 mL (20 °C) 149.2 g/100 mL (100 °C) |
| Solubility |
|
| Acidity (pKa) | 10.25 |
|
Magnetic susceptibility (χ) |
−59.0·10−6 cm3/mol |
| Thermochemistry[1] | |
|
Heat capacity (C) |
114.4 J·mol−1·K−1 |
|
Std molar |
155.5 J·mol−1·K−1 |
|
Std enthalpy of |
−1151.0 kJ·mol−1 |
|
Gibbs free energy (ΔfG⦵) |
−1063.5 kJ·mol−1 |
|
Enthalpy of fusion (ΔfH⦵fus) |
27.6 kJ·mol−1 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H302, H315, H319, H335 |
|
Precautionary statements |
P261, P305+P351+P338 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1870 mg/kg (oral, rat)[2] |
| Safety data sheet (SDS) | ICSC 1588 |
| Related compounds | |
|
Other anions |
Potassium bicarbonate |
|
Other cations |
Lithium carbonate Sodium carbonate Rubidium carbonate Caesium carbonate |
|
Related compounds |
Ammonium carbonate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium carbonate is the inorganic compound with the formula K2CO3. It is a white salt, which is soluble in water and forms a strongly alkaline solution. It is deliquescent, often appearing as a damp or wet solid. Potassium carbonate is mainly used in the production of soap and glass.[3]
History[edit]
Potassium carbonate is the primary component of potash and the more refined pearl ash or salts of tartar. Historically, pearl ash was created by baking potash in a kiln to remove impurities. The fine, white powder remaining was the pearl ash. The first patent issued by the US Patent Office was awarded to Samuel Hopkins in 1790 for an improved method of making potash and pearl ash.
In late 18th-century North America, before the development of baking powder, pearl ash was used as a leavening agent for quick breads.[4][5]
Production[edit]
Potassium carbonate is prepared commercially by the reaction of potassium hydroxide with carbon dioxide:[3]
- 2 KOH + CO2 → K2CO3 + H2O
From the solution crystallizes the sesquihydrate K2CO3·3⁄2H2O («potash hydrate»). Heating this solid above 200 °C (392 °F) gives the anhydrous salt. In an alternative method, potassium chloride is treated with carbon dioxide in the presence of an organic amine to give potassium bicarbonate, which is then calcined:
- 2 KHCO3 → K2CO3 + H2O + CO2
Applications[edit]
- (historically) for soap, glass, and dishware production
- as a mild drying agent where other drying agents, such as calcium chloride and magnesium sulfate, may be incompatible. It is not suitable for acidic compounds, but can be useful for drying an organic phase if one has a small amount of acidic impurity. It may also be used to dry some ketones, alcohols, and amines prior to distillation.[6]
- in cuisine, where it has many traditional uses. It is used in some types of Chinese noodles and mooncakes, as well as Asian grass jelly and Japanese ramen. German gingerbread recipes often use potassium carbonate as a baking agent, although in combination with hartshorn.
- in the alkalization of cocoa powder to produce Dutch process chocolate by balancing the pH (i.e., reduce the acidity) of natural cocoa beans; it also enhances aroma. The process of adding potassium carbonate to cocoa powder is usually called «Dutching» (and the products referred to as Dutch-processed cocoa powder), as the process was first developed in 1828 by Dutchman Coenraad Johannes van Houten.
- as a buffering agent in the production of mead or wine.
- in antique documents, it is reported to have been used to soften hard water.[7]
- as a fire suppressant in extinguishing deep-fat fryers and various other B class-related fires.
- in condensed aerosol fire suppression, although as the byproduct of potassium nitrate.
- as an ingredient in welding fluxes, and in the flux coating on arc-welding rods.
- as an animal feed ingredient to satisfy the potassium requirements of farmed animals such as broiler breeder chickens.
- as an acidity regulator in Swedish snus snuff tobacco
References[edit]
- ^ CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: others (link) - ^ Chambers, Michael. «ChemIDplus — 584-08-7 — BWHMMNNQKKPAPP-UHFFFAOYSA-L — Potassium carbonate [USP] — Similar structures search, synonyms, formulas, resource links, and other chemical information». chem.sis.nlm.nih.gov. Archived from the original on 2014-08-12.
- ^ a b H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). «Potassium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 3527306730.
{{cite encyclopedia}}: CS1 maint: uses authors parameter (link) - ^ See references to «pearl ash» in «American Cookery» by Amelia Simmons, printed by Hudson & Goodwin, Hartford, 1796.
- ^ Civitello, Linda (2017). Baking powder wars : the cutthroat food fight that revolutionized cooking. Urbana, Illinois: University of Illinois Press. pp. 18–22. ISBN 9780252041082.
- ^ Leonard, J.; Lygo, B.; Procter, G. «Advanced Practical Organic Chemistry» 1998, Stanley Thomas Publishers Ltd
- ^ Child, Lydia M. «The American Frugal Housewife» 1832
Bibliography[edit]
- A Dictionary of Science, Oxford University Press, New York, 2004
- Yu. Platonov, Andrew; Evdokimov, Andrey; Kurzin, Alexander; D. Maiyorova, Helen (29 June 2002). «Solubility of Potassium Carbonate and Potassium Hydrocarbonate in Methanol». Journal of Chemical & Engineering Data. 47 (5): 1175–1176. doi:10.1021/je020012v.
External links[edit]
- International Chemical Safety Card 1588
Карбонат калия – это достаточно известная в современной промышленности пищевая добавка, которую указывают в составе продуктов питания под индексом Е501. Внешне она представляет собой порошок из мелких кристаллов белого цвета, напоминающий поваренную соль.
Для обозначения карбоната калия, как правило, используют более короткое слово поташ. Вещество великолепно растворяется в обычной воде, обладает низкой токсичностью, что позволяет не бояться его присутствия в составе продуктов питания. Поташ относится к III классу опасности: то есть, к умеренно опасным соединениям, летальная доза которых варьируется от 150 до 50 тыс.мг на 1 килограмм веса.
Карбонат калия – это не что-то новое в мире пищевых технологий: его используют не сотни и даже не десятки лет. Однако, современный поташ отличается от того, который использовали люди в древности – он обладал длинным перечнем примесей, поэтому был не чисто белого, а бурого цвета. Вплоть до начала 20 столетия карбонат калия играл очень важную роль в химической промышленности и использовался в качестве реагента во многих процессах. Производили его тогда на основе растительной золы, которую впоследствии очищали до требуемого для той или иной цели уровня. Самые крупные производства располагались в лесистой местности: преимущественно, в России, Северной Америке и некоторых европейских странах.
В России производство карбоната калия началось во время правительства Петра I: наладить его экспорт он не пытался, а напротив под страхом смертной казни запретил продавать поташ за границу. Из соображений сохранения леса поташ производили из старых бочек и опавших ветвей.
Содержание
- Что такое карбонат калия: его особенности
- Формула карбоната калия и его свойства
- Получение карбоната калия
- Интересно знать
- Реакции с карбонатом калия
- Допустимые нормы употребления карбоната калия
- Сферы применения карбоната калия
- Животноводство
- Пищевая промышленность
- Медицина
- Сельское хозяйство
- Строительство
- Карбонат калия в различных сферах
- Воздействие карбоната калия на организм человека
- Полезные свойства карбоната калия и показания к его употреблению
- Вред карбоната калия и противопоказания к его употреблению
- Где можно приобрести карбонат калия и сколько он стоит
- Заключение
Что такое карбонат калия: его особенности
Карбонат калия, или другими словами поташ – это соль щелочного металла калия и угольной кислоты. Внешне пищевая добавка представляет собой белый порошок. Он обладает свойством плавиться при повышении температуры, не разлагаясь при этом. Поташ прекрасно растворяется и в холодной, и в теплой воде. А вот в спиртовой среде рассматриваемое вещество остается неизменным.
При растворении в воде поташ высвобождает тепло. Причем чем выше температура порошка, тем сильнее проявляются его щелочные свойства.
Поташ легко вступает в реакции с оксидом углерода серы, по завершению которой образуются кристаллогидраты. Данное взаимодействие возможно только в солевом растворе.
Формула карбоната калия и его свойства
Формула карбоната калия: K2CO3
Поташ – это кристаллическое однородное вещество белого цвета, его молярная масса – 138,2 г/моль. Плотность соединения составляет 2,44 г/см3, карбонат калия начинает плавиться при температуре выше 891 градуса.
Растворимость карбоната калия в воде
| Температура воды, ˚С | Растворимость, г/100 г воды |
| 0 | 107 |
| 10 | 109,2 |
| 20 | 111 |
| 25 | 112,3 |
| 30 | 113,7 |
| 40 | 116,9 |
| 60 | 125,7 |
| 80 | 139,2 |
| 100 | 155,8 |
| 200 | 274 |
Решетка карбоната калия
При нагревании вещества до 1200 градусов и выше оно разлагается на две составляющие – оксид калия и углекислый газ. Вещество прекрасно реагирует с кислотами-неокислителями, основаниями, углеродом (в условиях высокой температуры) и с оксидом серы.
Получение карбоната калия
Существует несколько способов получения карбоната калия. Среди них наибольшей популярностью пользуются следующие: смешивание пероксида калия с углекислым газом или угарным газом, соединение углерода с надпероксидом, разложение гидрокарбоната калия при температуре в диапазоне от 100 до 400 градусов, смешивание гидрокарбоната и гидроксида калия.
Рассмотрим все вышеперечисленные реакции подробнее:
Смешивание перекиси калия с влажным углекислым газом при температуре в диапазоне от 20 до 26 градусов. По завершению реакции образуется поташ и выделяется кислород:
4KO2+2CO2→2K2CO3+3O2
Смешивание пероксида калия с моноксидом углерода при температуре на отметке 50 градусов. В результате образуются два соединения – поташ и кислород:
4KO2+CO2→2K2CO3+O2
Смешивание высококонцентрированного гидроксида калия с моноксидом углерода. В итоге можно получить искомый карбонат калия и обычную воду:
2KOH+CO2→2K2CO3+H2O
Смешивание углерода с надпероксидом калия при температуре 30 градусов. По завершению реакции образуются поташ и моноксид углерода:
4KO2+3C→2K2CO3+CO2
Получить поташ можно и без смешиваний реактивов: достаточно разогреть гидрокарбонат калия до отметки в 100 и выше градусов и наблюдать за реакцией. В итоге вы получите карбонат калия, моноксид углерода и воду:
4KHCO3→2K2CO3+CO2+H2O
Соединение гидрокарбоната калия и его гидроксида с образованием карбоната калия и обычной воды:
4KHCO3+KOH→2K2CO3+H2O
Интересно знать
Жители древних Рима и Греции получали поташ из обычной золы. Полученное вещество они применяли для бытовых нужд, а именно – для стирки: карбонат калия прекрасно убирал с ткани жиры. В приготовлении пищи поташ не применяли.
На просторах Руси карбонат калия также получали на основе золы травянистых растений. Ее заливали родниковой водой, а затем выливали получившуюся смесь на костер. Пепелище упаривалось, а на дне со временем образовался толстый слой карбоната калия. Корку разбивали камнями.
В наши дни основными производителями карбоната калия считаются Китай, Германия, Франция и Корея.
Реакции с карбонатом калия
Взаимодействие с хлороводордной кислотой с образованием трех составляющих: хлорид калия, вода и моноксид углерода:
K2CO3+2HCL→2KCL+H2O+CO2↑
Взаимодействие с серной кислотой с образованием моноксида углерода, воды и сульфата натрия:
K2CO3+H2SO4→2KSO4+H2O+CO2↑
Вещество легко вступает в реакцию с простыми веществами, среди которых стоит отметить хлор, бром и йод:
K2CO3+3Cl2→5KCl+KClO3+3CO2↑
Поташ не ограничивается взаимодействиями с простыми металлами – он также реагирует со сложными соединениями, например, с водой и углекислым газом:
K2CO3+H2O+CO2→2KHCO3↓
С гидроксидом кальция:
K2CO3+Ca(OH)2→2KOH+CaCO3↓
Гидроксид калия реагирует с соединениями, принадлежащими к классу кислот, например, с хлороводородной кислотой:
K2CO3+2HCl→2KCl+H2O+CO2↑
С хлорной кислотой:
K2CO3+2HClO4→2KClO4+H2O+CO2↑
С фосфорной кислотой:
3K2CO3+2H3PO4→2KClО4+3H2O+3CO2↑
С плавиковой кислотой:
K2CO3+2HF→2KF+H2O+CO2↑
Карбонат калия, разведенный водой, взаимодействует с оксидом серы:
K2CO3+SO2→2K2CO3+CO2↑
Допустимые нормы употребления карбоната калия
Конкретных ограничений относительно употребления карбоната калия не существует, однако существуют определенные нормы, регулирующие использование пищевой добавки.
Несмотря на это, специалисты не рекомендуют употреблять более 50 мэкв карбоната калия в сутки.
При употреблении слишком большого количества карбоната калия может возникать мышечная слабость, помутнение сознания, тошнота и нарушения работы ЖКТ.
Сферы применения карбоната калия
Карбонат калия пользуется популярностью во многих отраслях. Так, без него трудно представить себе работу химической отрасли и предприятий по производству стекла, а также сельскохозяйственных предприятий, легкой промышленности, фотодела и других сфер.
Так, к числу процессов, в которых поташ принимает активное участие, относятся:
- производство жидкого мыла и бытовой химии;
- производство лакокрасочных средств;
- производство изделий из стекла;
- обработка кожи и изделий из нее;
- покраска различных поверхностей;
- изготовление проявителей, применяющихся для создания фотоснимков;
- изготовление калийсодержащих соединений;
- тщательная очистка газов;
- удаление паров влаги.
Благодаря своим свойствам поташ способен выступать в качестве стабилизатора, регулятора кислотности, разрыхлителя и осушителя. Данное вещество применяют также для получения однородной смеси из компонентов, которые в нормальных условиях не соединяются между собой: например, из воды, масла и жира.
Животноводство
Не меньшей популярностью поташ пользуется в сфере животноводства: его применяют для приготовления лекарственных препаратов – мазей, растворов и т.д.
Пищевая промышленность
В производстве продуктов питания добавку применяют в качестве эмульгатора, который добавляет хлебобулочным изделиям пышности: благодаря ему хлеб и булочки становятся более воздушными, приобретают пористую структуру. Встретить поташ можно также в составе алкогольных напитков, в древности добавку вводили в состав пряников. Из-за такого активного использования в производстве продуктов питания специалисты вели активные споры о том, насколько безопасен поташ для человека.
Медицина
В медицине карбонат калия необходим для усиления эффекта от употребления лекарственных препаратов, именно поэтому его часто вводят в состав мазей и кремов. Кроме того, поташ помогает избавиться от паразитов: он эффективен в избавлении от вшей и чесоточных клещей.
Сельское хозяйство
В сельскохозяйственной сфере карбонат калия применяют для удобрения почвы и повышения урожайности высаженных культур.
Наиболее часто карбонат калия применяют для обработки подзолистых почв.
Строительство
Поташ применяется и в сфере строительства. Он, в первую очередь, необходим для гидратации цемента, которая значительно замедляется при понижении температуры. Впрочем, добавление карбоната калия в состав строительного раствора имеет свои недостатки – работать с ним можно только при низкой температуре, как только начинает теплеть цемент теряет свои свойства.
Бетонные смеси. В состав которых входит поташ, наиболее часто применяют для устройства скользящей опалубки внутренних стен в зданиях средней этажности и многоэтажных постройках.
Впрочем, существуют определенные ограничения в использовании карбоната калия. Так, например, запрещено:
- вводить поташ в состав растворов с активным кремнеземом;
- добавлять рассматриваемое вещество в среду, где возможен контакт с известью или силикатным кирпичом;
- использовать карбонат калия в среде с повышенным показателем влажности;
- работать с растворами на основе поташа в условиях повышенных температур;
- использовать раствор с карбонатом калия в местах, где располагается скрытая электропроводка.
Карбонат калия в различных сферах
| Сфера применения | Применение карбоната калия |
| Животноводство | Приготовление лекарственных препаратов, действие которых направлено на борьбу с паразитами |
| Сельское хозяйство | Обработка почвы, защита растений от вредителей |
| Пищевая промышленность | Эмульгатор, стабилизатор. Можно встретить в составе алкогольных напитков и хлебобулочных изделий |
| Медицина | Усиление действия лекарственных препаратов, борьба с паразитами |
| Строительство | Приготовление строительных смесей для работы при пониженной температуре |
Воздействие карбоната калия на организм человека
Поташ важен для правильной работы многих систем организма. Более того, данное вещество содержится в организме человека и имеет свойство вымываться, дабы предотвратить дефицит поташа в организме, важно ввести его в свой рацион в достаточном количестве.
Вещество усваивается в стенках ЖКТ, а его излишек выводится вместе с продуктами жизнедеятельности.
Впрочем, злоупотреблять карбонатом калия не стоит: переизбыток добавки в организме может привести к развитию гиперкалиемии – состояния, при котором почки не способны вывести избыток калия из организма. Так что основной вред от неправильного употребления поташа испытывают почки.
В чистом виде употреблять поташ не стоит – он небезопасен, как и любая друга щелочь. При контакте с кожей вещество вызывает химический ожог, которому сопутствуют покраснения, раздражения и зуд. Дабы минимизировать негативные последствия необходимо промыть пораженный участок кожи.
Полезные свойства карбоната калия и показания к его употреблению
Калий крайне важен для правильной работы организма, а карбонат калия способен восполнять дефицит этого элемента. Рассматриваемое вещество необходимо для поддержания правильной работы пищеварительного тракта.
Так, поташ показан при:
- гипокалиемии, которой сопутствуют отклонения в работе ЖКТ, проявляющиеся рвотой, диареей, почечной недостаточностью;
- аритмии;
- гипокалиемической пароксизмальной миоплегии
Вред карбоната калия и противопоказания к его употреблению
При чрезмерном употреблении поташа возможно развитие гиперкалиемии – состоянии, при котором почки не способны вывести избыток карбоната калия из организма, вследствие чего начинают хуже работать.
Чистый карбонат калия небезопасен, поэтому употреблять его можно только в составе лекарственных препаратов.
Где можно приобрести карбонат калия и сколько он стоит
Для индивидуального использования рекомендуется отдавать предпочтение не чистому поташу, а специальным препаратам: Блемарену и Гевискону Форте, стоимость которых изменяется в диапазоне от 200 до 350 рублей.
Чистый карбонат калия можно приобрести в режиме онлайн, обойдется он вам примерно в 300 рублей за килограмм добавки.
Заключение
Карбонат калия – это вещество, широко применяемое в разных отраслях промышленности. Внешне оно представляет собой белый однородный порошок, состоящий из мелких гранул.
Наиболее широко поташ применяется в сфере производства пищи, сельском хозяйстве, животноводстве, фармакологии и строительстве. В производстве продуктов питания его используют в качестве стабилизатора и эмульгатора, встретить который можно в составе алкогольной продукции и хлебобулочных изделий. В составе его указывают под индексом Е501.
В фармакологии поташ необходим для усиления действия лекарственных препаратов, в частности тех, действие которых направлено на борьбу с паразитами. Данное соединение применяют также для обработки почвы: понижения ее кислотности, защиты растений от вредителей и повышения урожайности.
Использование поташа началось давно – вещество пользовалось большой популярностью еще во времена Киевской Руси: тогда вещество производили из золы и применяли в качестве порошка для удаления жирных пятен и в качестве удобрения.
Карбонат калия принадлежит к III классу опасности. Вещество важно для поддержания правильной работы желудочно-кишечного тракта, но злоупотреблять им не рекомендуется – избыток поташа в организме может привести к нарушению работы почек.
Читайте также:
- Сульфит натрия: описание, вред и польза, формула, получение, реакции
- Лактат кальция (Е327): свойства, инструкция по применению
- Альгинат натрия (Е401): свойства, инструкция по применению
- Гуаровая камедь (Е412): что это, вред и польза, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…
Карбонат калия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 ноября 2012;
проверки требуют 3 правки.
Перейти к: навигация, поиск
Запрос «Поташ» перенаправляется сюда; см. также другие значения.
| Карбонат калия | |
|---|---|

|
|
| Общие свойства | |
| Молекулярная формула | K2CO3 |
| SMILES | |
| Молярная масса | 138,205 г/моль |
| Внешний вид | Белый порошок |
| Номер CAS | 584-08-7 |
| Свойства | |
| Плотность и агрегатное состояние |
2290 кг/м³ |
| Растворимость в воде | 110,5г/100мл (при 20 °C) |
| Температура плавления | 891 °C (1163 K) |
| Опасность (в том числе токсическая) | |
| Температура вспышки |
|
| Температура самовоспламенения |
|
| Пределы взрываемости | |
| Класс опасности | |
| Родственные соединения | |
| Другие соединения | Бикарбонат калия Карбонат натрия Карбонат лития |
Карбонат калия (углекислый калий, пота́ш) K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде.
- Старое название соли — пота́ш, от лат. potassa, через нем. Pottasche, фр. potasse.
[править] История
Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но в основном в России и Северной Америке.
На производство поташа ещё Петр I в 1721 году установил монополию: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу»
[править] Получение
Его легко получить из щелочи при выщелачивании водой золы из злаков или водорослей, так как именно калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ). Как побочный продукт получается при переработке нефелинов. Сегодня карбонат калия получается путем электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия.
- 2KOH + CO2 → K2CO3 + H2O
[править] Применение
Поташ применяют для изготовления жидкого мыла, хрустального или тугоплавкого стекла, крашения, выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений), для фотодела, в качестве добавки в строительный раствор для уменьшения температуры замерзания (правда, потом могут выделяться белые пятна, поэтому сейчас появляются специальные противоморозные присадки, не дающие разводов).
Зарегистрирован в качестве пищевой добавки E501.
[править] См. также
- Калий
- Сульфит калия
- Соляной рыбный двор
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения калия |
|---|
|
Азид калия (KN3) • Амид калия (KNH2) • Ацесульфам (C4H4KNO4S) • Ацетат калия (CH3COOK) • Ацетиленид калия (K2C2) • Бензоат тригидрат калия (Брутто-формула:C7H11KO5) • Бромат калия (KBrO3) • Бромид калия (KBr) • Гексагидроксоплатинат(IV) калия (K2[Pt(OH)6]) • Гексагидроксостибат калия (K[Sb(OH)6]) • Гексанитрокобальтат(III) калия (K3[Co(NO3)6]) • Гексаоксибензол калия (C6(OK)6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторокупрат(III) калия (K3CuF6) • Гексафторомолибдат(III) калия (K3MoF6) • Гексафтороплатинат(V) калия (K[PtF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторфосфат калия (KPF6) • Гексахлоропалладат(IV) калия (K2[PdCl6]) • Гексахлороплатинат(IV) калия (K2[PtCl6]) • Гексахлоростаннат(IV) калия (K2[SnCl6]) • Гексахлорплатинат калия (K2PtCl6) • Гексацианоферрат(II) калия (K4[Fe(CN)6]) • Гексацианоферрат(II) тригидрат калия (K4[Fe(CN)6]•3H2O) • Гексацианоферрат(III) калия (K3[Fe(CN)6]) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрид калия (KH) • Гидрокарбонат калия (KHCO3) • Гидроксид калия (KOH) • Гидроортофосфат калия (K2HPO4) • Гидросульфат калия (KHSO4) • Гидросульфид калия (KHS) • Гидросульфит калия (KHSO3) • Гидрофторид калия (KHF2) • Дигидроарсенат калия (KH2AsO4) • Дигидроортофосфат калия (KH2PO4) • Динитрамид калия (KN(NO2)2) • Дисульфат калия (K2S2O7) • Дисульфит калия (K2S2O5) • Дисульфонатнитроксил калия ((KO3S)2NO) • Дитионат калия (K2S2O6) • Дихромат калия (K2Cr2O7) • Дицианоаргентат(I) калия (K[Ag(СN)2]) • Дицианоаурат(I) калия (K[Au(СN)2]) • Иодат калия (KIO3) • Иодид калия (KI) • Карбонат калия (K2CO3) • Манганат калия (K2MnO4) • Метаванадат калия (KVO3) • Метасиликат калия (K2SiO3) • Метафосфат калия (KPO3) • Надпероксид калия (KO2 или K2O4) • Нитрат калия (KNO3) • Нитрит калия (KNO2) • Озонид калия (KO3) • Оксалат калия (K2C2O4) • Оксалат моногидрат калия (K2C2O4•H2O) • Оксид калия (K2O) • Октахлоромолибдат калия (K4Mo2Cl8) • Ортофосфат калия (K3PO4) • Пербромат калия (KBrO4) • Периодат калия (KIO4) • Перманганат калия (KMnO4) • Пероксид калия (K2O2) • Пероксодикарбонат калия (К2С2О6) • Пероксомоносульфат калия (K2SO5) • Пероксодисульфат калия (K2S2O6(O2)) • Перренат калия (KReO4) • Перхлорат калия (KClO4) • Полисульфиды калия (K2Sn) • Политионаты калия (K2SnO6) • Сегнетова соль (NaKC4H4O6) • Соль Джонсона (K[I(I)2]•H2O) • Соль Цейзе (K[Pt(C2H4)Cl3]•H2O) • Сорбат калия (C6H7KO2) • Сульфат гидрат калия-гадолиния • Сульфат гидрат калия-кальция (K2Ca(SO4)2•H2O) • Сульфат калия (K2SO4) • Сульфат калия-кальция (K2Ca(SO4)2) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфид калия (K2S) • Сульфит дигидрат калия (K2SO3•2H2O) • Сульфит калия (K2SO3) • Тетрагидроалюминат калия (KAlH4) • Тетрагидроксодиоксоосмат(VI) калия (K2[OsO2(OH)4]) • Тетрагидроортотеллурат калия (K2H4TeO6) • Тетраиодомеркурат(II) калия (K2[HgI4]) • Тетранитроплатинат(II) калия (K2[Pt(NO2)4]) • Тетраоксорутенат(VI) калия (K2RuO4) • Тетрапероксохромат(V) калия (K3CrO8) • Тетрасиликат калия (K2Si4O9•H2O) • Тетрахлоромолибдат(III) калия (KMoCl4) • Тетрахлоропалладат(II) калия (K2[PdCl4]) • Тетрахлороплатинат(II) калия (K2[PtCl4]) • Тетрахлороферрат(III) калия (K[FeCl4]) • Тетрахлорплатинат калия (K2PtCl4) • Тетрацианоникколат(II) калия (K2[Ni(CN)4]) • Тетрацианоплатинат(II) калия (K2[Pt(CN)4]) • Тиосульфат калия (K2SO3S) • Тиоцианат калия (KSCN) • Феррат калия (K2FeO4) • Феррооксалат калия (K3[Fe(C2O4)3]) • Формиат калия (HCOOK) Фталимид калия • Фторид калия (KF) • Фторсульфит калия (KSO2F) • Фульминат калия (KCNO) • Хлорат калия (KClO3) • Хлорид калия (KCl) • Хлорид-триэтилалюминий калия ((C2H5)3Al•KCl) • Хромат калия (K2CrO4) • Хромит калия (KCrO2) • Цианат калия (KOCN) • Цианид калия (KCN) • Цианоаурат калия (K[Au(CN)2] • Этилксантогенат калия (C2H5OC(S)SK) • |








