Загрузить PDF
Загрузить PDF
Молекулярная формула содержит важную информацию о соответствующем химическом соединении. По ней можно определить, из каких атомов состоит данное соединение, и сколько атомов каждого элемента содержится в нем. Для нахождения молекулярной формулы необходимо знать эмпирическую формулу. Чтобы получить из эмпирической формулы молекулярную, следует умножить экспериментальные значения на целочисленный множитель.
-
1
Необходимо понимать связь между молекулярной и эмпирической формулами. Эмпирическая формула показывает количественное соотношение атомов в молекуле: например, два атома кислорода на каждый атом углерода. Молекулярная формула указывает на то, сколько атомов каждого вида входит в состав молекулы: к примеру, один атом углерода и два атома кислорода (диоксид углерода, или углекислый газ). Эти две формулы однозначно соотносятся друг с другом, и если умножить эмпирическую формулу на их целочисленное отношение, то получится молекулярная формула.[1]
-
2
Вычислите количество молей газа. Используйте для этого уравнение состояния идеального газа. С его помощью можно найти количество молей вещества, если известны давление, объем и температура, которые определяются экспериментальным путем. Количество молей находится по следующей формуле: n = PV/RT.[2]
- В данной формуле n — количество молей, P — давление, V — объем, T — температура в Кельвинах, и R — универсальная газовая постоянная.
- Например: n = PV/RT = (0,984 атм * 1 л) / (0,08206 л атм моль-1 K-1 * 318,15 K) = 0,0377 моль
-
3
Определите молекулярный вес газа. Это можно сделать лишь после того, как с помощью уравнения состояния идеального газа вы найдете количество молей газа. Необходимо также знать массу газа. Для того, чтобы найти молекулярный вес газа, следует поделить его массу в граммах на количество молей.
- Например: 14,42 г / 0.0377 моль = 382,49 г/моль
-
4
Сложите атомные веса всех атомов, которые входят в эмпирическую формулу. Каждый атом в эмпирической формуле имеет свой атомный вес. Этот вес можно найти в периодической таблице Менделеева под символом соответствующего элемента. Сложите атомные веса входящих в эмпирическую формулу элементов.[3]
- Например: (12,0107 г * 12) + (15,9994 г * 1) + (1,00794 г * 30) = 144,1284 + 15,9994 + 30,2382 = 190,366 г
-
5
Найдите соотношение между весами в молекулярной и эмпирической формулах. Таким образом вы определите, сколько раз эмпирический вес повторяется в реальной молекуле. Это позволит вам найти число повторений эмпирической формулы в молекулярной. Найденная величина должна представлять собой целое число. Если получится дробное число, необходимо округлить его до целого.
- Например: 382,49 / 190,366 = 2,009
-
6
Умножьте эмпирическую формулу на найденное соотношение. Умножьте подстрочные индексы в эмпирической формуле на полученное соотношение. В результате вы найдете молекулярную формулу. Если соотношение равно “1”, то молекулярная формула совпадает с эмпирической.
- Например: C12OH30 * 2 = C24O2H60
Реклама
-
1
Найдите массу каждого атома. Иногда массы атомов даются в условии. В некоторых задачах указываются массовые проценты. В последнем случае предположите, что полная масса вещества составляет 100 граммов — это позволит вам записать массовые проценты в виде обычной массы в граммах.[4]
- Например: 75,46 г C, 8,43 г O, 16,11 г H
-
2
Переведите массу в моли. Следует перевести молекулярную массу каждого элемента в количество молей. Для этого необходимо поделить молекулярную массу каждого элемента на его атомную массу. Атомные массы можно найти в периодической таблице Менделеева под символами соответствующих элементов.[5]
- Например:
- 75,46 г C * (1 моль / 12,0107 г) = 6,28 моль C
- 8,43 г O * (1 моль / 15,9994 г) = 0,53 моль O
- 16,11 г H * (1 моль / 1,00794) = 15,98 моль H
- Например:
-
3
Поделите все молярные значения на наименьшее количество молей. Необходимо найти элемент с минимальным количеством молей и поделить на эту величину количество молей каждого элемента, входящего в данное соединение. Таким образом вы найдете простейшие мольные соотношения. В результате для самого малочисленного элемента у вас получится “1”, а для остальных элементов числа больше единицы.[6]
- Например: меньше всего в соединении кислорода, его количество составляет 0,53 моль.
- 6,28 моль/0,53 моль = 11,83
- 0,53 моль/0,53 моль = 1
- 15,98 моль/0,53 моль= 30,15
- Например: меньше всего в соединении кислорода, его количество составляет 0,53 моль.
-
4
Округлите количество молей до целых чисел. Молярные количества войдут в эмпирическую формулу в виде подстрочных индексов. Необходимо округлить их до ближайших целых чисел. После нахождения этих чисел можно записать эмпирическую формулу.[7]
- Например: эмпирическая формула имеет вид C12OH30:
- 11,83 = 12
- 1 = 1
- 30,15 = 30
Реклама
- Например: эмпирическая формула имеет вид C12OH30:
-
1
Ознакомьтесь с понятием эмпирической формулы. Эмпирическая формула содержит информацию о соотношении количества атомов в молекуле. Она не показывает, сколько именно атомов входит в состав данной молекулы. Кроме того, эмпирическая формула не позволяет судить о структуре молекулы и связях между входящими в нее атомами.[8]
-
2
Узнайте о том, какая информация содержится в молекулярной формуле. Как и эмпирическая формула, молекулярная формула не позволяет судить о структуре молекулы и связях между атомами. Однако в отличие от эмпирической формулы, молекулярная формула показывает, сколько атомов того или иного элемента входит в состав молекулы. Между эмпирической и молекулярной формулами существует целочисленное соотношение.[9]
-
3
Ознакомьтесь с понятием структурной формулы. Структурная формула содержит больше информации, чем молекулярная формула. Помимо количества атомов каждого вида, структурная формула содержит информацию о связях между атомами и структуре молекулы. Эта информация очень важна для понимания того, как молекула будет реагировать с другими веществами.[10]
Реклама
Советы
- Внимательно прочитайте условие задачи и начальные данные.
Реклама
Предупреждения
- Не путайте эмпирические и молекулярные формулы.
Реклама
Что вам понадобится
- Периодическая таблица Менделеева
- Калькулятор
- Карандаш
- Лист бумаги
Похожие статьи
Об этой статье
Эту страницу просматривали 22 460 раз.
Была ли эта статья полезной?
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
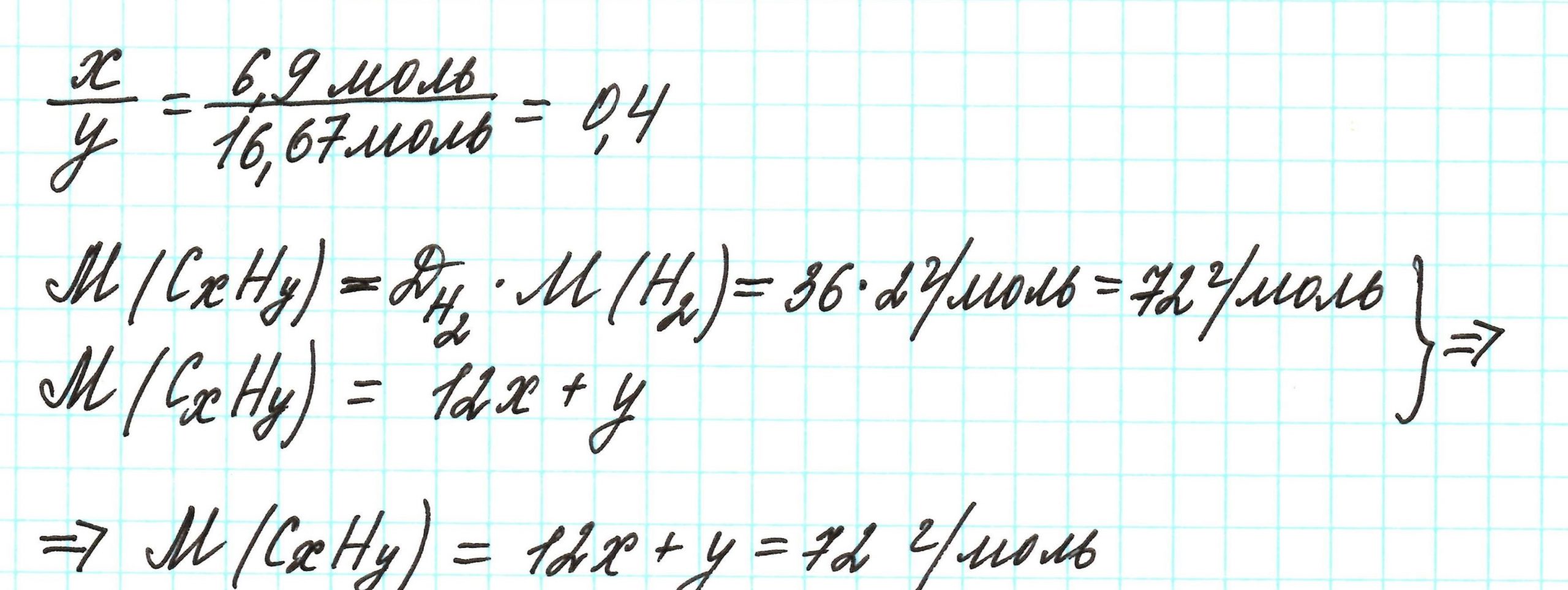
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
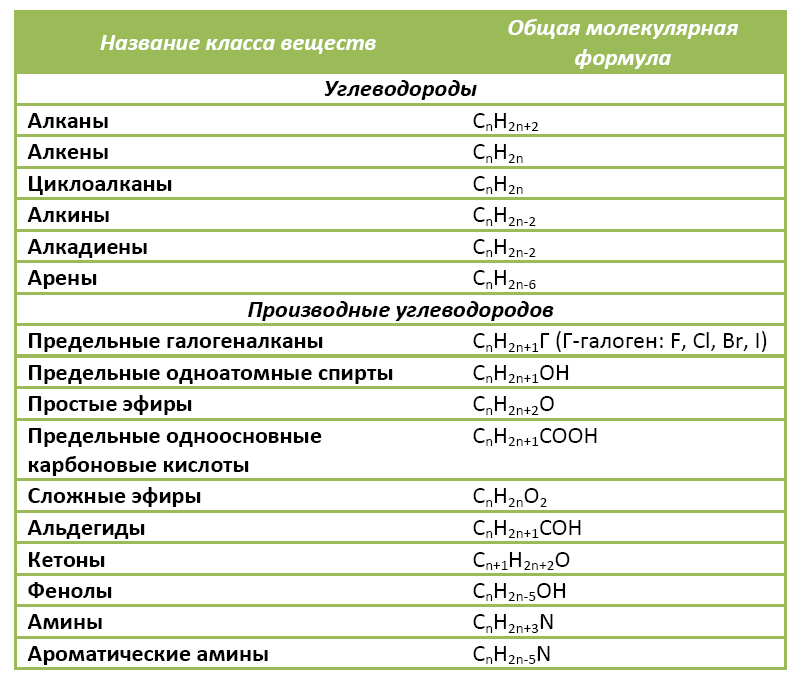
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
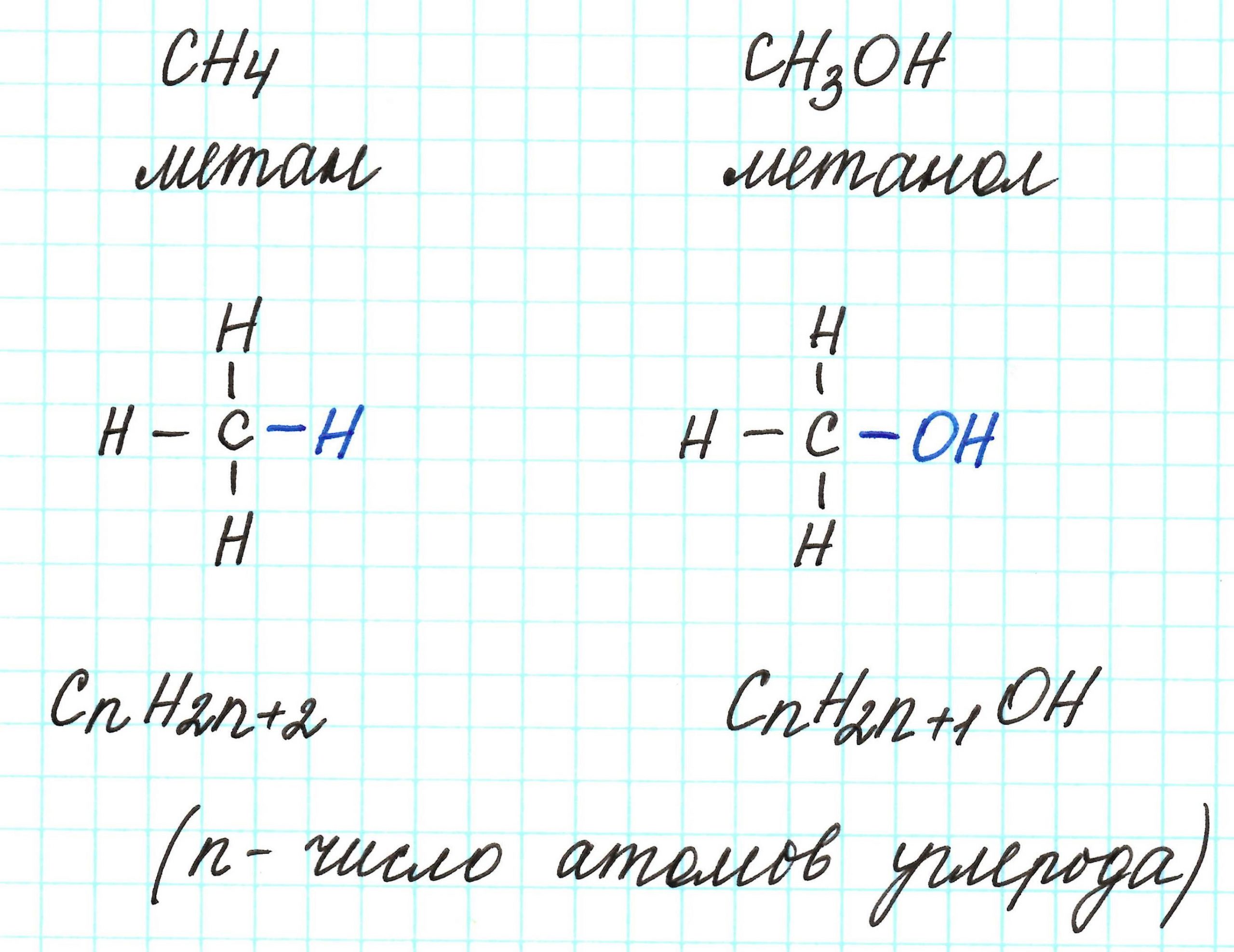
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
A chemical formula is a way of describing the information about the chemical proportions of atoms that make up a certain chemical compound or molecule. It uses the symbols of the chemical element and numbers, and also occasionally uses other symbols such as brackets, dashes, square brackets, commas, plus (+), and minus (-) signs. There are different types of chemical formulae like empirical formula, molecular formula, structural formula, and condensed formula. Let’s discuss the molecular formula and its calculation with examples in detail in this article.
What is Molecular Formula?
The molecular formula specifies the actual number of each type of atom in a molecule. For example, the molecular formula of benzene is C6H6, i.e., it is composed of six carbon and six hydrogen atoms. The molecular formula helps in determining whether a chemical compound is a binary compound, ternary compound, quaternary compound, or has even more elements depending upon the number of elements in a molecule. A molecular formula is always a multiple of the empirical formula, where an empirical formula for a chemical compound is defined as a simple expression that represents the ratio of the elements in the compound. For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO. We need the molar mass of a compound to find the molecular formula of a compound, and it is often derived after obtaining the empirical formula. Though molecular formulae are simple and easy to understand, they lack the knowledge concerning the atomic arrangement and bonding that is presented in a molecular formula. A molecular formula gives more information about a molecule than its empirical formula, however, it is more difficult to establish.
Relation between Molecular Formula and Empirical Formula
The molecular formula specifies the actual number of each type of atom in a molecule, whereas an empirical formula for a chemical compound is a simple expression that represents the ratio of the elements in the compound. For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO. Here, the n-factor is 2. The empirical formula might be the same for different chemical compounds. For example, glucose, formaldehyde, and acetic acid have the same empirical formula, CH2O, but their molecular formulae are different. For some chemical compounds, both formulae are the same, like water (H2O), hypochlorous acid (HClO), formaldehyde (CH2O), methane (CH4), etc.
M = n × E
where,
M is the molecular formula
n is the ratio of molar mass and empirical formula mass
E is the empirical formula
How to Calculate Molecular Formula?
The molecular formula of a chemical compound can be found in the following ways:
Using Composition and Molecular Weight
Step 1: Multiply the molecular weight with the given component percentage.
Step 2: Divide each value obtained by the atomic weight of that atom.
Step 3: Round off the obtained values to the closest whole number. Finally, write the molecular formula.
Example: A compound is composed of 82.78% nitrogen and 17.22% hydrogen. If its molecular weight is 17.031 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of a compound = 17.031 g/mol
Nitrogen percentage in the given compound = 82.78%
Hydrogen percentage in the given compound = 17.22%
Step 1: Multiply the molecular weight with the given component percentage.
Nitrogen = 17.031 × (82.78/100) = 14.0982
Hydrogen = 17.031 × (17.22/100) = 2.9327
Step 2: Divide each value obtained by the atomic weight of that atom.
Nitrogen: 14.0982/14.0067 = 1.00654
Hydrogen: 2.9327/1.00794 = 2.90960
Step 3: Round off the obtained values to the closest whole number.
Nitrogen: 1
Hydrogen: 3
Thus, the molecular formula of the given compound is NH3.
Using Empirical Formula and Molecular Weight
Step 1: Calculate the empirical formula mass from the given empirical formula.
Step 2: Find the n-factor by using its formula. n = Molar Mass/Empirical Formula Mass
Step 3: Now, multiply all the subscripts in the empirical formula by n and the resultant formula is the required molecular formula.
Example: The empirical formula of a compound of carbon, hydrogen, and oxygen is HO. If its molar mass is 34.014 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = CH2O
The molar mass of the compound = 60.052 g/mol
Step 1: First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 1.00794 + 15.9994
= 2.01588 + 31.9988
= 17.007 g/mol
Step 2: Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 60.052/17.007 = 2
Step 3: Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 2 × (HO) = H2O2
Hence, the molecular formula of the compound is H2O2.
Solved Examples on Molecular Formula
Example 1: A compound is composed of 68.29% carbon, 12.02% hydrogen, and 21.69% oxygen. If its molecular weight is 86.136 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of a compound = 86.136 g/mol
Carbon percentage in the given compound = 68.29%
Hydrogen percentage in the given compound = 12.02%
Oxygen percentage in the given compound = 21.69%
Step 1: Multiply the molecular weight with the given component percentage.
Carbon = 86.136 × (68.29/100) = 58.8223
Hydrogen =86.136 × (12.02/100) = 10.3535
Oxygen = 86.136 × (21.69/100) = 18.6828
Step 2: Divide each value obtained by the atomic weight of that atom.
Carbon: 58.8223 /12.0107 = 4.8973
Hydrogen: 10.3535/1.00794 = 10.2719
Oxygen: 18.6828/15.9994 = 1.1677
Step 3: Round off the obtained values to the closest whole number.
Carbon: 5
Hydrogen: 10
Oxygen: 1
Thus, the molecular formula of the given compound is C5H10O.
Example 2: Oxalic acid is composed of 27.42% carbon, 2.33% hydrogen, and 70.25% oxygen. If its molecular weight is 90.035 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of oxalic acid = 90.035 g/mol
Carbon percentage in oxalic acid = 27.42%
Hydrogen percentage in oxalic acid = 2.33%
Oxygen percentage in oxalic acid = 70.25%
Step 1: Multiply the molecular weight with the given component percentage.
Carbon = 90.035 × (27.42/100) = 24.6875
Hydrogen = 90.035 × (2.33/100) = 2.0978
Oxygen = 90.035 × (70.25/100) = 63.2496
Step 2: Divide each value obtained by the atomic weight of that atom.
Carbon = 24.6875/12.0107 = 2.0554
Hydrogen: 10.3535/1.00794 = 2.08127
Oxygen: 63.2496/15.9994 = 3.9532
Step 3: Round off the obtained values to the closest whole number.
Carbon: 2
Hydrogen: 2
Oxygen: 4
Thus, the molecular formula of the given compound is C2H2O4.
Example 3: The empirical formula of a compound of carbon, hydrogen, and oxygen is CH2O. If its molar mass is 60.052 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = CH2O
The molar mass of the compound = 60.052 g/mol
First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 12.0107 + 2 × 1.00794 + 15.9994
= 30.026 g/mol
Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 60.052/30.026 = 2
Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 2 × (CH2O) = C2H4O2
Hence, the molecular formula of the compound is C2H4O2.
Example 4: Boric acid is composed of 21.14% boron, 4.65% hydrogen, and 74.21% oxygen. If its molecular weight is 61.83 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of boric acid = 61.83 g/mol
Boron percentage in boric acid = 27.42%
Hydrogen percentage in boric acid = 4.65%
Oxygen percentage in boric acid = 68.79%
Step 1: Multiply the molecular weight with the given component percentage.
Boron = 61.83 × (21.14/100) = 13.0709
Hydrogen = 61.83 × (4.65/100) = 2.8750
Oxygen = 61.83 × (74.21/100) = 45.8840
Step 2: Divide each value obtained by the atomic weight of that atom.
Boron: 13.6891/10.811 = 1.209
Hydrogen: 2.2568/1.00794 = 2.8524
Oxygen: 32.2320/15.9994 = 2.8679
Step 3: Round off the obtained values to the closest whole number.
Boron: 1
Hydrogen: 3
Oxygen: 3
Thus, the molecular formula of the given compound is H3BO3.
Example 5: The empirical formula of a compound that is composed of hydrogen, chlorine, and oxygen is HClO. If its molar mass is 52.46 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = HClO
The molar mass of the compound = 52.46 g/mol
First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 1.00794 + 35.453 + 15.9994
= 52.460 g/mol
Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 52.460/52.46 = 1
Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 1 × (HClO) = HClO
Here, the empirical formula and the molecular formula of the given compound are the same.
Hence, the molecular formula of the compound is HClO.
FAQs on Molecular Formula
Question 1: What is meant by a chemical formula?
Answer:
A chemical formula is a way of describing the information about the chemical proportions of atoms that make up a certain chemical compound or molecule. It uses the symbols of the chemical element and numbers, and also occasionally uses other symbols such as brackets, dashes, square brackets, commas, plus (+), and minus (-) signs. There are different types of chemical formulae like the empirical formula, molecular formula, structural formula, and condensed formula.
Question 2: Define molecular formula and give an example.
Answer:
The Molecular Formula specifies the actual number of each type of atom in a molecule. For example, the molecular formula of benzene is C6H6, i.e., it is composed of six carbon and six hydrogen atoms. We need the molar mass of a compound to find the molecular formula of a compound, and it is often derived after obtaining the empirical formula.
Question 3: What is the difference between the empirical formula and the molecular formula?
Answer:
- The molecular formula specifies the actual number of each type of atom in a molecule, whereas an empirical formula for a chemical compound is a simple expression that represents the ratio of the elements in the compound.
- For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO.
- The empirical formula might be the same for different chemical compounds. For example, glucose, formaldehyde, and acetic acid have the same empirical formula, CH2O, but their molecular formulae are different.
- For some chemical compounds, both formulae are the same, like water (H2O), hypochlorous acid (HClO), formaldehyde (CH2O), methane (CH4), etc.
Question 4: What is the relationship between the empirical formula and the molecular formula?
Answer:
A molecular formula is always a multiple of the empirical formula and the relationship between the empirical formula and the molecular formula is given as follows:
Molecular Formula = n × (Empirical formula) (where n is a positive integer)
where “n” is the ratio of molar mass and empirical formula mass.
n = Molar Mass/Empirical Formula Mass
Question 5: What are the molecular formulae of glucose, dichlorine hexoxide, and dimethyl ether?
Answer:
Molecular formula of glucose = C6H12O6
Molecular formula of dichlorine hexoxide = Cl2O6
Molecular formula of dimethyl ether = C2H6O.
Related Resources
- Molecular Weight
- Chemical Formula of Common Compounds
- Molar Mass
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
НЕОБХОДИМЫЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ.
1. МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА В ВЕЩЕСТВЕ.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
3. МОЛЕКУЛЯРНАЯ И ПРОСТЕЙШАЯ ФОРМУЛА ВЕЩЕСТВА.
Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.
Если в задаче даны только массовые доли элементов, то в процессе
решения задачи можно вычислить только простейшую формулу вещества.
Для получения истинной формулы в задаче обычно даются ДОПОЛНИТЕЛЬНЫЕ ДАННЫЕ — молярная масса, относительная
или абсолютная плотность вещества или другие данные, с помощью которых можно
определить молярную массу вещества.
4. ОТНОСИТЕЛЬНАЯ ПЛОТНОСТЬ ГАЗА Х ПО ГАЗУ — DПОУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У.
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
5. АБСОЛЮТНАЯ ПЛОТНОСТЬ ГАЗА ПРИ НОРМАЛЬНЫХ УСЛОВИЯХ.
Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
АЛГОРИТМ 1
НАХОЖДЕНИЕ ФОРМУЛЫ ВЕЩЕСТВА ПО МАССОВЫМ ДОЛЯМ ЭЛЕМЕНТОВ И ОТНОСИТЕЛЬНОЙ ПЛОТНОСТИ
1. Составить краткую запись условия задачи.
2. Отметить массу вещества за 100г и перевести массовые доли элементов массы. Зная массу по формуле найти количество каждого элемента.
3. Записать соотношение количеств элементов, выразить это отношение целыми числами (разделив на самое маленькое число).
4.Составить химическую формулу по полученным индексам – если плотность не дана, это и есть формула вещества.
5. Если дана плотность, найти молярную массу вещества.
6. Определить молярную массу вещества по относительной плотности вещества.
7. Разделить молярную массу по относительной плотности на молярную массу определённого вещества
8. На полученное целое число умножить все индексы определённого вещества – это и есть данное вещество.
АЛГОРИТМ 2
НАХОЖДЕНИЕ ФОРМУЛЫ ВЕЩЕСТВА ПО ПРОДУКТАМ СГОРАНИЯ И ОТНОСИТЕЛЬНОЙ ПЛОТНОСТИ
1. Условие задачи
2. Составить краткую запись условия задачи.
3.Определить молярные массы продуктов сгорания, количество углерода и водорода в продуктах сгорания.
4. Если дана масса сгоревшего вещества, вычислить массу кислорода или других элементов.
Далее задача решается, как предыдущая.
ОПРЕДЕЛЕНИЕ ФОРМУЛ ВЕЩЕСТВ ПО ФОРМУЛЕ И ХИМИЧЕСКИМ СВОЙСТВАМ.
40(В) Задачи ЕГЭ ФИПИ 2015 на нахождение молекулярной формулы вещества
Приложение №1 Общие формулы неорганических соединений
Фреоны
Задача. В мастерской по ремонту холодильников и климатического оборудования отклеились этикетки от 5 баллонов с хранившимися в них фреонами (техническое название группы насыщенных алифатических галогенсодержащих углеводородов, применяемых в качестве хладагентов). Этикетки содержали следующие надписи: R-12, R-23, R-32, R-41, R-161. Для установления формул фреонов были проведены исследования. При сжигании фреона 1 образовалось 2,24 л СО2 и 4 г HF. Фреон 2 не горит (ω(C) = 9,92%; D(H2) = 60,5). У фреона 3 (ω(F) = 39,58%, ω(Н) = 10,42%). При взаимодействии фреона 4 с натрием образовался этан и фторид натрия. При щелочном гидролизе фреона 5 образовались две соли: формиат натрия (ω(C) = 17,65%; ω(О) = 47,06%) и фторид натрия. Установите структурные формулы указанных фреонов и дайте им химические названия, установите соответствие между кодом фреона и его формулой.
Данная задача предназначена для десятиклассников, которые еще не освоили курс кислородсодержащих органических соединений, поэтому даны массовые доли.
1. Начнем с фреона № 1. При его сжигании образовалось 2,24 л углекислого газа. Найдем количество углекислого газа. Делим его объем на молярный объем и получаем 0,1 моль. Соответственно, атомов углерода тоже 0,1 моль, поскольку в каждой молекуле углекислого газа содержится один атом углерода.
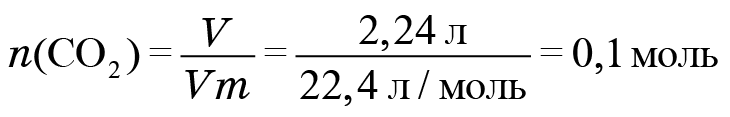
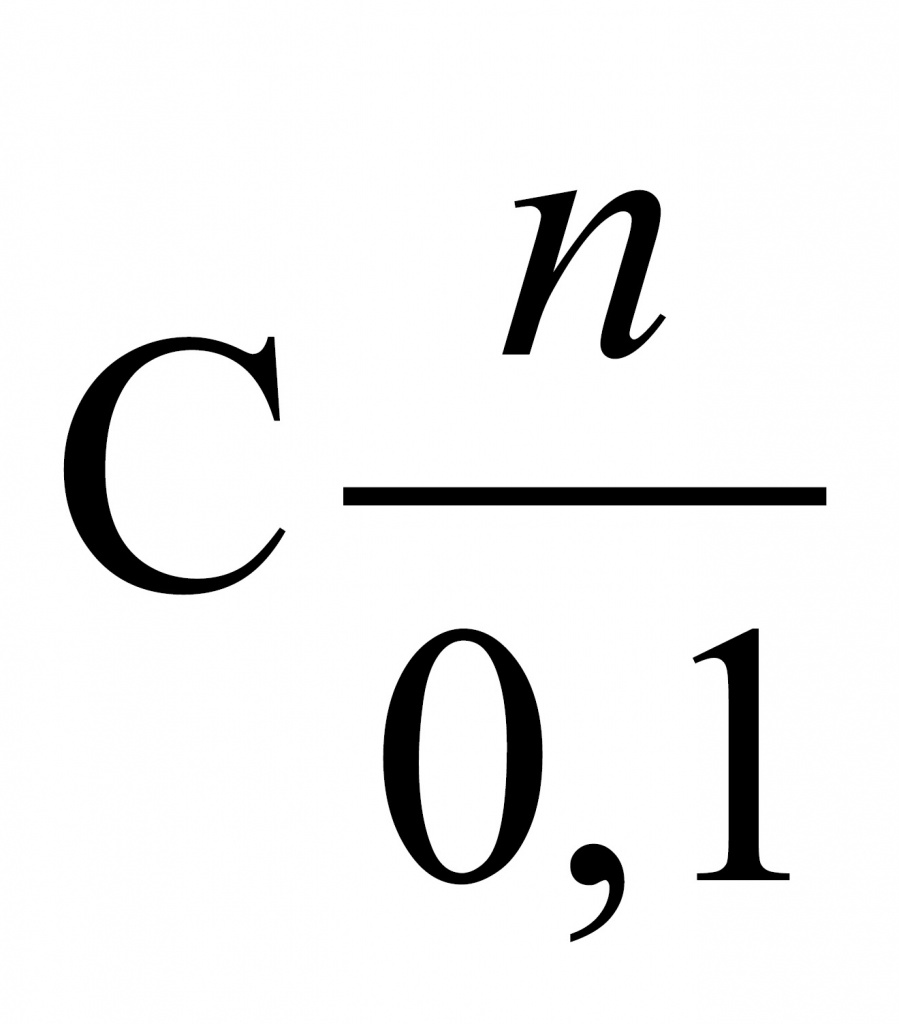
Информацию по водороду возьмем из фтороводорода. Найдем количество фтороводорода. Поскольку дана его масса, мы должны поделить массу (4 г) на молярную массу. Молекула фтороводорода состоит из атома фтора и атома водорода. Масса атома фтора 19, у водорода масса 1, значит, молярная масса 20. И мы получаем 0,2 моль.
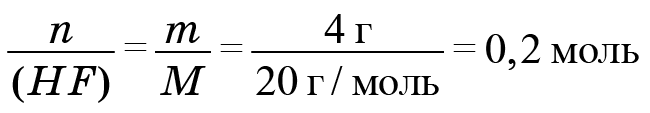
Следовательно, H = 0,2 и F = 0,2. Формула вещества, фреона № 1: CH2F2 (на один атом углерода приходится два атома водорода и два атома фтора).

2. Узнаем, что скрывается под фреоном № 2. Известно, что он не горит, и дана его плотность по водороду. Это относительная плотность, которая показывает, во сколько раз молярная масса вещества больше молярной массы (в данном случае) водорода. Молярная масса фреона № 2 равна 121 г/моль.
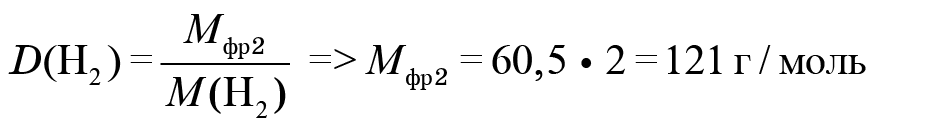
Сколько атомов углерода во фреоне № 2? Для подсчета используем массовую долю углерода. Масса углерода равна: молярную массу умножить на массовую долю. Получаем 12. Значит, в данной молекуле фреона № 2 содержится только один атом углерода.
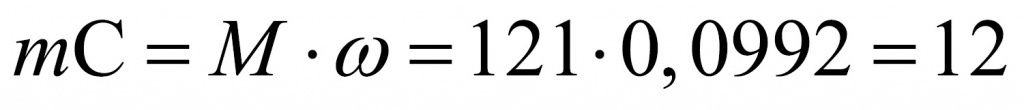
Нарисуем этот атом углерода. У него имеется четыре связи, поскольку в органической химии углерод четырехвалентный. Попробуем определить атомы, исходя из того, что в сумме один атом углерода и все остальные атомы должны равняться молярной массе (равной молекулярной) 121. Попробуем рассчитать. Если это четыре атома фтора, то получается мало. А если это четыре атома хлора, то много. Возьмем нечто среднее: половина — атомы фтора и половина — атомы хлора. Единица в показателе 121 говорит о том, что имеются нечетные значения. Молярная масса хлора 35,5. Для того чтобы получить целое численное значение, вероятно, нужны два атома хлора.
121 – 71 – 12 = 38 (ровно на два атома фтора)
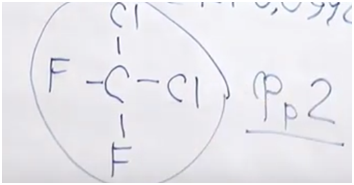
3. Перейдем к фреону № 3. Нам дана массовая доля фтора: 39,58. Дана массовая дола водорода: 10,42. Поскольку это органическое вещество, должен быть и углерод — попробуем его найти.
100 – 39,58 – 10,42 = 50
Проверим вариант, что там только хлор и нет других атомов. Предположим, что там всего один атом углерода (его масса будет равна 12). Посчитаем, какая масса при этом будет приходиться, например, на атом фтора.
12 ∙ 39,58 : 50 = 9,5
Как указано в периодической системе Менделеева, атомная масса фтора — 19. Ровно половина одного атома фтора — 9,5, так что в составе этой молекулы не может быть один атом углерода, их должно быть как минимум два. Следовательно, на углерод приходиться масса 24, на фтор — 19. Какая масса в данном случае приходится на водород? По сути, должно оставаться пять атомов водорода.
24 ∙ 10,42 : 50 = 5
Поскольку у нас один атом фтора, пять атомов водорода и два атома углерода, мы имеем дело с фторэтаном.

4. Что касается фреона № 4, то в реакции с натрием образовались этан и фторид натрия. Это реакция Вюрца — Фиттига. Мы имеем исходное вещество фторметан, которое реагирует с натрием, и образуются этан и фторид натрия.
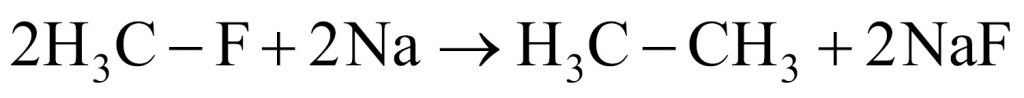
5. Переходим к фреону № 5. Формиат натрия образуется при гидролизе трифторметана. Получается формиат натрия, фторид натрия и две молекулы воды.
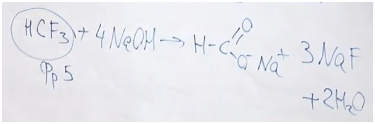
Посмотрев в справочную информацию, вы можете соотнести с кодами каждый из найденных фреонов.
Изучение фреонов очень интересно. Каждый тип холодильного оборудования требует особую марку фреона. Сегодня холодильное оборудование часто заполняют и углеводородами, поскольку, как известно, фреоны способствуют разрушению озонового слоя Земли. Но на сегодняшний день полного отказа от фреонов еще не произошло.

Химия. 10 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии, изложенный в учебниках «Химия. 8 класс» и «Химия. 9 класс» данного авторскогo коллектива. Предназначен для изучения химии на углубленном уровне. Учебник соответствует федеральному государственному образовательному стандарту среднего общeгo образования.
Купить
Вильгельм Рудольф Фиттиг
Задача. Вещество, открытое в 1862 году немецким ученым Вильгельмом Рудольфом Фиттигом, представляет собой бесцветные кристаллы (tпл = +690С). Они широко применяются в качестве пищевой добавки для сохранения товарного вида фруктов (например, цитрусовых) путем нанесения на кожуру плода. Для установления состава вещество массой 15,4 г сожгли, образовалось 26,88 л (н.у.) углекислого газа и 9 г воды. Установите структурную формулу, если известно, что оно может подвергаться каталитическому галогенированию. Составьте уравнение этого вещества с избытком водорода на платиновом катализаторе при повышенном давлении.
Похожую задачу часто можно встретить на ЕГЭ.
Начнем с определения молекулярной формулы вещества, то есть узнаем состав этой молекулы. Найдем количество углекислого газа, а оно равно количеству углерода. Разделим объем на молярный объем. Поскольку условия нормальные, молярный объем для газообразного вещества составляет около 22,4 л/моль.
26,88 л : 22,4 л/моль = 1,2 моль
Поскольку воды 9 г, а молярная масса воды 18 г, следовательно, воды 0,5 моль, а водорода 1 моль. Как такое может быть? В одной молекуле воды содержится целых два атома водорода. Но нам не сказано: соединение ли углеводородом? содержит ли кислород? Мы должны проверить наличие кислорода и найти массу углерода и водорода.
1,2 моль ∙ 12 = 14,4 г
Сумма углерода и водорода: 14,4 + 1 = 15,4. Следовательно, в составе неизвестного вещества нет кислорода.

Молярное соотношение показывает, что формула вещества С12H10. Почему не С6H5? Потому что в углеводородах никогда не бывает нечетного числа атомов водорода. Радикал С6H5 в химии называется фенилом. Иными словами, мы имеем соединение, которое называется в химии дифенил. На это также указывают химические свойства дифенила, и он является разрешенной пищевой добавкой. В магазинах можно встретить, например, апельсины, покрытые белым веществом — это и есть дифенил. Иногда его применяют в изрядном количестве, поэтому нужно тщательно мыть фрукты.
Составим уравнение реакции с избытком водорода. Очень просто посчитать, сколько атомов водорода потребуется на реакцию с дифенилом. Мы видим шесть двойных связей. Следовательно, на одну двойную связь нужна одна молекула водорода, а на шесть двойных связей — шесть молекул водорода при исчерпывающем гидрировании. Конечно, на platinum-катализаторе, потому что соединение ароматическое и требует преодоления достаточно высокого энергетического барьера. Мы получаем соединение, которое нельзя назвать никак иначе, кроме как дициклогексил.

Соединение дифенил и было открыто Рудольфом Фиттигом в 1862 году с температурой плавления 69°С.
Желеобразующая жидкость
Задача. Некоторая нерастворимая в воде жидкость при хранении на воздухе способна уплотняться, превращаясь в желе. Химик отобрал, отмерив, некоторый объем этой жидкости и установил, что при действии избытка раствора брома в четыреххлористом углероде образовалось 26,4 г дибромида. А при действии раствора хлора на такой же объем этой жидкости образовалось 17,5 г дихлорида. Определите структурную формулу этой жидкости, если известно, что в ее состав входят только атомы водорода и углерода. Составьте уравнение реакции полимеризации этой жидкости.
Обозначим неизвестную жидкость-углеводород через формулу CXHY. О какой реакции идет речь: замещения или присоединения? Поскольку реакция протекает при обычных условиях, значит, речь идет о реакции присоединения.
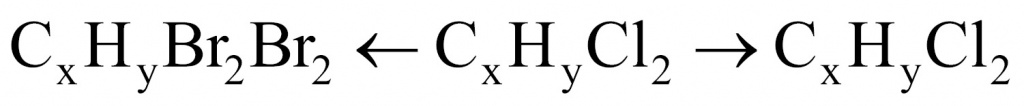
Для решения данной задачи нужно применить прием, известный в учебной химии как прием вычитания массы. Представим, что жидкости у нас ровно 1 моль. В этом случае разница между массой дибромида и дихлорида будет разницей между массой брома и хлора.
Молекула брома имеет массу 160, а молекула хлора — 71. Получаем 89. То есть если бы вещества у нас было 1 моль, то разница составила бы 89 г. Вычислим разницу массы дибромида и дихлорида:
26,4 – 17,5 = 8,9
Искомого вещества 0,1 моль.
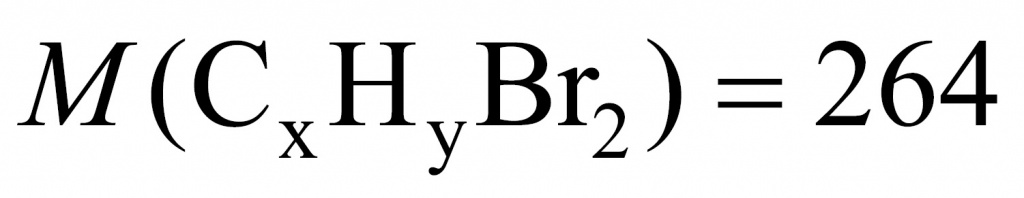
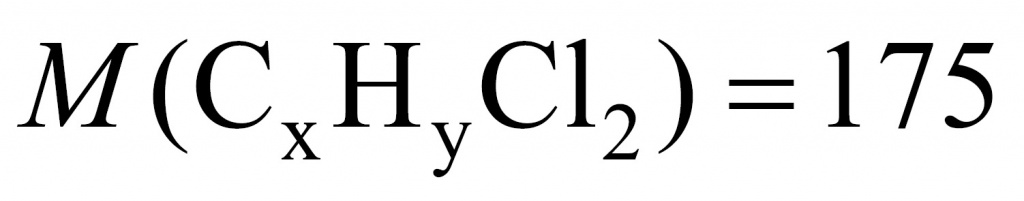
Теперь установим формулу. Обратимся к молекулярной записи. На углеводородную часть приходится 104. Сколько там может быть углеродов и водородов? Если углеродов 8 (что подходит), тогда на углероды приходится 96 и на водороды — 8.
Формула углеводорода C8H8.
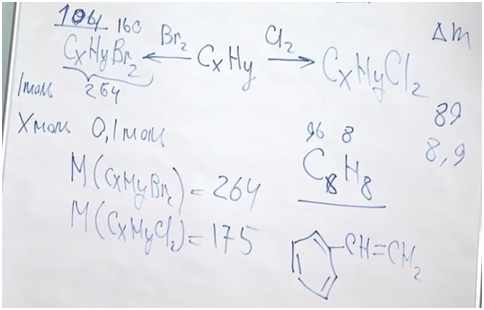
Разберемся, о каком углеводороде идет речь. Обратим внимание, что соединение непредельное, но оно способно присоединить только одну молекулу брома или одну молекулу хрома. Значит, исходя из малого числа атомов водорода по отношению к атомам углерода, скорее всего, это соединение есть не что иное, как производное бензола, то есть ароматическое соединение. В бензоле шесть атомов углерода и пять атомов водорода в остатке. У нас получается кетастирол.
Чтобы не было полимеризации, обычно в тот стирол, который можно купить в магазине, добавляют стабилизатор.
Уравнение полимеризации. Из n молекул стирола получается полимер, состоящий из n фрагментов.
Полистирол — это, например, одноразовая посуда. Она наносит существенный вред окружающей среде, и сейчас идет речь о том, чтобы ее запретить.
Отдушка для мыла
Задача. Некоторое легкоплавкое вещество, обладающее приятным запахом, используют в качестве ингибитора полимеризации, в качестве отдушки для мыла. При сжигании этого вещества массой 8,4 г получили 11,2 л (н.у.) углекислого газа, 7,2 г воды. Установите структурную формулу неизвестного соединения, если известно, что оно не реагирует с бромной водой, но реагирует с водородом в присутствии катализатора. Известно, что это соединение может быть получено в результате прокаливания кальциевой соли органической кислоты. Составьте уравнение соответствующей химической реакции.
По данным задачи, углекислый газ составляет 0,1 моль, соответственно, столько же и углерода. Поскольку воды 7,2 г, что в молях 0,4, то водорода 0,8. Проверим на наличие кислорода. Масса углерода 6, масса водорода – 0,8. Поскольку общая масса сожженного вещества составляет 8,4, то на кислород приходится масса 1,6 (в молях 0,1). Получается молекулярная формула C5H8O.

Перейдем к структурой формуле вещества. Вещество не реагирует с бромной водой — из этого можно делать вывод, что нет кратных соединений (то есть двойных, тройных углерод-углеродных связей). Но вещество реагирует с водородом в присутствии катализатора. Исходя из условий, скорее всего, речь идет о двухосновной кислоте. В результате прокаливания, нагревания (в пределах 200–250°С) отщепляется карбонат кальция и образуется кетон циклопентанон.
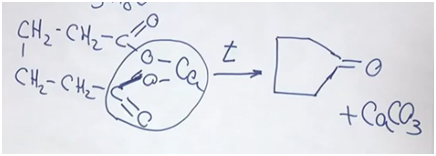
Циклопентанон как раз используют в качестве отдушки для мыла.
Ошибка А. М. Бутлерова
Задача. Установите структурную формулу альдегида, в определении которой немного ошибся великий А. М. Бутлеров, если известно, что в результате взаимодействия 100 г 0,9%-го раствора этого вещества с избытком раствора перманганата калия образуется осадок массой 3,48 г. Составьте уравнение реакции этого альдегида с раствором перманганата калия.
Все великие химики ошибались, в том числе и А. М. Бутлеров.
Для начала вспомним, как альдегиды взаимодействуют с перманганатом калия. Мы не знаем, о каком альдегиде идет речь. Допустим, у него была одна альдегидная группа (хотя, если в соединении две альдегидные группы, он все равно будет альдегидом). Возьмем также перманганат калия и мысленно нагреем. Мы получаем калиевую соль некой карбоновой кислоты, оксид марганца (IV) и гидроксид калия. Степень окисления углерода в альдегидной группе была +1, а стала +3. Получается, что углерод альдегид потерял два электрона. Марганец был +7, стал +4? значит, он принял три электрона. Так мы определили ключевые коэффициенты. Проблема состоит в том, что калия всего два атома. Можно сказать, что две молекулы были в форме соли, а одна молекула в форме кислоты. Поскольку гидроксида калия 3, мы видим, что его не хватает — вместо него будет вода.
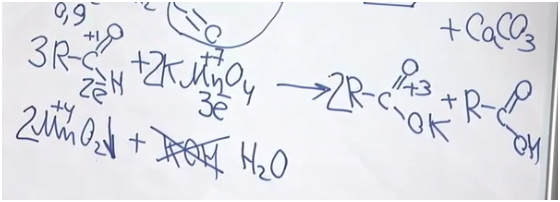
После составления уравнения найдем массу альдегида и массу осадка. Но осадок — это, разумеется, оксид марганца (IV).
Поскольку у нас 100 г 0,2%-го раствора и на 1% приходится 1 г, масса альдегида 0,9 г. Чтобы найти количество оксида марганца, 3,48 разделим на молярную масса оксида марганца — 87. Получаем 0,04 моль. В соответствии с этим уравнением альдегида у нас должно быть больше в полтора раза: 0,06 моль.
Найдем молярную массу альдегида.
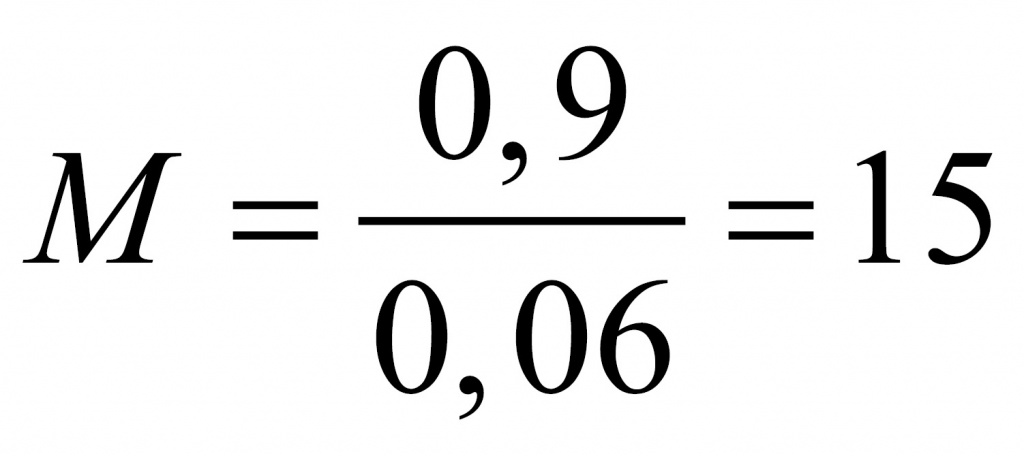
Где вы видели альдегид с молярной массой 15? Только на атом кислорода приходится 16. Значит, что либо альдегид содержал две альдегидные группы, либо это был формальдегид. Если бы он содержал две альдегидные группы, он бы отдал не два, а четыре электрона. Столько же отдал бы и формальдегид. Перманганат калия принимал бы три электрона. У оксида марганца (IV) было бы 4 моль. В этом случае оксида марганца 0,4 моль, а альдегида 0,3 моль.

Тогда
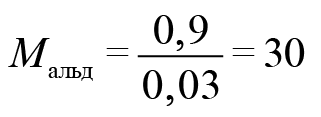
Следовательно, искомый альдегид — формальдегид. CH2O.
А. М. Бутлеров изначально определил формулу как C2H4O2.

Химия. 11 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии для старшей школы, изложенный в учебнике «Химия. Углубленный уровень. 10 класс» данного авторского коллектива. Учебник предназначен для изучения химии на углублённом уровне. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
…ловая кислота
Задача. На полке в химической лаборатории стояла склянка с полустертой надписью. Единственное, что можно было разобрать: «…ловая кислота». Для установления состава кислоты провели ряд экспериментов. Для полной нейтрализации раствора, содержащего 0,36 г этой кислоты, понадобилось 50 мл 0,1-молярного раствора гидроксида натрия. Такая же навеска кислоты смогла обесцветить V = 80 мл (ω = 1%, ρ ≈ 1 г/мл) бромной воды. Восстановите надпись на склянке.
Обозначим формулу кислоты (будем считать, что она монокарбоновая). Если она одноосновная, то реакция идет один к одному. Найдем количество гидроксида натрия: 50 миллилитров 0,1-молярного раствора. У нас раствор, в одном литре которого содержится 0,1 моль вещества. Поскольку 50 мл — это в 20 раз меньше, то 0,1 разделим на 20. Получаем 0,005 гидроксида натрия. Столько же и карбоновой кислоты.
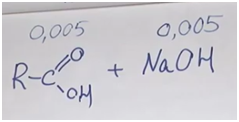
Отсюда легко находим молекулярную массу карбоновой кислоты.
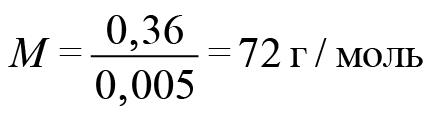
На карбоксильную группу приходится 45. Значит, на углеводородную часть приходится 27. В них поместятся два атома углерода и три атома водорода. Искомая кислота — акриловая.
Электроны
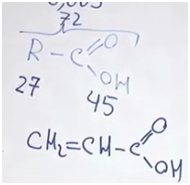
Задача. 0,800000 кг вещества содержит 0,2743 г электронов. Установите формулу вещества, если известно, что масса электрона равна 0,0005486 а.е.м.
Начнем с количества электронов. Масса электронов у нас известна и молярная масса тоже.
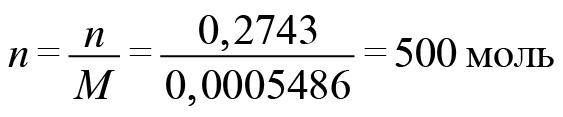
Число протонов равно количеству электронов:
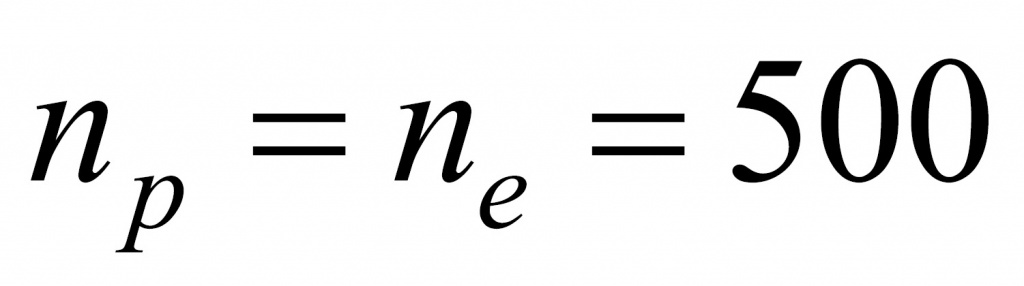
Отсюда находим массу, которая приходится на нейтроны (поскольку с точки зрения школьной химии любое число состоит из протонов, нейтронов и электронов). Обычно мы пренебрегаем массой электронов, но в данной задаче ей пренебрегать не нужно.
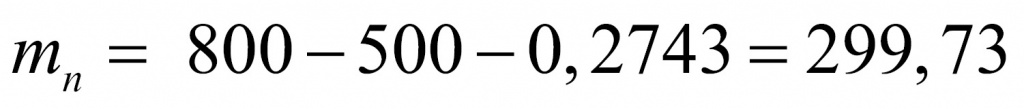
Получается интересное вещество. Обычно в атомах число нейтронов либо равно числу протонов, либо больше. В данном веществе протоны преобладают. Скорее всего, мы имеем дело с водородным соединением. Найдем соотношение между числом протонов и числом нейтронов.
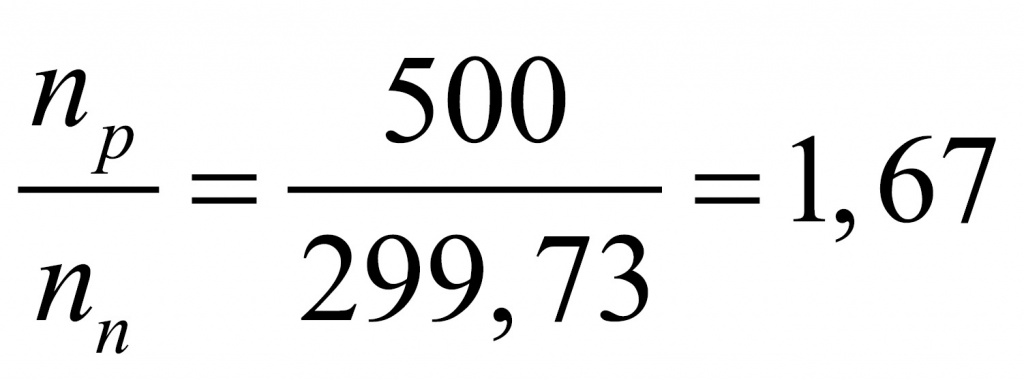
Если мы переберем водородные соединения элементов второго периода, то для метана получим, что в составе метана протонов буде 10, а нейтронов — 6.
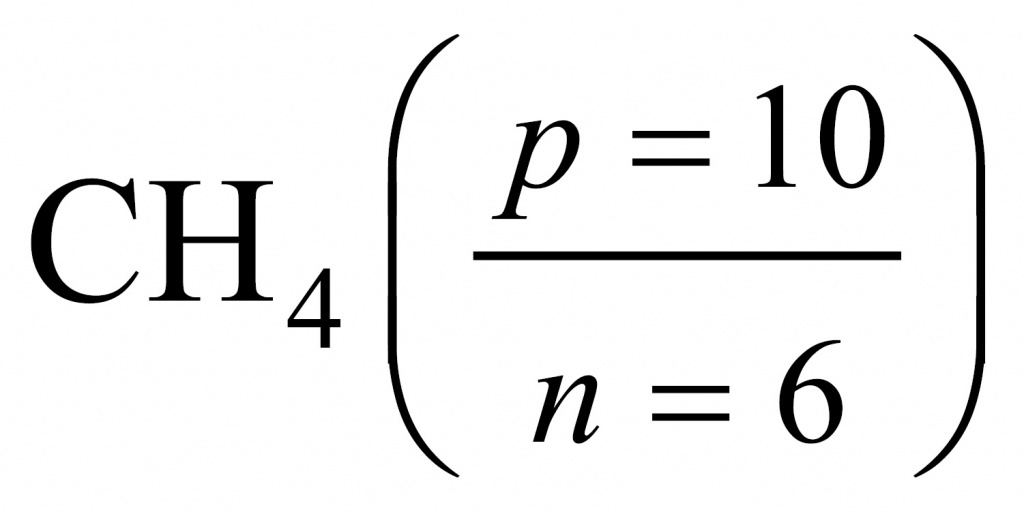
Поделив 10 на 6, получаем 1,67. Следовательно, искомым соединением был родоначальник предельных углеводородов, первый член гомологического ряда — метан.
#ADVERTISING_INSERT#














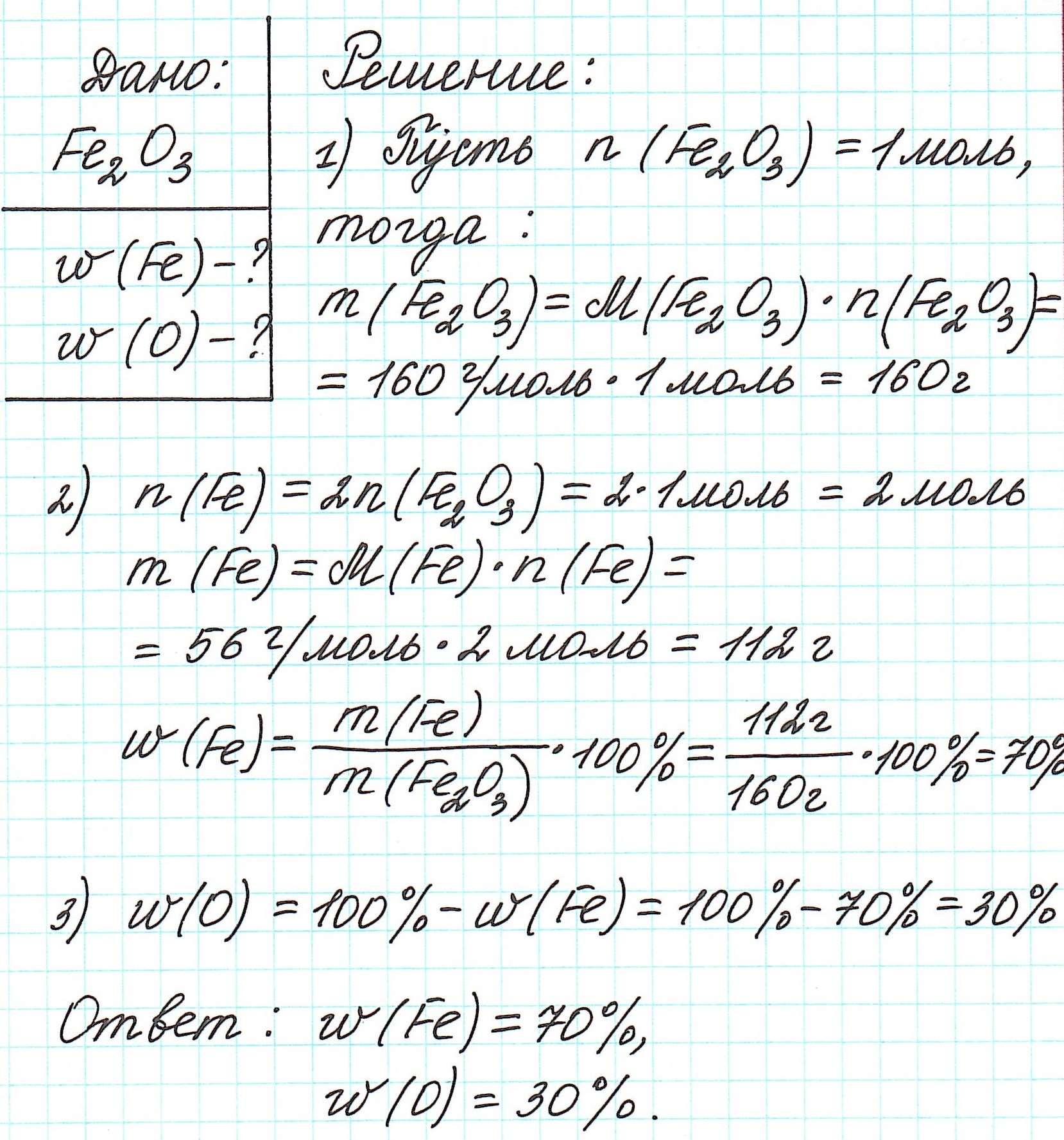
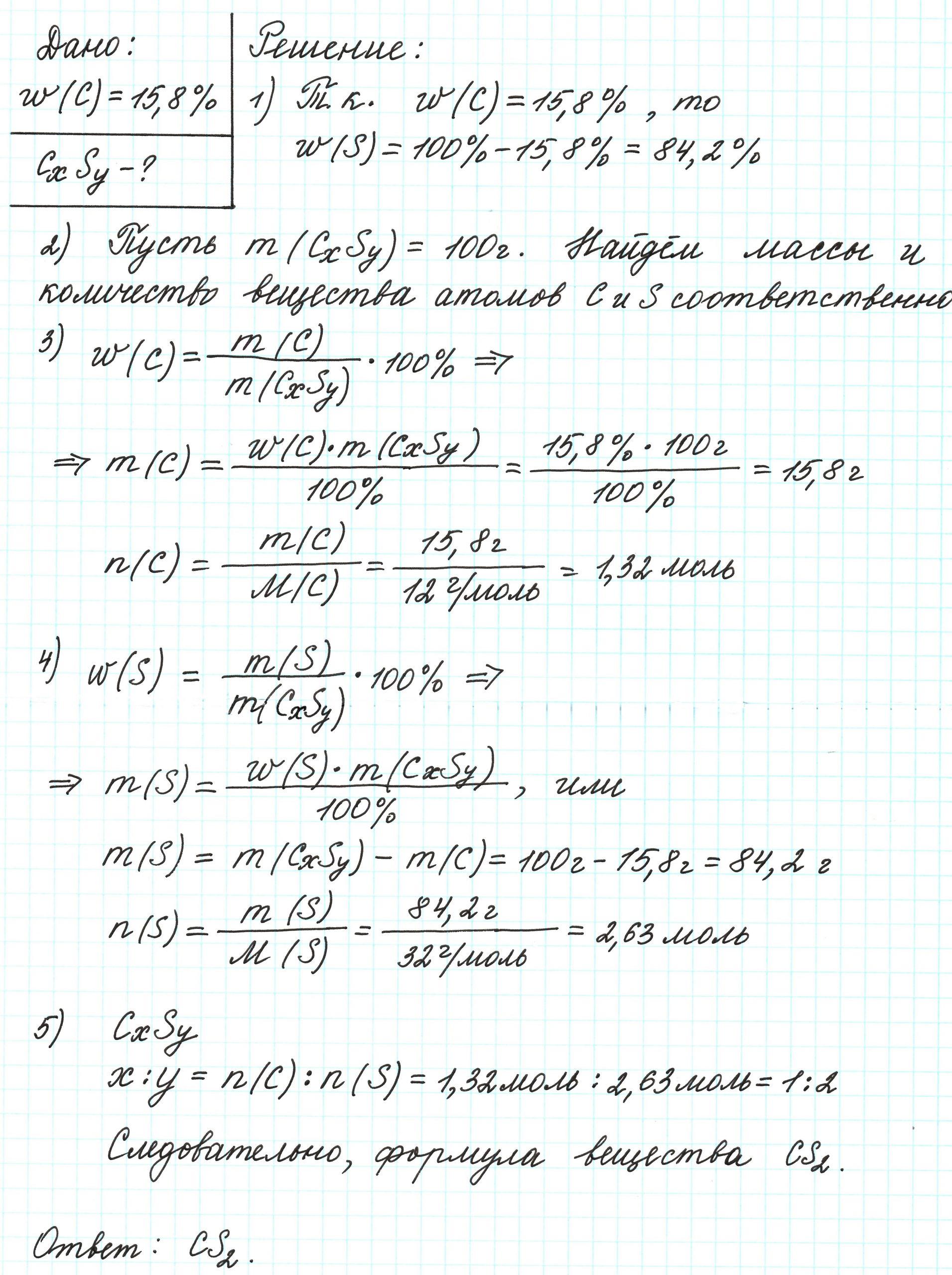


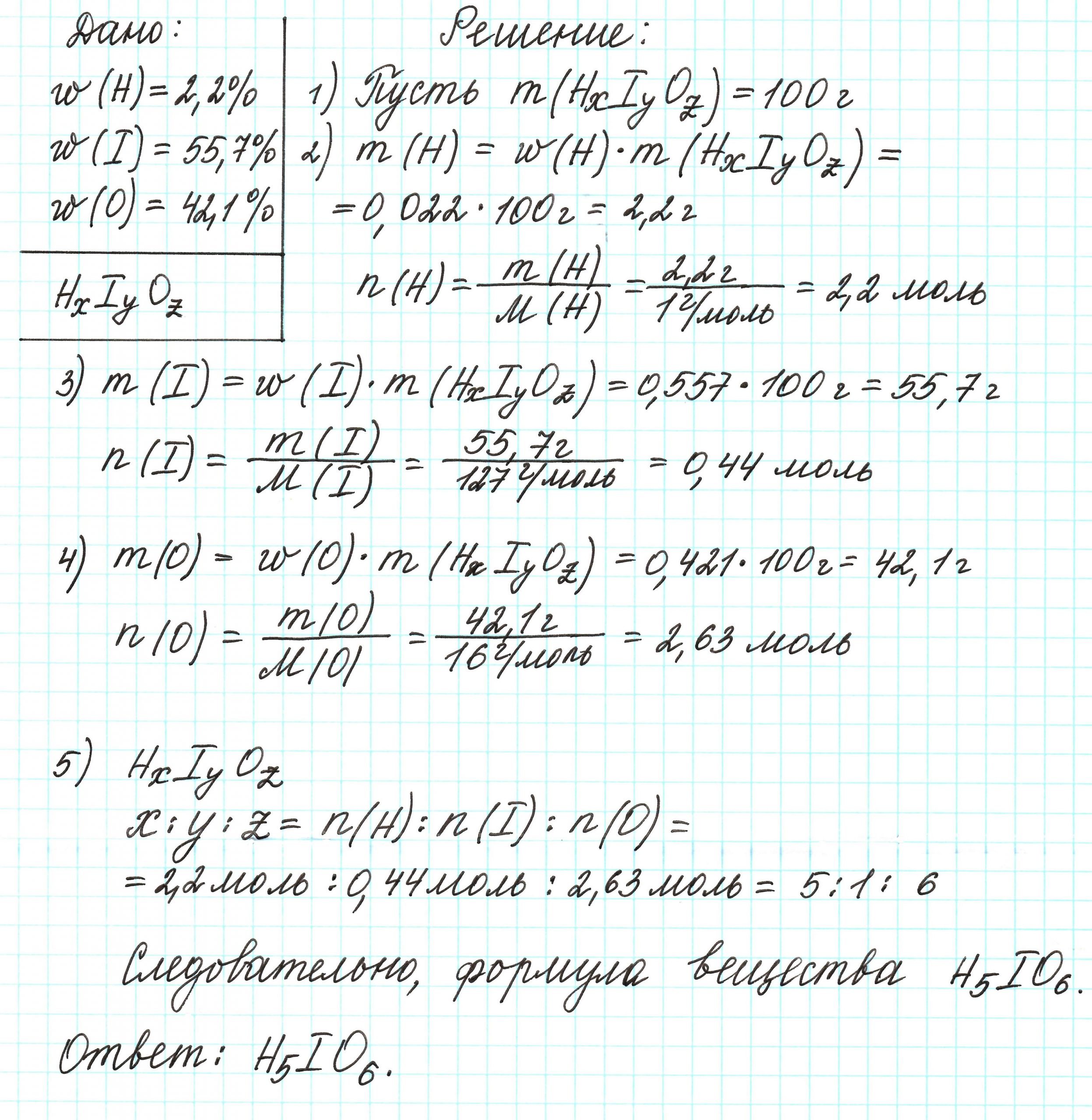


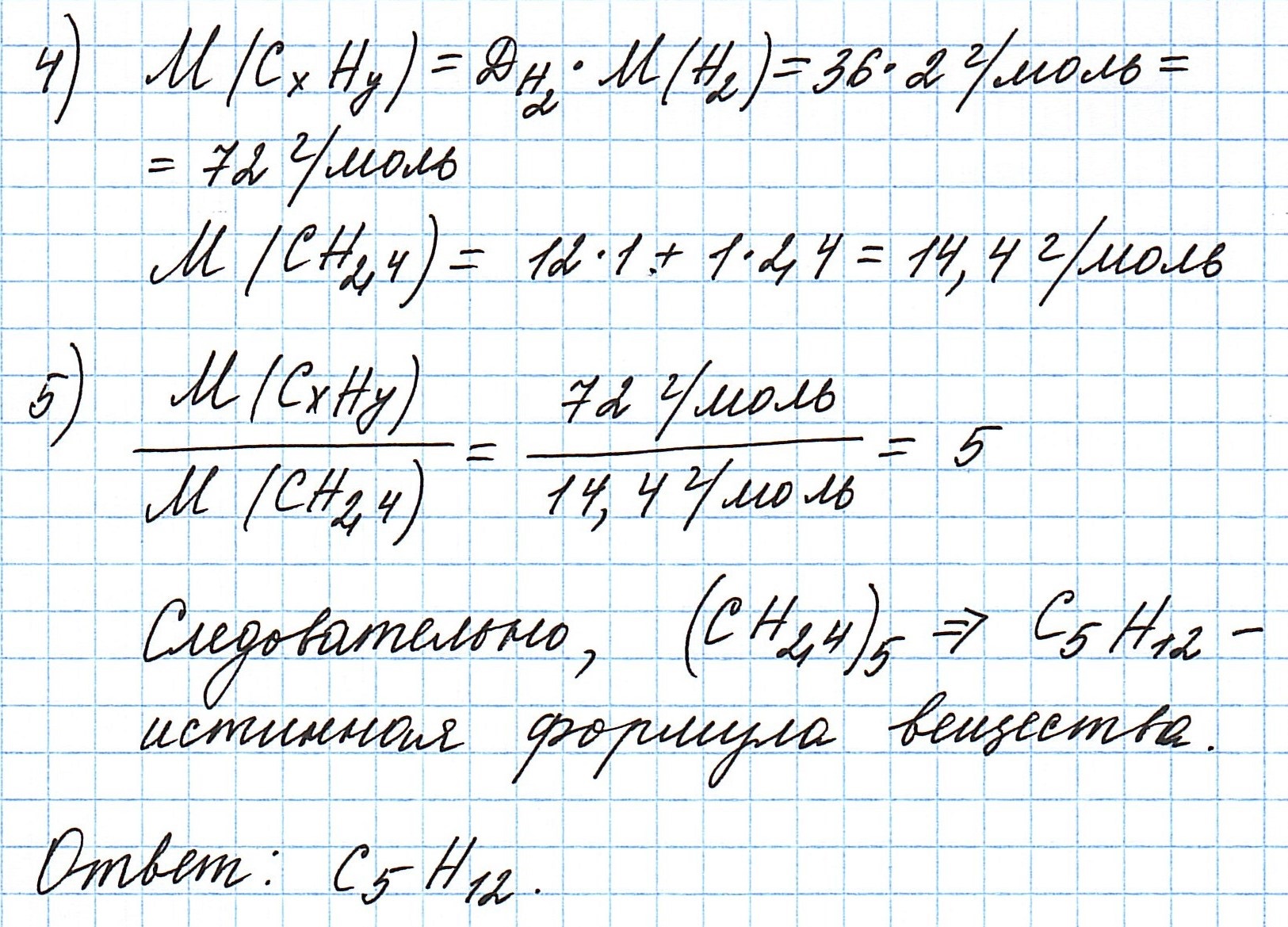









![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)










