Формула оксида фосфора
Определение и формула оксида фосфора
Также существует в аморфном (в виде хлопьев) и стеклообразномсостоянии. При нагревании кристаллический оксид фосфора (V) возгоняется. Плавится только под избыточным давлением, переходит в легкоподвижную жидкость.
Рис. 1. Оксид фосфора (V). Внешний вид.
При дальнейшем нагревании полимеризуется, при охлаждении жидкости образуется стеклообразный продукт. Температура плавления 422oC, кипения 591oC.
Проявляет кислотные свойства, энергично реагирует с водой и щелочами.
Химическая формула оксида фосфора
Химическая формула оксида фосфора (V) P2O5. Она показывает, что в состав данной молекулы входят два атома фосфора (Ar = 31 а.е.м.) и пять атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу оксида фосфора (V):
Mr(P2O5) = 2×Ar(P) + 5×Ar(O);
Mr(P2O5) = 2×31 + 5×16 = 62 + 80 = 142.
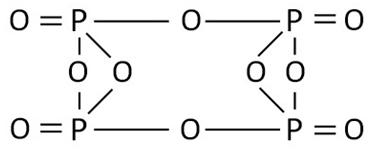
Графическая (структурная) формула оксида фосфора
Структурная (графическая) формула оксида фосфора (V) является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 2). Оксид фосфора (V) может димеризоваться (соответствует химической формуле P4O10) и существование его в такой форме наиболее предпочтительно.
Рис. 2. Графическая формула оксида фосфора (V).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Оксид фосфора((V))
P2O5
образуется при сгорании фосфора:
— белое кристаллическое вещество с молекулярным строением.
Рис. (1). Оксид фосфора((V))
Оксид фосфора((V)) очень гигроскопичен. Он активно присоединяет воду, поэтому применяется для осушки газов. Это типичный кислотный оксид.
Оксид фосфора((V)) реагирует:
- с водой:
- с основными оксидами с образованием соли фосфорной кислоты:
- со щелочами с образованием соли и воды:
Водородное соединение фосфора фосфин PH3 можно получить из фосфидов:
Фосфин — ядовитый газ c неприятным запахом, самовоспламеняющийся на воздухе. Он выделяется при разложении органических веществ. С образованием и окислением фосфина связано такое природное явление, как блуждающие болотные огни.
Источники:
Рис. 1. Оксид фосфора https://cdn.pixabay.com/photo/2021/05/11/07/00/salt-6245098_960_720.jpg
Оксид фосфора (V) – неорганическое вещество, имеет химическую формулу P4O10 и P2O5.
Краткая характеристика оксида фосфора (V)
Модификации оксида фосфора (V)
Физические свойства оксида фосфора (V)
Получение оксида фосфора (V)
Химические свойства оксида фосфора (V)
Химические реакции оксида фосфора (V)
Применение и использование оксида фосфора (V)
Краткая характеристика оксида фосфора (V). Формула оксида фосфора (V):
Оксид фосфора (V) – неорганическое вещество белого цвета.
Оксид фосфора (V) содержит четыре атома фосфора и десять атомов кислорода.
Химическая формула оксида фосфора (V) P4O10 и P2O5. Для простоты записи используют последнюю формулу.
В воде не растворяется, а взаимодействует с ней, образуя кислоты.
Кислотный оксид.
Модификации оксида фосфора (V):
Твердый оксид фосфора (V) склонен к полиморфизму. Существуют три формы-модификации оксида фосфора (V): H, O`, O и G формы-модификации.
| гексагональная H-форма | орторомбическая O`-форма | орторомбическая O-форма | G-форма | |
| Состояние вещества | Кристаллический вид | Кристаллический | Кристаллический вид | Стекловидный вид |
| Характер стабильности формы | Метастабильная форма | Стабильная форма | Метастабильная форма | |
| Другие характеристики | a=0,744 нм, угол = 87°, пространственная группа R3C | a=1,63 нм, b=0,814 нм, c=0,526 нм, пространственная группа Fdd2 | a=0,923 нм, b = 0,718 нм, c = 0,494 нм, пространственная группа Pnam |
H-форма переходит в O-форму при 300-360 °C (процесс заканчивается при 378 °C).
Физические свойства оксида фосфора (V). Масса, цвет, плотность, температура и пр.:
| Наименование параметра: | Значение: |
| Химическая формула оксида фосфора (V) | P4O10 и P2O5 |
| Синонимы и названия иностранном языке | phosphorus (V) oxide (англ.)
тетрафосфора декаоксид (рус.) фосфора пентаоксид (рус.) фосфорный ангидрид (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые тригональные кристаллы |
| Цвет оксида фосфора (V) | белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность H-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2300 |
| Плотность H-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,3 |
| Плотность O`-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3000 |
| Плотность O`-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,0 |
| Плотность O-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2720 |
| Плотность O-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,72 |
| Температура сублимации H-формы, °C | 340,5 |
| Температура кипения O`-формы, °C | 605,5 |
| Температура кипения O-формы, °C | 605,5 |
| Температура плавления H-формы, °C | 420,5 (0,48 МПа) |
| Температура плавления O`-формы, °C | 580,5 (74 кПа) |
| Температура плавления O-формы, °C | 562 (58 кПа) |
| Молярная масса оксида фосфора (V), P2O5, г/моль | 141,94 |
| Молярная масса оксида фосфора (V), P4O10, г/моль | 283,88 |
Примечание:
* — нет данных.
Получение оксида фосфора (V):
Оксид фосфора (V) получают путем сжигания фосфора в избытке кислорода или воздуха.
P4 + 5O2 → P4O10 (t = 34-60 °C).
Готовый продукт состоит из смеси разных форм P4O10.
Химические свойства оксида фосфора (V). Химические реакции оксида фосфора (V):
Оксид фосфора (V) относится к кислотным оксидам.
Химические свойства оксида фосфора (V) аналогичны свойствам кислотным оксидов других неметаллов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида фосфора (V) и белого фосфора:
3P4O10 + 2P4 → 5P4O6 (t = 50 °C).
В результате реакции образуются оксид фосфора (III).
2. реакция оксида фосфора (V) и натрия:
3P4O10 + 16Na → 10NaPO3 + 2Na3P (t = 300-400 °C).
В результате реакции образуются соли – метафосфат натрия и фосфид натрия.
3. реакция оксида фосфора (V) и лития:
3P4O10 + 16Li → 10LiPO3 + 2Li3P (t = 300-400 °C).
В результате реакции образуются соли – метафосфат лития и фосфид лития.
4. реакция оксида фосфора (V) и фтора:
P4O10 + 6F2 → 4POF3 + 3O2 (t = 100 °C).
В результате реакции образуются оксид-трифторид фосфора(V) и кислород.
5. реакция оксида фосфора (V) с водой:
P4O10 + 6H2O → 4H3PO4 или P2O5 + 3H2O → 2H3PO4,
P4O10 + 2H2O → 4HPO3 или P2O5 + H2O → 2HPO3.
В результате реакции образуются кислоты: в первом случае – ортофосфорная кислота, во втором – метафосфорная кислота.
6. реакция оксида фосфора (V) с оксидом кальция:
CaO + P2O5 → Ca(PO3)2,
2CaO + P2O5 → Ca2P2O7,
3CaO + P2O5 → Ca3(PO4)2 (t°).
В результате реакции образуется соль, в первом случае – метафосфат кальция, во втором – дифосфат кальция, в третьем – фосфат кальция.
7. реакция оксида фосфора (V) с оксидом натрия:
3Na2O + P2O5 → 2Na3PO4.
В результате реакции образуется соль – ортофосфат натрия.
8. реакция оксида фосфора (V) с оксидом бора:
2B2O3 + P4O10 → 4BPO4 (t°).
В результате реакции образуется соль – фосфат бора.
9. реакция оксида фосфора (V) с гидроксидом натрия:
P4O10 + 12NaOH → 4Na3PO4 + 6H2O или P2O5 + 6NaOH → 2Na3PO4 + 3H2O.
В результате реакции образуется соль – ортофосфат натрия и вода. Гидроксид натрия – разбавленный раствор.
10. реакция оксида фосфора (V) с плавиковой кислотой:
P4O10 + 3HF → POF3 + 3HPO3 (t = 120-170 oC).
В результате химической реакции получается оксид-трифторид фосфора и метафосфорная кислота.
11. реакция оксида фосфора (V) с бромистым водородом (бромоводородом):
P4O10 + 3HBr → POBr3 + 3HPO3 (t = 200 oC).
В результате химической реакции получается оксид-трибромид фосфора и метафосфорная кислота.
12. реакция оксида фосфора (V) с азотной кислотой:
4HNO3 + P4O10 → 2N2O5 + 4HPO3 или 2HNO3 + P2O5 → N2O5 + 2HPO3 (t = -10 oC).
В результате химической реакции получается оксид азота и метафосфорная кислота.
13. реакция оксида фосфора (V) с ортофосфорной кислотой:
P4O10 + 8H3PO4 → 6H4P2O7 (t = 80-100 oC).
В результате химической реакции получается дифосфорная кислота. Ортофосфорная кислота – концентрированный раствор.
14. реакция оксида фосфора (V) с пероксидом водорода:
P4O10 + 8H2O2 → 4H3PO2(O2)2 + 2H2O (t = -20 oC).
В результате химической реакции получается дипероксодиоксофосфата водорода и вода. Пероксид водорода – безводный.
15. реакции оксида фосфора (V) с органическими веществами:
Оксид фосфора (V) реагирует с амидами, превращая их в нитрилы, а также со спиртами, эфирами, фенолами и другими органическими соединениями, при этом образуются фосфорорганические соединения.
Применение и использование оксида фосфора (V):
Оксид фосфора (V) используется как осушитель газов и жидкостей в органическом синтезе.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид фосфора (V) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида фосфора (V)
реакции с оксидом фосфора (V)
Коэффициент востребованности
9 488
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
4P + 5O2 → 2P2O5
Химические свойства
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2HNO3 → 2HPO3 + N2O5
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
P2O5 + 3H2O → 2H3PO4
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
P2O5 + 2H2O → 2H4P2O7
P2O5 + H2O → HPO3
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями.
Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении):
P2O5 + 3BaO → Ba3(PO4)2
Admin
…
Фосфин (PH3)
Способы получения фосфина
Прямым синтезом PH3 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
- Реакция диспропорционирования фосфора в щелочах:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
- Разложение солей фосфония (Температура выше 80ºС):
P4I ↔ HI+ PH3↑
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.
PH3— Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами –
окислителями:
PH3 + 8H2SO4(конц) = H3PO4 + 8SO2↑ + 3H2O
PH3 + 8HNO3(конц. гор) = H3PO4 + 8NO2↑ + 4H2O
- С безводными кислотами образует соли:
HI+ PH3↑ = P4I
- Окисляется кислородом. При Т ~ 150ºС самовозгорается:
РН3 + 2О2 = P2O5 + H2O (Н3РО4)
Практического значения фосфин не имеет.
Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
2P + 3Mg → Mg3P2
2P + 3Ca → Ca3P2
P + 3Na → Na3P
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия
фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
4Р + 3О2 = 2Р2О3
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде
димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Р2О3 + ЗН2О =2H3PO3
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3вгорячей воде:
2Р2О3 + 6Н2О = РН3 + ЗH3PO4
- При взаимодействии Р2О3 с щелочами образуются соли фосфористой кислоты:
Р2О3 + 4NaOH = 2Na2HPO3 + Н2О
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Р2О3 + О2 = Р2О5
Окисление галогенами:
Р2О3 + 2Cl2 + 5Н2О = 4HCl + 2H3PO4
Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
4Р + 5О2 = 2Р2О5
Физические свойства фосфорного ангидрида
При комнатной
температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде
димеров Р4О10.
Очень гигроскопична, при
соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и
водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
Р2О5 + Н2О = 2HPO3 метафосфорная
Р2О5 + 2Н2О = Н4Р2О7 пирофосфориая
(дифосфорная)
Р2О5 + ЗН2О = 2H3PO4 ортофосфорная
- с основными оксидами, с образованием фосфатов
Р2О5 + ЗВаО = Ва3(PO4)2
- с щелочами, с образованием средних и кислых солей
Р2О5 + 6NaOH = 2Na3PO4 + ЗН2О
Р2О5 + 4NaOH = 2Na2HPO4 + Н2О
Р2О5 + 2NaOH = 2NaH2PO4 + Н2О
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду. Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Р2О5 + 2HNО3 = 2HPO3 + N2О5
Р2О5 + 2НСlО4 = 2HPO3 + Сl2О7
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
Видеоопыт Взаимодействие оксида фосфора с водой
Фосфорные кислоты
Фосфор
образует только 2 устойчивых оксида, в которых он находится в степенях
окисления +5 и +3. Однако существует большое число кислот, в которых фосфор
имеет валентность равную V (пять ковалентных связей) и степени окисления +5,
+4, +3, +1.
Строение
наиболее известных кислот выражается следующими формулами:
Наибольшее
практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая
(фосфористая) кислоты.
Фосфористая кислота ( H3PO3)
Способы получения фосфористой кислоты
- Реакция Р2О3 с водой:
Р2О3 + ЗН2О =2H3PO3
- Гидролиз галогенидов фосфора (III):
PCl3 + ЗН2О = H3PO3+ 3HCl
- Окисление белого фосфора хлором:
2Р + 3Cl2 + 6Н2О = 2H3PO3+ 6HCl
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты H3PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой
таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной
температуре H3PO3 –
кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора
в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является
слабой кислотой.
- Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
- Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
H2HPO3 + H2HPO3 = H3PO4 + PH3
Кислота и ее соли являются сильными восстановителями:
- Реагируют с сильными окислителями:
H3PO3 + Cl2 + Н2О = H3PO4 + 2HCl
5H3PO3 + 2KMnO4 + 3H2SO4 → 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
H3PO3 + HgCl2 + H2O → H3PO4 + Hg + 2HCl
- Реагируют с более слабыми окислителями:
H3PO3 + 2AgNO3 + Н2О = H3PO4 + 2Ag↓ + 2HNO3
- В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
H2HPO3 + 3Zn + 3H2SO4 = 3ZnSO4 + PH3 + 3Н2О
- При нагревании водного раствора Н3РO3окисляется до H3PO4 с выделением водорода:
H3PO3 + Н2О = H3PO4 + Н2
Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
- Взаимодействие фосфористой кислоты с щелочами:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
- взаимодействие фосфористой кислоты с металлами с выделением Н2
Н2[НРО3] + Ca = Ca[HРО3] + Н2
- взаимодействие фосфористой кислоты с оксидами металлов
Н2[НРО3] + CaO = Ca[HРО3] + Н2O
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
P4 + 8NaOH(конц) + 4H2O = Na2[HРО3] + 6H2
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
PCl3 + 5NaOH(разб) = Na2[HРО3] + 3NaCl + 2H2O
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо
растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты
плохо растворимы.
Химические свойства фосфитов
Имеют
химические свойства, характерные для солей
Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
Са3(РO4)2 + 3H2SO4 = 2Н3РO4 + 3CaSO4↓
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
ЗР + 5HNO3 + 2Н2О = ЗН3РO4 + 5NO↑
- Взаимодействием фосфорного ангидрида с водой:
Р2О5 + ЗН2О = 2H3PO4
Физические свойства, строение фосфорной кислоты
При обычной
температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С)
кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с
водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует
сиропообразную, вязкую жидкость.
Степень
окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При
нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в
метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При
добавлении AgNO3 к кислотам образуются осадки
различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видео Качественная реакция на фосфат-ион
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы
и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
Н3РO4 → Н+ + Н2РO4—
По 2-й и 3-й ступеням диссоциация протекает в ничтожно
малой степени:
Н2РO4— → Н+ + НРO42-
НРO42- → Н+ + РO43-
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
2Н3РO4 + 6Na = 2Na3РO4 + 3H2
- с основными оксидами:
2Н3РO4 + ЗСаО = Са3(РO4)2 + ЗН2О
2H3PO4 + 3MgO = Mg3(PO4)2 + 3H2O
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
Н3РO4 + NaOH = NaH2PO4 + Н2О
Н3РO4 + 2NaOH = Na2HPO4 + 2Н2О
Н3РO4 + 3NaOH = Na3PO4 + ЗН2О
- с аммиаком образует соли аммония:
Н3РO4 + NH3 = NH4H2PO4
Н3РO4 + 2NH3 = (NH4)2HPO4
- Вытесняет более слабые кислоты из их солей
(карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
- При нагревании H3PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
В отличие от
аниона NO3— в азотной
кислоте, анион РO43- окисляющим
действием не обладает.
Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают
кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства
ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO43- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO42- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4— | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.
- Соли щелочных металлов подвержены гидролизу:
Na3РO4 + Н2О = Na2HPO4 + NaOH
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
NaH2PO4 = NaPO3 + H2O
Na2HPO4 = Na4P2O7 +
H2O
(NH4)3PO4 = 3NH3 + H2O
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.