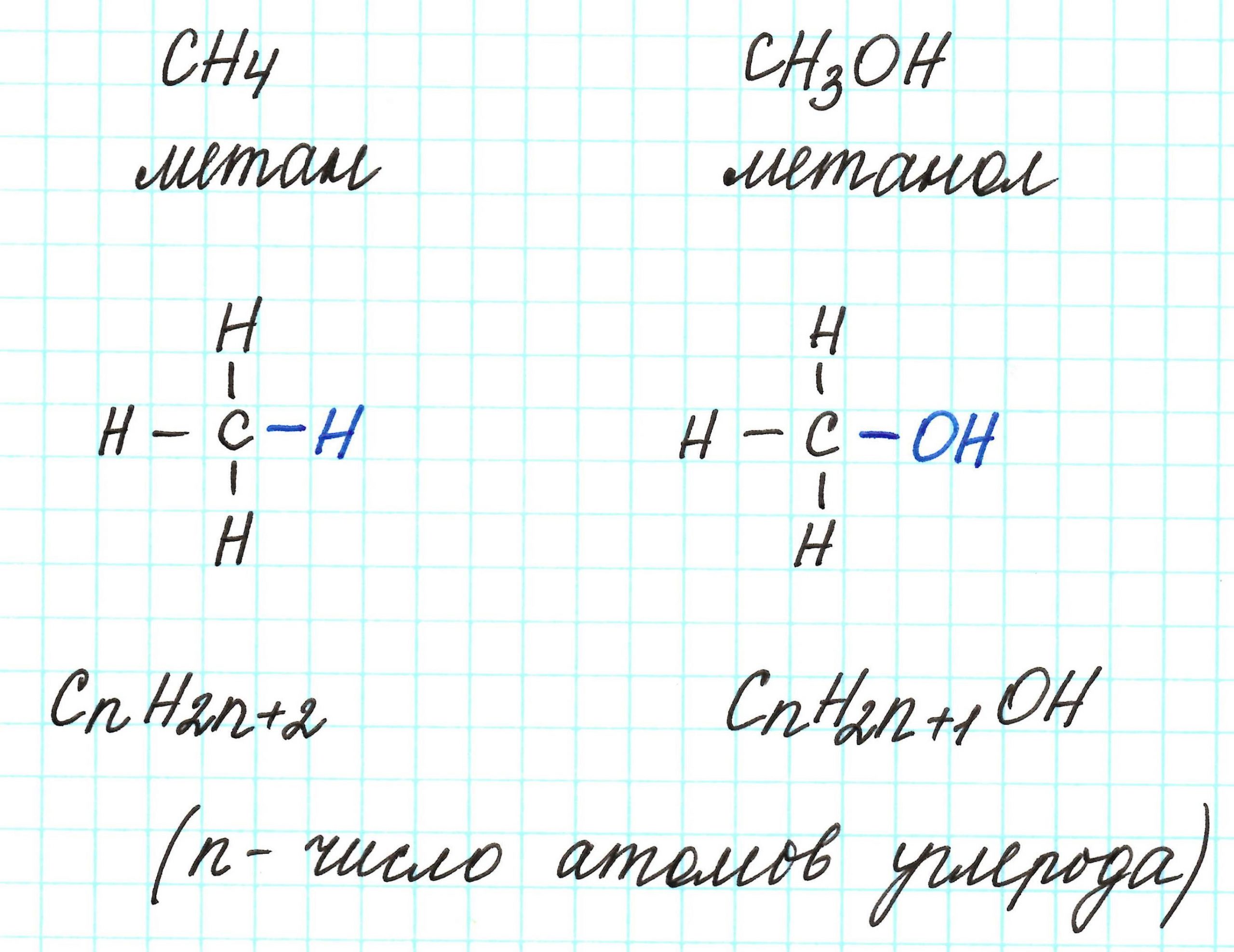
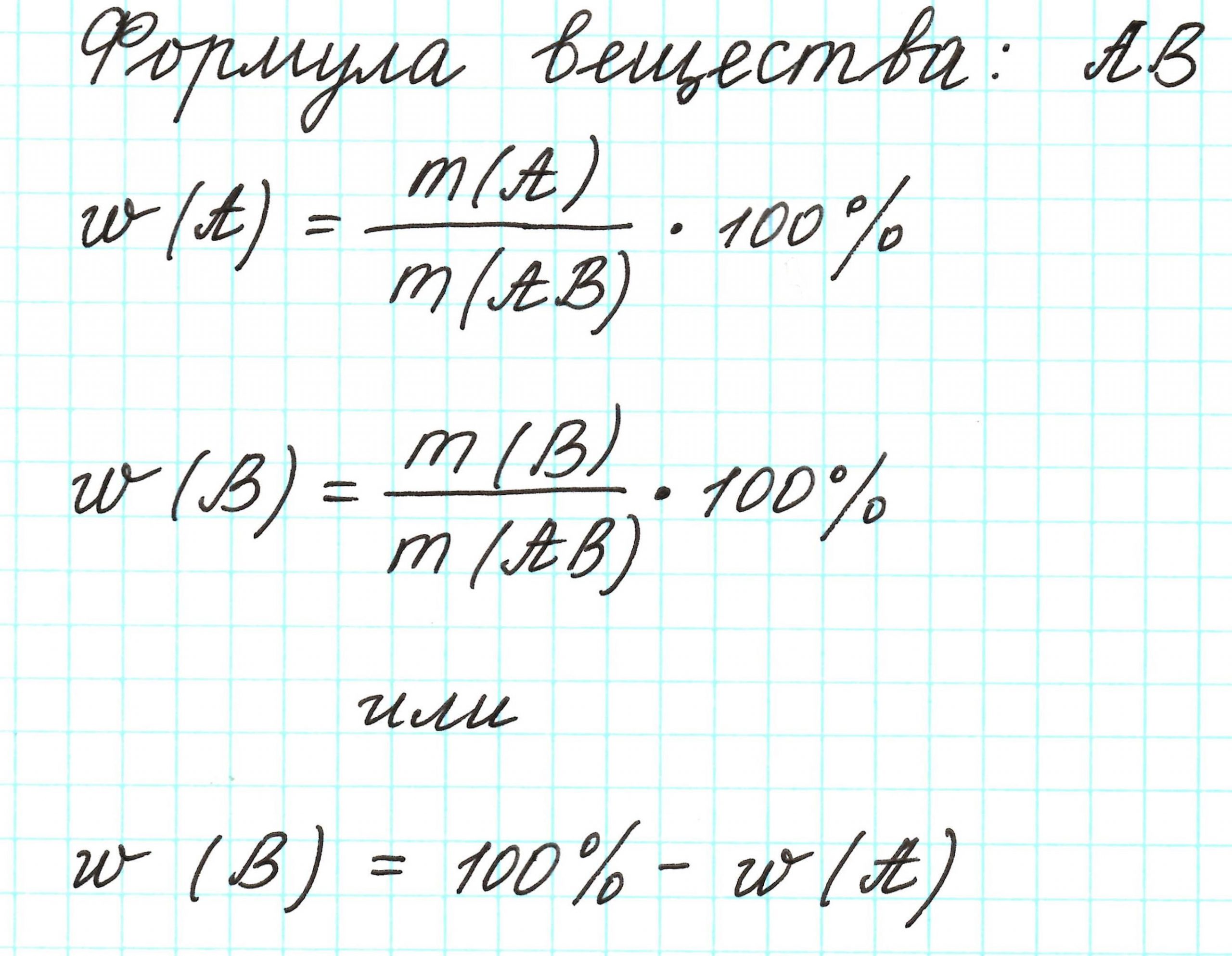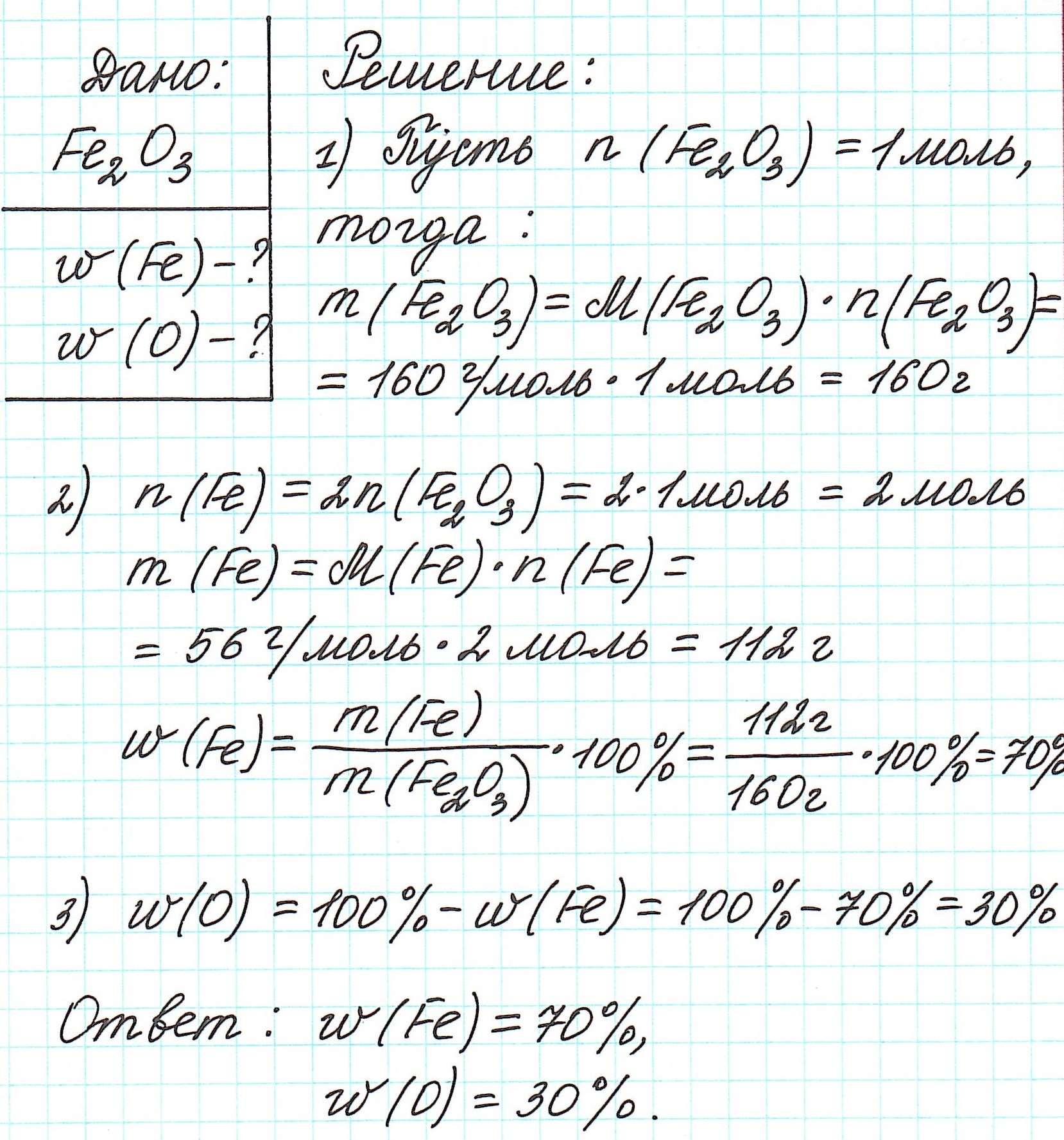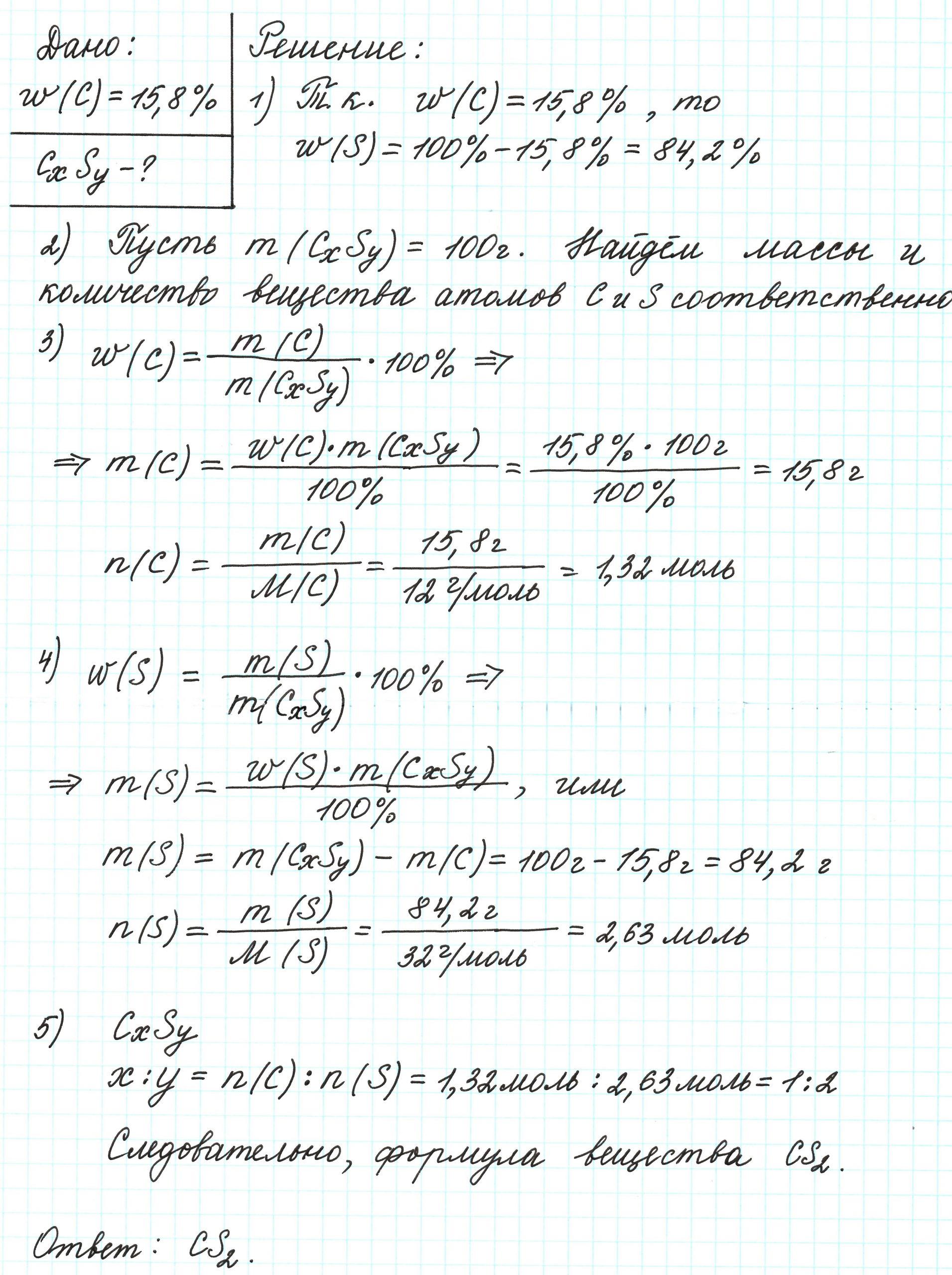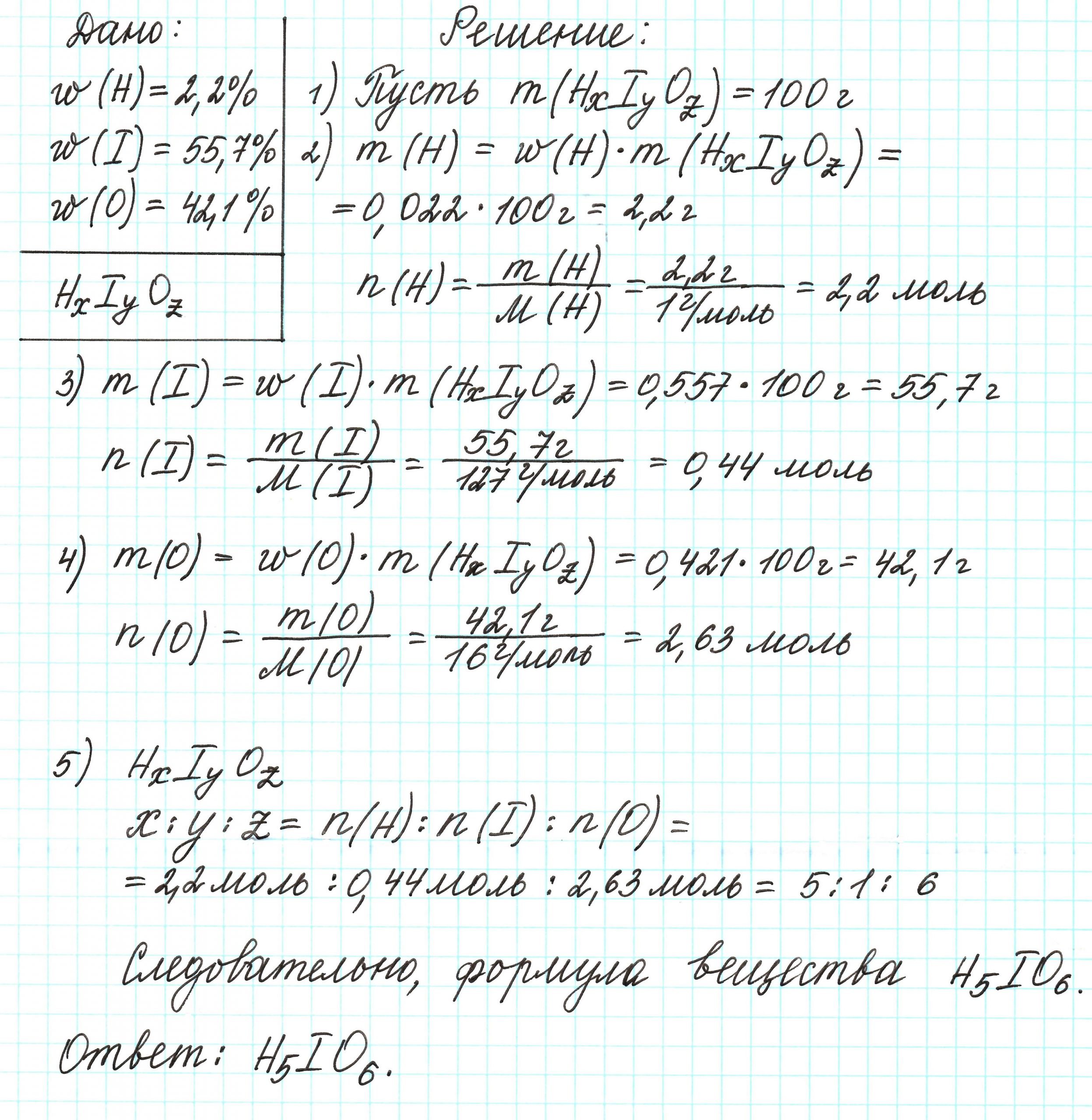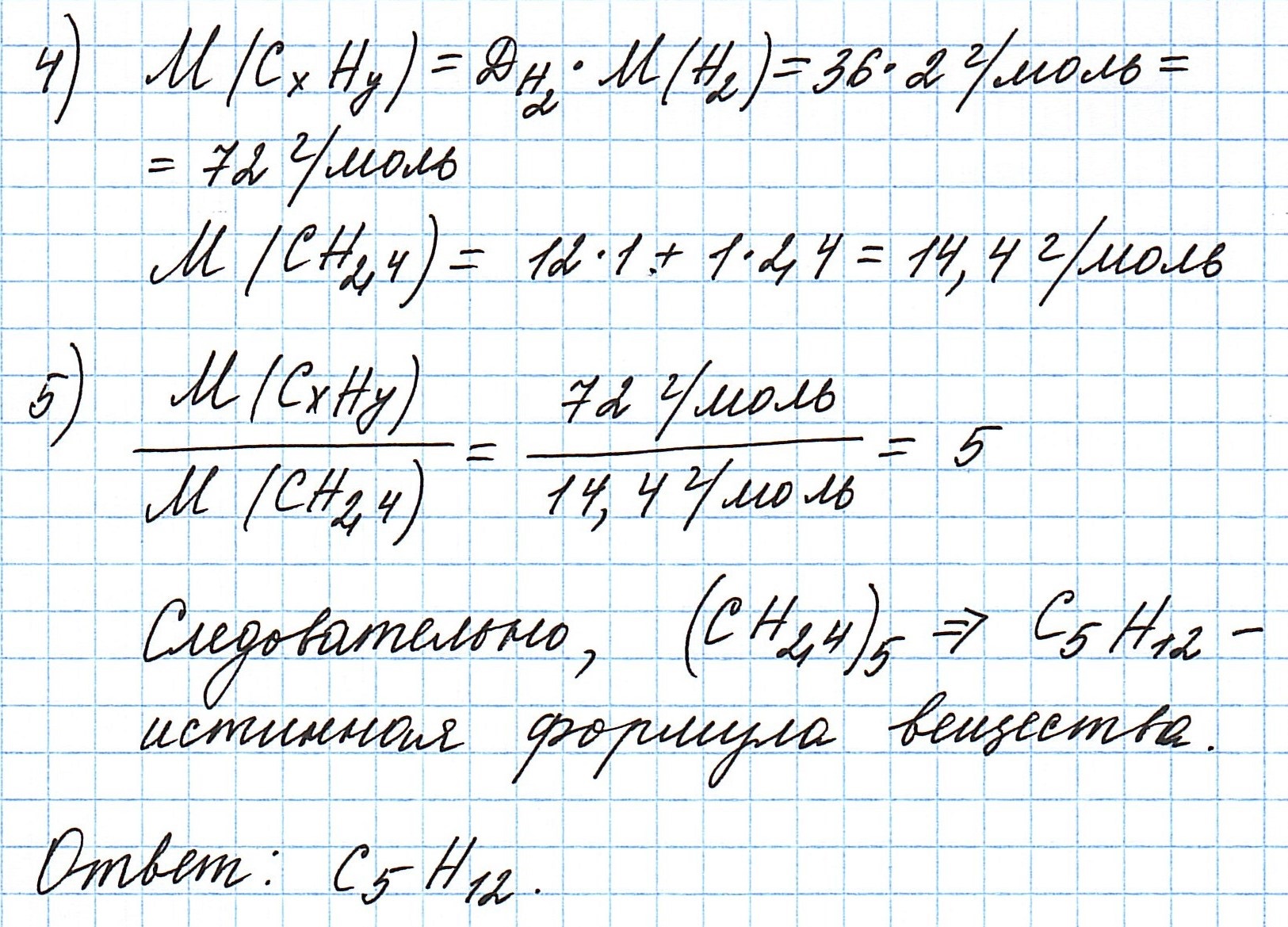Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
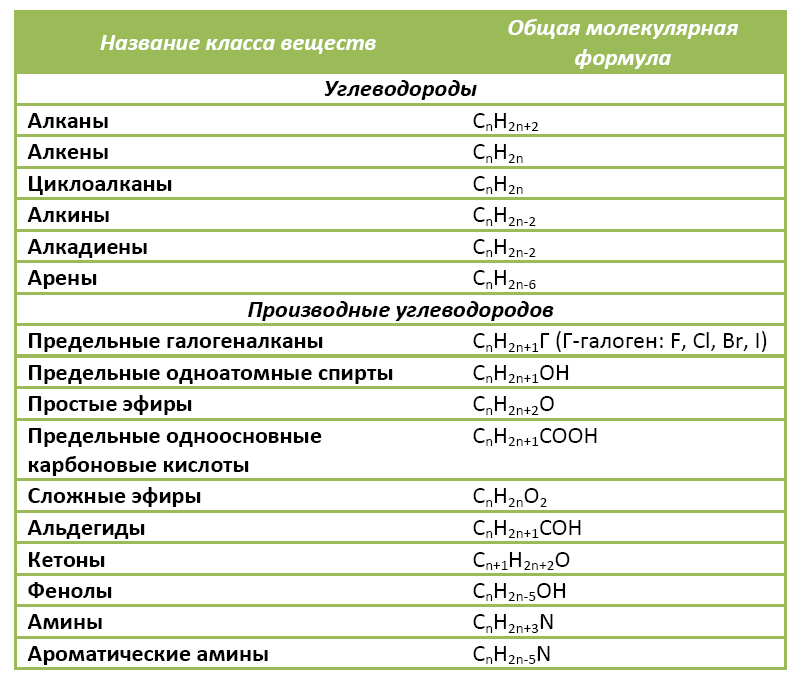
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Загрузить PDF
Загрузить PDF
Эмпирическая формула химического соединения представляет собой простейшую запись его состава. Эмпирическую формулу вещества можно определить по массе каждого входящего в него элемента, по весовым процентам элементов или по молекулярной формуле соединения.
-
1
Посмотрите, что дано. Если дан элементный состав неизвестного соединения в процентах, а не в граммах, следует предположить, что имеется ровно 100,0 граммов этого вещества.
- Ниже приведена процедура определения эмпирической формулы в том случае, если элементный состав дан в процентах. Если состав неизвестного соединения дан в граммах, перейдите к разделу «Использование веса в граммах».
- Пример: определите эмпирическую формулу соединения, которое состоит из 29,3% Na (натрий), 41,1% S (сера) и 29,6% O (кислород).
-
2
Определим количество граммов каждого элемента. Если мы предположим, что имеется 100 граммов неизвестного соединения, то количество граммов каждого элемента соответствует его процентному содержанию.
- Пример: в 100 граммах неизвестного вещества содержится 29,3 г Na, 41,1 г S и 29,6 г O.
-
3
Переведите массу каждого элемента в моли. Массу каждого входящего в соединение элемента следует перевести в моли. Для этого массу необходимо умножить на 1 моль и разделить на атомный вес соответствующего элемента.
- Проще говоря, следует разделить массу каждого элемента на его атомный вес.
- Учтите также, что при данных расчетах необходимо брать не менее четырех значимых цифр.
-
Пример: для соединения, которое состоит из 29,3 г Na, 41,1 г S и 29,6 г O, получаем:
- 29,3 г Na * (1 моль Na / 22,99 г Na) = 1,274 моль Na
- 41,1 г S * (1 моль S / 32,06 г S) = 1,282 моль S
- 29,6 г O * (1 моль O / 16,00 г O) = 1,850 моль O
-
4
Разделите найденное число молей каждого элемента на наименьшее количество молей. Следует найти стехиометрическое соотношение между элементами — это означает, что необходимо вычислить относительные доли каждого элемента по сравнению с остальными элементами, входящими в состав соединения. Для этого разделите каждое количество молей на наименьшее число молей.
-
Пример: наименьшее число молей в данном соединении составляет 1,274 моль (количество молей Na, натрия).
- 1,274 моль Na / 1,274 моль = 1,000 Na
- 1,282 моль S / 1,274 моль = 1,006 S
- 1,850 моль O / 1,274 моль = 1,452 O
-
Пример: наименьшее число молей в данном соединении составляет 1,274 моль (количество молей Na, натрия).
-
5
Умножьте полученные величины на коэффициент так, чтобы получились близкие к целым числа. Соотношение молей каждого элемента может не равняться целому числу. Это не проблема в случае малых отклонений от целого числа, которые не превышают одну десятую. Однако в случае более значительных отклонений следует умножить эти величины на один и тот же множитель, чтобы они стали близки к целым числам.
- Если соответствующая величина для одного элемента близка к 0,5, умножьте каждое значение на 2. Схожим образом, если для одного элемента число близко к 0,25, умножьте каждую величину на 4.
-
Пример: поскольку количество кислорода (O) близко к 1,5, чтобы приблизить его к целому значению, необходимо умножить каждую величину на “2”.
- 1,000 Na * 2 = 2,000 Na
- 1,006 S * 2 = 2,012 S
- 1,452 O * 2 = 2,904 O
-
6
Округлите полученные величины до ближайших целых чисел. Даже после последнего шага количество молей каждого элемента может слегка отличаться от целого числа. Поскольку в эмпирических формулах не используются десятичные дроби, необходимо округлить каждое значение до ближайшего к нему целого числа.
-
Пример: для определенных на предыдущем шаге значений получаем:
- 2,000 Na можно записать как 2 Na;
- 2,012 S можно округлить до 2 S;
- 2,904 O можно округлить до 3 O.
-
Пример: для определенных на предыдущем шаге значений получаем:
-
7
Запишите окончательный ответ. Переведите соотношение элементов в стандартную запись, которая используется для эмпирических формул. Количество каждого элемента в молекуле соединения записывается в виде подстрочного числа справа от символа соответствующего элемента (в случае единицы это число опускается).
- Пример: если соединение состоит из 2 частей Na, 2 частей S и 3 частей O, его эмпирическая формула записывается следующим образом: Na2S2O3
Реклама
-
1
Убедитесь, что количество элементов дано в граммах. Если элементный состав неизвестного соединения дан в граммах, используйте приведенные ниже шаги.
- С другой стороны, если вместо граммов даны проценты, перейдите к разделу «Использование весовых процентов».
- Пример: определите эмпирическую формулу неизвестного соединения, которое состоит из 8,5 г Fe (железо) и 3,8 г O (кислород).
-
2
Переведите массу каждого элемента в моли. Чтобы определить долю каждого элемента в молекуле соединения, необходимо перевести количество каждого элемента из граммов в моли. Для этого разделите массу каждого элемента в граммах на его атомный вес.
- При более формальном подходе следует умножить массу в граммах на один моль и разделить на атомный вес.
- Учтите, что для достаточной точности атомный вес необходимо округлить до четырех значимых цифр.
-
Пример: для 8,5 г Fe и 3,8 г O получаем:
- 8,5 г Fe * (1 моль Fe / 55,85 г Fe) = 0,152 моль Fe
- 3,8 г O * (1 моль O / 16,00 г O) = 0,238 моль O
-
3
Разделите количество молей каждого элемента на наименьшее значение. Определите, как каждый элемент соотносится с другими элементами, входящими в данное соединение. Для этого необходимо найти минимальное количество молей и разделить на него число молей каждого элемента.
-
Пример: для нашего случая минимальное количество молей составляет 0,152 (количество Fe, железа).
- 0,152 моль Fe / 0,152 моль = 1,000 Fe
- 0,238 моль O / 0,152 моль = 1,566 O
-
Пример: для нашего случая минимальное количество молей составляет 0,152 (количество Fe, железа).
-
4
Умножьте полученные значения, чтобы найти числа, близкие к целым. Часто количество молей не равно целому числу. Если отклонение от целого числа не превышает одной десятой, такое число можно просто округлить до целого. Однако в случае более значительного отклонения следует умножить каждое значение на такой коэффициент, чтобы получились близкие к целым числа.
- Например, если количество одного элемента превышает целое число примерно на 0,25, умножьте все значения на 4. Если же отклонение составляет около 0,5, умножьте все величины на 2.
-
Пример: поскольку соотношение для кислорода составляет 1,566, необходимо умножить оба соотношения на 2.
- 1,000 Fe * 2 = 2,000 Fe
- 1,566 O * 2 = 3,132 O
-
5
Округлите ответ до ближайшего целого числа. После того как соотношения для всех элементов не будут отличаться от целых чисел более чем на одну десятую, округлите их.
- Пример: количество Fe можно записать как 2. Количество O можно округлить до 3.
-
6
Запишите ответ. Найденное соотношение элементов следует переписать в форме, принятой для эмпирических формул. Полученные целые числа (за исключением 1) необходимо записать в виде подстрочных символов справа от символа соответствующего элемента.
- Пример: для соединения 2 частей Fe и 3 частей O эмпирическая формула имеет следующий вид: Fe2O3
Реклама
-
1
Определите, можно ли сократить подстрочные числа. Если дана молекулярная формула неизвестного соединения и требуется определить эмпирическую формулу, проверьте, нельзя ли сократить количество атомов. Посмотрите на подстрочные числа возле каждого элемента. Если все они имеют общий делитель (отличный от 1), понадобится несколько шагов, чтобы определить эмпирическую формулу соединения.
- Пример: C8H16O8
- С другой стороны, если подстрочные числа не имеют общего делителя, молекулярная формула является эмпирической формулой.
- Пример: Fe3O2H7
-
2
Найдите наибольший общий делитель подстрочных чисел. Выпишите делители для каждого подстрочного числа и определите максимальный общий делитель.
-
Пример: соединение C8H16O8 имеет подстрочные числа «4» and «8».
- Число 8 имеет следующие делители: 1, 2, 4, 8
- Число 16 имеет следующие делители: 1, 2, 4, 8, 16
- Число 8 является наибольшим общим делителем.
-
Пример: соединение C8H16O8 имеет подстрочные числа «4» and «8».
-
3
Разделите каждое подстрочное число на наибольший общий делитель. Чтобы привести каждое подстрочное число к простейшей форме, необходимо разделить его на только что найденный наибольший общий делитель.
-
Пример: для C8H16O8 получаем:
- Делим подстрочное число 8 на наибольший общий делитель 8: 8 / 8 = 1
- Делим подстрочное число 16 на наибольший общий делитель 8: 16 / 8 = 2
-
Пример: для C8H16O8 получаем:
-
4
Запишите ответ. Замените первоначальные подстрочные числа их упрощенными значениями. Таким образом вы определите эмпирическую формулу соединения по его молекулярной формуле.
- Помните, что если подстрочное число равно 1, то его обычно не записывают.
- Пример: C8H16O8 = CH2O
Реклама
Об этой статье
Эту страницу просматривали 7903 раза.
Была ли эта статья полезной?
-
Типы задач в задании С5.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
к оглавлению ▴
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол С2Н6О С:Н:О = 2:6:1 С2Н6О Бутен С4Н8 С:Н = 1:2 СН2 Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29 - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём. - Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы CnH2n+2 — Алкены CnH2n CnH2n+1–CH=CH2 Алкины CnH2n−2 CnH2n+1–C≡CH Диены CnH2n−2 — Гомологи бензола CnH2n−6 С6Н5–СnH2n+1 Предельные одноатомные спирты CnH2n+2O CnH2n+1–OH Многоатомные спирты CnH2n+2Ox CnH2n+2−x(OH)x Предельные альдегиды CnH2nO Кетоны CnH2nO O // CnH2n+1– C– O–CmH2m+1 Фенолы CnH2n−6O С6Н5(СnH2n)–OH Предельные карбоновые кислоты CnH2nO2 Сложные эфиры CnH2nO2 O // CnH2n+1– C– O–CmH2m+1 Амины CnH2n+3N СnH2n+1NH2 Аминокислоты (предельные одноосновные) CnH2n+1NO2 O // NH2– CH– C– OH C nH 2n+1
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль. - При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль. - Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду. - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.ν(C) = 0,7 моль
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль. - Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов. - Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2. - Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул N2 и его молярная масса 28 г/моль):
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Ответ: С4Н8.
-
Пример 7.
Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(C) = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.
ν(H) = 0,7 • 2 = 1,4 моль. - Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы С и Н.m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 гМасса всего вещества 9,8 г.
m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. - C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Ответ: С2Н7N.
-
Пример 8.
Вещества содержит С, Н, О и S. При сгорании 11 г его выделилось 8,8 г CO2, 5,4 г Н2О, а сера была полностью переведена в сульфат бария, масса которого оказалась равна 23,3 г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
ν(CO2) = m/M = 8,8/44 = 0,2 моль.
ν(C) = 0,2 моль.
ν(Н2О) = m / M = 5,4 / 18 = 0,3 моль.
ν(H) = 0,6 моль.
ν(BaSO4) = 23,3 / 233 = 0,1 моль.
ν(S) = 0,1 моль. - Рассчитываем предполагаемую массу кислорода в исходном веществе:
m(C) = 0,2 • 12 = 2,4 г
m(H) = 0,6 • 1 = 0,6 г
m(S) = 0,1 • 32 = 3,2 г
m(O) = mвещества − m(C) − m(H) − m(S) = 11 − 2,4 − 0,6 − 3,2 = 4,8 г,
ν(O) = m / M = 4,8 / 16 = 0,3 моль - Находим мольное соотношение элементов в веществе:
C : H : S : O = 0,2 : 0,6 : 0,1 : 0,3 = 2 : 6 : 1 : 3
Формула вещества C2H6SO3.
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы (С4Н12S2O6) получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Ответ: C2H6SO3.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль. - Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01 СnH2n−2 + 2Br2 → СnH2n−2Br4 Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.Это пентадиен С5Н8.
Ответ: C5H8.
-
Пример 10.
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na
→
2CnH2n+1ONa + H2
C3H6 + H2→
C3H8
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль. - Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
-
Пример 11.
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 мольСоответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
-
Пример 12.
Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
1–4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77 % кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204•1022 молекул.
2–3. Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего С, Н и хлор, выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он 5,6 г его при присоединении воды образуют 7,4 г спирта.
3–2. Для окисления 2,9 г предельного альдегида до кислоты потребовалось 9,8 г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой 3 г с избытком бромоводорода образует 6,24 г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1. С3Н8
1–2. С3Н6(NH2)2
1–3. C2H4(COOH)2
1–4. C4H6
1–5. (HCOO)2Ca — формиат кальция, соль муравьиной кислоты
2–1. С8Н16О
2–2. С3Н7NO
2–3. С5Н8 (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. C3H7Cl (не забудьте, что атомы водорода содержатся не только в воде, но и в HCl)
2–5. C4H11N
3–1. С4Н8
3–2. С3Н6О
3–3. С2Н5NO2
3–4. C4H8(OH)2
3–5. C4H9OH
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Химия, часть С. Задача С5. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023
A chemical formula is a way of describing the information about the chemical proportions of atoms that make up a certain chemical compound or molecule. It uses the symbols of the chemical element and numbers, and also occasionally uses other symbols such as brackets, dashes, square brackets, commas, plus (+), and minus (-) signs. There are different types of chemical formulae like empirical formula, molecular formula, structural formula, and condensed formula. Let’s discuss the molecular formula and its calculation with examples in detail in this article.
What is Molecular Formula?
The molecular formula specifies the actual number of each type of atom in a molecule. For example, the molecular formula of benzene is C6H6, i.e., it is composed of six carbon and six hydrogen atoms. The molecular formula helps in determining whether a chemical compound is a binary compound, ternary compound, quaternary compound, or has even more elements depending upon the number of elements in a molecule. A molecular formula is always a multiple of the empirical formula, where an empirical formula for a chemical compound is defined as a simple expression that represents the ratio of the elements in the compound. For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO. We need the molar mass of a compound to find the molecular formula of a compound, and it is often derived after obtaining the empirical formula. Though molecular formulae are simple and easy to understand, they lack the knowledge concerning the atomic arrangement and bonding that is presented in a molecular formula. A molecular formula gives more information about a molecule than its empirical formula, however, it is more difficult to establish.
Relation between Molecular Formula and Empirical Formula
The molecular formula specifies the actual number of each type of atom in a molecule, whereas an empirical formula for a chemical compound is a simple expression that represents the ratio of the elements in the compound. For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO. Here, the n-factor is 2. The empirical formula might be the same for different chemical compounds. For example, glucose, formaldehyde, and acetic acid have the same empirical formula, CH2O, but their molecular formulae are different. For some chemical compounds, both formulae are the same, like water (H2O), hypochlorous acid (HClO), formaldehyde (CH2O), methane (CH4), etc.
M = n × E
where,
M is the molecular formula
n is the ratio of molar mass and empirical formula mass
E is the empirical formula
How to Calculate Molecular Formula?
The molecular formula of a chemical compound can be found in the following ways:
Using Composition and Molecular Weight
Step 1: Multiply the molecular weight with the given component percentage.
Step 2: Divide each value obtained by the atomic weight of that atom.
Step 3: Round off the obtained values to the closest whole number. Finally, write the molecular formula.
Example: A compound is composed of 82.78% nitrogen and 17.22% hydrogen. If its molecular weight is 17.031 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of a compound = 17.031 g/mol
Nitrogen percentage in the given compound = 82.78%
Hydrogen percentage in the given compound = 17.22%
Step 1: Multiply the molecular weight with the given component percentage.
Nitrogen = 17.031 × (82.78/100) = 14.0982
Hydrogen = 17.031 × (17.22/100) = 2.9327
Step 2: Divide each value obtained by the atomic weight of that atom.
Nitrogen: 14.0982/14.0067 = 1.00654
Hydrogen: 2.9327/1.00794 = 2.90960
Step 3: Round off the obtained values to the closest whole number.
Nitrogen: 1
Hydrogen: 3
Thus, the molecular formula of the given compound is NH3.
Using Empirical Formula and Molecular Weight
Step 1: Calculate the empirical formula mass from the given empirical formula.
Step 2: Find the n-factor by using its formula. n = Molar Mass/Empirical Formula Mass
Step 3: Now, multiply all the subscripts in the empirical formula by n and the resultant formula is the required molecular formula.
Example: The empirical formula of a compound of carbon, hydrogen, and oxygen is HO. If its molar mass is 34.014 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = CH2O
The molar mass of the compound = 60.052 g/mol
Step 1: First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 1.00794 + 15.9994
= 2.01588 + 31.9988
= 17.007 g/mol
Step 2: Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 60.052/17.007 = 2
Step 3: Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 2 × (HO) = H2O2
Hence, the molecular formula of the compound is H2O2.
Solved Examples on Molecular Formula
Example 1: A compound is composed of 68.29% carbon, 12.02% hydrogen, and 21.69% oxygen. If its molecular weight is 86.136 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of a compound = 86.136 g/mol
Carbon percentage in the given compound = 68.29%
Hydrogen percentage in the given compound = 12.02%
Oxygen percentage in the given compound = 21.69%
Step 1: Multiply the molecular weight with the given component percentage.
Carbon = 86.136 × (68.29/100) = 58.8223
Hydrogen =86.136 × (12.02/100) = 10.3535
Oxygen = 86.136 × (21.69/100) = 18.6828
Step 2: Divide each value obtained by the atomic weight of that atom.
Carbon: 58.8223 /12.0107 = 4.8973
Hydrogen: 10.3535/1.00794 = 10.2719
Oxygen: 18.6828/15.9994 = 1.1677
Step 3: Round off the obtained values to the closest whole number.
Carbon: 5
Hydrogen: 10
Oxygen: 1
Thus, the molecular formula of the given compound is C5H10O.
Example 2: Oxalic acid is composed of 27.42% carbon, 2.33% hydrogen, and 70.25% oxygen. If its molecular weight is 90.035 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of oxalic acid = 90.035 g/mol
Carbon percentage in oxalic acid = 27.42%
Hydrogen percentage in oxalic acid = 2.33%
Oxygen percentage in oxalic acid = 70.25%
Step 1: Multiply the molecular weight with the given component percentage.
Carbon = 90.035 × (27.42/100) = 24.6875
Hydrogen = 90.035 × (2.33/100) = 2.0978
Oxygen = 90.035 × (70.25/100) = 63.2496
Step 2: Divide each value obtained by the atomic weight of that atom.
Carbon = 24.6875/12.0107 = 2.0554
Hydrogen: 10.3535/1.00794 = 2.08127
Oxygen: 63.2496/15.9994 = 3.9532
Step 3: Round off the obtained values to the closest whole number.
Carbon: 2
Hydrogen: 2
Oxygen: 4
Thus, the molecular formula of the given compound is C2H2O4.
Example 3: The empirical formula of a compound of carbon, hydrogen, and oxygen is CH2O. If its molar mass is 60.052 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = CH2O
The molar mass of the compound = 60.052 g/mol
First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 12.0107 + 2 × 1.00794 + 15.9994
= 30.026 g/mol
Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 60.052/30.026 = 2
Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 2 × (CH2O) = C2H4O2
Hence, the molecular formula of the compound is C2H4O2.
Example 4: Boric acid is composed of 21.14% boron, 4.65% hydrogen, and 74.21% oxygen. If its molecular weight is 61.83 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of boric acid = 61.83 g/mol
Boron percentage in boric acid = 27.42%
Hydrogen percentage in boric acid = 4.65%
Oxygen percentage in boric acid = 68.79%
Step 1: Multiply the molecular weight with the given component percentage.
Boron = 61.83 × (21.14/100) = 13.0709
Hydrogen = 61.83 × (4.65/100) = 2.8750
Oxygen = 61.83 × (74.21/100) = 45.8840
Step 2: Divide each value obtained by the atomic weight of that atom.
Boron: 13.6891/10.811 = 1.209
Hydrogen: 2.2568/1.00794 = 2.8524
Oxygen: 32.2320/15.9994 = 2.8679
Step 3: Round off the obtained values to the closest whole number.
Boron: 1
Hydrogen: 3
Oxygen: 3
Thus, the molecular formula of the given compound is H3BO3.
Example 5: The empirical formula of a compound that is composed of hydrogen, chlorine, and oxygen is HClO. If its molar mass is 52.46 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = HClO
The molar mass of the compound = 52.46 g/mol
First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 1.00794 + 35.453 + 15.9994
= 52.460 g/mol
Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 52.460/52.46 = 1
Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 1 × (HClO) = HClO
Here, the empirical formula and the molecular formula of the given compound are the same.
Hence, the molecular formula of the compound is HClO.
FAQs on Molecular Formula
Question 1: What is meant by a chemical formula?
Answer:
A chemical formula is a way of describing the information about the chemical proportions of atoms that make up a certain chemical compound or molecule. It uses the symbols of the chemical element and numbers, and also occasionally uses other symbols such as brackets, dashes, square brackets, commas, plus (+), and minus (-) signs. There are different types of chemical formulae like the empirical formula, molecular formula, structural formula, and condensed formula.
Question 2: Define molecular formula and give an example.
Answer:
The Molecular Formula specifies the actual number of each type of atom in a molecule. For example, the molecular formula of benzene is C6H6, i.e., it is composed of six carbon and six hydrogen atoms. We need the molar mass of a compound to find the molecular formula of a compound, and it is often derived after obtaining the empirical formula.
Question 3: What is the difference between the empirical formula and the molecular formula?
Answer:
- The molecular formula specifies the actual number of each type of atom in a molecule, whereas an empirical formula for a chemical compound is a simple expression that represents the ratio of the elements in the compound.
- For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO.
- The empirical formula might be the same for different chemical compounds. For example, glucose, formaldehyde, and acetic acid have the same empirical formula, CH2O, but their molecular formulae are different.
- For some chemical compounds, both formulae are the same, like water (H2O), hypochlorous acid (HClO), formaldehyde (CH2O), methane (CH4), etc.
Question 4: What is the relationship between the empirical formula and the molecular formula?
Answer:
A molecular formula is always a multiple of the empirical formula and the relationship between the empirical formula and the molecular formula is given as follows:
Molecular Formula = n × (Empirical formula) (where n is a positive integer)
where “n” is the ratio of molar mass and empirical formula mass.
n = Molar Mass/Empirical Formula Mass
Question 5: What are the molecular formulae of glucose, dichlorine hexoxide, and dimethyl ether?
Answer:
Molecular formula of glucose = C6H12O6
Molecular formula of dichlorine hexoxide = Cl2O6
Molecular formula of dimethyl ether = C2H6O.
Related Resources
- Molecular Weight
- Chemical Formula of Common Compounds
- Molar Mass
определим молекулярную формулу углеводорода, в котором содержится (85,71)
%
углерода и (14,29)
%
водорода. Известно, что относительная плотность этого углеводорода по воздуху составляет (0,966).
Первый вариант решения
1. В веществе содержатся только атомы углерода и водорода, значит, его формулу можно записать так —
CxHy
. Индексы в формуле показывают отношение количеств атомов:
x:y=n(C):n(H).
По массовым долям определяем, что в (100) г углеводорода содержится (85,71) г углерода и (14,29) г водорода.
Найдём количества этих элементов:
x=m(C)Ar(C)=85,71 г12 г/моль=7,1425 моль;
y=m(H)Ar(H)=14,29г1г/моль=14,29моль;
x:y=7,1425:14,29=7,14257,1425:14,297,1425=1:2.
Значит, простейшая формула углеводорода —
CH2
.
2. Определим относительную молекулярную массу вещества и сравним её с массой
CH2
:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
Mr(CxHy)Mr(CH2)=2814=2.
Следовательно, молекулярная формула вещества
(CH2)2=C2H4.
Второй вариант решения
1. Определим относительную молекулярную массу углеводорода:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
2. Найдём число атомов углерода и водорода в молекуле:
x=Mr(C)⋅w(C)Ar(C)⋅100%=28⋅85,71%12⋅100%=2;
y=Mr(CxHy)⋅w(H)Ar(H)⋅100%=28⋅14,29%1⋅100%=4.