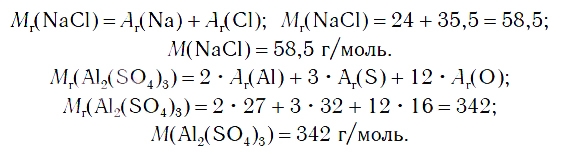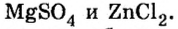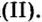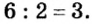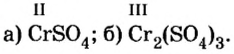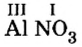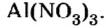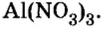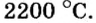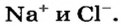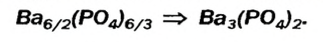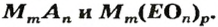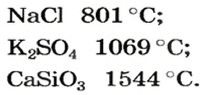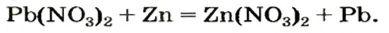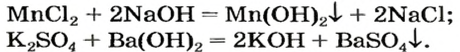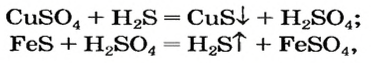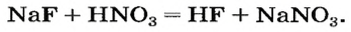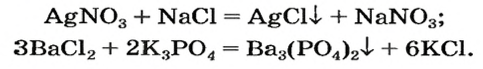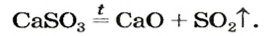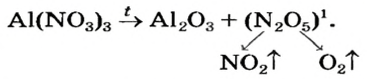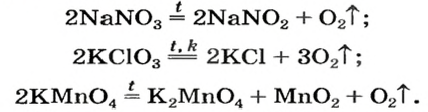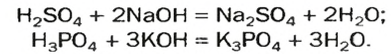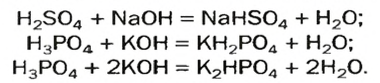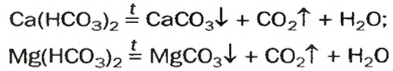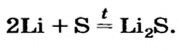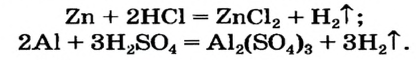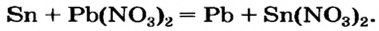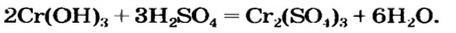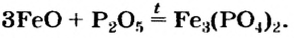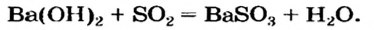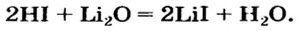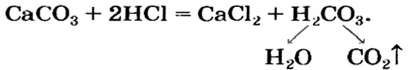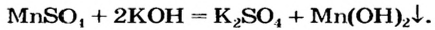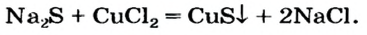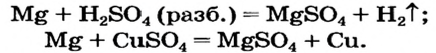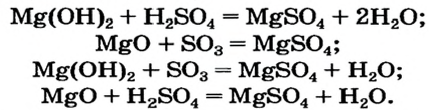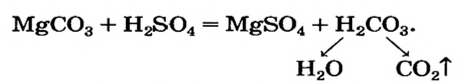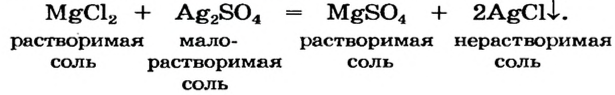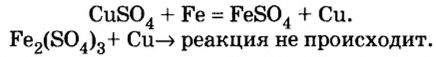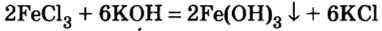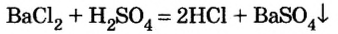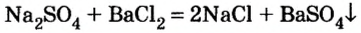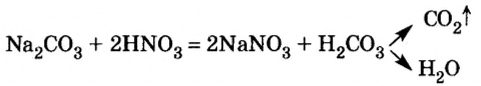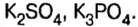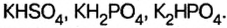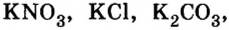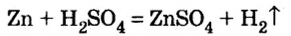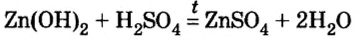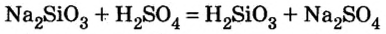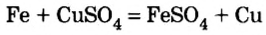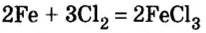В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
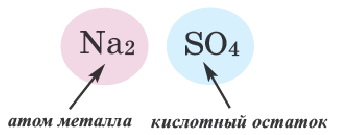
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
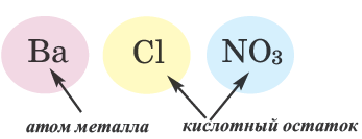
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
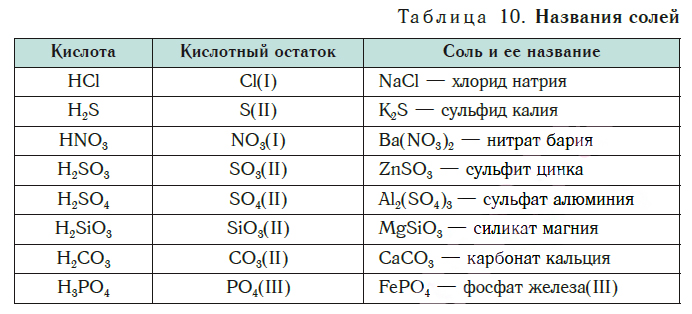
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Перейти к контенту
Панель информации
-
Вход
-
Панель информации
-
Курсы
-
Календарь
-
Входящие
Закрыть
2019 осень
Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» — краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
—
HCl соляная
кислота Cl хлорид
—
HF фтороводородная
кислота F фторид
—
HBr бромоводородная
кислота Br бромид
—
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
—
HNO3
азотная кислота NO3 нитрат
—
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
—
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3
Содержание:
Понятие о солях:
В предыдущем параграфе продукты замещения атомов водорода атомами металла имели формулы
Для этого разделим каждую формулу черточкой на две части:
Легко заметить, что первая составная часть формулы представлена металлическими элементами, а вторая — кислотными остатками. Кроме рассмотренных примеров, существует много веществ, формулы которых содержат металлические и кислотные остатки. Все они относятся к классу соединений, который получил название соли.
Соли — это сложные вещества, образованные атомами металлов и кислотными остатками
В отличие от кислот, представители класса солей имеют немолекулярное строение, их структурными частями являются ионы — катионы металлов и анионы кислотных остатков.
Формулу солей в общем виде можно записать так:
Номенклатура солей
Номенклатура солей (речь пойдет о так называемых средних солях, которые соответствуют приведенной общей формуле и являются продуктами полного замещения атомов водорода в кислоте). Название солей состоит из двух слов: названия металлического элемента и названия кислотного остатка в именительном падеже, например 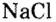
Если металл имеет переменную валентность, ее указывают в круглых скобках после его символа без интервала, например: 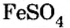
Кроме современных названий солей, которые отвечают указанным правилам, за некоторыми солями сохранились исторические названия, например: 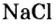
Определение валентности металлов в формулах солей и составление формул солей по валентности. Определяя валентность металла в формуле соли или составляя формулы солей, придерживаются общего правила, как при определении валентности элементов в бинарных соединениях и составлении их формул.
Сумма единиц валентности одной части формулы соли (атомов металла) равна сумме единиц валентности второй ее части (кислотного остатка).
Пример №
Определить валентность хрома в солях, формулы которых: 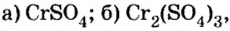
Решение
Обе соли содержат двухвалентный кислотный остаток серной кислоты.
Сумма единиц валентности кислотного остатка в первой формуле равна 2. Такой же должна быть и сумма валентностей атомов хрома. Поскольку атом хрома в этой формуле один, то обе валентности принадлежат ему. Следовательно, хром в формуле 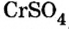
Во второй формуле кислотных остатков — три. Поэтому сумма единиц их валентностей составляет 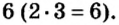
Ответ:
Пример №
Составить формулу нитрата алюминия.
Решение
1. Записываем символы металла и кислотного остатка:
2. Над металлом и кислотным остатком проставляем валентность:
3. Для единиц валентности металла и кислотного остатка находим наименьшее общее кратное: это число 3.
4. Делением общего кратного 3 на валентность металла и кислотного остатка находим индексы:
а) 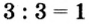
б) 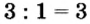
Полученные индексы вписываем в формулу нитрата алюминия:
Ответ:
Из общей формулы солей следует, что индекс металла совпадает с валентностью кислотного остатка, а индекс кислотного остатка — с валентностью металла. Однако, как и у оксидов, в формулах кислот четных индексов нет. Поэтому при составлении формул кислот по валентности проводят сокращение четных индексов.
Физические свойства солей
При нормальных условиях соли находятся только в твердом состоянии. Это тугоплавкие кристаллические вещества, поэтому, чтобы перевести их в жидкое состояние, а тем более в парообразное, нужны высокие температуры. Так, температура плавления сульфида бария равна
По способности растворяться в воде соли делят на растворимые (хлорид натрия, нитрат калия), малорастворимые (сульфит магния, хлорид свинца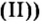
Соли — это вещества без запаха, разного вкуса. Может показаться, что класс веществ «Соли» получил такое название благодаря соленому вкусу его соединений. В действительности же с «чистым» соленым вкусом существует лишь одна соль, и вам она хорошо известна, это — хлорид натрия. Врачи предостерегают от избыточного употребления поваренной соли, однако в жизненно необходимых порциях хлорида натрия нуждается организм и человека, и животных. Она нужна для поддержания состава крови, а также вырабатывания желудочного сока. Физраствор, который используется для лечения больных,— ничто иное, как раствор хлорида натрия.
Соли бериллия — сладкие на вкус, соли магния — горькие, карбонат кальция (мел) — безвкусный. В большинстве своем соли имеют смешанный вкус — кисло-сладкий, горько-соленый.
Помните! В химическом кабинете соли ни в коем случае не пробуют на вкус!
Большинство солей белого цвета. Цвет перманганата калия 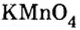
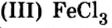
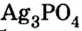
Внимательно рассмотрите образцы солей, которые учитель демонстрирует вам на урюке, и определите цвет и растворимость каждой из них.
Итоги:
- К классу солей относятся сложные вещества, образованные атомами металлов и кислотными остатками.
- В формулах солей сумма единиц валентности металла равна сумме единиц валентности кислотного остатка.
- Составляя формулу соли, необходимо знать валентность металла и кислотного остатка.
- По современной номенклатуре, названия солей образуют из названия металла и названия кислотного остатка и проставляют валентность металлов, у которых она имеет несколько значений.
Наиболее распространенной из солей угольной кислоты является карбонат кальция 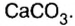
Жемчужина формируется в раковине моллюска вокруг раздражителей — чаще всего песчинок — и приблизительно за 12 лет вырастает величиной с горошину. Большие жемчужины правильной формы — чрезвычайная редкость.
Жемчуг издавна используют в качестве украшений. Особенно ценятся жемчужины правильной шарообразной формы. Они очень дорогостоящие: жемчужина диаметром 1 см стоит около 4000 долларов.
Средняя продолжительность хранения жемчужин составляет от 250 до 500 лет, после чего они теряют блеск и их легко измельчить в порошок.
Скелет других водных обитателей — коралловых полипов — по составу близок к жемчугу. Большие скопления коралловых полипов образуют коралловые рифы. В результате археологических раскопок обнаружилось, что люди издавна изготавливают украшения из кораллов (так называется скелет коралловых полипов). Благодаря несколько иному составу, чем у жемчужин, такие изделия сохраняются дольше. В зависимости от содержания органических веществ, кораллы бывают разного цвета: розовые, красные и даже черные. Изготовленные из таких кораллов украшения — ожерелья, серьги, кольца — считаются самыми дорогими. Владельцам кораллов нужно знать, что даже при легком нагревании эти драгоценности теряют свой цвет.
Что такое соли
К классу солей принадлежит соединение, которое мы употребляем ежедневно вместе с пищей. Это — поваренная соль 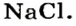
Соль — соединение, в состав которого входят катионы металлического элемента и анионы кислотного остатка.
Ион кислотного остатка имеет отрицательный заряд; его значение совпадает со значением валентности этого остатка:
Формулы солей. Для солей, как и кислот, существуют две общие формулы — 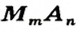
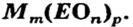
Примеры формул солей
Для того чтобы составить формулу соли, необходимо знать заряды катиона и аниона, а также учитывать то, что соединение электро-нейтрально. Для выяснения значений зарядов ионов можно использовать таблицу, размещенную на форзаце 2 (так называемая таблица растворимости).
Составим формулу соли, которая содержит катионы 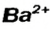
Графические формулы для солей, как и для других ионных соединений, не составляют.
Названия солей
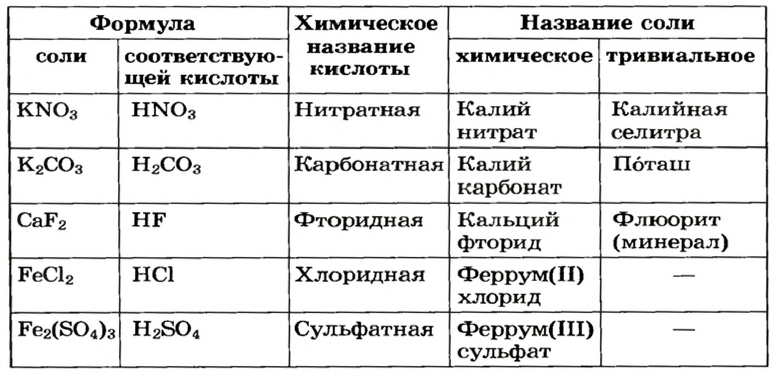
Для каждой соли существует химическое название, а для некоторых солей — еще и тривиальные названия (табл. 2). Химическое название соли состоит из двух слов. Первое слово — название металлического элемента, а второе происходит от химического названия соответствующей кислоты.
Формулы и названия некоторых солей
Если элемент имеет переменную валентность, то ее значение указывают после названия элемента (табл. 2, рис. 12). Склоняется только второе слово химического названия соли.
Существуют соли, образованные только неметаллическими элементами. В их состав входят катионы аммония 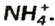
Два последних соединения применяют в качестве азотных удобрений.
Соли аммония происходят от основания 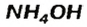
Распространенность в природе
В земной коре содержится много солей (рис. 13). В основном, это силикаты. Среди них встречаются и драгоценные камни: голубой топаз (алюминий силикат), золотистый циркон (цирконий силикат), бесцветный фенакит (бериллий силикат) и др.
Существует много залежей натрий хлорида NaCl (каменная соль), калий хлорида КС1, кальций карбоната СаС03 (мел, мрамор, известняк). Последнее соединение составляет основу ракушек, яичной скорлупы (рис. 14). Сульфиды 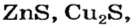
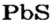
Различные соли находятся в растворенном состоянии в гидросфере. В морской воде преобладают хлориды Натрия и Магния, а в пресной — соли Кальция и Магния (в основном карбонатной и сульфатной кислот).
Выводы:
Соль — ионное соединение, в состав которого входят катионы металлического элемента и анионы кислотного остатка. Для солей существуют общие формулы
Каждая соль имеет химическое название, а некоторые соли — еще и тривиальные названия. Соли очень распространены в природе.
Свойства и применение солей
Физические свойства солей: Соли, как и другие ионные соединения, при обычных условиях являются кристаллическими веществами. Они обычно имеют высокие температуры плавления:
Часть солей растворяется в воде, некоторые являются малорастворимыми (рис. 31), а остальные — нерастворимые. Соответствующая информация помещена в таблице растворимости (форзац 2).
Образование растворов солей часто сопровождается тепловыми эффектами. Например, при растворении натрий карбоната выделяется небольшое количество теплоты и раствор немного нагревается. А во время приготовления раствора натрий нитрата можно зафиксировать незначительное понижение температуры.
Лишь одна соль — натрий хлорид — имеет соленый вкус. Многие другие растворимые соли горькие, а соли Плюмбума и Бериллия сладкие, но чрезвычайно ядовитые. Определяя вкус различных солей, некоторые алхимики, вероятно, поплатились за это жизнью.
Соли по-разному влияют на растения, животных, человека. Среди них есть соединения, которые содержат необходимые для растений элементы; их применяют в качестве удобрений. А поваренную соль мы ежедневно употребляем вместе с пищей, чтобы пополнить ее запасы в организме (это соединение постоянно выводится из организма вместе с потом и мочой).
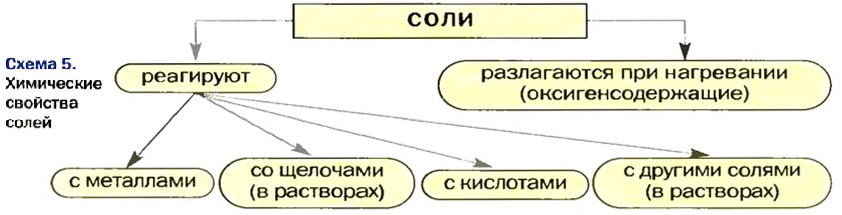
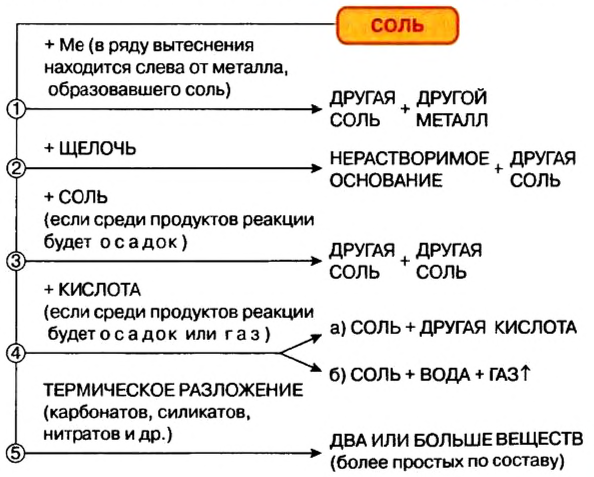
Химические свойства солей: Соли вступают в разнообразные реакции с простыми и сложными веществами.
Реакции с металлами
Соль в водном растворе может реагировать с металлом с образованием новой соли и другого металла (рис. 32). Часто говорят, что один металл «вытесняет» другой из раствора соли. Реакция происходит, если металл-реагент активнее, чем металл-продукт, т. е. находится в ряду активности слева от него (форзац 2):
Изучая основания и кислоты, вы узнали о реакциях этих соединений с солями. Кроме того, соли также могут взаимодействовать друг с другом. Все упомянутые реакции относят к реакциям обмена.
Реакции со щелочами
Реакция между солью и щелочью происходит лишь в растворе (нерастворимые соли со щелочами не взаимодействуют). Она возможна, если один из ее продуктов — основание или соль — выпадает в осадок (рис. 33):
Для прогнозирования возможности таких реакций используют таблицу растворимости (форзац 2).
Если к раствору купрум(II) сульфата добавить столько раствора щелочи, сколько необходимо для полного превращения соли в купрум(II) гидроксид, то после отстаивания над осадком увидим бесцветный раствор. Он будет содержать лишь натрий сульфат (ионы 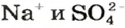
Реакции с кислотами
Соль (как растворимая, так и нерастворимая) может взаимодействовать с кислотой с образованием новой соли и новой кислоты. Такие реакции часто сопровождаются выделением осадка (рис. 34) или газа
но иногда остаются незаметными:
Случаи, в которых реакция между солью и кислотой возможна, указаны в §12(с. 81).
Реакции с другими солями
Взаимодействие между двумя солями происходит лишь в растворе (реагенты должны быть растворимыми в воде) с образованием двух новых солей. Реакция возможна, если один из ее продуктов выпадает в осадок (рис. 35), т. е. является нерастворимым или малорастворимым соединением.
Примеры реакций между двумя солями:
Термическое разложение солей
Оксиген-содержащие соли, образованные газообразными, летучими или неустойчивыми оксидами, при нагревании разлагаются. Продуктами этих реакций, как правило, являются два соответствующих оксида:
Нитраты, как и нитратная кислота, происходят от нитроген(V) оксида 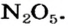
Соли щелочных элементов либо не разлагаются (карбонаты, сульфаты), либо их разложение происходит своеобразно. Некоторые из таких реакций используют в лаборатории для получения кислорода:
Изложенный материал обобщен в схеме 5.
1 — Так разлагаются нитраты металлических элементов от Магния до Купрума включительно (см. ряд активности металлов).
Применение солей
Многие соли применяются на практике. Натрий хлорид является сырьем для промышленного получения хлора, хлоридной кислоты, натрий гидроксида, соды. Это соединение незаменимо для приготовления пищи, консервирования. Хлорид, сульфат, нитрат Калия, фосфаты Кальция, некоторые другие соли применяют в качестве минеральных удобрений (рис. 36). Кальций карбонат в виде камня известняка используют в строительстве, а на заводах из него производят известь.
На основе искусственно полученной соли изготовляют зубную пасту. В школе пишут на доске мелом, а это — также кальций карбонат. Кальций сульфат (гипс) применяют в строительстве и медицине. Простым средством для мытья и чистки посуды, предметов домашнего обихода, смягчения воды перед стиркой является кальцинированная сода, или натрий карбонат. Кальцинированную соду вместе с мелом или известняком используют в производстве стекла.
Выводы:
Соли — ионные вещества. Они имеют высокие температуры плавления, различную растворимость в воде.
Соли взаимодействуют с металлами с образованием другой соли и другого металла. Такие реакции происходят, если металл-реагент более активный, чем металл-продукт (это определяют с помощью ряда активности металлов).
Соли вступают в реакции обмена со щелочами, кислотами, другими солями. Некоторые оксигенсодержащие соли при нагревании разлагаются на соответствующие оксиды. Многие соли используются на практике.
Кислые соли
Вы знаете, что при реакции кислоты со щелочью атомы Гидрогена каждой молекулы кислоты «заменяются» атомами (точнее — ионами) металлического элемента:
А возможна ли замена только части атомов Гидрогена в молекуле многоосновной кислоты? Да. В результате соответствующих реакций образуются так называемые кислые соли:
Кислые соли 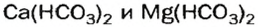
и на стенках сосуда образуется накипь — смесь карбонатов 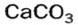
Кислые соли Кальция и ортофосфатной кислоты
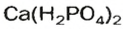

Способы получения солей
Соли можно получать значительно большим количеством способов, чем оксиды, основания или кислоты.
Три способа получения солей предполагают проведение химических реакций с участием металлов.
Способ 1: металл + неметалл 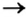
Способ 2: металл + кислота (раствор) 
В такие реакции вступают сульфатная (в разбавленном растворе), хлоридная, некоторые другие кислоты и металлы, находящиеся в ряду активности слева от водорода:
Способ 3: металл 1 + соль 1 (в растворе) 
Вам известно, что такая реакция возможна, если металл 1 активнее металла 2, т. е. металл 1 находится в ряду активности слева от металла 2:
Несколько других способов получения солей предусматривают использование реакций между соединениями, которые проявляют основные и кислотные свойства (§ 9, 11 —13).
Способ 4: основание (амфотерный гидроксид) + кислота (амфотерный гидроксид) 
Способ 5: основный (амфотерный) оксид + кислотный (амфотерный) оксид 
Способ 6: основание + кислотный (амфотерный) оксид 
Способ 7: кислота + основный (амфотерный) оксид 
Соли также получают с помощью реакций обмена с участием солей (§ 14).
Способ 8: соль 1 + кислота 1 
Способ 9: соль 1 + щелочь 
Способ 10: соль 1 -I- соль 2 —> соль 3 + соль 4 (рис. 43):
Это интересно. Солис 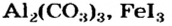
Способы 5 и 6 непригодны для получения солей безоксигеновых кислот, поскольку эти кислоты не имеют кислотных оксидов.
Выбирая способы 8—10, учитывают то, что реакция обмена возможна в случае образования осадка, газа или слабой кислоты (§11, 12, 14).
Вышеизложенное обобщено в схеме 9.
Пример №
Предложить максимальное количество способов получения магний сульфата
Решение
Магний сульфат — оксигенсодержащая соль. Поэтому способ 1 для получения соединения не подходит.
Эту соль можно получить, исходя из металла (способы 2 и 3):
Магний сульфат может образоваться в результате реакций между соответствующими соединениями основного и кислотного характера (способы 4—7):
Для реакции соли с кислотой (способ 
Реакция соли со щелочью (способ 9) для получения магний сульфата не подходит, поскольку одним из реагентов должен быть гидроксид 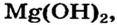
Магний сульфат растворяется в воде. Учитывая это, выберем для реакции между двумя солями (способ 10) такие реагенты:
Выводы:
Соли получают несколькими способами. Часть способов основана на реакциях металлов с неметаллами, кислотами, солями. Другие способы предусматривают осуществление реакций между соединениями с основными и кислотными свойствами, а также реакций обмена с участием солей.
Химические свойства солей
Соли, как и другие классы неорганических соединений, способны участвовать в химических реакциях.
Взаимодействие солей с металлами
Соли (в растворе) взаимодействуют с металлами, расположенными в вытесни-тельном ряду до того металла, из атомов которого они образовались. В результате реакции образуются новая соль и металл.
Опыт 1. Четыре химических стакана наполним растворами солей: два — сульфатом меди
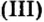
В реакции, которая состоялась, атомы простого вещества замещают атомы металлического элемента в сложном веществе. Поэтому эта реакция относится к реакциям замещения. Результаты опыта согласовываются с местом в вытеснительном ряду металлов, взятых для проведения опыта.
Взаимодействие солей с основаниями (щелочами)
В предыдущем параграфе вы узнали о том, что единственный способ, которым можно получить нерастворимое основание определенного металлического элемента,— это взаимодействие его растворенной в воде соли со щелочью. Такое взаимодействие мы рассматривали и при изучении свойств щелочей. Поэтому вспомним, что для протекания реакции вещества должны находиться в растворенном состоянии, а один из образовавшихся продуктов реакции — выпадать в осадок, например:
Взаимодействие солей с кислотами
Соли вступают в реакцию обмена с кислотами при условии, что среди продуктов реакции есть осадок или газ. (Вспомните взаимодействие соляной кислоты с нитратом серебра или питьевой соды — с уксусной кислотой.) Проведем соответствующие опыты.
Опыт 2. К раствору хлорида бария 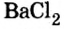
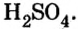
Среди образовавшихся продуктов нерастворимым веществом является сульфат бария.
Взаимодействие солей с солями
Повторим опыт 2, заменив серную кислоту на одну из ее растворимых солей.
Опыт 3. К раствору сульфата натрия 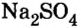
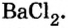
С помощью раствора хлорид бария или другого растворенного в воде соединения бария можно обнаружить в растворе серную кислоту и ее соли.
Опыт 4. К раствору карбоната натрия добавим раствор азотной кислоты. Наблюдается выделение газообразного вещества. Поднесенная к отверстию пробирки зажженная спичка гаснет. Следовательно, выделяется углекислый газ:
Для формулировки окончательного обоснованного вывода о химических свойствах солей проведите химический эксперимент, предусмотренный лабораторными опытами 7, 8, 9.
Итоги:
- Взаимодействие солей с другими веществами происходит в растворе.
- Одним из продуктов взаимодействия солей с другими веществами всегда является соль.
- Соли проявляют такие типичные химические свойства:
- Соли серной кислоты можно обнаружить в растворе с помощью растворов солей бария.
Соли, при образовании которых в молекуле кислоты все атомы водорода замещаются атомами металла, получили название средних солей. Средние соли не содержат ни атомов водорода, ни гидроксильных групп, а в их состав входят атомы одного металлического элемента, например:
Кроме средних, существуют еще и другие соли, в частности кислые, основные, двойные.
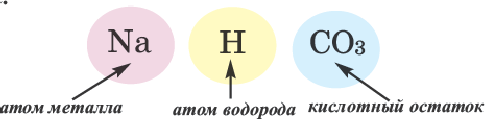
Кислые соли являются продуктом неполного замещения атомов водорода в молекуле кислоты на металл. Поэтому кислотные остатки таких солей содержат атомы водорода, например:
В молекулах серной и ортофосфорной кислот замещен на металл 1 атом водорода, поэтому остатки 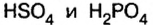



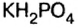
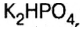
Основными называют соли, полученные частичной нейтрализацией основания кислотой (например, 
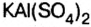
Какая образуется соль — средняя, кислая или основная — зависит от количества взятых для проведения реакции реагентов.
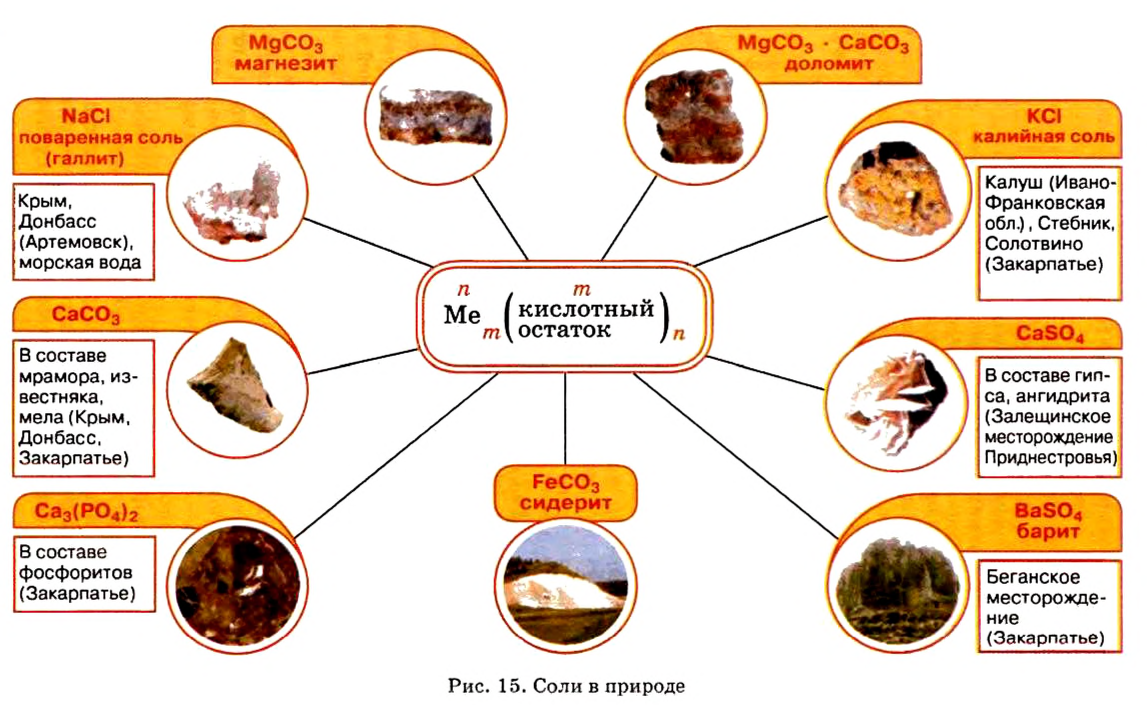
Соли в природе
По распространенности неорганических соединений в природе соли занимают второе место после оксидов. Так, горные породы и глина состоят из солей кремниевой кислоты, которые имеют сложное строение. Их формулы записывают с помощью формул оксидов, например формула полевого шпата — 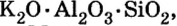
Местонахождение залежей солей в Украине представлено на рисунке 15.
Наиболее известная вам соль — хлорид натрия 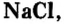
Как сырье хлорид натрия используется для производства гидроксида натрия, натрия, хлора, соляной кислоты, мыла, синтетических моющих средств. В пищевой, кондитерской и фармацевтической промышленности используют такие соли: хлорид натрия, карбонат натрия, нитрат натрия, сульфат магния и другие.
Карбонат кальция 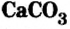
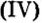
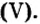
Кости позвоночных животных и человека содержат ортофосфат кальция 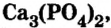
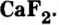
Соли входят также в состав крови, клеточного сока, нервной и мускульной тканей.
Из курсов природоведения и ботаники вам известно, что для полноценного роста и развития растениям нужны химические элементы калий, азот, фосфор. Их вносят в почву в виде минеральных удобрений. По своему составу почти все минеральные удобрения — это соли, в частности
Широко применяется и соль сульфата кальция 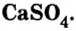
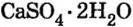
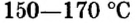
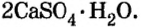
Карбонат натрия 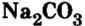
В плавательных бассейнах цвет воды обусловлен наличием в ней сульфата меди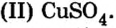
Хлорид калия 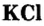
Из ортофосфата кальция 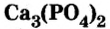
Сульфат бария 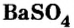
Ознакомившись с рисунком 16, вы пополните знания о применении солей новыми сведениями.
Приведенные здесь примеры — лишь небольшая часть того, как используются соли.
Итоги:
- Соли относятся к распространенным в природе сложным неорганическим веществам, среди которых больше всего хлоридов, силикатов, карбонатов, сульфатов, ортофосфатов.
- Часть солей используется непосредственно после добычи, а часть поддается химической переработке с целью получения новых веществ.
- Соли находят самое разнообразное применение в химической промышленности и многих других отраслях народного хозяйства, а также в быту.
Вода морей и океанов из-за содержащихся в ней различных солей на вкус солено-горькая. 100 г морской воды в среднем содержат 3,5 г солей, среди которых хлорида натрия почти 78 %. Моря и океаны имеют разную соленость — YaK называют содержание солей в единице объема морской воды. Однако состав солей в морской воде практически одинаков. Поэтому ученые считают, что Мировой океан в давние времена был единым.
Морские растения и животные приспособились к жизни в соленой воде. Более того, в их организмах накапливаются ионы, которые входят в состав солей морей и океанов. Морепродукты богаты кальцием, кремнием, иодом, медью, магнием, фосфором и другими элементами.
Используя сведения из географии и различных информационных источников, подготовьте рассказ (сообщение, реферат) о распространении какой-либо соли в природе и ее использовании.
Поработайте самостоятельно с дополнительной литературой, Интернетом и выясните, на каких химических свойствах солей основывается производство из них других веществ. Рассказ подтвердите примерами.
Справочный материал по солям
Соли можно получить многими способами:
1) взаимодействием металла с кислотой:
(Какой это тип реакции?)
Вспомните особенности взаимодействия кислот с металлами. Для получения солей каких металлов можно применить этот способ?
2) взаимодействием оксида металла с кислотой:
3) взаимодействием гидроксида металла с кислотой:
4) взаимодействием соли с кислотой:
5) взаимодействием основного или амфотерного оксида с кислотным оксидом:
6) взаимодействием металла с раствором соли другого металла:
7) взаимодействием металла с неметаллом (получают соли бескислородных кислот):
Итоги:
- В результате химических реакций образуются различные соединения. Это позволяет из соответствующих реагентов получать необходимые вещества.
- К общим способам получения оксидов относятся: окисление простых и сложных веществ, разложение нерастворимых гидроксидов при нагревании и др.
- К общим способам получения растворимых оснований (щелочей) относятся: взаимодействие металлов с водой, взаимодействие оксидов с водой и электролиз (разложение) растворов солей бескислородных кислот.
- Нерастворимые основания получают взаимодействием раствора их соли с раствором щелочи.
- Соли получают взаимодействием простого вещества (металла), сложных веществ (оксида металла, гидроксида металла, соли) с веществами, в состав которых входит кислотный остаток (кислота, соль), а также взаимодействием кислотных оксидов с основными оксидами или щелочами.
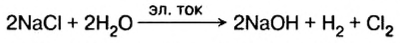
В лаборатории щелочь можно получить из металла и из оксида. Но чистых металлов натрия, калия, кальция, бария и их оксидов в природе не существует. Поэтому этими способами получают щелочи лишь в лабораториях. Чтобы обеспечить щелочами различные производства, нужны другие способы их получения из природного сырья. Впервые щелочь была получена электролизом (разложением постоянным электрическим током) раствора соли хлорида натрия. Электролиз стал основным промышленным способом производства щелочей гидроксида натрия и гидроксида калия.
Как происходит электролиз, вы будете изучать позже. А пока запишем суммарное уравнение электролиза водного раствора хлорида натрия:
Из записи уравнения видно, что из доступных природных веществ — поваренной соли и воды — получают три новых вещества, которых в природе нет, но каждое из них используется в промышленности, а значит есть потребность в их получении.
Классификация
Заполните таблицу.
| Химическая формула | Название | Тип соли |
| (CuOH)2CO3 | ? | ? |
| Fe2(SO4)3 | ? | ? |
| (NH4)2Cr2O7 | ? | ? |
| BaClNO3 | ? | ? |
| NaKSO4 | ? | ? |
Какие соли вам известны ? Как можно отличить соли друг от друга?
Соли получаются в результате замещения атомов водорода в молекуле кислоты атомами металла, а в основаниях гидроксильной группы (ОН.) кислотными остатками.
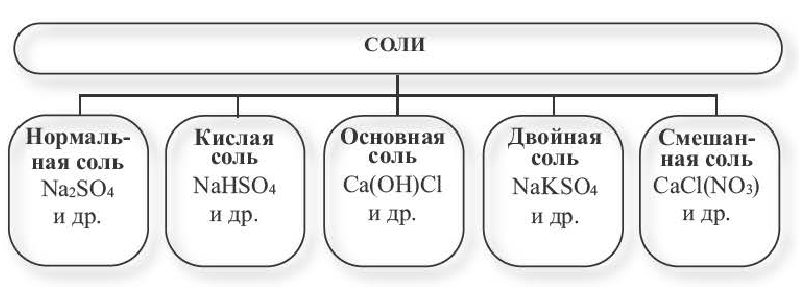
Солями называются вещества, в составе которых содержатся атомы металла (или аммония) и кислотный остаток. Соли классифицируют по их составу.
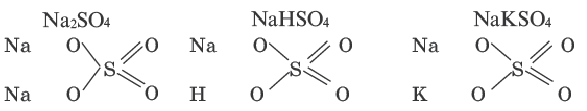
Графические формулы
Нормальные, кислые и двойные соли рассматриваются как продукты замещения атомов водорода в молекуле кислоты атомами металла.
Основные же соли рассматриваются как продукты замещения гидроксильной группы кислотным остатком.
Номенклатура
Нормальные соли. Соли, полученные в результате полного замещения атомов водорода, относящихся к основности кислот, атомами металлов, называются нормальными солями.
При наименовании нормальных солей, если металл обладает постоянной валентностью, то вначале дается название кислотного остатка, а затем название металла. Если же металл имеет переменную валентность, то вначале дается название кислотного остатка, следом название металла и его валентность (в скобках римскими цифрами).
| Нормальная соль | Название | Нормальная соль | Название | |
| Ah(SO4)3 | Сульфат алюминия | FeSO4 | Сульфат железа (II) |
Кислые соли
Соли, полученные в результате частичного замещения атомов водорода, относящихся к основности кислоты, атомами металлов (или же сложными ионами, например, ионами аммония), называются кислыми солями.
При наименовании кислых солей вначале дается название кислотного остатка с указанием на греческом количества атомов водорода, относящихся к основности кислоты и не замещенных металлом, с приставкой «гидро». При одном атоме водорода приставка «моно» не употребляется.
| Кислые соли | ||||
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| CaHPO4 | гидроортофосфат кальция | NH4H2PO4 | дигидроортофосфат аммония |
Основные соли
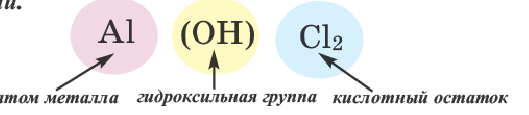
Соли, полученные в результате частичного замещения гидроксильных групп оснований кислотными остатками, называются основными солями.
Как и нормальные соли, при наименовании основных солей к кислотным остаткам здесь добавляется приставка «гидроксо» с указанием на греческом количества гидроксильных групп (ОН), не замещенных кислотным остатком. Если гидроксильная группа одна, то приставка «моно» не употребляется.
| Основные соли | ||||
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| Al(OH)Cl2 | гидроксохлорид алюминия | Al(OH)2Cl | дигидроксохлорид алюминия |
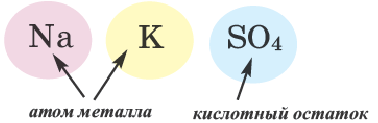
Двойные соли. Соли, полученные в результате замещения атомами двух разных металлов атомов водорода, относящихся к основности кислот в многоосновных кислотах, называются двойными солями.
При наименовании двойных солей после названия кислотного остатка даются оба названия металлов.
| Двойная соль | Название | Двойная соль | Название |
| NaKCO3 | карбонат натрия-калия | Na2KPO4 | ортофосфат динатрия-калия |
Смешанные соли
Соли, полученные в результате замещения гидроксильных групп в многокислотных основаниях двумя различными кислотными остатками, называются смешанными солями.
Если в составе смешанных солей содержатся бескислородные и кислородсодержащие кислотные остатки, то вначале даются названия бескислородных, а затем кислородсодержащих кислотных остатков.
| Смешанная соль | Название | Смешанная соль | Название |
| CaCl(OCl) (или CaOC2) | Хлорид гипохлорит кальция | BaClNO3 | хлорид нитрат бария |
Получение
При взаимодействии металлов с неметаллами
2Fe + ЗСЕ 
2Na + Cl2 
При взаимодействии металлов с солями. Начиная с элемента Mg в ряду активности металлов, каждый металл вытесняет последующие металлы из растворов их солей.
Zn + CuSO4 → ZnSO4 + Cu
При взаимодействии солей с солями. Такие реакции протекают в растворе в том случае, если обе исходные соли растворимы в воде и при их взаимодействии получится нерастворимая в воде соль.
Ca(NO3)2 + Na2CO3 → CaCO3↓ + 2NaNO3
Соли не вступают в реакцию с нерастворимыми в воде солями и основаниями.
Ca(NO3)2 + Cu(OH)2 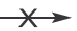
При взаимодействии однокислотных оснований с одноосновными кислотами, независимо от количества их молей, всегда получится нормальная соль.
KOH + HCI → KCl + H2O
При взаимодействии многоосновных кислот с многокислотными основаниями, в зависимости от количества молей веществ, получаются нормальная соль, кислая соль или основная соль. Для этого следует сравнить количество атомов водорода, показывающих основность кислоты, с количеством гидроксильных групп (ОН), выражающих кислотность основания.
При добавлении многоосновной кислоты к смеси двух различных оснований получится двойная соль.
NaOH + KOH + H2SO4 → 2H2O + NaKSO4
При нейтрализации одного многокислогного основания двумя различными кислотами получится смешанная соль.
Ca(OH)2+ HCl + HBr → CaClBr+ 2H2O
Физические и химические свойства солей
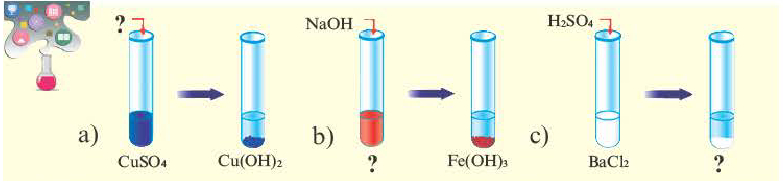
Определите вещества в соответствии с вопросительными знаками. Какие из представленных солей нерастворимы в воде?
Физические свойства:
Соли это твердые вещества с разной способностью к растворению и цветом. Все соли натрия (Na), калия (К) и аммония (NH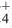
Ca3(PO4)2 → CaHPO4 → Ca(H2PQ4)2
увеличивается растворимость
Солям в основном присуща высокая температура плавления и кипения.
| Растворимость солей в воде | |
| Нерастворимые и малорастворимые | Растворимые |
| СaS04, BaS04, SrS04, PbS04, Ag2S04 | Остальные сульфаты растворяются в воде |
| AgCl, PbCl2, Hg2Cl2 | Другие хлориды растворяются в воде |
| FeS, CuS, PbS, ZnS и др. | Na2S, K2S, (NH4)2S |
| Другие ортофосфаты не растворяются вводе | Na3PO4, K3PO4, (NH4)3PO4 |
| Другие силикаты не растворяются в воде | Na2SiO3, K2SiO3 |
| Другие карбонаты не растворяются в воде | Na2CO3, K2CO3, (NH4)2CO3 |
| Все соли азотной кислоты, Na, К, NH4 растворяются в воде |
Химические свойства:
C химическими свойствами солей вы ознакомились при изучении свойств щелочей и кислот, способов получения оксидов и солей.
Кислые, основные, в том числе и двойные соли могут проявлять многие химические свойства нормальных солей. Кроме того, кислые соли легко нейтрализуются щелочами, а основные соли кислотами.
NaHSO4 + NaOH 
Mg(OH)Cl + HCl → MgCl2 + H2O
Основные соли могут взаимодействовать с щелочами.
Al(OH)2Cl+ NaOH → Al(OH)3↓ +NaCl
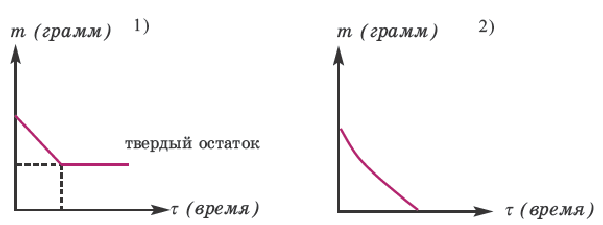
При нагревании большинства кислых солей (кроме солей аммония) они разлагаются с образованием нормальной соли.
При разложении солей металлов (кроме Hg(NO3)2) всегда выделяется твердый остаток (или оксид металла, или же полученная новая соль в твердом виде). Поэтому разложение этих солей происходит как в 1-ом графике. При разложении большинства аммонийных солей твердый остаток не выделяется. Вот почему их разложение происходит как во 2-ом графике.
Некоторые соли при взаимодействии с водой образуют вещества кристаллогидраты.
Na2CO3 +10H2O → Na2CO3 . 10H2O
кристаллическая сода
При нагревании кристаллогидраты вновь обезвоживаются.
CuSO4 . 5H2O 
синий кристалл белый кристалл
Вода, входящая в состав кристаллов в виде химических соединений, называется кристаллизационной водой. Кристаллогидрат это не просто набор из воды и соли, а вещество. Вода и соль лишь условно разделены точкой.
Многоосновные кислоты, вступая в реакцию соединения с нормальными солями, образуют кислую соль.
Применение солей
Большинство солей широко применяются в промышленности и быту. Так, например, всем хорошо известно применение поваренной соли (NaCl) в быту. В промышленности ее используют при получении гидроксида натрия, соды, хлора, натрия и др. Соли азотной и оргофосфорной кислот в основном считаются минеральными удобрениями.
Многие средства защиты растений от болезнетворных микробов и вредителей, ряд лекарственных препаратов также относятся к классу солей. Более подробные сведения о применении отдельных солей будут представлены при изучении химических элементов.
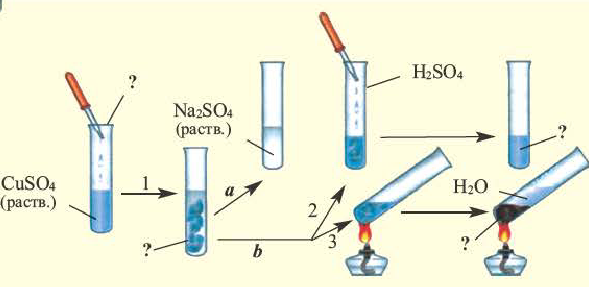
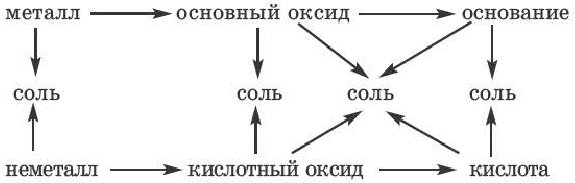
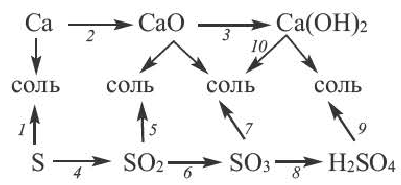
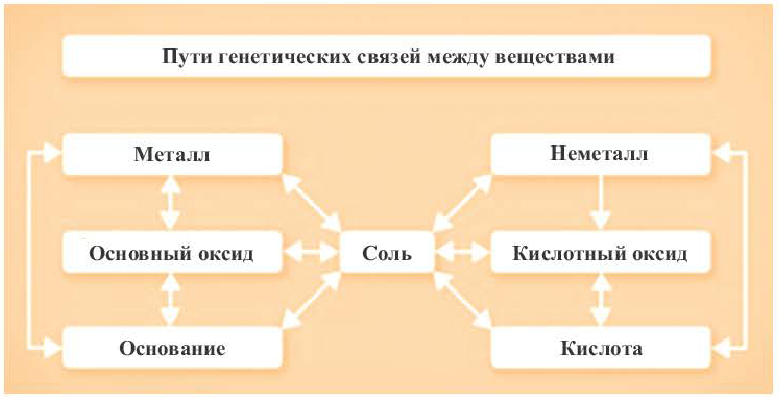
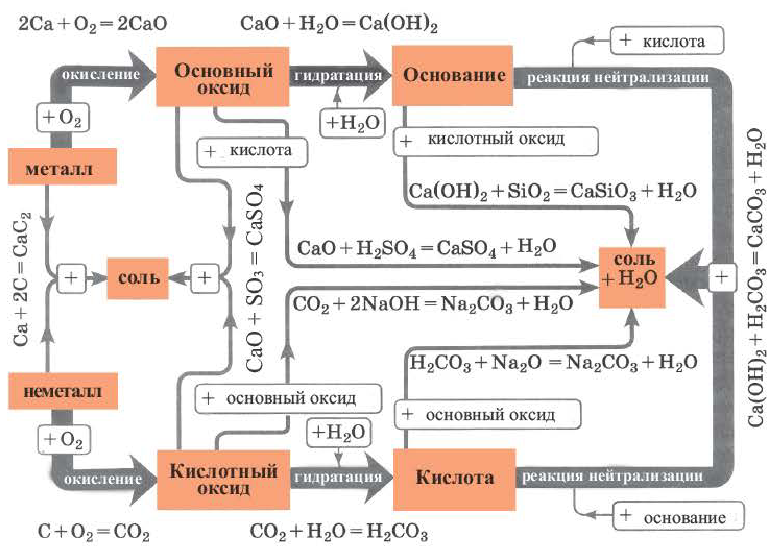
Генетическая связь между классами неорганических соединений
Обратите внимание на пробирки и содержащиеся в них вещества. Определите генетическую связь между этими веществами и запишите уравнения реакций.
Возможность получения из представителей одного класса неорганических соединений представителей другого класса свидетельствует о наличии между ними генетической связи. Взаимосвязь между веществами отдельных классов можно проследить по нижеприведенной схеме:
Получение одного представителя неорганических соединений из другого основывается на их химических свойствах. Приведем один пример относительно генетических связей неорганических соединений.
В качестве примера генетической связи между неорганическими веществами можно привести следующие схемы.
Задача:
Какие вещества взаимодействуют и с Na2CO3, и с Zn(OH)2?
1) HCl 2) MgSO4 3)K0H 4) Ca(OH)2 5) H2SO4
Решение: Na2CO3, вступая в реакцию с сильными кислотами (HC1, HBr, HI, HNO2, H2SO4, H2PO4), выделяет соль и CO2.
В таком случае:
1) Na2CO3+ 2HC1 → 2NaCl + C02↑ + H2O
2) Na2CO3+ H2SO4 → Na2SO4+ CO2↑ + H2O
Поскольку Zn(OH)2 является амфотерным основанием, оно вступает в реакцию как с сильными кислотами (HC1, HBr, HI, HNO3, H3PO4, H2SO4), так и с щелочами (NaOH, КОН, Ca(OH)2, Ba(OH)2). В таком случае:
1) Zn(OH)2+ 2HC1 → ZnCl2+ 2H2O
2) Ca(OH)2 + Zn(OH)2 → CaZnO + 2H2O
3) Zn(OH)2+ H2SO4→ ZnSO4+ 2H2O
В то время как Zn(OH)2 вступает в реакцию с КОН, Na2CO3 в эту реакцию не вступает.
C другой стороны, основание Zn(OH)2, находящееся в виде осадка, не вступает в реакцию ни с одной солью.
Ответ: 1, 4, 5
- Хлор в химии
- Сера в химии
- Азот в химии
- Фосфор в химии
- Озон как химический элемент
- Оксиды в химии
- Основания в химии
- Кислоты в химии
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
This article is about the term as used in chemistry. For the chemistry of table salt, see Sodium chloride.
In chemistry, a salt is a chemical compound consisting of an ionic assembly of positively charged cations and negatively charged anions, which results in a compound with no net electric charge.[1] A common example is table salt, with positively charged sodium ions and negatively charged chloride ions.
The component ions in a salt compound can be either inorganic, such as chloride (Cl−), or organic, such as acetate (CH
3COO−
). Each ion can be either monatomic, such as fluoride (F−), or polyatomic, such as sulfate (SO2−
4).
Types of salt[edit]
Salts can be classified in a variety of ways. Salts that produce hydroxide ions when dissolved in water are called alkali salts and salts that produce hydrogen ions when dissolved in water are called acid salts. Neutral salts are those salts that are neither acidic nor basic. Zwitterions contain an anionic and a cationic centre in the same molecule, but are not considered salts. Examples of zwitterions are amino acids, many metabolites, peptides, and proteins.[2]
Properties[edit]
Color[edit]
Solid salts tend to be transparent, as illustrated by sodium chloride. In many cases, the apparent opacity or transparency are only related to the difference in size of the individual monocrystals. Since light reflects from the grain boundaries (boundaries between crystallites), larger crystals tend to be transparent, while the polycrystalline aggregates look like opaque powders or masses.
Salts exist in many different colors, which arise either from their constituent anions, cations or solvates. For example:
- sodium chromate is made yellow by the chromate ion
- potassium dichromate is made orange by the dichromate ion
- cobalt nitrate is made red by the chromophore of hydrated cobalt(II) ([Co(H2O)6]2+).
- copper sulfate is made blue by the copper(II) chromophore
- potassium permanganate is made violet by the permanganate anion.
- nickel chloride is typically made green by the hydrated nickel(II) chloride [NiCl2(H2O)4]
- sodium chloride, magnesium sulfate heptahydrate appear colorless or white because the constituent cations and anions do not absorb light in the part of the spectrum that is visible to humans.
Few minerals are salts, because they would be solubilized by water.[dubious – discuss][clarification needed] Similarly, inorganic pigments tend not to be salts, because insolubility is required for fastness. Some organic dyes are salts, but they are virtually insoluble in water.
Taste[edit]
Different salts can elicit all five basic tastes, e.g., salty (sodium chloride), sweet (lead diacetate, which will cause lead poisoning if ingested), sour (potassium bitartrate), bitter (magnesium sulfate), and umami or savory (monosodium glutamate).
Odor[edit]
Salts of strong acids and strong bases («strong salts») are non-volatile and often odorless, whereas salts of either weak acids or weak bases («weak salts») may smell like the conjugate acid (e.g., acetates like acetic acid (vinegar) and cyanides like hydrogen cyanide (almonds) or the conjugate base (e.g., ammonium salts like ammonia) of the component ions. That slow, partial decomposition is usually accelerated by the presence of water, since hydrolysis is the other half of the reversible reaction equation of formation of weak salts.
Solubility[edit]
Many ionic compounds exhibit significant solubility in water or other polar solvents. Unlike molecular compounds, salts dissociate in solution into anionic and cationic components.
The lattice energy, the cohesive forces between these ions within a solid, determines the solubility. The solubility is dependent on how well each ion interacts with the solvent, so certain patterns become apparent. For example, salts of sodium, potassium and ammonium are usually soluble in water. Notable exceptions include ammonium hexachloroplatinate and potassium cobaltinitrite. Most nitrates and many sulfates are water-soluble. Exceptions include barium sulfate, calcium sulfate (sparingly soluble), and lead(II) sulfate, where the 2+/2− pairing leads to high lattice energies. For similar reasons, most metal carbonates are not soluble in water. Some soluble carbonate salts are: sodium carbonate, potassium carbonate and ammonium carbonate.
Conductivity[edit]
Edge-on view of portion of crystal structure of hexamethyleneTTF/TCNQ charge transfer salt.[3]
Salts are characteristically insulators. Molten salts or solutions of salts conduct electricity. For this reason, liquified (molten) salts and solutions containing dissolved salts (e.g., sodium chloride in water) can be used as electrolytes.
Melting point[edit]
Salts characteristically have high melting points. For example, sodium chloride melts at 801 °C. Some salts with low lattice energies are liquid at or near room temperature. These include molten salts, which are usually mixtures of salts, and ionic liquids, which usually contain organic cations. These liquids exhibit unusual properties as solvents.
Nomenclature[edit]
The name of a salt starts with the name of the cation (e.g., sodium or ammonium) followed by the name of the anion (e.g., chloride or acetate). Salts are often referred to only by the name of the cation (e.g., sodium salt or ammonium salt) or by the name of the anion (e.g., chloride salt or acetate salt).
Common salt-forming cations include:
- Ammonium NH+
4 - Calcium Ca2+
- Iron Fe2+
and Fe3+ - Magnesium Mg2+
- Potassium K+
- Pyridinium C
5H
5NH+ - Quaternary ammonium NR+
4, R being an alkyl group or an aryl group - Sodium Na+
- Copper Cu2+
Common salt-forming anions (parent acids in parentheses where available) include:
- Acetate CH
3COO−
(acetic acid) - Carbonate CO2−
3 (carbonic acid) - Chloride Cl−
(hydrochloric acid) - Citrate HOC(COO−
)(CH
2COO−
)
2 (citric acid) - Cyanide C≡N−
(hydrocyanic acid) - Fluoride F−
(hydrofluoric acid) - Nitrate NO−
3 (nitric acid) - Nitrite NO−
2 (nitrous acid) - Oxide O2−
(water) - Phosphate PO3−
4 (phosphoric acid) - Sulfate SO2−
4 (sulfuric acid)
Salts with varying number of hydrogen atoms replaced by cations as compared to their parent acid can be referred to as monobasic, dibasic, or tribasic, identifying that one, two, or three hydrogen atoms have been replaced; polybasic salts refer to those with more than one hydrogen atom replaced. Examples include:
- Sodium phosphate monobasic (NaH2PO4)
- Sodium phosphate dibasic (Na2HPO4)
- Sodium phosphate tribasic (Na3PO4)
Formation[edit]
Solid lead(II) sulfate (PbSO4)
Salts are formed by a chemical reaction between:
- A base and an acid, e.g., NH3 + HCl → NH4Cl
- A metal and an acid, e.g., Mg + H2SO4 → MgSO4 + H2
- A metal and a non-metal, e.g., Ca + Cl2 → CaCl2
- A base and an acid anhydride, e.g., 2 NaOH + Cl2O → 2 NaClO + H2O
- An acid and a base anhydride, e.g., 2 HNO3 + Na2O → 2 NaNO3 + H2O
- In the salt metathesis reaction where two different salts are mixed in water, their ions recombine, and the new salt is insoluble and precipitates. For example:
- Pb(NO3)2 + Na2SO4 → PbSO4↓ + 2 NaNO3
Strong salt[edit]
Strong salts or strong electrolyte salts are chemical salts composed of strong electrolytes. These ionic compounds dissociate completely in water. They are generally odorless and nonvolatile.
Strong salts start with Na__, K__, NH4__, or they end with __NO3, __ClO4, or __CH3COO. Most group 1 and 2 metals form strong salts. Strong salts are especially useful when creating conductive compounds as their constituent ions allow for greater conductivity.[citation needed]
Weak salt[edit]
Weak salts or «weak electrolyte salts» are, as the name suggests, composed of weak electrolytes. They are generally more volatile than strong salts. They may be similar in odor to the acid or base they are derived from. For example, sodium acetate, CH3COONa, smells similar to acetic acid CH3COOH.
See also[edit]
- Bresle method (the method used to test for salt presence during coating applications)
- Carboxylate
- Fireworks/pyrotechnics (salts are what give color to fireworks)
- Halide
- Ionic bonds
- Natron
- Salinity
References[edit]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «salt». doi:10.1351/goldbook.S05447
- ^ Voet, D. & Voet, J. G. (2005). Biochemistry (3rd ed.). Hoboken, NJ: John Wiley & Sons Inc. p. 68. ISBN 9780471193500. Archived from the original on 2007-09-11.
- ^ D. Chasseau; G. Comberton; J. Gaultier; C. Hauw (1978). «Réexamen de la structure du complexe hexaméthylène-tétrathiafulvalène-tétracyanoquinodiméthane». Acta Crystallographica Section B. 34 (2): 689. doi:10.1107/S0567740878003830.
- Mark Kurlansky (2002). Salt: A World History. Walker Publishing Company. ISBN 0-14-200161-9.
This article is about the term as used in chemistry. For the chemistry of table salt, see Sodium chloride.
In chemistry, a salt is a chemical compound consisting of an ionic assembly of positively charged cations and negatively charged anions, which results in a compound with no net electric charge.[1] A common example is table salt, with positively charged sodium ions and negatively charged chloride ions.
The component ions in a salt compound can be either inorganic, such as chloride (Cl−), or organic, such as acetate (CH
3COO−
). Each ion can be either monatomic, such as fluoride (F−), or polyatomic, such as sulfate (SO2−
4).
Types of salt[edit]
Salts can be classified in a variety of ways. Salts that produce hydroxide ions when dissolved in water are called alkali salts and salts that produce hydrogen ions when dissolved in water are called acid salts. Neutral salts are those salts that are neither acidic nor basic. Zwitterions contain an anionic and a cationic centre in the same molecule, but are not considered salts. Examples of zwitterions are amino acids, many metabolites, peptides, and proteins.[2]
Properties[edit]
Color[edit]
Solid salts tend to be transparent, as illustrated by sodium chloride. In many cases, the apparent opacity or transparency are only related to the difference in size of the individual monocrystals. Since light reflects from the grain boundaries (boundaries between crystallites), larger crystals tend to be transparent, while the polycrystalline aggregates look like opaque powders or masses.
Salts exist in many different colors, which arise either from their constituent anions, cations or solvates. For example:
- sodium chromate is made yellow by the chromate ion
- potassium dichromate is made orange by the dichromate ion
- cobalt nitrate is made red by the chromophore of hydrated cobalt(II) ([Co(H2O)6]2+).
- copper sulfate is made blue by the copper(II) chromophore
- potassium permanganate is made violet by the permanganate anion.
- nickel chloride is typically made green by the hydrated nickel(II) chloride [NiCl2(H2O)4]
- sodium chloride, magnesium sulfate heptahydrate appear colorless or white because the constituent cations and anions do not absorb light in the part of the spectrum that is visible to humans.
Few minerals are salts, because they would be solubilized by water.[dubious – discuss][clarification needed] Similarly, inorganic pigments tend not to be salts, because insolubility is required for fastness. Some organic dyes are salts, but they are virtually insoluble in water.
Taste[edit]
Different salts can elicit all five basic tastes, e.g., salty (sodium chloride), sweet (lead diacetate, which will cause lead poisoning if ingested), sour (potassium bitartrate), bitter (magnesium sulfate), and umami or savory (monosodium glutamate).
Odor[edit]
Salts of strong acids and strong bases («strong salts») are non-volatile and often odorless, whereas salts of either weak acids or weak bases («weak salts») may smell like the conjugate acid (e.g., acetates like acetic acid (vinegar) and cyanides like hydrogen cyanide (almonds) or the conjugate base (e.g., ammonium salts like ammonia) of the component ions. That slow, partial decomposition is usually accelerated by the presence of water, since hydrolysis is the other half of the reversible reaction equation of formation of weak salts.
Solubility[edit]
Many ionic compounds exhibit significant solubility in water or other polar solvents. Unlike molecular compounds, salts dissociate in solution into anionic and cationic components.
The lattice energy, the cohesive forces between these ions within a solid, determines the solubility. The solubility is dependent on how well each ion interacts with the solvent, so certain patterns become apparent. For example, salts of sodium, potassium and ammonium are usually soluble in water. Notable exceptions include ammonium hexachloroplatinate and potassium cobaltinitrite. Most nitrates and many sulfates are water-soluble. Exceptions include barium sulfate, calcium sulfate (sparingly soluble), and lead(II) sulfate, where the 2+/2− pairing leads to high lattice energies. For similar reasons, most metal carbonates are not soluble in water. Some soluble carbonate salts are: sodium carbonate, potassium carbonate and ammonium carbonate.
Conductivity[edit]
Edge-on view of portion of crystal structure of hexamethyleneTTF/TCNQ charge transfer salt.[3]
Salts are characteristically insulators. Molten salts or solutions of salts conduct electricity. For this reason, liquified (molten) salts and solutions containing dissolved salts (e.g., sodium chloride in water) can be used as electrolytes.
Melting point[edit]
Salts characteristically have high melting points. For example, sodium chloride melts at 801 °C. Some salts with low lattice energies are liquid at or near room temperature. These include molten salts, which are usually mixtures of salts, and ionic liquids, which usually contain organic cations. These liquids exhibit unusual properties as solvents.
Nomenclature[edit]
The name of a salt starts with the name of the cation (e.g., sodium or ammonium) followed by the name of the anion (e.g., chloride or acetate). Salts are often referred to only by the name of the cation (e.g., sodium salt or ammonium salt) or by the name of the anion (e.g., chloride salt or acetate salt).
Common salt-forming cations include:
- Ammonium NH+
4 - Calcium Ca2+
- Iron Fe2+
and Fe3+ - Magnesium Mg2+
- Potassium K+
- Pyridinium C
5H
5NH+ - Quaternary ammonium NR+
4, R being an alkyl group or an aryl group - Sodium Na+
- Copper Cu2+
Common salt-forming anions (parent acids in parentheses where available) include:
- Acetate CH
3COO−
(acetic acid) - Carbonate CO2−
3 (carbonic acid) - Chloride Cl−
(hydrochloric acid) - Citrate HOC(COO−
)(CH
2COO−
)
2 (citric acid) - Cyanide C≡N−
(hydrocyanic acid) - Fluoride F−
(hydrofluoric acid) - Nitrate NO−
3 (nitric acid) - Nitrite NO−
2 (nitrous acid) - Oxide O2−
(water) - Phosphate PO3−
4 (phosphoric acid) - Sulfate SO2−
4 (sulfuric acid)
Salts with varying number of hydrogen atoms replaced by cations as compared to their parent acid can be referred to as monobasic, dibasic, or tribasic, identifying that one, two, or three hydrogen atoms have been replaced; polybasic salts refer to those with more than one hydrogen atom replaced. Examples include:
- Sodium phosphate monobasic (NaH2PO4)
- Sodium phosphate dibasic (Na2HPO4)
- Sodium phosphate tribasic (Na3PO4)
Formation[edit]
Solid lead(II) sulfate (PbSO4)
Salts are formed by a chemical reaction between:
- A base and an acid, e.g., NH3 + HCl → NH4Cl
- A metal and an acid, e.g., Mg + H2SO4 → MgSO4 + H2
- A metal and a non-metal, e.g., Ca + Cl2 → CaCl2
- A base and an acid anhydride, e.g., 2 NaOH + Cl2O → 2 NaClO + H2O
- An acid and a base anhydride, e.g., 2 HNO3 + Na2O → 2 NaNO3 + H2O
- In the salt metathesis reaction where two different salts are mixed in water, their ions recombine, and the new salt is insoluble and precipitates. For example:
- Pb(NO3)2 + Na2SO4 → PbSO4↓ + 2 NaNO3
Strong salt[edit]
Strong salts or strong electrolyte salts are chemical salts composed of strong electrolytes. These ionic compounds dissociate completely in water. They are generally odorless and nonvolatile.
Strong salts start with Na__, K__, NH4__, or they end with __NO3, __ClO4, or __CH3COO. Most group 1 and 2 metals form strong salts. Strong salts are especially useful when creating conductive compounds as their constituent ions allow for greater conductivity.[citation needed]
Weak salt[edit]
Weak salts or «weak electrolyte salts» are, as the name suggests, composed of weak electrolytes. They are generally more volatile than strong salts. They may be similar in odor to the acid or base they are derived from. For example, sodium acetate, CH3COONa, smells similar to acetic acid CH3COOH.
See also[edit]
- Bresle method (the method used to test for salt presence during coating applications)
- Carboxylate
- Fireworks/pyrotechnics (salts are what give color to fireworks)
- Halide
- Ionic bonds
- Natron
- Salinity
References[edit]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «salt». doi:10.1351/goldbook.S05447
- ^ Voet, D. & Voet, J. G. (2005). Biochemistry (3rd ed.). Hoboken, NJ: John Wiley & Sons Inc. p. 68. ISBN 9780471193500. Archived from the original on 2007-09-11.
- ^ D. Chasseau; G. Comberton; J. Gaultier; C. Hauw (1978). «Réexamen de la structure du complexe hexaméthylène-tétrathiafulvalène-tétracyanoquinodiméthane». Acta Crystallographica Section B. 34 (2): 689. doi:10.1107/S0567740878003830.
- Mark Kurlansky (2002). Salt: A World History. Walker Publishing Company. ISBN 0-14-200161-9.
Общие сведения
Все соли имеют сложный химический состав и в зависимости от него могут быть органическими или неорганическими. В теоретической химии существует несколько определений этой группы веществ:
- являющиеся результатом взаимодействия оснований и кислот;
- соединения, образованные одним или несколькими кислотными остатками и ионом металла;
- при электролитической диссоциации — состоящие из катионов и анионов.
Кроме металлов, к кислотным остаткам могут присоединяться ионы аммония (NH4)+, гидроксония (Н3О)+, фосфония (РН4)+ и некоторые другие. С физической точки зрения чаще всего соли — это твердые кристаллические вещества. Встречаются вещества разной окраски. Прозрачные единичные кристаллы в большом количестве имеют белый цвет, например, поваренная соль NaCl.
Их строение представляет собой кристаллическую решетку, в узлах которой находятся анионы, а катионы занимают пространство между узлами. Другое распространенное строение — анионные фрагменты из кислотных остатков, соединенные в бесконечную цепочку, в трехмерных полостях которых находятся катионы. Такую структуру имеют силикаты, что отражается и на их свойствах: высокая температура плавления и неспособность проводить электрический ток.
Кроме ионных, в молекулах солей встречаются и молекулярные ковалентные связи, и промежуточные между ковалентными и ионными. В особую группу солей выделяются так называемые ионные жидкости, температура плавления которых ниже 100 °C, отличающиеся повышенной вязкостью.
Для изучения химических и физических свойств этой группы соединений важным критерием служит их растворимость в воде: полностью, частично или нерастворимые.
Классификация и номенклатура
Основные классы этой группы веществ были описаны французским химиком и аптекарем Г. Руэлем еще в 1754 году, а по мере развития химии к ним добавились новые. Главный принцип классификации солей основан на том, что при взаимодействии металла и кислоты в ней происходит частичное или полное замещение атомов водорода.
Общие характеристики
Формулы солей всегда образуются одним или несколькими металлами, кислотными остатками и гидроксильными группами. В зависимости от этого все солевые соединения делят на такие классы:
- Средние.
- Кислые.
- Основные.
- Двойные или смешанные.
- Комплексные.
- Кристаллогидраты.
Средними считаются те, у которых все атомы водорода образующей кислоты заменены атомами металла. К такому типу соединений относятся и те, в которых водород замещается одновалентной группой аммония NH4. Согласно принятой номенклатуре, названия этих веществ образуются из латинского названия кислотного остатка и русского названия металла. Кислородосодержащие остатки оканчиваются на «ат», бескислородные — на «ид». Например:
- Na2CO3 — карбонат натрия.
- NaCl — хлорид натрия.
- KNO3 — нитрат калия.
Если одному химическому элементу соответствует не одна кислота, то может использоваться и окончание «ит». Это относится к таким кислотам, как серная H2SO4 (сульфаты) и сернистая H2SO3 (сульфиты).
Кислые вещества образуются только от двух- или полиосновных кислот: серной, фосфорной, угольной. Они относятся к неустойчивым соединениям и при нагревании происходит их разложение на составляющие элементы. В названии таких веществ всегда используют приставку «гидро», а если незамещенных атомов водорода осталось два — приставку «ди»:
- NaHSO4 — гидросульфат натрия.
- CaHPO4 — гидрофостфат кальция.
- KH2PO4 — дигидрофосфат калия.
Образование основных солей происходит при частичном замещении гидроксильных групп кислотными остатками, причем валентность основного остатка всегда будет равна числу замещенных гидроксильных групп. Номенклатура названий таких химических соединений образуется в зависимости от количества гидроксогрупп приставками «гидроксо» и «дигидроксо»:
- Аl (OH)SO4 — гидроксосульфит алюминия.
- Cu (OH)Cl — гидроксохлорид меди.
- Fe (OH)2NO3 — дигидроксохлорид железа.
В двойных солях атомы водорода замещаются двумя разными металлами, соответственно и образовываться могут только от двух и более основных кислот: MgK (SO4)2, NaKCO3, KAl (SO4)2.
Комплексные соединения и кристаллогидраты
Этот класс химических соединений отличается большим разнообразием. В изучении комплексных солей (КС) большую роль сыграли швейцарский ученый А. Вернер и русский химик немецкого происхождения В. Освальд. КС состоят из комплексных частиц. Центральный элемент в комплексе называется комплексообразователем, а связанные с ним элементы — лигандами. Их число — это координационное число соединения. Лигандами могут быть как нейтральные молекулы, так и разнообразные ионы и катион водорода H+.
КС так и классифицируются на нейтральные, анионные и катионные. Разными лигандами образуются такие группы химических веществ:
- амиакаты, в которых с комплексообразователем связаны молекулы аммиака — [Co (NH3)6]Cl3;
- аквакомплексы, образованные лигандами воды — [Al (H2O)6]Cl3;
- ацидокомплексы, включающие кислотные остатки — K2[PtCl4].
Кристаллы, образующиеся в водном растворе при выпадении в осадок солей, называются кристаллогидратами. При этом между молекулами воды и солевыми ионами формируются прочные связи, образующие кристаллическую решетку. Химические формулы кристаллогидратов записывают в виде количественного соотношения соли и воды, разделенных точкой — Na2SO4⋅10H2O. В номенклатуре для обозначения количества воды употребляются греческие числа — ди, три, тетра, гекса и так далее, с которых и начинается название. Число выступает приставкой к слову «гидро», а затем следует стандартное название соли: CaSO4⋅2H2O — дигидрат сульфата кальция.
Исторические наименования
Названия химических веществ соответствуют международной системе правил, позволяющей давать им названия, по которым можно правильно составить их формулу. Многие соединения солевой группы давно и хорошо известны, и в процессе их использования химики много лет назад уже как-то называли их. Традиционные или тривиальные названия полезно знать любому человеку. Их список приведен в таблице:
| Соль | Номенклатурное название | Тривиальное название |
| CuSO4⋅5H2O | Пентагидрат сульфата меди | Медный купорос |
| CaCO3 | Карбонат кальция | Известняк |
| AgNO3 | Нитрат серебра | Ляпис |
| NaHCO3 | Гидрокарбонат натрия | Питьевая сода |
| K2СO3 | Карбонат калия | Поташ |
| HgCl2 | Хлорид ртути | Сулема |
| Na2SiO3 | Силикат натрия | Жидкое стекло |
Это далеко не полный перечь общеизвестных наименований. Какой-либо системе они не подчиняются, и тем, кто изучает химию, их надо просто запомнить.
Химические свойства
Соли как химические соединения проявляют разные свойства в зависимости от их структурного состава. В водных растворах могут диссоциировать на анион металла и катион кислотного остатка. Степень диссоциации зависит от того, какую способность растворяться имеют разные виды солей: растворимые диссоциируют полностью, нерастворимые — частично или не диссоциируют. Ход такой реакции зависит от вида соли: средние, двойные и комплексные распадаются на ионы одномоментно, а кислые и основные — ступенчато. Примеры:
- Хлорид натрия: NaCl ↔ (Na+) + (Cl-).
- Сульфат калия-натрия: КNaSO4 ↔ (К+) + (Na+) + (SO42-).
- Хлорид-бромид кальция: CaClBr ↔ (Ca2+) + (Cl -)+ (Br-).
- Гидросульфат калия: КHSO4 ↔ (К+) + (НSO4-), а затем (HSO4-) ↔ (H+) + (SO42-).
- Гидроксохлорид железа: FeOHCl ↔ (FeOH+) + (Cl-), а затем (FeOH+) ↔ (Fe2+) + (OH-).
Некоторые соли под действием температуры могут разлагаться. Например, при нагревании из карбоната кальция СаСO3 получается оксид кальция СаO и кислотный оксид СО2. Солевые вещества, образованные от бескислородных кислот, разлагаются на простые элементы: хлорид серебра AgCl распадается на серебро Ag с выделением хлора Cl. Если солеобразующим соединением выступает кислота с сильными окислительными свойствами, то разложения до простых элементов не происходит: 2КNO3 → 2КNO2 + O2.
Взаимодействие с оксидами и кислотами
Соли реагируют путем сплавления с кислотными или амфотерными оксидами. При этом образуется новое солевое соединение, а оксиды замещаются менее летучими. С основными оксидами такая реакция не происходит. Например, карбонат калия K2CO3 сплавляется с оксидом кремния (IV) SiO2 с образованием силиката калия KSiO3 и выделением углекислого газа CO2: K2CO3 + SiO2 → KSiO3 + CO2↑. K2CO3 может взаимодействовать и с оксидом алюминия, при этом получается алюминат калия KAlO2 и углекислый газ CO2: K2CO3 + Al2O3 → 2KAlO2 + CO2↑.
Взаимодействие с кислотами может происходить только в том случае, если в реакцию вступает кислота и соль, образованная более слабой кислотой. Показателем возможного совместного реагирования солей с кислотами могут быть предполагаемые:
- осадок;
- вода;
- газообразное вещество;
- слабый электролит.
Например, нерастворимое соединение угольной кислоты карбонат магния MgCO3 вступает в реакцию с сильной серной кислотой: MgCO3 + H2SO4 → MgSO4 + 2H2O + CO2. Растворимый силикат калия как производное кремниевой кислоты может взаимодействовать с соляной кислотой, потому что в ходе реакции ожидается получение нерастворимой кремниевой кислоты: K2SiO3 + 2HCl → H2SiO3↓ + 2KCl.
Реакции с основаниями и другими солями
Со щелочами взаимодействуют в основном только соли аммония и тяжелых металлов, если при этом они относятся к растворимым. В результате получают новое солевое вещество и новое основание. Например, в реакцию с гидроксидом калия KOH вступает сульфат меди (II) CuSO4, в результате чего образуется сульфат калия K2SO4, а гидроксид меди Cu (OH) выпадает в осадок: 2KOH + CuSO4 → K2SO4 + Cu (OH)2.
Взаимодействие хлорида аммония с гидроксидом натрия описывается таким уравнением (NH4)2SO4 + 2KOH → 2H2O + K2SO4 + 2NH3↑. Если воздействовать основанием на кислую соль, то в результате получится средняя соль и вода. Например, гидрокарбонат натрия NaHCO3 взаимодействует с гидроксидом натрия NaOH: NaHCO3 + NaOH → Na3CO3 + H2O.
Реакции между солями возможны только в случае хорошей растворимости обоих веществ, при этом образуются две новые соли. С нерастворимым соединением взаимодействие не случается. Некоторые вещества, относящиеся к кислым, реагируют со слабокислыми солями и со своими средними соединениями.
Получение и применение
Многие соединения солей всех видов встречаются в виде залежей минеральных пород и рассолов. Например: известняк, разные виды селитры, поваренная и калийная соли, сильвин, карналлит, натрон, мирабилит и многие другие. Условно все способы получения солевых веществ разделяют на физическую переработку сырья (выпаривание, кристаллизация, флотация и тому подобное) и извлечение их из полупродуктов, отходов других производств и минералов химическими способами, основанными на свойствах солей.
Больше всего химическая промышленность выпускает солей для сельского хозяйства, причем они используются как в качестве удобрений для хорошего роста растений и повышения урожайности, так и для их защиты от сорняков и вредителей. Минеральные соли используют и как сырье для производства самых разнообразных химических веществ, применяемых в таких отраслях:
- производство целлюлозы и бумаги;
- лакокрасочная промышленность;
- моющие средства;
- стекловарение;
- обработка кожи.
В качестве присадок и плавней соли применяются в металлургии для обогащения руд и при выплавке металлов. Производство цемента, одного из самых важных для строительной промышленности компонента, невозможно без известняка. Соли хрома используются при изготовлении огнеупорных материалов. Весь спектр разновидностей солей применяется и в фармацевтической промышленности.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Краткий список
Выбрана категория:
Соли
со всеми вложенными подкадегориями
Общее число найденных записей: 1487.
Показано записей: 20.
1. Глюконат кальция
Брутто-формула:
C12H22CaO14
CAS# 299-28-5
Названия
Русский:
- Глюконат кальция [Wiki]
- кальция (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаноат(IUPAC)
;
;
English:
- Calcicol
- Calciofon
- Calcipur
- Calcium gluconate [Wiki]
- Calglucol
- Calglucon
- D-Gluconic acid, calcium salt (2:1)(CAS)
- Dragocal
- E 578
- Ebucin
- Glucal
- Glucobiogen
- calcium (2R,3S,4R,5R)- 2,3,4,5,6-pentahydroxyhexanoate(IUPAC)
- calcium;(2R,3S,4R,5R)-2,3,4,5,6-pentahydroxyhexanoate(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
;
;
@:A()O^-`/|O`|`<`|wOH>`/<|wOH>`<`|wOH>`/<|dOH>«/HO@; Ca^2+<_(y-2,x-1,N0)@A()>_(x-1,y2,N0)@A()
HO/<|dOH>/<`|wOH><|wOH>/<`|wOH>|O`|/O^-$L(1.4)Ca^2+/0O`^-$L()|O`|/<`|dOH><|dOH>/<`|dOH><|wOH>/OH
2. Сульфат калия
Брутто-формула:
K2O4S
CAS# 7778-80-5
Названия
Русский:
- Сернокислый калий
- Сульфат калия(IUPAC) [Wiki]
- калия сульфат
;
;
;
English:
- Dipotassium sulfate
- E 515
- Potassium sulfate [Wiki]
- Sulfuric acid dipotassium salt
- dipotassium;sulfate(IUPAC)
;
;
;
;
;
K^+O`^-/S<_qq4O><_pp4O>/O^-K^+
3. Нитрат калия
Брутто-формула:
KNO3
CAS# 7757-79-1
Названия
Русский:
- Нитрат калия(IUPAC) [Wiki]
- азотнокислый калий
- калиевая селитра
- калийная селитра
- калия нитрат
;
;
;
;
;
English:
- EINECS:231-818-8
- Nitrate of potash
- Potassium nitrate(IUPAC) [Wiki]
- Saltpetre
;
;
;
;
O`^-/N^+`|O|O^-_(x1,N0)K^+
4. Хлорид калия
Брутто-формула:
ClK
CAS# 7447-40-7
Названия
Русский:
- Хлорид калия(IUPAC) [Wiki]
- калия хлорид
- хлористый калий
;
;
;
English:
- Chlorvescent
- E 508
- Enseal
- Kalitabs
- Kaochlor
- Klor-Con
- Klotrix
- Pfiklor
- Potassium chloride(IUPAC) [Wiki]
- Potavescent
- Slow-K
;
;
;
;
;
;
;
;
;
;
;
5. Карбонат калия
Брутто-формула:
CK2O3
CAS# 584-08-7
Названия
Русский:
- Карбонат калия(IUPAC) [Wiki]
- калия карбонат
- поташ
- углекислый калий
;
;
;
;
English:
- EINECS:209-529-3
- Potash
- Potassium carbonate(IUPAC) [Wiki]
- pearl ash
;
;
;
;
6. Гидрокарбонат калия
Брутто-формула:
CHKO3
CAS# 298-14-6
Названия
Русский:
- Гидрокарбонат калия(IUPAC) [Wiki]
- Углекислый калий, кислый
- бикарбонат калия
- калия гидрокарбонат
;
;
;
;
English:
- EINECS:206-059-0
- EPA Pesticide Chemical Code 073508
- Kaligreen
- Monopotassium carbonate
- Potassium bicarbonate [Wiki]
- Purple K
- compounds
- monopotassium salt;
- potassium acid carbonate
- potassium hydrogen carbonate(IUPAC)
;
;
;
;
;
;
;
;
;
;
7. Сульфат натрия
Брутто-формула:
Na2O4S
CAS# 7757-82-6
Названия
Русский:
- Сульфат натрия(IUPAC) [Wiki]
- натрий сернокислый
- натрия сульфат
;
;
;
English:
- Bisodium sulfate
- Disodium sulfate
- Disodium sulphate
- EINECS:231-820-9
- Salt cake
- Sodium sulfate(IUPAC) [Wiki]
- Sodium sulphate
- Sulfate, sodium
- Sulfuric acid disodium salt
- Sulfuric acid, disodium salt
- Thenardite
- disodium;sulfate(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
$slope(15)Na^+/0O^-<Na^+>|S<`=O><=O>|O^-
$L(1.2)Na^+O`^-/S<_qq4O><_pp4O>/O^-Na^+
8. Нитрат натрия
Брутто-формула:
NNaO3
CAS# 7631-99-4
Названия
Русский:
- Натриевая селитра
- Нитрат натрия(IUPAC) [Wiki]
- азотнокислый натрий
- натрия нитрат
- натронная селитра
- чилийская селитра
;
;
;
;
;
;
English:
- Caliche
- Chile saltpeter
- E 251
- EINECS:231-554-3
- Nitrate of soda
- Nitratine
- Nitric acid monosodium salt
- Nitric acid sodium salt
- Nitric acid sodium salt (1:1)
- Peru saltpeter
- Soda niter
- Sodium nitrate(IUPAC) [Wiki]
- cubic niter
;
;
;
;
;
;
;
;
;
;
;
;
;
O`^-/N^+`|O|O^-_(x1,N0)Na^+
9. Хлорид натрия
Брутто-формула:
ClNa
Названия
Русский:
- Хлорид натрия(IUPAC)
- галит
- каменная соль
- натрия хлорид
- обычная соль
- пищевая соль
- поваренная соль
- столовая соль
;
;
;
;
;
;
;
;
English:
- Common salt
- Halite
- Rock salt
- Saline
- Sodium chloric
- Sodium chloride(IUPAC)
- Table salt
;
;
;
;
;
;
;
10. Карбонат натрия
Брутто-формула:
CNa2O3
CAS# 497-19-8
Названия
Русский:
- Карбонат натрия [Wiki]
- динатрий(IUPAC)
- кальцинированная сода
- натрия карбонат
- триоксокарбонат(IUPAC)
- углекислый натрий
;
;
;
;
;
;
English:
- EINECS:207-838-8
- Soda ash
- Soda crystals
- Sodium carbonate(IUPAC) [Wiki]
- Washing soda
;
;
;
;
;
Na^+|0O`^-/`|O|O^-`|0Na^+
11. Гидрокарбонат натрия
Брутто-формула:
CHNaO3
CAS# 144-55-8
Названия
Русский:
- Гидрокарбонат натрия(IUPAC)
- бикарбонат натрия
- натрий двууглекислый
- натрия гидрокарбонат
- питьевая сода
- пищевая сода
;
;
;
;
;
;
English:
- Baking soda, bicarbonate of soda
- Sodium bicarbonate
- Sodium hydrogen carbonate(IUPAC)
- nahcolite
- sodium hydrogencarbonate
;
;
;
;
;
12. Сульфат кальция
Брутто-формула:
CaO4S
CAS# 7778-18-9
Названия
Русский:
- Сульфат кальция(IUPAC) [Wiki]
- алебастр
- гипс
- кальций сернокислый
- кальция сульфат
- селенит
;
;
;
;
;
;
English:
- Anhydrite
- Anhydrous gypsum
- Calcium sulfate(IUPAC) [Wiki]
- Crysalba
- Drierite
- EINECS:231-900-3
- Gypsum
- Karstenite
- Muriacite
- Osteoset
- Sulfuric acid, calciumsalt (1:1)(CAS)
- Thiolite
;
;
;
;
;
;
;
;
;
;
;
;
Ca^2+O//S`|O|<_(A80,w+)O^->dO^-
Ca^++/0O`^-# -S`|O|<=O>|O^-
13. меди хлорокись
Брутто-формула:
H3ClCu2O3
CAS# 1332-65-6
Названия
Русский:
- Абига-Пик
- Куприкол
- Оксихлорид меди
- ХОМ
- меди хлорокись
;
;
;
;
;
English:
- Dicopper chloride trihydroxide(IUPAC)
- copper chloride hydroxide(CAS)
- copper oxychloride
;
;
;
$L(1.2)Cu^2+Cl^-|0O^-<H`>`/0Cu^2+`O^-<`/H>`|0O^-`H
14. Хлорид кальция
Брутто-формула:
CaCl2
Названия
Русский:
- Хлорид кальция(IUPAC) [Wiki]
- Хлористый кальций
- кальция хлорид
;
;
;
English:
- Anhydrous calcium chloride
- Calcium chloride(IUPAC) [Wiki]
- Calcium dichloride
- Calcium(II) chloride
- Calcosan
- Calplus
- Caltac
- Dowflake
- E509
- EINECS:233-140-8
- Liquidow
- Peladow
- Snomelt
- Superflake anhydrous
;
;
;
;
;
;
;
;
;
;
;
;
;
;
15. Карбонат кальция
Брутто-формула:
CCaO3
CAS# 471-34-1
Названия
Русский:
- Карбонат кальция(IUPAC)
- кальция карбонат
- углекислый кальций
;
;
;
English:
- Calcium carbonate(IUPAC)
- Limestone
- aragonite
- calcite
- chalk
- marble
- pearl
;
;
;
;
;
;
;
$slope(35)Ca^++`/0O^-C|O`|/O^-
16. Гидрокарбонат кальция
Брутто-формула:
C2H2CaO6
Названия
Русский:
- Гидрокарбонат кальция(IUPAC)
- кальция гидрокарбонат
;
;
English:
- Calcium bicarbonate
- Calcium hydrogen carbonate(IUPAC)
;
;
HO/`|O|O^-/0Ca^2+O`^-/`|O|OH
17. Сульфат магния
Брутто-формула:
MgO4S
CAS# 7487-88-9
Названия
Русский:
- Сернокислый магний
- Сульфат магния(IUPAC) [Wiki]
- магний сернокислый
- магния сульфат
- эпсомская соль
;
;
;
;
;
English:
- Magnesium sulfate(IUPAC) [Wiki]
- magnesium sulphate
;
;
Mg^2+O//S`|O|<_(A80,w+)O^->dO^-
Mg^2+/0O`^-# -S`|O|<||O>-O^-
18. Нитрат магния
Брутто-формула:
MgN2O6
CAS# 10377-60-3
Названия
Русский:
- Нитрат магния(IUPAC) [Wiki]
- магния нитрат
;
;
English:
- EINECS:233-826-7
- Magnesium dinitrate
- Magnesium nitrate(IUPAC)
- Magnesium(II) NItrate
- Magnesium(II) Nitrate (1:2)
- Magniosan
- Nitricacid, magnesium salt (8CI,9CI)
;
;
;
;
;
;
;
O`^-/N^+`|O|O^-/0Mg^2+O`^-/N^+`|O|O^-
O=N^+</O^->O^-_(x1.2,y#2,N0)Mg^2+_(x1.2,y#3,N0)O`^-N`^+<`/O`^->=O
19. Хлорид магния
Брутто-формула:
Cl2Mg
CAS# 7786-30-3
Названия
Русский:
- Хлорид магния(IUPAC)
- магния хлорид
- хлористый магний
;
;
;
English:
- Aerotex Accelerator MX
- C-TEK
- Catalyst G
- E 511
- Ekimac
- FIX-Mg
- Freecat MX
- HMC 23D
- Magnesium chloride(IUPAC)(CAS)
- Magnesium dichloride
- Magnesium(II) chloride
- Magnogene
- White Nigari NS
;
;
;
;
;
;
;
;
;
;
;
;
;
20. Карбонат магния
Брутто-формула:
CMgO3
Названия
Русский:
- Карбонат магния(IUPAC)
- Магния карбонат
- магний углекислый
;
;
;
English:
- Magnesite
- Magnesium carbonate(IUPAC)
;
;