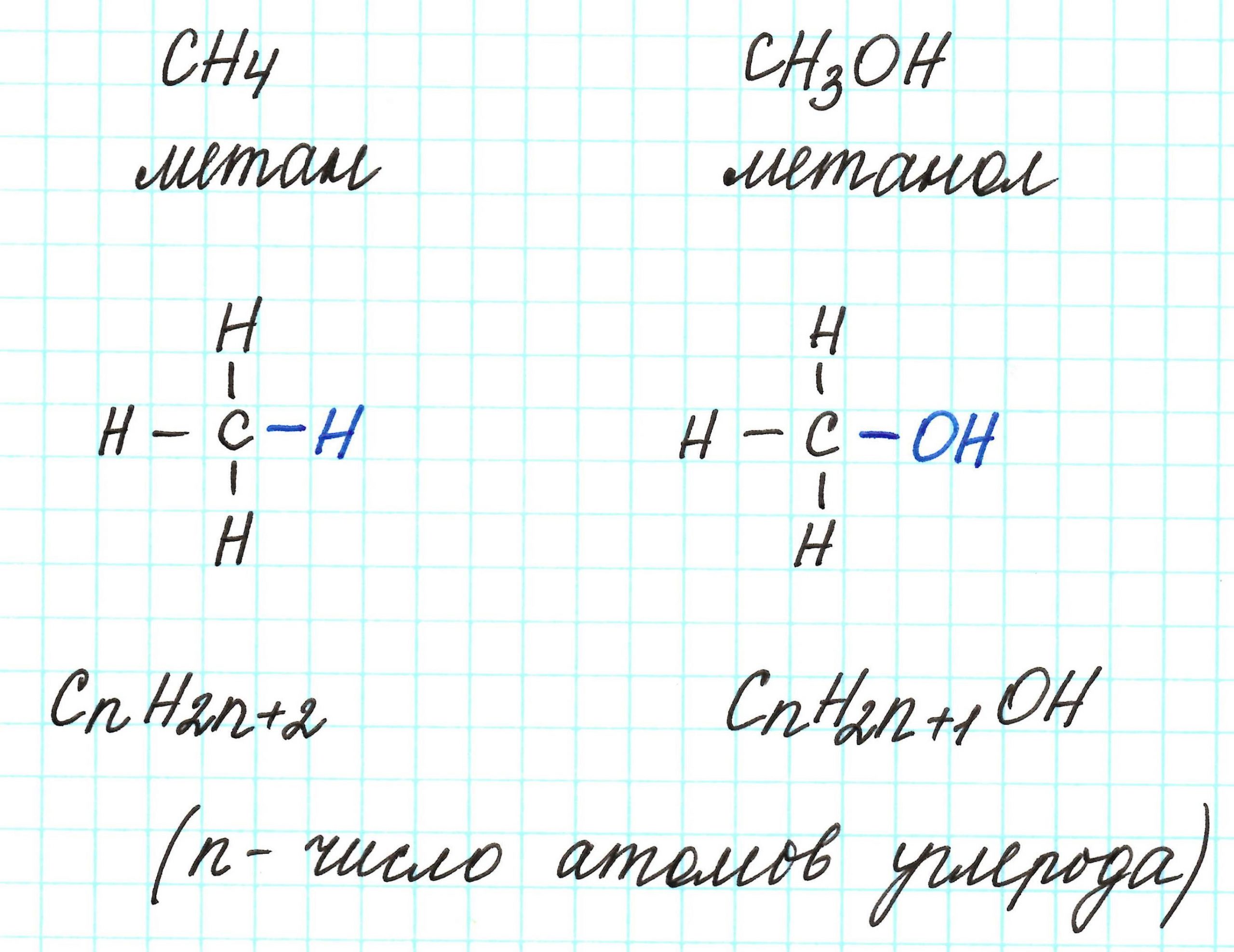
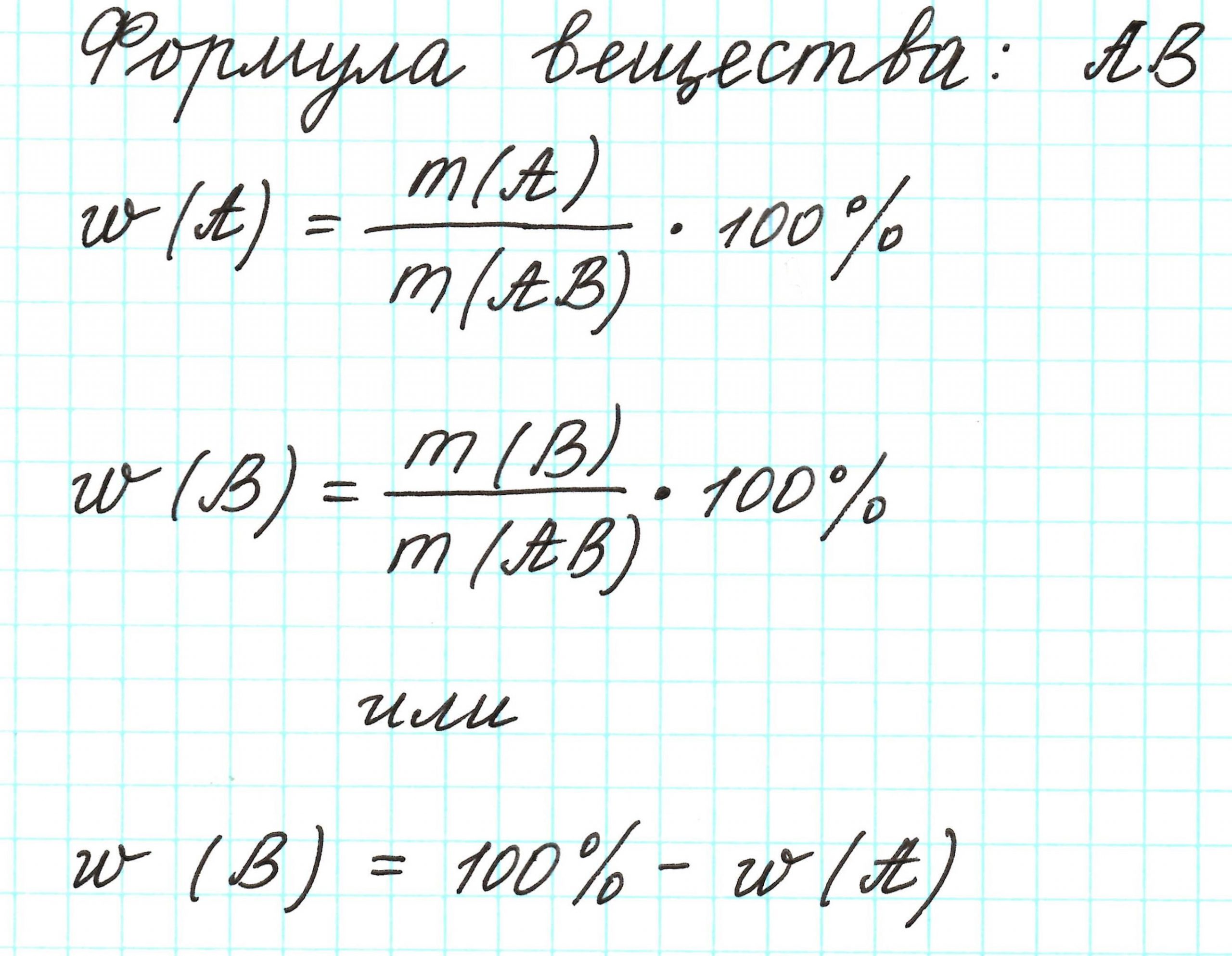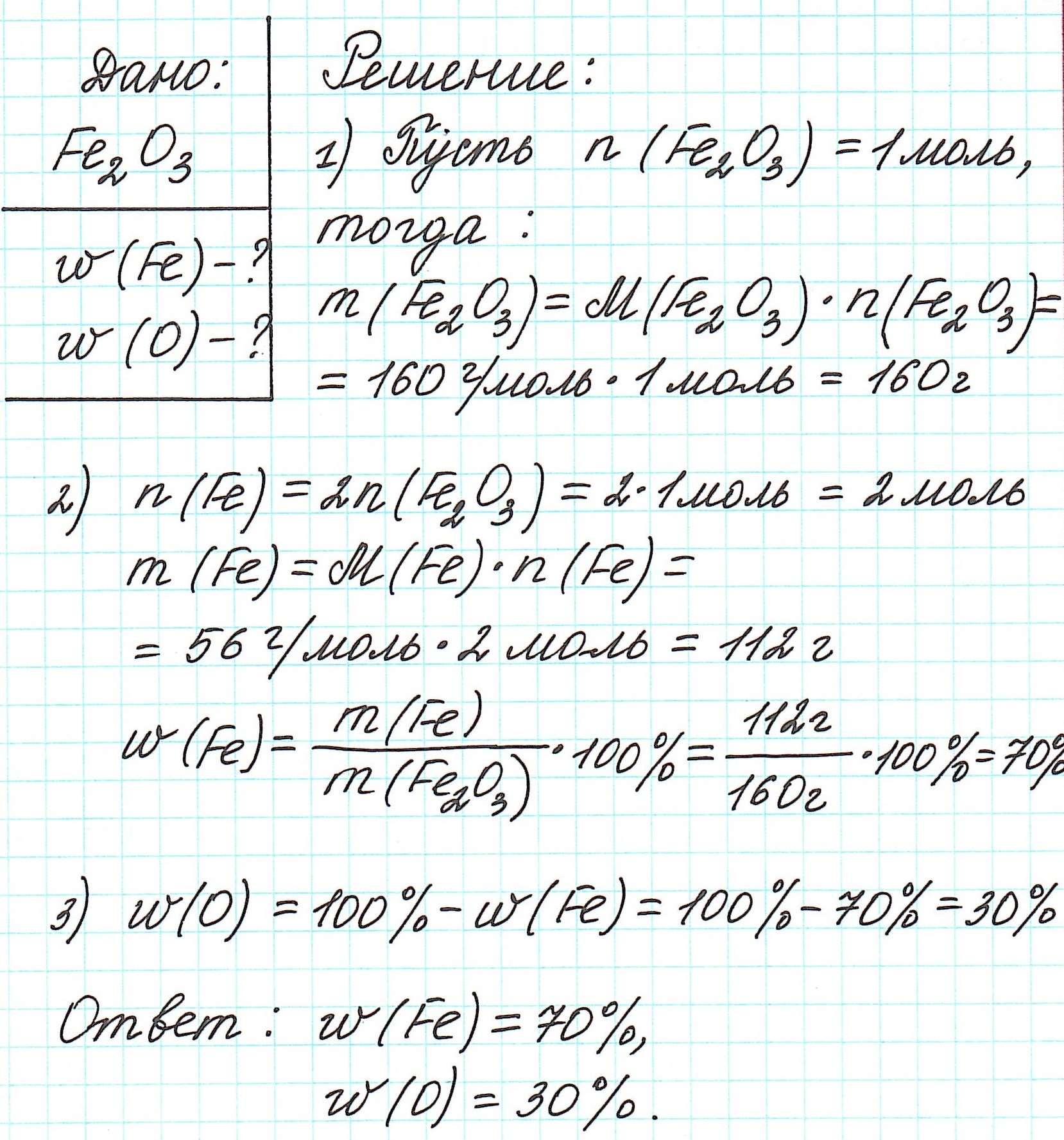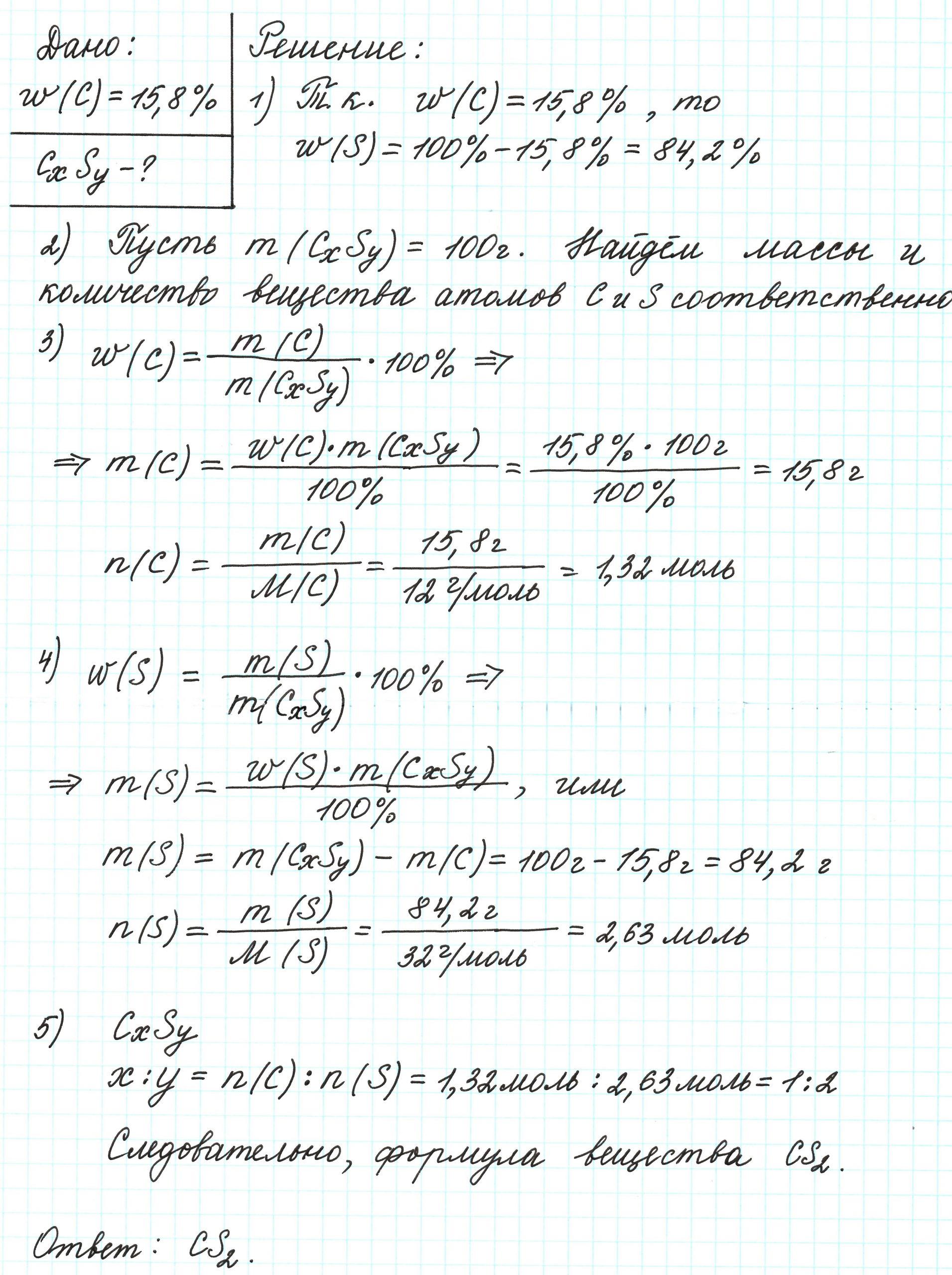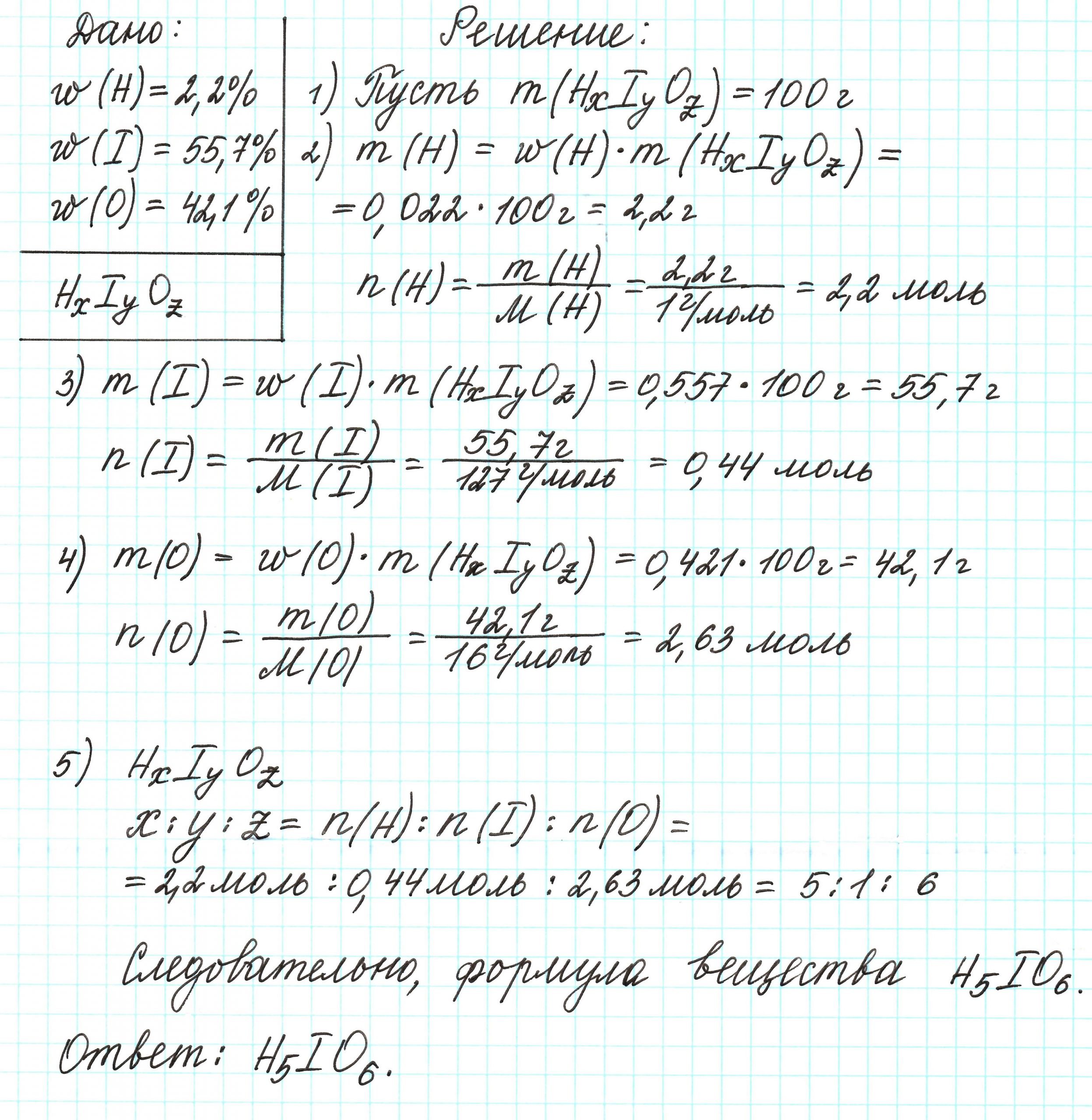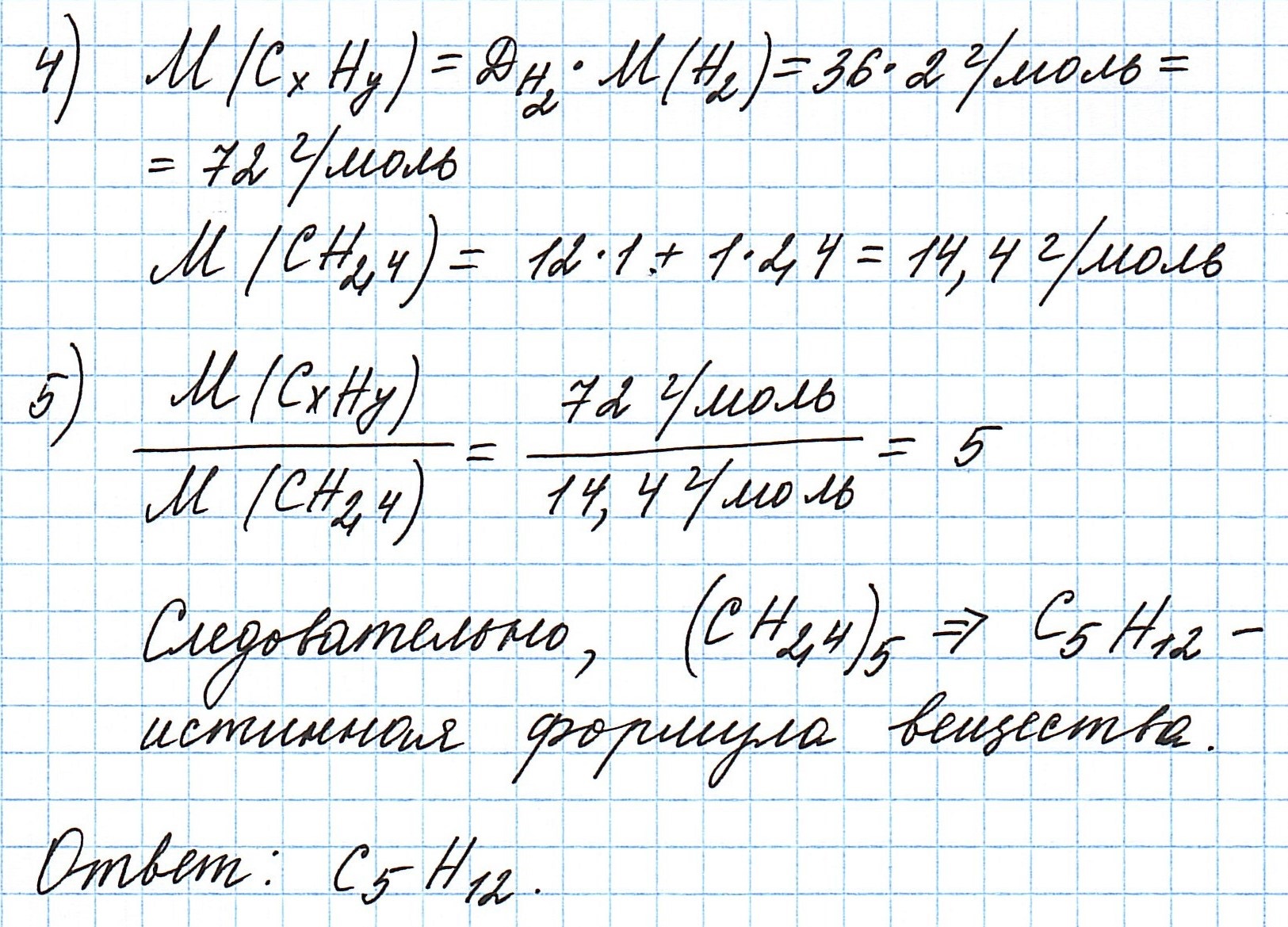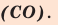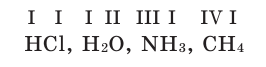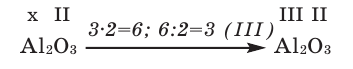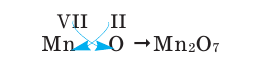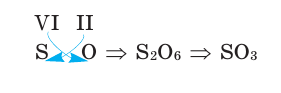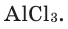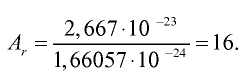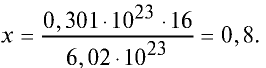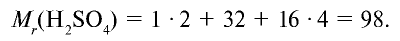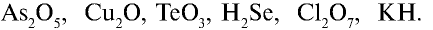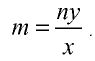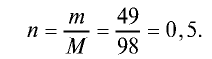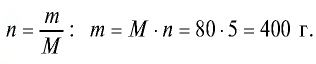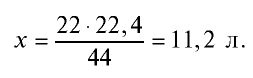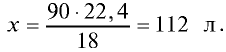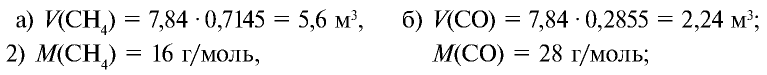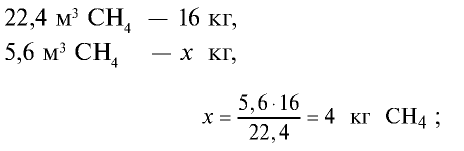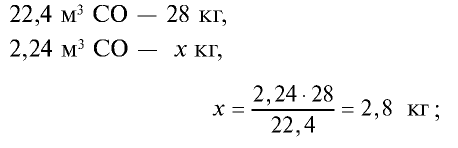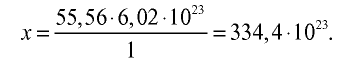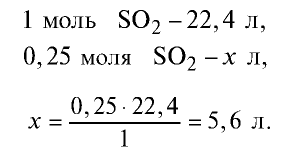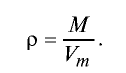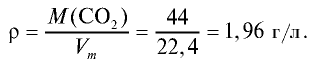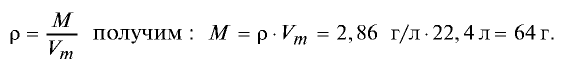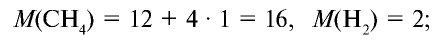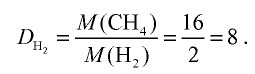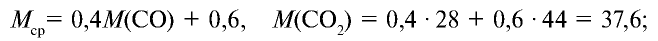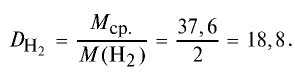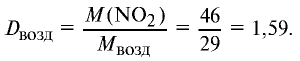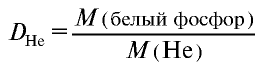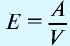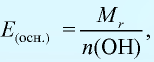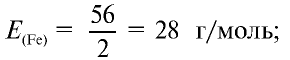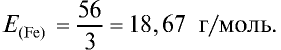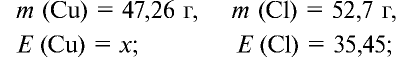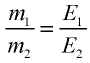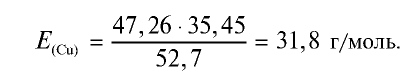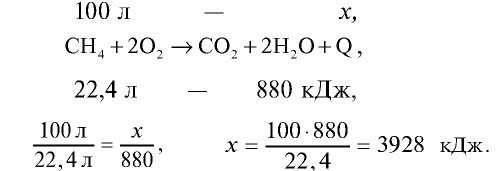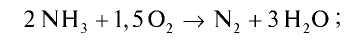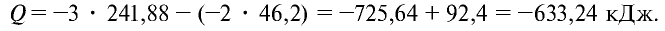Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
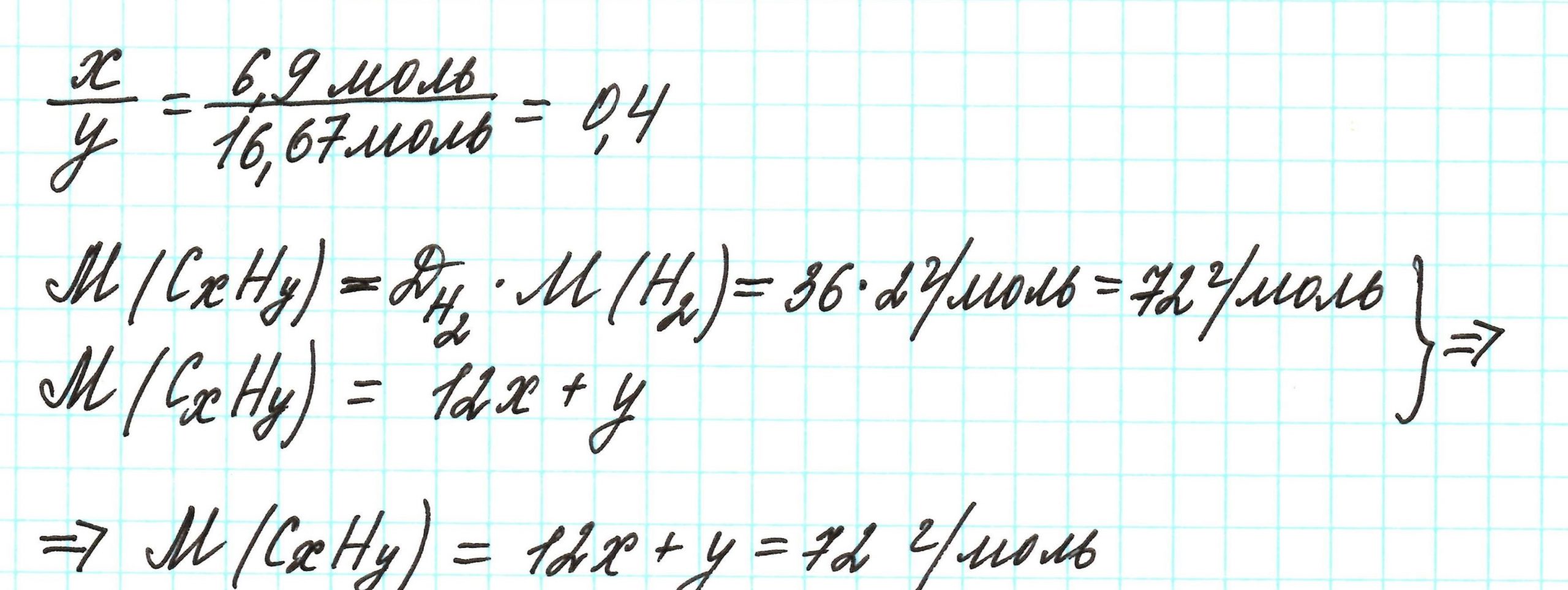
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
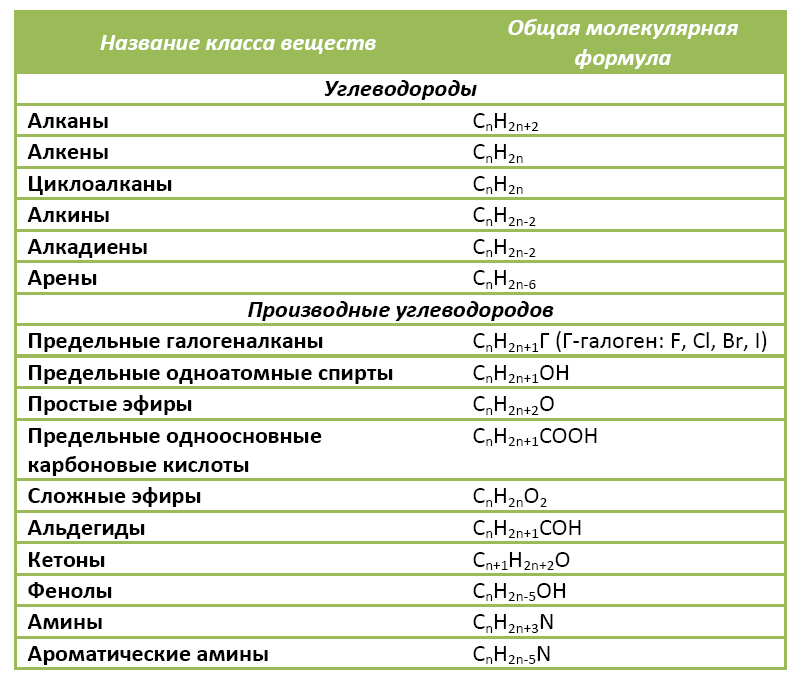
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
определим молекулярную формулу углеводорода, в котором содержится (85,71)
%
углерода и (14,29)
%
водорода. Известно, что относительная плотность этого углеводорода по воздуху составляет (0,966).
Первый вариант решения
1. В веществе содержатся только атомы углерода и водорода, значит, его формулу можно записать так —
CxHy
. Индексы в формуле показывают отношение количеств атомов:
x:y=n(C):n(H).
По массовым долям определяем, что в (100) г углеводорода содержится (85,71) г углерода и (14,29) г водорода.
Найдём количества этих элементов:
x=m(C)Ar(C)=85,71 г12 г/моль=7,1425 моль;
y=m(H)Ar(H)=14,29г1г/моль=14,29моль;
x:y=7,1425:14,29=7,14257,1425:14,297,1425=1:2.
Значит, простейшая формула углеводорода —
CH2
.
2. Определим относительную молекулярную массу вещества и сравним её с массой
CH2
:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
Mr(CxHy)Mr(CH2)=2814=2.
Следовательно, молекулярная формула вещества
(CH2)2=C2H4.
Второй вариант решения
1. Определим относительную молекулярную массу углеводорода:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
2. Найдём число атомов углерода и водорода в молекуле:
x=Mr(C)⋅w(C)Ar(C)⋅100%=28⋅85,71%12⋅100%=2;
y=Mr(CxHy)⋅w(H)Ar(H)⋅100%=28⋅14,29%1⋅100%=4.
Решение задач на вывод формул в соединении
Ключевые слова конспекта: решение задач на вывод формул в соединении, простейшая формула соединения, эмпирическая формула, истинная формула, молекулярная формула, вывод формулы, установление формулы, рассчитать количество вещества элементов.
При определении формул химических соединений необходимо различать простейшую (или эмпирическую) формулу соединения и его истинную (или молекулярную) формулу.
Простейшая формула (эмпирическая формула) показывает соотношение числа атомов каждого элемента в молекуле (формульной единице) вещества. Например, простейшая формула оксида фосфора (V) Р2O5. Она показывает, что на каждые 2 атома фосфора в молекуле данного оксида приходится 5 атомов кислорода.
Истинная формула (молекулярная формула) показывает точный качественный и количественный состав одной молекулы данного соединения. Так, истинная формула оксида фосфора (V) Р4О10. Она показывает, что одна молекула данного оксида образована четырьмя атомами фосфора и десятью атомами кислорода.
При выводе простейшей формулы соединения необходимо помнить, что индексы в ней пропорциональны количествам вещества элементов, образующих данное соединение и содержащихся в определенной порции данного вещества. Например, 1 моль воды содержит 2 моль атомов водорода и 1 моль атомов кислорода (т. е. v(H) : v(O) = 2:1, а формула воды — Н2О). Таким образом, чтобы определить простейшую формулу вещества, необходимо рассчитать количество вещества элементов, образующих данное соединение.
Чтобы установить истинную формулу, необходимо знать относительную молекулярную (или молярную) массу данного соединения. Молекулярная масса в целое число раз больше массы, которая отвечает простейшей формуле. На это число нужно умножить индексы в простейшей формуле, чтобы получить молекулярную формулу. Например, простейшая формула глюкозы СН2О, относительная молекулярная масса, отвечающая этой формуле, равна 30. Истинная относительная молекулярная масса глюкозы равна 180, т. е. в 6 раз больше. Таким образом, истинная формула глюкозы (СН2О)6, или С6Н12О6.
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Массовые доли железа и серы в соединении равны соответственно 46,67 и 53,33%. Определите формулу этого соединения.
Ответ. FeS2.
Задача № 2.
Массовая доля азота в оксиде азота равна 36,84%. Выведите простейшую формулу данного оксида.
Посмотреть РЕШЕНИЕ
Ответ. N2О3.
Задача № 3.
Массовая доля серы в ее оксиде в 1,5 раза меньше массовой доли кислорода. Определите простейшую формулу оксида.
Посмотреть РЕШЕНИЕ
Ответ. SО3.
Задача № 4.
Элемент образует оксид состава ЭO2. Плотность оксида по воздуху равна 1,586. Определите неизвестный элемент.
Посмотреть РЕШЕНИЕ
Ответ. Э — азот.
Задача № 5.
Азот образует оксид, плотность паров которого по гелию равна 19, а массовая доля кислорода в нем — 63,16%. Определите молекулярную формулу неизвестного оксида.
Посмотреть РЕШЕНИЕ
Ответ. N2О3.
Задача № 6.
Плотность по водороду смеси оксида серы (IV) и одного из оксидов азота равна 20,1, массовая доля оксида азота в смеси 52,24%, а массовая доля азота в оксиде — 46,67%. Определите молекулярную формулу оксида азота.
Посмотреть РЕШЕНИЕ
Ответ. NО.
Задача № 7.
Из 185,6 г оксида железа при восстановлении было получено 134,4 г железа. Какова формула данного оксида?
Посмотреть РЕШЕНИЕ
Ответ. Fe3О4.
Задача № 8.
Массы углерода и водорода, входящие в состав газа, занимающего объем 16,8 л (н. у.), равны соответственно 18 и 4,5 г. Определите истинную формулу газа.
Посмотреть РЕШЕНИЕ
Ответ. С2Н6.
Задача № 9.
Отношение молярных масс хлорида и оксида металла (М), в которых металл проявляет степень окисления +2, равно 1,679. Определите неизвестный металл.
Посмотреть РЕШЕНИЕ
Ответ. Цинк.
Задача № 10.
Элементы X и Y образуют с хлором соединения состава ХYСl2 и XY2Cl2. Массовые доли хлора в этих соединениях равны соответственно 59,66 и 52,59%. Определите формулы неизвестных соединений.
Посмотреть РЕШЕНИЕ
Ответ. SOCl2 и SO2Cl2.
Решение задач на вывод формул в соединении. Выберите дальнейшие действия:
- Перейти к: Решение задач на расчет исходных веществ и продуктов реакции
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Содержание:
Составление химических формул по валентности:
Пользуясь знаками представленных химических элементов, запишите химические формулы воды, поваренной соли, углекислого газа, серной кислоты. На чём основывается запись химических формул веществ?
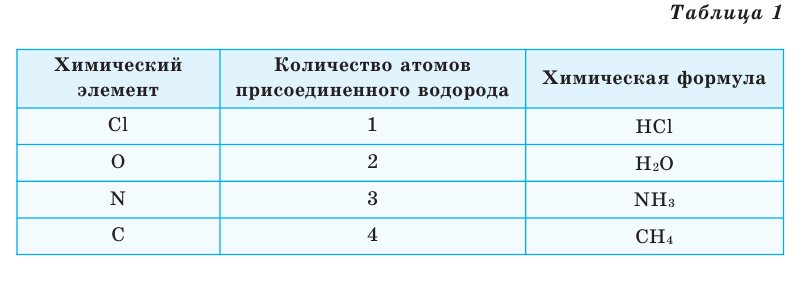
Химические формулы веществ можно вывести на основе различных химических опытов. Рассмотрим формулы водородных соединений некоторых элементов (таблица 1).
Из таблицы становится ясно, что атом хлора присоединяется с 1, атом кислорода — с 2, атом азота — с 3, а атом углерода — с 4 атомами водорода. Следовательно, химические элементы обладают разной способностью присоединять к себе атомы водорода. Для объяснения этого пользуются понятием «валентности». Свойство атомов химических элементов присоединять к себе определенное число атомов других химических элементов называют валентностью. Понятие валентности впервые было введено в 1852 году английским ученым Э.Франклендом.
Английский химик. В 1852 г. им было введено в науку понятие о соединительной силе атомов друг к другу. Данное свойство атомов впоследствии было названо валентностью.
Кислород в угарном газе в ионе гидроксония 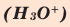
Валентность выражают римскими цифрами. Валентность водорода принята за единицу, и поэтому валентности других элементов берутся в сопоставлении с ним.
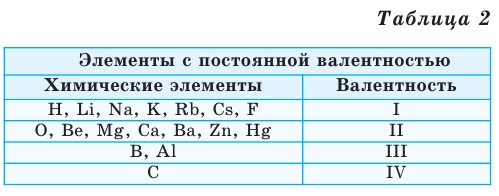
Валентность некоторых химических элементов остается неизменной во всех их химических соединениях, т.е. всегда обозначается одной и той же цифрой. Это элементы с постоянной валентностью (таблица 2).
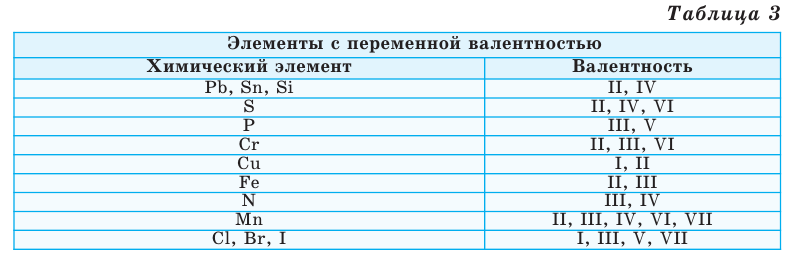
Однако другая группа элементов в различных химических соединениях имеет различную валентность. Их называют элементами с переменной валентностью (таблица 3).
Зная валентность химических элементов, можно легко составить формулу бинарного (двухэлементного) соединения, образованного ими. Для этого следует записать химические знаки элементов, проставив над ними их валентность. Далее, определив наименьшее общее кратное чисел, выражающих валентность этих элементов, его делят на валентность каждого из них и находят их индексы. Например:
1) Определим валентность атома алюминия по кислороду в химическом соединении 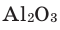
2) Составим химическую формулу соединения VII-валентного элемента марганца с кислородом:
3) Если при составлении формулы по валентности полученные индексы сократить до минимальных целых чисел, в таком случае можно, проведя эту операцию, получить простую формулу вещества (поделив VI и II на самый большой делитель — 2, можно получить формулу).
Химическая формула
Заполните таблицу. Как произносится химическая формула вещества?
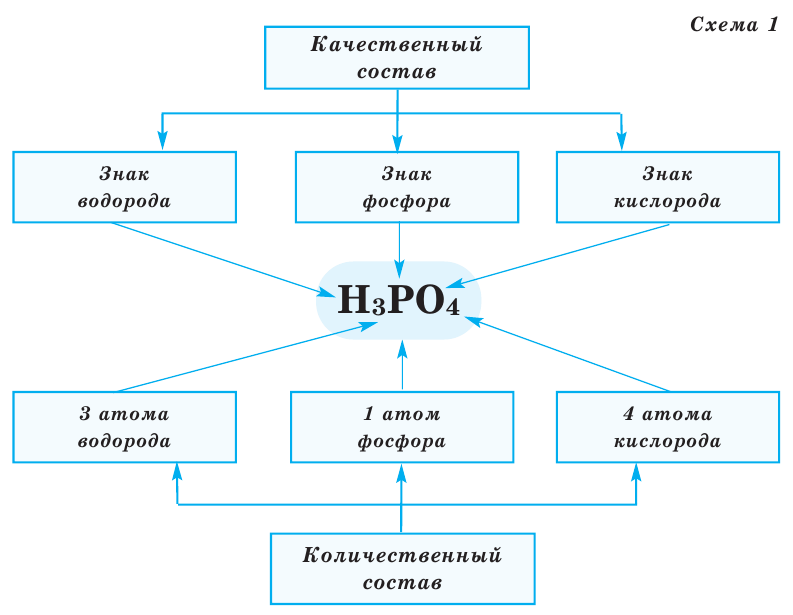
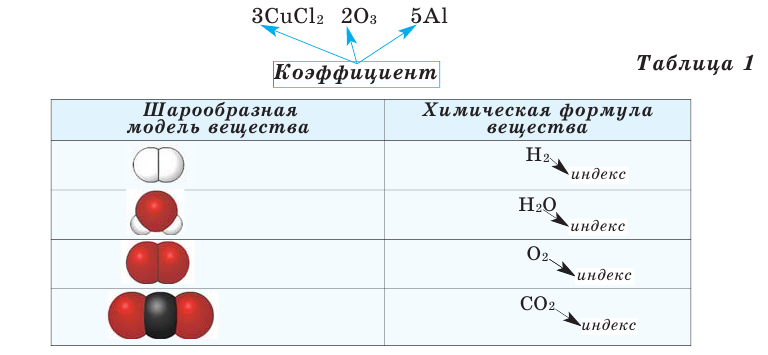
Все вещества имеют химическую формулу. Условное обозначение состава вещества при помощи химических знаков и индексов называют химической формулой. Химическая формула вещества выражает его количественный и качественный состав. Качественный состав вещества показывает, из атомов каких элементов оно состоит, а его количественный состав — число атомов элемента, содержащихся в его составе, т.е. в одной молекуле. Число, расположенное справа внизу у знака элемента и показывающее количество атомов, называется индексом (схема 1).
Число, стоящее перед химическими формулами и химическими знаками, называется коэффициентом.
На основе представленных в таблице 1 моделей молекул и химических формул водорода, кислорода, воды и углекислого газа можно определить число атомов в их составе (таблица 2).
Пользуясь краткими названиями химических элементов, можно прочитать формулы:
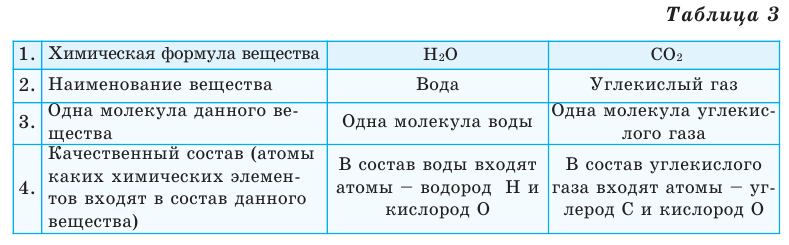
Выясним, какие сведения о веществе можно получить по его химической формуле (таблица 3).
Состав веществ определяют разными физико-химическими способами, методом анализа результатов химических опытов. Так, например, в результате разложения воды под воздействием постоянного электрического тока наблюдается превышение в два раза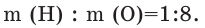
Французский химик. В период с 1799 по 1806 гг. исследовал составы различных оксидов, сульфидов и других веществ. В итоге им был открыт закон постоянства состава химических соединений.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Как известно, не все вещества имеют молекулярное строение. Целая группа веществ имеет немолекулярное строение. Как же составляются химические формулы этих веществ? Химические формулы веществ с немолекулярным строением составляются на основе количественного соотношения частиц элементов (атомов или ионов) в соединениях. Для определения этого соотношения выясняется, сколько частиц другого элемента окружает (соединяется) частицу элемента в кристалле вещества немолекулярного строения. Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения. В результате таких исследований стало известно, что в кварце количественное соотношение между атомами кремния (Si) и кислорода (О) составляет 1:2. Значит, его формулу можно представить в виде: 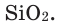

Начальные химические понятия и законы
Для овладения всесторонними знаниями о величинах атомов, а также их относительных и абсолютных массах требуется усвоить следующие важнейшие понятия.
Атом — это мельчайшая химически неделимая частица вещества.
Слово «атом» в переводе с древнегреческого языка означает ~ «неделимый».
В настоящее время доказано, что атом состоит из ряда более мелких частиц.
Химический элемент — это вид определенных атомов. Например, атомы кислорода означают элемент кислород (табл. 1).
Каждый химический элемент обозначается символом — первой буквой своего латинского названия или при необходимости первой и следующей за ней буквами. Например, Н (аш) — химический символ водорода, от латинского слова Hydrogenium («образующий воду»).
Будучи мельчайшими частицами, атомы обладают определенной массой. Так, абсолютная масса атома водорода составляет 0,00000000000000000000001674 г или 1,674•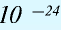

Относительная масса атома — это число, указывающее, во сколько раз масса атома химического элемента больше 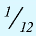
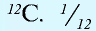
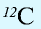

Относительная масса атома обозначается буквой Аг, где г — относительность (relative).
Количество вещества — величина, численно равная относительной атомной массе элемента, — выражается в г-молях (или молях).
В 1 моле любого вещества содержится 6,02•
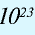
Таблица 1
Показатели некоторых химических элементов
| Химический элемент | Символ | Абсолютная масса атома, г | Абсолютная масса атома, 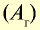 |
Число атомов в 1 моле |
| Водород | Н | 1,674•  |
1,008 | 6,02• |
| Кислород | О | 26,567• |
15,999 | 6,02• |
| Углерод | С |
19,993• |
12,011 | 6,02• |
Пример №1
Абсолютная масса атома кислорода равна 2,667•
Решение. Единица массы 1 атома равна 1,66057•
Ответ: 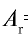
Пример №2
Какой будет масса (г) 0,301 • 
Решение. 6,02 •
Тогда, если 6,02 • 

Ответ: 0,8 г.
Определение химической формулы
- Химическая формула — это выражение состава молекулы вещества посредством химических символов и (при необходимости) индексов.
- По химической формуле можно определить качественный и количественный состав вещества.
Например: 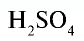
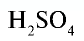
Точно так же можно найти абсолютную и относительную массы молекулы. Для нахождения абсолютной массы производится сложение абсолютных масс 2 атомов водорода, 1 атома серы и 4 атомов кислорода. Выполнение действий с такими малыми числами вызывает трудности, поэтому рассчитывают относительную массу молекулы (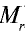
1 моль — значение, выраженное в граммах и численно равное относительной молекулярной массе вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода (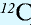
В 12 г углерода содержится 6,02•
Количество вещества обозначается буквой n и его значение выражается в молях.
Молярная масса вещества обозначается буквой М и выражается в г/молях (табл. 2).
Таблица 2
Показатели некоторых химических веществ
| Вещество | Химическая формула | Молярная масса, г/моль | Количество вещества, моль | Число молекул |
| Вода | 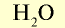 |
18 | 1 | 6,02• |
| Углекислый газ | 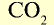 |
44 | 1 | 6,02• |
| Серная кислота | 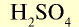 |
98 | 1 | 6,02• |
Валентность
1. Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Свойство атомов элемента присоединять определенное число атомов другого элемента называется валентностью.
В качестве единицы измерения валентности принята валентность водорода.
Валентность атома водорода равна единице. Атом кислорода всегда двухвалентен.
Неизвестная валентность элемента определяется по водородным или кислородным соединениям, а также соединениям с каким-нибудь другим элементом, валентность которого известна.
Пример №3
Перепишите в тетрадь формулы следующих соединений и определите их валентность:
Решение.
1) 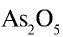
2) 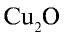
3) 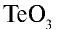
4) 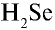
5) 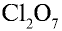
6) КН — 1•1 = 1, 1 : 1 =1. Калий одновалентен.
2. Составление формулы вещества, состоящего из двух элементов, валентности которых известны.
Пример №4
Составьте формулу оксида фосфора (V), зная, что фосфор пятивалентен, кислород двухвалентен.
Решение:
1) запишем символы фосфора и кислорода — РО;
2) запишем валентности элементов римскими цифрами над их символами — 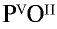
3) определим самое малое общее делимое чисел, выражающих валентности, то есть пяти и двух. Оно равно десяти;
4) чтобы найти число атомов элементов в формуле, разделим общее делимое на валентности элементов: фосфор — 10 : 5 = 2; кислород — 10:2 = 5. Следовательно, в соединении фосфор представлен двумя, а кислород — пятью атомами.
5) запишем найденные числа атомов в индексе химических символов — 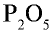
Пример №5
Определите валентность углерода в оксиде углерода (IV). Решение. Валентность кислорода в соединении равна двум, углерода — m. Если известны формула соединения и валентность (n) одного из элементов, валентность (m) второго можно определить по формуле
Например, валентность углерода в 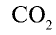
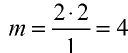
Количество вещества
Определение количества вещества, если известна его масса, или нахождение его массы, если известно количество вещества.
Пример №6
Вычислите количество вещества в 49 г серной кислоты.
Решение.
1) 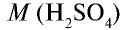
2) вычислим количество вещества n по формуле
Ответ: 0,5 моля.
Пример №7
Сколько граммов составляют 5 молей оксида меди(||)?
Решение.
1) М (СuО) = 64+ 16- 80 г/моль;
2) найдем массу вещества по формуле
Ответ: 5 молей СuО равны 400 г.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (закон Авогадро). 1 моль вещества в газообразном или парообразном состоянии при н.у. занимает объем 22,4 л, который называется молярным объемом (табл. 3).
Таблица 3
Молярные объемы некоторых газообразных веществ
| Вещество | 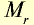 |
Молярная масса, г/моль | Молярный объем, л | Число молекул |
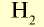 |
2 | 2 | 22,4 | 6,02• |
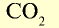 |
44 | 44 | 22,4 | 6,02• |
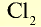 |
71 | 71 | 22,4 | 6,02• |
Плотность газа определятся по формуле 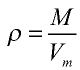
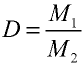
1. Определение объема газов.
Пример №8
Какой объем (л, ну) займут 22 г углекислого газа?
Решение:
1) 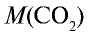
2) вычислим объем 22 г 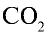
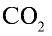
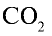
Ответ: 22 г 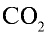
Определив количество вещества в 22 г углекислого газа, зная, что 1 моль любого газа занимает объем 22,4 л (н.у.), найдем
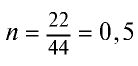
Если 1 моль газа занимает объем 22,4 л, то 0,5 моля — 11,2 л.
Пример №9
Каким будет объем 90 г воды, переведенной в газообразное (пар) состояние при 20°С ?
Решение. Жидкие и твердые вещества при переходе в газообразное состояние подчиняются тем же законам, что и газы. Поэтому:
1) М(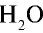
2) рассчитаем объем 90 г воды в газообразном состоянии с помощью пропорции:
18 г 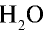
90г 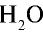
Ответ: объем 90 г водяного пара — 112 л.
Пример №10
Определите массу 7,84 м3 смеси, содержащей 71,45% метана и 28,55% оксида углерода (II).
Решение:
1) сколько метана и оксида углерода (II) содержится в 7,84 м3 смеси?
3)найдем массу 5,6 м3 СН4 с помощью пропорции: 22,4 м3 СН4 — 16 кг,
4) найдем массу 2,24 м3 СО с помощью пропорции: 22,4 м3 СО — 28 кг,
5) общая масса смеси газов: 4 кг + 2,8 кг = 6,8 кг.
Ответ: общая масса смеси газов — 6,8 кг.
Пример №11
Рассчитайте количество вещества и число молекул в 1 л воды при 20°С .
Решение:
1) найдем массу 1 л воды. Плотность воды — 1 г/см3. Отсюда т{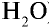
2) вычислим количество вещества в 1000 г воды:
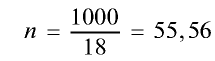
3) определим число молекул в 1 л (в 1000 г, или 55,56 моля) воды с помощью пропорции: в 1 моле воды — 6,02•
Ответ: в 1 л воды содержится 55,56 моля, 334,4 • 
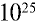
Пример №12
Какой объем (л,н.у.) займут 16 г оксида серы (IV)?
Решение:
1) найдем количество вещества в 16 г 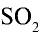
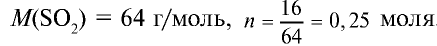
2) вычислим, какой объем займут 16 г (или 0,25 моля) 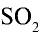
Ответ: 16 г 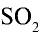
Вычисление плотности газов
Плотность газов определяется путем деления их молярной массы на молярный объем:
Пример №13
Рассчитайте плотность углекислого газа.
Решение:
Ответ: плотность углекислого газа — 1,96 г/л.
Пример 2. Рассчитайте молярную массу газа с плотностью р = 2,86 г/л.
Решение.
Из формулы
Ответ: молярная масса газа с плотностью 2,86 г/л —64 г.
Вычисление относительной плотности газов
Пример №14
Вычислите плотность метана относительно водорода.
Решение:
1) рассчитаем молекулярные массы метана и водорода:
2) определим плотность метана относительно водорода:
Ответ: плотность метана относительно водорода равна 8, или метан тяжелее водорода в 8 раз.
Пример №15
Определите относительную плотность газовой смеси, содержащей 40% угарного газа и 60 % углекислого газа.
Решение:
1) найдем среднюю молекулярную массу газовой смеси.
2) вычислим плотность газовой смеси относительно водорода:
Ответ: плотность газовой смеси относительно водорода равна 18,8. Пример 3. В процессе производства азотного удобрения на Ферганском производственном объединении «Азот» в качестве промежуточного вещества образуется оксид азота (IV). Найдите плотность оксида азота (IV) относительно воздуха.
Решение:
1) молекулярная масса оксида азота (IV)
M(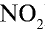
Средняя молекулярная масса воздуха — 29 г/моль;
2) вычислим плотность оксида азота (IV) относительно воздуха:
Ответ: плотность оксида азота (IV) относительно воздуха равна 1,59.
Пример №16
Плотность пара белого фосфора относительно гелия равна 31. Рассчитайте молекулярную массу белого фосфора.
Решение.
Из формулы
следует, что М(белый фосфор) = 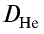
Ответ: молекулярная масса белого фосфора равна 124.
Закон эквивалентности
Химические элементы присоединяются друг к другу или замещаются в весовых количествах, пропорциональных своим эквивалентам (закон эквивалентности).
Эквивалентностью элемента называется количество этого элемента, присоединяющего или замещающего 1 моль или 1 г атомов водорода.
Отношение относительной атомной массы элемента к его валентноcти есть эквивалентность этого элемента:
Эквивалентность оксида выражается формулой: 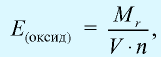
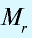
Эквивалентность оснований выражается формулой:
где 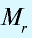
Эквивалентность кислот выражается формулой: 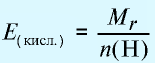
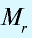
n(H) — число атомов водорода, замещаемых металлом, содержащимся в кислоте.
Эквивалентность солей выражается формулой: 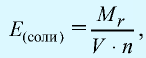
Пример №17
Определите эквивалентность железа в двух- и трехвалентных соединениях.
Решение:
1) найдем эквивалентность железа в двухвалентных соединениях:
2) найдем эквивалентность железа в трехвалентных соединениях:
Ответ: эквивалентность железа в двухвалентных соединениях равна 28, в трехвалентных соединениях — 18,67 г/моль.
Пример №18
47,26 г меди, соединяясь с 52,74 г хлора, образуют соль хлорид меди (II). Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Решение:
1) уточним условия задачи:
2) определим эквивалентность меди, пользуясь формулой
Ответ: эквивалентность меди равна 31,8 г/моль.
Энергетические явления в химических реакциях
Во всех химических реакциях происходит выделение или поглощение энергии.
Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при образовании из простых веществ 1 моля сложного вещества, называется теплотой образования вещества. Теплота разложения любого сложного вещества на простые вещества равна его теплоте образования и выражается противоположным знаком (закон Лавуазье и Лапласа).
Например: 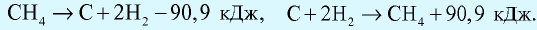
Пример №19
Для приготовления пищи в школьной столовой израсходовано 100 л метана (метан — основной компонент природного газа). Сколько тепла выделилось при сгорании 100 л метана? Тепловой эффект реакции горения метана равен + 880 кДж/моль.
Решение.
При полном сгорании 1 моля метана (22,4 л) выделяется 880 кДж тепла. Сколько тепла выделится при сгорании 100 л метана?
Ответ: при сгорании 100 л метана выделяется 3928 кДж.
Пример №20
Рассчитайте тепловой эффект реакции горения аммиака. Известно, что теплота испарения воды 241,88 кДж/моль, теплота образования 
Решение.
Запишем реакцию горения аммиака:
Найдем тепловой эффект реакции горения аммиака на основе закона Гесса. Для этого из суммы теплоты образования продуктов реакции вычтем сумму теплоты образования веществ, взятых в реакцию (примем, что теплота образования простых веществ равна нулю).
Ответ: 633,24 кДж.
- Относительная атомная и относительная молекулярная масса
- Молярная масса в химии
- Физические и химические явления
- Растворы в химии
- Вещества и их свойства в химии
- Чистые вещества и смеси в химии
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
-
Типы задач в задании С5.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
к оглавлению ▴
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол С2Н6О С:Н:О = 2:6:1 С2Н6О Бутен С4Н8 С:Н = 1:2 СН2 Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29 - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём. - Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы CnH2n+2 — Алкены CnH2n CnH2n+1–CH=CH2 Алкины CnH2n−2 CnH2n+1–C≡CH Диены CnH2n−2 — Гомологи бензола CnH2n−6 С6Н5–СnH2n+1 Предельные одноатомные спирты CnH2n+2O CnH2n+1–OH Многоатомные спирты CnH2n+2Ox CnH2n+2−x(OH)x Предельные альдегиды CnH2nO Кетоны CnH2nO O // CnH2n+1– C– O–CmH2m+1 Фенолы CnH2n−6O С6Н5(СnH2n)–OH Предельные карбоновые кислоты CnH2nO2 Сложные эфиры CnH2nO2 O // CnH2n+1– C– O–CmH2m+1 Амины CnH2n+3N СnH2n+1NH2 Аминокислоты (предельные одноосновные) CnH2n+1NO2 O // NH2– CH– C– OH C nH 2n+1
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль. - При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль. - Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду. - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.ν(C) = 0,7 моль
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль. - Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов. - Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2. - Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул N2 и его молярная масса 28 г/моль):
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Ответ: С4Н8.
-
Пример 7.
Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(C) = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.
ν(H) = 0,7 • 2 = 1,4 моль. - Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы С и Н.m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 гМасса всего вещества 9,8 г.
m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. - C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Ответ: С2Н7N.
-
Пример 8.
Вещества содержит С, Н, О и S. При сгорании 11 г его выделилось 8,8 г CO2, 5,4 г Н2О, а сера была полностью переведена в сульфат бария, масса которого оказалась равна 23,3 г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
ν(CO2) = m/M = 8,8/44 = 0,2 моль.
ν(C) = 0,2 моль.
ν(Н2О) = m / M = 5,4 / 18 = 0,3 моль.
ν(H) = 0,6 моль.
ν(BaSO4) = 23,3 / 233 = 0,1 моль.
ν(S) = 0,1 моль. - Рассчитываем предполагаемую массу кислорода в исходном веществе:
m(C) = 0,2 • 12 = 2,4 г
m(H) = 0,6 • 1 = 0,6 г
m(S) = 0,1 • 32 = 3,2 г
m(O) = mвещества − m(C) − m(H) − m(S) = 11 − 2,4 − 0,6 − 3,2 = 4,8 г,
ν(O) = m / M = 4,8 / 16 = 0,3 моль - Находим мольное соотношение элементов в веществе:
C : H : S : O = 0,2 : 0,6 : 0,1 : 0,3 = 2 : 6 : 1 : 3
Формула вещества C2H6SO3.
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы (С4Н12S2O6) получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Ответ: C2H6SO3.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль. - Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01 СnH2n−2 + 2Br2 → СnH2n−2Br4 Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.Это пентадиен С5Н8.
Ответ: C5H8.
-
Пример 10.
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na
→
2CnH2n+1ONa + H2
C3H6 + H2→
C3H8
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль. - Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
-
Пример 11.
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 мольСоответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
-
Пример 12.
Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
1–4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77 % кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204•1022 молекул.
2–3. Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего С, Н и хлор, выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он 5,6 г его при присоединении воды образуют 7,4 г спирта.
3–2. Для окисления 2,9 г предельного альдегида до кислоты потребовалось 9,8 г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой 3 г с избытком бромоводорода образует 6,24 г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1. С3Н8
1–2. С3Н6(NH2)2
1–3. C2H4(COOH)2
1–4. C4H6
1–5. (HCOO)2Ca — формиат кальция, соль муравьиной кислоты
2–1. С8Н16О
2–2. С3Н7NO
2–3. С5Н8 (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. C3H7Cl (не забудьте, что атомы водорода содержатся не только в воде, но и в HCl)
2–5. C4H11N
3–1. С4Н8
3–2. С3Н6О
3–3. С2Н5NO2
3–4. C4H8(OH)2
3–5. C4H9OH
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Химия, часть С. Задача С5. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023