Средняя соль ортофосфорной кислоты H3PO4 и гидроксида калия KOH. Пищевая добавка с индексом Е340, принадлежит к группе эмульгаторов, регуляторов pH и веществ против слеживания.
Синонимы
Ортофосфат калия, трикалийфосфат, калий фосфорнокислый
Формула
K3PO4
Свойства фосфата калия
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Кристаллическое вещество белого цвета |
| Молярная масса | 163,941 г/моль |
| Плотность | 2,536 г/см3 |
| Температура плавления | 1340°С |
| Растворимость в воде, 100 г | при 0°С — 79,4 при 20°С — 98,5 при 60°С — 178,5 |
Химические свойства
- В водных растворах гидролизуется по аниону:
K3P04 + H2O = K2HP04 + K0H.
Раствор имеет щелочную реакцию.
- При взаимодействии с кислотами образует кислые соли:
K3P04 + HСl = K2HP04 + KCl,
K3P04 + H2SO4 = KH2P04 + K2SO4.
- Вступает в реакции обмена с образованием нерастворимых фосфатов:
2K3P04 + 3CaCl2 = 6KCl + 2Ca3(P04)2↓,
K3P04 + AlCl3 = 3KCl + AlP04↓,
K3P04 + 3AgNO3 = 6KCl + Ag3P04↓.
Последняя реакция является качественной реакцией на растворимые фосфаты щелочных металлов и аммония. При добавлении раствора нитрата серебра AgNO3 выпадает осадок фосфата серебра Ag3P04 желтого цвета. А калий можно определить окрашиванию пламени в фиолетовый цвет.
Получение фосфата калия
Лабораторные способы получения
Фосфат калия получают взаимодействием фосфорной кислоты с гидроксидом или карбонатом калия:
H3PO4 + 3KOH = K3PO4 + 3H2O;
2H3PO4 + 3K2CO3 =2K3PO4 + 3H2O + 3CO2↑.
Получение фосфата калия в промышленности
В промышленности фосфат калия получают в два этапа.
Сначала взаимодействием поташа K2CO3 с фосфорной кислотой H3PO4 получают гидрофосфат калия K2HP04:
Н3Р04 + K2C03 = K2HP04 + С02↑+ Н20,
а затем взаимодействием едкого кали KOH с полученным гидрофосфатом калия K2HP04 получают фосфат калия K3PO4:
K2HP04 + K0H = K3P04 + H20.
После охлаждения нейтрализованных растворов до 34°С фосфат калия кристаллизуется в виде K3PO4·7H2O. Он плавится при 47,5°С. Чтобы получить безводный фосфат калия, кристаллогидрат прокаливают при температуре выше 250°С.
Применение
Фосфат калия в быту используют как составную часть жидкого мыла и других чистящех средств, так как он прекрасно отмывает жир и смягчает воду, переводя соли жесткости в нерастворимые фосфаты:
3Ca(HCO3)2 + 2K3P04 = 6KHCO3 + Ca3(P04)2↓,
3Mg(HCO3)2 + 2K3P04 = 6KHCO3 + Mg3(P04)2↓.
Фосфат калия добавляют в зубную пасту. В медицине фосфат калия применяют как вспомогательное вещество для предотвращения слеживания порошков.
В пищевой промышленности он известен как пищевая добавка Е340(iii). Фосфат калия используют в качестве эмульгатора, стабилизатора, влагоудерживающего агента. Добавляют его в газированные напитки, растворимый кофе, плавленные сыры и хлебобулочные изделия, правда чаще применяют гидрофосфат (пищевая добавка Е340(i)) и дигидрофосфат калия (пищевая добавка Е340(ii)).
Пример решения задачи
Сколько фосфата калия получится при реакции 200 г гидрофосфата калия с едким кали?
Решение
200 г – х г
K2HPO4 + KOH = K3PO4 + H2O.
1 моль – 1 моль
2⋅39+1+31+16⋅4=1412 cdot 39+1+31+16 cdot 4 = 141 г
3⋅39+31+4⋅16=2123 cdot 39+31+4 cdot 16 = 212 г
Составляем пропорцию:
141 г K2HPO4 – 212 г K3PO4,
200 г K2HPO4 – х г K3PO4.
Отсюда:
х=(200⋅212)/141=301х = (200 cdot 212)/141 = 301 г.
Ответ: 301 г.
Тест по теме «Фосфат калия»

Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.

Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!

Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Формула фосфата калия
Определение и формула фосфата калия

Химическая формула –
Молярная масса равна г/моль.
Физические свойства – твердое вещество белого цвета, плавится без разложения.
Хорошо растворяется в воде, в этом процессе происходит гидролиз по аниону, создает сильнощелочную среду.
Образует кристаллогидрат состава .
Химические свойства фосфата калия
- Вступает в реакции обмена с кислотами и солями:
- Фосфат калия переводит в раствор такие металлы как алюминий и цинк, например:
Получение
Фосфат калия можно получить по реакциям обмена:
Применение
Фосфат калия находит применение в качестве компонента мыл, шампуней для умягчения воды.
В пищевой промышленности известен как пищевая добавка .
Кроме того, является регулятором кислотности.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Фосфат калия, характеристика, свойства и получение, химические реакции.
Фосфат калия – неорганическое вещество, имеет химическую формулу K3PO4.
Краткая характеристика фосфата калия
Физические свойства фосфата калия
Получение фосфата калия
Химические свойства фосфата калия
Химические реакции фосфата калия
Применение и использование фосфата калия
Краткая характеристика фосфата калия:
Фосфат калия – неорганическое вещество бесцветного либо белого цвета, соль щелочного металла калия и ортофосфорной кислоты.
Фосфат калия представляет собой бесцветные кристаллы.
Химическая формула фосфата калия K3PO4.
Хорошо растворяется в воде, с которой образует кристаллогидраты различного состава: K3PO4×nH2O, где n = 1½, 3, 7, 9 и т.д. Водный раствор имеет сильнощелочную реакцию из-за гидролиза по аниону.
Не растворим в этаноле.
Обладает гигроскопичностью.
В пищевой промышленности используется 3 типа фосфатов калия, согласно степени замещения атомов водорода:
– добавка Е340(i) – ортофосфат калия 1-замещенный (Monopotassium orthophosphate) с химической формулой KH2PO4;
– добавка Е340(ii) – ортофосфат калия 2-замещенный (Dipotassium orthophosphate) с химической формулой K2HPO4;
– добавка Е340(iii) – ортофосфат калия 3-замещенный (Tripotassium orthophosphate) с химической формулой K3PO4.
Физические свойства фосфата калия:
| Наименование параметра: | Значение: |
| Химическая формула | K3PO4 |
| Синонимы и названия иностранном языке | potassium phosphate (англ.)
калий фосфорнокислый (рус.) калия ортофосфат (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кубические кристаллы |
| Цвет | бесцветный, белый |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 25 °C), кг/м3 | 2564 |
| Плотность (состояние вещества – твердое вещество, при 25 °C), г/см3 | 2,564 |
| Температура кипения, °C | — |
| Температура плавления, °C | 1640 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 212,26 |
| Растворимость в воде при 20 °C, г/100 мл | 98,5 |
* Примечание:
— нет данных.
Получение фосфата калия:
Фосфат калия получается в результате следующих химических реакций:
- 1. нейтрализацией избытком гидроксида калия ортофосфорной кислоты:
H3PO4 + 3KOH → K3PO4 + H2O.
- 2. нейтрализацией избытком карбоната калия ортофосфорной кислоты:
2H3PO4 + 3KCO3 → 2K3PO4 + 3CO2 + 3H2O.
- 3. нейтрализацией избытком хлорида калия ортофосфорной кислоты.
- 4. действием избытка гидроксида калия на кислые фосфаты калия:
KH2PO4 + 2KOH → K3PO4 + 2H2O,
K2HPO4 + KOH → K3PO4 + H2O.
Химические свойства фосфата калия. Химические реакции фосфата калия:
Химические свойства фосфата калия аналогичны свойствам фосфатов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция фосфата калия и хлорида индия:
InCl3 + K3PO4 → InPO4 + 3KCl.
В результате реакции образуются ортофосфат индия и хлорид калия.
2. реакция фосфата калия и хлорида кальция:
2K3PO4 + 3CaCl2 → Ca3(PO4)2 + 6KCl.
В результате реакции образуются ортофосфат кальция и хлорид калия.
3. реакция фосфата калия и хлорида лития:
3LiCl + K3PO4 → Li3PO4 + 3KCl.
В результате реакции образуются ортофосфат лития и хлорид калия.
4. реакция фосфата калия и сульфата алюминия:
2K3PO4 + Al2(SO4)3 → 2AlPO4↓ + 3K2SO4.
В результате реакции образуются ортофосфат алюминия и сульфат калия.
5. реакция фосфата калия, алюминия и воды:
2K3PO4 + 2Al + 8H2O → 2K[Al(OH)4] + 2K2HPO4 + 3H2 (to).
В результате реакции образуются тетрагидроксоалюминат (III) калия, гидроортофосфат калия и водород. Фосфат калия используется в виде концентрированного раствора. Реакция протекает при кипении.
6. реакция фосфата калия, цинка и воды:
2K3PO4 + Zn + 4H2O → K2[Zn(OH)4] + 2K2HPO4 + H2.
В результате реакции образуются тетрагидроксоцинкат (III) калия, гидроортофосфат калия и водород. Фосфат калия используется в виде концентрированного раствора.
7. реакция термического разложения кристаллогидрата фосфата калия:
K3PO4•7H2O → K3PO4 + 7H2O (t = 250 оС).
В результате реакции термического разложения гептагидрата фосфата калия образуются фосфат калия и вода. Реакция протекает в вакууме.
8. реакция фосфата калия с минеральными кислотами.
9. реакция термического разложения фосфата калия:
2K3PO4 → 3K2O + P2O5 (tо).
В результате реакции термического разложения фосфата калия образуются оксид калия и оксид фосфора.
Применение и использование фосфата калия:
Фосфат калия используется во множестве отраслей промышленности и для бытовых нужд:
– как компонент жидких моющих средств (мыл, шампуней) для умягчения воды,
– как компонент электролитов при получении каучуков методом эмульсионной полимеризации,
– в пищевой промышленности как регулятор кислотности, эмульгирующая соль, влагоудерживающий агент, стабилизатор, синергист антиоксидантов, питание для дрожжей,
– как пищевая добавка Е340,
– в медицине для производства лекарств,
– как компонент удобрений,
– входит в состав зубных паст, препятствуют развитию зубного кариеса.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
фосфат калия реагирует кислота 1 2 3 4 5 вода соль гидролиз цинка
уравнение реакций соединения масса взаимодействие масса фосфата калия
реакции
Коэффициент востребованности
5 313
Встретить фосфаты калия можно практически в каждой сфере, но наибольшей популярности они пользуются в области производства продуктов питания. В их составе добавку обозначают при помощи индекса Е340. Ее добавляют в пломбир, растворимый кофе, изделия из рыбы и мяса. В вышеперечисленных продуктах, пищевая добавка применяется для предотвращения окисления.
Пищевая добавка принадлежит к категории неорганических веществ. Внешне фосфаты калия представляют собой однородный порошок из прозрачных мелких крупиц без запаха. Они легко растворяется в воде при любых условиях, но не растворяются в спирте. При воздействии повышенными температурами происходит полное обезвоживание вещества.
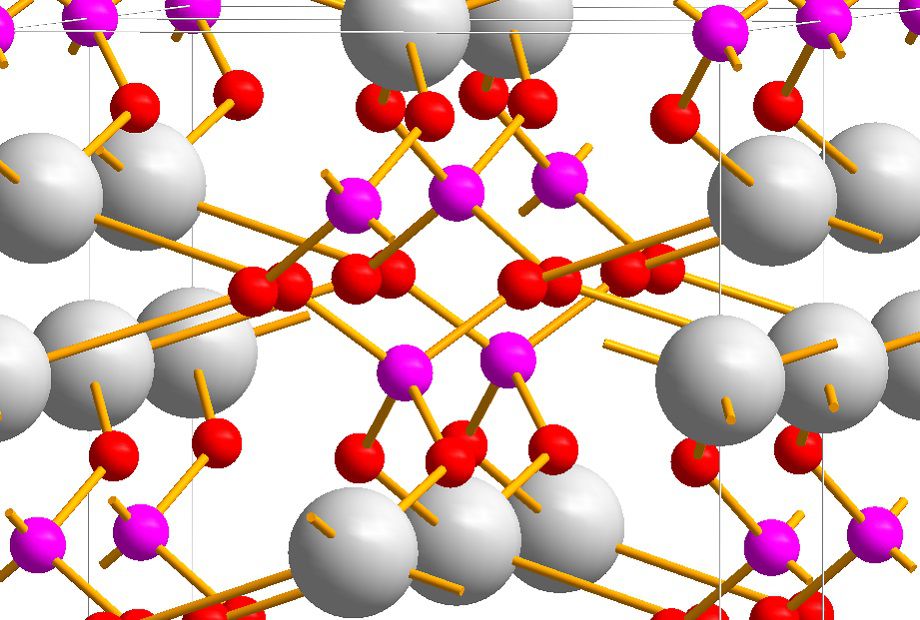
Кристаллическая решетка однозамещенного фосфата калия
Фосфаты калия играют огромное значение в обеспечении правильной работы организма – они регулируют скорость метаболизма и отвечают за кислотно-щелочной баланс, обеспечивают правильную работу почек. Однако злоупотреблять препаратами, содержащими добавку не стоит – в больших количествах она может стать причиной нарушения работы ЖКТ.
Содержание
- Что такое фосфаты калия: их особенности
- Формула фосфата калия и его основные свойства
- Методы получения
- Основные реакции
- Сферы применения фосфата калия
- Применение фосфата калия в пищевой промышленности
- Применение фосфата калия в производстве бытовой химии
- Фосфат калия в уходовой косметике
- Фосфат калия в сельском хозяйстве
- Фосфат калия в микробиологии
- Влияние фосфата калия на организм человека
- Польза фосфата калия
- Вред фосфата калия
- Противопоказания к употреблению фосфата калия
- Класс опасности фосфата калия как пищевой добавки
- Где можно приобрести фосфат калия и сколько он стоит
- Заключение
Что такое фосфаты калия: их особенности
Фосфаты калия – это группа неорганических соединений, широко применяющихся как в пищевой, так и в химической промышленности; встретить их можно также в сельском хозяйстве и фармацевтике. В составе продуктов питания они отвечают за нормализацию уровня кислотности, поддержание требуемой консистенции и стойкости окраски, выполняют роль эмульгаторов, обеспечивающих смешивание отдельных компонентов. Помимо этого, пищевая добавка Е340 обладает способностью предотвращать окисление продуктов.
В настоящее время известны 3 основные разновидности фосфата калия:
- однозамещенный (KH2PO4);
- двузамещенный (K2HPO4);
- трехзамещенный (K3PO4).
Пищевая добавка великолепно растворяется в обычной воде вне зависимости от ее температуры, но не реагирует со спиртом – при попадании в спиртовой раствор порошок просто оседает на дно лабораторной посуды.
На крупных химических предприятиях большие объемы реагента получают в ходе смешивания ортофосфорной кислоты с одним из двух соединений – едким калием или углекислым калием.
Формула фосфата калия и его основные свойства
Наиболее часто как в химической, так и в других отраслях промышленности используется ортофосфат калия трехзамещенный. Его формула выглядит следующим образом:
K3PO4
Вещество выглядит как смесь бесцветных кристаллов, не имеющих запаха.
Реагент хорошо растворяется в воде, но не меняет своего состояния при попадании в спирт, обладает высоким показателем гигроскопичности.
Фосфат калия принадлежит к классу неорганических веществ.
В нормальных условиях его плотность составляет 2,56 г/см3.
Температура, при которой кристаллы начинают плавиться – 1640˚С.
Молярная масса – 213 г/моль.
Растворимость в воде при температуре 20˚С составляет 99 г на 100 г жидкости.
Методы получения
Наибольшей популярностью пользуется метод, предполагающий смешивание ортофосфорной кислоты с высококонцентрированным едким калием:
H3PO4 + 3KOH → K3PO4 + 3H2O
Также возможно применение методики получения вещества посредством смешивания избыточного количества углекислого калия с фосфорным ангидридом, в результате чего получаются фосфат калия и вода:
6KOH + P2O5 → 2K3PO4 + 3h3O
На 3 месте находится метод получения вещества в ходе смешивания калия с ортофосфорной кислотой:
6K + 2H3PO4 → 2K3PO4 + 3H2↑
На крупных предприятиях часто используют способ, основанный на нейтрализации кислых минеральных солей, в ходе которого смешивают дигидрофосфат калия с концентрированным гидроксидом калия:
KH2PO4 + 2KOH → K3PO4 + 2H2O
Реже применяется методика, предполагающая смешивание основных оксидов с кислотами. Для получения вещества соединяют оксид калия и ортофосфорную кислоту:
3K2O + 2H3PO4 → 2K3PO4 + 3H2O
Основные реакции
Наиболее часто реагент используют для получения гидрофосфата калия:
2K3PO4 + H3PO4 → 3K2HPO4
Фосфат калия также участвует в реакции ионного обмена с выпадением осадка в виде фосфата серебра и образования нитрата калия:
K3PO4 + 3AgNO3 → 3KNO3 + Ag3PO4↓
Реагенту также характерна реакция гидролиза по аниону:
K3PO4 + H2O → K2HPO4 +K+OH
Соединение вступает в реакцию с хлоридом индия с образованием ортофосфата индия и хлористого калия:
InCl3 + K3PO4 → InPO4 + 3KCl
При воздействии повышенной температурой реагент разлагается на окись калия и фосфорный ангидрид:
2K3PO4 → 3К2О + Р2О5 (t˚)
Сферы применения фосфата калия
Фосфат калия востребован во многих сферах: его используют технологи пищевых предприятий, химики, работники сельского хозяйства; обнаружить соединение можно в составе лекарственных препаратов, бытовой химии и уходовой косметики. Фосфат калия является важным компонентом электролитов, применяемых при производстве каучуков.
Помимо прочего, обнаружить добавку можно в составе некоторых средств для ухода за ротовой полостью и удобрений, применяющихся в сельском хозяйстве.
Применение фосфата калия в пищевой промышленности
В производстве продуктов питания фосфаты калия известны под индексом Е340. Обнаружить такую пищевую добавку можно в составе практически всех фруктовых, овощных, мясных и рыбных консервов, в кофе, яичном порошке, сухом молоке, сахарной пудре и других сыпучих продуктах.
В консервированных продуктах пищевая добавка отвечает за сохранение формы и консистенции обрабатываемого продукта – благодаря ей консервированные персики остаются круглыми, а рыбное филе сохраняет свою текстуру. В мелкодисперсных продуктах Е340 выполняет роль разрыхлителя, препятствующего образованию комочков.
Также фосфат калия способен удерживать влагу в составе продукта, тем самым увеличивая его объем и, как результат, стоимость. Даже при продолжительном хранении продукты, включающие в свой состав фосфат калия, не теряют внешней привлекательности и вкусовых характеристик.
Без фосфатов калия сложно представить себе процесс производства мороженого. Добавка применяется как эмульгатор, позволяющий с легкостью смешивать компоненты, которые невозможно объединить в обычном состоянии. Кроме того, фосфат калия придает готовому десерту однородную консистенцию и делает массу более устойчивой.
В сладких газированных напитках пищевая добавка Е340 применяется как усилитель вкуса, аналогичные функции ложатся на нее в составе некоторых алкогольных напитков и всевозможных сладостей. В ходе получения сахара-песка добавка выполняет роль отбеливателя.
Применение фосфата калия в производстве бытовой химии
Фосфат калия часто применяется при производтве жидкого мыла, средств для мытья посуды. Добавка облегчает процесс удаления жира с любых поверхностей, а также смягчает воду.
Фосфат калия в уходовой косметике
Фосфат калия можно обнаружить в составе шампуней, мыла и зубных паст. Добавка применяется как эмульгатор в составе гелеобразной продукции. В средства для ухода за ротовой полостью его вводят для защиты зубной эмали от негативного воздействия бактерий.
Фосфат калия в сельском хозяйстве
Вещество часто применяется в качестве внекорневой подкормки в современном сельском хозяйстве. Добавка позволяет ускорить процесс насыщения выращиваемых культур важными для них питательными веществами.
Фосфат калия в микробиологии
Фосфат калия широко применяется биологами для создания условий, требуемых плесневым грибам для комфортного существования. Добавка также применяется для получения пенициллина.
Влияние фосфата калия на организм человека
Однозначного ответа на вопрос о том, полезен или вреден фосфат калия для человека не существует. Все относительно, равно как и влияние, которое оказывает фосфат калия на состояние здоровья. В разумных дозах и при правильном употреблении фосфат калия способен оказывать положительное воздействие, тогда как в избытке он может стать причиной развития длинного перечня заболеваний.
Польза фосфата калия
При разумном употреблении добавки можно заметить положительные изменения. Так, в небольших количествах она способна регулировать кислотно-щелочной баланс и устранять дискомфорт в желудке.
Помимо этого, пищевая добавка способна оказывать желчегонный эффект и выводить застоявшуюся жидкость, тем самым уменьшая отеки и нормализируя водно-солевой баланс. В дополнение к этому, фосфат калия способен стабилизировать артериальное давление и укреплять сердечную мышцу.
В составе зубных паст фосфат калия отвечает за эффективность борьбы с кариесом и защиту зубной эмали.
Вред фосфата калия
При употреблении избыточного количества продуктов или препаратов, включающих в свой состав эту пищевую добавку, повышается риск развития заболеваний ЖКТ и расстройств в работе пищеварительной системы. Кроме того, вещество способно стать причиной развития остеопороза.
Повышенная концентрация добавки Е340 в организме может стать причиной образования бляшек и закупоривания сосудов, что в свою очередь вызывает нарушения в работе сердца и сосудов, увеличивая риск инфаркта.
Избыток фосфата калия в организме может привести к возникновению проблем с почками.
Противопоказания к употреблению фосфата калия
Специалисты не рекомендуют вводить в свой рацион фосфат калия в случае его непереносимости, наличия серьезных поражений печени и почечной недостаточности. Ограничить потребление этой пищевой добавки также рекомендуется детям в возрасте до 3 лет.
Класс опасности фосфата калия как пищевой добавки
Предельно допустимой дозой фосфата калия считается 70 мг соединения на кг веса человека. При превышении этого показателя велик риск возникновения отклонений в работе пищеварительной системы и развития дефицита кальция.
Пищевая добавка E340 разрешена к применению в пищевой и фармацевтической промышленности как на территории России, так и на территории стран ЕС.
Согласно нормативным документам, пищевая добавка Е340 принадлежит к 3 классу опасности – то есть, к умеренно опасным веществам.
Хранить фосфат калия необходимо в герметичных мешках в помещениях с температурой 20-25 градусов.
При работе с большими объемами данной пищевой добавки, рекомендуется использовать средства индивидуальной защиты, а все манипуляции производить исключительно в вытяжном шкафу.
Где можно приобрести фосфат калия и сколько он стоит
Приобрести фосфат калия можно как на специализированных химических предприятиях, так и в режиме онлайн. Цена фосфата калия зависит от его разновидности и объема. Так, килограмм пищевой добавки E340 обойдется вам примерно в 300 рублей. Добавка в таблетках будет стоить около 700 рублей за упаковку из 125 капсул.
Заключение
Фосфат калия – это неорганическое соединение, широко применяемое как в производстве продуктов питания, так и в изготовлении различных удобрений. Вещество также востребовано в химической промышленности и фармацевтике, его можно обнаружить в составе средств для мытья посуды и в перечне компонентов, входящих в гели дня умывания и шампуни.
Внешне он представляет собой однородный порошок из мелких бесцветных кристаллов с высокой степенью растворимости в воде. Запаха вещество не имеет, в спиртах не растворяется.
На предприятиях пищевой промышленности реагент известен как добавка под индексом Е340. Ее можно обнаружить в составе консервированных плодов, мяса и рыбы, муки, сахара, кофе, колбас и сладостей. В том объеме, в котором добавка присутствует в продуктах питания, она полностью безопасна. Более того, добавка способна оказывать положительное влияние на состояние здоровья человека. Так, фосфат калия регулирует кислотно-щелочной баланс, выводит лишнюю жидкость из организма, нормализует давление, улучшает работу сердечно-сосудистой системы и защищает зубную эмаль. Однако употребление слишком большого объема фосфата калия может, наоборот, привести к развитию заболеваний органов ЖКТ и нарушениям в работе сердечной мышцы. Рекомендованная доза фосфата калия составляет 70 мг на килограмм веса человека.
Фосфат калия разрешен к применению во всех странах, однако при работе с большими объемами вещества необходимо соблюдать правила безопасности и использовать средства индивидуальной защиты.
Загрузка…
Toggle the table of contents
From Wikipedia, the free encyclopedia