Определение и формула
Фосфат натрия Na3PO4– средняя соль ортофосфорной кислоты H3PO4 и гидроксида натрия NaOH. Пищевая добавка с индексом Е542, принадлежит к группе эмульгаторов, регуляторов pH и веществ против слеживания.
Синонимы
Ортофосфат натрия, тринатрийфосфат, натрий фосфорнокислый
Формула
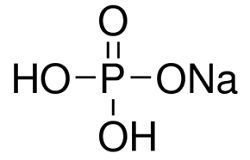
Na3PO4
Свойства фосфата натрия
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Кристаллическое вещество белого цвета |
| Молярная масса | 163,941 г/моль |
| Плотность | 2,536 г/см3 |
| Температура плавления | 1340°С |
| Cтандартная мольная энтальпия образования при 298К ΔGDelta G °298, кДж/моль | -1922,8 |
| Cтандартная мольная энергия Гиббса образования при 298 К ΔDelta кДж/моль | -1819 |
| Стандартная мольная энтропия при 298 К S°298, Дж/(моль•К) | 224,7 |
| Растворимость в воде, 100 г | при 0°С — 5,4 при 25°С — 14,5 при 100°С — 94,6 |
Химические свойства
В водных растворах гидролизуется по аниону:
Na3P04 + H2O = Na2HP04 + Na0H.
Раствор имеет щелочную реакцию.
При взаимодействии с кислотами образует кислые соли:
Na3P04 + HСl = Na2HP04 + NaCl,
Na3P04 + H2SO4 = NaH2P04 + Na2SO4.
Вступает в реакции обмена с образованием нерастворимых фосфатов:
2Na3P04 + 3CaCl2 = 6NaCl + 2Ca3(P04)2↓,
Na3P04 + AlCl3 = 3NaCl + AlP04↓,
Na3P04 + 3AgNO3 = 6NaCl + Ag3P04↓.
Последняя реакция является качественной реакцией на растворимые фосфаты щелочных металлов и аммония. При добавлении к их раствором раствора нитрата серебра AgNO3 выпадает осадок фосфата серебра Ag3P04 желтого цвета. А натрий можно определить окрашиванию пламени в желтый цвет.
Получение химического соединения
Лабораторные способы получения
Фосфат натрия получают взаимодействием фосфорной кислоты с гидроксидом или карбонатом натрия:
H3PO4 + 3NaOH = Na3PO4 + 3H2O;
2H3PO4 + 3Na2CO3 =2Na3PO4 + 3H2O + 3CO2↑.
Получение фосфата натрия в промышленности
В промышленности фосфат натрия получают в два этапа.
Сначала взаимодействием кальцинированной соды Na2CO3 с фосфорной кислотой H3PO4 получают гидрофосфат натрия Na2HP04:
Н3Р04 + Na2C03 = Na2HP04 + С02↑+ Н20,
а затем взаимодействием едкого натра NaOH с полученным гидрофосфатом натрия Na2HP04 получают фосфат натрия Na3PO4:
Na2HP04 + Na0H = Na3P04 + H20.
После охлаждения нейтрализованных растворов до 30°С фосфат натрия кристаллизуются в виде Na3PO4·12H2O. Он плавится при 70°С. Чтобы получить безводный фосфат натрия, кристаллогидрат прокаливают 2 часа при температуре 120°С, а затем 30 мин при температуре 800°С.
Применение
Фосфат натрия в быту используют как чистящее средство, так как он прекрасно отмывает жир. Благодаря этому свойству он также входит в состав моющих средств. Кроме того, фосфат натрия смягчает воду, переводя соли жесткости в нерастворимые фосфаты:
3Ca(HCO3)2 + 2Na3P04 = 6NaHCO3 + Ca3(P04)2↓,
3Mg(HCO3)2 + 2Na3P04 = 6NaHCO3 + Mg3(P04)2↓.
Применяется он также и в стекольной промышленности для получения оптических стекол.
В строительстве фосфат натрия используют для упрочнения бетона. Его добавка увеличивает также влагостойкость бетона, так как он становится менее пористым.
В медицине фосфат натрия изредка применяют как слабительное и средство от изжоги.
В пищевой промышленности он известен как пищевая добавка Е339(iii). Фосфат натрия используют в качестве эмульгатора, стабилизатора, влагоудерживающего агента. Добавляют его в майонезы и кетчупы, плавленные сыры и хлебобулочные изделия, правда чаще применяют гидрофосфат (пищевая добавка Е339(i)) и дигидрофосфат натрия (пищевая добавка Е339(iii)). Фосфатом натрия обрабатывают куриные окорочка, мясо и рыбу, чтобы удержать воду и сохранить вес.
Относится к малоопасным веществам (4 класс опасности), но при передозировке в пищевых продуктов приводит к расстройствам пищеварения, а у детей нередко вызывает возбуждение и гиперактивность.
Пример решения задачи
Сколько фосфата натрия получится при нейтрализации фосфорной кислотой 240 г едкого натра?
Решение.
240 г – х г
H3PO4 + 3NaOH = Na3PO4 + 3H2O.
3 моля – 1 моль
3 * (23+16+1) = 120 г
3 * 23+31+4 * 16 = 164 г
Составляем пропорцию:
120 г NaOH – 164 г Na3PO4,
240 г NaOH – х г Na3PO4.
Отсюда:
х= (240 * 164)/120 = 328 г.
Ответ: 328 г.
Тест по теме «Фосфат натрия»
Фосфат натрия, характеристика, свойства и получение, химические реакции.
Фосфат натрия – неорганическое вещество, имеет химическую формулу Na3PO4.
Краткая характеристика фосфата натрия
Физические свойства фосфата натрия
Получение фосфата натрия
Химические свойства фосфата натрия
Химические реакции фосфата натрия
Применение и использование фосфата натрия
Краткая характеристика фосфата натрия:
Фосфат натрия – неорганическое вещество бесцветного либо белого цвета, соль щелочного металла натрия и ортофосфорной кислоты.
Фосфат натрия представляет собой бесцветные кристаллы.
Химическая формула фосфата натрия Na3PO4.
Хорошо растворяется в воде, с которой образует кристаллогидраты Na3PO4·0,5H2O, Na3PO4·H2O и Na3PO4·12H2O. Водный раствор имеет сильнощелочную реакцию из-за гидролиза по аниону.
Не растворим в этаноле.
Обладает гигроскопичностью.
В пищевой промышленности используется 3 типа фосфатов натрия, согласно степени замещения атомов водорода:
– добавка Е339(i) – ортофосфат натрия 1-замещенный с химической формулой NaH2PO4;
– добавка Е339(ii) – ортофосфат натрия 2-замещенный с химической формулой Na2HPO4;
– добавка Е339(iii) – ортофосфат натрия 3-замещенный с химической формулой Na3PO4.
Физические свойства фосфата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na3PO4 |
| Синонимы и названия иностранном языке | sodium phosphate (англ.)
натрий фосфорнокислый трёхзамещенный (устар. рус.) натрия ортофосфат (рус.) тринатрий фосфат (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные тетрагональные кристаллы |
| Цвет | бесцветный, белый |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2536 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,536 |
| Температура кипения, °C | — |
| Температура плавления, °C | 1340 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 163,94067 |
| Растворимость в воде при 25 °C, г/100 мл | 14,5 |
* Примечание:
— нет данных.
Получение фосфата натрия:
Фосфат натрия получается в результате следующих химических реакций:
- 1. взаимодействием карбоната натрия и ортофосфорной кислоты:
2H3PO4 + 3NaCO3 → 2Na3PO4 + 3CO2 + 3H2O.
- 2. взаимодействием гидроксида натрия и ортофосфорной кислоты:
H3PO4 + 3NaOH → Na3PO4 + 3H2O.
Химические свойства фосфата натрия. Химические реакции фосфата натрия:
Химические свойства фосфата натрия аналогичны свойствам фосфатов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция фосфата натрия с нитратом серебра:
3AgNO3 + Na3PO4 → Ag3PO4 + 3NaNO3.
В результате реакции образуются ортофосфат серебра и нитрат натрия.
2. реакция фосфата натрия и нитрата хрома:
Cr(NO3)3 + Na3PO4 → CrPO4 + 2NaNO3.
В результате реакции образуются ортофосфат хрома и нитрат натрия.
3. реакция фосфата натрия и нитрата галлия:
Ga(NO3)3 + Na3PO4 → GaPO4 + 3NaNO3.
В результате реакции образуются ортофосфат галлия и нитрат натрия.
4. реакция фосфата натрия и хлорида алюминия:
AlCl3 + Na3PO4 → AlPO4 + 3NaCl.
В результате реакции образуются ортофосфат алюминия и хлорид натрия.
5. реакция фосфата натрия и хлорида кальция:
2Na3PO4 + 3CaCl2 → Ca3(PO4)2 + 6NaCl.
В результате реакции образуются ортофосфат кальция и хлорид натрия.
6. реакция фосфата натрия и хлорида бария:
2Na3PO4 + 3BaCl2 → Ba3(PO4)2 + 6NaCl.
В результате реакции образуются ортофосфат бария и хлорид натрия.
7. реакция фосфата натрия и сульфата железа:
3FeSO4 + 2Na3PO4 → Fe3(PO4)2 + 3Na2SO4 (t = 60-80 oС).
В результате реакции образуются ортофосфат железа и сульфат натрия. Фосфат натрия используется в виде разбавленного раствора.
8. реакция фосфата натрия и сульфата лития:
2Na3PO4 + 3Li2SO4 → 2Li3PO4 + 3Na2SO4.
В результате реакции образуются ортофосфат лития и сульфат натрия.
9. реакция фосфата натрия и сульфата магния:
2Na3PO4 + 3MgSO4 → Mg3(PO4)2 + 3Na2SO4.
В результате реакции образуются ортофосфат магния (который выпадает в осадок) и сульфат натрия. Реакция уменьшения жесткости воды.
10. реакция фосфата натрия и гидрокарбоната кальция:
2Na3PO4 + 3Ca(HCO3)2 → Ca3(PO4)2 + 6NaHCO3.
В результате реакции образуются ортофосфат кальция (который выпадает в осадок) и гидрокарбонат натрия. Реакция уменьшения жесткости воды.
11. реакция фосфата натрия, алюминия и воды:
2Al + 2Na3PO4 + 8H2O → 2Na[Al(OH)4] + 2Na2HPO4 + 3H2 (to).
В результате реакции образуются тетрагидроксоалюминат (III) натрия, гидроортофосфат натрия и водород. Фосфат натрия используется в виде концентрированного раствора. Реакция протекает при кипении.
12. реакция фосфата натрия, цинка и воды:
Zn + 2Na3PO4 + 4H2O → Na2[Zn(OH)4] + 2Na2HPO4 + H2 (to).
В результате реакции образуются тетрагидроксоцинкат (III) натрия, гидроортофосфат натрия и водород. Фосфат натрия используется в виде концентрированного раствора. Реакция протекает при кипении.
13. реакция термического разложения кристаллогидрата фосфата натрия:
Na3PO4•12H2O → Na3PO4 + 12H2O (t = 200 оС).
В результате реакции термического разложения додекагидрата фосфата натрия образуются фосфат натрия и вода. Реакция протекает в вакууме.
14. реакция фосфата натрия с азотной кислотой:
Na3PO4 + 3HNO3 ⇄ 3NaNO3 + H3PO4.
В результате химической реакции образуются нитрат натрия и ортофосфорная кислота. Реакция носит обратимый характер.
Аналогично проходят реакции фосфата натрия и с другими сильными минеральными кислотами.
15. реакция термического разложения фосфата натрия:
2Na3PO4 → 3Na2O + P2O5 (tо).
В результате реакции термического разложения фосфата натрия образуются оксид натрия и оксид фосфора.
Применение и использование фосфата натрия:
Фосфат натрия используется во множестве отраслей промышленности и для бытовых нужд:
– для уменьшения жесткости воды,
– в пищевой промышленности как разрыхлитель для теста (при взаимодействии с пищевой содой) и эмульгатор для плавленого сыра, колбасы, сгущённого молока,
– как пищевая добавка Е339,
– в стекольной промышленности для обесцвечивания стекла при его плавке,
– как составной компонент зубных паст и некоторых косметических препаратов.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
фосфат натрия реагирует кислота 1 2 3 4 5 вода соль гидролиз цинка
уравнение реакций соединения масса взаимодействие масса фосфата натрия
реакции
Коэффициент востребованности
4 971
Фосфат натрия (Е399) широко используется во многих промышленных сферах, как влагоудерживатель, кислотный регулятор, эмульгатор, закрепитель структуры. Формула вещества изменяется, в зависимости от используемых компонентов и реакций. Отсюда изменена водность, название и тип (замещаемой или незамещаемый). Рассмотрим: что такое фосфат натрия, формулы, способы получения, свойства, где применяется, как влияет на здоровье.
Содержание
- Что такое фосфат натрия
- Виды тринатрийфосфата
- Формула и свойства фосфата натрия
- Химические реакции, свойства
- Получение и производство фосфата натрия
- Лабораторный способ
- Промышленный
- Сферы применения фосфата натрия
- Фармацевтика
- Пищевая индустрия
- Изготовление бытовой химии
- Стекольное производство
- Строительство
- Смягчение воды
- Влияние на здоровье
- Польза
- Вред
- В каких продуктах содержится фосфат натрия
- Тип пищевой добавки
- Класс опасности и токсичности
- Первая помощь
- Хранение и транспортировка
- Где купить, сколько стоит фосфат натрия, расфасовка
- Отзывы
- Заключение
Что такое фосфат натрия
Фосфат натрия – это синтетическое кристаллизованное вещество белогопрозрачного оттенка, являющееся средней солью щелочного гидроксида натрия и ортофосфорной кислоты (пищевая добавка Е399).
Дополнительные названия:
- ортофосфат натрия;
- натрий фосфорнокислый;
- натриевый ортофосфат;
- тринатрийфосфат;
- триполифосфат натрия;
- пищевая добавка Е399.
Основная сфера использования ортофосфат натрия – продуктовая, фармацевтическая, в качестве противослеживающегося вещества, эмульгатора, щелочного регулятора.
Виды тринатрийфосфата
Фосфат натрия бывает замещенным (зам.)не замещенным, 1-12-ти водным (вод.), образованным под влиянием различных компонентов и факторов
Na3PO4
- Na3PO4 – натриевый 3-зам. ортофосфат, ортофосфатный Na;
- Na3PO4 * 12H2O – 12-ти вод. фосфорнокислый 3-зам. Na, додекагидрат фосфат Na;
- Na3PO4 * H2O – 1-но вод. фосфорнокислый 3-зам. Na, фосфатный моногидрат Na;
- Na3PO4 * 0,5H2O – 0,5-вод. фосфорнокислый 3-зам. Na, полугидрат фосфата натрия.
NaH2PO4
- NaH2PO4 * 2H2O – 2-х вод. 1-но зам. фосфорнокислый Na, натриевый дигидратдигидрофосфат;
- NaH2PO4 * H2O – 1-но водная 1-но замещенная натриевая фосфорная кислота, моногидратдигидрофосфат Na;
- NaH2PO4 – 1-но зам. натриевая кислота, безводный дигидрофосфат Na.
Na2HPO4
- Na3PO4 * 12H2O – 12-ти вод. 2-х зам. натриевая фосфорная кислота, додекагидрат гидрофосфат Na;
- Na2HPO4 – 2-х зам. фосфорнокислая кислота Na, безводная форма гидрофосфата Na;
- Na3PO4 * 7H2O – 7-ми вод., 2-х зам. фосфорнокислый Na, гептагидрат, натриевый гидрофосфат;
- Na3PO4 * 2H2O – 2-х вод., 2-х зам. натриевая фосфорная кислота, дигидрат гидрофосфат Na.
Вещества оказывают полезное воздействие на организм человека при отсутствии противопоказаний к применению.
Формула и свойства фосфата натрия
Формула фосфата натрия:
Na3PO4
- Агрегатное состояние: твердое гранулированное, кристаллизованное.
- Запах: отсутствует.
- Вид: гранулы, кристаллы белогопрозрачного оттенка, измельченный порошок.
- Температура плавления: 1340°С.
- Масса (гмоль): 163,941.
- Энтропия Дж/(моль•К): 224, 7.
- Энергия кДж/моль: 1819.
- Энтальпия кДж/моль: 1922,8.
- Плотность: 2,536 г/см3.
- Растворимость (на 100 гмл): 0°С – 5, при 25°С – 14.
- Гигроскопичность: высокая.
- Способность к гидролизу: создает щелочную среду.
Структурная формула фосфата натрия
Фосфат натрия устойчив к термическим изменениям, высоким температурам, под воздействием которых плавится, не разлагаясь на другие вещества.
Химические реакции, свойства
Натриевый гидроксид (NaOH) + кислота ортофосфорная (H3PO4) взаимодействуют, приводя к реакции, образовывающей фосфат натрия (Na3PO4). Растворение в Н2О активирует анионный гидролиз 3 ступени.
1-я ступень:
- Na3PO4 ↔ 3Na+ + PO43-;
- 3Na+ + PO43- + HOH ↔ HPO42- + 3Na+ + OH—;
- Na3PO4 + HOH ↔ Na2HPO4 + NaOH.
2-я:
- Na2HPO4 ↔ 2Na+ + H2PO4—;
- 2Na+ + H2PO4— + HOH ↔ NaHPO4 + 2Na+ + OH—;
- Na2HPO4 + HOH ↔ NaHPO4 + NaOH.
3-я:
- NaHPO4 ↔ Na+ + PO43-;
- Na+ + PO43- + HOH ↔ H3PO4 + Na+ + OH—;
- NaHPO4 + HOH ↔ H3PO4 + NaOH.
Другие уравнения:
- анионный гидролиз тринатрийфосфата с образованием щелочной реакции в Н2О: Na3PО4 + H2O = Na2HPО4 + NaОH;
- образование кислых солей при контакте с кислотами: Na3PО4 + H2SO4 = NaH2PО4 + Na2SO4 и Na3PО4 + HСl = Na2HPО4 + NaCl;
- обменная реакция, формирующая фосфаты не растворимого типа:2Na3PО4 + 3CaCl2 = 6NaCl + 2Ca3(PО4)2↓; Na3PО4 + AlCl3 = 3NaCl + AlPО4↓; Na3PО4 + 3AgNO3 = 6NaCl + Ag3PО4↓
Качественная реакция:
Na3PО4 + 3AgNO3 = 6NaCl + Ag3PО4↓
При добавлении AgNO3 (серебряного нитрата) осаждается желтый серебряный фосфат (Ag3PО4). Na определяется, путем пожелтения огня.
Получение и производство фосфата натрия
Синтезирование ортофосфата натрия выполняют лабораторно (небольшими партиями) и промышленно (крупными).
Лабораторный способ
Незначительное количество ортофосфата натрия добывают, путем взаимодействия натриевого карбоната/гидроксида с кислотой (ортофосфорной):
H3PO4 + 3NaOH = Na3PO4 + 3H2O
2H3PO4 + 3Na2CO3 =2Na3PO4 + 3H2O + 3CO2↑
Промышленный
Крупные партии гранулированного тринатрийфосфата добывают в 2 этапа:
- Н3РО4 + Na2CО3 = Na2HPО4 + СО2↑+ Н2О
- Na2HPО4 + NaОH = Na3PО4 + H2О
Растворы охлаждают до 30°С. Вещество преобразуется в Na3PO4 * 12H2O (плавящийся при 70°С), кристаллизуется. Для получения безводной формы, его в течение 120 минут прокалывают при 120°С, затем еще полчаса при 800°С.
Сферы применения фосфата натрия
Медицинская и пищевая отрасли – самые востребованные для применения фосфата натрия. Его также добавляют в бытовую химию, стройматериалы, благодаря свойствам. Рассмотрим подробно:
Фармацевтика
Добавка Е399 в медицинских препаратах используется, как основное вещество для приготовления антацидных и противозапорных медикаментов. В качестве дополнительного – для нормализации щелочного, кислотного, минерального уровня.
Слабительные
Принцип действия основывается на удержании влаги в 12-ти перстной кишке. За счет этого улучшается перистальтика и стимулируется выведение фекалий. Лекарства выпускают, в виде жидкости для разовой клизмы, например: «Энема Клин», «Fleet Enema». Медикаменты изготовлены из одинаковых компонентов в разных пропорциях.
Кишечные
Ортофосфат натрия выпускаются в форме таблеток и растворов для экстренной кишечной чистки накануне хирургической терапии, толстокишечнойаноректальной манометрии, рентгеноскопии, колоноскопии. Например: «Флит фосфо-сода» распространенный в России и зарубежные: «OsmoPrep», «Visicol», «Phosphate Laxative».
Раствор фосфата натрия
Антацидные
Препараты, направленные на нормализацию кишечной флоры. Назначаются при неправильной выработке желудочного сока. Избавляют от изжоги, язвы, гастрита, гастроэзофагеальной рефлюксной болезни, желудочных болей. Но, специалисты стараются минимизировать использование препаратов данной группы. Воздействуя на пищеварительный тракт, вещество может нанести больше вреда, чем пользы т.к. передозировка кислотой способна обжечь желудок, кишечник приводя к обострению или формированию заболеваний. Употребляйте только по назначению врача!
Внутривенные растворы
На территории РФ внутривенные растворы с фосфатом натрия местного производства не зарегистрированы. Существуют только зарубежные медикаменты, используемые для нормализации кислотно-щелочного, минерального кровяного баланса. Препараты запрещаются для введения беременнымкормящим грудью женщинам, поскольку транспортируются кровеносной системой, проникают в молоко и вредят плодуребенку.
Пищевая индустрия
В продуктовой индустрии ортофосфат натрия классифицируется, как пищевая добавка Е339, «ГОСТ Р 52823-2007». Условия распространяются только на 1-но, 2-х, 3-х замещаемые монофосфаты. Используются, как: стабилизатор, влагоудерживатель, кислотный регулятор, текстуратор, комплексообразователь, эмульгатор при изготовлении спиртных напитков, сладких/хлебобулочных, рыбных, мясных, молочных изделий, полуфабрикатов, консерв.
Изготовление бытовой химии
Фосфат натрия широко используется для изготовления бытовых чистящих средств. Хорошо справляется с жирами, налетом, растворяя их кислотным влиянием. Работая с концентратами защищайте руки резиновыми перчатками. Регулярный контакт со средствами вызывает сухость кожи, раздражение. На чувствительной дерме, кислота может оставить ожоги.
Стекольное производство
При помощи фосфата натрия изготавливают оптическое стекло.
Строительство
Технические сорта ортофосфата натрия снижают пористость бетона, улучшая его устойчивость к влаге, прочность.
Смягчение воды
Ортофосфат натрия применяется для смягчения воды. Эффект достигается, путем преобразования жестких солей в нерастворимые фосфаты.
Влияние на здоровье
Пищевая добавка Е399 считается безопасной. Разрешается, даже для изготовления детских молочныхбезмолочных смесей в России, Украине, во всех странах Евросоюза.
Польза
Фосфорные и натриевые соли легко расщепляются организмом, участвуют в растворении жиров и углеводов, помогая пище лучше усваиваться, образовывать необходимое количество энергии, нормализуют стул. Натриевые ионы улучшают минеральный и кислотно-щелочной баланс. При отсутствии передозировки не угрожают, а помогают организму в повседневной деятельности.
Вред
Навредить ортофосфат натрия может при передозировке и заболеваниях ЖКТ (на стадии обострения). Обычно данные состояния сопутствуют друг другу. Для стабилизации тринатривого фосфата в организме, употребляйте кальцийсодержащие продукты. Они помогут избежать сердечно-сосудистых болезней, спровоцированных передозировкой. Также чрезмерное потребление грозит возникновением остеопороза, повреждением зубной эмали, замедлением роста костной ткани. Особенно опасно проявление у детей т.к. тормозит физическое развитие.
В некоторых странах натриевый ортофосфат запрещен или ограничен, из-за загрязнения сточных вод, в результате производства бытовой химии.
В каких продуктах содержится фосфат натрия
Натриевый триполифосфат обладает эмульгирующими, разрыхляющими, стабилизирующими свойствами. Содержится в:
- ликероводочных товарах;,
- хлебобулочных изделиях, печенье;
- фабрично подготовленном мясе, рыбе;
- колбасных, копченых продуктах;
- консервах;
- сырах;
- супах, вермишели, пюре быстрого приготовления;
- густых соусах, заправках;
- концентрированном бульоне;
- сливках, промышленном молоке.
Съедобный Е399 может быть измельченным до порошкообразного состояния или гранулированным. Это дает возможность использовать его, в качестве разрыхлителя и соли-плавителя (для приготовления плавленых сырков).
Тип пищевой добавки
Фосфат натрия (пищевая добавка Е339) – разрыхлитель, влагоудерживатель, стабилизатор вкусацвета, эмульгатор, регулятор кислотности, текстурообразователь, усиливающий антиоксидантные свойства других веществ. Используется во многих промышленных сферах, особенно строительной, медицинской и пищевой. Пожаробезопасен, не взрывоопасен.
Класс опасности и токсичности
Фосфат натрия внесен в Регистр Росстандарта 03.02.2016 г. информационно-аналитическим центром «Безопасность веществ и материалов» ФГУП «ВНИИ СМТ». Присвоен 4 класс опасности (малотоксичная по степени воздействия на организм продукция), сигнальное слово: осторожно!
- фосфат натрия вреден при передозировке. Вызывает нарушения пищеварительного тракта, сердечные патологии (в исключительно редких случаях);
- пыль пищевой добавки Е399 раздражает слизистые органов зрения, дыхательных путей, дерму;
- выброс отходов в водосток загрязняет окружающую среду.
Предприятиям минимизировать утилизацию отходов в сточные воды, с целью экологической сохранности. Сотрудникам, контактирующим в тринатрийфосфатом работать в перчатках и респираторах для защиты органов зрения, дыхания, поверхности кожи от мелких частиц кислоты (пыли).
Первая помощь
При возникновении: першения в горле, головных болей, сухости в ротовой полости, кашле, общей слабости (в результате воздействия тринатрийфосфата) тщательно промыть пораженную область, пить много воды, обеспечить покой, принять активированный уголь. По необходимости обратиться за врачебной помощью. При отравлении пероральным путем рвоту не вызывать!
При попадании в глаза, режущих ощущениях, жжении: в течение 15 минут промывать широко раскрытые органы зрения под проточной водой. При контакте с носовой слизистой – тщательно промыть нос водой. С кожей – вымыть поверхность кожи с гигиеническим средством.
Обязательно обратиться к врачу при: рвоте, болях в зоне пищевода, расстройстве кишечника, красноте глаз!
Хранение и транспортировка
Хранить в хорошо вентилируемом сухом помещении при комнатной температуре, не превышающей 25°С, в упаковке производителя. Транспортировать сырье любым удобным способом в упаковке производителя (синтетических или бумажных мешках с внутренним вкладышем, защищающим от влаги).
Где купить, сколько стоит фосфат натрия, расфасовка
Приобрести фосфат натрия можно у завода производителя или дистрибьютора, через интернет, при личной встрече в необходимом количестве. Мелкие дилеры обеспечат доставку мешков Е399, объемом 1, 5, 10, 25 кг удобным и выгодным Вам способом.
Крупным предприятиям можно там же заказать нужный объем сырья и забрать покупку, объемом от 100 кг можно самостоятельно, воспользоваться доставкой от завода, курьером, почтовой службой.
Стоимость технических сортов натриевого фосфата колеблется в пределах 40-80 рубкг. Цена пищевого, используемого в фармацевтике – 200-400 руб, зависимо от ступеней замещения, объема заказа. В качестве бонуса постоянным крупным клиентам, производитель предоставляет сырье по заниженной цене.
Отзывы
Ангелина 38 лет.
Чтобы сэкономить на лекарствах (у меня частые запоры) купила пищевой фосфат натрия. При возникновении проблемы принимаю дозу на кончике ножа. Эффект, практически не отличается от таблеток. Улучшает стул, не влияет на общее самочувствие. Единственный недостаток – нельзя принимать часто, иначе возникает расстройство кишечника.
Владимир 65 лет.
Для собственного хлебного цеха приобрел 100 кг фосфата натрия. Хорошо разрыхляет хлеб, булочки, улучшает вкус, консистенцию.
Диана 28 лет.
Часто мучает изжога. Принимала фосфат натрия вместо таблеток, как «шипучку». В целом довольна. Жаль, что нельзя принимать при беременности.
Заключение
Фосфат натрия не взрывается, не самовоспламеняется. В целом безопасен для человека, но загрязняет окружающую среду, поэтому его использование ограничено. Можно применять для приготовления пищи (в промышленных) масштабах, употреблять медикаменты на основе фосфата натрия, но с осторожностью. Регулярное потребление влечет передозировку, влияющую на функциональность пищеварительного тракта, сердечную деятельность. Работая на производстве защищайте слизистые глаз, органов дыхания, кожу. То же касается применения концентрированных чистящих средств. Кислота легко поражает дерму, дыхательные пути, вызывая симптомы от дискомфорта до раздражения, требующего врачебной помощи.
Читайте также:
- Нитрит натрия (Е250): что это, свойства, вредно или нет, использование
- Карбонат натрия (кальцинированная сода): свойства, применение, реакции
- Сульфит натрия: описание, вред и польза, формула, получение, реакции
- Альгинат натрия (Е401): свойства, инструкция по применению
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…
|
Запишите формулы фосфатов — соединений металлов (натрия, кальция, алюминия) с группой атомов остатка ортофосфорной кислоты Н₃РО₄. (Габриелян. Химия. 8 класс. Параграф 8, №6) Учащиеся 8 класса в начале изучения курса химии учатся называть вещества по заданным химическим формулам и, наоборот, составлять химические формулы по названиям веществ. Остаток ортофосфорной кислоты Н₃РО₄ имеет степень окисления -3, натрий — +1, поэтому присоединяются 3 атома натрия, формула ортофосфата натрия: Na₃РО₄. Кальций имеет степень окисления +2, поэтому в формуле ортофосфата кальция 3 атома кальция и два остатка ортофосфорной кислоты: Са₃(РО₄)₂. Алюминий имеет степень окисления +3, в формуле ортофосфата алюминия получаем 1 атом алюминия и 1 остаток ортофосфорной кислоты, формула такая: AlPO₄. Абдигапар 6 месяцев назад Формулы фосфатов — соединений металлов (натрия, кальция, алюминия) с группой атомов остатка ортофосфорной кислоты Н₃РО₄: а) Ортофосфат натрия: Na3PO4 б) Ортофосфат кальция: Ca3(PO4)2 в) Ортофосфат алюминия: AlPO4 Знаете ответ? |
Смотрите также: ВПР по химии 8 класс 2020, задания, ответы, демоверсии, где найти? ВПР Химия 8 класс, Как выполнить задания с химическими веществами? ВПР Химия 8 класс, Как выполнить задания по перечню химических веществ? Химия 8 класс учебник Аббасов, где читать онлайн, краткое содержание? Химия 8 класс учебник Усманова, Сакарьянова, где читать онлайн? Химия 8 класс учебник Григорович, где читать онлайн, краткое содержание? Химия 8 класс учебник Еремин, Кузьменко, Дроздов, Лунин, где читать онлайн? Химия 8 класс учебник Габриелян, где читать онлайн, краткое содержание? Химия 8 класс учебник Кузнецова, Титова, Гара, где читать онлайн? ВПР 2022, химия, 8 класс, все варианты с ответами — где найти, скачать? |
Фосфат натрия ГОСТ 9337-79
Na3PO4·12H2O
Фосфат натрия (ортофосфат натрия) — натриевая соль ортофосфорной кислоты с химической формулой Na3PO4.
Фосфат натрия — соль. Белого цвета, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагирует в растворе с цинком и алюминием. Вступает в реакции ионного обмена. В присутствии воды образует кристаллогидрат с общей формулой Na3PO4×12H2O.
Применение
Использование фосфата натрия в стиральных порошках запрещено во многих странах для уменьшения эвтрофикацииводоемов.
В продуктах питания (пищевая добавка E339(iii)) используется не фосфат натрия, а дигидрофосфат как разрыхлитель для теста (при взаимодействии с пищевой содой) и эмульгатор для плавленого сыра, колбасы, сгущённого молока.
Применяется для обесцвечивания стекла при его плавке.
| Физические свойства | |
|---|---|
| Состояние |
твёрдое кристаллическое вещество |
| Примеси |
вода, входит в состав кристаллогидратов ортофосфатов натрия |
| Молярная масса |
163,94067 г/моль |
| Плотность |
безводный — 2,536; кристаллогидрат — 1,62 г/см³ |
| Термические свойства | |
| Т. плав. |
безводный — 1340; кристаллогидрат — 73,3÷76,7 °C |
| Энтальпия образования |
безводный -1922,8; кристаллогидрат -4471,6 кДж/моль |
| Химические свойства | |
| Растворимость в воде |
в пересчете на безводный 12,1(0°С); 94,6(100°С) |
Технические характеристики
| Наименование показателя | чда | ч |
|---|---|---|
| 1. Массовая доля натрия фосфорнокислого 12-водного, (Na3PO4*12H2O),% , не менее | 99 | 98 |
| 2. Массовая доля свободной щелочи (NaOH),%, не более | 1,5 | 2,0 |
| 3. Массовая доля натрия фосфорнокислого двузамещенного, (Na2HPO4), %, не более | 0,8 | 1,0 |
| 4. Массовая доля нерастворимых в воде веществ, %, не более | 0,005 | 0,01 |
| 5. Массовая доля общего азота (N), %, не более | 0,001 | 0,004 |
| 6. Массовая доля сульфатов (SO4), %, не более | 0,005 | 0,01 |
| 7. Массовая доля хлоридов (Cl), %, не более | 0,001 | 0,005 |
| 8. Массовая доля железа (Fe), %, не более | 0,0005 | 0,001 |
| 9. Массовая доля тяжелых металлов (Pb), %, не более | 0,0005 | 0,0005 |
| 10. Массовая доля мышьяка (As), %, не более | 0,00005 | 0,0005 |