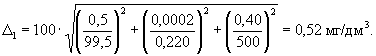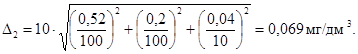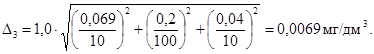Автоматический анализатор общего фосфора и ортофосфатов в потоке воды, стоков и канализации
- Внесены в гос.реестр средств измерений РФ
- Автоматическая передача данных по GSM
- Автоматическая очистка датчика
- Не нужны реагенты для работы
ПЕРЕЙТИ К ВЫБОРУ АНАЛИЗАТОРА
Фосфор и его соединения в сточных водах
Фосфор, как и азот, является биогенным элементом, поэтому его присутствие в водоёмах наблюдается даже в случае отсутствия сброса сточных вод. Однако, этот элемент находит широкое применение человеком, поэтому его концентрация в сточных водах столь высока. Фосфор может присутствовать в воде в виде нерастворимых и растворимых соединений.
Важное свойство фосфора (при условии достаточного наличия в воде азота) – эвтрофикация (стимуляция роста водорослей). Благодаря этому свойству происходит биологическое обрастание систем водооборота.
Общий фосфор
Общим фосфором в контексте изучения сточных вод принято называть общую концентрацию элементарного фосфора и всех его соединений, как органических, так и неорганических. Принято выделять следующие классы фосфорсодержащих загрязнений в сточных водах:
- Ортофосфаты.
- Фосфаты гидролизуемые.
- Органические соединения фосфора.
- Элементарный фосфор.
Для водоочистки наибольшую проблему представляют соли фосфорных кислот – фосфаты.
Фосфаты
Фосфатами называются соли ортофосфорной кислоты H3PO4. При этом следует отметить, что из-за строения молекулы данной кислоты, может образовываться ряд фосфатов различного состава и строения. К примеру, растворимые соли щелочных металлов натрия (Na) и калия (K) могут быть представлены как трёхзамещёнными ортофосфатами (Na3PO4, K3PO4), так и одно- и двузамещёнными (NaH2PO4, KH2PO4; Na2HPO4, K2HPO4).
Отдельно стоит упомянуть, что при дегидратации одно- и двузамещённых ортофосфатов происходит образование линейных или кольцевых полимерных фосфатов, отвечающих общей формуле Mn+2PnO3n+1. Ключевая особенность полифосфатов –способность радикально изменять свойства (растворимость, термостабильность и т.д.).
Польза и вред фосфатов
Фосфор – важный биогенный элемент. Благодаря этому, фосфор и его соединения нашли широкое применение в самых различных областях жизни человека. Одно из важнейших мест применения этого элемента – производство удобрений для агропромышленности, поскольку фосфор, наряду с калием и азотом, стимулируют рост и плодоношение многих сельскохозяйственных культур. Помимо производства удобрений, соединения фосфора используют в пищевой промышленности: в качестве подкислителей (например, в газированных напитках), загустителей (в хлебопекарном деле), консервантов для масел и замороженных овощей. Бытовое применение соединений фосфора также весьма обширно, поскольку они входят в состав поверхностно-активных веществ для моющих средств и стиральных порошков.
Тем не менее, избыток фосфора может причинять вред человеку и природе. Прямых доказательств вреда фосфатов, содержащихся в стиральных порошках и другой бытовой химии нет, есть опосредованное губительное влияние на среду обитания человека. Например, запуск процессов эвтрофикации водоёмов, куда происходит сброс сточных вод. Совершенно иначе обстоят дела с некоторыми другими соединениями фосфора (в основном органическими). Широко известны боевые отравляющие вещества зоман, зарин, фосфин, новичок, VX. Все эти БОВ имеют в основе фосфор, оказывают нервнопаралитическое воздействие. Отметим, что некоторые инсектициды, применяемые в сельскохозяйственной промышленности, генетически происходят от БОВ. Разумеется, современные разработки в области инсектицидов делают их неопасными для человека.
Откуда берутся в воде?
Фосфаты и другие соединения фосфора попадают в воду в основном антропогенным путём. Небольшие количества этого элемента и его соединений присутствуют в водоёмах как часть биологического цикла. Интересно, что одно из соединений фосфора (фосфин) – это биологический маркер, присутствие которого в атмосфере других планет говорит о возможном наличие жизни.
Промышленность
Химическая, сельскохозяйственная и пищевая промышленность являются основными источниками фосфора и его соединений в сточных водах. Способы применения не ограничиваются сферой производства удобрений, бытовой и пищевой химией. В тяжёлой промышленности соединения фосфора применяются в качестве фреонов, флюсов, пассиваторов, гидрожидкостей.
Бытовой сектор
Бытовой сектор – основной источник фосфатов в сточных водах. Продукция бытовой химии содержит в своём составе фосфорорганические соединения и фосфаты в качестве поверхностно-активных веществ, регуляторов кислотности, смягчителей воды.
Считается, что фосфаты вредны для экологии и здоровья человека. Поэтому их содержание в составе бытовой химии пытаются уменьшить. Пример борьбы с антропогенными причинами повышения концентрации фосфатов в сточных водах – постепенный ввод ограничений в ряде стран Европейского союза на их содержание в стиральных порошках. В данный момент допустимая норма – 0,3-0,5г на один цикл стирки.
Неантропогенные причины
Несмотря на то, что основной источник фосфора – «человеческий фактор», это не означает, что он единственный. Большинство живых организмов так или иначе использует фосфор и его соединения в своей биохимии. Например, для млекопитающих фосфор играет важнейшую роль, поскольку он необходим для существования энергетического обмена при помощи аденозинтрифосфата (АТФ). В 1941 году Фриц Лапман открыл, что именно этот нуклеозидтрифосфат является основным переносчиком энергии в клетке. Таким образом, фосфор необходим для существования высокоорганизованных форм жизни.
Фосфор выделяется в окружающую воду во время процесса автолиза трупов животных и рыб, при разложении растительной биомассы. Затем этот фосфор вновь поступает в живые клетки, участвуя в замкнутом биологическом цикле. Можно сделать вывод, что влияние неантропогенных факторов на концетрацию фосфатов в водах достаточно низкое, поскольку эта система находится в равновесии.
Нормы и ПДК
В природоохранной сфере
В нашей стране нормы содержания фосфора и его соединений в водоёмах регулируются в соответствии с ГН 2.1.5.1315-03 «Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования», постановлении Правительства РФ от 29.07.2013 N 644 (ред. от 22.05.2020) «Об утверждении правил холодного водоснабжения и водоотведения и о внесении изменений в некоторые акты Правительства Российской Федерации» и ряде другой нормативно-технической документации. В общем случае, ПДК зависит от типа водоёма и составляет примерно следующие величины:
- Для объектов хозяйственно-питьевого и культурно-бытового водопользования: от 0,0001 мг/л для элементарного красного фосфора до 3,5 мг/л (некоторые нерастворимые фосфаты).
- Для объектов рыбохозяйственного значения: от 0,0001 мг/л до 0,1 мг/л (некоторые органические соединения фосфора).
Моющие средства
Роспотребнадзор с 2017 года подготовил изменения в нормативы евразийского экономического союза, которые обязывают производителей бытовой химии снижать количество фосфатов в своей продукции до 1% по массе. Вызваны такие меры во многом тем, что сброс стоков, загрязнённых синтетическими моющими средствами, в водоёмы вызывает неконтролируемый бурный рост сине-зелёных водорослей и цианобактерий. Последние нарушают природное состояние водоёмов, приводя к исчезновению тех или иных видов водорослей и живых существ.
Методики определения в сточных водах
Существует достаточно широкий перечень методов определения фосфатов в сточных водах. Условно их можно поделить на две группы – простые и сложные. Первые, к сожалению, неточны. Вторые – сложны в применении. В связи с этим, выбор конкретной методики обусловлен целесообразностью:
- Необходимая точность измерений.
- Требования к квалификации оператора.
- Желательная скорость получения результатов измерения.
Исходя из этого, методики определения можно разделить на точные и грубые.
Грубые
К грубым методикам измерения относится органолептический колориметрический анализ проб воды. Данный способ измерения и требования к условиям его проведения регламентируются по ГОСТ 18309-2014 «Вода. Методы определения фосфорсодержащих веществ».
Особенность данного метода состоит в гидролизе полифосфатов с целью их превращения в ортофосфаты, с дальнейшим образованием окрашенных в синий цвет комплексных соединений с молибденом. Затем полученный раствор фотометрически исследуют при длине волны от 690 до 720 нм. Отметим, что определению фосфатов таким способом мешают железо, нитриты и растворимые силикаты. Их влияние нивелируют разбавлением или введением дополнительных реактивов, однако, это снижает точность исследования.
Ход исследования состоит из таких стадий:
- Отбор проб воды в соответствии с ГОСТ 17.1.5.05-85 «Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков»
- Подготовка посуды для удаления следов окрашенного комплекса от прошлых испытаний путём ополаскивания растворами NaOH или NaHCO3
- Приготовлении ряда рабочих растворов (KH2PO3 различной концентрации, раствор молибдата аммония (NH4)2MoO4, 37%-й раствор серной кислоты, 13,6%-й раствор соляной кислоты, раствор SnCl2)
- Введение растворов молибдата аммония и двухлористого олова в пробу
- Фотометрический анализ пробы на приборе
Для проведения исследований с помощью колориметрического анализа требуется достаточно много времени, опыт работы в лаборатории. Высокие трудозатраты снижают целесообразность применения этого метода.
Точные
На сегодняшний день наиболее точные значения концентрации фосфатов и других соединений фосфора даёт спектрофотометрический метод анализа с использованием электронных приборов. В современном мире спектрофотометрия перестала требовать высокой квалификации оператора прибора, поскольку современная электроника позволяет проводить анализ практически без участия человека. Сущность метода состоит в измерении изменений прохождения света через образец при различной длине волны, сопоставления данных и получения данных о градации спектров образца. Этот метод весьма удобен, поскольку не требует реактивов. Анализ происходит быстро и точно. Это как раз то, что нужно, чтобы обеспечить контроль состава сточных вод.
Очистка, доочистка, удаление фосфатов
Физико-химические способы
Как и со многими другими загрязняющими сточными воды веществами, для очистки вод от фосфатов применяются физико-химические методы. Сточную воду подвергают фильтрованию с целью удаления взвешенных веществ. Благодаря этому из воды удаляют часть фосфатных соединений. Затем в воду, подвергаемую очистке, вводятся коагулянты на основе сульфата алюминия, оксихлорида алюминия или хлорида железа, иногда совместно с флокулянтом – полиакриламидом. Это помогает образованию коллоидных фосфатов, их совместному осаждению с коагулянтами. Потом, вода с уже осаждёнными фосфатами подвергается отстаиванию или очистке флотацией. На этом этапе удаляется до 90% фосфатов. Источником коагулянтов могут служить специальные железные или алюминиевые аноды. В случае электрохимической очистки процесс происходит быстрее, поскольку выделяющиеся при электролизе газы помогают хлопьям оксидов и гидроксидов металлов подыматься на поверхность воды, где они удаляются. Однако, этот метод дорогой в эксплуатации, из-за чего его редко используют.
Биологические способы
Биологическим методом очистки сточной воды называется использование активного ила, содержащего в себе ряд аэробных и анаэробных микроорганизмов, способных использовать загрязняющие фосфаты в своём метаболизме. Как правило, при биологической очистке идёт процесс одновременного удаления из сточных вод фосфора и азота, поскольку оба этих элемента играют важную роль в процессах обмена веществ живых организмов.
Специфика метода заключается во введении в специальных резервуарах (аэротенках и метантенках) в сточные воды активного ила и питательного субстрата для него. Питательный субстрат необходим для создания оптимальных условий для тех бактерий, которые активно участвуют в процессе дефосфоризации. В качестве этого субстрата часто используют низкомолекулярные летучие жирные кислоты, а основной питательной средой выступают уксусная и пропионовая кислоты. В процессе бескислородного потребления бактериями органических кислот полифосфаты начинают разлагаться (до фосфатов). Бактерии используют энергию распада этих соединений в качестве топлива для поддержания процессов жизнедеятельности. Затем уже в аэробных условиях начинается размножение бактерий и водорослей, во время которого свободные фосфаты используются для синтеза АТФ бактериями. Таким образом, фосфаты из воды попадают в биомассу, которая затем отделяется от уже очищенной воды.
Комбинированные
Комбинированным методом очистки сточных вод называется процесс, в котором после химической коагуляции, вода подвергается дополнительно процессу биологической очистки. Использование комбинированного метода весьма выгодно, поскольку происходит более полная и тщательная очистка воды. Однако, существуют нюансы.
Например, введение коагулянтов и извести в фильтруемую воду достаточно сильно повышает показатель рН воды, что губительно для микроорганизмов. Чтобы бороться с этим явлением, воду подвергают карбонизации – насыщают её углекислым газом. Углекислый газ, проходя сквозь воду, образует угольную кислоту, которая помогает снизить рН до допустимых значений.
После прохождения двух этапов очистки, вода фильтруется, из неё удаляются нерастворимые осадки, активный ил, проводится её исследование на соответствие требованиям. После этого очищенная вода отправляется в сброс.
Извлечение фосфора из осадков стоков
Из осадка сточных вод можно выделять фосфорсодержащие соединения. Для такого выделения используют методы кристаллизации и магнитного удаления.
Кристаллизацией называется процесс роста кристаллов различных фосфатов (как поли- так и орто-) в растворе на затравочных центрах. В качестве последних часто используют фосфорсодержащие минералы, либо костяной уголь, шлак доменных печей и др. После выращивания кристаллов удовлетворительного размера и массы, они удаляются из раствора.
Для магнитной очистки фосфаты связывают в нерастворимые формы, вводя соответствующие реагенты (например, хлорид кальция), а затем выделяют их из массы при помощи магнитного металла.
Важно заметить, что мировая добыча фосфора весьма ограничена, поэтому достаточно остро встаёт вопрос переработки остатков сточных вод, зачастую содержащих этот ценный элемент. Ранее считалось, что присутствие тяжёлых металлов и других опасных загрязняющих веществ делает невозможным отделение чистого фосфора от других компонентов осадков стоков, однако, современные исследования приводят к возможности использования диоксида углерода в газообразной или сверхкритической форме для извлечения фосфора и отделения его от других соединений. Более подробно про этот метод можно прочитать в патенте RU 2 531 815 C2.

Автоматический анализатор общего фосфора и ортофосфатов в потоке воды, стоков и канализации
- Внесены в гос.реестр средств измерений РФ
- Автоматическая передача данных по GSM
- Автоматическая очистка датчика
- Не нужны реагенты для работы
ПЕРЕЙТИ К ВЫБОРУ АНАЛИЗАТОРА
Способы определения некоторых из этих элементов были подробно рассмотрены раньше. Определение углерода сжиганием описано в 127. Для определения фосфора сталь или чугун растворяют в азотной кислоте и в полученном азотнокислом растворе осаждают фосфат-ион молибденовой жидкостью. [c.454]
Для определения фосфора сплав меди растворяют в азотной кислоте и из полученного раствора осаждают фосфат-ион молибденовой жидкостью. В случае присутствия олова при растворении сплава в азотной кислоте образуется оловянная кислота, адсорбирующая из раствора фосфорную кислоту (см. 43). Тогда азотнокислый раствор сплава предварительно выпаривают несколько раз досуха, добавляя каждый раз соляную кислоту для удаления большей части олова в виде летучего хлорного олова, после чего осаждают фосфат-ион обычным способом. [c.456]
Купферон реагирует со многими катионами, образуя труднорастворимые комплексы. Растворимость купферона-тов металлов зависит от кислотности растворов регулируя кислотность, можно провести разделение катионов. Например, в сильнокислом растворе (5—10 %-ной соляной или серной) купфероном осаждаются железо, галлий, гафний, ниобий, палладий, полоний, олово, тантал и титан частично осаждаются висмут, молибден, сурьма, вольфрам. В слабокислом растворе осаждаются висмут, медь, ртуть, молибден, олово, торий, вольфрам. В нейтральной среде осаждаются (в присутствии ацетатного буфера) серебро, алюминий, бериллий, кобальт, хром, марганец, никель, свинец, РЗЭ, таллий и цинк. Купферон дает возможность отделить железо, титан, ванадий и цирконий от алюминия, кобальта, меди, арсенита и фосфата. Его часто используют для отделения мешающих катионов, например железа при определении алюминия, а также железа и ванадия при определении фосфора в феррованадии. [c.165]
Аналитической формой при определении фосфора является фосфат-ион. Поэтому в процессе разложения анализируемого образца выполняют окисление различных форм существования фосфора в Р04 -ион, применяя сильные окислители азотную кислоту, царскую водку, перманганат калия. При действии неокисляющих соляной или серной кислот фосфор может теряться в виде летучего фосфина (фосфористого водорода). [c.231]
Для определения фосфора предварительно отделяют мышьяк (а также примеси Sb, Sn и Hg) осаждением в кислой среде с помощью сульфида натрия, из фильтрата выделяют фосфор осаждением в виде фосфата магния-аммония, заканчивают определение комплексонометрическим титрованием магния или гравиметрическим методом, прокаливая осадок до нирофосфата магния. [c.203]
Колориметрическое определение фосфора (можно определять и дру гими методами). Основано на реакции фосфатов с молибдатом аммония, в результате которой образуется комплексное соединение голубого цвета. Его восстанавливают до окрашенного в темно-синий цвет оксида молибдена, который называется молибденовой синью. [c.105]
Для определения фосфора в природных фосфатах и фосфорных удобрениях, при содержании его от 3 до 8%, применяют титрование перхлоратом висмута [343]. [c.62]
При определении фосфора в железных рудах фосфор предварительно выделяют, чаще всего в виде фосфоромолибдата аммония, с титриметрическим окончанием анализа. Навеску руды разлагают соляной кислотой [82]. При наличии титана, образующего труднорастворимые фосфаты, часть фосфора может остаться в нерастворимом остатке. В этом случае фосфор отделяют от Ti сплав- [c.104]
Предложен метод определения фосфора в высокочистых окислах неодима и иттрия [3], основанный на получении фосфорномолибденовой сини взаимодействием фосфата и смеси Mo(VI) и Mo(V). [c.113]
Определение фосфора в природных фосфатах и удобрениях [c.115]
Определение содержания фосфора микрометодом. Для определения фосфора органическое вещество предварительно окисляют. При этом фосфор переходит в фосфат-ион, который определяют обычными методами неорганического анализа. Для определения фосфора применяют метод сжигания пробы в токе кислорода и микрометод. [c.209]
Первая группа. На принципе подавления сигнала другого элемента (особенно щелочноземельных металлов) основаны косвенные методы определения фосфора. Эффект подавления фосфором абсорбционного сигнала объясняют образованием термостойких фосфатов, которые в пламени полностью не диссоциируют. Этим методом можно определять до 0,001% фосфора. [c.259]
Отделение силиката от фосфата осуществляется путем выпаривания с хлорной кислотой до появления белых паров, при этом кремневая кислота обезвоживается и переходит в нерастворимую форму ее отфильтровывают или центрифугируют. Таким способом удаляли кремневую кислоту при фотометрическом определении фосфора в железной руде [9], известняке [8] и биологических объектах [17]. [c.11]
Условия непосредственного осаждения фосфора в виде фосфата магния и аммония изложены в приведенном ниже ходе определения фосфора в фосфатной породе, не содержащей заметных количеств нерастворимых в кислоте соединений фосфора [c.791]
При определении фосфора в чугунах и сталях после растворения навески в НЫОз и окислении образовавшейся фосфористой кислоты до фосфорной фосфат-ион осаждают в виде (ЫН4)зР04- 12МоОз. Отфильтровав осадок, его растворяют в аммиаке, после чего осаждают молибденовую кислоту в виде РЬМо04, по массе которого и вычисляют содержание фосфора. Вычислить фактор пересчета для этого определения. [c.191]
Метод определения фосфора из золы углей был исследован институтом СЕРШАР в рамках разработки рекомендаций ISO [41 ]. Чтобы избежать влияния кремниевого ангидрида, после сжигания угля, согласно стандарту [25], образующуюся золу обрабатывают в горячем состоянии смесью азотной и фтористоводородной кислот. Кремниевый ангидрид улетучивается, другие составляющие находятся в растворенном состоянии и фосфат восстанавливается в форме осадка фосфоромолибденаммония, который затем анализируют. Метод является сложным, требующим особой внимательности при промывке полученного осадка. [c.51]
Содержание фосфата в пробе рассчитывают по калибровочному графику. Для построения графика проводят определение фосфора в стандартном растворе КН2РО4, беря различные его количества в пределах чувствительности данного метода, а именно от 0,2 до 2 мкмоль (фосфата в пробе для колориметрирования (5 мл). Если в исследуемом растворе присутствуют лабильные фосфорные соединения, то поступают следующим образом. Определяют содержание фосфата в исходном безбелковом растворе айв том же растворе после осаждения из него неорганического фосфата магнезиальной смесью б (с. 38). Tio разности количества фосфата, найденного в пробах а—б), рассчитывают количество неорганического фосфата в исследуемом растворе. [c.35]
Определение фосфора. По окончании минерализации содержимое колбы количественно переносят в мерную колбу на 25 мл или в мер- ную пробирку на 10 мл, добавляя небольшими порциями воду и тщательно ополаскивая колбу Кьельдаля. Первую порцию воды в колбу Кьельдаля следует добавить очень осторожно, так как при этом происходит сильное разогревание раствора и создаются условия для гидролиза пирофосфата, который может образоваться в процессе минерализации при длительном нагревании фосфата с концентрированной серной кислотой. В мерную колбу или пробирку, заполненную приблизительно наполовину разбавленным минерализатом, добавляют, 1—2 капли фенолфталеина и нейтрализуют кислоту сначала 5 н., а затем 0,5 н. раствором щелочи до слаборозовой окраски, доводят водой до метки и перемешивают. Из каждой колбы (пробирки) отбирают по две параллельные пробы и проводят определение неорганического фосфата (с. 33). При содержании в образце небольших количеств фосфата (до 0,1 мкмоль на пробу) удобно пользоваться методом, предложенным Бартлеттом (с. 48). [c.45]
Определение по фосфору считается наиболее надежным методом оценки количества нуклеиновых кислот, так как его процентное содержание в наименьшей степени зависит от нуклеотидного состава для ДНК оно составляет 9,8—10,1%, для РНК —9,1—9,6 26. При определении фосфора нуклеиновых кислот в тканях необходимо предварительно удалить свободные нуклеотиды, неорганический фосфат, а также все фосфорсодержащие соединения ненуклеотидной природы, в частности липиды. [c.163]
Основным преимуществом титриметрического метода является быстрота выполнения анализа. Метод неоднократно усовершенствовали [72, 158, 416, 428, 513, 1125] он дает удовлетворительные результаты и широко применяется до настоящего времени для определения концентраций фосфора выше 0,02%. Описано опре-. деление фосфора титриметрическим фосфоромолибдатным методом в сталях и чугунах 40, 74, 94, 104, 210, 249, 257, 263, 375, 376, 483, 550, 573, 599, 878, 885, 1057, 1099], рудах черных и цветных металлов [104, 225, 298, 301, 356, 379, 844], силикоцирконии, силикохроме, хромистом железняке [19], медных сплавах [263], фтористом, церии [1159], электролите для латунирования [244], фосфоритах [234], моющих средствах [670, 671], нефтепродуктах [228], вине [607]. Описано определение фосфорной кислоты в присутствии серной и хромовой кислот [631], ортофосфата в присутствии конденсированных фосфатов [509], фосфора в органических веществах [231, 997]. [c.32]
При определении фосфора в конденсированных фосфатах, например в NajPaOie, их предварительно переводят в ортофосфаты осторожным кипячением с концентрированной НС1 [1226]. [c.34]
При прямом титровании фосфатов раствором соли свинца [1172] при рн 2—3 в качестве индикатора применяют хлороформный раствор дитизона. Титруют до перехода зеленой окраски в фиолетовую. Метод применяют для определения фосфора в фосфатных удобрениях [1174]. В качестве индикатора применяют также эриох-ром черный Т (растворяют 0,2 г эриохрома черного Т в 5 мл С2Н5ОН и 15 мл триэтаНоламина) [950]. Титруют до появления красной окраски. Метод применяют для определения микроколичеств фосфора в органических веществах. Для определения микроколичеств фосфора применяют также титрование нитратом свинца в присутствии 2-азо-4-резорцина [1018]. Титруют до появления красного окрашивания. При содержании фосфора 20— 400 мкг средняя абсолютная ошибка определения составляет 2—3 мкг Р. При косвенном определении фосфатов с помощью нитрата свинца применяют окислительно-восстановительные индикаторы [732, 733]. Метод основан на осаждении РО/ в виде РЬз(Р04)2 нитратом свинца, избыток которого оттитровывают К4[Ге(СК)б1 в присутствии вариаминового синего и Кз[Ге(СК)б] в качестве индикатора. Титруют до перехода фиолетовой окраски в бледно-желтую. [c.37]
Косвенный комплексонометрический метод определения фосфора с применением солей висмута основан на осаждении фосфора в виде В1Р04. Избыток висмута титруют комплексоном III в присутствии одного из индикаторов пирокатехинового фиолетового [187, 1034, 11131, К или пирогаллового красного [187] при pH < 1. Определению фосфата мешают С1 , 804 , Ге, Hg, ЗЬ, 1п, Оа, Ът и ТЬ [1034]. [c.39]
Описан комплексонометрический метод определения фосфора с применением лантана в качестве осадителя. После отделения осадка LaP04 добавляют известное количество комплексона III, избыток которого титруют раствором La(N0g)3 при pH 5 в присутствии хромазурола S [353]. Метод применяют для определения фосфора в элементоорганических соединениях. По другому варианту к раствору фосфата добавляют известное количество La(N03)g, избыток которого титруют раствором комплексона III при pH 5 в присутствии индикатора ксиленолового оранжевого [801, 802]. Метод применяют для определения фосфора в морской воде [801]. [c.40]
Описан метод определения фосфора в вольфрамовом ангидриде с использованием Мо [455, 457]. Навеску растворяют в горячем 20%-ном растворе КОН, фильтруют. Из фильтрата осаждают и отделяют фосфаты действием Са (N0g)2. Фосфаты на фильтре растворяют горячим раствором HNOg и вторично осаждают фосфат. Осадок промывают, растворяют в горячей HNOg, разбавляют, вводят радиоактивный молибден в виде К2 Мо04, экстрагируют ФМК изобутанолом, затем смесью изобутанола и хлороформа, и объединенном экстракте определяют активность Мо. [c.65]
Яцимирским и др. [464] разработан метод определения фосфатов, сульфатов и молибдатов, основанный на радиометрическом титровании их раствором лутеохлорида, содержащего Со. Титрование проводят при pH 13. Определению мешают СгО , [Ре (СК) ] -, [Ге (СН) ] -, С О -, 30, -, СОд -, Вг», тартраты и цитраты. Относительная ошибка не превышает +2% при содержании фосфора 3—10 мг. Метод применен для определения фосфора в фосфорите. [c.66]
Для определения фосфора в присутствии лабильных фосфатов применена экстракция фосфорномолибденовой кислоты бутанолом из 0,05 N H2SO4 [718]. [c.88]
Обычный гравиметрический метод определения фосфора в природных фосфатах и удобрениях заключается в осаждении Р0 в кислом растворе в виде фосфоромолибдата аммония и переосаж-дении его в виде MgNH4P04 после прокаливания осадка его взвешивают в виде МдгРгО,. Метод является наиболее точным [И, 780]. [c.115]
Предложен метод определения фосфора в природных фосфатах и суперфосфатных удобрениях, основанный на отделении фосфора осаждением в виде В1Р04 [187, 1138]. Анализ заканчивают комп-лексонометрическим методом [1138]. [c.116]
При анализе природных фосфатов применяют титриметрический метод определения фосфора [11], заключающийся в осаждении РО4 — в кислом растворе молибдатом аммония в виде фосфоромолибдата аммония (КН4)зР04-12М00з-Н20 осадок отфильтровывают и растворяют в определенном объеме титрованного раствора щелочи. Избыток щелочи, не вошедший в реакцию, оттитровывают обратно раствором кислоты. [c.116]
Для определения фосфора в нефтепродуктах органически связанный фосфор переводят в ионную форму быстрым сжиганием в О2 и сплавлением остатка с Naa Og , полученный фосфат определяют колориметрически в виде восстановленного фосфорномолибденового комплекса. Метод применим для определения содержаний фосфора от 0,003 до 4% [710, 715]. [c.158]
Спектрофотометрический метод определения фосфора путем восстановления фосфорномолибденового комплекса Na2S20з и 1-амино-2-нафтол-4-сульфоновой кислотой может быть применен для определения РО4 в присутствии поли- и метафосфатов [274]. Метод применим также для определения РО4 в присутствии органических фосфатов. [c.165]
Определение фосфора в виде Mg2P20 может быть осуществлено и без образования осадка фосфоромолибдата аммония. Осаждение проводят из раствора, содержащего фосфат-ионы, действием магнезиальной смеси далее поступают так же, как и при определении ионов магния (см. 17). [c.302]
Разработаны различные экстракционно-фотометрические варианты определения фосфора в виде синего ФМК комплекса, возникающего после обработки экстракта восстановителем. Так, экстракция ФМК эфиром, обработка экстракта раствором двухлористого олова и фотометрирование ФМК сини применены для определения фосфора в присутствии больших количеств ванадпя [130]. Аналогичные методики, отличающиеся только восстановителем или природой экстрагента, описаны для определения фосфора в сталях, чугуне и железных рудах [131] металлическом хроме [132] природных водах [133] для одновременного определения фосфора и кремния [134] разделения и фотометрического оиределения фосфата, арсената и силиката [135, 136]. [c.240]
Фотометрический метод определения фосфора в стали основан на восстановлении фосформолибденовой кислоты Ре(П) и МагЗОз до так называемого молибденового синего — ярко окрашенного синего комплекса, в котором молибден находится в более низкой степени окисления, чем в молибдате. Для этого после окисления до фосфата при помощи КМПО4 и восстановления полученного МпОа азотнокислый раствор нейтрализуют аммиаком, раствор слабо подкисляют НС1 и Ре(П1) восстанавливают НагЗОз при нагревании. Раствор дополнительно подкисляют НС1, охлаждают, чтобы предотвратить образование гетерополикислот, как в случае кремния и мышьяка, и к нему медленно по каплям прибавляют определенный объем раствора молибдата аммония. Полученный синий раствор переливают в мерную колбу, доливают до отметки и фотометрируют. Концентрацию фосфора находят по предварительно построенной калибровочной кривой. [c.477]
Все химические данные, а также спектры поглощения указывают, что центральный атом определяет все свойства двенадцати окружающих его молибдат-ионов. Это видно из спектра поглощения желтая окраска обусловлена сдвигом всей полосы поглощения молибдата к длинноволновой части спектра. Далее, резко изменяется растворимость различных соединений так, фосфат аммония и молибдат аммония хорошо растворимы в воде, тогда как фосфоромолибдат аммония малорастворим. Существенно изменяется отношение к органическим растворителям. Изменяются даже такие характерные свойства, как отношение к восстановителям. На восстановлении ГПК до синих соединейий основан ряд методов определения фосфора, кремния и других центральных атомов свободный молибдат в этих же условиях почти не восстанавливается. Наконец, хорошо известен индивидуальный характер ГПК, т. е. зависимость свойств от центрального атома. Так кремнемолибденовая кислота значительно более устойчива к действию различных (оксалат, тартрат и др.) комплексонатов и кислот по сравнению с фосфорномолибденовой кислотой. Необходимо подчеркнуть, что образование кремнемолибденовой кислоты происходит п и меньшей кислотности, чем фосфорномолибденовой кислоты. Однако это связано не с устойчивостью кремнемолибденовой кислоты, а со свойствами кремневой кислоты, которая в кислых растворах сильно полимеризована (сМ.ниЖе). [c.259]
Фосфор больше всего распространен в более основных изверженных и метаморфических породах и практически всегда в них содержится, хотя бы в следах. Он чаще встречается в породах, богатых известью и железом, чем в магнезиальных породах. За одним или двумя редкими исключениями, фосфор в природных неорганических соединениях находится в виде фосфатов, число которых очень велико. Он распространен главным образом в виде минерала апатита Gag (F, G1, 0Н)(Р04)з, но находится также в минералах ксенотимеДУ, Ег, Се)Р04 имонаците (Се, La, Nd, Рг)Р04-Ь ТЬз(Р04)4. В метеоритах встречается фосфид железа Фосфор является также важной составной частью живых организмов. Он присутствует в многочисленных рудах и продуктах металлургического производства. Методы точного определения фосфора имеют исключительно важное значение. [c.777]
При анализе шести аликвотных частей стандартного раствора чистого двузамещенного фосфата аммония (без предварительного осаждения в виде фосфоромолибдата) было получено 0,2367 г и 0,2368 г MgaP207 после однократного осаждения, 0,2370 г и 0,2368 г после двукратного осаждения и 0,2366 г и 0,2368 г после трехкратного осаждения. Как показали результаты тщательного определения фосфора в 10 фильтратах и промывных водах от 12 осаждений, при каждом осаждении в среднем теряется менее 0,03 мг РгОб. Совпадение результатов, полученных однократным и двукратным осаждением, является исключением и объясняется тем, что сначала фосфор определялся в растворе двукратным осаждением, причем было вычислено количество магнезиальной смеси, необходимое для получения избытка в 2 мл, а однократное осаждение затем проводилось в растворах, содержапщх этот избыток осадителя, а также и то количество соляной кислоты, которое было израсходовано для растворения первого осадка при других определениях. [c.785]
Селеновая кислота пе зшияет на определение фосфора двукратным осаждением в виде фосфора магния и аммония. Селенистая кислота несколько мешает, а мешающее влиязше теллуристой и теллуровой кислот очень велико. Однако ни одно из тих соединений не мешает, если перед первым осаждением фосфата в раствор ввести 1 г лимонной кислоты. [c.786]
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО ГИДРОМЕТЕОРОЛОГИИ
И МОНИТОРИНГУ ОКРУЖАЮЩЕЙ СРЕДЫ
(РОСГИДРОМЕТ)
|
РУКОВОДЯЩИЙ ДОКУМЕНТ |
РД |
МАССОВАЯ КОНЦЕНТРАЦИЯ ФОСФАТОВ И
ПОЛИФОСФАТОВ В ВОДАХ. МЕТОДИКА ВЫПОЛНЕНИЯ
ИЗМЕРЕНИЙ ФОТОМЕТРИЧЕСКИМ МЕТОДОМ
Ростов-на-Дону
2006
Предисловие
1. РАЗРАБОТАН ГУ «Гидрохимический
институт»
2. РАЗРАБОТЧИКИ Л.В. Боева, канд. хим.
наук, А.А. Назарова, канд. хим. наук, Т.О. Гончарова, канд. хим. наук, И.А.
Рязанцева.
3. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ
Заместителем Руководителя Росгидромета
4. СВИДЕТЕЛЬСТВО ОБ АТТЕСТАЦИИ МВИ Выдано
метрологической службой ГУ «Гидрохимический институт» 15.02.2005 г. №
33.24-2005 г.
5. ЗАРЕГИСТРИРОВАН ГУ ЦКБ ГМП за номером
РД 52.24.382-2006
6. ВЗАМЕН РД 52.24.382-95 «Методические
указания. Методика выполнения измерений массовой концентрации фосфатов и
полифосфатов в водах фотометрическим методом»
Введение
Фосфор относится к числу биогенных
элементов, имеющих особое значение для развития жизни в водных объектах.
Соединения фосфора встречаются во всех живых организмах, они регулируют
энергетические процессы клеточного обмена. При отсутствии соединений фосфора в
воде рост и развитие водной растительности прекращается, однако избыток их
также приводит к негативным последствиям, вызывая процессы эвтрофирования
водного объекта и ухудшение качества воды.
Соединения фосфора попадают в природные
воды в результате процессов жизнедеятельности и посмертного распада водных
организмов, выветривания и растворения пород, содержащих фосфаты, обмена с
донными осадками, поступления с поверхности водосбора, а также с бытовыми и
промышленными сточными водами. Загрязнению природных вод фосфором способствуют
широкое применение фосфорных удобрений, полифосфатов, содержащихся в моющих
средствах, флотореагентов и др.
Неорганические соединения фосфора в
природных водах представлены в виде ортофосфатов и полифосфатов (к последним
причисляются также пирофосфаты), причем преобладающей формой обычно являются
ортофосфаты — соли ортофосфорной кислоты. Сумму неорганических соединений
фосфора часто обозначают термином «фосфор минеральный»; данный термин принят и
в настоящей методике выполнения измерений (иногда термин «фосфор минеральный»
применяют по отношению к ортофосфатам, однако, несмотря на то, что ортофосфаты
являются обычно преобладающей формой, такое использование термина некорректно).
Если используется термин «фосфаты», обычно имеют в виду ортофосфаты, в
противном случае приводят уточнение, например, полифосфаты, пирофосфаты и т.п.
Фосфаты в воде могут присутствовать в
виде различных ионов в зависимости от величины рН (таблица 1).
Таблица 1 —
Мольные доли, %, производных фосфорной кислоты в зависимости от рН воды
|
рН |
5 |
6 |
7 |
8 |
8,5 |
9 |
10 |
11 |
|
н3ро4 |
0,10 |
0,01 |
— |
— |
— |
— |
— |
— |
|
н2ро4— |
97,98 |
83,68 |
33,90 |
4,88 |
1,60 |
0,51 |
0,05 |
— |
|
НРО42- |
1,91 |
16,32 |
66,10 |
95,12 |
98,39 |
99,45 |
99,59 |
96,53 |
|
РО43- |
— |
— |
— |
— |
0,01 |
0,04 |
0,36 |
3,47 |
В водах соединения фосфора,
как минеральные, так и органические могут присутствовать в растворенном,
коллоидном и взвешенном состоянии. Переход соединений фосфора из одной формы в
другую осуществляется довольно легко, что создает сложности при определении тех
или иных его форм. Обычно идентификация их осуществляется по процедуре, с
помощью которой проводят определение. В том случае, когда анализируют
фильтрованную пробу, говорят о растворенных формах, в противном случае — о
суммарном содержании. Содержание взвешенных соединений фосфора находят по
разности. Определение растворенных фосфатов (ортофосфатов) осуществляется по
реакции с молибдатом аммония и аскорбиновой кислотой с образованием
молибденовой сини в исходной водной пробе, в то время как для определения
полифосфатов требуется предварительно перевести их в фосфаты путем кислого
гидролиза. Следует, однако, отметить, что разграничение приведенных форм не
является строгим. При определении фосфатов из-за кислой реакции среды может
гидролизоваться некоторая часть полифосфатов или лабильных органических
соединений фосфора, но доля таких соединений невелика и на практике этим
пренебрегают. При определении растворенных форм также может возникать
неопределенность из-за возможности быстрого перехода разных форм фосфора друг в
друга или прохождения через фильтр коллоидных веществ с размером частиц меньше,
чем размер пор фильтра, поэтому иногда используют термин не «растворенные»
формы, а «фильтруемые».
По причинам, приведенным выше, для
получения сравнимых результатов определения соединений фосфора и однозначной их
интерпретации важно строгое соблюдение условий предварительной обработки проб и
процедуры анализа, в частности при определении растворенных форм проба должна
быть отфильтрована как можно быстрее после отбора через фильтр с размером пор
0,45 мкм.
Концентрация фосфатов в незагрязненных
природных водах может составлять тысячные, редко сотые доли мг/дм3.
Повышение их содержания свидетельствует о загрязнении водного объекта.
Концентрация фосфатов в воде подвержена сезонным колебаниям, поскольку она
зависит от интенсивности процессов фотосинтеза и биохимического разложения
органических веществ. Минимальные концентрации соединений фосфора наблюдаются
весной и летом, максимальные — осенью и зимой.
Уменьшение содержания фосфатов в воде
связано с потреблением его водными организмами, а также переходом в донные
отложения при образовании нерастворимых фосфатов.
Предельно допустимая концентрация
фосфатов (в пересчете на фосфор) в воде водных объектов рыбохозяйственного назначения
составляет:
— для олиготрофных водных объектов 0,05
мг/дм3;
— для мезотрофных — 0,15 мг/дм3;
— для эвтрофных — 0,20 мг/дм3.
Предельно допустимая концентрация
фосфатов для водных объектов хозяйственно-питьевого и культурно-бытового
назначения не установлена, в них нормируется только содержание полифосфатов.
Предельно допустимая концентрация полифосфатов составляет 3,5 мг/дм3
в пересчете на фосфат-ион и 1,1 мг/дм3 в пересчете на фосфор.
РУКОВОДЯЩИЙ ДОКУМЕНТ
МАССОВАЯ
КОНЦЕНТРАЦИЯ ФОСФАТОВ И ПОЛИФОСФАТОВ В ВОДАХ. МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
ФОТОМЕТРИЧЕСКИМ МЕТОДОМ
Дата введения — 2006-04-01
1.
Область применения
1.1. Настоящий руководящий документ
устанавливает методику выполнения измерений (далее — методика) массовой
концентрации неорганических соединений фосфора — фосфатов и полифосфатов — в
сумме (фосфор минеральный) и раздельно в пробах природных и очищенных сточных
вод в диапазоне от 0,010 мг/дм3 до 0,200 мг/дм3 в
пересчете на фосфор фотометрическим методом.
При анализе проб воды с массовой
концентрацией фосфора, превышающей 0,20 мг/дм3, допускается
выполнение измерений после соответствующего разбавления пробы дистиллированной
водой.
1.2. Настоящий руководящий документ
предназначен для использования в лабораториях, осуществляющих анализ природных
и очищенных сточных вод.
2.
Нормативные ссылки
В настоящем руководящем документе
использованы ссылки на следующие нормативные документы:
ГОСТ
12.1.005-88 ССБТ. Общие санитарно-гигиенические требования к воздуху
рабочей зоны
ГОСТ
12.1.007-76 ССБТ. Вредные вещества. Классификация и общие требования
безопасности
ГОСТ
17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора,
первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ
17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб
поверхностных и морских вод, льда и атмосферных осадков
ГОСТ
Р ИСО 5725-6-2002 Точность (правильность и прецизионность)
методов и результатов измерений. Часть 6. Использование значений
точности на практике
ГОСТ Р 51592-2000 Вода. Общие
требования к отбору проб
МИ 2881-2004 Рекомендация. ГСИ. Методики
количественного химического анализа. Процедуры проверки приемлемости
результатов анализа.
А также на нормативные документы,
приведенные в разделе 4.
3.
Приписанные характеристики погрешности измерения
3.1. При соблюдении всех регламентируемых
методикой условий проведения измерений характеристики погрешности результата
измерения с вероятностью 0,95 не должны превышать значений, приведенных в
таблице 2.
Таблица 2 —
Диапазон измерений, значения характеристик погрешности и ее составляющих (Р =
0,95)
|
Диапазон измерений массовой концентрации фосфора, X, мг/дм3 |
Показатель |
Показатель |
Показатель |
Показатель |
|
Фосфаты |
||||
|
От |
0,001 |
0,001 |
0,026 |
0,002 |
|
Фосфор |
||||
|
От |
0,058 |
0,001 |
0,068 |
0,002 |
|
Св. |
0,008 |
0,014 |
0,011 |
0,030 |
При выполнении измерений в
пробах с массовой концентрацией фосфора свыше 0,200 мг/дм3 после
соответствующего разбавления погрешность измерения не превышает величины D · η, где D — погрешность измерения концентрации фосфора в
разбавленной пробе; η — степень разбавления
Предел обнаружения фосфатов 0,002 мг/дм3,
полифосфатов 0,005 мг/дм3 (в пересчете на фосфор), фосфора
минерального — 0,004 мг/дм3.
3.2. Значения показателя точности
методики используют при:
— оформлении результатов измерений,
выдаваемых лабораторией;
— оценке деятельности лабораторий на
качество проведения измерений;
— оценке возможности использования
результатов измерений при реализации методики в конкретной лаборатории.
4. Средства измерений, вспомогательные устройства,
реактивы, материалы
4.1.
Средства измерений, вспомогательные устройства
При выполнении измерений применяют
следующие средства измерений и другие технические средства:
4.1.1. Фотометр или спектрофотометр
любого типа (КФК-3, КФК-2, СФ-46, СФ-56 и др.)
4.1.2. Весы лабораторные высокого (II)
класса точности по ГОСТ 24104-2001.
4.1.3. Весы лабораторные обычного (IV)
класса точности по ГОСТ
29329-92 с наибольшим пределом взвешивания 200 г.
4.1.4. Государственный стандартный
образец состава раствора фосфат-ионов ГСО 7260-96.
4.1.5. Колбы мерные не ниже 2 класса
точности по ГОСТ
1770-74
вместимостью: 50
см3 — 8 шт.
100
см3 — 4 шт.
200
см3 — 6 шт.
500
см3 — 1 шт.
4.1.6. Пипетки градуированные не ниже 2
класса точности по ГОСТ
29227-91 вместимостью: 1 см3 — 3 шт.
2
см3 — 1 шт.
5
см3 — 3 шт.
10
см3 — 4 шт.
4.1.7. Пипетки с одной отметкой не ниже 2
класса точности по ГОСТ 29169-91
вместимостью: 5 см3 — 2 шт.
10
см3 — 2 шт.
20
см3 — 1 шт.
25
см3 — 2 шт.
100
см3 — 1 шт.
4.1.8. Цилиндры мерные по ГОСТ
1770-74 вместимостью:
25
см3 — 1 шт.
50
см3 — 3 шт.
100
см3 — 2 шт.
250
см3 — 1 шт.
500
см3 — 1 шт.
4.1.9. Колбы конические или плоскодонные
по ГОСТ
25336-82 вместимостью:
100
см3 — 10 шт.
500
см3 — 1 шт.
4.1.10. Колбы конические или плоскодонные
термостойкие по ГОСТ
25336-82 вместимостью: 250 см3 — 4 шт.
4.1.11. Часовые стекла —
4 шт.
4.1.12. Воронки лабораторные по ГОСТ
25336-82 диаметром:
56
мм — 4 шт.
75
мм — 1 шт.
4.1.13. Стаканы химические термостойкие
по ГОСТ
25336-82 вместимостью:
100
см3 — 1 шт.
250
см3 — 1 шт.
500
см3 — 1 шт.
1000
см3 — 2 шт.
4.1.14. Стаканчики для взвешивания
(бюксы) по ГОСТ
25336-82 — 2 шт.
4.1.15. Эксикатор по ГОСТ
25336-82 — 1 шт.
4.1.16. Капельница по ГОСТ
25336-82 — 1 шт.
4.1.17. Шкаф сушильный общелабораторного
назначения.
4.1.18. Плитка электрическая с закрытой
спиралью по ГОСТ
14919-83 или баня песчаная.
4.1.19. Палочка стеклянная
4.1.20. Устройство для фильтрования проб
с использованием мембранных фильтров.
Допускается использование других типов
средств измерений, вспомогательных устройств, в том числе импортных, с
характеристиками не хуже, чем у приведенных в 4.1.
4.2. Реактивы и материалы
При выполнении измерений применяют
следующие реактивы и материалы:
4.2.1. Калий фосфорнокислый
однозамещенный (дигидрофосфат калия) KН2РО4 по ГОСТ
4198-75, х. ч. (при отсутствии ГСО).
4.2.2. Аммоний молибденовокислый
(молибдат аммония (NН4)6Мo7О24 · 4Н2О) по ГОСТ 3765-78,
ч. д. а.
4.2.3. Аскорбиновая кислота
фармакопейная.
4.2.4. Калий сурьмяно-виннокислый (антимонилтартрат
калия) K(SbO)C4H4O6 · 1/2Н2O по
ТУ 6-09-803-76, ч. д. а. (допускается ч.).
4.2.5. Натрия гидроокись (гидроксид
натрия) по ГОСТ 4328-77, ч. д. а.
4.2.6. Кислота серная по ГОСТ
4204-77, х. ч.
4.2.7. Кислота соляная по ГОСТ 3118-77, ч. д.
а.
4.2.8. Калий марганцевокислый (перманганат
калия) по ГОСТ 20490-75, ч. д. а.
4.2.9. Натрий серноватистокислый (натрия
тиосульфат) 5-водный по ГОСТ
27068-86, ч. д. а.
4.2.10. Сульфаминовая кислота по ТУ
6-09-2437-79, ч.
4.2.11. Фенолфталеин, индикатор, по ТУ
6-09-629-77, ч. д. а.
4.2.12. Кальций хлористый, безводный
(хлорид кальция) по ГОСТ 450-77, ч.
4.2.13. Спирт этиловый по ГОСТ
18300-87.
4.2.14. Хлороформ по ГОСТ
20015-88, очищенный.
4.2.15. Вода дистиллированная по ГОСТ 6709-72.
4.2.16. Фильтры бумажные обеззоленные
«белая лента» по ТУ 6-09-1678-86.
4.2.17. Фильтры мембранные «Владипор
МФАС-ОС-2», 0,45 мкм, по ТУ 6-55-221-1-29-89 или другого типа, равноценные по
характеристикам.
Допускается использование реактивов,
изготовленных по другой нормативно-технической документации, в том числе
импортных, с квалификацией не ниже указанной в 4.2.
5.
Метод измерений
Определение ортофосфатов фотометрическим
методом основано на взаимодействии их с молибдатом аммония в кислой среде с
образованием молибдофосфорной гетерополикислоты Н7[Р(Мо2O7)6] · nH2О, которая затем восстанавливается аскорбиновой
кислотой в присутствии антимонилтартрата калия до интенсивно окрашенной
молибденовой сини. Максимум оптической плотности образовавшегося соединения
наблюдается при 882 нм.
Для определения полифосфатов их
предварительно переводят в ортофосфаты кипячением с серной кислотой. В
полученном растворе находят сумму орто- и полифосфатов (фосфор минеральный).
Полифосфаты определяют по разности между содержанием ортофосфатов в исходной
пробе и в пробе после кипячения.
6.
Требования безопасности, охраны окружающей среды
6.1. При выполнении измерений массовой
концентрации орто- и полифосфатов в пробах поверхностных вод суши и очищенных
сточных вод соблюдают требования безопасности, установленные в государственных
стандартах и соответствующих нормативных документах.
6.2. По степени воздействия на организм
вредные вещества, используемые при выполнении измерений, относятся ко 2, 3
классам опасности по ГОСТ
12.1.007-76.
6.3. Содержание используемых вредных
веществ в воздухе рабочей зоны не должно превышать установленных предельно
допустимых концентраций в соответствии с ГОСТ
12.1.005-88.
6.4. Вредно действующие вещества подлежат
сбору и утилизации в соответствии с установленными правилами.
6.5. Дополнительных требований по
экологической безопасности не предъявляется.
7.
Требования к квалификации операторов
К выполнению измерений и обработке их
результатов допускаются лица со средним профессиональным образованием
или без профессионального образования, но имеющие стаж работы в
лаборатории не менее года, освоившие методику.
8.
Условия выполнения измерений
При выполнении измерений в лаборатории
должны быть соблюдены следующие условия:
температура окружающего воздуха (22 ± 5)
°C;
атмосферное давление от 84,0 до 106,7 кПа
(от 630 до 800 мм рт. ст.);
влажность воздуха не более 80 % при 25 °C;
напряжение в сети (220 ± 10) В;
частота переменного тока в сети питания
(50 ± 1) Гц.
9.
Отбор и хранение проб
Отбор проб для определения фосфатов и
полифосфатов производится в соответствии с ГОСТ
17.1.5.05-85 и ГОСТ Р 51592-2000.
Оборудование для отбора проб должно соответствовать ГОСТ
17.1.5.04-81 и ГОСТ Р 51592-2000. Пробы
помещают в стеклянную посуду, полиэтиленовая посуда допускается только при консервации
пробы замораживанием.
Вследствие биохимической неустойчивости
соединения фосфора следует определять как можно быстрее после отбора пробы.
Если анализ не может быть выполнен в течение 4 ч после отбора, пробу
консервируют, добавляя 2 — 4 см3 хлороформа на 1 дм3
воды, и хранят при температуре 3 — 5 °C не более 3 дней. Более
длительное хранение возможно при замораживании пробы. Следует иметь в виду, что
использование консервации не дает гарантии полной сохранности проб.
При определении растворенных форм фосфора
фильтрование проб осуществляют немедленно после отбора пробы.
10.
Подготовка к выполнению измерений
10.1.
Приготовление растворов и реактивов
10.1.1. Раствор серной кислоты, 34 %-ный
(по объему)
170 см3 концентрированной
серной кислоты осторожно при непрерывном перемешивании приливают к 370 см3
дистиллированной воды. После охлаждения раствор переносят в толстостенную
склянку.
10.1.2. Раствор серной кислоты, 2,5
моль/дм3
70 см3 серной кислоты
осторожно приливают к 440 см3 дистиллированной воды, непрерывно
перемешивая смесь. Раствор применяют после охлаждения.
10.1.3. Раствор молибдата аммония
20 г молибдата аммония (NH4)6Mo7O24 · 4H2O растворяют в 500 см3
теплой дистиллированной воды. Если соль не растворяется, оставляют раствор до
следующего дня. Если раствор остается мутным, его фильтруют через бумажный
обеззоленный фильтр «белая лента». Хранят раствор в темной склянке не более
месяца.
10.1.4. Раствор аскорбиновой кислоты
1,76 г аскорбиновой кислоты растворяют в
100 см3 дистиллированной воды. Используют раствор в день
приготовления, либо хранят в холодильнике не более 5 дней.
10.1.5. Раствор антимонилтартрата калия
0,274 г антимонилтартрата калия K(SbO)C4H4O6 · 1/2Н2O растворяют в
100 см3 дистиллированной воды. Раствор хранят в темной склянке до
появления белого хлопьевидного осадка.
10.1.6. Смешанный реактив
125 см3 раствора серной
кислоты, 2,5 моль/дм3, смешивают с 37,5 см3 раствора
молибдата аммония, добавляют 75 см3 раствора аскорбиновой кислоты и
затем приливают 12,5 см3 раствора антимонилтартрата калия.
Полученную смесь тщательно перемешивают. Реактив можно хранить не более 24 ч.
10.1.7. Раствор для
компенсации собственной оптической плотности воды, обусловленной цветностью или
мутностью
Смешивают 42 см3 раствора
серной кислоты, 2,5 моль/дм3, 17 см3 дистиллированной
воды и 25 см3 раствора аскорбиновой кислоты. Полученную смесь
тщательно перемешивают. Раствор хранят не более 24 ч.
10.1.8. Раствор тиосульфата натрия, 12
г/дм3
1,2 г тиосульфата натрия растворяют в 100
см3 дистиллированной воды. Хранят раствор в темной склянке не более
3 мес.
10.1.9. Раствор гидроксида натрия, 10
%-ный
25 г гидроксида натрия растворяют в 225
см3 дистиллированной воды. Хранят в полиэтиленовой посуде с плотно завинчивающейся
пробкой.
10.1.10. Раствор фенолфталеина, 1 %-ный
0,4 г фенолфталеина растворяют в 50 см3
этилового спирта. Хранят в темной плотно закрытой склянке.
10.1.11. Раствор соляной кислоты, 5 %-ный
К 360 см3 дистиллированной
воды приливают 50 см3 концентрированной соляной кислоты и
перемешивают.
10.2. Приготовление градуировочных растворов
10.2.1. Градуировочные растворы готовят
из стандартного образца (ГСО) с массовой концентрацией ортофосфатов 0,500 мг/см3,
что в пересчете на фосфор составляет 0,1631 мг/см3.
Вскрывают ампулу и ее содержимое
переносят в сухую чистую пробирку. Для приготовления градуировочного раствора №
1 отбирают 4,90 см3 образца с помощью чистой сухой градуированной
пипетки вместимостью 5 см3 и переносят в мерную колбу вместимостью
100 см3. Доводят объем в колбе до метки свежеперегнанной
дистиллированной водой и перемешивают. Массовая концентрация фосфора в
градуировочном растворе № 1 составит 7,99 мг/дм3 (если концентрация
фосфат-ионов в ГСО не равна точно 0,500 мг/см3, рассчитывают
массовую концентрацию фосфора в градуировочном растворе № 1 в соответствии с
концентрацией конкретного образца). Раствор хранят в плотно закрытой склянке в
холодильнике не более 2-х недель.
Для приготовления градуировочного
раствора № 2 пипеткой с одной отметкой отбирают 25 см3
градуировочного раствора № 1, помещают его в мерную колбу вместимостью 200 см3
и доводят до метки дистиллированной водой. Массовая концентрация фосфора в
градуировочном растворе № 2 составит 1,00 мг/дм3. Раствор хранению
не подлежит.
10.2.2. При отсутствии ГСО допускается
использовать аттестованный раствор, приготовленный из дигидрофосфата калия.
Методика приготовления аттестованного раствора приведена в приложении А.
10.3. Установление
градуировочной зависимости
Для приготовления образцов для
градуировки в мерные колбы вместимостью 50 см3 градуированными
пипетками вместимостью 1, 5 и 10 см3 вносят 0; 0,5; 1,0; 2,0; 3,0;
4,0; 6,0; 8,0; 10,0 см3 градуировочного раствора № 2 с массовой
концентрацией фосфора фосфатов 1,00 мг/дм3, доводят объём растворов
до меток дистиллированной водой и тщательно перемешивают. Массовые концентрации
фосфора в полученных образцах равны соответственно 0; 0,010; 0,020; 0,040;
0,060; 0,080; 0,120; 0,160; 0,200 мг/дм3. Содержимое каждой колбы
полностью переносят в сухие конические или плоскодонные колбы вместимостью 100
см3 и далее выполняют определение в соответствии с 10.1.
Значение оптической плотности холостого опыта (раствора, не содержащего
фосфатов) вычитают из оптической плотности растворов, содержащих фосфаты.
Градуировочную зависимость оптической
плотности от массовой концентрации фосфора фосфатов рассчитывают методом
наименьших квадратов.
Градуировочную зависимость устанавливают
один раз в год, а также при замене измерительного прибора.
10.4. Контроль стабильности градуировочной
характеристики
10.4.1. Контроль стабильности
градуировочной характеристики проводят при приготовлении нового раствора
молибдата аммония. Средствами контроля являются образцы, используемые для
установления градуировочной зависимости по 10.3 (не менее 3 образцов).
Градуировочная характеристика считается стабильной при выполнении следующих
условий:
|X — C| £ sR, (1)
где X — результат контрольного измерения массовой
концентрации фосфора в образце, мг/дм3;
С — приписанное значение массовой
концентрации фосфора в образце, мг/дм3;
sr
— показатель воспроизводимости для
концентрации С, мг/дм3 (таблица 2).
Если условие стабильности не выполняется
для одного образца для градуировки, необходимо выполнить повторное измерение
этого образца для исключения результата, содержащего грубую погрешность. При
повторном невыполнении условия, выясняют причины нестабильности, устраняют их и
повторяют измерение с использованием других образцов, предусмотренных
методикой. Если градуировочная характеристика вновь не будет удовлетворять условию
(1),
устанавливают новую градуировочную зависимость.
10.4.2. При выполнении условия (1)
учитывают знак разности между измеренными и приписанными значениями массовой
концентрации фосфора в образцах. Эта разность должна иметь как положительное,
так и отрицательное значение, если же все значения имеют один знак, это говорит
о наличии систематического отклонения. В таком случае требуется установить
новую.
10.5. Подготовка посуды для определения фосфора
Посуду, используемую для определения
соединений фосфора, периодически обрабатывают горячим 5 %-ным раствором соляной
кислоты, после чего посуду тщательно промывают дистиллированной водой. Новую
посуду или посуду после анализа сильно загрязненных проб заливают на несколько
часов концентрированной серной кислотой, затем промывают водой. Синий налет на
стенках колб можно устранить промыванием 10 %-ным раствором щелочи.
Использовать посуду для других
определений не рекомендуется.
11. Выполнение измерений
11.1.
Выполнение измерений массовой концентрации фосфора фосфатов при отсутствии
мешающих влияний
Отмеривают мерным цилиндром вместимостью
50 см3 две аликвоты отфильтрованной анализируемой воды объемом 50 см3
и помещают в две сухие конические или плоскодонные колбы вместимостью 100 см3,
добавляют в каждую 10 см3 смешанного реактива и содержимое колб
хорошо перемешивают. Через 10 — 15 мин измеряют оптическую плотность раствора
на спектрофотометре или фотометре с непрерывной разверткой спектра при длине
волны 882 нм (на фотометре, снабженном светофильтрами — при 670 — 750 нм) в
кювете с толщиной слоя 5 см относительно дистиллированной воды.
Одновременно выполняют два параллельных
измерения оптической плотности холостых проб, в качестве которых используют 50
см3 дистиллированной воды.
Если оптическая плотность пробы выше
таковой для последней точки градуировочной зависимости, повторяют определение,
предварительно разбавив исходную пробу воды дистиллированной водой. Для этого
отбирают пипеткой такой объем анализируемой воды, чтобы при разбавлении в
мерной колбе вместимостью 50 см3 полученная концентрация фосфора
находилась в пределах от 0,1 до 0,2 мг/дм3.
11.2. Устранение мешающих
влияний
11.2.1. Если проба воды интенсивно
окрашена или слегка мутная, следует отдельно измерить оптическую плотность
пробы, к которой вместо смешанного реактива добавлено 10 см3
раствора для компенсации собственной оптической плотности воды (10.1.7).
В том случае, когда пробу перед определением фосфатов разбавляли, собственную
оптическую плотность следует учитывать также для воды, разбавленной в той же
пропорции.
11.2.2. Для устранения
влияния сероводорода и сульфидов при содержании их более 3 мг/дм3, в
пробу (объемом примерно 200 см3) добавляют несколько миллиграммов
кристаллического перманганата калия и перемешивают 1 — 2 мин. Раствор при этом
должен остаться слабо-розовым, если же он обесцветился, следует добавить ещё
немного перманганата. После этого избыток перманганата восстанавливают,
добавляя по каплям до обесцвечивания раствор для компенсации собственной
оптической плотности воды (10.1.7).
Если при этом выпадает осадок, раствор фильтруют через бумажный обеззоленный
фильтр «белая лента», предварительно промытый горячей дистиллированной водой.
Первую порцию фильтрата отбрасывают, из оставшейся отбирают 50 см3
пробы в колбу и добавляют смешанный реактив.
11.2.3. Для устранения мешающего влияния
мышьяка (V) при концентрации последнего более 50 мкг/дм3,
его восстанавливают, добавляя к 50 см3 пробы 1 см3
раствора тиосульфата натрия, выдерживают 10 мин, затем добавляют смешанный
реактив. Измерение оптической плотности следует в этом случае проводить через
10 — 11 мин после добавления смешанного реактива (не позже!!!).
11.2.4. Влияние повышенной концентрации
нитритов устраняют добавлением к пробе нескольких кристалликов сульфаминовой
кислоты.
11.2.5. Влияние хрома (VI)
при концентрации более 2 мг/дм3 устраняют, добавляя 10 капель
раствора для компенсации собственной оптической плотности воды на 50 см3
пробы и выдерживая 5 мин, после чего добавляют смешанный реактив. Если к пробе
добавляли тиосульфат натрия, то проводить дополнительно устранение влияния хромa (VI)
не следует.
11.2.6. Мешающее
влияние на определение фосфатов оказывает кремний при концентрации более 200
мг/дм3, маловероятной для поверхностных или очищенных сточных вод.
11.2.7. При достаточно высоком содержании
фосфатов мешающее влияние перечисленных веществ можно также устранить
разбавлением пробы в такой пропорции, при которой концентрации мешающих веществ
станут ниже указанных в 11.2.2 — 11.2.6.
11.3. Выполнение измерений массовой концентрации
фосфора минерального (суммы фосфатов и полифосфатов)
Для определения растворенного фосфора
минерального в термостойкую коническую или плоскодонную колбу вместимостью 250
см3 отбирают 100 см3 отфильтрованной анализируемой воды,
содержащей не более 0,020 мг фосфора (или меньший объем, доведенный до 100 см3
дистиллированной водой), прибавляют 2 см3 34 %-ного раствора серной
кислоты. Колбу накрывают часовым стеклом или лабораторной воронкой диаметром 56
мм и кипятят пробу на слабо нагретой электроплитке или песчаной бане 30 мин.
После охлаждения в пробу добавляют 1 — 2
капли раствора фенолфталеина и нейтрализуют 10 %-ным раствором гидроксида
натрия до появления бледно-розовой окраски индикатора. Следует избегать избытка
щелочи. Переносят пробу в мерную колбу вместимостью 100 см3, при
необходимости доводят до метки дистиллированной водой и перемешивают. Если в
пробе появился осадок, ее фильтруют через фильтр «белая лента», предварительно
промытый горячей дистиллированной водой. Первую порцию фильтрата отбрасывают,
из остальной отбирают 50 см3 пробы в коническую колбу вместимостью
100 см3 и определяют фосфаты, как описано в 11.1. Для каждой пробы
выполняют два параллельных определения. Холостой опыт выполняют аналогично,
используя 100 см3 дистиллированной воды.
При выполнении измерений массовой
концентрации фосфора минерального следует учитывать только возможное мешающее
влияние цветности и мышьяка (V). Устранение мешающего влияния производится, как
описано в 11.2.
При необходимости определения общего
содержания растворенных и взвешенных форм минерального фосфора для кипячения
отбирают аликвоту тщательно перемешанной нефильтрованной пробы. В этом случае
стадия фильтрования после нейтрализации пробы является обязательной.
12.
Вычисление и оформление результатов измерений
12.1. Вычисление
результатов измерения массовой концентрации фосфатов (в пересчете на фосфор)
12.1.1. Вычисляют значение оптической
плотности Ах, соответствующее концентрации фосфора фосфатов в пробе
воды по формуле
Ах = А — A1 — A2, (2)
где А — значение оптической плотности анализируемой
пробы, в которую добавлен смешанный реактив;
A1 —
значение собственной оптической плотности анализируемой воды (если ее измерение
не проводилось, A1 = 0);
А2 — среднее арифметическое
значение оптической плотности холостой пробы.
12.1.2. По градуировочной зависимости
находят массовую концентрацию фосфора, соответствующую рассчитанному значению
оптической плотности.
Массовую концентрацию фосфатов
(ортофосфатов) в пересчете на фосфор Хо.ф, мг/дм3, в
исходной пробе воды рассчитывают по формуле
(3)
где X — массовая концентрация фосфора, найденная по
градуировочной зависимости, мг/дм3;
V — объем аликвоты исходной пробы воды, отобранный для
анализа, см3.
Если необходимо произвести пересчет
фосфора в другие формы, следует пользоваться таблицей 3.
Таблица 3 —
Коэффициенты пересчета для различных соединений фосфора
|
1,00 мг |
P |
PO43- |
нро42- |
Н2РО4— |
Н3РО4 |
|
Р |
1,000 |
3,066 |
3,099 |
3,131 |
3,164 |
|
РО43- |
0,326 |
1,000 |
1,011 |
1,021 |
1,032 |
|
нро42- |
0,323 |
0,989 |
1,000 |
1,011 |
1,021 |
|
Н2РО4— |
0,319 |
0,979 |
0,990 |
1,000 |
1,010 |
|
Н3РО4 |
0,316 |
0,969 |
0,979 |
0,990 |
1,000 |
12.2. Вычисление результатов
измерения массовой концентрации фосфора минерального
Массовую концентрацию фосфора
минерального (суммы орто- и полифосфатов в пересчете на фосфор) Хф.м,
мг/дм3, в анализируемой пробе воды рассчитывают по формуле
(4)
где X1 —
массовая концентрация фосфора в пробе после кипячения, найденная по
градуировочной зависимости, мг/дм3;
V — объем аликвоты исходной пробы воды, отобранный для
анализа, см3.
12.3. Расчет массовой концентрации фосфора
полифосфатов
Массовую концентрацию полифосфатов в
пересчете на фосфор Хп.ф, мг/дм3, в анализируемой пробе
воды рассчитывают по формуле
Xп.ф = Хф.м — Хо.ф, (5)
12.4. Результат измерений массовой
концентрации фосфора минерального, фосфора ортофосфатов и полифосфатов в
документах, предусматривающих его использование, представляют в виде
мг/дм3
(Р = 0,95), (6)
где —
среднее арифметическое значение двух результатов, разность между которыми не
превышает предела повторяемости r (2,77sr). Значения sr приведены
в таблице 2.
При превышении предела повторяемости следует поступать в соответствии с 12.2
± D — границы
характеристики погрешности измерений данной массовой концентрации фосфора
ортофосфатов и фосфора минерального, мг/дм3 (таблица 2).
Погрешность расчета массовой концентрации
фосфора полифосфатов Dп.ф, мг/дм3,
вычисляют по формуле
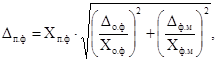
где Dо.ф — значение характеристики погрешности,
соответствующее массовой концентрации фосфора ортофосфатов Хо.ф,
мг/дм3;
Dф.м —
значение характеристики погрешности, соответствующее массовой концентрации
фосфора минерального Хф.м, мг/дм3.
Численные значения результата измерений
должны оканчиваться цифрой того же разряда, что и значения характеристики
погрешности.
12.5. Допустимо представлять
результат в виде
(Р
= 0,95) при условии Dл < D, (8)
где ± Dл — границы характеристики погрешности результатов
измерений, установленные при реализации методики в лаборатории и обеспечиваемые
контролем стабильности результатов измерений, мг/дм3.
Примечание — Допустимо характеристику
погрешности результатов измерений при внедрении методики в лаборатории
устанавливать на основе выражения Dл
= 0,84 · D с последующим уточнением по
мере накопления информации в процессе контроля стабильности результатов
измерений.
12.4. Результаты измерения оформляют
протоколом или записью в журнале, по формам, приведенным в Руководстве по
качеству лаборатории.
13. Контроль
качества результатов измерений при реализации методики в лаборатории
13.1. Общие
положения
13.1.1. Контроль качества результатов
измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль исполнителем
процедуры выполнения измерений (на основе оценки повторяемости и погрешности
при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов
измерений (на основе контроля стабильности среднеквадратического отклонения
повторяемости, внутрилабораторной прецизионности, погрешности).
13.1.2. Периодичность оперативного
контроля исполнителем процедуры выполнения измерений, а также реализуемые
процедуры контроля стабильности результатов выполнения измерений
регламентируются в Руководстве по качеству лаборатории.
13.2. Алгоритм оперативного контроля повторяемости
13.2.1. Оперативный контроль
повторяемости осуществляют для каждого из результатов измерений, полученных в
соответствии с методикой. Для этого отобранную пробу воды делят на две части, и
выполняют анализ в соответствии с разделом 11.
13.2.2. Результат контрольной процедуры rк, мг/дм3, рассчитывают по формуле
rк = |Х1 — Х2|, (9)
где Х1, Х2 — результаты
контрольных измерений массовой концентрации фосфора ортофосфатов и фосфора
минерального, мг/дм3.
13.2.3. Предел повторяемости rп, мг/дм3, рассчитывают по формуле
rп = 2,77 · sr, (10)
где sr — показатель повторяемости методики, мг/дм3
(таблица 2).
13.2.4. Результат контрольной процедуры
должен удовлетворять условию
rк £ rп. (11)
13.2.5. При несоблюдении условия (11)
выполняют еще два измерения и сравнивают разницу между максимальным и
минимальным результатами с нормативом контроля равным 3,6 · sr. В случае повторного
превышения предела повторяемости, поступают в соответствии с разделом 5 ГОСТ
Р ИСО 5725-6-2002.
13.3. Алгоритм оперативного контроля процедуры
выполнения измерений с использованием метода добавок
13.3.1. Контроль исполнителем процедуры
выполнения измерений проводят путем сравнения результатов отдельно взятой
контрольной процедуры Кк с нормативом контроля К.
13.3.2. Результат контрольной процедуры Кк,
мг/дм3, рассчитывают по формуле
(12)
где —
результат контрольного измерения массовой концентрации определяемой формы
фосфора в пробе с известной добавкой, мг/дм3;
— результат контрольного измерения массовой
концентрации определяемой формы фосфора в рабочей пробе, мг/дм3;
С — величина добавки, мг/дм3.
13.3.3. Норматив контроля погрешности К,
мг/дм3, рассчитывают по формуле
(13)
где —
значения характеристики погрешности результатов измерений установленные в
лаборатории при реализации методики, соответствующие массовой концентрации
определяемой формы фосфора в пробе с добавкой, мг/дм3;
DлХ —
значения характеристики погрешности результатов измерений, установленные в
лаборатории при реализации методики, соответствующие массовой концентрации
определяемой формы фосфора в рабочей пробе, мг/дм3.
Примечание — Допустимо для расчета
норматива контроля использовать значения характеристик погрешности, полученные
расчетным путем по формулам DлХ
= 0,84 · и
DлХ = 0,84 · DХ.
13.3.4. Если результат контрольной
процедуры удовлетворяет условию
|Кк| £ К, (14)
процедуру признают удовлетворительной.
При невыполнении условия (14)
контрольную процедуру повторяют. При повторном невыполнении условия (14),
выясняют причины, приводящие к неудовлетворительным результатам, и принимают
меры по их устранению.
14.
Проверка приемлемости результатов, полученных в условиях воспроизводимости
Расхождение между результатами измерений,
полученными в двух лабораториях, не должно превышать предела воспроизводимости.
При выполнении этого условия приемлемы оба результата измерений и в качестве
окончательного может быть использовано их общее среднее значение. Значение
предела воспроизводимости рассчитывают по формуле
R =
2,77 · sR. (15)
При превышении предела воспроизводимости
могут быть использованы методы оценки приемлемости результатов измерений
согласно разделу 5 ГОСТ
Р ИСО 5725-6-2002 или МИ 2881-2004.
Примечание —
Проверка приемлемости проводится при необходимости сравнения результатов
измерений, полученных двумя лабораториями
Приложение А
(рекомендуемое)
Методика
приготовления аттестованных растворов дигидрофосфата калия для установления градуировочных
характеристик приборов и контроля точности измерений массовой концентрации
фосфора орто- и полифосфатов фотометрическим методом АР1-Р, АР2-Р, АР3-Р
А.1. Назначение и
область применения
Настоящая методика регламентирует
процедуру приготовления аттестованных растворов дигидрофосфата калия,
предназначенных для установления градуировочных зависимостей и контроля
точности результатов измерений массовой концентрации орто- и полифосфатов в
природных и очищенных сточных водах фотометрическим методом.
А.2 Метрологические характеристики
Метрологические характеристики
аттестованных растворов приведены в таблице А1.
Таблица А1 —
Метрологические характеристики аттестованных растворов дигидрофосфата калия
|
Характеристика |
Шифр |
||
|
АР1-Р |
АР2-Р |
АР3-Р |
|
|
Аттестованное |
100,0 |
10,00 |
1,000 |
|
Предел |
0,52 |
0,07 |
0,007 |
А.3. Средства измерений, вспомогательные устройства,
реактивы
А.3.1. Весы аналитические не ниже 2
класса точности по ГОСТ 24104-2001.
А.3.2. Колбы мерные не ниже 2 класса
точности по ГОСТ
1770-74 вместимостью:
500
см3 — 1 шт.
100
см3 — 2 шт.
А.3.3. Пипетки с одной отметкой не ниже 2
класса точности по ГОСТ 29169-91
вместимостью: 10 см3 — 2 шт.
А.3.3. Пипетка градуированная не ниже 2
класса точности по ГОСТ
29227-91 вместимостью: 2 см3 — 1 шт.
А.3.4. Стаканчик для взвешивания (бюкс)
по ГОСТ
25336-82.
А.3.5. Воронка лабораторная по ГОСТ
25336-82 диаметром 56 мм.
А.3.6. Шпатель.
А.3.7. Промывалка.
А.3.8. Эксикатор по ГОСТ
25336-82 с безводным хлоридом кальция.
А.3.9. Шкаф сушильный общелабораторного
назначения.
А.3.10. Калий фосфорнокислый
однозамещенный (дигидрофосфат калия) по ГОСТ
4198-75, х. ч. с содержанием основного вещества КН2РО4
не менее 99,5 %.
А.3.11. Вода дистиллированная по ГОСТ 6709-72.
А.3.12. Хлороформ по ГОСТ
20015-88, очищенный.
А.4. Процедура приготовления аттестованных растворов
дигидрофосфата калия
А.4.1. Приготовление аттестованного
раствора AP1-P
На аналитических весах взвешивают в бюксе
с точностью до четвертого знака после запятой 0,220 г КН2РО4,
предварительно высушенного в сушильном шкафу при температуре 105 — 110 °C в течение 1 ч и охлажденного до комнатной температуры в эксикаторе над
хлоридом кальция. Количественно переносят навеску в мерную колбу вместимостью
500 см3, растворяют в свежеперегнанной дистиллированной воде,
добавляют 2 см3 хлороформа, доводят объём раствора до метки, и
перемешивают. Переносят раствор в темную склянку с плотно закрывающейся
пробкой.
Полученному раствору приписывают массовую
концентрацию фосфора 100 мг/дм3.
А.4.2. Приготовление аттестованного
раствора АР2-Р
Пипеткой с одной отметкой отбирают 10 см3
раствора АР1-Р, помещают его в мерную колбу вместимостью 100 см3,
доводят до метки свежеперегнанной дистиллированной водой и перемешивают.
Переносят раствор в темную склянку с плотно закрывающейся пробкой.
Полученному раствору приписывают массовую
концентрацию фосфора 10,0 мг/дм3.
А.4.3. Приготовление аттестованного
раствора АР3-Р
Пипеткой с одной отметкой отбирают 10 см3
раствора АР2-Р, помещают его в мерную колбу вместимостью 100 см3,
доводят до метки свежеперегнанной дистиллированной водой и перемешивают.
Переносят раствор в темную склянку с плотно закрывающейся пробкой.
Полученному раствору приписывают массовую
концентрацию фосфора 1,00 мг/дм3.
А.5. Расчет метрологических характеристик
аттестованных растворов
А.5.1. Аттестованное значение массовой
концентрации фосфора в растворе АР1-Р С1, мг/дм3,
рассчитывают по формуле
(A.1)
где m — масса навески дигидрофосфата калия, г;
30,97 — молярная масса фосфора, г/моль;
V — вместимость мерной колбы, см3;
136,09 — молярная масса дигидрофосфата
калия, г/моль.
А.5.2. Аттестованное значение массовой
концентрации фосфора в растворе АР2-Р С2 мг/дм3,
рассчитывают по формуле
(А.2)
А.5.3. Аттестованное значение массовой
концентрации фосфора в растворе АР3-Р С3, мг/дм3,
рассчитывают по формуле
(А.3)
А.5.4. Расчет предела возможных значений
погрешности приготовления аттестованного раствора AP1-P D1 с массовой концентрацией фосфора 100 мг/дм3
выполняют по формуле
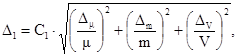
где С1 — приписанное раствору значение
массовой концентрации фосфора, мг/дм3;
µ — массовая доля основного вещества (КН2РО4)
в реактиве, приписанная реактиву квалификации х. ч.;
Dµ —
предельное значение возможного отклонения массовой доли основного вещества в
реактиве от приписанного значения µ;
m — масса навески дигидрофосфата калия, г;
Dm
— предельная возможная погрешность взвешивания, г;
V — вместимость мерной колбы, см3;
Dv
— предельное значение возможного отклонения вместимости мерной колбы от номинального
значения, см3.
Предел возможных значений погрешности
приготовления аттестованного раствора АР1-Р
А.5.5. Расчет предела возможных значений
погрешности приготовления аттестованных растворов АР2-Р (D2) и АР3-Р
(D3) с
массовой концентрацией фосфора 10,0 и 1,00 мг/дм3, соответственно,
выполняют по формуле
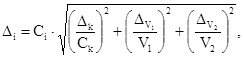
где Сi — приписанное растворам
АР2-Р и АР3-Р значение массовой концентрации фосфора, мг/дм3;
Сk
— значение массовой концентрации фосфора,
приписанное раствору, используемому для приготовления раствора АР2-Р или АР3-Р,
мг/дм3;
Dk
— предел возможного значения погрешности приготовления раствора с массовой
концентрацией фосфора Сk;
V1 —
вместимость мерной колбы, см3;
— предельное значение возможного отклонения
вместимости мерной колбы от номинального значения, см3.
V2 —
номинальный объем раствора, отбираемого пипеткой, см3;
— предельное значение возможного отклонения объема
раствора, отбираемого пипеткой, от номинального значения, см3.
Предел возможных значений погрешности
приготовления аттестованного раствора АР2-Р
Предел возможных значений погрешности
приготовления аттестованного раствора АР3-Р
А.6. Требования
безопасности
Необходимо соблюдать общие требования
техники безопасности при работе в химических лабораториях.
А.7. Требования
к квалификации операторов
Аттестованные растворы может готовить
инженер или лаборант со средним профессиональным образованием, прошедший
специальную подготовку и имеющий стаж работы в химической лаборатории не менее
6 мес.
А.8. Требования к маркировке
На склянки с аттестованными растворами
должны быть наклеены этикетки с указанием шифра раствора, массовой концентрации
фосфора, погрешности ее установления и даты приготовления.
А.9. Условия хранения
Аттестованный раствор АР1-Р хранят не
более 3 мес. при температуре от 4 до 8 °C. Аттестованный раствор АР2-Р хранят
не более 2-х недель при температуре от 4 до 8 °C. Аттестованный раствор АР3-Р
хранению не подлежит.
Федеральная служба по
гидрометеорологии и мониторингу окружающей среды
ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ «ГИДРОХИМИЧЕСКИЙ ИНСТИТУТ»
|
344090, г. Ростов-на-Дону пр. Стачки, |
Факс: (8632) 22-44-70 Телефон (8632) 22-66-68 E-mail ghi@aaanet.ru |
СВИДЕТЕЛЬСТВО №
33.24-2005
об аттестации методики выполнения измерений
Методика выполнения измерений массовой
концентрации фосфатов и полифосфатов в водах фотометрическим методом, разработанная
ГУ «Гидрохимический институт» (ГУ ГХИ) и регламентированная PД 52.24.382-2006 аттестована
в соответствии с ГОСТ Р 8.563-96 с изменениями
2002 г.
Аттестация осуществлена по результатам экспериментальных
исследований
В результате аттестации МВИ установлено:
1. МВИ соответствует предъявляемым к ней
метрологическим требованиям и обладает следующими основными метрологическими
характеристиками:
Диапазон измерений, значения характеристик погрешности и ее
составляющих (Р = 0,95)
|
Диапазон |
Показатель |
Показатель sR, |
Показатель |
Показатель |
|
Фосфаты |
||||
|
От 0,010 до |
0,001 |
0,001 |
0,026 |
0,002 |
|
Фосфор |
||||
|
От 0,010 до |
0,058 |
0,001 |
0,068 |
0,002 |
|
Св. 0,125 до |
0,008 |
0,014 |
0,011 |
0,030 |
2. Диапазон измерений, значения пределов
повторяемости и воспроизводимости при доверительной вероятности Р = 0,95
|
Диапазон |
Предел |
Предел |
|
Фосфаты |
||
|
От 0,010 до |
0,003 |
0,003 |
|
Фосфор |
||
|
От 0,010 до |
0,16 |
0,003 |
|
Св. 0,125 до |
0,022 |
0,039 |
3. При реализации методики в
лаборатории обеспечивают:
— оперативный контроль исполнителем
процедуры выполнения измерений (на основе оценки повторяемости и погрешности
при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов
измерений (на основе контроля стабильности среднеквадратического отклонения
повторяемости, среднеквадратического отклонения внутрилабораторной
прецизионности, погрешности).
Периодичность оперативного контроля и
процедуры контроля стабильности результатов выполнения измерений регламентируют
в Руководстве по качеству лаборатории.
Дата выдачи
свидетельства 15 февраля 2005 г.
Главный метролог ГУ ГХИ _____________
А.А. Назарова
СОДЕРЖАНИЕ

Соединения фосфора попадают в природные воды в результате процессов жизнедеятельности и посмертного распада водных организмов, выветривания и растворения пород, содержащих фосфаты, обмена с донными осадками, поступления с поверхности водосбора, а также с бытовыми и промышленными сточными водами. Загрязнению природных вод фосфором способствуют широкое применение фосфорных удобрений, полифосфатов, содержащихся в моющих средствах, флотореагентов и др.
Фосфаты в воде могут присутствовать в виде различных ионов в зависимости от величины рН. В водах соединения фосфора, как минеральные, так и органические могут присутствовать в растворенном, коллоидном и взвешенном состоянии. Переход соединений фосфора из одной формы в другую осуществляется довольно легко, что создает сложности при определении тех или иных его форм. Обычно идентификация их осуществляется по процедуре, с помощью которой проводят химический анализ сточных вод . В том случае, когда анализируют фильтрованную пробу воды, говорят о растворенных формах, в противном случае — о суммарном содержании. Содержание взвешенных соединений фосфора находят по разности. Определение растворенных фосфатов (ортофосфатов) при анализе сточных вод осуществляется по реакции с молибдатом аммония и аскорбиновой кислотой с образованием молибденовой сини в исходной водной пробе, в то время как для определения полифосфатов в сточной воде требуется предварительно перевести их в фосфаты путем кислого гидролиза.
Для получения сравнимых результатов определения соединений фосфора и однозначной их интерпретации важно строгое соблюдение условий предварительной обработки проб и процедуры анализа сточных вод, в частности при определении растворенных форм проба должна быть отфильтрована как можно быстрее после отбора через фильтр с размером пор 0,45 мкм.
Концентрация фосфатов в незагрязненных природных водах может составлять тысячные, редко сотые доли мг/дм3. Повышение их содержания свидетельствует о загрязнении водного объекта. Концентрация фосфатов в воде подвержена сезонным колебаниям, поскольку она зависит от интенсивности процессов фотосинтеза и биохимического разложения органических веществ Минимальные концентрации соединений фосфора наблюдаются весной и летом, максимальные — осенью и зимой
Уменьшение содержания фосфатов в воде связано с потреблением его водными организмами, а также переходом в донные отложения при образовании нерастворимых фосфатов
Предельно допустимая концентрация фосфатов (в пересчете на фосфор) в воде водных объектов рыбохозяйственного назначения составляет
— для олиготрофных водных объектов 0,05 мг/дм;
— для мезотрофных — 0,15 мг/дм;
— для эвтрофных — 0,20 мг/дм»
Предельно допустимая концентрация фосфатов для водных объектов хозяйственно-питьевого и культурно-бытового назначения не установлена, в них нормируется только содержание полифосфатов Предельно допустимая концентрация полифосфатов составляет 3,5 мг/дм3 в пересчете на фосфат-ион и 1,1 мг/дм3 в пересчете на фосфор.
РД 52.24.382-2006 Массовая концентрация фосфатов и полифосфатов в водах. Методика выполнения измерений фотометрическим методом.
В лаборатории «Экологический мониторинг» вы можете заказать комплексный анализ питьевой воды, ливневых сточных вод и промышленных, хозбытовых стоков. Заказать анализ сточных вод, можно оставив заявку на sales@chemanalytica.ru, или воспользовавшись формой обратной связи.
- Анализ сточных вод
- Анализ ливневых сточных вод
- Анализ воды из родника
- Анализ воды из скважины
- Анализ воды из колодца
- Анализ бутилированной воды
- Анализ дистиллированной воды
Если у Вас возникли вопросы, направляйте их к нам на почту по адресу sales@chemanalytica.ru или звоните по телефонам
8-800-600-62-40; 8(495)969-35-06.
Материал сайта www.chemanalytica.ru
Что такое фосфор ?
Фосфор (P) — многовалентный неметаллический химический элемент группы VA, № 15 Периодической системы. Его молярная масса 30,97. Известно двадцать три изотопа фосфора , но только один из них является стабильным.
Фосфор — элемент с высокой реакционной способностью. Он реагирует с кислородом, галогенами, серой и многими металлами. Из-за его высокой реакционной способности фосфор не может быть найден как свободный элемент на Земле.
Атом фосфора содержит пять валентных электронов на внешнем слое. В соединениях с металлами и водородом фосфор проявляет степень окисления –3, а при взаимодействии с более электроотрицательными элементами, такими как кислород, фтор и т. Д., Степень окисления составляет +3 или +5.
Для фосфора характерна аллотропия. Он образует несколько простых веществ, различающихся по структуре и свойствам. Наиболее распространены белый и красный фосфор.
Белый фосфор состоит из молекул P 4 . Это белое воскообразное вещество с желтым оттенком, светящееся в темноте. Белый фосфор не растворяется в воде, но растворяется в сероуглероде. Это ядовито. Он очень реактивен и может самовоспламеняться.
Красный фосфор имеет кристаллическую атомную решетку. Не растворяется в воде и сероуглероде. Он не ядовит и имеет более низкую активность по сравнению с белым фосфором.
Аллотропные модификации фосфора взаимопревращаемы.
Что такое фосфат ?
Фосфат — это химическое производное фосфорной кислоты, содержащее фосфат- ион (PO 3 — 4 ). Фосфат-ион может образовывать множество различных солей. Формально любая соль оксикислоты фосфора является фосфатом.
Ион фосфата представляет собой многоатомный ион с тетраэдрическим расположением атомов. Он состоит из одного атома фосфора, расположенного в центре и окруженного четырьмя атомами кислорода. Молярная масса фосфат-иона составляет 94,97 г / моль.
В зависимости от количества атомов фосфора фосфаты можно разделить на четыре основные группы: ортофосфаты, пирофосфаты, триполифосфаты и полифосфаты. Каждая из этих групп имеет свои специфические функциональные свойства.
Разница между фосфором и фосфатом
Определение
Фосфор: фосфор — это многовалентный неметаллический химический элемент группы VA.
Фосфат: Фосфат — это химическое производное фосфорной кислоты, содержащее фосфат-ион (PO 3 — 4 ). Формально любая соль оксикислоты фосфора является фосфатом.
Молярная масса
Фосфор: молярная масса фосфора составляет 30,97 г / моль.
Фосфат: молярная масса иона фосфата составляет 94,97 г / моль.
Химическая формула
Фосфор: символ фосфора — P.
Фосфат: химическая формула иона фосфата — PO 4.
Состав
Фосфор: фосфор образует несколько простых веществ, наиболее широко распространены белый фосфор, состоящий из молекул P 4 , и красный фосфор, который имеет кристаллическую атомную решетку.
Фосфат: ион фосфата представляет собой многоатомный ион с тетраэдрическим расположением атомов. Он состоит из одного атома фосфора, расположенного в центре и окруженного четырьмя атомами кислорода.
Степень окисления
Фосфор: в соединениях с металлами и водородом фосфор проявляет степень окисления –3, а при взаимодействии с более электроотрицательными элементами, такими как кислород, фтор и т. Д., Степень окисления составляет +3 или +5.
Фосфат: фосфат имеет степень окисления –3.
Формы / Типы
Фосфор: фосфор характеризуется аллотропией и образует несколько простых веществ, различающихся по структуре и свойствам. Наиболее распространены белый и красный фосфор.
Фосфат: в зависимости от количества атомов фосфора фосфаты бывают ортофосфатами, пирофосфатами, триполифосфатами и полифосфатами.
Фосфор против. Фосфат: сравнительная таблица
Резюме Phosphorus Vs. Фосфат :
- Фосфор — многовалентный неметаллический химический элемент группы VA.
- Фосфат — это химическое производное фосфорной кислоты, содержащее фосфат-ион (PO 3 — 4 ). Формально любая соль оксикислоты фосфора является фосфатом.
- Молярная масса фосфора составляет 30,97 г / моль. Молярная масса фосфат-иона составляет 94,97 г / моль.
- Символ фосфора — P. Химическая формула фосфат-иона — PO 4.
- Белый фосфор состоит из молекул P 4 , красный фосфор имеет кристаллическую атомную решетку. Фосфат-ион представляет собой многоатомный ион с тетраэдрическим расположением атомов, состоящий из одного атома фосфора, расположенного в центре и окруженного четырьмя атомами кислорода.
- Фосфор имеет степень окисления –3, +3 или +5. Фосфат имеет степень окисления –3.
- Фосфор образует несколько простых веществ, различающихся по структуре и свойствам, наиболее широко распространены белый и красный фосфор. В зависимости от числа атомов фосфора фосфаты бывают ортофосфатами, пирофосфатами, триполифосфатами и полифосфатами.
- Автор
- Недавние Посты
Эксперт по окружающей среде с докторской степенью ботаники в Институте исследований леса Болгарской академии наук.
Мариам имеет степень магистра экологии и доктора ботаники. В настоящее время она работает в Научно-исследовательском институте леса Болгарской академии наук. Мариам имеет более 10 лет профессионального опыта в области научных исследований и консультирования по вопросам окружающей среды. Она работала в некоммерческой, коммерческой и академической среде и консультировала бизнес-клиентов и компетентные органы. Ее основные профессиональные интересы лежат в области: научных исследований; написания веб-контента; консультирования по вопросам окружающей среды.
Цитируйте APA 7 Божилова Д. (5 июля 2019 г.). Разница между фосфором и фосфатом. Разница между похожими терминами и объектами. http://www.12vn.net/science/difference-between-phosphorus-and-phosphate/. ОМС 8 Божилова, доктор Мариам. «Разница между фосфором и фосфатом». Разница между похожими терминами и объектами, 5 июля 2019 г., http://www.12vn.net/science/difference-between-phosphorus-and-phosphate/.