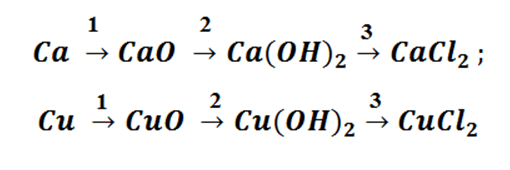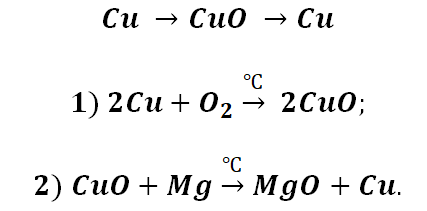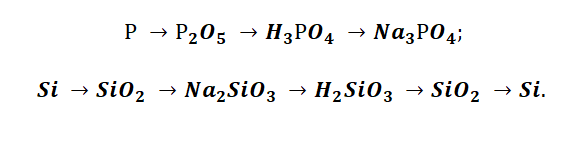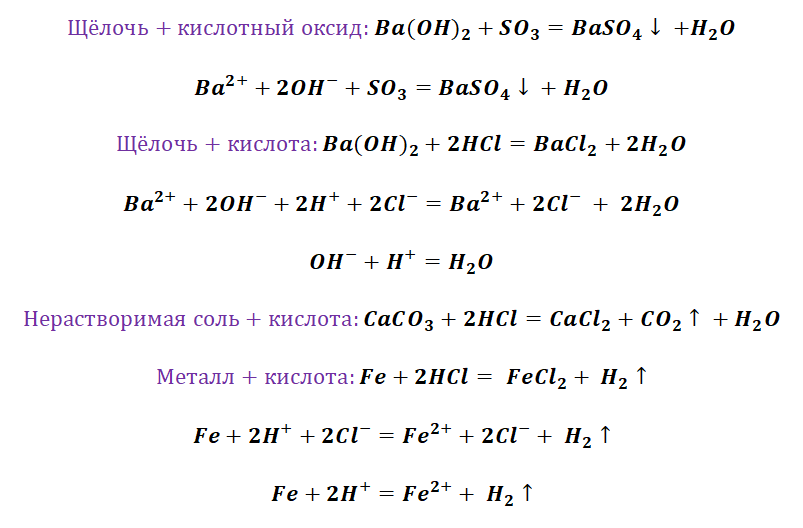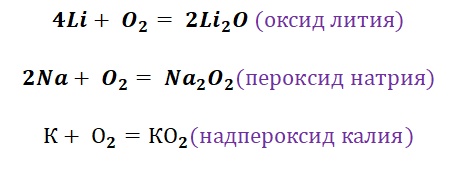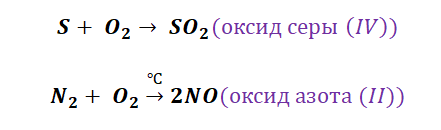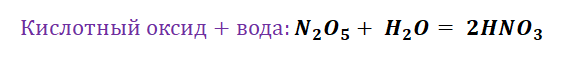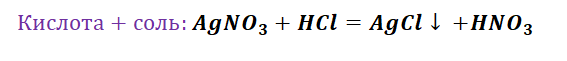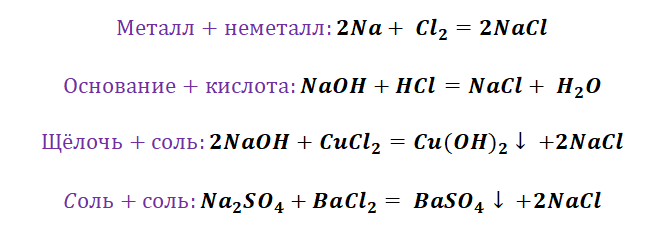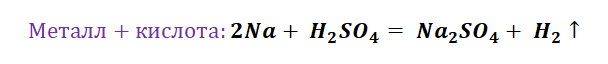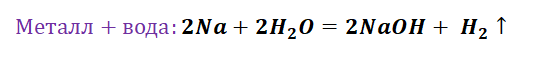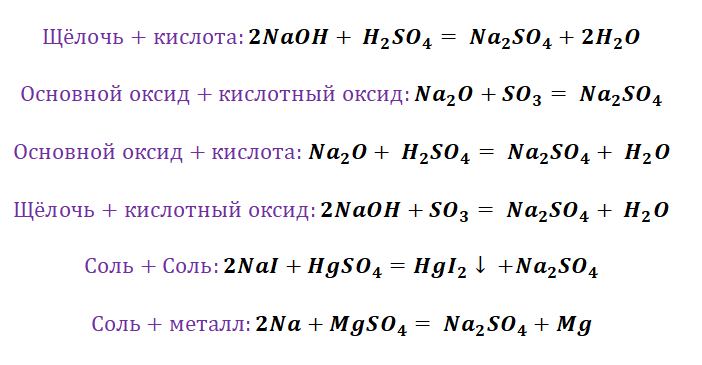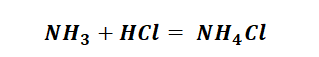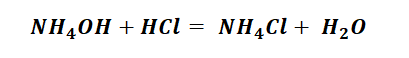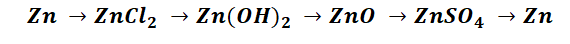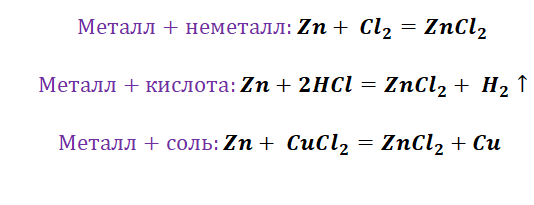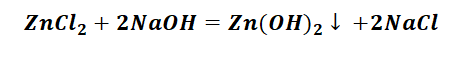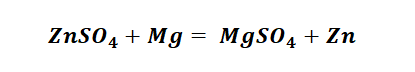План урока:
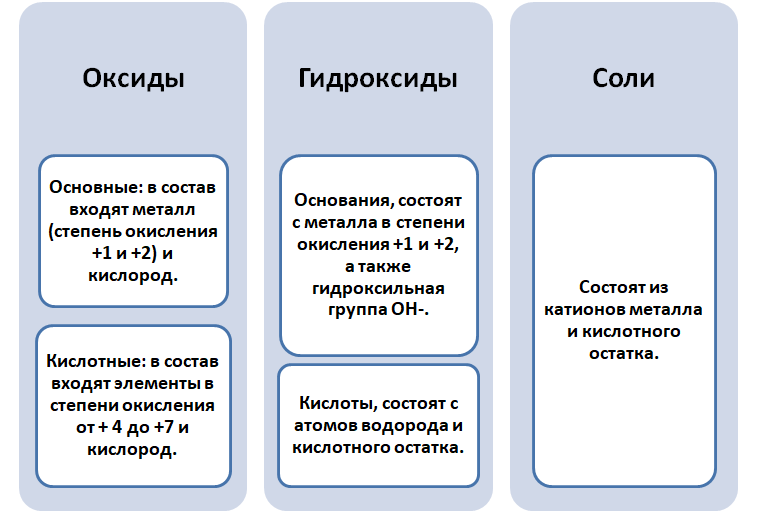
Почему связь между классами веществ считается генетической
Родственные связи между металлами и неметаллами
Взаимопревращения между классами веществ
Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
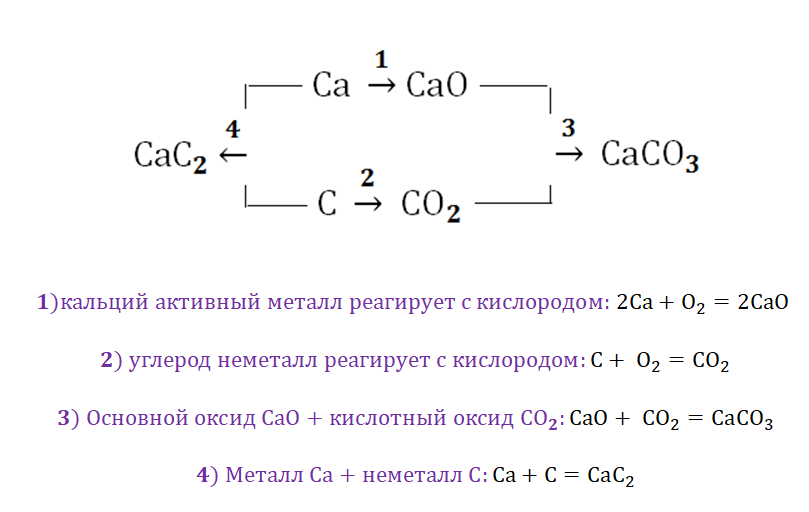
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
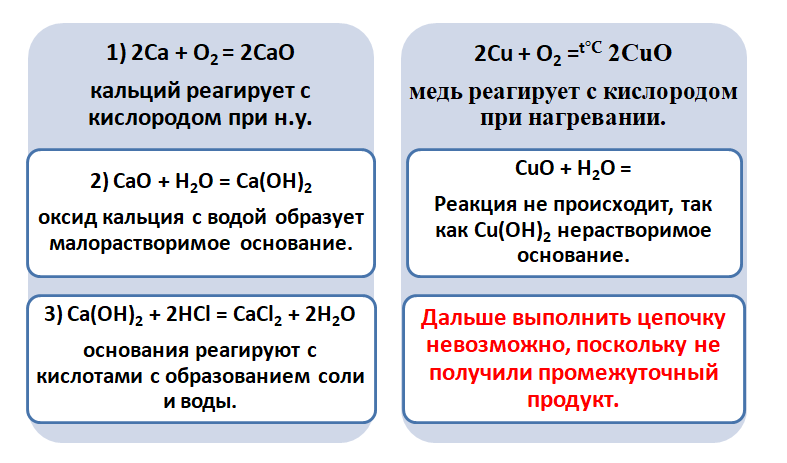
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
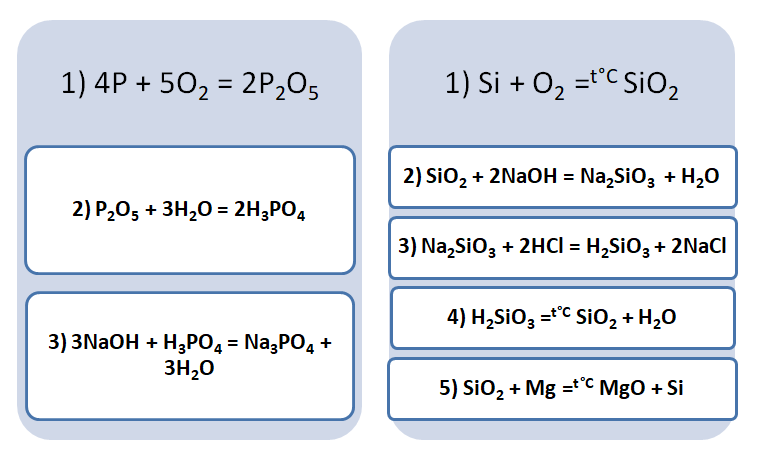
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
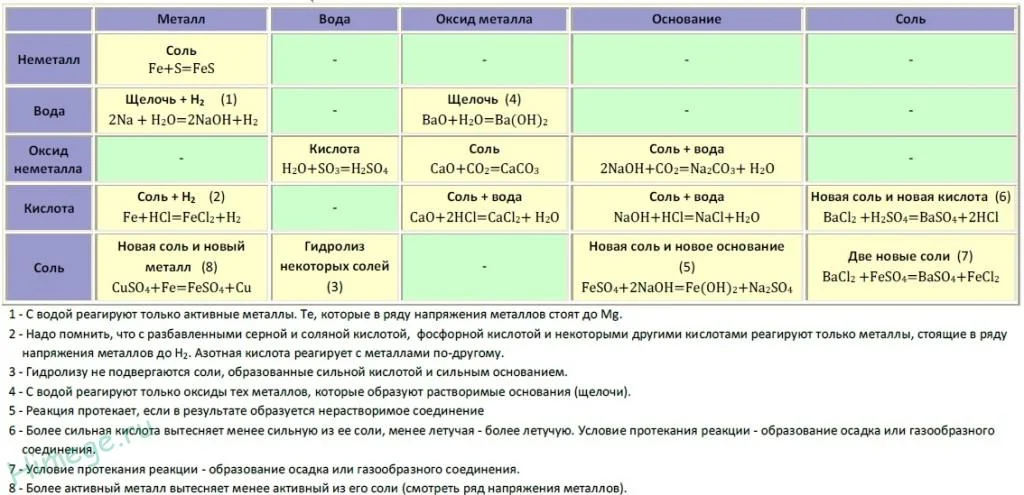
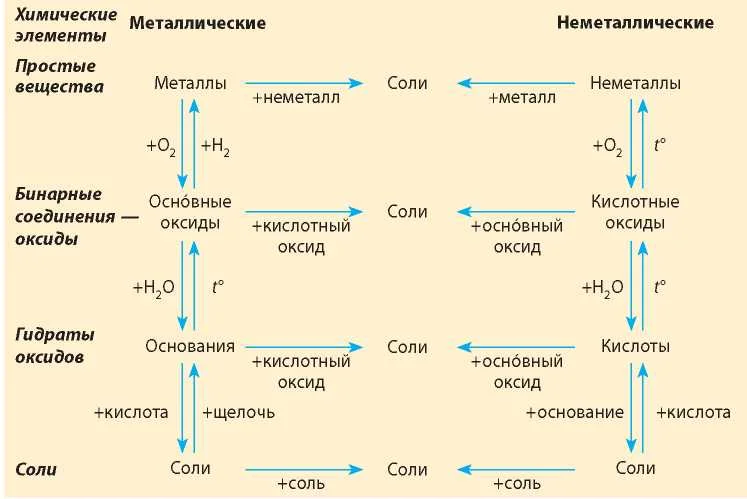
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Источник
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
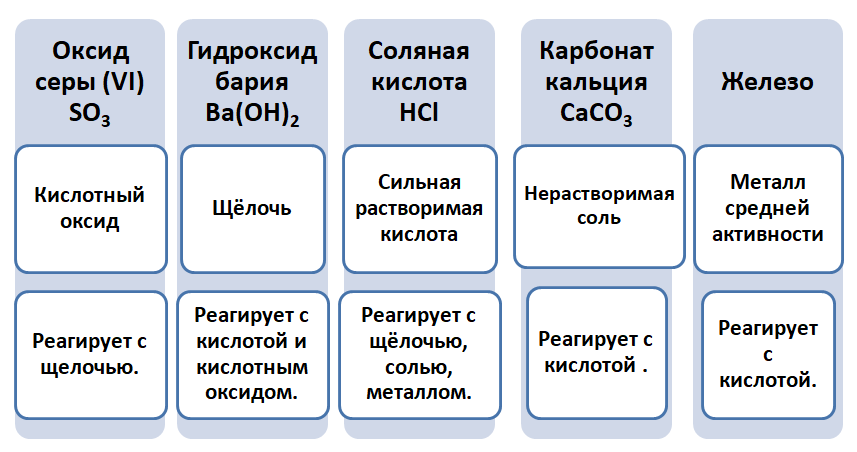
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Источник
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Пример 1.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Источник
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Генетические связи — это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
металл→основный оксид→щёлочь→соль
Например, K→K2O→KOH→KCl
2. Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
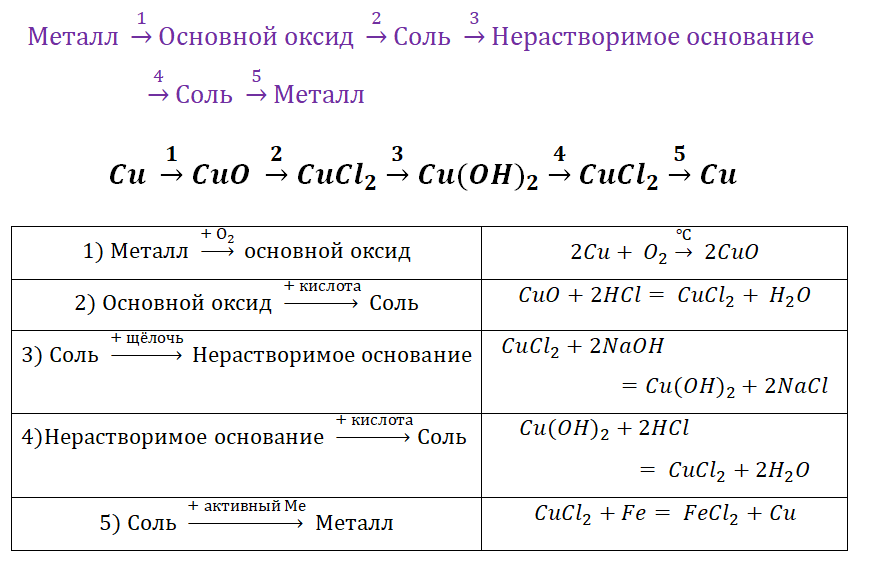
металл→основный оксид→соль→нерастворимое основание→основный оксид→металл
Например, Cu→CuO→CuCl2→Cu(OH)2→CuO→Cu
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде:
неметалл→кислотный оксид→растворимая кислота→соль
Например, P→P2O5→H3PO4→Na3PO4
2. Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:
неметалл→кислотный оксид→соль→кислота→кислотный оксид→неметалл
Например, Si→SiO2→Na2SiO3→H2SiO3→SiO2→Si
В настоящее время
известно более миллиона видов живых организмов и все они отличаются друг от
друга. Внутри одного вида не найти двух одинаковых особей. Мир неживой природы
также разнообразен. Например, все вы видели, как разнообразны минералы.
Но за этим внешним
разнообразием материи скрывается её внутренне единство. Это единство выражается
в том, что при множестве известных веществ, а их зарегистрировано около
двадцати миллионов, все они образованы ограниченной группой химических
элементов.
Внутреннее
единство можно проследить и в способности взаимного превращения одних
классов веществ в другие. Эта возможность взаимного превращения, а также
определённая обусловленность свойств веществ различных классов, образованных
одними и теми же химическими элементами, носит название генетической
связи.
Как же возникают
генетические связи? Рассмотрим пример превращения сульфата меди два в
сульфат натрия, затем в хлорид натрия и хлорида натрия в хлорид серебра
один.
Первое превращение
можно осуществить в реакции взаимодействия сульфата меди два с гидроксидом
натрия. Для получения хлорида натрия нужно к сульфату натрия добавить хлорид
бария. Для получения хлорида серебра один нужно к хлориду натрия добавить
нитрат серебра.
Однако этот ряд
нельзя назвать генетическим, хотя он и связан взаимностью превращений, но здесь
не все вещества образованы одним и тем же химическим элементом.
Рассмотрим ещё
один ряд превращений.
Фосфат натрия
затем получим сульфат натрия, из него хлорид натрия, а из хлорида натрия – нитрат
натрия.
Сульфат натрия
можно получить взаимодействием фосфата натрия и хлорида бария. Хлорид натрия
можно получить в результате взаимодействия сульфата натрия и хлорида бария.
Для получения нитрата натрия можно к хлориду натрия добавить нитрат серебра
один.
В этом ряду все
вещества связаны не только взаимностью превращений, но и единством
происхождения: все они содержат натрий. Однако этот ряд не
является генетическим, так как в нём нет признаков, которые связывают
вещества в генетическую связь, а именно того, что все вещества
генетического ряда должны относиться к различным классам.
Генетический ряд
всегда начинается с простого вещества, все вещества в этом ряду должны быть
связаны единством происхождения. Само слово «генэзис» в переводе с греческого
означает происхождение.
Этому требованию
отвечает ряд превращения натрия в гидроксид натрия, а затем в хлорид натрия.
Данный
генетический ряд является незаконченным.
Сначала нужно
осуществить реакцию взаимодействия натрия с водой, в результате образуется
гидроксид натрия. Для получения хлорида натрия нужно осуществить взаимодействие
гидроксида натрия с соляной кислотой.
Этот генетический
ряд можно сделать законченным, если из хлорида натрия получить натрий. Это
можно осуществить электролизом хлорида натрия. Таким образом, в генетических
рядах можно показать переход из простого вещества в сложное, а также и
возможность перехода сложного вещества в простое.
Таким образом, генетический
ряд – это ряд веществ, где представители различных классов содержат
один и тот же химический элемент, которые связаны взаимопревращениями и
отражают общность происхождения этих веществ.
Рассматривают
генетические ряды металлов, неметаллов и переходных элементов.
Характер
основателя ряда задаёт и характер соединений, образующий данных генетический
ряд.
Возьмём
генетический ряд металла. В этом ряду будут представлены основные оксиды,
основания и соли.
Рассмотрим
генетический ряд меди.
Этот ряд
начитается металлом, этому металлу соответствует основный оксид – оксид меди
два, затем идёт соль – хлорид меди два, из этой соли можно получить основание –
гидроксид меди два, из гидроксида можно получить снова оксид – оксид меди два,
а затем опять простое вещество – медь.
Этот генетический
ряд является законченным, так как демонстрирует способность
усложнения состава вещества, но и упрощение состава. Здесь вещества связаны
взаимными превращениями. Разберём, как можно осуществить эти превращения.
Оксид меди два
получают реакцией меди с кислородом. Хлорид меди два получают реакцией оксида
меди два с соляной кислотой. Для получения гидроксида меди два нужно к хлориду
меди два добавить щёлочь. При разложении гидроксида меди два образуется оксид
меди два и вода. При восстановлении оксида меди два водородом образуется медь и
вода.
2Cu + O2 = 2CuO
В генетическом
ряду неметалла будут кислотные оксиды, кислотные гидроксиды и соли. В
генетическом ряду неметаллов могут быть и несолеобразующие оксиды, которым не
соответствуют ни кислотные гидроксиды, ни соли.
Рассмотрим
генетический ряд серы.
Простому веществу
сере соответствует оксид серы четыре, этому оксиду соответствует кислотный
гидроксид – сернистая кислота, из сернистой кислоты нужно получить сульфит
натрия, из него следует получить оксид серы четыре, и наконец, простое вещество
– серу.
Как видно, в этом
ряду представлены неметаллы, кислотные оксиды, кислота и соль. Разберём, как
можно осуществить следующие превращения.
При горении серы
образуется оксид серы четыре. В реакции с водой этот оксид образует сернистую
кислоту. В реакции сернистой кислоты с гидроксидом натрия образуется сульфит
натрия.
В реакции
взаимодействия сульфита натрия с соляной кислотой образуется оксид серы четыре.
Сернистый газ в реакции с сероводородом образуется сера. По данной реакции
образуется вулканическая сера.
Генетический ряд
серы может быть более разнообразен и содержать серу в различной степени
окисления. Например сера, сероводород, оксид серы четыре, сернистая кислота,
сульфит калия, оксид серы четыре, оксид серы шесть, серная кислота, оксид серы
четыре и сера.
Рассмотрим, как
можно осуществить эти превращения. В реакции серы с водородом образуется
сероводород, при горении сероводорода образуется оксид серы четыре, в реакции
этого оксида с водой образуется сернистая кислота.
В реакции
сернистой кислоты с гидроксидом калия образуется сульфит калия. Если к этой
соли добавить серную кислоту, то получается оксид серы четыре. В реакции оксида
серы четыре с кислородом образуется оксид серы шесть, который в реакции с водой
образует серную кислоту. Для того чтобы получить оксид серы четыре нужно к меди
добавить концентрированной серной кислоты. В реакции сернистого газа с
сероводородом образуется сера.
Генетический ряд
переходных элементов может быть представлен амфотэрными оксидами и амфотэрными
гидроксидами.
Так, генетический
ряд цинка состоит из переходного металла, амфотэрного оксида – оксида цинка,
соли – сульфата цинка, амфотэрного гидроксида – гидроксида цинка, из которого
можно получить две соли: тэтра-гидроксо-цинкат-натрия и хлорид цинка. Из
хлорида цинка можно получить простое вещество – цинк.
Рассмотрим, как
получают эти соединения. В реакции цинка с кислородом получается оксид цинка, в
реакции оксида цинка с серной кислотой образуется сульфат цинка, в реакции
сульфата цинка с гидроксидом натрия образуется гидроксид цинка.
В реакции
гидроксида цинка с гидроксидом натрия получается тэтра-гидроксо-цинкат-натрия.
Хлорид цинка можно получить реакцией гидроксида цинка с соляной кислотой. При
взаимодействии хлорида цинка с алюминием можно получить цинк.
Генетические ряды
могут содержать и вещества, обладающие кислотными, основными и амфотэрными
свойствами.
Такие вещества содержит генетический ряд железа. Например, генетический ряд
железа содержит металлы, соли, основание, основный оксид, амфотэрный гидроксид
и амфотэрный оксид.
Рассмотрим, как
можно осуществить эти превращения. В реакции железа с соляной кислотой
образуется соль – хлорид железа два, при взаимодействии хлорида железа два с
гидроксидом натрия образуется основание – гидроксид железа два.
При разложении
гидроксида железа два образуется основный оксид – оксид железа два.
При восстановлении
водородом этого оксида образуется железо. В реакции железа с хлором образуется
соль – хлорид железа три. В реакции хлорида железа три с гидроксидом натрия
образуется амфотэрное основание – гидроксид железа три. При разложении этого
основания образуется амфотэрный оксид – оксид железа три. При восстановлении
оксида водородом образуется железо.
Генетический ряд
органических веществ состоит из соединений различных классов, содержащих
одинаковое число атомов углерода в молекуле. Эти вещества связаны взаимностью
превращения, иллюстрирующие усложнение или упрощение состава вещества.
Какие же
органические вещества связаны взаимностью превращений?
Из алканов
можно получить алкены реакцией дэгидрирования, и, наоборот, из алкенов
по реакции гидрирования можно получить алканы.
Их алкенов
по реакции дэгидрирования можно получить алкины, а из алкинов по
реакции гидрирования можно получить алкены.
Тримеризацией алкинов
можно получить арены, а их аренов по реакции гидрирования – циклоалканы.
Дэгидратацией спиртов
можно получить алкены, и наоборот, гидратацией алкенов получают спирты.
При окислении спиртов получают альдэгиды, а при восстановлении альдэгидов
– спирты. При окислении альдэгидов получаются карбоновые кислоты,
из карбоновых кислот можно получить аминокислоты, а из них – белки.
Рассмотрим
генетический ряд алкана, содержащего два атома углерода.
В этом ряду видно,
что из этана реакцией дэгидрирования можно получить этэн, из этэна
гидрированием – этан. Из этэна по реакции гидратации можно
получить этанол, а из него по реакции дэгидратации – этэн. При
окислении этанола получается этаналь, при восстановлении этаналя
– этанол. При окислении этаналя получается уксусная кислота,
из уксусной кислоты можно получить хлоруксусную кислоту, из неё можно
получить аминоуксусную кислоту, а из аминоуксусной кислоты – полипептид.
Так, при
дэгидрировании этана образуется этэн, в реакции гидратации этэна образуется
этанол.
При окислении
этанола оксидом меди два образуется этаналь, окислением этаналя аммиачным
раствором оксида серебра образуется уксусная кислота.
В реакции её с
хлором образуется хлоруксусная кислота.
При взаимодействии
хлоруксусной кислоты с аммиаком образуется аминоуксусная кислота.
В реакции поликондэнсации
аминоуксусной кислоты образуется полипептид.
Таким образом,
данный ряд содержит алкан, алкен, предельный одноатомный спирт, альдэгид,
карбоновую кислоту, аминокислоту.
В этой цепочке
полипептид не содержит тоже число атомов углерода, как остальные вещества, но
отражают принцип усложнения состава вещества. На ряду с усложнением, возможно и
упрощение состава, которое осуществляется реакциями разложения или окисления
сложных веществ.
Принцип усложнения
и упрощение состава непрерывно происходит в живой природе. Так, расщепление
сложных веществ происходит в желудочно-кишечном тракте животных. В клетках
непрерывно происходит синтез сложных веществ из простых.
Кроме того,
существует много возможностей перехода неорганических веществ в органические и
обратно.
Например: карбонат
кальция, оксид кальция, карбид кальция, ацэтилен, бензол, нитробензол, анилин.
Как же можно
осуществить эти превращения? При разложении карбоната кальция образуется оксид
кальция.
В реакции с
углеродом оксид кальция образует карбид кальция, который при взаимодействии с
водой образует ацэтилен.
Тримеризацией
ацэтилена образуется бензол. В реакции бензола с азотной кислотой образуется
нитробензол, при восстановлении водородом нитробензола образуется анилин.
Таким образом,
неорганические генетические ряды могут содержать металлы, неметаллы и
переходные элементы. В генетических рядах вещества связаны взаимопревращениями.
Органический генетический ряд содержит вещества различных классов, которые
содержат одинаковое число атомов углерода. В генетических рядах возможен
переход неорганических веществ в органические.
Из веществ одного класса можно получить вещества другого класса. Такую связь, отражающую происхождение веществ, называют генетической (от греч. «генезис» — происхождение). Рассмотрим сущность генетических связей между классами неорганических веществ.
В ходе химических реакций химический элемент не исчезает, атомы переходят из одного вещества в другое. Атомы химического элемента как бы передаются от простого вещества к более сложному, и наоборот. Таким образом, возникают так называемые генетические ряды, начинающиеся простым веществом – металлом или неметаллом – и заканчивающиеся солью.
Напомню вам, что в состав солей входят металлы и кислотные остатки. Итак, генетический ряд металла может выглядеть таким образом:
Из металла в результате реакции соединения с кислородом можно получить основный оксид, основный оксид при взаимодействии с водой дает основание (только, если это основание – щелочь), из основания в результате реакции обмена с кислотой, солью или кислотным оксидом можно получить соль.
Обратите внимание, такой генетический ряд подходит только для металлов, гидроксиды которых являются щелочами.
Запишем уравнения реакций, соответствующих превращениям лития в его генетическом ряду:
Li → Li2O → LiOH→ Li2SO4
Как вы знаете, металлы при взаимодействии с кислородом, как правило, образуют оксиды. При окислении кислородом воздуха литий образует оксид лития:
4Li + O2 = 2Li2O
Оксид лития, взаимодействуя с водой, образует гидроксид лития – растворимое в воде основание (щелочь):
Li2O + H2O = 2LiOH
Сульфат лития можно получить из лития несколькими способами, например, в результате реакции нейтрализации с серной кислотой:
2LiOH + H2SO4 = Li2SO4 + 2H2O
2. Генетический ряд неметалла
Составим теперь генетический ряд неметалла:
Неметалл образует кислотный оксид. Из кислотного оксида при реакции с водой образуется кислота. Из кислоты в результате взаимодействия с металлом, основанием, солью или основным оксидом можно получить соль.
В качестве примера рассмотрим последовательные превращения серы:
S → SO2 → H2SO3 → K2SO3
Для получения оксида серы(IV) нужно провести реакцию горения серы в кислороде:
S + O2 = SO2
При растворении оксида серы(IV) в воде образуется сернистая кислота:
SO2 + H2O = H2SO3
Сульфит калия из сернистой кислоты можно получить, например, в результате реакции с основным оксидом — оксидом калия:
K2O + H2SO3 = K2SO3 + H2O
Другой способ получения сульфита калия из сернистой кислоты – реакция нейтрализации с гидроксидом калия:
2KOH + H2SO3 = K2SO3 + 2H2O
3. Реакции между представителями двух генетических рядов
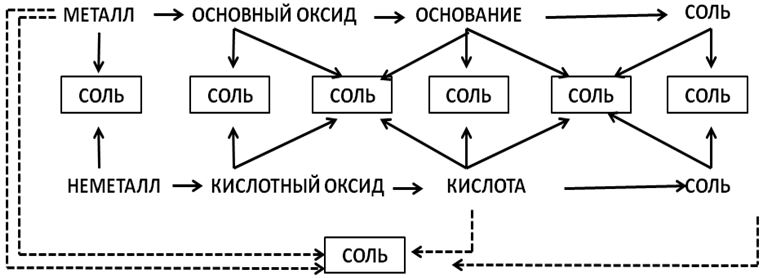
Генетическая связь между классами неорганических веществ приведена на Рис. 1.
Рис. 1. Генетическая связь между классами неорганических веществ
В приведенной схеме пары стрелок, направленных навстречу друг другу, показывают, какие реагенты нужно взять, чтобы получить соль.
Например, соль образуется при взаимодействии металла и неметалла, основного оксида и кислоты, металла и кислоты и т.д.
Запомним, что характерными являются реакции между представителями разных генетических рядов. Вещества из одного генетического ряда, как правило, не вступают во взаимодействия.