Сначала короткий ликбез для тех, кто еще не знает или уже забыл, что означают некоторые слова из трех букв: ДНК и ген.
Строение и форма организмов, в том числе человека, определяются белками, структура которых зашифрована в дезоксирибонуклеиновой кислоте (ДНК). Она представляет собой спираль из двух переплетенных цепей. Каждая цепь состоит из четырех видов звеньев-нуклеотидов, обозначаемых буквами: А, Т, Г, Ц. Последовательность нуклеотидов определяет, какой белок будет построен клеткой. Участок ДНК, кодирующий структуру одного вида белка, называется «ген», а все гены организма — «геном».
Одним из величайших прорывов XX века стал вывод, что ДНК можно прочитать, словно это текст, и понять индивидуальные особенности организма. А если прочитать ДНК разных организмов, можно понять, насколько близки этносы, как люди расселялись по планете и чем обусловлены наследственные заболевания.
Над первой в истории расшифровкой человеческого генома ученые бились больше десяти лет. В 2003-м эта задача была решена. Дальше процесс пошел быстрее благодаря совершенствованию технологии секвенирования (от англ. sequence — последовательность), то есть определения порядка нуклеотидов ДНК.
Очень много данных
Современная геномика — область, где данных чрезвычайно много. Особенно сейчас, когда ученые пытаются сделать медицину персонализированной, основанной на информации о клеточном строении каждого отдельного человека. Лаборатории по всему миру ежегодно собирают терабайты и петабайты информации, а данные биобанков удваиваются каждые семь месяцев.
— Если в одном и том же участке гена у одного человека стоит буква А, а у другого Ц, это патогенная мутация или норма? Единственная возможность ответить на этот вопрос — исследовать как можно больше людей, посмотреть частоту данной мутации в популяции, выяснить, больны или здоровы ее носители. Некоторые мутации встречаются часто, и их легко идентифицировать, но есть и очень редкие — одна на миллион. Именно поэтому в мире сейчас активно накапливают генетическую информацию, — рассказывает Андрей Афанасьев, гендиректор компании iBinom, старший научный сотрудник лаборатории функционального анализа генома МФТИ на конференции «Яндекса» «Data & Science: бионформатика».
В 2008 году ученые из Азии, Европы, Африки, США и Латинской Америки включились в беспрецедентное по масштабам исследование «1000 геномов». Целью проекта было создание максимально подробной карты генетических вариаций человека. Исследователи планировали секвенировать геномы по крайней мере тысячи анонимных участников — представителей разных этнических групп. Проект завершился в 2015 году с перевыполнением плана: секвенировали 2,5 тыс. геномов представителей 26 популяций из 5 регионов мира; описали свыше 88 млн генетических вариаций.
Наша страна в проект «1000 геномов» не попала и теперь наверстывает упущенное. В 2015 году сотрудники Центра геномной биоинформатики им. Ф.Г. Добржанского Санкт-Петербургского госуниверситета запустили исследование «Российские геномы», чтобы создать открытую базу данных по полногеномным последовательностям не менее 3 тыс. человек — представителей разных этнических и региональных групп России.
Геномная картина России
Поселок Борисовка, Белгородская область. В центральной районной больнице в восемь утра теснее, чем обычно. Местные жители приходят семьями и, сверяясь со стрелочками на стенах, шагают в процедурный кабинет. Заходят сразу по трое, что не смущает ни врачей, ни тех, кто в очереди. Выходят с ватой на согнутой руке и сувенирными футболками с эмблемой «Российские геномы» — только что они стали участниками этого проекта.
— Жена сказала, вот я и пришел, — пожимает плечами мужчина средних лет, не совсем понимая, зачем серьезным людям в белом вдруг понадобилась его кровь.
К участию в проекте привлекали группы из трех человек — родителей и ребенка старше 18 лет. Перед сдачей крови каждый заполнял анкету. Главный вопрос: «Ваши бабушка и дедушка родились в этой местности?». Именно благодаря коренным жителям исследователи смогут построить геномную картину региона. Кровь уже сдали в Архангельской, Псковской, Новгородской областях, Приморском и Хабаровском крае, в Твери, Нижнем Новгороде, Красноярске.
В базе данных «Российских геномов» каждому образцу ДНК присваивают шифр, чтобы сохранить анонимность, поэтому исследователи знают только пол, год рождения и этническую или региональную группу, к которой относится донор. Данные хранятся в «облаках»: любой исследователь в любой точке мира должен иметь к ним доступ.
— Первое, что мы хотим понять: как расселялись древние люди, как племена скрещивались и контактировали между собой. Это можно увидеть в геноме, — объясняет молодой генетик Андрей Шевченко из центра им. Ф.Г. Добржанского. — Другая сторона исследования медицинская: разные народы имеют предрасположенность к разным заболеваниям, и это отчасти определяется генами.
Какие наследственные заболевания характерны для россиян, как раз предстоит выяснить.
— Сейчас лечение назначают почти вслепую, поэтому одним таблетки помогают, другим нет, — поясняет Шевченко. — Всему есть причина, и она кроется в генетических особенностях, в мутациях, унаследованных от предков, и в среде обитания.
Уточнение важное, потому что гены определяют не все. Если говорить математическим языком, два умножить на три равно шесть. Чей вклад здесь больше: двойки или тройки? Невозможно сказать. Генетики свою часть задачи решают с помощью секвенирования.
— С каждого генома мы получаем несколько десятков миллионов фрагментов средней длиной 100-150 пар нуклеотидов, они занимают примерно полтерабайта памяти. У нас хранятся в электронном виде данные 60 обработанных геномов и 42 необработанных, так называемых сырых ридов. После получения сырых ридов в работу включаются биоинформатики, которые контролируют качество материала, проверяют, какова длина и глубина покрытия генома. Нам нужна глубина покрытия не менее 3Х, то есть каждая буква генома должна быть прочитана не менее 30 раз. Длина покрытия должна составлять не менее 80%, — рассказывает главный научный сотрудник Центра геномной биоинформатики им. Ф.Г. Добржанского Владимир Брюхин.
Болезни и миграции
Речь идет о колоссальной работе с непременным контролем качества на каждом этапе. Когда материал подготовлен, ученые сравнивают частоту мутаций в генах, выясняют наличие однонуклеотидных полиморфизмов, влияющих и не влияющих на работу генов. По этим данным можно не только определить предрасположенность к заболеваниям в каждой популяции, но и выяснить их родство, а также пути миграции предков.
Первая расшифровка человеческого генома, завершившаяся в начале 2000-х стоила миллиарды долларов. За 15 лет цена упала, но по-прежнему остается баснословной: в России полногеномное секвенирование стоит около 5 тыс. долларов. За рубежом дешевле, но российские законы запрещают вывозить из страны образцы ДНК.
— В Европе цена секвенирования полного генома человека ниже тысячи долларов, в Японии и Китае — 600-700 долларов. Вдобавок мест, где это можно сделать, совсем немного: Москва, Петербург да Новосибирск. Пока нам удалось получить средства и отсеквенировать чуть более сотни индивидуальных геномов, — резюмирует Владимир Брюхин.
На сегодня в рамках проекта «Российские геномы» собрано свыше 1,5 тыс. образцов крови. Контроль качества прошли около 700 образцов. Всего исследователи планируют собрать их около 3 тысяч.
Геном, Twitter и You Tube
В 2015 году в журнале PLOS Computational Biology была опубликована статья, авторы которой назвали астрономию, геномику, Twitter и You Tube главными поставщиками потоков больших данных. И спрогнозировали, как вырастут эти потоки к 2025 году.
Что такое Полный геном и зачем он нужен
Время на прочтение
12 мин
Количество просмотров 28K
Атлас запустил новый продукт — Полный геном. Теперь мы можем исследовать не только отдельные точки в геноме, как в генетическом тесте, но и прочитать всю последовательность нуклеотидов генома. В этой статье рассказываем, что это и зачем это нужно.
Внимание! Мы подарим Полный геном одному из наших читателей, кто выполнит все задания. Подробнее — в конце статьи.

Что значит Полный геном?
Чтобы разобраться с полным геномом или полногеномным секвенированием (whole genome sequencing, WGS), мы сначала расскажем коротко о технологии обычного генетического теста.
Микрочип и обычный генетический тест
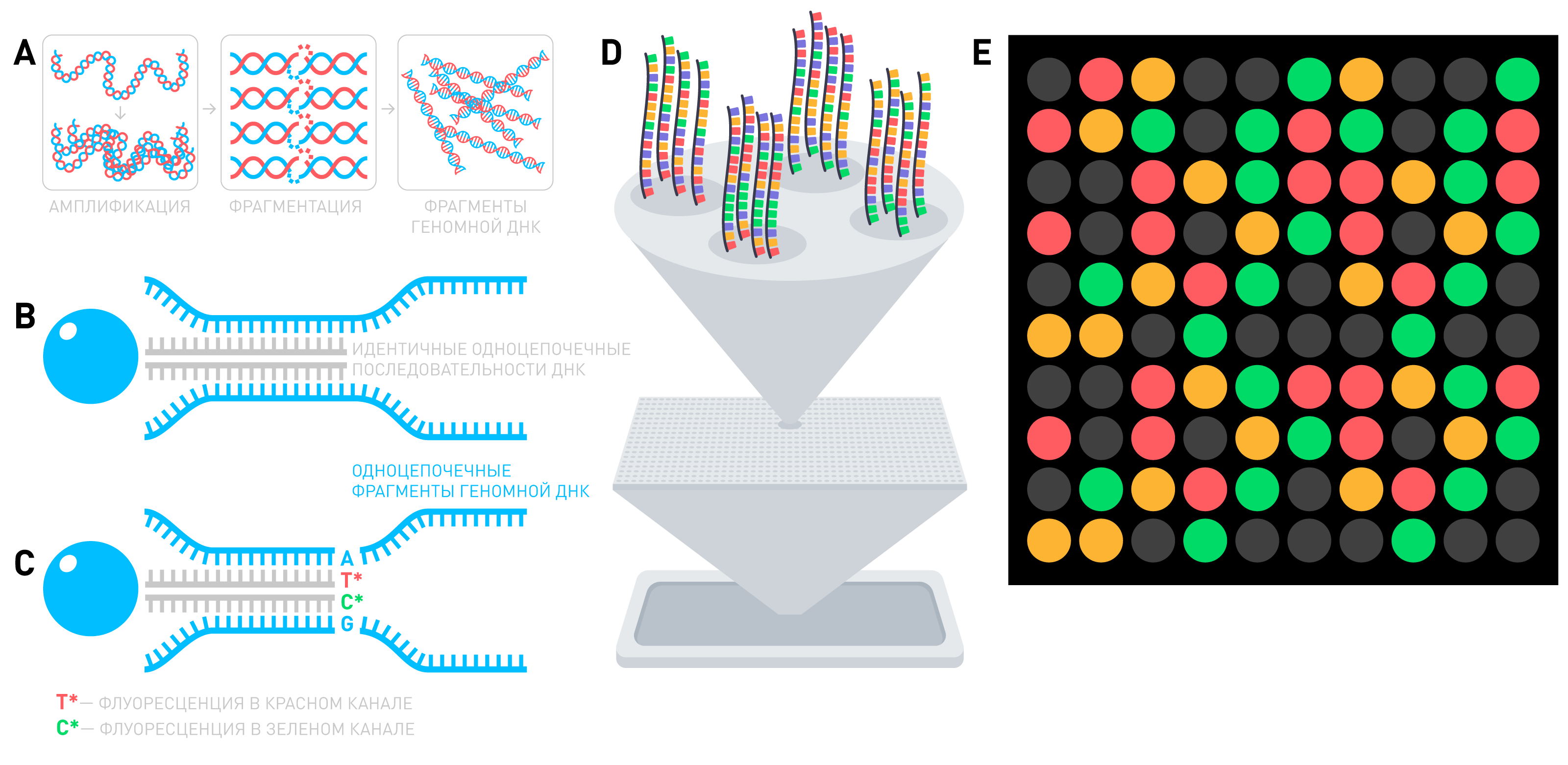
Генетический тест «Атлас», как и многие подобные тесты, делают с помощью ДНК-микрочипа (DNA-microarray, Beadchip). Поверхность ДНК-микрочипа содержит множество небольших углублений (порядка 700 тысяч), в каждом из которых находится по кремниевому шарику диаметром около 3 микрометров. На поверхности этого шарика находятся сотни тысяч сшитых с ним идентичных коротких последовательностей одноцепочечной ДНК, соответствующих участку генома человека, расположенному рядом с исследуемой вариацией (снип, SNV). Каждый шарик соответствует только одной генетической вариации, а координаты лунки на чипе для каждого шарика известны (Рисунок 2D).
Образовательный блок 1
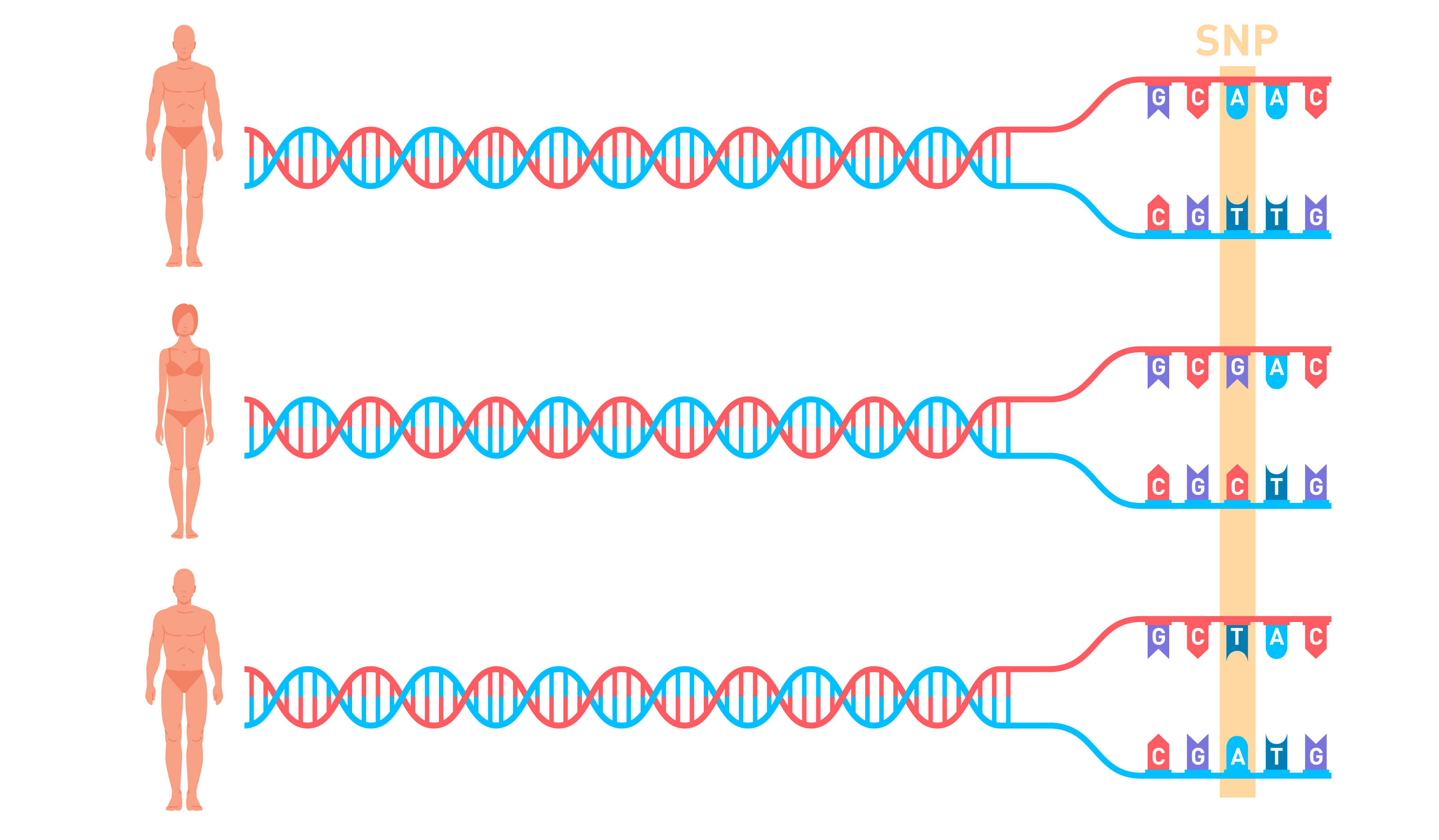
Снип или SNV (Single Nucleotide Varition) — генетическая вариация, то есть изменение последовательности ДНК только в одном нуклеотиде. Например, на участке гена Х в определенной позиции может существовать один из трех нуклеотидов (аллелей) A, G или T, а в остальной части последовательности у разных людей нуклеотиды идентичны (Рисунок 1). От этой одной буквы может зависеть определенная особенность человека.
Рисунок 1 Автор иллюстраций RentonoramaНапример, полиморфизм rs4481887, который находится на первой хромосоме рядом с геном обонятельного рецептора OR2M7, имеет три аллеля: A, G и T. Наличие аллеля А на одной или на обеих хромосомах (генотипы A/G, A/T и A/A) определяет чувствительность к запаху мочи после употребления спаржи. При отсутствии аллеля А человек даже не будет догадываться о том, что после поедания спаржи с мочой выделяется вещество с характерным запахом.
Индел или INDEL (Insertion/Deletion) — другой тип генетических вариаций, в который относят удаление или вставку одного или нескольких нуклеотидов. Снипы и инделы вместе, наряду с возможными структурными изменениями: большими делециями, инсерциями, транслокациями, инверсиями, являются фактической разницей в геноме разных людей.
При сдаче генетического теста «Атлас» из слюны выделяют геномную и митохондриальную ДНК, увеличивают количество ее копий (амплифицируют) и фрагментируют — нарезают на небольшие отрезки (Рисунок 2А). Многочисленные одноцепочечные фрагменты человеческой ДНК соединяются с соответствующими им последовательностями на кремниевых шариках (Рисунок 2В), после чего происходит удлинение этих последовательностей на 1 искусственный флюоресцирующий нуклеотид (Рисунок 2С). Разные нуклеотиды светятся разными цветами: красным и зеленым. По соотношению интенсивностей свечения каждого цвета (Рисунок 2E) можно определить генотип, который соответствует шарику.
Рисунок 2
После сканирования всего чипа мы получаем около 700 тысяч генотипов вариаций и пропускаем их через нашу систему интерпретации. Часто пользователи пытаются сравнить результаты разных тестов, но замечают сильную разницу. Это происходит по нескольким причинам. Во-первых, разные компании используют разные версии чипов и наборы SNV. Как следствие, на одних чипах существуют уникальные наборы вариаций, которые нельзя найти на других чипах. Во-вторых, всегда существует ошибка генотипирования, которая может возникнуть по разным причинам, хотя она вносит наименьший вклад в различие результатов. Данные исследований показывают, что точность генотипирования на ДНК-микрочипах, которые использует Атлас, выше 99,5%. Но основная причина отличий результатов генетических тестов в интерпретации: разные компании делают ее по-разному даже для одинаковых исходных данных генотипирования.
Что такое полногеномное секвенирование?
Главное отличие полногеномного секвенирования от генотипирования на микрочипах — технология и обработка получаемых данных. При полногеномном секвенировании определяется почти вся последовательность ДНК. Почти — потому, что в геноме существуют участки, которые в силу различных причин невозможно прочитать. Часто это участки теломер и центромер — концов и центра хромосом. Для определения последовательностей подобных регионов генома используют малодоступные узкоспециализированные технологии. Такие исследования носят в основном исследовательский характер.
Определение последовательности ДНК позволяет узнать генотипы вариаций в любом месте генома, включая исследуемые вариации на ДНК микрочипе в генетическом тесте «Атлас». Для быстрого и эффективного определения последовательности генома используется технология NGS (next generation sequencing, секвенирование следующего поколения). Существует несколько принципиально отличающихся методов, созданных разными компаниями.
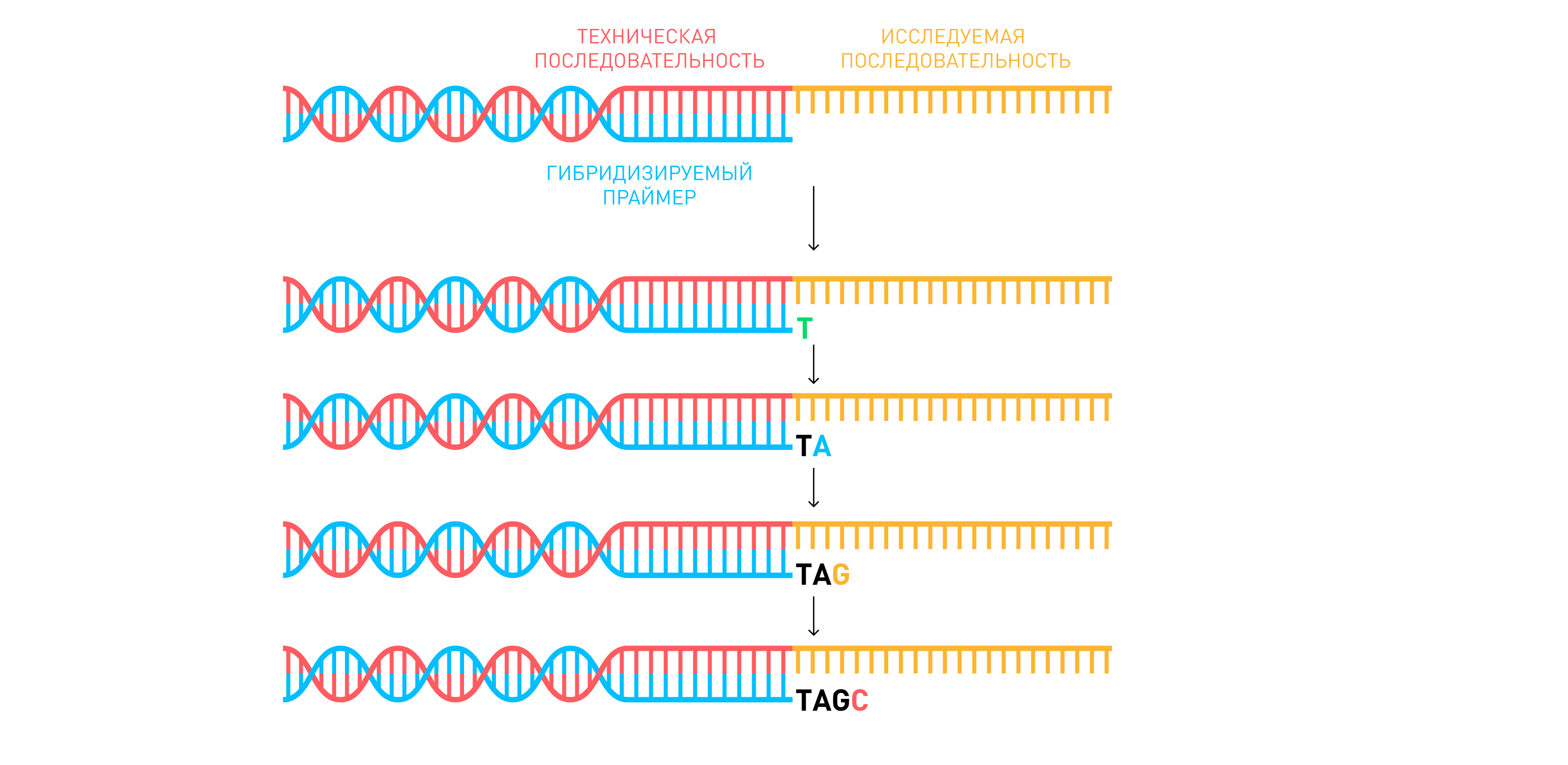
Суть метода Атласа заключается в следующем: выделенную и очищенную ДНК многократно амплифицируют и фрагментируют до определенной длины. К каждому фрагменту пришиваются специальные последовательности, которые позволяют управлять данным фрагментом. Прочитываются, именно эти обработанные фрагменты (Рисунок 3).
Рисунок 3. Процесс пошагового секвенирования: каждый следующий нуклеотид флуоресцирует в уникальном для него цветовом канале.
На каждом шаге происходит удлинение на один нуклеотид, с которым связан флуоресцентный зонд. Каждый из четырех нуклеотидов связан с зондом определенного цвета. Таким образом, шаг за шагом по цвету свечения можно определить порядок нуклеотидов в исследуемом фрагменте. Полученные последовательности каждого фрагмента называются прочтениями или ридами (reads), и их получается около 1 миллиарда на каждый образец исследуемой ДНК. Риды и показатели качества их прочтения хранятся в текстовом формате FASTQ.
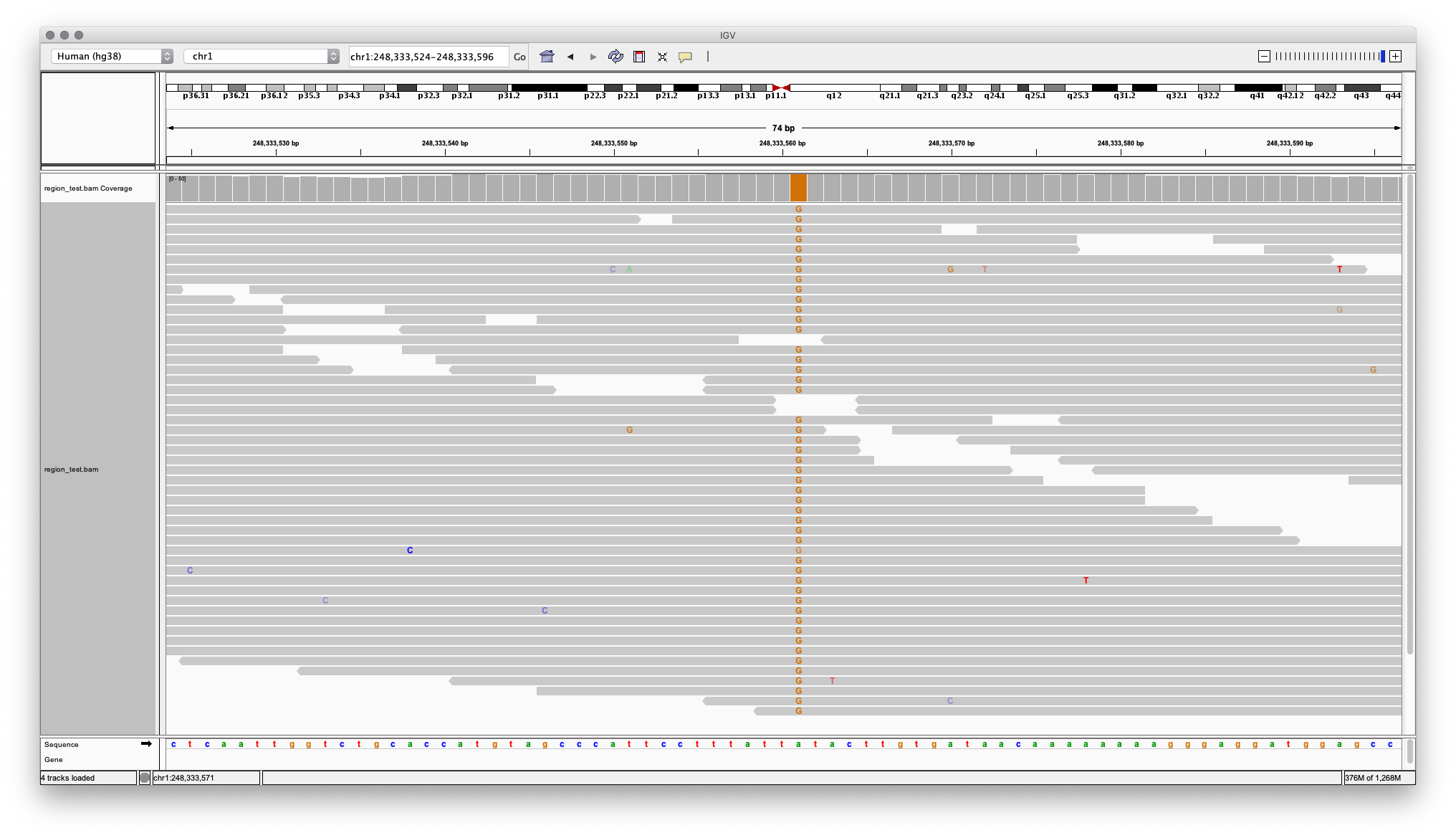
Далее риды выравниваются (картируются) на референсный геном. С использованием специального программного обеспечения, например Burrows-Wheeler aligner, для каждого рида происходит поиск места на референсном геноме, которому он соответствует. Прочтение вместе с информацией о положении в геноме записывается в файл формата SAM или BAM. Визуализация картированных на геном ридов в SAM (BAM) файле с помощью геномного браузера IGV показана на Рисунке 4.
Рисунок 4. Визуализация BAM файла в программе IGV (участок хромосомы одного человека). Картированные риды обозначены горизонтальными блоками, позиция указана в треке сверху.
На рисунке также видно, что такое глубина прочтения (depth of coverage) — когда, любую позицию в референсном геноме покрывает несколько выровненных ридов. Значение усредняется по всему геному и используется как показатель качества исследования. Атлас гарантирует среднее покрытие генома глубиной выше 30, что обеспечивает высокое качество генотипирования. Увеличение глубины прочтения значительно увеличивает стоимость секвенирования, точность определения генетических вариаций и используется в узких онкологических исследованиях, например, в Атлас Онкодиагностике.
Образовательный блок 2
Референсный геном — это искусственно собранная последовательность ДНК биологического вида. Большинство последовательностей, из которых собран референсный геном человека, были взяты у одного человека Африкано-Европейского происхождения. Референсный геном регулярно обновляется: последняя версия, GRCh38, была выпущена в 2013 году и содержит в себе 3,3 млрд нуклеотидов. Несмотря на доступность новой версии, многие генетические тесты и сервисы по анализу генетических данных используют предыдущую — GRCh37. Для предоставления наиболее точных результатов анализа Атлас использует версию GRCh38.
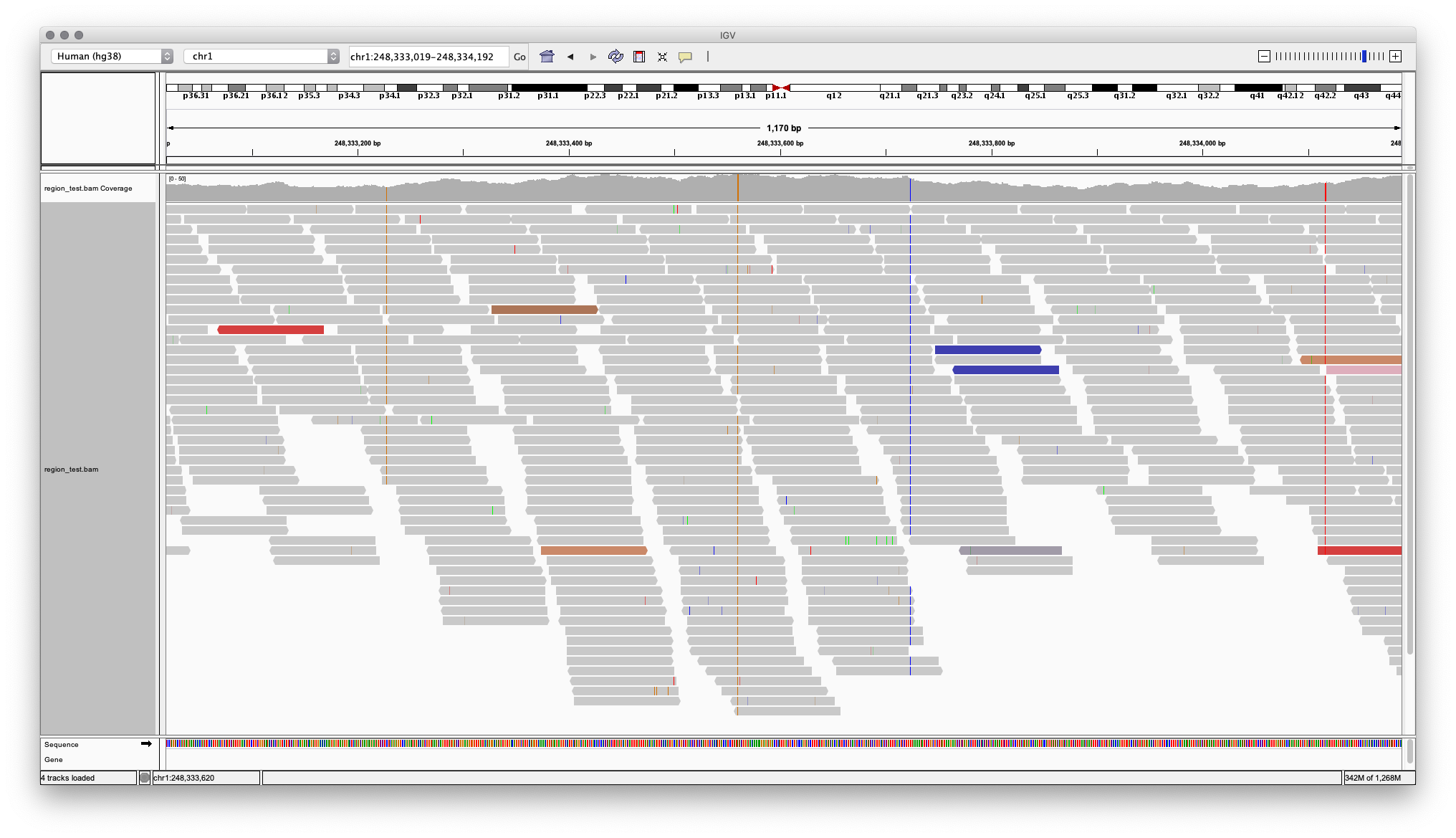
Полученные после картирования файлы (SAM-файлы, sequencing alignment map, или в бинарном виде BAM — binary alignment map) фильтруются и используются для поиска вариаций в геноме, включая как однонуклеотидные вариации, так и короткие инсерции и делеции. Наличие однонуклеотидного варианта на хромосоме 1 в позиции 248333561 (приведенный ранее пример rs4481887 — вариант, определяющий чувствительность к запаху мочи после употребления спаржи) показано на Рисунке 5.
Рисунок 5. Визуализация BAM файла в программе IGV. Участок хромосомы 1. В позиции 248333561 находится полиморфизм rs4481887: нуклеотид в данной позиции не соответствует референсному геному и выделен цветом. Во всех ридах, которые покрывают данный участок генома, присутствует нуклеоид G, что говорит о гомозиготности генотипа. У человека с такими результатами секвенирования будет генотип G/G и нечувствительность к запаху мочи после употребления спаржи.
Найденные генетические вариации хранятся в VCF файле (variant call format). Он содержит обнаруженные аллели для каждой позиции генома, а также показатели качества генотипирования. VCF файл фильтруется: из него удаляются записи о наличии/отсутствии вариаций, которые не соответствуют порогам качества и являются потенциально ложными. Каждой найденной вариации присваиваются известные по ней данные из dbSNP, в частности, уникальные идентификаторы rsID.
Подробно ознакомиться со спецификой форматов хранения данных секвенирования и генотипирования можно по следующим ссылкам:
FASTQ — maq.sourceforge.net
SAM — samtools.github.io
VCF — samtools.github.io
Для визуализации картирования ридов (SAM или BAM файлов) используется различное программное обеспечение. Наиболее популярным является IGV (Integrative Genomics Viewer от Broad Institute). Загрузить IGV и ознакомиться с ним можно по ссылке.
Какие данные интерпретирует Атлас?
Полный геном содержит данные по тем вариантам генов, которые есть в генетическом тесте «Атлас», а также по признакам, которые нельзя подсчитать с помощью технологии генотипирования с использованием ДНК-микрочипов. Например, к таким признакам относятся риски онкологических заболеваний.
Здоровье
383 Наследственных заболеваний
Основной акцент всех тестов Атласа — раздел здоровье, и наш новый тест «Полный геном» не стал исключением. К признакам нашего основного теста мы добавили еще 65 наследственных заболеваний.
К наследственным или моногенным заболеваниям относятся болезни, которые передаются от родителей детям и на развитие которых не влияет образ жизни человека. Для развития такого заболевания достаточно мутации от одного или от обоих родителей в зависимости от типа наследования заболевания.
21 Многофакторное заболевание
На развитие многофакторных заболеваний влияют гены, образ жизни и факторы окружающей среды. К таким болезням относятся, например, сахарный диабет, ожирение, болезнь Паркинсона и Альцгеймера, атопический дерматит. В личном кабинете пользователю доступен расчет относительного риска развития заболевания на основе данных теста и опросника об образе жизни.
6 других признаков, связанных со здоровьем
Здесь мы собрали признаки, которые влияют на образ жизни человека. Например, продолжительность сна, хронотип, синдром хронической усталости, боязнь боли.
Клиническая генетика
43 Онкологических риска
Благодаря тому, что в полном геноме исследуется больше вариантов генов, мы получаем больше данных и можем оценить риски развития онкологических заболеваний. По результатам теста мы оцениваем предрасположенность к наследственным онкологическим синдромам.
Наследственные онкологические синдромы — генетические заболевания, которые могут передаваться в семье из поколения в поколение и повышать риски некоторых видов рака. Около 10% случаев онкологии имеют наследственную природу.
Поиск наследственных онкологических синдромов полезен в первую очередь тем, у кого в семье были случаи рака. На наследственную природу может указывать ранний возраст начала болезни (до 50 лет), наличие нескольких родственников по одной линии с одинаковым диагнозом, редкие формы рака. На основе результатов теста врач определит объем дополнительных исследований и составит персональную программу управления онкологическими рисками. Узнайте больше о том, как развиваются злокачественные образования, можно в нашей серии статей.
53 Показателей восприимчивости к активным компонентам лекарств
Каждый человек по разному реагирует на лекарства: у одних препарат действует хорошо, другие страдают от тяжелый побочных эффектов, а у третьих лечение оказывается неэффективным. В некоторых случаях это обусловлено работой генов, которые влияют на метаболизм активных веществ и риски побочных реакций.
Например, препарат Омепразол снижает секрецию соляной кислоты в желудке. Используется при лечении язвенной болезни желудка и двенадцатиперстной кишки, рефлюксной болезни. Ген CYP2C19 кодирует фермент, который отвечает за метаболизм омепразола. Поэтому, в зависимости от вариантов гена, необходимо корректировать дозу омепразола или использовать альтернативное лекарственное средство.
В тесте мы исследуем варианты генов, связанные с особенностями метаболизма 53 препаратов. Среди них есть антидепрессанты, гормональные контрацептивы, препарат для снижения свертываемости крови и некоторые другие.
Специализированный отчет по наследственным заболеваниям
Отчет — заключение Лаборатории клинической биоинформатики Федора Коновалова. Биоинформатики лаборатории ищут носительство рецессивных заболеваний. Такое носительство чаще всего не влияет на здоровье человека, но у его будущих детей оно может привести к заболеванию. Также лаборатория может выявить уникальную, нигде ранее не описанную мутацию и дать по ней заключение, является ли она вероятно патогенной.
Эксперты проводят тщательный анализ актуальной научной информации о мутациях и заболеваниях в каждом конкретном случае. В заключении содержится вся необходимая информация для врача-генетика. С этим отчетом вы сможете обратиться к профильному специалисту в случае необходимости.
Такие генетические отчеты похожи на юридический документ с обилием сложных терминов, правильно оценить который может только специалист, в нашем случае — генетик. Поэтому мы не показываем данные клинической генетики до консультации. Во время встречи врач-генетик подробно рассказывает, на что стоит обратить внимание с учетом вашей семейной истории и наличия симптомов. Это может помочь, например, для уточнения возраста начала скрининга определенных заболеваний или при планировании семьи.
Питание
28 Отчетов
По генетическим тестам и даже по полному геному подобрать оптимальное питание и составить рацион нельзя. Продуктов, их способов приготовления и блюд настолько много, что исследователям трудно найти какие-либо корреляции с вариантами генов. При этом некоторые данные все же есть.
По определенным вариантам генов мы можем узнать, есть ли у человека предрасположенность к непереносимости лактозы или глютена, быстро или медленно организм справляется с алкоголем или кофеином, а также оценить предрасположенность к определенному уровню железа, кальция, омега-3 и 6 жирных кислот. По этим данным человек может решить, какие продукты ему стоит убрать или наоборот добавить в рацион.
Спорт
16 Отчетов
Определить вид спорта, который вам больше подходит генетически — так же сложно, как и подобрать питание. Видов физической нагрузки сейчас множество, и понятие спорт с каждым годом расширяется. Так скейтбординг и серфинг добавили в программу олимпийских видов спорта. Видов физической нагрузки слишком много, чтобы это в большей степени было обусловлено генетикой. Поэтому не верьте генетическим тестам, которые обещают найти наиболее подходящий вам вид спорта. Выбирайте тот вид спорта, который просто нравится.
Научные сообщества генетиков обеспокоены, что родители делают генетические тесты детям, чтобы узнать, какой вид спорта им больше подходит. В таком случае ребенка могут отправить в группу, которая ему не нравится, но подходит по результатам теста. Если человек хочет добиться выдающихся результатов в спорте, то успех в большей степени будет зависеть от его амбиций, силы воли и характера. Варианты генов тут играют меньшую роль.
С помощью генетического теста можно узнать, как гены влияют на риски спортивных травм, количество свободного инсулиноподобного фактора роста-1, уровень эритроцитов, эритропоэтина, а также на особенности обмена аминокислот — валина, лейцина и L-карнитина. К результатам «Полного генома» мы добавили также риск невралгии седалищного нерва, уровень IGFBP‑3, объем выдоха и другие.
Другие признаки
15 Отчетов
В этом разделе мы собрали признаки, которые относятся к особенностям организма: черты внешности, восприятие света, чувствительность к травам и запахам. В нашем тесте вы не найдете признаков, которые связаны с эмоциями, поведением или характером. В основном эти черты зависят от особенностей воспитания, окружения и привычек, и в меньшей степени на них влияют варианты генов. К тому же многие личные качества можно поменять или выработать во взрослом возрасте.
Происхождение
3 Отчета
Генетики не используют понятия этнической или национальной принадлежности. В большей степени они обусловлены культурными различиями, а не разными вариантами генов. Вместо этого генетики используют понятие популяция — группа людей, которая долгое время живет на одной территории. Сегодня доступны геномные данные определенных популяций, из них ученые выделили последовательности и варианты генов, характерные для каждой. Генетические исследования происхождения — это поиск таких вариантов в геноме и определение генетической схожести с известными популяциями в процентном соотношении.
Кроме популяционного состава по генетическому коду можно узнать свою гаплогруппу. Гаплогруппа — это группа людей с одинаковым вариантом гена, который случился у одного общего предка тысячи лет назад. Также по геному можно определить процент ДНК неандертальца. В геноме современного человека оказалось около 1–4 % ДНК неандертальцев. Сейчас известно только несколько признаков, которые зависят от наличия вариантов гена неандертальца, — рост волос на спине и уровень липопротеинов низкой плотности ЛПНП (плохой холестерин).
Сравнение Полного генома и генетического теста «Атлас»
Почему Полный геном?
Главный плюс Полного генома в том, что вы получаете всю информацию о своей ДНК. Когда появятся новые данные, мы просто добавим их в личный кабинет. С обычным генетическим тестом это работает не всегда, так как в нем исследуется около 660 000 вариантов — 0,1% всей ДНК. Для интерпретации новых признаков их может быть недостаточно.
Результаты теста помогут предпринять меры по профилактике заболеваний, планированию семьи, а врач сможет уточнить диагноз в будущем или уже сейчас. Тест доставят на дом и всё, что требуется от пользователя — собрать образец слюны и вызвать курьера для передачи пробирки в лабораторию.
Основа Полного генома «Атласа»: генетический анализ высокой точности (99,5%), контроль качества полученных данных, запатентованная система интерпретации данных, доступ к исходным данным, консультация генетика, а также отобранные научные статьи, которые доступны каждому пользователю. Всё это пользователь получает за 94 500 — самая низкая цена за подобные услуги в России. Тест уже можно купить на сайте Атласа.
Если вы умеете работать с большими данными, а особенно биоинформатическими, ваши сырые данные полного генома могут быть пластилином, с которым на досуге можно поиграть и узнать о себе больше. Например, можно отсеять варианты генов, которые изучают другие компании и загрузить в их базу интерпретации, узнать родственную связь с другим человеком, взять референсную ДНК шимпанзе или Неандертальца и сравнить насколько вы схожи.
А еще
Атлас приготовил большой подарок читателям Хабра! В следующих статьях мы дадим 3 задачи с примерами и вводными данными, а также информацией по необходимому ПО. Первый, кто решит все задачи, — получит Полный геном в подарок!
ПРАКТИКА
Как устроен процесс выделения ДНК в лаборатории
Рассказываем, как проходит первый этап генетического исследования — выделение геномной ДНК из биологических образцов.
Что такое ДНК
ДНК — это длинная молекула с отрицательным зарядом: она кодирует инструкцию по сборке отдельных белков, клеток, тканей и целых организмов. ДНК содержится во всех клетках за редкими исключениями: например, зрелые эритроциты млекопитающих теряют ядро с генетическим материалом, чтобы лучше переносить кислород. Поэтому выделить ДНК можно из любой ткани живого или мертвого организма — вопрос только в том, сколько усилий придется затратить.
Сотрудники лаборатории Genotek успешно справлялись с иголками сосны, стволовыми клетками, йогуртами, зародышами лягушек, сердцами мышей и золотистым стафилококком, а автор этой статьи на студенческом практикуме выделяла ДНК из консервированной кукурузы. Но чаще всего источником генетического материала для анализа становится кровь или слюна человека.
Анна Красненко
Руководитель лаборатории Genotek
В слюне содержатся клетки эпителия внутренней поверхности щек — это надежный источник ДНК. Важным преимуществом является безболезненность и неинвазивность данного типа сбора биоматериала.
Зачем выделять ДНК?
Обработка биоматериала и выделение ДНК — это первый этап молекулярно-биологического исследования. Генетический материал хранится в ядрах клеток, которые нужно разрушить, иначе ДНК не выйдет в раствор и будет недоступна для анализа. Из клеток животных часть ДНК можно высвободить простым нагреванием, а вот с клетками растений это не пройдет: они защищены прочной клеточной стенкой из целлюлозы.
Чтобы анализ прошел успешно, важно очистить ДНК от примесей. Примеси ингибируют активность ферментов, которые нужны для подготовки образка к анализу на секвенаторе или чиповом анализаторе.
Самые распространенные ингибиторы в биологических тканях — это гем (компонент эритроцитов, который позволяет им переносить кислород), коллаген в костях и других соединительных тканях, меланин в волосах и коже, ароматические соединения в растительных образцах, миоглобин в тканях мыщц (1, 2). В слюне анализу мешают остатки пищи и консервант, который используется для хранения и перевозки образца: он содержит SDS, ингибирующий работу ферментов. При перевозке SDS защищает ДНК от разрушения, но при попадании в реакционную смесь нарушает работу ДНК-полимеразы.
Анна Красненко
Руководитель лаборатории Genotek
При криминалистических исследованиях для ДНК-идентификации достаточно луковицы волоса или кусочка кожи. Но для полногеномных исследований необходима неразрушенная ядерная и митохондриальная ДНК, поэтому мы используем в своей работе слюну и кровь, а так же реагенты ведущего производителя на рынке.
Фридрих Мишер и выделенная им ДНК (источник)
Кто выделил ДНК первым
Открыл ДНК швейцарский врач Фридрих Мишер, когда изучал лейкоциты из гноя на хирургических повязках. В 1869 году Мишер заметил, что при выделении белков из лейкоцитов в осадок выпадает вещество с кислотными свойствами, которое он назвал «нуклеином». Позднее Мишер использовал для получения нуклеина молоки лососевых рыб, которых собственноручно ловил в Рейне, и писал о роли вещества в оплодотворении. Однако роль ДНК в передаче наследственной информации еще долго не замечали: ученые считали, что она слишком просто устроена для вещества, в котором записаны наследственные признаки. Только через 83 года генетическую роль нуклеиновой кислоты установили исследователи Херши и Чейз.
В 1952 году Херши и Чейз доказали, что наследственная информация содержится в ДНК, а не белках, как считали до этого. Ученые работали с бактериофагом Т2 — вирусом, заражающим кишечную палочку. Бактериофаг состоит из белковой оболочки и молекулы ДНК внутри нее. Оболочка содержит атомы серы, а ДНК аккумулирует 99% фосфора. Херши и Чейз кормили бактериофагов радиоактивными изотопами фосфора и серы, чтобы меченые атомы включились в состав оболочки и ДНК. Радиоактивными фагами ученые заражали бактерий и изучали вирусное потомство. Так они выяснили, что дочерние фаги наследуют 30% меченого фосфора и менее одного процента серы. При заражении белковая оболочка вируса остается прикрепленной к мембране клетки, а внутрь нее попадает только ДНК. Херши и Чейз отмыли оболочки с поверхности клеток, чтобы проверить, нужны ли они для размножения фагового потомства. Оказалось, что без белковых «теней» фаги размножаются так же эффективно, как с ними. Результаты эксперимента А. Херши и М. Чейз стали решающим доказательством роли ДНК в передаче наследственной информации.
Как выделяют ДНК
в лаборатории
Наш робот в процессе выделения ДНК
В лаборатории Genotek выделение ДНК полностью автоматизировано: робот не ошибается и не устает. Процесс выделения происходит в несколько шагов:
- Разрушаем мембраны клеток и клеточных ядер, чтобы все содержимое клетки — ДНК, белки, липиды и сахара — вышло в раствор. Для этого используем лизисный буфер с детергентом SDS (для слюны) или тиоцианатом гуанидина (для крови). Детергент разрушает мембраны, а буферный компонент раствора поддерживает pH на оптимальном для ДНК уровне. Лаурилсульфат натрия (SDS) входит в состав обычного шампуня, а вот тиоцианат гуанина токсичен и вызывает щелочные ожоги при попадании на кожу. Его агрессивные денатурирующие свойства используют при изучении испанского гриппа: инактивированные вирусные частицы становятся безопасными для исследователей.
- Избавляемся от белков. Вышедшую в раствор ДНК нужно освободить от связанных с ней белков. Одновременно с этим необходимо инактивировать ДНКазы — ферменты, которые атакуют «оголенную» ДНК. За разрушение клеточных белков отвечает еще один компонент лизисного буфера — протеина К, фермент, который получают из микроскопических грибов рода Engyodontium album.Буква К в названии указывает на способность расщеплять кератин, белок ногтей и волос.
- Отделяем ДНК от примесей. Центрифугируем раствор в пробирках с кремниевой мембраной, которая связывается с ДНК и пропускает остальные органические компоненты клетки. Центрифугирование многократно увеличивает скорость фильтрации сквозь мембрану. Мембрану со связанной ДНК несколько раз промывают спиртом — изопропанолом или этанолом.
- Растворяем ДНК в буфере для хранения. Связанную с мембраной ДНК отмывают буфером для элюции (элюцией называют процесс выведения в раствор адсорбированного вещества). Растворенная в буфере ДНК может храниться при −20°С в течение нескольких лет
Как оценить качество ДНК
При неправильном сборе, некорректном или слишком долгом хранении биологических образцов ДНК в клетках разрушается. Такие образцы подходят для анализа небольших фрагментов генома (например, при установлении отцовства), но непригодны для исследований, где важно прочитать всю генетическую последовательность (секвенирование) или проанализировать одновременно сотни тысяч нуклеотидов в разных участках ДНК (генотипирование на микрочипах).
Отсутствие деградации геномной ДНК проверяют электрофорезом в агарозном геле. Под действием тока отрицательно заряженные молекулы ДНК движутся к аноду со скоростью, пропорциональной их размеру. Геномная ДНК хорошего качества выглядит на форезе четкой полоской, а некачественная ДНК «шмерит» — формирует градиент из фрагментов разных длин. Такой образец нельзя брать на анализ.
Что делать, если контроль не пройден
Важно, чтобы ДНК не разрушилась при перевозке и хранении биообразца. Для этого в пробирку добавляют консервант. Если слюны больше, чем требуется, консервант не сработает. Если слюны мало, ДНК не хватит для анализа. Поэтому все поступившие в лабораторию пробирки оценивают визуально и в случае проблем сразу отправляют на перезабор.
Иногда не получается выделить качественную ДНК из внешне пригодного образца. Тогда лаборатория делает вторую попытку, используя оставшуюся порцию слюны, чтобы исключить технические ошибки. Если она тоже оказывается неудачной, мы приглашаем клиента на перезабор и просит внимательно соблюдать правила сдачи биоматериала: важно, чтобы в слюне оказалось достаточно клеток эпителия щек и не было посторонних примесей.
К сожалению, в слюне некоторых людей от природы содержится слишком мало ДНК. Поэтому, если на «пересдаче» человек проваливается, мы предлагаем ему сдать кровь.
ДНК, прошедшую контроль качества, направляют на секвенирование или генотипирование на микрочипах.
Комплексные ДНК-тесты — ваша инвестиция в расширенный доступ к персональной генетической информации
Инвестиция в будущее: выдаем расшифровку всех 3 млрд. маркеров генома.
Подпишитесь на нашу рассылку, и мы все подробно расскажем. Это бесплатно.
Содержание
- Способы получения генетического материала для генной инженерии
- Что такое генная инженерия и зачем вмешиваться в природу организмов
- Содержание:
- История развития
- Истоки
- На подъеме
- Новая эра
- Технологии генной инженерии
- Где и как применяется генная инженерия
- Медицина
- Сельское хозяйство
- Скотоводство
- С прицелом на человека
- Изменение ДНК человека
- Генная терапия
- Этическая сторона вопроса
- Страх неизвестности
Способы получения генетического материала для генной инженерии
Генная, или генетическая инженерия ( genetic engineering , genetic modification technology ) – это совокупность биотехнологических методов, позволяющих создавать синтетические системы на молекулярно-биологическом уровне
Генная инженерия дает возможность конструировать функционально активные структуры в форме рекомбинантных нуклеиновых кислот: рекДНК ( recDNA ) или рекРНК ( recRNA ) – вне биологических систем ( in vitro ), а затем вводить их в клетки.
Возможность прямой (горизонтальной) передачи генетической информации от одного биологического вида другому была доказана в опытах Ф. Гриффита с пневмококками (1928).
Однако генная инженерия как технология рекДНК возникла в 1972 г., когда в лаборатории П. Берга ( Станфордский ун-т, США) была получена первая рекомбинантная (гибридная) ДНК ( рекДНК ), в которой были соединены фрагменты ДНК фага лямбда и кишечной палочки с кольцевой ДНК обезьяньего вируса SV 40.
С начала 1980-х гг. достижения генной инженерии начинают использоваться на практике.
С 1996 г. генетически модифицированные растения ( genetic modified plants ) начинают использоваться в сельском хозяйстве.
Задачи генной инженерии
Основные направления генетической модификации организмов:
– придание устойчивости к ядохимикатам (например, к определенным гербицидам);
– придание устойчивости к вредителям и болезням (например, Bt -модификация);
– повышение продуктивности (например, быстрый рост трансгенного лосося);
– придание особых качеств (например, изменение химического состава).
Методы генной инженерии
Методы генной инженерии основаны на получении фрагментов исходной ДНК и их модификации.
Для получения исходных фрагментов ДНК разных организмов используется несколько способов:
– Получение фрагментов ДНК из природного материала путем разрезания исходной ДНК с помощью специфических нуклеаз ( рестриктаз ).
– Прямой химический синтез ДНК, например, для создания зондов.
– Синтез комплементарной ДНК (кДНК) на матрице мРНК с использованием фермента обратной транскриптазы (ревертазы).
Выделенные участки ДНК встраивают в векторы переноса ДНК. Векторы ДНК – это небольшие молекулы ДНК, способные проникать в другие клетки и реплицироваться в них.
В состав вектора ДНК входит не менее трех групп генов:
1. Целевые гены, которые интересуют экспериментатора.
2. Гены, отвечающие за репликацию вектора, его интеграцию в ДНК клетки-хозяина и экспрессию требуемых генов.
3. Гены-маркеры (селективные, репортерные гены), по деятельности которых можно судить об успешности трансформации (например, гены устойчивости к антибиотикам или гены, отвечающие за синтез белков, светящихся в ультрафиолетовом свете).
Для внедрения векторов в прокариотические или эукариотические клетки используют различные способы, например:
1. Биотрансформация . Используются векторы, способные сами проникать в клетки. Частным случаем биотрансформации является агробактериальная трансформация.
2. Микроинъекции . Используются, если клетки, подлежащие трансформации, достаточно крупные (например, икринки, пыльцевые трубки).
3. Биобаллистика ( биолистика ) . Векторы «вбивают» в клетки с помощью специальных «пушек».
4. Комбинированные методы, например, сочетание агробактериальной трансформации и биолистики .
В качестве векторов часто используют плазмиды (кольцевые молекулы ДНК прокариотических клеток), а также ДНК вирусов. У эукариот в качестве векторов используют мобильные генетические элементы – участки хромосом, способные образовывать множество копий и встраиваться в другие хромосомы. В составе одного вектора можно комбинировать различные фрагменты ДНК (различные гены). Вновь образованные фрагменты ДНК называют рекомбинантными.
Векторы переноса ДНК вместе с внедренными фрагментами ДНК различными способами вводят в прокариотические или эукариотические клетки и получают трансгенные клетки. В ходе размножения трансгенных клеток происходит клонирование требуемых фрагментов ДНК, в частности, отдельных генов. Клонированные гены эукариот подвергают различным модификациям (например, добавляют перед ними определенные промоторы) и внедряют в клетки-продуценты. Основная проблема состоит в том, чтобы чужеродные гены экспрессировались постоянно, то есть должен происходить синтез необходимых веществ без ущерба для клетки–хозяина.
Практические достижения современной генной инженерии заключаются в следующем:
– Созданы банки генов, или клонотеки , представляющие собой коллекции клонов бактерий. Каждый из этих клонов содержит фрагменты ДНК определенного организма (дрозофилы, человека и других).
– На основе трансформированных штаммов вирусов, бактерий и дрожжей осуществляется промышленное производство инсулина, интерферона, гормональных препаратов. На стадии испытаний находится производство белков, позволяющих сохранить свертываемость крови при гемофилии, и других лекарственных препаратов.
– Созданы трансгенные высшие организмы (многие растения, некоторые рыбы и млекопитающие) в клетках которых успешно функционируют гены совершенно других организмов. Широко известны генетически защищенные генно-модифицированные растения (ГМР), устойчивые к высоких дозам определенных гербицидов, а также Bt -модифицированные растения, устойчивые к вредителям. Среди трансгенных растений лидирующие позиции занимают: соя, кукуруза, хлопок, рапс.
Эколого-генетические риски ГМ-технологий
Генная инженерия относится к технологиям высокого уровня ( high technology ). В противоположность технологиям низкого уровня, высокие биотехнологии характеризуются высокой наукоемкостью, т.е. использованием рабочих систем, полученных с использованием самых современных методов экологии, генетики, микробиологии, цитологии, молекулярной биологии. Материалы, применяемые в высоких биотехнологиях, часто нуждаются в специальной подготовке. Для реализации таких технологий требуется специальное технологическое оборудование, обслуживаемое квалифицированными специалистами. Из-за нехватки таких специалистов расширение высокотехнологичного производства сопровождается его автоматизацией и компьютеризацией.
ГМ-технологии ( GM — technology ) используются как в рамках обычного сельскохозяйственного производства, так и в других областях человеческой деятельности: в здравоохранении, в промышленности, в различных областях науки, при планировании и проведении природоохранных мероприятий.
Любые технологии высокого уровня могут быть опасными для человека и окружающей его среды, поскольку последствия их применения непредсказуемы. Поэтому технологии генной инженерии ( GM — technology ) вызывают у населения вполне понятное недоверие.
Для снижения вероятности неблагоприятных эколого-генетических последствий применения генно-инженерных технологий постоянно разрабатываются новые подходы. Например, трансгенез ( внедрение в геном генетически модифицируемого организма чужеродных генов ) в ближайшем будущем может быть вытеснен цисгенезом ( внедрение в геном генетически модифицируемого организма генов этого же или близкородственного вида ).
© Афонин Алексей Алексеевич
Доктор с.-х. наук, профессор Брянского государственного университета
Зав. лабораторией популяционной цитогенетики НИИ ФиПИ БГУ
главная страница сайта ОБЩАЯ И ТЕОРЕТИЧЕСКАЯ БИОЛОГИЯ http :// afonin -59- bio . narod . ru
Источник
Что такое генная инженерия и зачем вмешиваться в природу организмов
Содержание:
Генная инженерия — это современное направление биотехнологии, объединяющее знания, приемы и методики из целого блока смежных наук — генетики, биологии, химии, вирусологии и так далее — чтобы получить новые наследственные свойства организмов.
Перестройка генотипов происходит путем внесения изменений в ДНК (макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов) и РНК (одну из трех основных макромолекул, содержащихся в клетках всех живых организмов).
Если внести в растение, микроорганизм, организм животного или даже человека новые гены, можно наделить его новой желательной характеристикой, которой до этого он никогда не обладал. С этой целью сегодня генная инженерия используется во многих сферах. Например, на ее основе сформировалась отдельная отрасль фармацевтической промышленности, представляющая собой одну из современных ветвей биотехнологии.
История развития
Истоки
Основы классической генетики были заложены в середине XIX века благодаря экспериментам чешского-австрийского биолога Грегора Менделя. Открытые им на примере растений принципы передачи наследственных признаков от родительских организмов к их потомкам в 1865 году, к сожалению, не получили должного внимания у современников, и только в 1900 году Хуго де Фриз и другие европейские ученые независимо друг от друга «переоткрыли» законы наследственности.
Параллельно с этим шел процесс формирования знаний о ДНК. Так, в 1869 году швейцарский биолог Фридрих Мишер открыл факт существования макромолекулы, а в 1910 году американский биолог Томас Хант Морган обнаружил на основе характера наследования мутаций у дрозофил, что гены расположены линейно на хромосомах и образуют группы сцепления. В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
На подъеме
К концу 1960-х годов генетика активно развивалась, а ее важными объектами стали вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов, а в 1970-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК.
Генная инженерия как отдельное направление исследовательской работы зародилась в США в 1972 году, когда в Стэнфордском университете ученые Пол Берг, Стэнли Норман Коэн, Герберт Бойер и их научная группа внедрили новый ген в бактерию кишечной палочки (E. coli), то есть создали первую рекомбинантную ДНК.
Техника ПЦР была впервые разработана в 1980-х годах американским биохимиком Кэри Маллисом. Будущий лауреат Нобелевской премии по химии (1993 года), обнаружил в специфический фермент — ДНК-полимеразу, который участвует в репликации ДНК. Этот фермент буквально считывает отрезки цепи нуклеотидов молекулы и использует их в качестве шаблона для последующего копирования генетической информации.
Новая эра
В 1996 году методом пересадки ядра соматической клетки в цитоплазму яйцеклетки на свет появилось первое клонированное млекопитающее — овца Долли. Это событие стало революционным в истории развития генной инженерии, потому что впервые стало возможным серьезно говорить о создании клонов и выращивании живых организмов на основе молекул.
Технологии генной инженерии
Генная инженерия за короткий срок оказала огромное влияние на развитие различных молекулярно-генетических методов и позволила существенно продвинуться на пути познания генетического аппарата.
Так, появилась технология CRISPR — инструмент редактирования генома. В 2014 году MIT Technology Review назвал его «самым большим биотехнологическим открытием века». Он основан на защитной системе бактерий, которые производят специальные ферменты, позволяющие им защищаться от вирусов.
«Каждый раз, когда бактерия убивает вирус, она разрезает остатки его генома, будь то ДНК или РНК, и сохраняет их внутри последовательности CRISPR, как в архив. Как только вирус атакует снова, бактерия использует информацию из «архива» и быстро производит защитные белки Cas9, в которых заключены фрагменты генома вируса. Если вдруг эти фрагменты совпадают с генетическим материалом нынешнего атакующего вируса, Cas9 как ножницами разрезает захватчика, и бактерия снова в безопасности», — поясняет Алевтина Федина, медицинский директор Checkme.
Уникальное открытие состоялось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье обнаружили, что белок Cas9 можно обмануть. Если дать ему искусственную РНК, синтезированную в лаборатории, то он, найдя в «архиве» соответствие, нападет на нее. Таким образом, с помощью этого белка можно резать геном в нужном месте — и не просто резать, а еще и заменять другими генами.
Теоретически, технология CRISPR может позволить редактировать любую генетическую мутацию и излечивать заболевание, которое она вызывает. Но практические разработки CRISPR в качестве терапии еще только в начальной стадии, и многое еще непонятно.
Есть и другие методы генной инженерии, например, ZFN и TALEN.
- ZFN разрезает ДНК и вставляет туда заготовленный заранее новый фрагмент с помощью белков с ионами цинка (отсюда название — Zinc Finger Nuclease).
- TALEN делает то же самое, только используя TAL-белки. Для обеих технологий приходится создавать отдельные белки, а это очень долгая работа, поэтому пока два этих метода особого применения не нашли.
Где и как применяется генная инженерия
Медицина
Уже сейчас активно применяется инсулин человека (хумулин), полученный посредством рекомбинантных ДНК. Клонированные гены человеческого инсулина были введены в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали. С 1982 года компании США, Японии, Великобритании и других стран производят генно-инженерный инсулин.
Кроме того, несколько сотен новых диагностических препаратов уже введены в медицинскую практику. Среди лекарств, находящихся в стадии клинического изучения, препараты, потенциально лечащие артрозы, сердечно-сосудистые заболевания, онкологию и СПИД. Среди нескольких сотен генно-инженерных компаний 60% заняты именно разработкой и производством лекарственных и диагностических средств.
«В медицине среди достижений генной инженерии сегодня можно выделить терапию рака, а также другие фармакологические новинки — исследования стволовых клеток, новые антибиотики, прицельно бьющие по бактериям, лечение сахарного диабета. Правда, пока все это на стадии исследований, но результаты многообещающие», — говорит Алевтина Федина.
Сельское хозяйство
В сельском хозяйстве одна из важнейших задач генной инженерии — получение растений и животных, устойчивых к вирусам. В настоящее время уже есть виды, способные противостоять воздействию более десятка различных вирусных инфекций.
Еще одна задача связана с защитой растений от насекомых-вредителей. Путем генетической модификации растений можно уменьшить интенсивность обработки полей пестицидами. Например, трансгенные растения картофеля и томатов стали устойчивы к колорадскому жуку, растения хлопчатника — к разным насекомым, в том числе и к хлопковой совке.
Использование генной инженерии позволило сократить применение инсектицидов (препаратов для уничтожения насекомых) на 40–60%.
Благодаря генной инженерии зерновые культуры стали более устойчивы к климатическим условиям, кроме того появилась возможность увеличить количество витаминов и полезных веществ в продукте. Например, можно обогатить рис витамином «А» и выращивать его в тех регионах, где люди имеют массовую нехватку этого элемента.
С помощью генной инженерии пытаются решить и экологические проблемы. Так, уже созданы особые сорта растений с функцией очистки почвы. Они поглощают цинк, никель, кобальт и иные опасные вещества из загрязненных промышленными отходами почв.
Скотоводство
В Кемеровской области работа генетиков позволила получить устойчивое к вирусу лейкоза племенное поголовье высокопродуктивных животных. Для проведения эксперимента кузбасские ученые отобрали здоровых коров черно-пестрой породы массой до 500 кг. Животным трансплантировали модифицированные эмбрионы, устойчивые к вирусу лейкоза. В середине сентября 2020 года родилось 19 телят с измененными генами.
«В месячном возрасте была проведена оценка, которая показала, что телята отличаются от своих сверстников только устойчивостью к вирусу. Пять особей отобрали для дальнейшей селекционной работы. Это позволит закрепить наследственные признаки устойчивости к вирусу лейкоза у последующих поколений», — пояснила руководитель проекта, доктор биологических наук, профессор кафедры зоотехнии Кузбасской ГСХА Татьяна Зубова.
По словам Зубовой, лейкоз крупного рогатого скота — вирусная хронически неизлечимая болезнь, при которой возникают поражение кроветворной системы и новообразования. Данное заболевание наносит значительный ущерб генофонду пород и мясной промышленности в целом, потому что мясо зараженных животных запрещено употреблять в пищу. Единственным доступным методом борьбы с лейкозом ранее было только уничтожение зараженного скота.
Этот успех позволяет говорить о том, что в дальнейшем будет возможно редактировать гены крупного рогатого скота и от других болезней.
С прицелом на человека
В 2009 году группа ученых под руководством молодого исследователя Джея Нейтца из Вашингтонского университета сумели с помощью генной терапии вернуть обезьянам способность различать оттенки зеленого и красного, которой они были лишены от рождения.
В область сетчатки глаза двух подопытных обезьян был введен безвредный вирус, несущий недостающий ген фоточувствительного рецептора. Вскоре после процедуры обе обезьяны начали различать оттенки красного и зеленого на сером фоне. Два года наблюдения не выявили у них каких-либо нарушений, поэтому ученые не исключают, что данную методику уже вскоре можно будет применять у людей, страдающих дальтонизмом.
Ученые шагнули еще дальше и уже пробуют выращивать в теле животных органы для трансплантации людям. Для минимизации риска отторжения тканей животным вводят специальные гены. Этими опытами занимается научная лаборатория Рослинского института в Великобритании, которая представила миру овцу Долли.
В 2019 году британские ученые вывели кур, яйца которых содержат два вида человеческих белков, способных противодействовать артриту и некоторым видам онкологических заболеваний. В яйцах содержится человеческий белок под названием IFNalpha2a, обладающий мощными противовирусными и противораковыми свойствами, а также человеческий и свиной вариант белка под названием макрофаг-CSF, который планируют использовать для создания препарата, стимулирующего самостоятельное заживление поврежденных тканей.
Изменение ДНК человека
Первые клинические испытания методов генной терапии были предприняты 22 мая 1989 года с целью генетического маркирования опухоль-инфильтрующих лимфоцитов в случае прогрессирующей меланомы.
14 сентября 1990 года в Бетесде (США) четырехлетней девочке, страдающей наследственным иммунодефицитом, обусловленным мутацией в гене аденозиндезаминазы (АDA), были пересажены ее собственные лимфоциты.
Работающая копия гена ADA была введена в клетки крови с помощью модифицированного вируса, в результате чего клетки получили возможность самостоятельно производить необходимый белок. Через шесть месяцев количество белых клеток в организме девочки поднялось до нормального уровня.
После этого область генной терапии получила толчок к дальнейшему развитию. С 1990-х годов сотни лабораторий ведут исследования по использованию генной терапии для лечения различных заболеваний. Уже сегодня с помощью генной терапии можно лечить диабет, анемию и некоторые виды онкологии.
Генная терапия
Генная терапия — введение, удаление или изменение генетического материала, в частности ДНК или РНК, в клетке пациента для лечения определенного заболевания.
Существует три основных стратегии использования генной терапии:
- Замена мутировавшего гена, вызывающего заболевание, здоровой копией.
- Инактивация или «выбивание» мутировавших генов, которые функционируют неправильно.
- Введение нового гена в организм, помогающего бороться с болезнью.
Наиболее часто применяемый метод включает вставку «терапевтического» гена для замены «ненормального» или «вызывающего болезнь».
В 2015 году впервые была проведена процедура изменения ДНК человека с целью продления молодости клеток, когда американке Элизабет Пэрриш 44 лет ввели в организм препарат, влияющий на ДНК, а в 2018 году китайский ученый Хэ Цзянькуй заявил, что с его помощью у двух детей-близнецов якобы изменены гены для выработки у них иммунитета к вирусу ВИЧ, носителем которого являлся их отец.
Все это, с одной стороны, выглядит грандиозно и обнадеживает, но с другой, — вызывает опасения, ведь генетические манипуляции, теоретически, возможно использовать не только в благих и мирных целях.
После эксперимента с ДНК близнецов в Китае, ЮНЕСКО выступила с инициативой о запрете изменения генов у новорожденных до того момента, пока достоверно не будет доказана безопасность таких манипуляций.
Этическая сторона вопроса
В 1997 году ЮНЕСКО выпустила Всеобщую декларацию о геноме человека и его правах, рекомендовав мораторий на генетическое вмешательство в зародышевую линию человека, а в декабре 2015 года на международном саммите по геномному редактированию человека изменение гаметоцитов и эмбрионов для генерации наследственных изменений у людей было объявлено безответственным.
Российское сообщество генетиков в большинстве своем считает, что такие эксперименты на данный момент преждевременны и требуют более глубокого исследования и обсуждений.
«Вопрос клонирования уже давно стоит на горизонте. Этично ли выращивать клонов, чтобы потом забирать их органы для трансплантации человеку… Большой вопрос. Само собой, это абсолютно нормально, что нет единой точки зрения, ведь смысл подобных дискуссий как раз в том, чтобы найти правильные формулировки и отрегулировать потенциально спасительное, но при этом очень опасное знание», — говорит Алевтина Федина.
Страх неизвестности
Вариантов развития событий в области генной инженерии существует множество, и далеко не все они изучены и, в принципе, известны. Поэтому они должны быть последовательно зафиксированы и регламентированы.
Естественно, больше всего опасений вызывают плохие сценарии развития событий. Как правило, все начинается с помощи людям и изобретения новых лекарств. Но потом человек может прийти к желанию сделать своего ребенка светловолосым и зеленоглазым или создать армию универсальных солдат, не боящихся боли и не ведающих страха.
Олег Долгицкий, социальный философ, отмечает, что современное общество настолько неоднородно в культурном и экономическом плане, что любые методы, способные существенно изменить геном, могут создать условия не только для классового, но и видового расслоения, где представители «первого мира» смогут существенно продлевать свою жизнь и не бояться никаких болезней, в отличие от менее богатых людей. Это является серьезнейшей почвой для конфликтов и столкновений.
Эксперты убеждены, что генная инженерия — это будущее медицины. Возможность избавить младенца от пожизненного гнета заболевания, излечить людей от рака, найти лекарство против ВИЧ — за всем этим будет стоять генная инженерия. При этом желание человека изменить, например, цвет глаз или предотвратить наследственное заболевание, несмотря на все риски, будет только расти. И похоже, что остановить этот процесс уже не представляется возможным.
Источник