При изучении органической химии, отличающейся сложностью своих закономерностей, первое и основное, что следует понять — свойства и законы гомологических рядов.
Гомология, гомологи, гомологический ряд — определения и примеры
Гомология — химическое явление, при котором соединения отличаются друг от друга на определённое количество групп, обладают сходной характеристикой и проявляют похожие свойства.
Гомологический ряд — последовательность однотипных органических соединений, каждое из последующих имеет с предыдущим определённую гомологическую разность. При этом свойства веществ, состоящих в рядах, то есть гомологов, изменяются с определённой закономерностью.
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
-
этин — C2H2;
-
пропин — C3H4;
-
бутин — C4H6;
-
пентин — C5H8 и т. д.
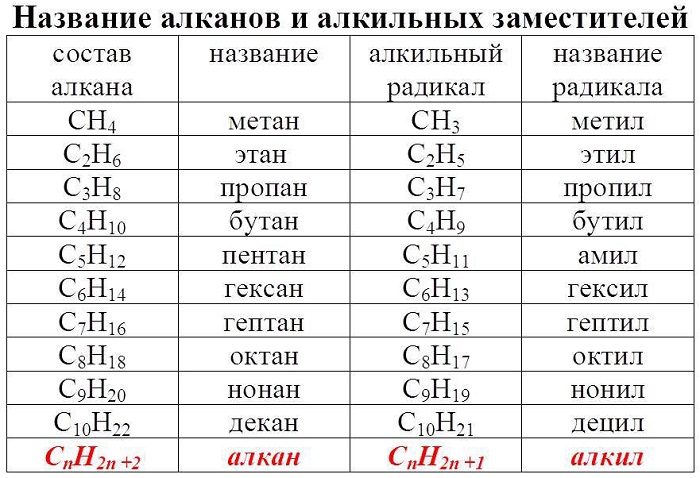
Гомологический ряд алканов в таблице
Алканы — ациклические предельные углеводороды:
-
всеобщая формула алканов — СnH2n+2;
-
названия веществ имеют суффикс -ан-.
Алканы обладают следующими свойствами:
-
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
-
нерастворимы в воде, но могут растворяться в неполярных растворителях;
-
используются в промышленности (метан — топливо, пропан — автомобильное топливо, бутан — сырье для производства каучука, пропан и бутан — балонные газы).
|
Метан |
СН4 |
|
Этан |
С2Н6 |
|
Пропан |
С3Н8 |
|
Бутан |
С4Н10 |
|
Пентан |
С5Н12 |
|
Гексан |
С6Н14 |
При изучении алканов стоит обращать внимание на их изомеры. Например, структурным изомером бутана является метилпропан, а пентана — метилбутан.
Алканы могут вступать в следующие реакции:
-
Горение в кислороде: СН4 + 2О2 = СО2 + 2Н2О.
-
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
-
Разложение при высокой температуре: СН4 = C + 2H2.
Гомологический ряд алкенов в таблице
Алкены — углеводороды, имеющие ациклический непредельный характер.
Краткая характеристика:
-
общая формула — CnH2n;
-
имеют суффикс -ен-.
Алкены обладают следующими свойствами:
-
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
-
имеют очень высокую температуру плавления и кипения;
-
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
|
Этилен |
C2H4 |
|
Пропен |
C3H6 |
|
Бутен |
C4H8 |
|
Пентен |
C5H10 |
|
Гексен |
C6H12 |
Алкены участвуют в следующих химических реакциях:
-
Горение в кислороде: C2H4 + 3O2 = 2CO2 + H2O.
-
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
-
Присоединение к водороду (гидрирование): CH2=CH-CH3 + H2 = CH3-CH2-CH3.
-
Гидратация (присоединение к воде): CH2=CH2 + H2O = CH3-CH2OH.
-
Полимеризация: nCH2=CH2 = (-CH2-CH2-) * n.
Гомологический ряд альдегидов
Альдегиды — органические вещества, имеющие в своём составе группу -CHO.
Делятся на насыщенные и алифатические насыщенные, общая молекулярная формула первых — СnH2nO, вторых — СnH2n+1CHO соответственно.
Названия составляются с помощью суффикса -аль-.
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
-
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
-
Присоединение спиртов: CH3-CH = O + C2H5OH = CH3-CH(OH)-O-C2H5.
-
Присоединение аминов: C6H5CH = O + H2NC6H5 = C6H5CH = NC6H5 + H2O.
-
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
-
низшие представители класса имеют резкий запах;
-
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
-
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.
Гомологи – это вещества близкие по строению и свойствам, которые
отличаются на одну или несколько групп – СН2.
Каждый класс органических соединений имеет свою общую формулу и для
каждого класса органических соединений можно составить их гомологический ряд.
Например, алканы имеют общую
формулу CnH2n+2, где n –
число атомов углерода, причём каждый член гомологического ряда будет отличаться
от предыдущего на группу – СН2. Такая последовательность соединений
называется гомологическим рядом (от греческого homolog – «сходный»), отдельные
члены этого ряда называются гомологами, а группа атомов, на которую
отличаются соседние гомологи (группа – СН2) – гомологической
разностью.
Гомологический ряд легко построить, для этого нужно к каждому последующему
представителю добавить один атом углерода и 2 атома водорода, то есть группу –
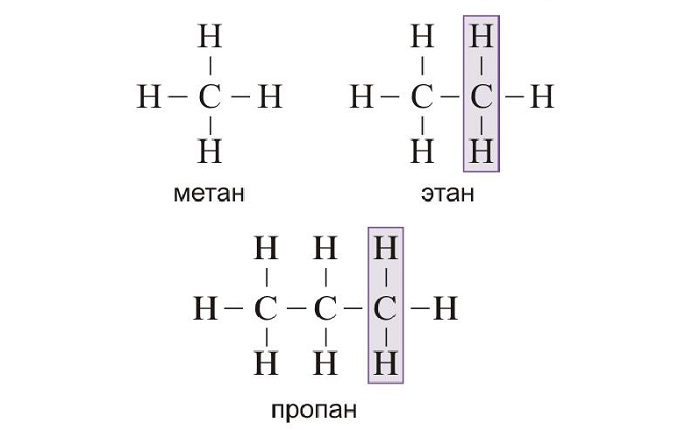
СН2. Так, первым представителем алканов
является метан – СН4 содержит один атом углерода (Н – СН2
– Н). Второй член гомологического ряда, у которого 2 атома углерода – этан – С2Н6
(Н – СН2 – СН2 – Н). Третий член гомологического – С3Н8, у него 3 атома углерода и он отличается
от предыдущего на группу – СН2 (Н – СН2 – СН2
– СН2 – Н). Четвёртый представитель гомологического ряда алканов также отличается от предыдущего на группу – СН2,
у него уже четыре атома углерода (Н – СН2 – СН2 – СН2
– СН2 – Н).
Понятно, что гомологи отличаются молярной массой, а значит физическими
свойствами. Как правило, с увеличение числа атомов углерода в молекуле
увеличиваются температуры кипения и плавления, увеличивается плотность.
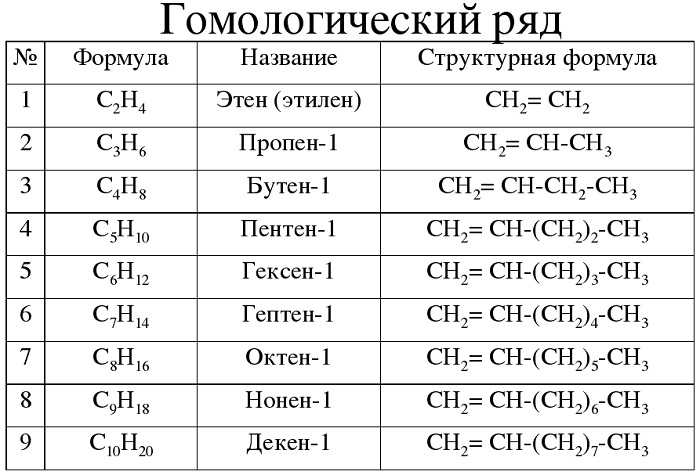
Для алкенов характерна общая формула СnH2n. Первый член
гомологического ряда имеет формулу С2Н4 и называется этен, второй представитель алкенов
– пропен – С3Н6, третий –
бутен-1,четвёртый – пентен-1. И так далее, то есть в
данном гомологическом ряду также каждый последующий член гомологического ряда
отличается от предыдущего на группу – СН2.
Для алкинов также можно составить
гомологический ряд. Общая формула алкинов – СnH2n-2, поэтому первым
представителем этого ряда будет этин, али ацетилен –
С2Н2, вторым членом ряда является пропин
– С3Н4, третим – бутин-1 – С4Н6,
четвёртым – пентин-1 – С5Н8.
Общая формула спиртов – СnH2n+1OH. Первым членом
гомологического ряда спиртов является метанол – СН3ОН, или метиловый
спирт, затем С2Н5ОН – этанол, или этиловый спирт, третьим
представителем ряда спиртов является пропанол-1, или пропиловый
спирт – С3Н7ОН, четвёртым – бутанол-1, или бутиловый
спирт – С4Н9ОН, пятым – пентанол-1, или амиловый спирт –
С5Н11ОН. Таким образом, в этом гомологическом ряду каждый
последующий представитель отличается от предыдущего на группу -СН2.
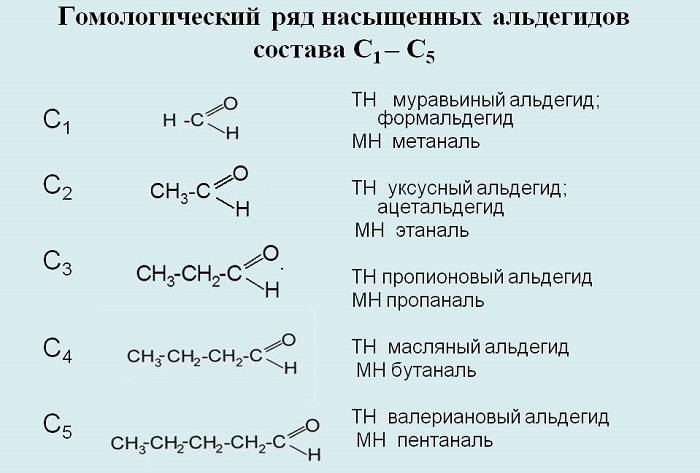
Составим гомологический ряд альдегидов. Учитывая, что общая формула альдегидов
СnH2n+1CHO, то первым
представителем данного гомологического ряда будет метаналь,
или муравьиный альдегид – НСОН, вторым членом ряда – этаналь,
или уксусный альдегид – СН3СНО, третьим – пропаналь,
или пропионовый альдегид – СН3СН2СНО,
четвёртым – бутаналь, или масляный альдегид – СН3СН2СН2СНО
и так далее.
Аналогично и для карбоновых кислот. Так, общая формула насыщенных
одноосновных карбоновых кислот – CnH2n+1COOH. Поэтому первым
представителем данного гомологического ряда является метановая кислота, или
муравьиная – НСООН, вторым – этановая кислота, или
уксусная – СН3СООН, третьим – пропановая,
или пропионовая кислота – СН3СН2СООН,
четвёртым – бутановая, или масляная кислота – СН3СН2СН2СООН,
пятым – пентановая, или валериановая кислота – СН3СН2СН2СН2СООН.
Таким образом, для каждого класса органических соединений можно составить
гомологический ряд, учитывая общую формулу данного класса. Каждый последующий
член гомологического ряда отличается от предыдущего на группу – СН2,
которую называют гомологической разность. А сами вещества этого ряда называются
гомологами. Как правило, с увеличением числа атомов углерода в гомологическом
ряду увеличиваются температуры плавления и кипения, увеличивается плотность.
Классификация органических соединений
В основу классификации органических веществ положены различия в строении углеродных цепей. В соответствии с этим все органические вещества делятся на ациклические и циклические.
Ациклические (алифатические) – соединения с открытой (незамкнутой) цепью углеродных атомов.
Ациклические соединения, в свою очередь, подразделяются на
-
Предельные (алканы),
-
Непредельные (алкены, алкины, диеновые углеводороды)
Циклические – соединения, в молекулах которых углеродные атомы замкнуты в кольцо.
-
Карбоциклические – если цикл образован только углеродными атомами,
-
Гетероциклические – если в состав цикла помимо углеродных атомов входят атомы других химических элементов (азота, кислорода, серы)
Карбоциклические соединения, в свою очередь, подразделяются алициклические (циклоалканы) и ароматические (соединения, содержащие в составе молекулы одно или несколько бензольных колец).
Классификация органических соединений по строению углеродной цепи представлена в следующей таблице.
В учебнике «Фоксфорд»
Углерод соединяется друг с другом одинарными и кратными связями (двойными и тройными), образуя прямые, разветвлённые и замкнутые цепи.
А) Прямая (неразветвлённая) цепь:
CH3 – CH2 – CH2 – CH3
СH2 = CH – CH2 – CH3
CH ≡ C – CH2 – CH3
CH2 = CH – CH = CH2
Б) Разветвлённая цепь:
К циклическим относятся карбоциклические – содержащие в цикле только атомы углерода и гетероциклические соединения – содержащие в цикле кроме атомов углерода атомы других элементов – кислорода, азота и др.
Функциональные производные углеводородов
Функциональная группа – структурный фрагмент молекулы, единый для конкретного гомологического ряда и определяющий характерные химические свойства данного класса соединений.
( -R или -СnH2n+1) — это углеводородный радикал, частица, образующаяся при отрыве атома водорода от молекулы предельного углеводорода (алкана)
Например,
-СН3 метил; -С2Н5 этил.
Среди многообразия органических соединений можно выделить группы веществ, которые сходны по химическим свойствам и отличаются друг от друга на группу -СН2.
Гомологи – это соединения, сходные по химическим свойствам, состав которых отличается друг от друга на одну или несколько групп -СН2.
Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд.
Гомологическая разность – это группы -СН2.
Примером гомологического ряда может служить ряд предельных углеводородов (алканов).
Простейший его представитель – метан СН4.
Формула любого последующего гомолога может быть получена прибавлением к формуле предыдущего углеводорода гомологической разности.
Состав молекул всех членов гомологического ряда может быть выражен одной общей формулой, например, СnН2n+2, где n – число атомов углерода.
Гомологические ряды могут быть построены для всех классов органических соединений. Зная свойства одного из членов гомологического ряда, можно сделать выводы о свойствах других представителей того же ряда. Это обусловливает важность понятия гомологии при изучении органической химии.
Примеры гомологических рядов алканов
Примеры гомологических рядов спиртов и альдегидов
Гомологи. Гомологический ряд
Органические вещества разных классов тесно взаимосвязаны.
Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства.
Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд.
Гомологи – это вещества, которые входят в один и тот же гомологический ряд.
Группу –СH2– называют гомологической разностью.
| Например, 2-метилбутан и 2-метилпентан являются гомологами: | |
 |
 |
Оглавление
Алгоритм 1. Составление названия
углеводородов по систематической номенклатуре
Алгоритм 2.
Составление изомеров и гомологов для органического вещества
Алгоритм 3.
Составление названия производных углеводородов по систематической номенклатуре
Алгоритм 4.
Составление названия аминов и аминокислот по систематической номенклатуре
Алгоритм 5.
Решение расчетных задач на вывод молекулярной формулы вещества по массовым
долям элементов
Алгоритм 6.
Вычисление массы вещества по известной массе другого вещества, участвующего в
реакции.
Алгоритм 7.
Решение задач на выход продукта реакции
Алгоритм
8
— Расчёты по термохимическим уравнениям (ТХУ)
Алгоритм 1. Составление названия
углеводородов по систематической номенклатуре
Задание
1. Назвать вещество
по систематической номенклатуре:
Решение
1. Выбрать
главную цепь (наиболее длинная цепь углеродных атомов):
2. Пронумеровать
атомы углерода в главной цепи с того конца, к которому ближе стоит
заместитель (углеводородный радикал – ответвление главной цепи):
Если присутствуют кратные связи (С=С, С=С), то нумерация
цепи начинается с того края, к которому ближе кратная связь.
3. Последовательно
назвать:
1) номер
углеродного атома, с которым связан радикал (ответвление)
2) назвать
сам радикал (СН3 – метил, С2Н5 – этил);
Если
радикалов несколько, то перечисляем цифры, в случае одинаковых радикалов,
поставив перед названием радикала приставку -ди, -три и т.д.;
Если
радикалы разные, то называем сначала старший радикал (метил), а потом остальные
по старшинству.
3) углеводород,
которому соответствует длинная цепь: (см. гомологический ряд алканов –
приложение 1)
Если
есть кратные связи, то меняем суффикс –ан, на -ен (в случае двойной связи),
на ин (в случае тройной связи), на –диен (в случае двух двойных связей)
4. В
нашем примере получаем название, которое записываем в одну строчку:
2-метилбутан
Алгоритм 2. Составление изомеров и
гомологов для органического вещества
Алгоритм 2.1. Составление формул
изомеров
Задание. Составить формулы изомеров пентана С5Н12.
Решение
1.
Записать углеродные скелеты изомеров, уменьшая число атомов углерода в
основной цепи, таким образом разветвляя углеродную цепь:
2.
Расставить атомы водорода и представить структурные формулы в сокращенном
виде:
Алгоритм 2.2. Составление формул
гомологов
Задание. Составить формулы двух гомологов для вещества, имеющего
строение:
Решение
1.
Составляя формулы гомологов, увеличиваем или уменьшаем число групп СН2 в
основной цепи, сохраняя строение (разветвление).
Приведены
два низших гомолога:
Алгоритм 3. Составление названия производных
углеводородов по систематической номенклатуре
Задание
1. Назвать вещество
по систематической номенклатуре:
СН3
– СН – СН2 – СН2 – ОН
СН3
Решение
1. Выбрать
главную цепь (наиболее длинная цепь углеродных атомов):
СН3
– СН – СН2 – СН2 – ОН
СН3
2. Пронумеровать
атомы углерода в главной цепи с того конца, к которому ближе стоит функциональная
группа (названия функциональных групп – смотри в приложении 2):
С4Н3
– С3Н – С2Н2 – С1Н2
– ОН
СН3
3. Последовательно
назвать:
1) номер
углеродного атома, с которым связан радикал (ответвление)
2) назвать
сам радикал (СН3 – метил, С2Н5 – этил);
Для
спиртов принято устанавливать цифрой после суффикса функциональной группы –
номер атома углерода, при котором расположена функциональная группа.
Если
радикалов несколько, то перечисляем цифры, в случае одинаковых радикалов,
поставив перед названием радикала приставку -ди, -три и т.д.;
Если
радикалы разные, то называем сначала старший радикал (метил), а потом
остальные по старшинству.
3) углеводород,
которому соответствует длинная цепь: (см. гомологический ряд алканов –
приложение 1)
4. В
нашем примере получаем название, которое записываем в одну строчку:
3-метилбутанол-1
Алгоритм 4. Составление названия аминов
и аминокислот по систематической номенклатуре
Задание
1. Назвать вещество
по систематической номенклатуре:
СН3 – СН – СН – СН2 – СООН
СН3 NH3
Решение
1. Выбрать
главную цепь (наиболее длинная цепь углеродных атомов):
СН3 – СН – СН – СН2 – СООН
СН3 NH3
2. Пронумеровать
атомы углерода в главной цепи с того конца, к которому ближе стоит функциональная
группа (если амин – то ориентируемся на аминогруппу, если кислота, то на
карбоксильную группу):
С5Н3 – С4Н – С3Н2
– С2Н2 – С1ООН
СН3 NH3
3. Последовательно
назвать:
1) номер
углеродного атома, с которым связан радикал (ответвление)
2) назвать
сам радикал (СН3 – метил, С2Н5 – этил);
Для
спиртов принято устанавливать цифрой после суффикса функциональной группы –
номер атома углерода, при котором расположена функциональная группа.
Если
радикалов несколько, то перечисляем цифры, в случае одинаковых радикалов,
поставив перед названием радикала приставку -ди, -три и т.д.;
Если
радикалы разные, то называем сначала старший радикал (метил), а потом
остальные по старшинству.
3) углеводород,
которому соответствует длинная цепь: (см. гомологический ряд алканов –
приложение 1)
Если
2 карбоксильные группы, то указать суффикс – ди (диовая кислота), если 2
аминогруппы, то указать цифры аминогруппы и приставку – ди (2,3-диамин-).
4. В
нашем примере получаем название, которое записываем в одну строчку:
3-амино,3-метилпентановая
кислота
Алгоритм 5. Решение расчетных задач на
вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества,
содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества
по азоту равна 1,57.
Решение
1. Записать условие
задачи.
2. Вычислить
относительную молекулярную массу Mr(CхHy)
по относительной плотности:
1.
3. Найти индексы х и y по
отношению :
2.
4. Записать простейшую
формулу: С3Н8.
Проверка: Мr(C3H8)
= 44, следовательно, C3H8 – истинная формула.
Задача
2. При сжигании 5,6
л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.)
углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна
1,875 г. Найти его молекулярную формулу.
Решение
1.
Записать условие задачи.
2.
Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m =
42 г, M = 42 г/моль.
3.
Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4.
Найти количества веществ воды и водорода:
(H2O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5.
Найти сумму масс углерода и водорода:
m(C)
+ m(H) = 0,75•12 +1,5•1 = 10,5 г.
6.
Найти массу сожженного вещества:
Следовательно,
вещество содержит только углерод и водород.
7.
Найти простейшую формулу углеводорода CхHy:
(C) :
(H)
= 0,75 : 1,5 = 1 : 2,
следовательно,
простейшая формула – СН2.
8.
Найти истинную формулу углеводорода:
Mr(CH2)
= 14,
Mr(в—ва) : Mr(CH2)
= 42 : 14 = 3,
следовательно,
истинная формула – С3Н6.
Алгоритм 6. Вычисление массы вещества
по известной массе другого вещества, участвующего в реакции.
Пример. Вычислите
массу оксида меди (I), если
в реакцию с кислородом вступает медь массой 19,2г.
|
Последовательность выполнения действий |
Оформление задачи |
|
1. |
Дано: m(Cu)=19,2г Найти: m(Cu2O)=? |
|
2. |
4 Cu + O2 = 2 Cu2O |
|
3. |
М(Cu)=64г/моль М |
|
4. дана |
|
|
5. |
|
|
6. составим |
|
|
7. Посчитаем массу искомого вещества по формуле. Запишем ответ |
m(Cu2O)= 0,15 моль * 144гмоль = 21,6 г Ответ: |
Алгоритм 7. Решение задач на выход
продукта реакции
Алгоритмы решения
задач трёх типов на выход продукта реакции:
А. Определение
выхода продукта в % от теоретически возможного.
1. Запишите уравнение
химической реакции и расставьте коэффициенты.
2. Под формулами
веществ напишите количество вещества согласно коэффициентам.
3. Практически
полученная масса известна.
4. Определите
теоретическую массу.
5. Определите выход
продукта реакции (%), отнеся практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Б. Расчет массы
продукта реакции, если известен выход продукта.
1. Запишите “дано” и
“найти”, запишите уравнение, расставьте коэффициенты.
2. Найдите
теоретическое количество вещества для исходных веществ. n =
3. Найдите
теоретическое количество вещества продукта реакции, согласно коэффициентам.
4. Вычислите
теоретические массу или объем продукта реакции.
m = M * n
или V = Vm * n
5. Вычислите
практические массу или объем продукта реакции (умножьте массу теоретическую или
объем теоретический на долю выхода).
В. Расчет массы
исходного вещества, если известны масса продукта реакции и выход продукта.
1. По известному
практическому объёму или массе, найдите теоретический объём или массу
(используя долю выхода продукта).
2. Найдите
теоретическое количество вещества для продукта.
3. Найдите
теоретическое количество вещества для исходного вещества, согласно
коэффициентам.
4. С помощью теоретического
количества вещества найдите массу или объем исходных веществ в реакции.
Алгоритм 8 — Расчёты по термохимическим уравнениям (ТХУ)
Задача 3.
При сжигании
магния массой 3г выделяется 75,15кДж теплоты. Составьте термохимическое
уравнение реакции горения магния.
Алгоритм
решения
1. Составим
химическое уравнение реакции горения магния:
2Mg + O2 =
2MgO
2. Вычислим
количество вещества магния:
3. Над
формулами веществ надпишем ν(Mg) и 75,15 кДж, а
под формулой – соотношение, отображаемое уравнением реакции
4. Решая
пропорцию, находим тепловой эффект (Q = х)
реакции:
Ответ:
термохимическое уравнение имеет вид: 2Mg + O2 =
2MgO +
1202,4кДж