Микозы желудочно-кишечного тракта — патологические состояния, развившиеся вследствие поражения пищеварительных органов дрожжеподобными, плесневыми, диморфными грибами. Проявляются изменением вкуса, появлением налетов на видимых слизистых, диспепсией, жидким стулом, болевыми ощущениями разной локализации. Диагностируются с помощью эзофагогастродуоденоскопии, колоноскопии, электрогастрографии, микробиологического исследования биоптата, ИФА, РИФ, ПЦР. Для лечения используют антимикотики, пробиотики, иммуномодуляторы в сочетании с комплексной терапией основного заболевания, осложнившегося грибковой инфекций.
Общие сведения
Первые упоминания о специфическом поражении слизистой ротовой полости у ослабленных больных относятся к временам Гиппократа. Детальное описание орофарингеальной формы кандидозной инфекции было впервые подготовлено германским хирургом Бернгардом Лангенбеком в 1839 году. Микозы пищеварительного тракта выявляются у 8-10% пациентов, страдающих желудочно-кишечными болезнями. У 63% больных поражение ЖКТ протекает в виде кандидо-бактериальной, кандидо-герпетической, кандидо-протозойной микст-инфекции. Увеличение частоты микотических патологий связано с эпидемией ВИЧ, ростом распространенности миконосительства, заболеваний с вторичным иммунодефицитом, успехами фармакологии, предложившей эффективные иммуносупрессорные и антибактериальные средства для ранее труднокурабельных патологий.
Микозы желудочно-кишечного тракта
Причины микозов желудочно-кишечного тракта
Возбудителями микотической инфекции органов ЖКТ становятся плесневые, дрожжеподобные, диморфные грибы, в большинстве случаев являющиеся естественными комменсалами человеческого организма. 9 из 10 микозов пищеварительного тракта провоцируется Candida albicans — условно-патогенным микроорганизмом, который высеивается у 65-70% населения. Микотический процесс также может развиться в результате размножения так называемых кандид non-albicans (С. guilliermondii, С. kefyr, С. krusei, С. tropicalis и др.). Некандидозные формы микотических желудочно-кишечных болезней, вызванные возбудителями бластомикоза, гистоплазмоза, кокцидиомикоза, криптококкоза, паракокцидиомикоза, споротрихоза, возникают при диссеминации грибов из очагов на коже, в респираторном тракте, других органах. Аспергиллез пищеварительных органов, интестинальный зигомикоз диагностируются редко, обычно – при наличии тяжелой сопутствующей патологии.
Манифестации микозов часто предшествуют другие патологические состояния, способствующие патологической активации условно-патогенной флоры за счет снижения местной защитной реакции слизистой ЖКТ, угнетения иммунных сил организма. Специалисты в сфере гастроэнтерологии и микологии выделяют следующие предпосылки к развитию желудочно-кишечного микотического заболевания:
- Физиологическая иммунная недостаточность. Естественное снижение иммунитета наблюдается у беременных, связано с необходимостью поддержания гестации. Незрелость иммунной системы характерна для новорожденных, риск инфицирования возрастает при недоношенности и наличии генитального кандидоза у матери. В пожилом возрасте отмечается инволютивное угасание защитных сил.
- Патологический иммунодефицит. Несостоятельность иммунной системы лежит в основе ВИЧ-инфекции и ее клинически выраженной формы — СПИД. Нарушения иммунитета отмечаются при дисплазии тимуса, других первичных иммунодефицитах, онкогематологических и лимфопролиферативных болезнях (лейкозах, лимфогранулематозе, неходжкинских лимфомах), сахарном диабете, голодании.
- Ятрогенные факторы. Иммунная функция угнетается при использовании кортикостероидов, цитостатиков, других химиопрепаратов у пациентов, перенесших трансплантацию органа, принимающих лечение по поводу онкопатологии, ревматоидного артрита, СКВ, гломерулонефрита, других системных болезней. Развитию микозов способствует антибактериальная терапия.
- Повреждения слизистой оболочки ЖКТ. Инвазии грибов более подвержены больные, страдающие атрофическим гастритом, ахалазией кардии, бульбитом, гастроэзофагеальной рефлюксной болезнью, дисбиозом, болезнью Крона, другой желудочно-кишечной патологией. Инфицирование облегчается при ожогах, травматизации эпителия зубными протезами, твердой пищей, интубационной трубкой.
Патогенез
Механизм развития микозов желудочно-кишечного тракта основан на нарушении баланса между реактивностью организма и факторами патогенности грибов — протеолитическими ферментами инвазии (коагулазой, каталазой, козеиназой, фосфолипазой), фибриллярными белковыми комплексами, эндотоксинами. При иммунодефиците уменьшается активность интраэпителиальных лимфоцитов, В-клеток кишечника, снижается цитотоксичность Т-клеточных элементов, нарушается секреция интерферона, фагоцитоз. В результате возбудители микозов быстро обсеменяют эпителий, легко проникают через собственную пластинку слизистой, агрегируются в пейеровых бляшках.
При травмах, химических ожогах, заболеваниях пищеварительных органов, изменениях кислотности и ферментативного состава желудочного, кишечного соков ситуация усугубляется наличием участков пораженной слизистой, замедленной регенерацией эпителиальных клеток, нарушением защитной функции естественных секретов. У пациентов, принимающих антибиотики, дополнительным патогенетическим фактором становится гибель облигатных микроорганизмов (кишечной палочки, аэробных лактобацилл, анаэробных бифидобактерий), которые являются естественными антагонистами грибов и сдерживают их неконтролируемое размножение.
Классификация
При систематизации форм микотической инфекции ЖКТ учитывают вид возбудителя, локализацию и распространенность патологического процесса. С учетом этиологии различают кандидоз, являющийся самым частым видом микозов, и редкие формы грибкового поражения (аспергиллез, криптококкоз, зигомицетоз и др.). При поражении одного отдела пищеварительного тракта говорят о фокальном микозе, при массивном распространении инфекции — об инвазивном диффузном, при отсутствии признаков инвазии — о микотическом дисбиозе. Наиболее часто используют классификацию микозов по локализации поражения, в соответствии с которой выделяют:
- Орофарингеальные поражения. В структуре микотических инфекций ЖКТ занимают первое место. Обычно встречаются у новорожденных и пациентов с иммунодефицитными состояниями (СПИД, гемобластозы).
- Микотический эзофагит. Диагностируется у 1-7% больных. Чаще развивается при сниженном иммунитете. Может протекать как в поверхностной, так и в эрозивной форме с повышенной кровоточивостью.
- Микотические поражения желудка. Составляют до 5,2% микозов ЖКТ. Выявляются при гастродуоденальных язвах, хронических гастритах. В ряде случаев определяются ассоциации грибов и хеликобактера.
- Микозы кишечника. Обычно возникают на фоне микотического поражения верхних отделов пищеварительного тракта. Как правило, диагностируются у больных, получающих массивную антибиотикотерапию.
- Микотическая инфекция гепатобилиарной системы. Осложняет дискинезию желчных путей, холестаз, холецистолитиаз, лямблиоз. Диагностируется редко, в том числе из-за низкой настороженности.
Симптомы микозов ЖКТ
Клиническая картина заболевания различна в зависимости от распространенности поражения. При орофарингеальной локализации микоза у пациента возникают боли во время приема пищи, неприятный привкус во рту, на слизистой оболочке щек и языка появляются белые налеты. Поражение пищевода и желудка характеризуется болью при глотании, дисфагией, изжогой, отрыжкой, тошнотой и рвотой, дискомфортом в эпигастральной области, снижением аппетита. При прогрессировании заболевания в процесс вовлекаются нижележащие отделы желудочно-кишечного тракта, что клинически проявляется диареей с примесями слизи и крови, болезненностью в левой подвздошной области. Возможны нарушения общего состояния: субфебрильная температура тела, слабость, снижение трудоспособности, резкое уменьшение веса.
Осложнения
Вследствие проникновения микроорганизмов из пищеварительного тракта в забрюшинную клетчатку могут возникать гнойно-воспалительные процессы — парапроктит, паранефрит, межкишечные или поддиафрагмальные абсцессы. У пациентов со сниженной реактивностью организма имеется склонность к генерализации микозов с развитием септицемии, приводящей к распространению грибков на другие органы. Наиболее опасно микотическое поражение гепатобилиарной системы, которое может вызывать желтуху и печеночную недостаточность. При тяжелом течении заболевания формируются некрозы стенки кишечника, иногда – с перфорацией. Возможны профузные желудочно-кишечные кровотечения, пенетрация язв в соседние органы.
Диагностика
Постановка диагноза микозов желудочно-кишечного тракта затруднена из-за полиморфности и неспецифичности клинической картины заболевания, которая сходна с проявлениями других патологий пищеварительной системы. Для диагностики грибкового поражения требуется комплексное обследование пациента. Наиболее информативными являются следующие методы:
- Эзофагогастродуоденоскопия. Характерные признаки микозов при эндоскопии — гиперемия, выраженная отечность и контактная ранимость слизистой оболочки, наличие белесоватого налета, язвенных дефектов. Во время исследования производится забор материала (налетов, биоптатов) для гистологического и цитологического анализа.
- Колоноскопия. Введение гибкого эндоскопа в толстую кишку позволяет оценить состояние кишечного эпителия, обнаружить эрозии или язвы слизистой, которые могут быть источником желудочно-интестинальных кровотечений, провести биопсию пораженных участков. Метод используется для дифференцировки микозов с другими патологиями толстой кишки.
- Электрогастрография. Регистрация биопотенциалов применяется для оценки моторно-эвакуаторной функции желудка, которая зачастую снижена при грибковых поражениях, что создает благоприятные условия для размножения микроорганизмов. Для изучения гастродуоденальной моторики также может назначаться сцинтиграфия.
- Микробиологическое исследование биоптата. Окраска материала по Граму, Романовскому-Гимзе позволяет определить грибки в материале, что подтверждает диагноз микоза. Выявление активной вегетации и формирования мицелия свидетельствует об остром процессе. Широко используется культурологическое исследование на среде Сабуро.
- Серологические реакции. Проведение реакций агглютинации, связывания комплемента, преципитации помогает обнаружить в крови пациента специфические противогрибковые антитела. ИФА повторяется через 10-15 дней для оценки количества антител в динамике – нарастание титра в 4 раза и более дает возможность верифицировать диагноз микоза.
В клиническом анализе крови наблюдаются неспецифические признаки воспалительного процесса: повышение СОЭ, незначительный лейкоцитоз, может выявляться снижение уровня эритроцитов и гемоглобина, что обусловлено кровотечениями. Для исследования структуры всех слоев стенки пищеварительного тракта выполняется эндоскопическая ультрасонография. Дифференциальная диагностика осуществляется с воспалительными заболеваниями кишечника (терминальным илеитом, неспецифическим язвенным колитом), злокачественными новообразованиями, псевдомембранозным энтероколитом, желудочно-кишечным туберкулезом. Помимо осмотра гастроэнтеролога пациенту могут потребоваться консультации инфекциониста, онколога, фтизиатра.
Лечение микозов ЖКТ
Основными задачами являются терапия расстройства, вызвавшего активацию микотической флоры, и этиопатогенетическое воздействие на возбудителя грибковой инфекции. Лечение болезней пищеварительного тракта, иммунодефицитных и других патологических состояний проводят по протоколам соответствующих заболеваний. Для подавления грибкового процесса используют:
- Антимикотики. По результатам наблюдений, наиболее эффективной является терапия триазолами. Средства этой группы угнетают систему цитохрома P-450 и синтез эргостерола клеточных мембран, нарушая рост и репликацию кандид и криптококков. В качестве альтернативы с учетом особенностей возбудителя могут применяться полиены, аллиламины, эхинокандины.
- Пробиотики. Препараты, в которых содержатся непатогенные и нетоксигенные микроорганизмы, позволяют восполнить естественную микрофлору кишечника, нормализовать ее состав после проведенной антибактериальной терапии. Апатогенные бактерии стимулируют кишечный иммунитет, оказывают антагонистический эффект по отношению к грибам, нарушают их адгезию к слизистым.
При отсутствии противопоказаний проводится неспецифическая иммунотерапия стимуляторами естественного иммунитета (высокополимерные полисахаридные комплексы, регенеранты, производные пиримидина), Т- и В-лимфоцитов (полипептидные экстракты вилочковой железы, культур клеток костного мозга, селезенки). Возможно дополнительное использование растительных иммуномодуляторов, витаминно-минеральных комплексов.
Прогноз и профилактика
Исход болезни зависит от степени повреждения пищеварительных органов, состояния иммунной системы пациента, своевременности диагностики и терапии. Прогноз сомнительный при генерализации процесса и наличии тяжелых сопутствующих заболеваний. Для предупреждения развития микозов необходимо не допускать неоправданного применения антибактериальных средств, назначать профилактические курсы противогрибковых препаратов при длительном лечении цитостатиками, кортикостероидами, другими медикаментами с иммунодепрессорным эффектом, осуществлять диспансерное наблюдение за пациентами с иммунодефицитом.
Что такое кандидоз кишечника
Кандидоз кишечника — это воспаление слизистой оболочки кишечника, вызванное грибковой инфекцией.
Грибы рода Candida относятся к условно-патогенным организмам. Это значит, что в небольших количествах они присутствуют в организме здорового человека, не вызывая неприятных симптомов. Но если иммунитет снижается, они начинают активно размножаться, провоцируя воспаление. В этом случае говорят о кандидозе.
При снижении общего иммунитета кандидоз не только развивается в кишечнике, но и поражает другие органы, например гениталии, бронхи, носоглотку.
Когда грибы активно размножаются, воспаление сопровождается образованием на слизистых оболочках белого налёта или появлением белых творожистых выделений. Поэтому заболевание получило название «молочница».
Причины кандидоза кишечника
В норме грибы рода Candida находятся в кишечнике в небольшом количестве. Если же они активируются и начинают размножаться, развивается кандидоз.
Воспаление, которое возникает при реактивации собственных условно-патогенных организмов, называется аутоинфекция.
Кишечный кандидоз развивается на фоне снижения иммунитета. Этому может способствовать множество факторов.
Факторы, влияющие на развитие кандидоза кишечника:
- тяжёлые инфекционные заболевания, которые сопровождаются снижением иммунитета, например ВИЧ-инфекция;
- хронические эндокринные нарушения — сахарный диабет, снижение функции щитовидной железы;
- изменения гормонального фона из-за беременности или лечения гормональными препаратами;
- терапия антибиотиками.
Течение кандидоза кишечника
В норме микроскопические грибы рода Candida в небольшом количестве могут присутствовать на слизистых оболочках желудочно-кишечного тракта. От активного роста их сдерживает полезная флора, населяющая кишечник.
При снижении местного или общего иммунитета сдерживающая функция флоры ослабевает и грибы переходят к активному росту.
В большинстве случаев грибковая инфекция протекает неинвазивно, то есть развивается в просвете кишечника, не проникая в ткани. В процессе жизнедеятельности грибы выделяют токсины, которые раздражают слизистую оболочку и вызывают ухудшение самочувствия с признаками расстройства кишечника.
Если целостность слизистой оболочки нарушена (например, при язвенной болезни), возможно локальное проникновение инфекции в ткани кишечника.
При значительном снижении иммунитета (например, при заражении вирусом иммунодефицита человека) грибы проникают в ткани кишечника, а затем в кровоток. По мере распространения инфекции воспаление переходит в опасную для жизни генерализованную форму с поражением печени, головного мозга, сердца и других внутренних органов (грибковый сепсис).
Название «молочница» заболевание получило из-за строения грибов: размножаясь, они образуют белый налёт на слизистых оболочках и вызывают творожистые выделения.
Грибы Candida под микроскопом. Фото: CDC/Dr. William Kaplan
Виды кандидоза кишечника
Кандидоз кишечника классифицируют по распространённости и характеру поражения тканей:
- Неинвазивный — наиболее распространённая форма. Грибы активно размножаются в просвете кишечника, не проникая в ткани.
- Инвазивный может возникать на фоне других заболеваний кишечника, например язвенной болезни. Грибковая инфекция проникает в ткани в местах нарушения слизистой оболочки.
- Диссеминированный (кандидемия) встречается у людей с иммунодефицитом. Грибковая инфекция проникает в кровоток и поражает внутренние органы.
Кандидоз кишечника может распространяться на другие органы желудочно-кишечного тракта, вызывая кандидоз желудка и пищевода.
Симптомы кандидоза кишечника
Симптомы зависят от формы течения заболевания и степени поражения тканей и органов. Специфических признаков, однозначно указывающих на то, что кандида вызвала воспаление в кишечнике, не существует.
В большинстве случаев инфекция протекает в неинвазивной форме и сопровождается неприятными ощущениями в животе, метеоризмом и нарушениямиями стула. Возможно незначительное ухудшение общего самочувствия из-за интоксикации: тошнота, головная боль.
При инвазивных формах кандидоз сопровождается резким ухудшением самочувствия с повышением температуры, сильной болью в животе и расстройством стула. Возможны примеси крови в кале и признаки поражения других органов пищеварительной системы — печени, жёлчного пузыря, поджелудочной.
Возможные симптомы при кандидозе кишечника:
- вздутие живота;
- боль в животе;
- разжижение стула;
- повышение температуры (редко);
- признаки интоксикации — головная боль, тошнота, озноб (редко);
- признаки поражения других органов пищеварения (редко).
У женщин кандидозу кишечника часто сопутствует вагинальный кандидоз: он сопровождается жжением, зудом и творожистыми выделениями из влагалища.
Осложнения кандидоза кишечника
При своевременной диагностике и соблюдении назначений врача кандидоз кишечника редко вызывает осложнения.
Но при отсутствии лечения (или при попытке лечить воспаление самостоятельно) инфекция может распространяться на органы других систем — мочевыделительной, репродуктивной. В результате могут пострадать уретра, мочевой пузырь, почки, у женщин — влагалище, шейка матки, маточные трубы и яичники. Без лечения эти патологии могут привести к бесплодию.
У людей со сниженным иммунитетом инфекция при кандидозе кишечника может переходить в генерализованную форму, вызывая заражение крови и поражая мозг, сердце и другие органы.
У беременных кандидоз может приводить к преждевременным родам или внутриутробному заражению плода. Такое состояние опасно для жизни ребёнка.
Диагностика кандидоза кишечника
Так как грибы рода Candida относятся к условно-патогенным микроорганизмам и в норме присутствуют на коже и слизистых оболочках организма, лечить их нужно только при наличии признаков воспаления. Это значит, что сдавать анализы на кандидоз в профилактических целях не имеет смысла.
При подозрении на кандидоз кишечника врач назначает исследования, чтобы определить, вызвано ли воспаление грибковой инфекцией, и узнать, какая разновидность грибов его спровоцировала (наиболее частые возбудители — это Candida tropicalis и Candida albicans). Также анализ определяет чувствительность возбудителя к лекарственным препаратам — от этого показателя зависит выбор лекарства.
Поскольку кандидоз кишечника нередко сопровождается бактериальным воспалением — ростом стафилококков, кишечной палочки и других микроорганизмов, — вместе с посевом назначают анализ кала на дисбактериоз и бактериологическое исследование кала.
135.0. Соскоб (+450 ₽) 
Соскоб (+450 ₽) 4 дня

120.0. 
4 дня

124.0.05.19.01.3. 
5 дней

Чтобы определить причину воспаления и уточнить диагноз, применяют эндоскопию — осмотр слизистых оболочек кишечника с помощью специальной камеры. При необходимости во время процедуры врач берёт участки тканей для биопсии — исследования, которое позволяет исключить злокачественный характер изменения тканей.
15.60. 
3 дня

Если есть признаки системного поражения, назначают общий анализ крови и исследования, которые определяют вид возбудителя грибковой инфекции, — это позволяет назначить наиболее эффективное лечение.
3.9.1. Вен. кровь (+230 ₽) 
Вен. кровь (+230 ₽) 1 день

19.777. Соскоб (+450 ₽) 
Соскоб (+450 ₽) 2 дня

Лечение кандидоза кишечника
Так как развитие кандидоза кишечника обусловлено рядом факторов, лечение носит комплексный характер.
Меры, направленные на лечение кандидоза кишечника:
- облегчение симптомов (спазмолитики, сорбенты, обезболивающие препараты);
- подавление роста инфекции (противогрибковые и антибактериальные препараты);
- укрепление местного и общего иммунитета.
Препараты для лечения кандидоза кишечника всегда подбирает врач.
Меры для укрепления иммунитета:
- приём пробиотиков для восстановления нормальной флоры;
- нормализация питания и сна;
- работа со стрессом;
- контроль дефицитов витаминов и минералов;
- лечение хронических заболеваний, в том числе скрытых воспалений.
К какому врачу обращаться при кандидозе кишечника
Кандидоз кишечника и слизистых оболочек других органов, как правило, развиваются параллельно. Поэтому первично заподозрить болезнь могут терапевт, гастроэнтеролог или гинеколог — в зависимости от того, к кому обратился с жалобами пациент. В дальнейшем назначать лечение кандидоза кишечника и контролировать его эффективность будет гастроэнтеролог. Именно этот врач специализируется на лечении заболеваний органов пищеварения (пищевода, желудка, кишечника, печени и поджелудочной железы).
Прогноз и профилактика при кандидозе кишечника
Если кандидоз кишечника развивается на фоне приёма антибиотиков или инфекционного заболевания, воспаление имеет временный характер и, как правило, быстро проходит. Но когда патология развивается из-за снижения иммунитета, она может перейти в серьёзную форму.
Например, для ВИЧ-инфицированных пациентов кандидоз очень опасен.
Во время беременности кандидоз без адекватного лечения также повышает риск преждевременных родов или внутриутробного заражения плода.
Долгое время основным возбудителем кандидоза была Candida albicans. Однако в последнее время всё чаще стали встречаться воспаления, вызванные другими представителями рода Candida: С. glabrata, C. dubliniensis, C. tropicalis, C. parapsilosis и C. krusei. Врачи связывают это с ростом устойчивости грибов к антибактериальным препаратам на фоне бесконтрольного приёма антибиотиков и доступности препаратов для самолечения.
Инфекции, вызванные более редкими возбудителями, хуже поддаются лечению.
Чтобы снизить риск развития кандидоза, в том числе вызванного устойчивыми штаммами, рекомендуется избегать самолечения и при возникновении симптомов обращаться к врачу.
Диета при кандидозе кишечника
Нет убедительных научных данных о том, что какая-то специальная диета помогает предотвратить развитие кандидоза. Чтобы поддерживать иммунитет и нормальную кишечную микрофлору, достаточно придерживаться принципов здорового питания: рацион должен быть полноценным и разнообразным, стоит чаще употреблять продукты, содержащие полезные жиры, витамины, минералы и клетчатку.
Есть мнение, что грибы Candida «любят» сладкую среду, поскольку они развиваются на клетках, богатых гликогеном (это полисахарид, образованный остатками глюкозы). Поэтому считается, что большое количество сахара в рационе способствует формированию комфортной среды для развития грибковой инфекции. Однако польза ограничения сахара для профилактики кандидоза не доказана.
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже известные варианты болезни и описываются редкие и новые нозологические формы.
Грибы, являясь нормальными комменсалами желудочно-кишечного тракта (ЖКТ), становятся патогенными при определенных условиях. Это касается в основном дрожжеподобных грибов Candida spp., виды и даже штаммы которых различаются по факторам агрессии, способности к адгезии и инвазии [15].
Candida albicans — наиболее частый возбудитель кандидоза ЖКТ. Однако в последние годы большую роль играют Candida non-albicans (C. krusei, C. tropicalis, C. kefyr, C. glabrata, C. parapsilosis); у лиц с иммунодефицитом их пропорция составляет более 50%, при «относительно нормальном» иммунитете — 15%.
Грибы Candida (условно-патогенные микроорганизмы) заселяют ЖКТ — этот феномен называется колонизацией, — процесс протекает бессимптомно. Исследование взрослых здоровых добровольцев показало, что Candida albicans присутствует в орофарингеальной зоне у 20–30% из них, в тонком кишечнике — у 50–54%, в толстом кишечнике — у 55–70% и в фекалиях — у 65–70% [9, 13]. При исследовании состава микрофлоры полости рта у населения нескольких стран Европы обнаружено присутствие грибов у 10–25% людей, в кале — у 65–80% [11, 17]. Детально изучена колонизация зева грибами Candida у больных гемобластозами: она составила 33% [8]. В биоптатах гастродуоденальных язв в 17–30% случаев находят дрожжеподобные грибы [12]. У 50% жителей Германии в микробиоте кишечника присутствуют грибы, а у онкогематологических больных колонизация кишечника составляет 63–65% [10, 11]. Нельзя забывать, что у 0,8–4% пациентов грибы случайно обнаруживаются в пузырной и протоковой желчи, а при желчнокаменной болезни — у 15–20%.
Бессимптомное пребывание грибов в ЖКТ может прекратиться, когда они приобретают патогенные свойства. Так, у больных с нейтропенией грибы из кишечника могут диссеминировать в печень, селезенку и легкие, а в катетер-ассоциированной ситуации грибы попадают непосредственно в ток крови, достигают сердца и почек.
Дрожжеподобный гриб Cryptococcus neoformans в патологии ЖКТ как этиологический фактор играет незначительную роль. Он чаще поражает нервную систему и, диссеминируя из первичного очага, вовлекает гастроинтестинальный тракт. Описаны единичные случаи (чаще посмертно) криптококкового эзофагита, стоматита, терминального илеита, колита, холецистита, панкреатита. Как правило, они относились к ВИЧ-серопозитивным больным, а также к пациентам, страдающим гипергаммаглобулинемией Е с рецидивирующими абсцессами печени и перианальной зоны.
Болезни ЖКТ, вызванные диморфными патогенными грибами (II группы патогенности), зарегистрированы в Южной Америке, но время от времени встречаются как спорадические случаи по всему миру. Большинство диморфных грибов в природе существуют в мицелиальной форме, попав в организм они трансформируются в дрожжеподобные и приобретают патогенные свойства. Пероральный путь проникновения не характерен, в ЖКТ эти грибы попадают при диссеминации из других органов. Blastomyces dermatitidis продуцирует гранулематозное повреждение в желудке и тонком кишечнике. Coccidioides immitis, Histoplasma capsulatum, Paracoccidioides brasiliensis и Sporothrix schenckii поражают кишечник только при диссеминации из кожных очагов и респираторного тракта [6, 15].
Грибы Aspergillus spp. редко вызывают болезнь ЖКТ, только в случаях стойкой нейтропении, кахексии и при других отягощающих состояниях.
Грибы класса Zygomycetes могут привести к развитию интестинального зигомикоза, который, как правило, ассоциирован с амебиазом, голоданием, диабетическим кетоацидозом, почечным гемодиализом. Penicillium spp. и Geotrichum поражают ЖКТ также редко.
Дрожжеподобные, плесневые и некоторые диморфные грибы — это условно-патогенные, оппортунистические микроорганизмы, которые широко распространены в окружающей среде и легко могут попадать на кожу, слизистые оболочки полости рта, гениталий и в дыхательные пути. Кроме того, для грибов характерен эндогенный способ существования (миконосительство).
ЖКТ покрыт слизистой оболочкой, состоящей из двух компонентов — поверхностного скользкого, слизистого слоя, по которому микроорганизмы легко продвигаются вдоль всего ЖКТ, и более глубокого плотного гликопротеинового слоя с остатками сиаловой кислоты, который формирует физиологический барьер. Адгезия и последующая инвазия грибов через этот плотный слой возможны только благодаря продукции грибами протеолитических «ферментов инвазии»: коагулазы, каталазы, козеиназы, фосфолипазы, а также фибриллярных протеиновых комплексов и эндотоксинов [15].
При физиологическом благополучии между макро- и микроорганизмами существует определенное равновесие, в котором играют роль, с одной стороны, факторы устойчивости организма к микроскопическим грибам, а с другой — факторы патогенности грибов.
Устойчивость организма зависит от принадлежности к группам риска и состояния иммунной системы.
Перечислим факторы риска развития грибковых инфекций ЖКТ.
- Поражение слизистых оболочек полости рта (красный плоский лишай, зубные протезы, травмы, ксеростомия, использование гормональных ингаляторов).
- Хронические заболевания ЖКТ (атрофический гастрит, гипоацидность желудка, ахалазия, бульбит, эрозивно-язвенные заболевания пищевода и кишечника, дивертикулез, полипоз, гастроэзофагальная рефлюксная болезнь, энтероколит, болезнь Крона, синдром раздраженной кишки, обсемененность желудка Helicobacter pylori, дисбиоз, микст-инфекция кишки).
- Травмирование слизистой оболочки (ожоги, пищеводно-желудочный зонд, эндотрахеальная интубация).
- Беременность.
- Период новорожденности (недоношенность, массивность инфекции при прохождении через родовые пути, естественное несовершенство иммунной системы).
- Пожилой возраст (старение иммунной системы, сопутствующие заболевания, уменьшение амплитуды продольных сокращений пищевода, силы сокращений сфинктеров, нарушение процессов всасывания и т. д.).
- Онкологические и гематологические заболевания (нейтропения).
- Эндокринопатии (особенно сахарный диабет).
- СПИД, ВИЧ-инфицированность.
- Трансплантационные операции.
- Состояния, требующие пребывания в отделениях интенсивной терапии.
- Тяжелые аллергические заболевания.
- Прием антибиотиков, цитостатиков, гормонов и других химиопрепаратов в неадекватных дозах.
- Нарушения питания, в том числе голодание с целью снижения веса.
- Алкоголизм, курение, наркомания.
Важным компонентом защиты от инвазии ЖКТ является иммунная система, ассоциированная с кишечником. Клеточная часть этой системы включает в себя интраэпителиальные лимфоциты, которые препятствуют дисперсии возбудителя через lamina propria и агрегации в пейеровых бляшках. В-лимфоциты кишечника участвуют в продукции секреторных IgA и IgM, которые уменьшают способность грибов к адгезии.
Т-клетки здорового организма продуцируют защитный интерферон, усиливают фагоцитоз, активируют Т-цитотоксические лимфоциты. СД4 и СД8 укрепляют местный иммунитет в ЖКТ. Причем оказалось, что цитотоксичность СД8 играет более существенную роль в предотвращении заболевания, чем предполагали раньше.
В защите важны также макрофагальный и нейтрофильный фагоцитоз, препятствующие диссеминации грибковой, особенно кандидозной инфекции.
У ВИЧ-пациентов и больных с нейтропенией, у которых фагоцитоз резко подавлен, местная инвазия и диссеминация инфекции наступают очень быстро. Известно, что нейтрофилы хотя и не могут полностью защитить слизистую оболочку ЖКТ от «атаки» грибов, но благодаря собственной «киллерной» субстанции через специфический механизм запускают активацию комплемента, который усиливает фагоцитоз. Следует отметить, что фагоцитоз особенно важен при кандидозной инфекции, но «не работает» в тканях против капсулированных криптококков и большинства мицелиальных грибов.
Нормальные биохимические, гистохимические и физиологические процессы в ЖКТ, своевременная регенерация эпителиоцитов, кислотно-ферментативный барьер, полноценная перистальтическая активность также являются защитными факторами, которые препятствуют проникновению грибковой и бактериальной флоры [4]. Роль желудочной кислоты в предотвращении внедрения грибов в слизистую неоспорима. В среде с пониженной кислотностью грибы Candida приобретают патогенные свойства, появляются вегетирующие формы, образуется псевдомицелий или мицелий, повреждающий слизистую оболочку. У ВИЧ-инфицированных лиц, для которых характерна ахлоргидрия, попадающие с пищей грибы Candida могут вызывать кандидоз желудка, в то время как у людей с нормальным иммунитетом эта локализация встречается редко. Роль кислотности желудочного сока в развитии бактериальной и грибковой инфекции кишечника не подтверждена.
Облигатные микроорганизмы желудка и кишечника (аэробные лактобациллы, анаэробные бифидум-бактерии, нормальная кишечная палочка и др.) также играют защитную роль. Применение антибиотиков убивает, наряду с патогенными, и эти «полезные» бактерии, открывая на слизистой оболочке рецепторы адгезии для грибов [2].
Нельзя не упомянуть также о Helicobacter pylori, который довольно часто обитает в желудке, вызывает гастрит, язвенную болезнь, а иногда оказывает канцерогенное воздействие. В свою очередь, лечение хеликобактериоза антибиотиками приводит к активации грибов Candida и кандидозу желудка [1]. Ассоциации грибов с Helicobacter pylori и другими бактериями в ЖКТ встречаются нередко, что требует продуманного адекватного подхода к тактике лечения.
В желудке могут также присутствовать Saccharomyces cerevisiae и некоторые виды Candida, способные сбраживать и ферментировать до винного спирта сахара, попадающие с пищей в желудок. Этот феномен называется синдромом «пивоваренного завода» [14].
Вирулентность грибов, патогенные факторы, как и полисахариды (маннаны), плазмокоагулаза, эндотоксины, липиды, глюкоконъюгаты, влияют на развитие заболевания. Даже от внутривидовых способностей грибов зависит, разовьются ли в каждом конкретном случае кандиданосительство или болезнь [13]. Например, серотип В Candida albicans считается более вирулентным и наиболее распространенным возбудителем орофарингеального кандидоза у ВИЧ-инфицированных больных, также он поражает генитоуринарную систему и нередко выделяется из зева у гомосексуалистов.
Микроскопически факторы агрессии грибов Candida проявляются формированием ростковых трубок, псевдогифов и истинного мицелия — за счет них грибы могут врастать в стенку фагоцитов. Однако дрожжи, которые не способны продуцировать мицелий, такие, как Candida glabrata, Cryptococcus neoformans, также могут вызывать заболевания ЖКТ.
Диагностика
Тщательное изучение анамнеза, выявление факторов риска, хронических заболеваний ЖКТ, патогномоничных клинических симптомов играют большую роль в своевременности установления диагноза.
В последние годы за счет эндоскопических технологий расширились возможности диагностики грибкового эзофагита и гастрита. При эзофагогастродуоденоскопии обращают внимание на гиперемию и изъязвления слизистой, наличие белых налетов и «пленок», сужение просвета пищевода, скопление слизи. Во время этой процедуры в обязательном порядке следует брать материал для микробиологического исследования, так как не всегда этиология этих проявлений грибковая. Причем информативность исследования налетов выше, чем биоптатов (95% по сравнению с 39%).
Особенно перспективны видеоинформационные эндоскопические исследования с цифровой регистрацией и анализом изображения. Четкое разграничение неизмененных и патологических тканей, анализ гистохимических процессов в слизистой оболочке пищеварительного тракта возможны с помощью эндоскопической спектроскопии и флюоресцентной эндоскопии. Видео- и колоноскопия, хромоэндоскопия на фоне «лекарственного» сна по технологии «Диантек» имеют высокое качество исследования, безболезненность манипуляций и отсутствие стресса и страха у пациентов.
Следует, однако, подчеркнуть, что инвазивные манипуляции при воспаленной слизистой ЖКТ небезопасны, могут способствовать грибковой и бактериальной диссеминации, а иногда приводят к травме и перфорации стенки пищевода или желудка. Эндоскопическая ультрасонография с допплеровским картированием, контрастным усилением тканевых и сосудистых структур перспективна, она позволяет детально дифференцировать все слои стенки пищеварительного тракта. Неинвазивные методы — виртуальная эндоскопия, позволяющая получить трехмерное изображение, магнитно-резонансное исследование — имеют большое будущее [3].
Изучение гастродуоденальной моторики с помощью сцинтиграфии и электрогастрографии также важно для диагностики и назначения дополнительных лекарственных средств, так как нарушение двигательной функции желудка, «застой» в ЖКТ создают условия для размножения грибов и бактерий. Колоноскопия дает возможность оценить состояние слизистой кишечника, наличие белого налета, язвенных дефектов и т. д. В перспективе в гастроэнтерологии будут внедряться методы, в основе которых лежат новые научно-практические исследования: иммуноферментный анализ фекальных антигенов, ПЦР и даже генетическое тестирование [3].
Еще одним достаточно информативным методом в гастроэнтерологии является рентгенография пищевода, желудка и кишечника. Она дает возможность выявить дефекты наполнения (депо бария), изъязвления, деформацию, конвергенцию складок, изменения контуров и глубины перистальтики, сужение или расширение пищеводной трубки. С помощью рентгенографии желудка можно оценить его моторику, своевременность эвакуации пищевого комка, что важно для понимания патогенеза заболевания.
Лабораторное подтверждение грибкового заболевания ЖКТ возможно при микроскопировании и/или культуральном исследовании смывов со слизистых оболочек полости рта и пищевода, содержимого желудка и кишечника, патологических «пленок», налетов и др. Количественная оценка грибов в биосубстратах должна проводиться в сопоставлении с клинической симптоматикой, с учетом наличия фоновых заболеваний, микст-инфекции и т. д. Например, обнаружение на слизистых единичных колоний Candida не является основанием для постановки диагноза «кандидоз» у иммунокомпетентных пациентов.
В кале диагностическую значимость приобретает количество колоний (более 105–106). По-другому, с более низким диагностическим порогом, интерпретируются результаты посевов у иммуносупрессированных лиц, при нейтропении у больных СПИДом и в отделениях интенсивной терапии. Следует также обращать внимание на способность грибов к вегетации и образованию мицелия, так как это является одним из лабораторных признаков, подтверждающих диагноз кандидоза.
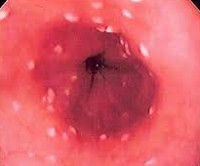
Гистологическое (окраска по Гомори–Гроккоту, ШИК-реакция) и цитологическое (окраска по Романовскому–Гимзе) исследования биоптатов позволяют обнаружить тканевые формы грибов. Многими авторами эти методы рассматриваются как наиболее достоверные. Кроме того, мицелий и псевдомицелий в тканях служат подтверждением наличия инвазивной формы грибковой инфекции ЖКТ (рис. 1, 2).
Кандидоз
Это наиболее распространенная грибковая оппортунистическая висцеральная патология. Агрессивные свойства грибов Candidа проявляются в их способности через стадию адгезии и инвазии поражать слизистые оболочки любых органов, в том числе и ЖКТ. Причем «атаке» подвергается чаще всего многослойный плоский эпителий полости рта и пищевода, реже — однослойный цилиндрический эпителий кишечника. Поэтому, как правило, в верхних отделах ЖКТ происходит инвазия грибов Candidа, а в отделах, расположенных ниже желудка, — колонизация. В то же время в кишечнике даже на стадии адгезии могут наблюдаться клинические симптомы — проявления неинвазивного кандидоза [10].
Язвенные дефекты пищевода, желудка и кишечника поддерживают грибковую колонизацию вплоть до инвазии. Желудочно-кишечный кандидоз нередко приводит к кандидемии.
Классификация кандидоза
I. Орофарингеальный кандидоз.
- Кандидоз полости рта у новорожденных.
- Псевдомембранозный кандидоз.
- Атрофический кандидоз полости рта (чаще у пожилых).
- Эритематозный кандидоз (новая форма).
- Срединный ромбовидный глоссит.
- Лейкоплакия, ассоциированная с кандидозом.
- Ангулярный кандидозный хейлит.
- Кандидозный гингивит (изолированно встречается редко).
II. Кандидозный эзофагит.
- Без эрозий.
- С эрозиями.
III. Кандидоз желудка.
- Эрозивно-фибринозный гастрит (диффузный).
- Вторичный кандидоз на фоне язвенной болезни.
- IV. Кандидоз кишечника.
- Псевдомембранозный.
- Коллагеновый.
- Лимфоцитарный.
V. Кандидозный проктосигмоидит.
VI. Перианальный кандидоз.
VII. Секреторная диарея, ассоциированная с кандидозом.
 |
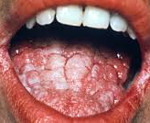
| Рисунок 3. Кандидозный глоссит. Типичные белые налеты и эрозии на воспаленной инфильтрированной слизистой |
Среди всех локализаций кандидоза пищеварительного тракта орофарингеальная занимает 1-е место (рис. 3).
О кандидозе полости рта упоминал еще Гиппократ, а впервые описал его хирург Лангенберк в 1839 г.
Кандидозный стоматит у новорожденных — распространенное заболевание. В первые дни после рождения слизистые ребенка устойчивы к грибам.
В дальнейшем недостаточная секреция IgA и постепенное снижение антимикробного иммунитета, переданного от матери, приводят к высокой заболеваемости. Патогномоничный синдром — белые творожистые налеты на слизистой полости рта, так называемая «молочница» [16].
Кандидоз ассоциирован также с ношением протезов. При этом развивается атрофический кандидоз, огромное количество грибов скапливается в щечных складках на фоне красного точечного воспаления слизистой; инвазия, как правило, отсутствует.
Кандидозный эзофагит в стационарах общего профиля встречается у 1,3–2,8% больных, в отделениях трансплантации — до 4%, при диссеминированном карциноматозе — от 2,8 до 6,7%. Это заболевание протекает часто без субъективных жалоб и выявляется случайно при «сплошных» исследованиях населения в 1–7% случаев [5, 17]. Иногда больные отмечают боль и дискомфорт при прохождении твердой и жидкой пищи, дисфагию, гиперсаливацию. По глубине поражения эндоскопически выделяют четыре типа — от легкого отека, гиперемии, единичных белых налетов < 1 мм в диаметре до массивного воспаления, деформации и кровоточивости слизистой, изъязвлений, вплоть до перфорации.
Кандидоз желудка, как правило, развивается вторично на фоне язвенной и гастроэзофагальной рефлюксной болезни. Ахлоргидрия, в свою очередь, способствует колонизации грибов на слизистой, с последующей инвазией, особенно в зонах дефекта (язвы, эрозии), что замедляет репарацию, появляется болевой синдром, иногда отмечается кровоточивость язвы.
Кандидозное поражение кишечника обычно проявляется абдоминальным дискомфортом, диареей, вздутием живота, болевым синдромом и другими симптомами. Изучение микробиоценоза кишечника позволяет конкретизировать аморфный «энтероколит», а именно дифференцировать псевдомембранозный колит, вызываемый Clostridium difficile, острый процесс в кишечнике, вызываемый ротовирусами и Escherichia coli, от кандидоза или дисбактериоза с преимущественным кандидозным компонентом.
Грибковому поражению билиарной системы способствуют предшествующие дискинезия желчевыводящих путей, диспанкреатизм, лямблиоз, холестаз, гипотония желчного пузыря и другие поражения. При этих состояниях создаются благоприятные условия для размножения грибов и других микроорганизмов. Причиной кандидозного холецистита могут быть камни желчных протоков, которые часто являются «резервуаром» грибов, некоторые авторы даже называют их «грибковыми тельцами» или «кандидозными камнями».
Микозы желчевыводящих путей встречаются чаще, чем принято считать. Микробиологическое исследование порций желчи, полученных при многофракционном дуоденальном зондировании, позволяет дифференцировать грибковую от бактериальной или функциональной патологии двенадцатиперстной кишки, желчного пузыря, желчевыводящих путей и печени.
Лечение
Лечение кандидоза пищеварительного тракта, как, впрочем, и других грибковых инфекций, должно быть комплексным и этиопатогенетическим.
При появлении жалоб со стороны ЖКТ больному прежде всего следует соблюдать строгую диету и отказаться от вредных привычек.
Необходимо принимать средства, направленные на устранение факторов, предрасполагающих к развитию кандидоза, проводить коррекцию сопутствующих заболеваний.
- При подозрении на кандидоз, развившийся на фоне неспецифического язвенного колита, болезни Крона, хронического воспаления стенки кишки подбирают глюкокортикостероиды с минимальным системным действием и «мягкие» иммуномодуляторы.
- Лечение язвенной и гастроэзофагальной рефлюксной болезни проводят антисекреторными препаратами производными бензимидазола — ингибиторами протонной помпы париетальных клеток (нексиум, париет, ланзап); а также блокаторами гистаминовых H2-рецепторов (квамател, ульфамид, ульцеран, гастросидин, фамосан).
- С целью предотвращения заброса содержимого желудка в пищевод повышают тонус нижнего пищеводного сфинктера и двигательную активность ЖКТ, назначая современные препараты — антагонисты серотониновых 5-НТ4-рецепторов.
- Функциональное заболевание «синдром раздраженной кишки» лечат аналогами соматостатина, каппа-антагонистами.
- Антихеликобактерную терапию омепразолом, амоксициллином, тинидазолом и др. проводят с большой осторожностью, так как Helicobacter pylori часто существует в ассоциации с грибами Candida spp., а последние на фоне антибиотикотерапии резко активизируются.
Необходима противогрибковая терапия. Список противогрибковых средств с каждым годом пополняется новыми эффективными препаратами. Среди современных антимикотиков выделяют несколько групп.
- Полиены: амфотерицин В (амфоглюкамин), липидный комплекс Амфо В (амфолип), липосомальный Амфо В (амбизом), коллоидная дисперсия Амфо В (амфоцил).
- Триазолы: флуконазол (дифлюкан), вориконазол (вифенд), равуконазол (в стадии клинических испытаний), итраконазол (орунгал), позаконазол (в стадии клинических испытаний), альбаконазол (в стадии клинических испытаний).
- Аллиламины: тербинафин (ламизил).
- Эхинокандины: каспофунгин (кансидас), микафунгин, анидулафунгин (в стадии клинических испытаний).
Многолетние наблюдения, проводившиеся на базе Центра глубоких микозов и посвященные эффективности лечения грибковых заболеваний пищеварительного тракта (более 150 больных), позволяют нам выделить из общего ряда препаратов наиболее эффективное адекватное этиотропное средство. Это антимикотик из группы триазолов — флуконазол (дифлюкан, дифлазон, флюкостат), использующийся при лечении дрожжеподобных инфекций ЖКТ (кандидоз, криптококкоз). Он обладает высочайшей эффективностью, которая основана на угнетении системы цитохрома Р-450 и последующем нарушении синтеза эргостерола в клеточной мембране дрожжеподобного гриба. За счет высокой биодоступности, активной всасываемости в ЖКТ, отсутствия влияния на синтез тестостерона и кортизола, флуконазол хорошо переносится и не вызывает побочных воздействий. Препарат обладает уникальной способностью проникать через гематоэнцефалический барьер, что особенно важно в случае диссеминации грибковой инфекции из ЖКТ в кровь и ЦНС.
При назначении per os объем всасывания флуконазола в пищеварительной системе составляет более 90%, причем степень его резорбции высока даже при ахлоргидрии, что выгодно отличает этот триазол от полиенов и других азолов. Препарат не оказывает негативного влияния на процессы всасывания в кишечнике при совместном приеме с антацидами. Наивысшая концентрация препарата в плазме при приеме его внутрь или внутривенно достигается через 0,5–1,5 ч. В то же время период полувыведения длительный — 30 ч, а процент связывания с белками плазмы низкий — 11–12%. Отсутствие токсических действий флуконазола объясняется не только слабым связыванием с белками, но и большим объемом (79,6%) выведения его через почки с мочой в неизмененном виде.
В настоящее время на российском рынке флуконазол представлен 18 генерическими копиями, которые имеют аналогичные фармакокинетические характеристики, хорошо переносятся больными. Однако в отношении клинической и микологической эффективности некоторые из них несколько уступают оригинальному флуконазолу — дифлюкану.
Флуконазол выпускается в трех формах:
- раствор по 50, 100 и 200 мл во флаконе для внутривенного применения (2 мг/мл);
- капсулы желатиновые по 50, 100, 150 и 200 мг;
- порошок во флаконе для приготовления 60 мл суспензии с апельсиновым вкусом для приема внутрь (50 мг/5 мл).
Нами разработаны комплексные схемы лечения кандидоза пищеварительного тракта с учетом локализации, глубины поражения, состояния иммунозащитных сил, наличия отягощающих заболеваний. Этиотропное значение в этой схеме отводилось флуконазолу, который назначали взрослым по 2–2,5 мг/кг, в среднем 100–150 мг в сутки, 2–3 нед. В первый день доза удваивалась.
Детские дозировки: для новорожденных — 7–12 мг/кг в сутки; для детей дошкольного и школьного возраста 50–100 мг/сут; курс лечения составлял 7–14 дней.
Таким образом, как показала наша практика, при системных микозах, в том числе и при кандидозе ЖКТ, раствор флуконазола для внутривенного введения и суспензия применяются чаще, чем капсулы.
Причины развития патологии пищеварительной системы многообразны, клиническая симптоматика вариабельна. Грибковые инфекции, вызываемые дрожжеподобными, плесневыми и диморфными грибами, составляют 8–10% от общего числа заболеваний ЖКТ, а колонизированы грибами до 80% населения. Заболеванию особенно подвержены ВИЧ-инфицированные и больные с нейтропенией. Для диагностики используют современные эндоскопические и рентгенологические методы. Проводят микробиологическое исследование биосубстратов для выяснения этиологии заболевания. Наиболее распространенная грибковая инфекция ЖКТ — кандидоз. Схема лечения грибковой патологии пищеварительного тракта включает назначение эффективного, нетоксичного антимикотика, противовоспалительных, общеукрепляющих и иммуномодулирующих средств. Терапия должна проводиться на фоне диеты, больные нуждаются в диспансерном наблюдении.
Литература
- Баженов Л. Г. и соавт. Роль грибов рода Candida в микробиоценозе желудка при хеликобактериозе// Успехи мед. микологии. — 2003. — Т. I. — С. 8-9.
- Бурова С. А. Особенности течения и терапии грибковых инфекций у детей//Доктор. Ру. — 2003. — Декабрь. — С. 24-25.
- Ивашкин В. Т., Лапина Т. Л. Гастроэнтерология XXI века// РМЖ. — 2000. — Т. 8. — № 17 (118). — С. 697-703.
- Лазебник Л. Б. Старение пищеварительного тракта и полиморбидность: Лекция для практ. врачей//XI Росс. Национальный конгресс «Человек и лекарство». — 2004. — С. 331-341.
- Лессовой В. С., Липницкий А. В., Очкурова О. М. Кандидоз ротовой полости// Проблемы мед. микологии. — 2003. — Т. 5. — № 1. — С. 21-26.
- Лессовой В. С., Липницкий А. В., Очкурова О. М. Микозы пищеварительного тракта// Проблемы мед. микологии. — 2004. — Т. 6. — № 2. — С. 19-23.
- Петрова Н. А., Клясова Г. А., Шарикова О. А. Колонизация слизистой зева дрожжевыми грибами у больных гемобластозами// Успехи мед. микологии. — М., 2003. — Т. 1. — С. 28-29.
- Сергеев А. Ю., Сергеев Ю. В. Кандидоз желудочно-кишечного тракта. — М., 2000. — С. 322-345.
- Толкачева Т. В. и соавт. Частота выделения и видовой спектр дрожжевых грибов в кишечнике у больных гемобластозами// Успехи мед. микологии. — 2003. — Т 1. — С. 30-32.
- Шевяков М. А. Кандидоз слизистых оболочек пищеварительного тракта// Проблемы мед. микологии. — 2000. — Т. 2. — № 2. — C. 6-10.
- Шевяков М. А. Диагностика и лечение кандидоза желудка// Проблемы мед. микологии. — 2002. — Т. 4. — № 2. — С. 50.
- Cohen R. et al. Fungal flora of the normal human small and large intestine. New E et al Candida infection of the gastrointestinal tract. Medicine, 1972; 51: 367-369.
- Gazzard B. Fungal infection of the gastrointestinal tract. Principles and Practice of Clinical Mycology. Edited by C. C. Kibller et al., 1996: 165-177.
- Hanss H., Hanss R. Heien in Derm die heimliche gefahr // Haufman Pediatrie. — 1994; 6; 1: 56-57.
- Levine J., Dycoski R. D., Janoff E. N. Candida — associated diarrhea: a syndrome in search of credibility //Clin. Inf. Dis. — 1995; 21: 881-886.
- Odds F. C. Candida and Candidiasis. Bailliere Findall, 1988. London.
С. А. Бурова, доктор медицинских наук, профессор
Национальная академия микологии, ГКБ № 81, Москва
Сегодня человечество переживает эпидемию оппортунистических инфекций, среди которых микозам принадлежит одно из ведущих мест. По данным ВОЗ, в последнее десятилетие около 20% населения мира страдает микозами [1].
Микозы – инфекционные заболевания, этиологическим возбудителем которых являются грибы. Чаще всего микозом болеют люди, имеющие первичные или вторичные иммунодефицитные состояния [2]. Микоз относится к оппортунистическим инфекциям [3, 4].
Грибы – низшие растения (более 100 тыс. видов), лишенные хлорофилла, поэтому для их существования требуются готовые органические вещества. Подавляющее большинство грибов относится к сапрофитам, меньшая часть из них – паразиты человека и животных. Около 500 видов грибов могут вызывать инфекционные болезни у человека. Чаще всего у человека встречаются дрожжеподобные С. albicans [5]. Кандидоз – антропонозный микоз, характеризующийся поражением слизистых оболочек и кожи.
Поражения у человека вызывают С. albicans (более 90% поражений), С. tropicalis, С. krusei, С. lusitaniae, С. parapsilosis, С. kefyr, С. guilliermondii и др. [6–8]. В начале XX в. кандидозы наблюдали сравнительно редко. С началом применения антибиотиков и по настоящее время заболеваемость кандидозами значительно возросла и продолжает расти. Немаловажное значение в развитии кандидозов имеет неблагоприятная экологическая обстановка, оказывающая отрицательное воздействие на иммунную систему организма человека [9]. Кандидоз обычно возникает эндогенно в результате дисфункций иммунной системы и дисметаболических расстройств в организме. В последние годы кандиды являются наиболее распространенными возбудителями оппортунистических микозов [4]. При поражении организма кандидами возможно развитие тяжелых висцеральных форм, чаще с вовлечением легких и органов пищеварения и других систем организма. Кандидоз может носить системный характер и стать диссеминированным (массивный рост возбудителя в организме) и принять картину грибкового сепсиса с поражением всех органов (почек, сердца, селезенки, мозга), а иногда с развитием септического шока [10]. Чаще эта форма кандидоза поражает больных с последней стадией рака и СПИДа [11, 12].
Этиология и патогенез
Наиболее часто встречающийся возбудитель микозов С. albicans – нормальный комменсал полости рта, ЖКТ, влагалища и иногда кожи. С. albicans относятся к условно-патогенным микроорганизмам с высоким уровнем носительства и с выраженной тенденцией к его повышению: если в 1920-е гг. носительство на слизистой ротовой полости составляло10%, то в 1960–1970-е гг. возросло до 46–52% [13].
Во многих исследованиях показано, что любые нарушения резистентности организма или изменения нормального микробного ценоза кишечника могут приводить к развитию заболевания – кандидоза [14].
Кожные покровы и слизистые оболочки являются «открытыми системами» макроорганизма, непрерывно контактирующими с окружающей средой. В свою очередь Candida spp. широко распространены в природе, часто контаминируют почву, воду, продукты питания, бытовые поверхности. Частый контакт человека с Candida spp. объясняет значительную распространенность транзиторного кандидоносительства в популяции людей. По статистическим данным, среди населения стран Европы кандиды выделяются в кале у 65–80%. Как условно-патогенный представитель микрофлоры человека грибы не представляют серьезную угрозу здоровью иммуннокомпетентного человека [15]. В то же время на фоне увеличения числа пациентов с нарушениями в системах антимикробной резистентности наблюдается значительный рост заболеваемости кандидозом [16]. Многие исследователи связывают рост кандидозов с факторами риска, к которым относят детский и старческий возраст, терапию глюкокортикостероидами и антибактериальными препаратами, интенсивную цитостатическую полихимиотерапию, сахарный диабет и другие заболевания эндокринной системы, СПИД, тяжелые истощающие заболевания, нарушение трофологического статуса, генетически детерминированные иммунодефициты [17–19].
Первичное инфицирование организма человека кандидами происходит при прохождении через родовые пути матери, о чем свидетельствуют высокая частота выделения Candida у новорожденных (до 58%) и почти полное совпадение видового состава Candida у ребенка и матери. Инфицированию способствует увеличенная частота носительства и кандидоза влагалища в последней трети беременности. Имеются сведения о передаче грибов рода Candida при кормлении грудью [20].
Грибы, паразитирующие на коже человека, питаются частицами эпидермиса, роговыми массами ногтевых пластинок, а продукты их жизни – белки вызывают аллергическую реакцию.
Фактором патогенности грибов рода Candida является их способность к адгезии и инвазии с последующим цитолизом ткани, а затем и к лимфогематогенной диссеминации [21]. Candida spp. способны к инвазивному процессу в слизистых оболочках, в первую очередь представленных многослойным плоским эпителием, реже – однослойным цилиндрическим. Чаще всего инвазивный микотический процесс наблюдается в полости рта, пищеводе, желудке и кишечнике. Доказано, что даже без внедрения вглубь эпителия Candida spp. [22] могут вызывать патологию – неинвазивную форму кандидоза. Контакт поверхностных и корпускулярных антигенов гриба с имммунокомпетентными клетками макроорганизма может привести к выработке повышенных количеств специфических IgE и сенсибилизированных лимфоцитов, что служит патогенетической основой для микогенной сенсибилизации. Аллергенами у Candida albicans являются и первичные метаболиты – алкогольдегидрогеназа и кислый P2-протеин. Это потенциально опасно в плане развития микогенных аллергических заболеваний: специфической бронхиальной астмы, атопического дерматита, крапивницы. Резорбция в кишечнике продуктов метаболизма грибов рода Candida – его плазмокоагулаза, протеазы, липофосфорилазы, гемолизин и эндотоксины могут вызвать специфическую интоксикацию и вторичный иммунодефицит [23].
За счет взаимодействия с представителями облигатной нормобиоты и условно-патогенными микроорганизмами Candida spp. могут индуцировать дисбиоз и микст-инфекцию слизистых оболочек. Ключевым фактором начала инфекционного кандидозного процесса является нарушение неспецифической и специфической резистентности организма как на местном, так и на общем уровне [23].
К факторам неспецифической резистентности традиционно относят адекватный баланс десквамации и регенерации эпителиоцитов, мукополисахариды слизи, нормальную микробиоту слизистых оболочек (Bifidobacterium spp., Lactobacillus spp., Escherichia coli, Peptostreptococcus spp.), перистальтическую активность и кислотно-ферментативный барьер пищеварительного тракта. Показано, например, что лечение больных препаратами, содержащими бифидобактерии, значительно снижает содержание грибов рода Candida в кале больных [24]. К неспецифическим факторам относят также секреторный IgA, лизоцим, трансферрин, компоненты комплемента. Однако наиболее важны число и функция полиморфноядерных мононуклеарных фагоцитов, в частности их способность к хемотаксису, аттракции, килингу и презентированию грибкового антигена. Именно в условиях нейтропении развиваются жизнеугрожающие формы кандидоза, включая висцеральные поражения (печени, желчного пузыря, поджелудочной железы) [11].
Специфический иммунный ответ при кандидозе представлен наработкой специфических противокандидозных антител классов IgA, IgG, IgM, инактивирующих ферменты инвазии и эндотоксины гриба, а также вместе с компонентами комплемента участвующих в опсонизации [25, 26].
Конфликт между факторами патогенности гриба и факторами антифунгальной резистентности приводит к развитию той или иной формы кандидоза. Механизмы патогенеза 2-х принципиально различных форм кандидоза (инвазивного и неинвазивного) легли в основу классификации кандидоза кишечника.
Клинические формы
Для практических целей необходимо выделять 3 формы поражения:
– инвазивный диффузный;
– фокальный (вторичный при язве двенадцатиперстной кишки, неспецифическом язвенном колите);
– неинвазивный (так называемый кандидозный дисбиоз) [27].
Довольно часто кандидоз органов пищеварения протекает в виде микст-инфекции: Candida-бактериальной, Candida-герпетической, Candida-протозойной, что делает клиническую картину заболевания довольно вариабельной. Частота микст-инфекции при дисбиозе кишечника с повышенной пролиферацией грибов рода Candida, по некоторым данным, составляет 63%. При этом чаще обнаруживают ассоциацию со значительным количеством бактерий с так называемым протеолитическим основным путем метаболизма (условно-патогенными): Escherichia coli, Ristella, Clostridium perfringens, Klebsiella, Morganella, Bacteroides, Staphylococcus aureus, Pseudomonas aeruginosa [28].
Среди всех локализаций кандидоза пищеварительного тракта орофарингеальная локализация занимает 1-е место [29]. Кандидозный стоматит у новорожденных — распространенное заболевание. В первые дни после рождения слизистые ребенка устойчивы к грибам. В дальнейшем недостаточная секреция IgA и постепенное снижение антимикробного иммунитета, переданного от матери, приводят к высокой заболеваемости [30, 31].
Оральный (орофарингеальный) кандидоз – широко распространенный микоз у лиц, страдающих различными формами иммунодефицитов, прежде всего СПИДом и гемобластозами, причем гастроинтестинальная локализация кандидоза у больных СПИДом может быть источником кандидемии, которая у таких больных при других локализациях кандидоза встречается всего в 1% случаев [32, 33].
Частым микозом пищеварительного тракта является кандидоз пищевода, который регистрируют как у иммунокомпетентных, так и (гораздо чаще) у иммунокомпрометированных лиц [34]. Кандидозный эзофагит в стационарах общего профиля встречается у 1,3–2,8% больных, в отделениях трансплантации — у 4%, при диссеминированном карциноматозе — у 2,8–6,7%. Это заболевание протекает часто без субъективных жалоб и выявляется случайно при «сплошных» исследованиях населения в 1–7% случаев. Иногда больные отмечают боль и дискомфорт при прохождении твердой и жидкой пищи, дисфагию, гиперсаливацию. По глубине поражения эндоскопически выделяют 4 типа — от легкого отека, гиперемии, единичных белых налетов < 1 мм в диаметре до массивного воспаления, деформации и кровоточивости слизистой, изъязвлений, вплоть до перфорации. Сравнительной оценкой различных методов диагностики кандидоза пищевода показано, что в 95% случаев кандидоз был выявлен при анализе соскобов и только в 39% – при анализе материала биопсий [35].
Микозы желудка, в т. ч. и кандидоз, при отсутствии какой-либо другой патологии соматической или бактериальной этиологии отмечают редко [36–38]. Их доля среди всех случаев кандидоза верхнего отдела пищеварительного тракта составляет лишь 5,2%. Гораздо чаще (до 17–30%) Candida spp. находят в биоптатах гастродуоденальных язв, а также при хронических гастритах [39]. Однако лишь находки псевдомицелиальных структур гриба, а не отдельных непочкующихся клеток, при морфологическом исследовании окрашенных по Романовскому – Гимзе или PAS-методом цитологических и/или гистологических препаратов, достоверно подтверждают диагноз кандидоза желудка. В последние годы Candida spp. часто выделяют в ассоциации с Helicobacter pylori, причем стандартная противохеликобактерная терапия способствует увеличению частоты кандидоза желудка [40]. Подавляющее большинство Candida spp., выделенных от больных (65,6%), обладали высокой или умеренной вирулентностью. При выделении из желудочного сока больных гастродуоденальными заболеваниями ассоциации Candida spp. и Helicobacter pylori можно предполагать более тяжелое течение заболевания, а планируемую антибактериальную терапию необходимо проводить совместно с антифунгальной [39].
Кандидоз кишечника как изолированная форма заболевания бывает нечасто. Обычно он является продолжением кандидоза желудка и верхнего отдела пищеварительного тракта. Кандидоз кишечника нередко сопровождается диареей. Различают диареи различной этиологии [40] с сопутствующим выделением Candida и кандидозные диареи (КД), при которых Candida является единственным выделяемым возбудителем. Основным предрасполагающим фактором риска КД, особенно у госпитализированных больных, является антибиотикотерапия. Другие факторы риска: эндокринные нарушения, иммунные дисфункции, неоплазмы, стероидная терапия; играет роль и пожилой возраст больных [41]. У больных КД чаще выделяют С. albicans, далее – C. krusei, C. tropicalis, C. kefyr, C. stellatoidea, C. guilliermondii, C. parapsilosis, C. lusitaniae [41]. В тех случаях, когда Candida является компонентом нормальной биоты кишечника, его рост и размножение подавляются микроорганизмами кишечника, где гриб присутствует в стабильном количестве и не размножается [35]. При подавлении бактериобиоты антибиотиками отмечается размножение дрожжей с образованием у них ростовых трубок и появлением мицелиальных структур. По данным Т.В. Толкачевой с соавт. [13], частота выделения дрожжевых грибов из кишечника иммунокомпрометированных больных сохраняется высокой, достигая в последние 2 года 63–65%. Соотношение частоты выявления штаммов C. albicans и non-albicans составляет 52,5%. Среди последних доминируют C. krusei (40%), C. glabrata (28%) и C. kefyr (15,6%) [42]. Отмечено увеличение частоты встречаемости ассоциации из 2-х видов Candida non-albicans и расширение видового спектра дрожжевых грибов, колонизирующих кишечник больных гемобластозами. Кандидоз толстого кишечника – редкое заболевание, чаще он регистрируется в ассоциации с другими кишечными патогенами бактериальной природы [43]. В последние годы выдвинута гипотеза о том, что хронический кишечный кандидоз является, возможно, этиологическим фактором формирования синдрома хронической усталости [44].
Признаки микогенной сенсибилизации выявляют у 10,4% больных с дисбиозом кишечника с избыточным ростом грибов рода Candida. Диагноз устанавливают при наличии следующих критериев, таких как: флатуленция, абдоминальный дискомфорт, изменения консистенции и частоты стула, признаки умеренной интоксикации и тенденция к обострению аллергических заболеваний.
Грибковому поражению билиарной системы способствуют предшествующие дискинезия желчевыводящих путей, диспанкреатизм, лямблиоз, холестаз, гипотония желчного пузыря и другие поражения. При этих состояниях создаются благоприятные условия для размножения грибов и других микроорганизмов. Причиной кандидозного холецистита могут быть камни в желчных протоках, которые часто являются «резервуаром» для грибов, некоторые авторы даже называют их «грибковыми тельцами» или «кандидозными камнями». Микозы желчевыводящих путей встречаются чаще, чем принято считать.
Диагностика
Диагностика кандидоза с помощью чисто клинических методов невозможна ввиду того, что его клинические проявления не имеют абсолютной специфичности. В подавляющем большинстве случаев современная клинико-лабораторная инструментальная база позволяет провести высококачественное обследование и помочь клиницисту в постановке диагноза, а также назначить эффективное лечение инфекций, вызванных грибами. В последние годы за счет эндоскопических технологий расширились возможности диагностики грибкового эзофагита и гастрита. При эзофагогастродуоденоскопии обращают внимание на гиперемию и изъязвления слизистой, наличие белых налетов и пленок, сужение просвета пищевода, скопление слизи [45]. Во время этой процедуры в обязательном порядке следует брать материал для микробиологического исследования, т. к. не всегда этиология этих проявлений – грибковая. Причем информативность исследования налетов выше, чем биоптатов (95% по сравнению с 39%). Особенно перспективны видеоинформационные эндоскопические исследования с цифровой регистрацией и анализом изображения. Четкое разграничение неизмененных и патологических тканей, анализ гистохимических процессов в слизистой оболочке пищеварительного тракта возможны с помощью эндоскопической спектроскопии и флюоресцентной эндоскопии [46]. Видео- и колоноскопия, хромоэндоскопия на фоне «лекарственного» сна по технологии «Диантек» отличаются высоким качеством исследования, безболезненностью манипуляций и отсутствием стресса и страха у пациентов [8].
Следует, однако, подчеркнуть, что инвазивные манипуляции при воспаленной слизистой ЖКТ небезопасны, могут способствовать грибковой и бактериальной диссеминации, а иногда приводят к травме и перфорации стенки пищевода или желудка. Эндоскопическая ультрасонография с допплеровским картированием, контрастным усилением тканевых и сосудистых структур перспективна, она позволяет детально дифференцировать все слои стенки пищеварительного тракта. Неинвазивные методы — виртуальная эндоскопия, позволяющая получить 3-мерное изображение, магнитно-резонансное исследование — имеют большое будущее [47].
Изучение гастродуоденальной моторики с помощью сцинтиграфии и электрогастрографии также важно для диагностики и назначения дополнительных лекарственных средств, т. к. нарушение двигательной функции желудка, «застой» в ЖКТ создают условия для размножения грибов и бактерий. Колоноскопия дает возможность оценить состояние слизистой кишечника, наличие белого налета, язвенных дефектов и т. д. В перспективе в гастроэнтерологии будут внедряться методы, в основе которых лежат новые научно-практические исследования: иммуноферментный анализ фекальных антигенов, ПЦР и даже генетическое тестирование [5, 47].
Лабораторное подтверждение грибкового заболевания ЖКТ возможно при микроскопировании и/или культуральном исследовании смывов со слизистых оболочек полости рта и пищевода, содержимого желудка и кишечника, патологических пленок, налетов и др. Количественная оценка грибов в биосубстратах должна проводиться в сопоставлении с клинической симптоматикой, с учетом наличия фоновых заболеваний, микст-инфекции и т. д. [48]. Например, обнаружение на слизистых единичных колоний Candida не является основанием для постановки диагноза «кандидоз» у иммунокомпетентных пациентов. В кале диагностическую значимость приобретает количество колоний (более 105–106). По-другому, с более низким диагностическим порогом, интерпретируются результаты посевов у иммуносупрессированных лиц, при нейтропении у больных СПИДом и в отделениях интенсивной терапии [49, 50]. Следует также обращать внимание на способность грибов к вегетации и образованию мицелия, т. к. это является одним из лабораторных признаков, подтверждающих диагноз кандидоза. Гистологическое (окраска по Гомори–Гроккоту, ШИК-реакция) и цитологическое (окраска по Романовскому – Гимзе) исследования биоптатов позволяют обнаружить тканевые формы грибов. Многими авторами эти методы рассматриваются как наиболее достоверные. Кроме того, мицелий и псевдомицелий в тканях служат подтверждением наличия инвазивной формы грибковой инфекции ЖКТ [51].
Микробиологическое исследование порций желчи, полученных при многофракционном дуоденальном зондировании, позволяет дифференцировать грибковую от бактериальной или функциональной патологии двенадцатиперстной кишки, желчного пузыря, желчевыводящих путей и печени.
Заключение
Таким образом, на сегодняшний день кандидоз является наиболее часто встречающимся типом грибковой инфекции. Люди с ослабленным иммунитетом должны воспринимать любые проявления кандидоза серьезно и обращаться к врачу при первых признаках заболевания для проведения терапии.
Содержание
- Основные причины развития заболевания
- Виды кишечного кандидоза
- Проявление симптомов кандидоза кишечника
- Потенциально возможные осложнения
- Диагностирование заболевания
- Основные методы лечения
- Дополнительные рекомендации для больных
- Видео в тему
Один из самых распространенных грибков, который большую часть времени обитает в организме человека без видимых признаков – это грибок Candida. Каждый, кто хоть раз в жизни сталкивался с молочницей, знает, насколько это неприятное и достаточно болезненное заболевание.
Дело в том, что кишечный кандидоз может появиться у абсолютно любого человека в момент упадка иммунных ресурсов организма. Этот грибок находится на еде, мебели и многих других вещах, потому стоит знать все о том, как с ним бороться, если заражение произошло.
Основные причины развития заболевания
Специалисты отмечают, что очень часто кандидоз кишечника может развиваться из-за какого-либо другого заболевания, вызвавшего нарушения в иммунной системе организма. Поскольку грибок уже находится внутри тела, он есть у всех жителей нашей планеты, как только появляются подходящие для роста условия, и подавление организмом уже не столь сильное, начинается вспышка заболевания со всеми соответствующими последствиями.
Причинами проявления заболевания могут стать:
- Вредные привычки, ослабляющие организм и нарушающие работу многих его систем;
- Инфекции желудочно – кишечного тракта;
- Дисбактериоз;
- Прием антибиотиков на протяжении длительного времени;
- Онкологические заболевания, связанные с желудком или кишечником;
- Неправильное питание;
- Хронические заболевания пищеварительной системы;
- Болезни печени;
- Аллергии;
- Самостоятельное лечение (тот же прием антибиотиков, только без назначения врача).
Также определяющим фактором здесь может стать особый период в жизни, например беременность или же неспособность организма защищаться от грибка, введу возрастных особенностей. К тому же, приобретенный иммунодефицит и какие-либо нарушения в работе эндокринной системы, тоже могут быть причиной развития молочницы в кишечнике.
Как и в случае с кандидозом в других частях тела, эта разновидность достаточно легко определяется, как визуально, так и по ощущениям, потому при появлении симптомов не стоит спешить принимать антибиотики в надежде, что это простое отравление — лучше обратиться к врачу. К тому же, кандидоз кишечника, причины появления которого бывают самыми разными, не всегда проходит без последствий, потому не стоит медлить с лечением.
Виды кишечного кандидоза
На данный момент есть два определения этого вида (формы) молочницы:
- Инвазивный. Достаточно сложный вид кандидоза, который проявляется не только в самом кишечнике, но может прогрессировать и на легких, печени, а также других органах. Для него характерны полное расстройство работы пищеварительной системы, так называемый «жидкий стул», дополняющийся кровяными выделениями. Но болеть именно такой формой будет далеко не каждый, поскольку она развивается лишь в очень слабых организмах, пораженных ВИЧ – инфекцией, раковыми опухолями или находящихся под постоянным влиянием гормональных препаратов;
- Неинвазивный. В данном случае происходит поражение слизистой именно кишечника, и локальное развитие заболевания. Происходит уничтожение микрофлоры, характерной для здорового человека. В любом случае, пытаться вылечить эту форму кандидоза самостоятельно не стоит.
Как бы ни проявлялась молочница кишечника, и насколько сложной не была бы её форма, не нужно пытаться решить задачу в домашних условиях, поскольку, скорее всего, развивается заболевание не просто так и здесь нужен комплексный подход, а также тщательное обследование всего организма, для поиска первоначальной причины.
Проявление симптомов кандидоза кишечника
Введу того, что у каждого кандида в кишечнике развивается с разной скоростью, симптомы будут проявляться также по – разному, в большей степени это зависит от состояния организма и способа ведения жизни в момент самого заболевания. Также течение болезни может идти разными путями, поскольку есть две её формы, но при инвазивном кандидозе, лечение будет проводиться совершенно другими методами.
Если брать все возможные варианты, то признаки кандидоза кишечника могут выглядеть следующим образом:
- В первую очередь ощущаются боли в животе;
- Начинается диарея, притом в кале можно рассмотреть белые вкрапления, кровь, а также слизь. Связано это с тем, что после попадания грибка в желудок и дальнейшего его развития в кишечнике, на стенах внутренних органов могут образовываться язвы и, что самое неприятное – начинается некроз;
- Во время посещения туалета, могут возникать боли в прямой кишке;
- Вздутие;
- После еды могут начинаться спазмы в животе, помимо того, нередко аппетит вообще пропадает;
- Ночью может повышаться потливость;
- Общее воспаление кишечника.
Не стоит забывать о том, что проявляются эти симптомы при разных формах кандидоза, то есть, если дело доходит до поражения внутренних органов, сопровождения этой болезни еще и молочницей ротовой полости и паха, выделения крови и прочего – это уже, скорее всего, более редкая, инвазивная форма.
Но, опять же, это сможет определить только лишь врач, потому паниковать, заранее не стоит. Обычные симптомы молочницы не выходят за пределы болей и незначительных выделений на ранних её стадиях.
Потенциально возможные осложнения
Важно помнить, что как только появились подозрения насчет возможного развития в организме кандидоза кишечника, симптомы которого были описаны выше, необходимо как можно скорее посетить врача и начать лечиться, иначе можно добиться очень неприятных последствий.
Начав своевременное лечение проявляющегося грибка, можно избавить себя от следующих осложнений:
- Перфорация кишечника. В таком случае инфекция попросту разрушает кишку, вызывая образование отверстий в её стенах, через которые все содержимое выпадает в брюшную полость;
- Появление кровотечений по всему кишечнику;
- Развитие язв;
- Возможен сепсис, при попадании микроорганизмов в кровь;
- При затягивании лечения, можно получить хроническую форму заболевания;
- Замедление развития у маленьких детей;
- Может начаться развитие кандидозной пневмонии;
- При самых запущенных случаях, когда кровь полностью заражена грибком, имеется даже вероятность летального исхода.
Именно потому стоит четко знать, как лечить кандидоз кишечника, а вернее, как быстро обращаться к врачу, для решения этой проблемы. Никакие народные средства не смогут искоренить инфекцию из организма, потому нет необходимости тратить время на это.
Диагностирование заболевания
Это один из немногих случаев, когда грибок, а вернее его наличие в чрезмерном количестве, пациент сможет определить даже самостоятельно. Само собой, после этого нужно отправляться в больницу, даже если все будет нормально, тем не менее. Для эксперимента, берется стакан с кипяченой водой и больному остается лишь хорошенько туда сплюнуть.
Ждать придется всего минут 30, поскольку если в организме повышенное количество грибка этого рода, то слюна опустится на дно. Как бы там ни было, диагностировать болезнь нужно более профессиональными методами. В тот момент, когда симптомы и лечение этой болезни будут определены точно, лучше всего незамедлительно перейти к приему препаратов.
Обычно выполняется порядка трех различных анализов. Когда молочница в кишечнике проявляет свои симптомы, берутся следующие образцы:
- Кровь, для определения количества иммуноглобулинов. Если их много, значит, грибок прогрессирует;
- Анализ кала, для выявления количественного соотношения микроорганизмов характерных для этой среды, и грибков. Также, благодаря этому анализу, удается точно выяснить, какие именно препараты наилучшим образом противодействуют найденным микроорганизмам;
- Анализ мочи, для выявления отходов, которые грибок оставляет вследствие своей жизнедеятельности.
Суть в том, что молочница кишечника, симптомы который проявляются различными способами, может быть не обнаружена при каком-то одном анализе, потому комплексный подход к решению вопроса обязателен. Только после проведения необходимых процедур, можно начинать лечение кандидоза кишечника под присмотром врача.
Основные методы лечения
Необходимо понимать, что нет единого рецепта для каждого больного, ведь сопутствующие заболевания, запущенность текущей болезни, а также множество других факторов, будут влиять на решение врача. В большинстве случаев, схема лечения кандидоза кишечника состоит из трех пунктов:
- Проведение терапии против грибков;
- Терапия для восстановления работы кишечника, его микрофлоры, а также укрепления иммунной системы организма;
- Разработка индивидуальной диеты, для нормализации функционирования желудочно – кишечного тракта.
Нельзя забывать и о том, что вылечить кандидоз будет невозможно, если не выяснить, какая именно из его форм прогрессирует в теле человека. Когда обнаруживается неинвазивная форма, то в таком случае прописываются препараты вроде Флуконазола, Пимафуцина, Кетоконазола или Итраконазола. При этом вышеуказанные средства лучше всего вводить инъекциями, поскольку так они лучше достигнут пораженных грибком мест.
Если же диагностируется инвазивная форма кандидоза, то в таком случае используют лишь те средства, которые всасываются в кровь и разносятся по всему организму. Иногда к ним дополнительно приписывают еще и препараты антибактериального действия.
Поскольку лечение кандидоза кишечника у женщин и у мужчин в некоторой мере проводится одинаково, три основных направления, которые были указанны выше, наиболее часто используются врачами. Тем не менее, в большинстве случаев, задействуются именно индивидуальные схемы лечения, ведь как появляется болезнь и как она проходит в организме, зависит именно от его состояния.
Дополнительные рекомендации для больных
Есть ряд рекомендаций от специалистов, касающиеся диеты, которую будут составлять во время курса лечения. Не все относятся к этому серьезно, потому необходимо обозначить самые вредные продукты, которые не стоит принимать во время лечения.
Все это выглядит следующим образом:
- Не желательно создавать в организме кислую среду, идеальную для грибка, принимая во время лечения цитрусовые;
- Не рекомендуется также принимать в пищу: виноград и бананы, поскольку большое количество глюкозы в них, также подкрепит грибок;
- Помимо того, кандидоз кишечника, лечение которого длится достаточно долго, может прогрессировать, если употреблять алкоголь, любой вид дрожжевого теста, а также мёд;
- Такая продукция, как уксус, пищевые маринады и соусы, тоже помогут болезни в развитии, потому от них лучше воздержаться;
- Для любителей мяса тоже найдутся ограничения, поскольку желательно отказаться от колбас, картошки и ветчины;
- Сладости и острые блюда не рекомендуются.
Единственное, что может стать дополнительной помощью во время лечения – клетчатка, содержащаяся в овощах и зелени, именно ею и стоит разнообразить свою диету, и то, исключительно по рекомендации врача, а не самостоятельно.