Как определить ионную связь
Когда между атомами образуется химическая связь, происходит перераспределение электронной плотности. В результате, могут образоваться заряженные частицы – ионы. Если атом теряет электроны, он становится катионом – положительно заряженным ионом. Если же он притягивает к себе чужой электрон, становится анионом – отрицательно заряженным ионом. А поскольку частицы с разными зарядами могут притягиваться друг к другу, ионы образуют химическую связь. При этом образуются химические соединения. Эта связь так и называется ионная.

Инструкция
Существует закономерность: ионную связь образуют главным образом атомы щелочных и щелочноземельных металлов, соединяясь с атомами галогенов. То есть прежде всего посмотрите на химическую формулу вещества. Вот, например, поваренная соль – хлористый натрий, NaCl. Натрий – щелочной металл, находится в первой группе таблицы Менделеева, хлор – газ, галоген, находится в седьмой группе. Следовательно, в молекуле поваренной соли – ионная химическая связь. Или, например, фтористый калий, КF. Калий — также щелочной металл, причем еще более активный, чем натрий. Фтор – галоген, еще более активный, чем хлор. Поэтому в молекуле этого вещества – тоже ионная химическая связь.
Об ионном типе связи могут свидетельствовать некоторые физические признаки. Например, вещества с такой связью имеют высокие температуры плавления и кипения. У того же хлористого натрия они составляют 800,8 и 1465 градусов, соответственно. Растворы таких веществ проводят электрический ток. Если вы обнаружите подобные свойства – знайте, что это вещество с ионной связью.
Можно воспользоваться значениями электроотрицательности каждого химического элемента, то есть показателем того, насколько легко атом этого элемента притягивает или отдает электроны. Существуют разные таблицы электроотрицательности. Наиболее широко известна шкала Полинга, названная в честь известного американского ученого. Минимальное значение электроотрицательности по этой шкале имеет самый активный щелочной металл франций (0,7), максимальное – самый активный галоген фтор (4,0).
Чтобы определить, имеет ли ионный тип связи вещество, состоящее из двух элементов, необходимо сделать следующее: найдите электроотрицательности этих элементов (по шкале Полинга).
Вычтите из большего значения меньшее значение. То есть установите разность электроотрицательностей (ЭО). Например, для той же самой поваренной соли она будет составлять: 3,16(Cl)–0,99(Na)=2,17. Сравните полученную величину ЭО с 1,7. Если она больше этого значения – связь в веществе ионная.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни.
Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженную частицу. Такие частицы называются ионами.
Ионы — заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной.
Ионная связь — связь между положительно и отрицательно заряженными ионами.
Рассмотрим механизм образования ионной связи на примере взаимодействия натрия и хлора.
Na0+Cl0→Na++Cl−→Na+Cl−
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов, электроотрицательности которых резко различаются.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов.
Рассмотрим другие примеры образования ионной связи.
Пример:
Взаимодействие кальция и фтора
1. Кальций — элемент главной подгруппы второй группы. Ему легче отдать два внешних электрона, чем принять недостающие.
2. Фтор — элемент главной подгруппы седьмой группы. Ему легче принять один электрон, чем отдать семь.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2). Определим число атомов фтора, которые примут два электрона от атома кальция: (2) (:) (1) (=) (2).
4. Составим схему образования ионной связи:
Пример:
Взаимодействие натрия и кислорода
1. Натрий — элемент главной подгруппы первой группы. Он легко отдаёт один внешний электрон.
2. Кислород — элемент главной подгруппы шестой группы. Ему легче принять два электрона, чем отдать шесть.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2) (:) (1) (=) (2). Определим число атомов натрия, которые отдадут два электрона атому кислорода: (2).
4. Составим схему образования ионной связи:
С помощью ионной связи образуются также соединения, в которых имеются сложные ионы:
.
Значит, ионная связь существует также в солях и основаниях.
Обрати внимание!
Соли аммония
NH4NO3,NH4Cl,NH4SO42
не содержат металла, но образованы ионной связью.
Ионы создают вокруг себя электрическое поле, действующее во всех направлениях. Поэтому каждый ион окружён ионами противоположного знака. Такое соединение представляет собой огромную группу положительных и отрицательных частиц, расположенных в определённом порядке.
Рис. (1). Ионный кристалл
Притяжение между ионами довольно сильное, поэтому ионные вещества имеют высокие температуры кипения и плавления.
Обрати внимание!
Все ионные соединения при обычных условиях — твёрдые вещества.
Примеры веществ с ионной связью:
|
|
|
 |
|
Рис. (2). Питьевая сода |
Рис. (3). Железный купорос |
Рис. (4). Поваренная соль |
Источники:
Рис. 1. Ионный кристалл https://upload.wikimedia.org/wikipedia/commons/e/eb/Sodium_chloride_crystal.png
Рис. 2. Питьевая сода https://pixabay.com/images/id-768950/ 8.06.2021
Рис. 3. Железный купорос https://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/Iron%28II%29-sulfate-heptahydrate-sample.jpg/1280px-Iron%28II%29-sulfate-heptahydrate-sample.jpg
Рис. 4. Поваренная соль https://upload.wikimedia.org/wikipedia/commons/9/93/Chlorid_sodn%C3%BD.JPG
Ионы – это атомы, потерявшие или получившие электроны и, как следствие, некоторый заряд. Для начала хотелось бы напомнить, что ионы бывают двух типов: катионы (положительный заряд ядра больше, чем количество электронов, несущих отрицательный заряд) и анионы (заряд ядра меньше количества электронов). Ионная связь образуется в результате взаимодействия двух ионов с разноименными зарядами.
Ионная и ковалентная связь
Данный тип связи является частным случаем ковалентной. Разность электроотрицательностей в данном случае столь велика (более чем 1,7 по Полингу), что общая пара электронов не частично смещается, а полностью переходит к атому с большей электроотрицательностью. Поэтому образование ионной связи является результатом возникновения сильного электростатического взаимодействия между ионами. Важно понимать, что не существует стопроцентно ионной связи. Данный термин применяется, если «ионные признаки» более выражены (т.е. электронная пара сильно смещена к более электроотрицательному атому).
Механизм ионной связи
Атомы, имеющие практически полную или практически пустую валентную (внешнюю) оболочку, наиболее охотно вступают в химические реакции. Чем меньше пустых орбиталей на валентной оболочке, тем выше шанс, что атом получит электроны извне. И наоборот – чем меньше электронов находится на внешней оболочке, тем вероятнее, что атом отдаст электрон.
Это способность атома притягивать к себе электроны, поэтому атомы с наиболее заполненными валентными оболочками более электроотрицательны.
Типичный металл охотно отдает электроны, тогда как типичный неметалл охотнее их забирает. Поэтому чаще всего ионную связь образуют металлы и неметаллы. Отдельно следует упомянуть другой тип ионной связи – молекулярную. Ее особенность в том, что в роли ионов выступают не отдельные атомы, а целые молекулы.
Схема ионной связи
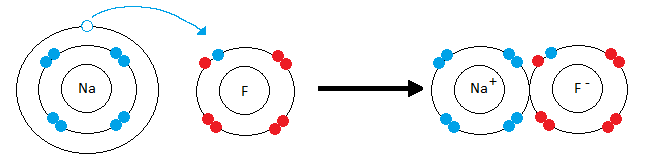
На рисунке схематически изображено формирование фторида натрия. Натрий имеет низкую электроотрицательность и всего один электрон на валентной оболочке (ВО). Фтор – значительно более высокую электроотрицательность, ему не хватает всего одного электрона для заполнения ВО. Электрон с ВО натрия, переходит на ВО фтора, заполняя орбиталь, в следствии чего оба атома приобретают разноименные заряды и притягиваются друг к другу.
Свойства ионной связи
Ионная связь достаточно сильна – разрушить ее при помощи тепловой энергии крайне сложно, а потому вещества с ионной связью имеют высокую температуру плавления. В то же время радиус взаимодействия ионов достаточно низкий, что обуславливает ломкость подобных соединений. Важнейшими ее свойствами являются ненаправленность и ненасыщаемость. Ненаправленность происходит из формы электрического поля иона, которое представляет собой сферу и способно взаимодействовать с катионами или анионами во всех направлениях. При этом поля двух ионов не компенсируются полностью, вследствие чего они вынуждены притягивать к себе дополнительные ионы, образуя кристалл, – это и есть явление, называемое ненасыщаемостью. В ионных кристаллах нет молекул, а отдельные катионы и анионы окружены множеством ионов противоположного знака, количество которых зависит в основном от положения атомов в пространстве.
Кристаллы поваренной соли (NaCl) – типичный пример ионной связи.
Таблица веществ с ионной связью
| Название | Формула | Применение и свойства |
|---|---|---|
| Бромид серебра | AgBr | Ионная связь в молекуле разрывается под воздействием фотонов (фотолиз), что широко применяется в фотографии и оптике. |
| Хлорводород | HCl | Как следует из формулы, ионная связь тут образуется между хлором и водородом, а потому водный раствор HCl (соляная кислота), широко применяется для получения различных хлоридов. |
| Оксид кальция | CaO | Негашеная известь. Широко применяется при производстве кирпича. |
| Фторид натрия | NaF | Применяется для укрепления зубной эмали, в производстве керамики. |