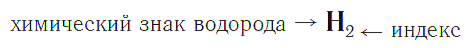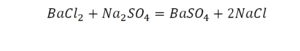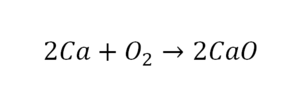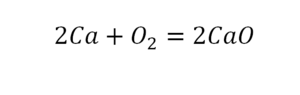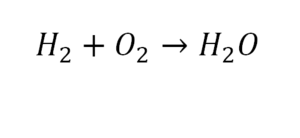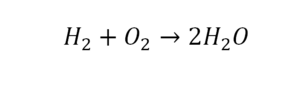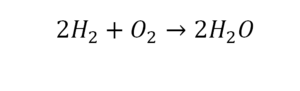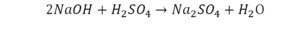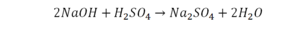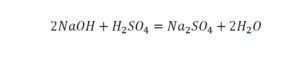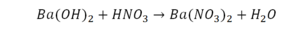«Химическая формула. Индекс и коэффициент.
Формульная единица»
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Представленные на рисунке формулы читаются так: три-купрум-хлор-два, пять-алюминий-два-о-три, три-феррум-хлор-три.
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
ЗАДАНИЕ. Обозначить, используя символы химических элементов
а) три молекулы азота
б) семь молекул сульфида железа
в) четыре атома серы
г) два атома кальция
д) семь молекул воды
е) четыре молекулы кислорода
ж) две молекулы сернистой кислотыОТВЕТ:
а) три молекулы азота — 3N2
б) семь молекул сульфида железа — 7FeS
в) четыре атома серы — S4
г) два атома кальция — Ca2
д) семь молекул воды — 7H2O
е) четыре молекулы кислорода — 4O2
ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4.
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
Следующая тема: «Массовая доля элемента в соединении».
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.
Состав любого вещества выражается в виде химической формулы.
Химическая формула — это условная запись состава вещества с помощью химических знаков и индексов.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
и читается «аш-два».
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
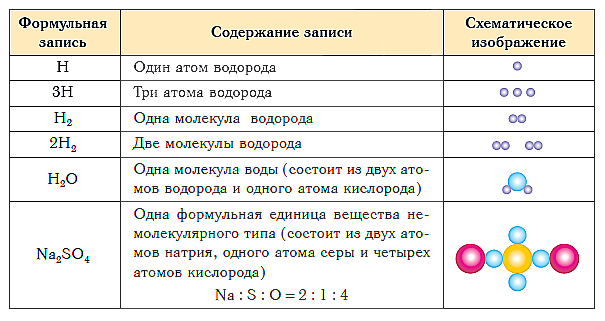
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.
- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химическая формула вещества — условная запись вещества, отражающая его качественный и количественный состав.
Символы химических элементов показывают из каких атомов состоит вещество (его качественный состав), а индексы — число атомов химических элементов в веществе (его количественный состав).
Индекс — цифра, находящаяся справа внизу символа химического элемента, обозначающая число атомов этого элемента в химической формуле вещества.
Обрати внимание!
Индекс «(1)» в химической формуле опускается (не пишется).
Если в формуле записан знак химического элемента без индекса, значит, в частице вещества содержится один атом данного элемента.
Химические формулы веществ молекулярного строения показывают состав молекул. Это молекулярные формулы.
Пример:
(«о-два») — молекулярная формула кислорода. В молекуле кислорода содержатся два атома химического элемента кислорода.
(«гелий») — молекулярная формула инертного (благородного) газа гелия. Молекулы благородных газов одноатомные.
(«аш-два-эс-о-четыре») — молекулярная формула серной кислоты. Молекула серной кислоты содержит два атома водорода, один атом серы и четыре атома кислорода.
Химические формулы веществ немолекулярного строения показывают простейшее соотношение числа атомов химических элементов в веществе. Такие формулы называют простейшими формулами.
Группа атомов, состав которой соответствует простейшей формуле вещества, называется формульной единицей.
Для простых веществ немолекулярного строения формульной единицей является атом, поэтому их формулы записывают просто знаками химических элементов без индексов.
Пример:
(«купрум»)— формула меди, которая показывает, что её формульной единицей является атом.
(«феррум-два-о-три») — простейшая формула оксида железа(
III
). В этом веществе на два атома железа приходится три атома кислорода.
Обрати внимание!
Повторяющиеся группы атомов в формуле заключают в скобки.
Пример:
(«магний-о-аш-дважды»)— в гидроксиде магния на один атом магния приходится два атома кислорода и два атома водорода.
(«кальций-три-пэ-о-четыре-дважды»)— в фосфате кальция на три атома кальция приходится два атома фосфора и восемь атомов кислорода.
В химических записях используются коэффициенты.
Коэффициент — цифра в химической записи, которая ставится перед формулой и показывает число отдельных атомов, молекул или формульных единиц.
Обрати внимание!
Коэффициент «(1)» не записывается.
Пример:
— три молекулы водорода, каждая из которых состоит из двух атомов химического элемента водорода.
— десять молекул серной кислоты, содержащих по два атома водорода, одному атому серы и по четыре атома кислорода.
— две формульные единицы гидроксида магния, состоящие из одного атома магния, двух атомов кислорода и двух атомов водорода.
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Как узнать индексы в уравнениях химических реакций
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Представленные на рисунке формулы читаются так: три-купрум-хлор-два, пять-алюминий-два-о-три, три-феррум-хлор-три .
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
ЗАДАНИЕ. Обозначить, используя символы химических элементов
а) три молекулы азота
б) семь молекул сульфида железа
в) четыре атома серы
г) два атома кальция
д) семь молекул воды
е) четыре молекулы кислорода
ж) две молекулы сернистой кислотыОТВЕТ:
а) три молекулы азота — 3N2
б) семь молекул сульфида железа — 7FeS
в) четыре атома серы — S4
г) два атома кальция — Ca2
д) семь молекул воды — 7H2O
е) четыре молекулы кислорода — 4O2
ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4.
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
Как определять, находить коэффициент в химических уравнениях
Уравнение реакции в химии — символическая запись протекания химического взаимодействия с помощью математических знаков, химических обозначений и коэффициентов. Расставить в химических уравнениях коэффициенты можно несколькими способами, каждый из которых имеет свои преимущества и уровень сложности.
Распространненые способы уравнивания
Существует не один способ правильной расстановки коэффициентов в химических уравнениях. Чтобы найти нужную схему реакций, можно ознакомиться с самыми распространёнными методами:
- Подбор коэффициентов. В этом способе расставляются акценты на нахождение наименьшего общего кратного и приравнивания к нему обеих частей уравнения.
- Запись онлайн. Безусловно, наипростейший из всех представленных, для которого нужно лишь уметь находить подходящий сайт.
- Вычисления столбиком. Способ представляет собой математическую запись с подбором.
- Метод полуреакций. Иногда встречается под названием «Электронно-ионный баланс», используется при окислительно-восстановительных реакциях.
Чтобы научиться уравнивать химические записи, необходимо разобраться в перечисленных способах. Безусловно, необязательно запоминать каждый, но ознакомившись с методами, легче подобрать тот, с которым расставить коэффициенты в уравнениях химических реакций станет упрощённой задачей.
Подбор коэффициентов
Чтобы решить, как расставить индексы и коэффициенты в записи, можно использовать метод подбора, который считается самым лёгким и понятным, среди прочих:
- Изначально в левой части реакции записываются исходные вещества, ставится стрелка к правой, ещё не заполненной части.
- В правой части записываются полученные продукты.
- В этом пункте происходит выравнивание коэффициентов за счет закона сохранения массы, который гласит о том, что с обеих сторон уравнения должно быть одинаковое количество атомов.
- Число атомов проверяется на соответствие в правой и левой частях уравнения и под стрелкой рисуется диагональная черта.
Метод подбора активно применяется при записи реакций, у которых продуктом является одно вещество. Он наиболее лёгок для понимания и запоминания, с него начинается путь уравнивания записей для школьников 8 класса.
Вычисления с помощью столбика
Такой способ заключается в том, чтобы определять нужные числа с помощью валентностей, составляя небольшие уравнения. Всё, что нужно, — уметь правильно определить, показывать и посчитать исходные реагенты и продукты реакции.
Шаг первый — записать реакцию и в двух столбиках перечислить реагенты и продукты.
Ag + O2 -> AgO. Вещества из этого примера распределяем в 2 колонки, соответственно Ag, O2 — в одной, AgO — в другой.
Следующее действие — расставление валентностей и поиск наименьшего общего кратного.
Валентность серебра — постоянная, в соединении с кислородом также III. Поэтому нужно показать в столбцах эти валентности (II и III). Наименьшим общим кратным является число 6, значит, количество молекул серебра нужно домножить на 2.
Предпоследний шаг — сравнение коэффициентов и индексов.
Сравнивая обе части записи, можно заметить, что они неравны, поэтому необходимо найти сумму и в продуктах поставить индекс 2, а перед серебром в части реагентов — 4. Так получается уравнение: 4Ag + O2 = 2 Ag2O.
Этот вариант похож на метод уравнивания, но отличается тем, что в нём нужно учитывать не закон сохранения массы, а больше внимания уделять валентности элемента. Он используется при вычислении как простых и коротких записей, так и громоздких, достаточно сложных.
Решение методом полуреакций
Способ полуреакций создан для упрощения составления ионных реакций. В нём учитывается число зарядов и их направленность. Для уравнивания по числу зарядов нужно от той части схемы, в которой прописаны реагенты отнять количество электронов, равное коэффициенту перед продуктом из правой части схемы. После этого стрелку можно заменить на знак равенства.
Несколько советов для уравнивания реакций
Прежде всего, стоит изучить все способы выравнивания коэффициентов и понять, с помощью какого метода записывать будет проще, быстрее и удобнее. Для этого нужно рассмотреть плюсы и минусы способов и согласовать их со слабыми и сильными сторонами в понимании химии.
Если же подробное изучение темы не понадобится в дальнейшем, а уравнять реакцию нужно только единожды, можно воспользоваться множеством сайтов, которые предлагают решить проблему онлайн. Нужно просто ввести уравнение в нужное поле.
http://na5.club/himiya/kak-opredelyat-nahodit-koefficzient-v-himicheskih-uravneniyah.html
Тема. Химические формулы. Индексы.
Цель. Сформулировать представление о
химической формуле, качественном и количественном составе вещества.
Задачи:
·
Ввести
понятие «Химическая формула», «индекс», «коэффициент»
·
Научить
правильно читать химические формулы, характеризовать качественный и
количественный состав вещества по формуле.
·
Развивать
умение анализировать, сравнивать, сопоставлять и обобщать
·
Формирование
целостного мировоззрения
Планируемые результаты.
Предметные. Знать определение понятия
«химическая формула», что обозначает индекс в химической формуле. Уметь
характеризовать по данной химической формуле качественный и количественный
состав вещества.
Метапредметные. Формировать умение
рассуждать логически, применять знаки и символы для решения учебных и
познавательных задач.
Личностные. Формировать ответственное
отношение к учебе.
Тип урока. Получение новых знаний
Оборудование. Шаростержневая модель воды
Ход урока
I.
Организационный
момент
Вступительное
слово учителя.
II.
Проверка
Д/з
1.
Путешествие
по таблице.
·
Назовите
химические элементы, которые начинаются на букву: «а», «к», «б»
·
Составьте
название элементов из букв: Б, Л, М, Р, О, Х.
·
Составьте
название химических элементов из слог: РА, МАГ, ЛИТ, НИЙ, ИЙ, ДИЙ.
·
Какие
элементы названы в честь: частей света (Европий, Америций), стран (Франций,
Германий, Полоний, Рутений, Галий), планет и небесных светил (Уран,
Нептуний, Плутоний, Гелий, Церий), героев мифов (Прометий, Титан, Тантал,
Необий, Плутоний)
·
Название
каких химических элементов переводится как: фиолетовый (йод), зловоний (бром),
новый (неон), скрытый (криптон), чужой (ксенон), краска
(хром).
·
Заполните
пустые клетки Ag, Br, Fe,
H, I,
O, Sn:
(олово, йод, бром, водород, кислород, железо, серебро)
|
О |
|||||||
|
О |
|||||||
|
О |
|||||||
|
О |
|||||||
|
О |
|||||||
|
О |
|||||||
|
О |
III.
Мотивация
учебной деятельности
—
Мы выучили «буквы» — химические символы. Теперь пришло время составлять
«слова».
—
Как вы думаете, какая тема нашего сегодняшнего урока?
Озвучивает
тему и цель урока. Уточняет понимание обучающимися поставленных целей урока.
Выдвигает проблему:
—
Какие знания необходимы для того, чтобы составлять формулы химических
элементов?
IV.
Изучение
нового материала
— Что должно быть отражено в
письменной записи о веществе? Какая характеристика вещества позволяет не путать
одно вещество с другим? (состав, строение)

Химические формулы отображают состав вещества. Выразим с помощью символов
состав самого распространённого вещества на Земле – воды. (учитель
демонстрирует шаростержневую модель или рисунок модели молекулы воды)
— Какие
элементы входят в состав молекулы воды?
— Как
обозначаются эти элементы?
— Сколько
атомов кислорода в молекуле воды?
— Сколько
атомов водорода в молекуле воды?
— Как вы
думаете, как показать, что в состав молекулы воды входит один атом кислорода и
два атома водорода?
— Число
атомов элемента принято обозначать с помощью индексов – цифр, которые
ставятся внизу справа от химического знака. Индекс «1» в химических формулах не
пишется. Если возле химического знака нет никаких индексов, это означает, что в
состав молекулы входит один такой атом.
Н2О
– химическая формула воды.
Читается: «Аш-два-о».
Химическая
формула – условная запись состава вещества при помощи химических знаков и
индексов.
Индекс
– цифра, показывающая число атомов каждого химического элемента в
молекуле.
Знаки
отражают качественный состав вещества, а индексы
– количественный состав. Т.е. химическая формула показывает какие
элементы и в каком количестве входят в состав вещества.
Если
требуется обозначить не одну, а несколько молекул, то перед химической формулой
ставят соответствующую цифру, которая называется коэффициентом.
Коэффициент
– число перед формулой, означающее число молекул данного вещества.
3
CuCl2 – 3 молекулы хлорида меди,
читается «три-купрум-хлор-два»
5Al2O3 – 5 молекул оксида алюминия,
читается «пять-алюминий-о-три»
3
FeCl3 – 3 молекулы хлорида
железа, читается «три-феррум-хлор-три»
5H2O – 5 молекул воды, читается
«пять-аш-два-о»
SO2 – молекула оксида серы,
читается «эс-о-два»
5
O – 5 атомов кислорода, читается
«пять-о»
O2 – молекула кислорода,
читается «о-два»
2
Fe – 2 атома железа, читается
«два-феррум»
V.
Закрепление
полученных знаний
1.
Обозначьте
атом водорода; молекулу водорода, которая состоит из двух атомов; две молекулы
водорода, два атома водорода (Н, Н2, 2 Н2, 2 Н).
2.
Что
обозначают следующие записи:
·
3H –
·
4H2O
–
·
2 CO2
–
·
3H2
–
·
Cl2
–
·
Cl –
·
Hq –
·
N2 –
·
2N –
·
3O2
–
·
O2 –
·
2FeO —
3.
Напишите
формулы соединений, состоящих из:
·
Одного
атома бария и одного атома кислорода;
·
Одного
атома углерода и двух атомов кислорода;
·
Двух
атомов алюминия и трех атомов кислорода;
·
Одного
атома железа и трех атомов хлора;
·
Одного
атома азота и трех атомов водорода.
VI.
Домашнее
задание
§14 чит,, стр. 49 № 4,5 (п)
VII.
Подведение
итогов урока. Рефлексия.
Выставление оценок
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1.
Акимова
Е.В. Технологическая карта урока «Химические формулы. Относительная
атомная и молекулярная массы». 8 класс.
Ссылка:https://kopilkaurokov.ru/himiya/uroki/tekhnologicheskaia_karta_uroka_khimicheskie_formuly_otnositelnaia_atomnaia_i_mol
2.
Гара Н.
Н. Химия : уроки в 8 классе : пособие для учителя / Н. Н. Гара. — 2-е изд.,
перераб. — М. : Просвещение, 2014. — 127 с
3.
Абрамович
С.И., Левитская О.В. Химия. Решение задач к учебникам «Химия. 8 класс» и
«Химия 9 класс». – Харьков: Веста, 2002. — 240 л.
4.
Курганский
С.М. Увлекательная химия: внеклассная работа по химии. 8 – 11 классы/
С.М.Курганский. – М.: ООО «ТИД «Русское слово – РС», 2011. – 248 с.