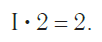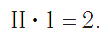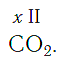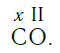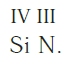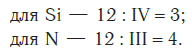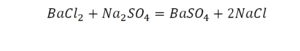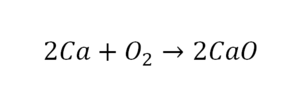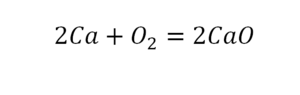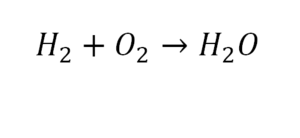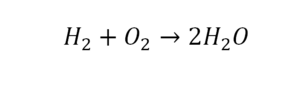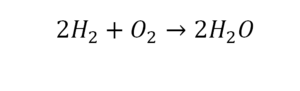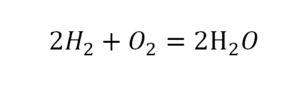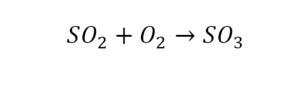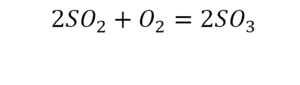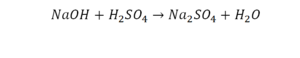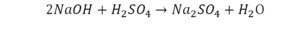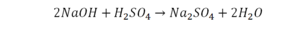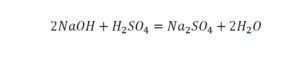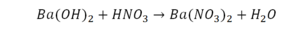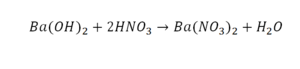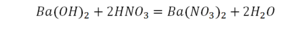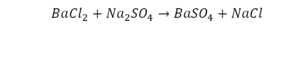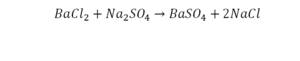Урок 6. Валентность
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
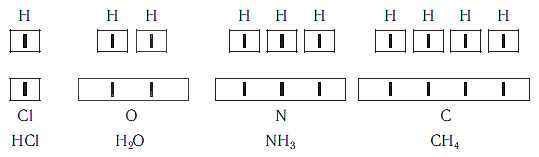
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
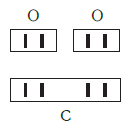
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
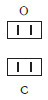
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х ·1 = II · 2 , откуда х = IV .
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II , так как х ·1 = II · 1 , откуда х = II :
Постоянная и переменная валентность
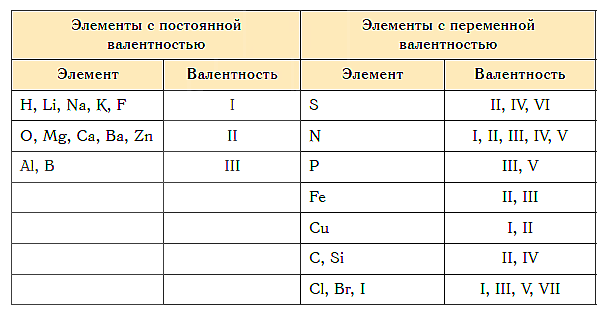
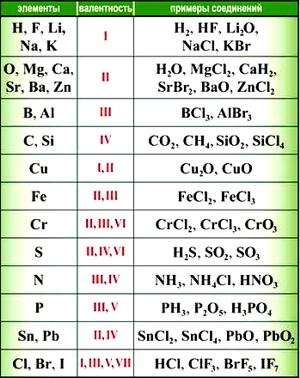
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV , а азота — III .
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Написание формулы по валентности
Валентность — способность атома присоединять то или иное число других атомов с образованием химической связи (см. «Что такое валентность»).
Для того, чтобы выводить химические формулы веществ по валентности элементов, необходимо знать, как минимум, валентности наиболее часто встречающихся элементов.
Алгоритм написания химической формулы вещества по валентности элементов, входящих в него:
- записать химические знаки элементов, входящих в вещество;
- определить валентность этих элементов;
- найти наименьшее общее кратное для валентностей этих элементов;
- определить индексы для атомов.
Составление формулы оксидов по валентности элементов
В качестве примера составим формулу оксида железа (III).
- В оксид железа входят железо и кислород: Fe O;
- Указываем валентность этих элементов: Fe III O II ;
- Находим наименьшее общее кратное (НОК): 3·2=6;
- Делим НОК на число единиц валентности каждого элемента:
- для Fe — 6:3=2;
- для O — 6:2=3.
- Записываем полученные индексы справа внизу от элемента: Fe2O3.
Составление формулы оснований
Важный нюанс, который неободимо знать — группы атомов могут рассматриваться, как единое целое.
Составление формул оснований по валентности элементов отличается от составления формулы оксидов лишь тем, что вместо атома кислорода в формуле стоит гидроксогруппа OH. В случае, если гидроксогруппа в формуле повторяется несколько раз, она берется в скобки.
В качестве примера составим составим формулу гидроксида магния.
На первом месте в основаниях стоит атом металла, гидроксогруппа — на втором.
Составление формулы солей
В солях «роль» гидроксогруппы OH играют кислотные остатки.
На первом месте в формуле средней соли стоит атом(ы) металла, кислотный остаток — на втором.
В качестве примера составим формулу соли фосфата натрия.
Составление формулы кислот
На первом месте в формуле кислот стоит атом(ы) водорода, кислотный остаток — на втором.
В качестве примера составим формулу серной кислоты.
Потренируемся в решении обратной задачи, когда по готовой формуле надо определить валентность элементов.
Определение валентности по готовой формуле
«Фишка» решения подобных задач заключается в том, что некоторые химические элементы в любых соединениях, в которые они входят, имеют постоянную валентность.
Элементы с постоянной валентностью:
- валентность I: H, F, Li, Na, K, Rb, Cs
- валентность II: O, Mg, Ca, Sr, Ba, Zn
- валентность III: Al
Большинство элементов в различных соединениях могут принимать различную валентность,, т. е., образовывать различное число химических связей.
Для нахождения валентности элементов с переменной валентностью в том или ином соединении используют правило валентности.
| x·m=y·n |
| в бинарных соединениях типа AmBn произведение валнетности элемента A(x) на кол-во его атомов m равно произведению валентности элемента B(y) на число его атомов n |
Определим, используя правило валентности, валентность фософра в соединении P2O5.
Поскольку валентность кислорода равна II, то:
Теперь решим ту же задачу, используя алгоритм, описанный выше для выведения формулы по валентности, который будем применять «сзади-наперёд».
Определим валентность фосфора и кислорода в соединении P2O5.
- P2O5
- валентность кислорода равна двум: P2O5 II
- общее число единиц валентности всех атомов вещества будет равно 2·5=10
- делим общее число единиц валентности (10) на индекс кислорода, валентность которого известна: 10:2=5 — это и будет валентность неизвестного, в нашем случае, фосфора
- P2 V O5 II
Немного усложним задачу и определим валентность элементов в соли кислородсодержащей кислоты Al2(SO4)3.
- решение задачи начинается с элемента с известной валентностью, т. е., с кислорода — определяем кол-во его атомов: 4·3=12
- с учётом того, что валентность кислорода равна 2, находим общее число единиц валентности для кислорода: 12·2=24
- по аналогии вычисляем общее число единиц валентности для атомов алюминия (валентность=3): 2·3=6
- от общего числа единиц валентности кислорода вычитаем общее число единиц валентности алюминия: 24-6=18 — это общее число единиц валентности, которое будет приходиться на серу
- по аналогии с кислородом определяем число атомов серы, валентность которой неизвестна: 1·3=3
- чтобы узнать валентность серы следует разделить разность, найденную в п.4, на число атомов серы: 18:3=6
- Al2 III (S VI O4 II )3
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
источники:
http://liveposts.ru/articles/education-articles/himiya/koeffitsienty-i-indeksy-v-himicheskih-uravneniyah
http://prosto-o-slognom.ru/chimia_primery/001-valentnost.html
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Как узнать индексы в уравнениях химических реакций
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Представленные на рисунке формулы читаются так: три-купрум-хлор-два, пять-алюминий-два-о-три, три-феррум-хлор-три .
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
ЗАДАНИЕ. Обозначить, используя символы химических элементов
а) три молекулы азота
б) семь молекул сульфида железа
в) четыре атома серы
г) два атома кальция
д) семь молекул воды
е) четыре молекулы кислорода
ж) две молекулы сернистой кислотыОТВЕТ:
а) три молекулы азота — 3N2
б) семь молекул сульфида железа — 7FeS
в) четыре атома серы — S4
г) два атома кальция — Ca2
д) семь молекул воды — 7H2O
е) четыре молекулы кислорода — 4O2
ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4.
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
Как определять, находить коэффициент в химических уравнениях
Уравнение реакции в химии — символическая запись протекания химического взаимодействия с помощью математических знаков, химических обозначений и коэффициентов. Расставить в химических уравнениях коэффициенты можно несколькими способами, каждый из которых имеет свои преимущества и уровень сложности.
Распространненые способы уравнивания
Существует не один способ правильной расстановки коэффициентов в химических уравнениях. Чтобы найти нужную схему реакций, можно ознакомиться с самыми распространёнными методами:
- Подбор коэффициентов. В этом способе расставляются акценты на нахождение наименьшего общего кратного и приравнивания к нему обеих частей уравнения.
- Запись онлайн. Безусловно, наипростейший из всех представленных, для которого нужно лишь уметь находить подходящий сайт.
- Вычисления столбиком. Способ представляет собой математическую запись с подбором.
- Метод полуреакций. Иногда встречается под названием «Электронно-ионный баланс», используется при окислительно-восстановительных реакциях.
Чтобы научиться уравнивать химические записи, необходимо разобраться в перечисленных способах. Безусловно, необязательно запоминать каждый, но ознакомившись с методами, легче подобрать тот, с которым расставить коэффициенты в уравнениях химических реакций станет упрощённой задачей.
Подбор коэффициентов
Чтобы решить, как расставить индексы и коэффициенты в записи, можно использовать метод подбора, который считается самым лёгким и понятным, среди прочих:
- Изначально в левой части реакции записываются исходные вещества, ставится стрелка к правой, ещё не заполненной части.
- В правой части записываются полученные продукты.
- В этом пункте происходит выравнивание коэффициентов за счет закона сохранения массы, который гласит о том, что с обеих сторон уравнения должно быть одинаковое количество атомов.
- Число атомов проверяется на соответствие в правой и левой частях уравнения и под стрелкой рисуется диагональная черта.
Метод подбора активно применяется при записи реакций, у которых продуктом является одно вещество. Он наиболее лёгок для понимания и запоминания, с него начинается путь уравнивания записей для школьников 8 класса.
Вычисления с помощью столбика
Такой способ заключается в том, чтобы определять нужные числа с помощью валентностей, составляя небольшие уравнения. Всё, что нужно, — уметь правильно определить, показывать и посчитать исходные реагенты и продукты реакции.
Шаг первый — записать реакцию и в двух столбиках перечислить реагенты и продукты.
Ag + O2 -> AgO. Вещества из этого примера распределяем в 2 колонки, соответственно Ag, O2 — в одной, AgO — в другой.
Следующее действие — расставление валентностей и поиск наименьшего общего кратного.
Валентность серебра — постоянная, в соединении с кислородом также III. Поэтому нужно показать в столбцах эти валентности (II и III). Наименьшим общим кратным является число 6, значит, количество молекул серебра нужно домножить на 2.
Предпоследний шаг — сравнение коэффициентов и индексов.
Сравнивая обе части записи, можно заметить, что они неравны, поэтому необходимо найти сумму и в продуктах поставить индекс 2, а перед серебром в части реагентов — 4. Так получается уравнение: 4Ag + O2 = 2 Ag2O.
Этот вариант похож на метод уравнивания, но отличается тем, что в нём нужно учитывать не закон сохранения массы, а больше внимания уделять валентности элемента. Он используется при вычислении как простых и коротких записей, так и громоздких, достаточно сложных.
Решение методом полуреакций
Способ полуреакций создан для упрощения составления ионных реакций. В нём учитывается число зарядов и их направленность. Для уравнивания по числу зарядов нужно от той части схемы, в которой прописаны реагенты отнять количество электронов, равное коэффициенту перед продуктом из правой части схемы. После этого стрелку можно заменить на знак равенства.
Несколько советов для уравнивания реакций
Прежде всего, стоит изучить все способы выравнивания коэффициентов и понять, с помощью какого метода записывать будет проще, быстрее и удобнее. Для этого нужно рассмотреть плюсы и минусы способов и согласовать их со слабыми и сильными сторонами в понимании химии.
Если же подробное изучение темы не понадобится в дальнейшем, а уравнять реакцию нужно только единожды, можно воспользоваться множеством сайтов, которые предлагают решить проблему онлайн. Нужно просто ввести уравнение в нужное поле.
http://na5.club/himiya/kak-opredelyat-nahodit-koefficzient-v-himicheskih-uravneniyah.html
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Уравняли.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример:
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Химия – это наука о веществах, их свойствах и превращениях.
То есть, если с окружающими нас веществами ничего не происходит, то это не относится к химии. Но что значит, «ничего не происходит»? Если в поле нас вдруг застала гроза, и мы все промокли, как говорится «до нитки», то это ли не превращение: ведь одежда была сухой, а стала мокрой.
Если, к примеру взять железный гвоздь, обработать его напильником, а затем собрать железные опилки (Fe), то это ли так же не превращение: был гвоздь – стал порошок. Но если после этого собрать прибор и провести получение кислорода (О2): нагреть перманганат калия (КМпО4) и собрать в пробирку кислород, а затем в неё поместить раскалённые «до красна» эти железные опилки, то они вспыхнут ярким пламенем и после сгорания превратятся в порошок бурого цвета. И это так же превращение. Так где же химия? Несмотря на то, что в этих примерах меняется форма (железный гвоздь) и состояние одежды (сухая, мокрая) – это не превращения. Дело в том, что сам по себе гвоздь как был веществом (железо), так им и остался, несмотря на другую свою форму, а воду от дождя как впитала наша одежда, так потом его и испарила в атмосферу. Сама вода не изменилась. Так что же такое превращения с точки зрения химии?
Превращениями с точки зрения химии называются такие явления, которые сопровождаются изменением состава вещества. Возьмём в качестве примера тот же гвоздь. Не важно, какую форму он принял после обработки напильником, но после того как собранные от него железные опилки поместили в атмосферу кислорода — он превратился в оксид железа (Fe2O3). Значит, что-то всё-таки изменилось? Да, изменилось. Было вещество гвоздь, но под воздействием кислорода сформировалось новое вещество – оксид элемента железа. Молекулярное уравнение этого превращения можно отобразить следующими химическими символами:
4Fe + 3O2 = 2Fe2O3 (1)
Для непосвящённого в химии человека сразу возникают вопросы. Что такое «молекулярное уравнение», что такое Fe? Почему поставлены цифры «4», «3», «2»? Что такое маленькие цифры «2» и «3» в формуле Fe2O3 ? Это значит, наступило время во всём разобраться по порядку.
Знаки химических элементов.
Несмотря на то, что химию начинают изучать в 8-м классе, а некоторые даже раньше, многим известен великий русский химик Д. И. Менделеев. И конечно же, его знаменитая «Периодическая система химических элементов». Иначе, проще, её называют «Таблица Менделеева».
В этой таблице, в соответствующем порядке, располагаются элементы. К настоящему времени их известно около 120. Названия многих элементов нам были известны ещё давно. Это: железо, алюминий, кислород, углерод, золото, кремний. Раньше мы не задумываясь применяли эти слова, отождествляя их с предметами: железный болт, алюминиевая проволока, кислород в атмосфере, золотое кольцо и т.д. и т.д. Но на самом деле все эти вещества (болт, проволока, кольцо) состоят из соответствующих им элементов. Весь парадокс состоит в том, что элемент нельзя потрогать, взять в руки. Как же так? В таблице Менделеева они есть, а взять их нельзя! Да, именно так. Химический элемент – это абстрактное (то есть отвлечённое) понятие, и используется в химии, впрочем как и в других науках, для расчётов, составления уравнений, при решении задач. Каждый элемент отличается от другого тем, что для него характерна своя электронная конфигурация атома. Количество протонов в ядре атома равно количеству электронов в его орбиталях. К примеру, водород – элемент №1. Его атом состоит из 1-го протона и 1-го электрона. Гелий – элемент №2. Его атом состоит из 2-х протонов и 2-х электронов. Литий – элемент №3. Его атом состоит из 3-х протонов и 3-х электронов. Дармштадтий – элемент №110. Его атом состоит из 110-и протонов и 110-и электронов.
Каждый элемент обозначается определённым символом, латинскими буквами, и имеет определённое прочтение в переводе с латинского. Например, водород имеет символ «Н», читается как «гидрогениум» или «аш». Кремний имеет символ «Si» читается как «силициум». Ртуть имеет символ «Нg» и читается как «гидраргирум». И так далее. Все эти обозначения можно найти в любом учебнике химии за 8-й класс. Для нас сейчас главное уяснить то, что при составлении химических уравнений, необходимо оперировать указанными символами элементов.
Простые и сложные вещества.
Обозначая единичными символами химических элементов различные вещества (Hg ртуть, Fe железо, Cu медь, Zn цинк, Al алюминий) мы по сути обозначаем простые вещества, то есть вещества, состоящие из атомов одного вида (содержащие одно и то же количество протонов и нейтронов в атоме). Например, если во взаимодействие вступают вещества железо и сера, то уравнение примет следующую форму записи:
Fe + S = FeS (2)
К простым веществам относятся металлы (Ва, К, Na, Mg, Ag), а так же неметаллы (S, P, Si, Cl2, N2, O2, H2). Причём следует обратить
особое внимание на то, что все металлы обозначаются единичными символами: К, Ва, Са, Аl, V, Mg и т.д., а неметаллы – либо простыми символами: C,S,P или могут иметь различные индексы, которые указывают на их молекулярное строение: H2, Сl2, О2, J2, P4, S8. В дальнейшем это будет иметь очень большое значение при составлении уравнений. Совсем не трудно догадаться, что сложными веществами являются вещества, образованные из атомов разного вида, например,
1). Оксиды:
оксид алюминия Al2O3, 
оксид меди CuO,
оксид цинка ZnO,
оксид титана Ti2O3 ,
угарный газ или оксид углерода (+2) CO,
оксид серы (+6) SO3
2). Основания:
гидроксид железа (+3) Fe(OH)3,
гидроксид меди Cu(OH)2 ,
гидроксид калия или щёлочь калия КOH,
гидроксид натрия NaOH.
3). Кислоты:
соляная кислота HCl,
сернистая кислота H2SO3,
азотная кислота HNO3
4). Соли:
тиосульфат натрия Na2S2O3,
сульфат натрия или глауберова соль Na2SO4 ,
карбонат кальция или известняк СаCO3,
хлорид меди CuCl2
5). Органические вещества:
ацетат натрия СН3СООNa,
метан СН4,
ацетилен С2Н2 ,
глюкоза С6Н12О6
Наконец, после того как мы выяснили структуру различных веществ, можно приступать к составлению химических уравнений.
Химическое уравнение.
Само слово «уравнение» производное от слова «уравнять», т.е. разделить нечто на равные части. В математике уравнения составляют чуть ли не самую сущность этой науки. К примеру, можно привести такое простое уравнение, в котором левая и правая части будут равны «2» :
40 : (9 + 11) = (50 х 2) : ( 80 – 30 );
И в химических уравнениях тот же принцип: левая и правая части уравнения должны соответствовать одинаковым количествам атомов, участвующим в них элементов. Или, если приводится ионное уравнение, то в нём число частицтак же должно соответствовать этому требованию. Химическим уравнением называется условная запись химической реакции с помощью химических формул и математических знаков . Химическое уравнение по своей сути отражает ту или иную химическую реакцию, то есть процесс взаимодействия веществ, в процессе которых возникают новые вещества. Например, необходимо написать молекулярное уравнение реакции, в которой принимают участие хлорид бария ВаСl2 и серная кислота H2SO4. В результате этой реакции образуется нерастворимый осадок – сульфат бария ВаSO4 и соляная кислота НСl :
ВаСl2 + H2SO4 = BaSO4 + 2НСl (3)
Прежде всего необходимо уяснить, что большая цифра «2», стоящая перед веществом НСlназывается коэффициентом, а малые цифры «2», «4» под формулами ВаСl2, H2SO4 ,BaSO4 называются индексами. И коэффициенты и индексы в химических уравнениях выполняют роль множителей, а не слагаемых. Что бы правильно записать химическое уравнение, необходимо расставить коэффициенты в уравнении реакции. Теперь приступим к подсчёту атомов элементов в левой и правой частях уравнения. В левой части уравнения: в веществе ВаСl2 содержатся 1 атом бария (Ва), 2 атома хлора (Сl). В веществе H2SO4: 2 атома водорода (Н), 1 атом серы (S) и 4 атома кислорода (О) . В правой части уравнения: в веществе BaSO4 1 атом бария (Ва) 1 атом серы (S) и 4 атома кислорода (О), в веществе НСl: 1 атом водорода (Н) и 1 атом хлора (Сl). Откуда следует, что в правой части уравнения количество атомов водорода и хлора вдвое меньше, чем в левой части. Следовательно, перед формулой НСl в правой части уравнения необходимо поставить коэффициент «2». Если теперь сложить количества атомов элементов, участвующих в данной реакции, и слева и справа, то получим следующий баланс:
В обеих частях уравнения количества атомов элементов, участвующих в реакции, равны, следовательно оно составлено правильно.
Химические уравнение и химические реакции
Как мы уже выяснили, химические уравнения являются отражением химических реакций. Химическими реакциями называются такие явления, в процессе которых происходит превращение одних веществ в другие. Среди их многообразия можно выделить два основных типа:
1). Реакции соединения
2). Реакции разложения.
В подавляющем своём большинстве химические реакции принадлежат к реакциям присоединения, поскольку с отдельно взятым веществом редко могут происходить изменения в его составе, если оно не подвергается воздействиям извне (растворению, нагреванию, действию света). Ничто так не характеризует химическое явление, или реакцию, как изменения, происходящие при взаимодействии двух и более веществ. Такие явления могут осуществляться самопроизвольно и сопровождаться повышением или понижением температуры, световыми эффектами, изменением цвета, образованием осадка, выделением газообразных продуктов, шумом.
Для наглядности приведём несколько уравнений, отражающих процессы реакций соединения, в процессе которых получаются хлорид натрия (NaCl), хлорид цинка (ZnCl2), осадок хлорида серебра (AgCl), хлорид алюминия (AlCl3)
Cl2 + 2Nа = 2NaCl (4)
СuCl2+ Zn= ZnCl2 + Сu (5)
AgNO3 + КCl = AgCl+ 2KNO3 (6)
3HCl+ Al(OH)3 = AlCl3 + 3Н2О (7)
Cреди реакций соединения следует особым образом отметить следующие: замещения (5), обмена (6), и как частный случай реакции обмена – реакцию нейтрализации (7).
К реакциям замещения относятся такие, при осуществлении которой атомы простого вещества замещают атомы одного из элементов в сложном веществе. В примере (5) атомы цинка замещают из раствора СuCl2 атомы меди, при этом цинк переходит в растворимую соль ZnCl2, а медь выделяется из раствора в металлическом состоянии.
К реакциям обмена относятся такие реакции, при которых два сложных вещества обмениваются своими составными частями.В случае реакции (6) растворимые соли AgNO3 и КCl при сливании обоих растворов образуют нерастворимый осадок соли AgCl. При этом они обмениваются своими составными частями – катионами и анионами. Катионы калия К+ присоединяются к анионам NO3, а катионы серебра Ag+ – к анионам Cl—.
К особому, частному случаю, реакций обмена относится реакция нейтрализации. К реакциям нейтрализации относятся такие реакции, в процессе которых кислоты реагируют с основаниями, в результате образуется соль и вода. В примере (7) соляная кислота HCl, реагируя с основанием Al(OH)3 образует соль AlCl3 и воду. При этом катионы алюминия Al3+ от основания обмениваются с анионами Сl— от кислоты. В итоге происходит нейтрализация соляной кислоты.
К реакциям разложения относятся такие, при котором из одного сложного образуются два и более новых простых или сложных веществ, но более простого состава. В качестве реакций можно привести такие, в процессе которых разлагаются 1). Нитрат калия(КNO3) с образованием нитрита калия (КNO2) и кислорода (O2); 2). Перманганат калия (KMnO4): образуются манганат калия (К2МnO4), оксид марганца (MnO2) и кислород (O2); 3). Карбонат кальция или мрамор; в процессе образуются углекислый газ (CO2) и оксид кальция (СаО)
2КNO3 =2КNO2 + O2 (8)
2KMnO4 = К2МnO4 + MnO2 + O2 (9)
СаCO3 = CaO + CO2 (10)
В реакции (8) из сложного вещества образуется одно сложное и одно простое. В реакции (9) – два сложных и одно простое. В реакции (10) – два сложных вещества , но более простых по составу
Разложению подвергаются все классы сложных веществ:
1). Оксиды: оксид серебра 2Ag2O = 4Ag + O2 (11)
2). Гидроксиды: гидроксид железа 2Fe(OH)3 = Fe2O3 + 3H2O (12)
3). Кислоты: серная кислота H2SO4 = SO3 + H2O (13)
4). Соли: карбонат кальция СаCO3 = СаO + CO2 (14)
5). Органические вещества: спиртовое брожение глюкозы
С6Н12О6 = 2С2Н5ОH + 2CO2 (15)
Согласно другой классификации, все химические реакции можно разделить на два типа: реакции, идущие с выделением теплоты, их называют экзотермические, и реакции, идущие с поглощением теплоты – эндотермические. Критерием таких процессов является тепловой эффект реакции. Как правило, к экзотермическим реакциям относятся реакции окисления, т.е. взаимодействия с кислородом, например сгорание метана:
СН4 + 2O2 = СО2 + 2Н2О + Q (16)
а к эндотермическим реакциям – реакции разложения, уже приводимые выше (11) – (15). Знак Q в конце уравнения указывает на то, выделяется ли теплота в процессе реакции (+Q) или поглощается (-Q):
СаCO3 = СаO+CO2 — Q (17)
Можно так же рассматривать все химические реакции по типу изменения степени окисления, участвующих в их превращениях элементов. К примеру, в реакции (17) участвующие в ней элементы не меняют свои степени окисления:
Са+2C+4O3-2 = Са+2O-2+C+4O2-2 (18)
А в реакции (16) элементы меняют свои степени окисления:
2Mg0 + O20 = 2Mg+2O-2
Реакции такого типа относятся к окислительно-восстановительным. Они будут рассматриваться отдельно. Для составления уравнений по реакциям такого типа необходимо использовать метод полуреакцийи применять уравнение электронного баланса.
После приведения различных типов химических реакций, можно приступать к принципу составлений химических уравнений, иначе, подбору коэффициентов в левой и правой их частях.
СЛОЖНА-А-А 🙀 Ты же знаешь, что если не разобраться в теме сейчас, то потом придется исправлять оценки. Беги на бесплатное онлайн-занятие с репетитором (подробности тут + 🎁).
Механизмы составления химических уравнений.
К какому бы типу ни относилась та или иная химическая реакция, её запись ( химическое уравнение) должна соответствовать условию равенства количества атомов до реакции и после реакции.
Существуют такие уравнения (17), которые не требуют уравнивания, т.е. расстановки коэффициентов. Но в большинстве случаях, как в примерах (3), (7), (15), необходимо предпринимать действия, направленные на уравнивание левой и правой частей уравнения. Какими же принципами необходимо руководствоваться в таких случаях? Существует ли какая ни будь система в подборе коэффициентов? Существует, и не одна. К таковым системам относятся:
1). Подбор коэффициентов по заданным формулам.
2). Составление по валентностям реагирующих веществ.
3). Составление по степеням окисления реагирующих веществ.
В первом случае полагается, что нам известны формулы реагирующих веществ как до реакции, так и после. К примеру, дано следующее уравнение:
N2 + О2 →N2О3 (19)
Принято считать, что пока не установлено равенство между атомами элементов до реакции и после, знак равенства (=) в уравнении не ставится, а заменяется стрелкой (→). Теперь приступим к собственно уравниванию. В левой части уравнения имеются 2 атома азота (N2) и два атома кислорода (О2), а в правой – два атома азота (N2) и три атома кислорода (О3). По количеству атомов азота его уравнивать не надо, но по кислороду необходимо добиться равенства, поскольку до реакции их участвовало два атома, а после реакции стало три атома. Составим следующую схему:
до реакции после реакции
О2 О3
Определим наименьшее кратное между данными количествами атомов, это будет «6».
О2 О3
6 /
Разделим это число в левой части уравнения по кислороду на «2». Получим число «3», поставим его в решаемое уравнение:
N2 + 3О2 →N2О3
Так же разделим число «6» для правой части уравнения на «3». Получим число «2», так же поставим его в решаемое уравнение:
N2 + 3О2 → 2N2О3
Количества атомов кислорода и в левой и в правой частях уравнения стали равны, соответственно по 6 атомов:
3О2 → 2О3
Но количество атомов азота в обеих частях уравнения не будут соответствовать друг другу:
N2→ 2N2
В левой – два атома, в правой – четыре атома. Следовательно, что бы добиться равенства, необходимо удвоить количество азота в левой части уравнения, поставив коэффициент «2»:
2N2→ 2N2
Таким образом, равенство по азоту соблюдено и в целом, уравнение примет вид:
2N2 + 3О2 → 2N2О3
Теперь в уравнении можно вместо стрелки поставит знак равенства:
2N2 + 3О2 = 2N2О3 (20)
Приведём другой пример. Дано следующее уравнение реакции:
Р + Cl2→ РCl5
В левой части уравнения имеется 1 атом фосфора (Р) и два атома хлора (Cl2), а в правой – один атом фосфора (Р) и пять атомов кислорода (Cl5). По количеству атомов фосфора его уравнивать не надо, но по хлору необходимо добиться равенства, поскольку до реакции их участвовало два атома, а после реакции стало пять атома. Составим следующую схему:
до реакции после реакции
Cl2 Cl5
Определим наименьшее кратное между данными количествами атомов, это будет «10».
Cl2 Cl5
10 /
Разделим это число в левой части уравнения по хлору на «2». Получим число «5», поставим его в решаемое уравнение:
Р + 5Cl2→ РCl5
Так же разделим число «10» для правой части уравнения на «5». Получим число «2», так же поставим его в решаемое уравнение:
Р + 5Cl2→ 2РCl5
Количества атомов хлора и в левой и в правой частях уравнения стали равны, соответственно по 10 атомов:
5Cl2→ 2Cl5
Но количество атомов фосфора в обеих частях уравнения не будут соответствовать друг другу:
Р → 2Р
Следовательно, что бы добиться равенства, необходимо удвоить количество фосфора в левой части уравнения, поставив коэффициент «2»:
2Р → 2Р
Таким образом, равенство по фосфору соблюдено и в целом, уравнение примет вид:
2Р + 5Cl2= 2РCl5 (21)
При составлении уравнений по валентностям необходимо дать определение валентности и установить значения для наиболее известных элементов. Валентность – это одно из ранее применяемых понятий, в настоящее время в ряде школьных программ не используется. Но при его помощи легче объяснить принципы составления уравнений химических реакций. Под валентностью понимают число химических связей, которые тот или иной атом может образовывать с другим, или другими атомами. Валентность не имеет знака ( + или — ) и обозначается римскими цифрами, как правило, над символами химических элементов, например:
I II III IV V
H O N S Р
Откуда берутся эти значения? Как их применять при составлении химических уравнений? Числовые значения валентностей элементов совпадают с их номером группы Периодической системы химических элементов Д. И. Менделеева (Таблица 1).
Для других элементов значения валентностей могут иметь иные значения, но никогда не больше номера группы, в которой они расположены. Причём для чётных номеров групп (IV и VI ) валентности элементов принимают только чётные значения, а для нечётных – могут иметь как чётные, так и нечётные значения (Таблица.2).
Конечно же, в значениях валентностей для некоторых элементов имеются исключения, но в каждом конкретном случае эти моменты обычно оговариваются. Теперь рассмотрим общий принцип составления химических уравнений по заданным валентностям для тех или иных элементов. Чаще всего данный метод приемлем в случае составления уравнений химических реакций соединения простых веществ, например, при взаимодействии с кислородом (реакции окисления). Допустим, необходимо отобразить реакцию окисления алюминия. Но напомним, что металлы обозначаются единичными атомами (Al), а неметаллы, находящиеся в газообразном состоянии – с индексами «2» — (О2). Сначала напишем общую схему реакции:
Al + О2 →AlО
На данном этапе ещё не известно, какое правильное написание должно быть у оксида алюминия. И вот именно на данном этапе нам на помощь придёт знание валентностей элементов. Для алюминия и кислорода проставим их над предполагаемой формулой этого оксида:
III II
Al О
После чего «крест»-на-«крест» у этих символов элементов поставим внизу соответствующие индексы:
III II
Al2 О3
Состав химического соединения Al2О3 определён. Дальнейшая схема уравнения реакции примет вид:
Al+ О2 →Al2О3
Остаётся только уравнять левую и правую его части. Поступим таким же способом, как в случае составления уравнения (19). Количества атомов кислорода уравняем, прибегая к нахождению наименьшего кратного:
до реакции после реакции
О2 О3
6 /
Разделим это число в левой части уравнения по кислороду на «2». Получим число «3», поставим его в решаемое уравнение. Так же разделим число «6» для правой части уравнения на «3». Получим число «2», так же поставим его в решаемое уравнение:
Al + 3О2 → 2Al2О3
Что бы добиться равенства по алюминию, необходимо скорректировать его количество в левой части уравнения, поставив коэффициент «4»:
4Al + 3О2 → 2Al2О3
Таким образом, равенство по алюминию и кислороду соблюдено и в целом, уравнение примет окончательный вид:
4Al + 3О2 = 2Al2О3 (22)
Применяя метод валентностей, можно прогнозировать, какое вещество образуется в процессе химической реакции, как будет выглядеть его формула. Допустим, в реакцию соединения вступили азот и водород с соответствующими валентностями III и I. Напишем общую схему реакции:
N2 + Н2 → NН
Для азота и водорода проставим валентности над предполагаемой формулой этого соединения:
III I
N Н
Как и прежде «крест»-на-«крест» у этих символов элементов поставим внизу соответствующие индексы:
III I
N Н3
Дальнейшая схема уравнения реакции примет вид:
N2 + Н2 → NН3
Уравнивая уже известным способом, через наименьшее кратное для водорода, равное «6»,получим искомые коэффициенты, и уравнение в целом:
N2 + 3Н2 = 2NН3 (23)
При составлении уравнений по степеням окисления реагирующих веществ необходимо напомнить, что степенью окисления того или иного элемента называется число принятых или отданных в процессе химической реакции электронов. Степень окисления в соединениях в основном, численно совпадает со значениями валентностей элемента. Но отличаются знаком. Например, для водорода валентность равна I, а степень окисления (+1) или (-1). Для кислорода валентность равна II, а степень окисления (-2). Для азота валентности равны I,II,III,IV,V, а степени окисления (-3), (+1), (+2), (+3), (+4), (+5) и т.д. Степени окисления наиболее часто применяемых в уравнениях элементов, приведены в таблице 3.
В случае реакций соединения принцип составления уравнений по степеням окисления такой же, как и при составлении по валентностям. Например, приведём уравнение реакции окисления хлора кислородом, в которой хлор образует соединение со степенью окисления +7. Запишем предполагаемое уравнение:
Cl2 + О2 →ClО
Поставим над предполагаемым соединением ClО степени окисления соответствующих атомов:
+7 -2
Cl О
Как и в предыдущих случаях установим, что искомая формула соединения примет вид:
+7 -2
Cl2О7
Уравнение реакции примет следующий вид:
Cl2 + О2 → Cl2О7
Уравнивая по кислороду, найдя наименьшее кратное между двумя и семи, равное «14», установим в итоге равенство:
2Cl2 + 7О2 = 2Cl2О7 (24)
Несколько иной способ необходимо применять со степенями окисления при составлении реакций обмена, нейтрализации, замещения. В ряде случаев предоставляется затруднительным узнать: какие соединения образуются при взаимодействии сложных веществ?
Как узнать: что получится в процессе реакции?
Действительно, как узнать: какие продукты реакции могут возникнут в ходе конкретной реакции? К примеру, что образуется при взаимодействии нитрата бария и сульфата калия?
Ва(NО3) 2 + К2SO4 → ?
Может быть ВаК2(NО3) 2 + SO4 ?Или Ва + NО3SO4 + К2? Или ещё что-то? Конечно же, в процессе этой реакции образуются соединения: ВаSO4 и КNО3 . А откуда это известно? И как правильно написать формулы веществ? Начнём с того, что чаще всего упускается из вида: с самого понятия «реакция обмена». Это значит, что при данных реакциях вещества меняются друг с другом составными частями. Поскольку реакции обмена в большинстве своём осуществляются межу основаниями, кислотами или солями, то частями, которыми они будут меняться, являются катионы металлов ( Na+, Mg2+,Al3+,Ca2+,Cr3+), ионов Н+ или ОН—, анионов – остатков кислот,(Cl—, NO32-,SO32-, SO42-, CO32-, PO43-). В общем виде реакцию обмена можно привести в следующей записи:
Kt1An1 + Kt2An1 = Kt1An2 + Kt2An1 (25)
Где Kt1 и Kt2 – катионы металлов (1) и (2), а An1 и An2 – соответствующие им анионы (1) и (2). При этом обязательно надо учитывать, что в соединениях до реакции и после реакции на первом месте всегда устанавливаются катионы, а анионы – на втором. Следовательно, если в реакцию вступит хлорид калия и нитрат серебра, оба в растворённом состоянии
KCl + AgNO3→
то в процессе её образуются вещества KNO3 и AgClи соответствующее уравнение примет вид:
KCl + AgNO3=KNO3 + AgCl (26)
При реакциях нейтрализации протоны от кислот (Н+) будут соединяться с анионами гидроксила (ОН—) с образованием воды (Н2О):
НCl + КОН = КCl + Н2O (27)
Степени окисления катионов металлов и заряды анионов кислотных остатков указаны в таблице растворимости веществ (кислот, солей и оснований в воде). По горизонтали приведены катионы металлов, а по вертикали – анионы кислотных остатков.
Исходя из этого, при составлении уравнения реакции обмена, необходимо вначале в левой его части установить степени окисления принимающих в этом химическом процессе частиц. Например, требуется написать уравнение взаимодействия между хлоридом кальция и карбонатом натрия.Составим исходную схему этой реакции:
СаCl + NаСО3 →
Над катионами и анионами проставим соответствующие заряды:
Са2+Cl— + Nа+СО32- →
Совершив уже известное действие «крест»-на-«крест», определим реальные формулы исходных веществ:
СаCl2 + Nа2СО3 →
Исходя из принципа обмена катионами и анионами (25), установим предварительные формулы образующихся в ходе реакции веществ:
СаCl2 + Nа2СО3 → СаСО3 + NаCl
Над их катионами и анионами проставим соответствующие заряды:
Са2+СО32- + Nа+Cl—
Формулы веществ записаны правильно, в соответствии с зарядами катионов и анионов. Составим полное уравнение, уравняв левую и правую его части по натрию и хлору:
СаCl2 + Nа2СО3 = СаСО3 + 2NаCl (28)
В качестве другого примера приведём уравнение реакции нейтрализации между гидроксидом бария и ортофосфорной кислотой:
ВаОН + НРО4 →
Над катионами и анионами проставим соответствующие заряды:
Ва2+ ОН— + Н+РО43- →
Определим реальные формулы исходных веществ:
Ва(ОН)2 + Н3РО4 →
Исходя из принципа обмена катионами и анионами (25), установим предварительные формулы образующихся в ходе реакции веществ, учитывая, что при реакции обмена одним из веществ обязательно должна быть вода:
Ва(ОН)2 + Н3РО4 → Ва2+ РО43- + Н2O
Определим правильную запись формулы соли, образовавшейся в процессе реакции:
Ва(ОН)2 + Н3РО4 → Ва3(РО4)2 + Н2O
Уравняем левую часть уравнения по барию:
3Ва (ОН)2 + Н3РО4 → Ва3(РО4)2 + Н2O
Поскольку в правой части уравнения остаток ортофосфорной кислоты взят дважды, (РО4)2, то слева необходимо также удвоить её количество:
3Ва (ОН)2 + 2Н3РО4 → Ва3(РО4)2 + Н2O
Осталось привести в соответствие количество атомов водорода и кислорода в правой части у воды. Так как слева общее количество атомов водорода равно 12, то справа оно так же должно соответствовать двенадцати, поэтому перед формулой воды необходимо поставить коэффициент «6» (поскольку в молекуле воды уже имеется 2 атома водорода). По кислороду так же соблюдено равенство: слева 14 и справа 14. Итак, уравнение имеет правильную форму записи:
3Ва (ОН)2 + 2Н3РО4 → Ва3(РО4)2 + 6Н2O (29)
Возможность осуществления химических реакций
Мир состоит из великого множества веществ. Неисчислимо так же количество вариантов химических реакций между ними. Но можем ли мы, написав на бумаге то или иное уравнение утверждать, что ему будет соответствовать химическая реакция? Существует ошибочное мнение, что если правильно расставить коэффициенты в уравнении, то оно будет осуществимо и на практике. Например, если взять раствор серной кислоты и опустить в него цинк, то можно наблюдать процесс выделения водорода:
Zn+ H2SO4 = ZnSO4 + H2 (30)
Но если в этот же раствор опустить медь, то процесс выделения газа наблюдаться не будет. Реакция не осуществима.
Cu+ H2SO4≠
В случае, если будет взята концентрированная серная кислота, она будет реагировать с медью:
Cu + 2H2SO4 = CuSO4 + SO2 + 2Н2O (31)
В реакции (23) между газами азотом и водородом наблюдается термодинамическое равновесие, т.е. сколько молекул аммиака NН3 образуется в единицу времени, столько же их и распадётся обратно на азот и водород. Смещение химического равновесия можно добиться повышением давления и понижением температуры
N2 + 3Н2 = 2NН3
Если взять раствор гидроксида калия и прилить к нему раствор сульфата натрия, то никаких изменений наблюдаться не будет, реакция будет не осуществима:
КОН + Na2SO4 ≠
Раствор хлорида натрия при взаимодействии с бромом не будет образовывать бром, несмотря на то, что данная реакция может быть отнесена к реакции замещения:
NаCl + Br2≠
В чём же причины таких несоответствий? Дело в том, что оказывается недостаточно только правильно определять формулы соединений, необходимо знать специфику взаимодействия металлов с кислотами, умело пользоваться таблицей растворимости веществ, знать правила замещения в ряду активности металлов и галогенов. В этой статье излагаются только самые основные принципы как расставить коэффициенты в уравнениях реакций, как написать молекулярные уравнения, как определить состав химического соединения.
Химия, как наука, чрезвычайно разнообразна и многогранна. В приведённой статье отражена лишь малая часть процессов, происходящих в реальном мире. Не рассмотрены типы окислительно-восстановительных реакций, термохимические уравнения, электролиз, процессы органического синтеза и многое, многое другое. Но об этом в следующих статьях.
Молодец! Раз ты дочитал это до конца, вероятно, ты все отлично усвоил. Но если вдруг что-то еще непонятно — попробуй онлайн-занятие с репетитором (подробности тут + 🎁).
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
|
Ну например,оксид алюминия(AL2O3). Записываем элементы ALO, теперь помним,что валентность кислорода равна 2,а валентность алюминия равна 3,теперь находим наименьшее общее кратное этих валентностей (наименьшее число, которое будет делиться на 3 и на 2),это будет 6,теперь делим 6 на валентность каждого элемента(для алюминия:6÷3=2,для кислорода:6÷2=3). И теперь записываем результаты после элементов(AL2O3). Ещё раз,1)записываем элементы;2) записываем их валентности;3)находим наименьшее общее кратное этих валентностей;4)делим это наименьшее общее кратное на данные валентности;5) записываем результаты после элементов. Знаете ответ? |