Все наверное слышали о таких инертных металлах, как золото, платина или серебро. Однако немногие знают, что существуют также газы, обозначаемые как инертные. К ним относятся, в частности: гелий, ассоциирующийся с продающимися на рынке шарами, или неон, повсеместно встречающийся на улицах городов. Каковы свойства инертных газов и где их применяют? Далее приведены самые важные факты.

Что такое инертные газы? Самая важная информация
Что такое инертные газы? Это так называемые гелиевые, или инертные, газы (название происходит от элемента — гелий), т. е. летучие вещества с низкой молекулярной массой. При взгляде на модели атомов инертных газов из учебников можно быстро заметить, что они имеют очень простую одноатомную структуру, не образуют более крупных кластеров и молекул.
Инертные газы отличаются прежде всего своей легкостью и почти нулевой реакционной способностью. Эти элементы существуют в свободном состоянии во Вселенной. На Земле их относительно немного, чаще всего они создаются в лабораторных условиях и на специализированных производственных предприятиях. Как можно получить инертный газ? Для этого работники лабораторий используют метод перегонки сжиженного воздуха.
Какие инертные газы были открыты за последние 200 лет? Список весьма короткий. В поисковике найдите Периодическую таблицу элементов и обратите внимание на последний, восемнадцатый, столбец. В состав группы входят 6 элементов:
- гелий (He);
- неон (Ne);
- аргон (Ar);
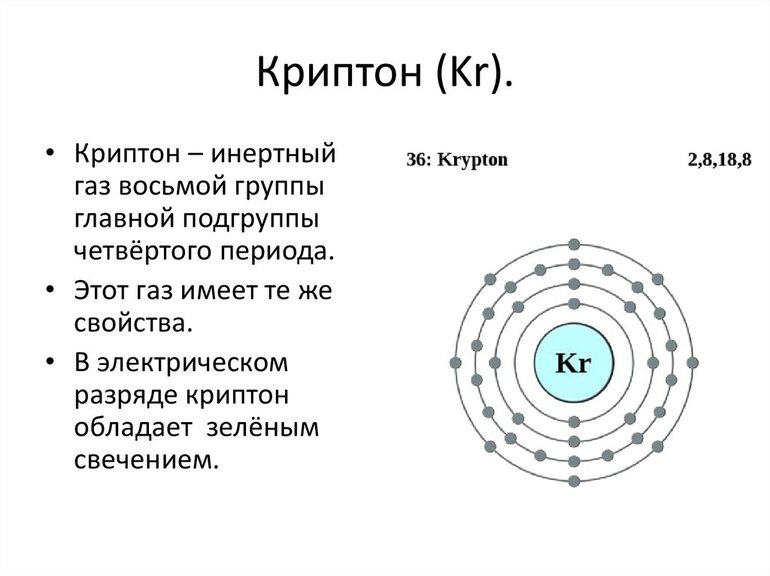
- криптон (Kr);
- ксенон (Хе);
- радон (Рн).
Перечисленные элементы могут совместно образовывать различные химические соединения, оксиды и кислородные кислоты.
Физические и химические свойства инертных газов
Что стоит знать о физических и химических свойствах инертных газов? Несомненно, эти вещества являются одними из самых ценных и интригующих элементов, известных человеку. Как следует из названия, инертные газы имеют летучее агрегатное состояние и легче воздуха. Какие общие особенности имеют инертные газы? Это элементы:
- без запаха и цвета;
- легкие;
- которые очень сложно сжижаются (температура сжижения гелия составляет -268,93 °С);
- которые поддаются кипячению и плавлению при низких температурах.
Растворяются ли инертные газы в воде? Эти элементы плохо растворяются в водной среде.
Особого внимания заслуживает вопрос о реакционной способности инертных газов. Инертные газы активны или химически неактивны? Интересно, что они не вступают в химическую реакцию с другими элементами (поэтому они химически неактивны). Чем тяжелее газ, тем больше увеличивается его способность вступать в реакцию с другими молекулами. Почему инертные газы по сути химически неактивны? Это связано с тем, что они имеют набор спаренных электронов в своей валентной оболочке, что автоматически делает невозможным создание новых пар. Наличие полных электронных оболочек также объясняет то, почему инертные газы не обладают электроотрицательностью. Ведь они стабильны и не притягивают внешние электроны.
Инертные газы и их электронная конфигурация
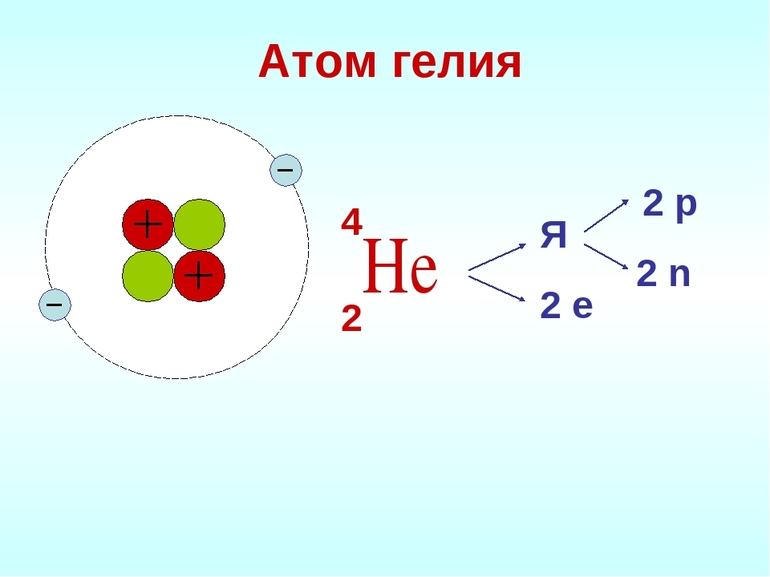
Электронная конфигурация — это обозначение строения атомов различных элементов и расположения электронов на их оболочках. Каково строение инертных газов? У них очень упрощенная схема электронной конфигурации — самое простое обозначение касается гелия и это: 1s2 (буква s обозначает подоболочку атома). Ксенон (4d10 5s2 5p6) или аргон (1s22s22p63s23p6) и другие инертные газы, состоящие из нескольких оболочек и различного количества электронов, имеют более сложную структуру.
Плотность инертных газов
Когда мы говорим о свойствах газов, нельзя обойти вниманием вопрос об их плотности. Гелий — инертный газ с наименьшей плотностью, составляющей 0,1785 кг/м³, что делает его примерно в 7 раз легче воздуха! Для сравнения: плотность аргона составляет 1,635 кг/м³, плотность неона — 0,824 кг/м³, криптона — 3430 кг/м³, ксенона — 5396 кг/м³, а радона — 9078 кг/м³. Указанные различия в плотности достаточно велики, что сказывается, среди прочего, и на разнообразии применения инертных газов.
Цвета инертных газов — как светятся инертные газы?
В Интернете часто можно встретить вопросы типа: каким цветом светятся инертные газы? Однако следует знать, что инертные газы сами по себе не излучают никакого цвета. Ведь они бесцветные! Оттенок газа появляется под действием электрических импульсов. Гелий светится ярко-желтым светом, неон — оранжевым или красным, а аргон — синим. Под действием тока криптон приобретает зеленый цвет, а ксенон — синий, белый или фиолетовый.
Являются ли инертные газы горючими и могут ли они проводить электрический ток?
Одним из ключевых химических свойств инертных газов является их негорючесть и отсутствие явления электропроводности. Таким образом, эти летучие вещества полностью безопасны даже на предприятиях, где существует высокий риск воспламенения и возгорания. Они прекрасно проводят тепловую энергию, светятся, но не горят, поэтому нашли самое разнообразное применение в быту.
Применение инертных газов: аргона, гелия и неона
Гелий, аргон и неон — элементы, привлекающие ученых и инвесторов с девятнадцатого века. Человечество постоянно ищет ответы на вопросы о возможном применении инертных газов, которые человек начал массово использовать только в двадцатом веке. Вы имеете дело с элементами Хе, Ар и Ne каждый день. Они входят в состав множества различных предметов, которые вы используете, — вот краткий обзор того, для чего нужны инертные газы:
Гелий
У вас он наверняка ассоциируется с баловством, плавающими в воздухе шариками для детей — и правильно, он продается как газ для наполнения шариков. Именно он заставляет разноцветные воздушные шарики улетать высоко вверх. Этот элемент также используют в следующих областях:
- производство дыхательных смесей для профессиональных водолазов;
- добыча природного газа;
- холодильные установки;
- сварочные процессы;
- приведение в действие дирижаблей, личных воздушных шаров.
Гелий как самый легкий газ нашел применение и в лабораториях как носитель различных веществ. В промышленности этот элемент также используют для диагностики протекания в установках, резервуарах и т. д.
Неон
Когда вы слышите слово «неон», вы можете представить себе светящуюся вывеску магазина или яркую городскую рекламу. И неудивительно, ведь неон — это не только название элемента, это еще и электрическая люминесцентная лампа (рекламная или декоративная), состоящая из цветных трубок, известная с начала двадцатого века. Что стоит знать о применении неона? В настоящее время его в основном используют, чтобы производить:
- средства освещения (светильники, лампочки);
- фотодиоды;
- лазеры;
- компоненты телевизоров.
Аргон
Газ аргон был открыт в конце девятнадцатого века. В настоящее время его применяют, среди прочего, для производства лампочек, энергосберегающих окон и полупроводников. Аргон позволяет создавать защитную атмосферу в различных технологических процессах, таких как упаковка или сварка. Он также бесценен в лабораториях и хроматографии, полезен в процессах разделения различных веществ.
Инертные газы — применение ксенона, криптона и радона
Другими элементами из группы гелия являются: ксенон, криптон и радон. Где применяют эти инертные газы? Использование элементов Xe, Kr и Rn в промышленности и медицине действительно впечатляет. Вот краткий обзор наиболее важных областей применения этих газов:
- Ксенон: применяется в производстве автомобильных ксеноновых ламп, фотовспышек, стробоскопов, применяется в медицине как обезболивающее и вспомогательное средство в борьбе с последствиями переохлаждения.
- Криптон: используется в основном для наполнения мощных ламп накаливания, применяется в производстве люминесцентных ламп, стеклопакетов (выполняет функцию изолятора).
- Радон: этот инертный газ в основном используется в лучевой терапии (лечении опухолей).
Ученые и представители сферы бизнеса постоянно открывают новые свойства и области применения инертных газов. Исследования гелия продолжаются и оказываются бесценными в медицине, авиации, автомобилестроении и даже межпланетном транспорте! Легкие нереакционноспособные газы обладают огромным потенциалом и, несомненно, являются одним из самых многообещающих сырьевых материалов будущего.
Инертные газы: особенности, факты и мифы
В эпоху развития науки мы как человечество хотели бы знать все об инертных газах, чтобы иметь возможность в полной мере использовать их свойства. Гелий, который известен человеку всего около 100 лет, до сих пор остается одним из самых загадочных элементов. Какие интересные факты связаны с инертными газами? Какие факты и мифы об инертных газах стоит знать? Речь идет о следующем:
Радон является канцерогеном
В группе инертных газов радон является самым тяжелым радиоактивным газом. Встречается в природе в минералах, почве, воде и горных породах, из которых проникает в атмосферу. Этот элемент легко попадает в легкие человека, так как в небольших количествах он содержится практически в каждом здании. Согласно информации, размещенной на сайте Санэпиднадзора, допустимая норма концентрации радона внутри помещений составляет 300 Бк/м3/год. Так в каких же обстоятельствах повышается вероятность развития рака легких? В плохо проветриваемых зданиях, при наличии негерметичной сантехники, находящихся в геологически нестабильных регионах, вблизи урансодержащих пород.
К группе инертных газов также относится оганессон
Оганессон (Og, оганесон) — один из новейших элементов, открытых 20 лет назад. Что о нем известно? Вещество получено искусственным путем, его атомное число — 118. Официально этот элемент появился в таблице Менделеева только в 2016 году, но до конца не познан и не изучен. В научном сообществе он лишь условно классифицируется как инертный газ и трансурановый материал, то есть радиоактивный элемент с атомным числом более 92.
Гелий — газ, изменяющий человеческий голос
Как так получается, что после нескольких вдохов гелия голос меняется до неузнаваемости? Гелий заставляет звуки выходить из голосовых связок очень быстро. Поэтому, когда вы закачиваете этот инертный газ в легкие, то начинаете говорить голосом, напоминающим голос маленького ребенка или героев из мультфильмов. Конечно, стоит иметь в виду, что гелий сам по себе не вреден, но если слишком долго пропускать его в легкие, можно вызвать гипоксию организма.
From Wikipedia, the free encyclopedia
An inert gas is a gas that does not readily undergo chemical reactions with other chemical substances and therefore does not readily form chemical compounds. The noble gases often do not react with many substances[1] and were historically referred to as the inert gases. Inert gases are used generally to avoid unwanted chemical reactions degrading a sample. These undesirable chemical reactions are often oxidation and hydrolysis reactions with the oxygen and moisture in air. The term inert gas is context-dependent because several of the noble gases can be made to react under certain conditions.
Purified argon gas is the most commonly used inert gas due to its high natural abundance (78.3% N2, 1% Ar in air) and low relative cost.
Unlike noble gases, an inert gas is not necessarily elemental and is often a compound gas. Like the noble gases, the tendency for non-reactivity is due to the valence, the outermost electron shell, being complete in all the inert gases.[2] This is a tendency, not a rule, as noble gases and other «inert» gases can react to form compounds.
Need/Necessity[edit]
The inert gases are obtained by fractional distillation of air, with the exception of helium which is separated from a few natural gas sources rich in this element,[3] through cryogenic distillation or membrane separation.[4] For specialized applications, purified inert gas shall be produced by specialized generators on-site. They are often used by chemical tankers and product carriers (smaller vessels). Benchtop specialized generators are also available for laboratories.
Applications on inert gas[edit]
Because of the non-reactive properties of inert gases, they are often useful to prevent undesirable chemical reactions from taking place. Food is packed in an inert gas to remove oxygen gas. This prevents bacteria from growing.[5] It also prevents chemical oxidation by oxygen in normal air. An example is the rancidification (caused by oxidation) of edible oils. In food packaging, inert gases are used as a passive preservative, in contrast to active preservatives like sodium benzoate (an antimicrobial) or BHT (an antioxidant).
Historical documents may also be stored under inert gas to avoid degradation. For example, the original documents of the U.S. Constitution are stored under humidified argon. Helium was previously used, but it was less suitable because it diffuses out of the case more quickly than argon.[6]
Inert gases are often used in the chemical industry. In a chemical manufacturing plant, reactions can be conducted under inert gas to minimize fire hazards or unwanted reactions. In such plants and in oil refineries, transfer lines and vessels can be purged with inert gas as a fire and explosion prevention measure. At the bench scale, chemists perform experiments on air-sensitive compounds using air-free techniques developed to handle them under inert gas. Helium, neon, argon, krypton, xenon, and radon are inert gases.
Inert gas systems on ships[edit]
Inert gas is produced on board crude oil carriers (above 8,000 tonnes)(from Jan 1, 2016) by burning kerosene in a dedicated inert gas generator. The inert gas system is used to prevent the atmosphere in cargo tanks or bunkers from coming into the explosive range.[7] Inert gases keep the oxygen content of the tank atmosphere below 5% (on crude carriers, less for product carriers and gas tankers), thus making any air/hydrocarbon gas mixture in the tank too rich (too high a fuel to oxygen ratio) to ignite. Inert gases are most important during discharging and during the ballast voyage when more hydrocarbon vapor is likely to be present in the tank atmosphere. Inert gas can also be used to purge the tank of the volatile atmosphere in preparation for gas freeing — replacing the atmosphere with breathable air — or vice versa.
The flue gas system uses the boiler exhaust as its source, so it is important that the fuel/air ratio in the boiler burners is properly regulated to ensure that high-quality inert gases are produced. Too much air would result in an oxygen content exceeding 5%, and too much fuel oil would result in the carryover of dangerous hydrocarbon gas. The flue gas is cleaned and cooled by the scrubber tower. Various safety devices prevent overpressure, the return of hydrocarbon gas to the engine room, or having a supply of IG with too high oxygen content.
Gas tankers and product carriers cannot rely on flue gas systems (because they require IG with O2 content of 1% or less) and so use inert gas generators instead. The inert gas generator consists of a combustion chamber and scrubber unit supplied by fans and a refrigeration unit which cools the gas. A drier in series with the system removes moisture from the gas before it is supplied to the deck. Cargo tanks on gas carriers are not inerted, but the whole space around them is.
Inert gas systems on aircraft[edit]
Inert gas is produced on board commercial and military aircraft in order to passivate fuel tanks. On hot days, fuel vapor in fuel tanks may otherwise form a flammable or explosive mixture which if oxidized, could have catastrophic consequences. Conventionally, Air Separation Modules (ASMs) have been used to generate inert gas. ASMs contain selectively permeable membranes. They are fed compressed air that is extracted from a compressor stage of a gas turbine engine. The pressure drives the separation of oxygen from the air due to the increased permeability of oxygen through the ASMs in comparison to nitrogen. For fuel tank passivation, it is not necessary to remove all oxygen, but rather enough to stay below the lean flammability limit and the lean explosion limit. An oxygen concentration of 10% to 12% is common over the course of a flight.
Welding[edit]
In gas tungsten arc welding (GTAW), inert gases are used to shield the tungsten from contamination. It also shields the fluid metal (created from the arc) from the reactive gases in air which can cause porosity in the solidified weld puddle. Inert gases are also used in gas metal arc welding (GMAW) for welding non-ferrous metals.[8] Some gases which are not usually considered inert but which behave like inert gases in all the circumstances likely to be encountered in some use can often be used as a substitute for an inert gas. This is useful when an appropriate pseudo-inert gas can be found which is inexpensive and common. For example, carbon dioxide is sometimes used in gas mixtures for GMAW because it is not reactive to the weld pool created by arc welding. But it is reactive to the arc. The more carbon dioxide that is added to the inert gas, such as argon, will increase your penetration. The amount of carbon dioxide is often determined by what kind of transfer you will be using in GMAW. The most common is spray arc transfer, and the most commonly used gas mixture for spray arc transfer is 90% argon and 10% carbon dioxide.
Diving[edit]
In underwater diving an inert gas is a component of the breathing mixture which is not metabolically active and serves to dilute the gas mixture. The inert gas may have effects on the diver, but these are thought to be mostly physical effects, such as tissue damage caused by bubbles in decompression sickness. The most common inert gas used in breathing gas for commercial diving is helium.
See also[edit]
- Breathing gas – Gas used for human respiration
- Industrial gas – Gaseous materials produced for use in industry
- Inerting system for aircraft
- Tank blanketing
- Purging (gas), a fire and explosion prevention procedure to avoid the formation of an ignitable atmosphere, accomplished by flushing a closed system with an inert gas
- Inerting (gas) – Introduction of inert gas in a closed system, a fire and explosion prevention procedure to make an ignitable atmosphere safe, accomplished by injecting an inert gas
References[edit]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «inert gas». doi:10.1351/goldbook.I03027
- ^ Singh, Jasvinder. The Sterling Dictionary of Physics. New Delhi, India: Sterling, 2007. 122.
- ^ «Qatargas — Operations». www.qatargas.com. Archived from the original on 2020-04-28. Retrieved 2018-08-31.
- ^ «SEPURAN® Noble for helium recovery — SEPURAN® — Efficient gas separation». www.sepuran.com. Archived from the original on 2020-08-06. Retrieved 2018-08-31.
- ^ Maier, Clive & Teresa Calafut. Polypropylene: The Definitive User’s Guide and Databook. Norwich, New York: Plastics Design Library, 1998. 105.
- ^ «Charters of Freedom Re-encasement Project». National Archives. Retrieved 2012-02-11.
- ^ International Maritime Organization. Tanker yes Familiarization London: Ashford Overload Services, 2000. 185.
- ^ Davis, J.R., ed. Corrosion: Understanding the Basics. Materials Park, Ohio: ASM International, 2000. 188.
Открытие и список инертных газов
Инертные газы относятся к 18-й группе химических элементов периодической таблицы Менделеева. Всего существует 6 элементов, которые имеют следующие названия и формулы:
- гелий (He);
- неон (Ne);
- аргон (Ar);
- криптон (Kr);
- ксенон (Xe);
- радиоактивный радон (Rn).
Они довольно широко представлены во вселенной. По современным подсчетам космическая масса вселенной состоит на 76% из водорода, на 23% из гелия и только 1% приходится на другие элементы.
Водород и гелий ученые относят к элементам первичной материи вселенной. В атмосфере Земли благородных газов около одного процента. В основном это аргон. Их открытие — одна из увлекательнейших страниц истории науки.
Содержание инертных газов в природе:
- В космосе особенно много гелия, образующегося там из водорода в результате термоядерной реакции. После водорода, это самый распространенный элемент. На Земле гелий можно обнаружить в составе природных горючих газов.
- Неон присутствует в атмосфере и в земной коре — 0,00005 г/т.
- Аргон — это самый распространенный на планете инертный газ. (в земной коре его ничтожно мало, а в атмосфере почти один процент).
- Криптон, ксенон и радон обнаруживается в земной атмосфере и в отдельных минералах, содержащих уран.
- Радон относится к радиоактивным элементам, среди всех он один из самых тяжелых, он определяет степень естественной радиоактивности воздуха.
Первым из этих элементов был открыт гелий. В 1868 году его обнаружили в солнечном спектре. В Парижской академии газ назвали гелий или «солнечный». Британский химик Уильям Рамзай открыл гелий и на Земле, но уже после того, как был открыт аргон.
В 1892 году в Лондоне химик Джон Уильям Стретт (лорд Рэлей) опубликовывает обращение к ученым в журнале «Природа». Он обнаружил, что азот, полученный из воздуха, имеет больший вес, чем азот, полученный химическим путем. Как объяснить это явление — задал Рэлей вопрос своим коллегам?
Рамзай высказал предположение: в азоте воздуха содержится неизвестный газ. Два года совместных исследований привели к сенсационным результатам. Был открыт новый газ, он оказался инертным. Он стал называться аргон — «медленный» или «неактивный».
Физические свойства
Менделеев открытие аргона расценивал как испытание периодического закона. Ведь если аргон существует, то он должен стоять на месте калия, однако это противоречило бы закону периодической повторяемости свойств элементов.
Испытание было выдержано с успехом. Открытие гелия на Земле позволило предположить наличие отдельной группы. Из-за инертности газов их выделили в нулевую группу. Рамзай был непоколебимым сторонником периодического закона Менделеева и, опираясь на него, предсказал, а потом уже открыл неон, криптон и ксенон.
Радон был обнаружен в 1900 году, как результат распада радиоактивного радия. Сам он также подвергался дальнейшему распаду. Превращаемость элементов, стала доказанным фактом и новые открытия, обусловленные развитием техники.
Инертные газы имеют следующие физические свойства:
- они не обладают ни цветом, ни запахом;
- их с трудом можно обратить в жидкое состояние;
- с возрастанием поляризуемости молекул от гелия к радону, повышается их способность растворяться в воде;
- они могут легко растворяться в органических растворителях, например, спирте или бензине;
- они способны адсорбироваться на поверхности активированного угля при низких температурах, что дает возможность проводить их очистку и разделение;
- у гелия очень высока способность проникать в другие химические элементы, он может просачиваться сквозь стенки различных сосудов (стеклянных, пластмассовых и некоторых металлических).
При помощи масс-спектрографа у всех инертных газов обнаружены изотопы. В природе у гелия наименьшее количество стабильных изотопов — 2, у ксенона — наибольшее 9. У радона стабильных изотопов не обнаружено.
Строение атомов
Причина инертности благородных газов в строении атомов. Исследования показали, что у них максимально заполненные энергетические уровни. Гелий обозначается как 1s2 элемент. Он имеет самую прочную структуру атома среди всех химических элементов.
Остальные благородные газы — это p элементы. Электронное строение атома определяет многие свойства этих газов. Их молекулы одноатомные. У них низкая энергия сродства к электрону.
Завершенность внешнего энергетического уровня обусловливает диамагнитность благородных газов. Высокие потенциалы ионизации, также прямое следствие замкнутости и устойчивости электронных оболочек атомов.
С ростом порядкового номера элемента его потенциал ионизации уменьшается. При сравнении видно, что начиная с криптона, у инертных газов ионизационный потенциал уже ниже, чем у кислорода и фтора. Это обусловливает возможность взаимодействия этих элементов.
Опровержение теории химической инертности
По плотности они делятся на легкие: гелий и неон и тяжелые — все остальные. Гелий самый легкий газ в природе, он легче воздуха в 7 раз. Аргон открывает группу тяжелых газов. Жидкий аргон тяжелее не только воздуха, но и воды.
С увеличением поляризуемости от гелия к радону, увеличиваются радиусы атомов, а также возрастает растворимость в воде и абсорбируемость. Газообразный гелий с трудом можно собрать в закрытый сосуд. Аргон, по сравнению с гелием, уже более вязкий. Его можно перелить из сосуда в сосуд. С увеличением атомной массы и радиуса атома у газов уменьшается теплопроводность, повышается температура кипения. Кроме того, увеличивается возможность деформации внешних электронных слоёв, а значит создается предпосылка химической связи.
Для сжижения благородных газов нужны сверхнизкие температуры, особенно для гелия. У жидкого гелия обнаружено уникальное свойство — сверхтекучесть.
Это подтверждается простым опытом. Если погрузить пробирку в сосуд с жидким гелием, то жидкость будет ползти вверх по наружной стенке пробирки и опускаться по внутренней. Если пробирку приподнять, то гелий начинает двигаться в обратную сторону, выравнивая уровни. Когда пробирку вынимают, то гелий продолжает стекать по ней и капать вниз.
Это свойство у гелия открыл советский физик, академик Петр Леонидович Капица. В 1962 году канадский химик Нил Бартлетт, наконец, опроверг теорию химической инертности благородных газов. Ему удалось в процессе гетерогенного катализа синтезировать соединение ксенона с гексафторидом платины (Xe+PtF6=Xe (PtF6)x).
Событие это было также сенсационно, как заявление Рамзая об инертности аргона. Это позволило инертным газам покинуть нулевую группу. Инертные газы в таблице Менделеева справедливо заняли свое место в восьмой группе.
Правда, еще до открытия Бартлетта были получены клатратные соединения тяжелых инертных газов. При относительно высоких давлениях молекулы газов, в этом случае криптона, плотно окружаются молекулами гидрохинона и включаются в них.
В клатратных соединениях связь молекулярная, валентные электроны в них не взаимодействуют. Клатраты нестойкие соединения, в растворах они быстро распадаются на составные части. Их можно использовать как удобные формы для хранения благородных газов.
Фториды и оксиды ксенона
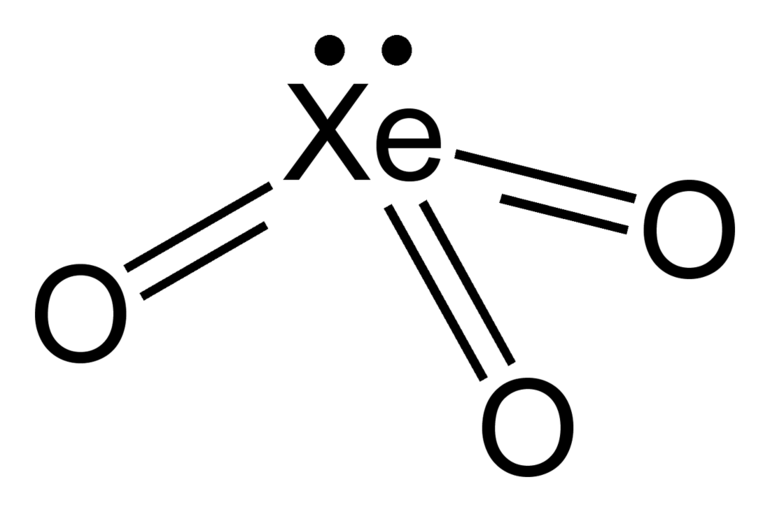
После работ Бартлетта, следующим шагом стали явились опыты по непосредственному соединению ксенона с фтором. Из смеси одного объема ксенона, варьируя условия реакции, получают фториды с различной степенью окисления ксенона. Самый устойчивый из них — тетрафторид ксенона.
Фториды ксенона довольно летучие вещества. Хранят их в тефлоновых сосудах. Они хорошие окислители и фторирующие агенты. Фториды ксенона подвержены гидролизу. В результате реакции образуются оксофториды или оксиды. Триоксид ксенона в сухом виде легко взрывается. Сила взрыва такая же, как у тротила.
Оксиды обладают кислотными свойствами. При взаимодействии с основаниями образуют соли. Триоксид образует ксенаты. Реакция диспропорционирования ксенатов приводит к образованию перксенатов. Ксенаты являются солями ксенонистой кислоты, а перксенаты — ксеноновой. Ксеноновая кислота, в свою очередь, является производной тетраоксида ксенона.
Оксиды ксенона, так же как и фториды, являются сильными окислителями. При реакции с йодом калия образуется йод и ксенон. Кристаллы дифторида ксенона можно получить, если смесь газов в кварцевой ампуле подвергнуть ультрафиолетовому облучению. Его можно получить также при помощи электрического разряда.
Химия инертных газов — это прежде всего химия ксенона. Это синтезированные и комплексные соединения фторидов, полученные катионные и анионные формы комплексов.
Получение и использование аргона
В промышленности благородные газы получили широкое применение. Наиболее доступный из них — аргон. Его получают из воздуха методом двойной ректификации при низких температурах. Воздух очищают от углекислоты и влаги, сжижают с помощью глубокого холода и подают в ректификационную колонну.
Сравнительно легко выделяют азот, а вот с кислородом труднее. Температура кипения его и аргона близки. Способом двойной ректификации кислород отделяется, и сырой аргон поступает в блок тонкой адсорбционной очистки.
Адсорбция идет на синтетических цеолитах, так называемых молекулярных ситах. Благодаря этому методу аргон получается очень чистым, практически без примеси.
Основная область применения аргона — металлургическая и металлообрабатывающая промышленность. Аргонодуговая сварка очень высокопроизводительна и обеспечивает хорошее качество шва.
Другой способ получения аргона, а также криптона и ксенона основан на методе адсорбции из отходящих газов при синтезе аммиака.
Использование в промышленности гелия и радона
Гелий получают из природных газов, которые предварительно очищаются от примесей и влаги.
Сухой газ, проходя несколько этапов, охлаждается до такой температуры, когда все его компоненты конденсируются в жидкость, лишь гелий остается газообразным. Через верхнюю часть разделительного аппарата он выводится наружу. Налажено производство и жидкого гелия. Он играет большую роль в современной физике и криогенной технике.
В газообразном виде легкий и инертный гелий — идеальный наполнитель для дирижаблей. Благодаря налаженному промышленному получению гелия, идея дирижаблестроения в стране возрождается.
Находят применение и радиоактивные изотопы благородных газов. Радиоизотопы ксенон-133 используется для исследования спинного мозга и кровотока головного мозга. Прибор, регистрирующий радиоактивность, определяет локализацию изотопа ксенона и помогает ставить правильный диагноз.
Радон — радиоактивный газ, он дочерний элемент изотопа радия-226. Используя хорошую растворимость радона в воде, медицина поставила его на службу человека. Растворенный радон диффундирует через кожу и оказывает благотворительное воздействие на центральную нервную систему, а через нее и на другие органы человека. Поэтому широко распространено лечение радоновыми ваннами.
В геологии изотопом аргон-40 определяют абсолютный возраст горных пород по методу советского ученого Герлинга. В основе метода лежит процесс распада радиоактивного изотопа калия-40 с образованием основного изотопа аргона-40.
В электровакуумной промышленности используют свойство инертных газов светиться, если через них пропускать электрический разряд. Промышленность выпускает очень широкий ассортимент газоразрядных источников света.
На основе изучения благородных газов складывался ряд фундаментальных научных законов. Все отчетливее выявляется их значение в познании Земли и космоса.
Содержание статьи:
- Какие свойства есть у инертных газов
- Области использования
- Особенности применения разных видов газов
В промышленности часто используются инертные газы. Это группа элементов таблицы Менделеева, имеющие одноатомную структуру и при этом плохо взаимодействующие с другими типами веществ.
При ближайшем рассмотрении атомов такого газа, можно заметить у большинства из них восемь электронов. Единственным исключением является гелий. Это обеспечивает хорошие показатели энергетической стабильности — фактор, во многом определивший повсеместное применение.
За одно и то же, т. е. за один способ поведения, известную группу металлов называют благородными, а газы ― инертными.
Венедикт Ерофеев
Как еще называют инертные газы? Они часто встречаются под названием благородных. Распространено и название редких, потому что они действительно не так часто встречаются на нашей планете, высоко ценятся и бережно расходуются.
В группу входят сразу несколько веществ:
- Гелий.
- Криптон.
- Ксенон.
- Аргон.
- Радон.
- Криптон.
Сегодня нередко можно встретить научный подход, который причисляет к группе и оганесон.
Это открытый сравнительно недавно элемент, который пока отличается малой изученностью. В силу недостатка информации об этом газе, мы не будет подробно рассматривать его в материале. Ему только предстоит пополнить группу «благородных», либо оказаться отнесенным к другим категориям.
На Земле инертные газы содержатся в разных местах. Одни получают из воздуха, в то время как другие в малых концентрациях есть в горных породах, воде, нефти, других видах природных газов.
Исследования отмечают, что в других местах солнечной системы элементы встречаются значительно чаще и в большем количестве. К примеру, Солнце очень богато гелием.
Основной метод добычи большинства редких газов — сжижение воздуха с его последующим разделением фракционным методом.
Какие свойства есть у инертных газов
При планировании большое значение имеет хорошее понимание физических и химических свойств инертных газов. Среди важных показателей:
- Вещества не имеют цвета и запаха.
- Масса крайне мала, к примеру гелий меньше воздуха.
- Высокая сложность сжижения с необходимостью использования повышенных температур.
- Склонность к кипению при экстремально низких температурах.
- Плохая растворимость в воде.
- Низкая теплопроводность.
- Негорючесть и неспособность поддерживать горение.
- Хорошая токопроводимость.
Благородные газы практически не вступают в реакцию с металлами, а также со многими другими химическими элементами. К примеру, не наблюдается никакого взаимодействия с кислотами и щелочами, органикой и кислородом.
Ученые наблюдают заметное увеличение степени химической активности по мере возрастная атомной массы.
Есть и специфические свойства отдельных элементов. К примеру, неон и гелий крайне сложно вступают во взаимодействие с другими веществами. Для этого требуется создание, поддержание на протяжении определенного времени целого ряда условий.
Хотите получить консультацию?
Позвоните нам по телефону!
+7 (495) 532 17 17 Пн.-Пт. с 9:00 до 18:00, обед с 13:00 до 14.00, Сб. с 9.00 до 15:00
Электронная конфигурация
Этот параметр дает представление о строении атомов и о том, как на оболочке располагаются электроны. По сравнению со многими другими веществами у редких газов предельно упрощена электронная конфигурация. При этом, может быть, несколько атомных оболочек с разным количеством электронов.
Плотность
Плотность зависит от типа газа. Меньшая она у гелия — составляет всего 0,1785 кг/м³. Показатели для других веществ:
| Тип газа | Плотность (кг/м³) |
|---|---|
| Аргон | 1,635 |
| Неон | 0,824 |
| Криптон | 3430 |
| Ксенон | 5396 |
| Радон | 9078 |
Области использования
Вещества могут применяться как сами по себе, так и в составе смесей с другими элементами. Среди основных областей:
- Системы подачи инертного газа на судах. В судостроении вещества отвечают за поддержание плавучести и безопасности, а также при контроле специфических процессов.
- Сварка. Газ создает безопасную среду во время процесса сваривания металлических деталей. Это нужно для увеличения качества шва, уменьшения разбрызгивания металла, исключения окислительного процесса.
- Системы подачи инертного газа на летательных аппаратах. Применяются комплексы передачи газовой среды, гарантирующие стабильность и безопасность разных видов авиасредств.
- Дайвинг. Газовая смесь закачивается в баллоны ныряльщиков. Это нужно для сохранения здоровья аквалангистов, стабилизации давления, уменьшения рисков при нырянии на разную глубину.
Есть и много других областей применения — создание оптики, приборов для разных отраслей использования, светильников. Может потребоваться использовать элемент, чтобы получить металл сверхвысокой степени чистоты.
Особенности применения разных видов газов
Далее мы рассмотрим особенности и применение основных газов, которые относятся к этой группе.
Гелий
У гелия много важных свойств, в том числе, уникальных. В жидком состоянии он представляет собой самую холодную жидкость из всех, что могут присутствовать на нашей планете. Это объясняет его большое распространение в сложных сферах — поддержание работы ядерных ускорителей, формирование эффекта сверхпроводимости, выполнение магнитно-резонансной томографии в медицинской сфере.
Также газ применяется в дайвинге. Он направлен на то, что при погружении на большую глубину защитить человека от развития кессонной болезни. Ранее во время всплытия она часто становилась причиной получения инвалидности или летального исхода среди дайверов.
Газ применяется в воздухоплавании. Им наполняют воздушные шары, различные метеорологические зонды. В силу своей негорючести в этой сфере он получил большее распространение, чем аналогичный по многим характеристикам водород.
Допускается использование в диагностических системах. Гелий помогает искать места разгерметизации технических систем, эксплуатируемых под высоким давлением.
Кроме обеспечения работы магнитно-резонансных томографов в медицине гелий также подходит для лечения заболеваний дыхательной системы.
Неон
Еще один достаточно распространенный в промышленности газ. В сочетании с гелием он создает защитную среду при работе газового лазера. Это помогает повысить качество кромки во время резки.
В жидком состоянии он становится хорошим охладителем. По этим параметрам он превосходит не только гелий, но и водород.
Аргон
Очень распространенный газ. Кроме его выраженных физических свойств это стимулируется невысокой ценой. Применение помогает в формировании инертной среды. В ней значительно лучше проводятся работы с разными материалами:
- Сталь в жидком виде.
- Цветмет.
- Щелочные металлы.
По этой причине большую востребованность получила аргоновая сварка и резка.
Также вещество подойдет для наполнения гидрокостюмов. Радиоактивный изотоп задействован в тестировании качества монтажа вентиляционных систем на ответственных объектах.
Ксенон
Есть множество видов продукции, изготовление которой невозможно представить без применения ксенона. Он вошел в технологические процессы изготовления таких изделий и приборов, как:
- Автомобильные лампы.
- Вспышки для фотоаппаратов.
- Стробоскопы.
Медицинская среда использует газ в качестве анестетика. Он также подойдет и при лечении в качестве дополнительного средства для борьбы с сильным переохлаждением организма пациента.
Криптон
Так же как многие другие виды веществ, используется в качестве заполнителя. Его могут закачивать в лампы накаливания высокого уровня мощности, а также в люминесцентные светильники.
Оконная промышленность в последние годы стала большим потребителем криптона. Его изоляционные свойства позволяют обеспечивать закачку в стеклопакеты. Так заметно уменьшается теплопотеря, оптимизируется работа отопительной системы.
Радон
Вещество имеет большое значение в медицине. Оно необходимо для выполнения лучевой терапии. Таким образом удается проводить успешное лечение угрожающих здоровью и жизни пациента опухолей.
В сварке нередко применяются так называемые инертные газы. К ним относится группа химических элементов, у которых оказываются схожие свойства. Инертный газ благородный при нормальных условиях является одноатомным. Практически все они не обладают ни цветом, ни запахом. Характерной отличительной особенностью является очень низкая химическая реактивность. Они практически не вступают в реакцию с металлами, что и требуется для нормальной работы. Такие газы занимают первые 6 периодов и относятся к восьмой группе химических элементов в периодической таблице.
Свойства инертных газов можно объяснить по теории об атомных структурах. У них получаются полные электронные оболочки из валентных электронов. Это создает условия, в которых вещество может участвовать лишь в небольшом количестве химических реакций. Стоит отметить, что различия в температурах кипения и плавления практически у всех благородных газов менее 10 градусов Цельсия.
Содержание
Что такое инертные газы?
Благородные газы, известные в химии благодаря своему уникальному свойству не смешиваться с другими веществами, также часто называют инертными. Как можно судить из названия, “благородство” инертных газов не позволяет им взаимодействовать с более простыми субстанциями и даже друг с другом. Такая избирательность благородных газов вызвана их атомным строением, которое проявляется в замкнутой внешней электронной оболочке, не позволяющей радону, гелию, ксенону, аргону, криптону и неону обмениваться своими электронами с атомами других газов.
Самым распространенным инертным газом в природе считают аргон, который занимает почетное третье место по содержанию в атмосфере Земли после азота и кислорода. У аргона нет вкуса, запаха и цвета, однако именно этот газ считается одним из самых распространенных во Вселенной. Так, наличие этого газа наблюдается даже в некоторых планетарных туманностях и в составе некоторых звезд.
При нагревании в газоразрядной трубке аргон приобретает розовый оттенок
Самым редким благородным газом в природе считают ксенон, который несмотря на свою редкость, содержится в атмосфере Земли наряду с аргоном. Ксенон обладает наркотическими свойствами и часто применяется в медицине в качестве анестезирующего средства. Кроме того, согласно данным Всемирного антидопингового агентства, ингаляции этого редкого газа имеют допинговый эффект, влияющий на физическое состояние применяющих его спортсменов. Заполнение ксеноном легких человека приводит к временному понижению тембра голоса, что является эффектом, обратным применению гелия.
При нагревании ксенон светится фиолетовым цветом
Четверо остальных благородных газов — Радон, Гелий, Неон и Криптон — также обладают своими уникальными свойствами. Все они не имеют какого-либо специфического вкуса, запаха или цвета, однако присутствуют в атмосфере Земли в небольших количествах и важны для нашего дыхания. Так, гелий считается одним из самых распространенных элементов в космосе, а его наличие в атмосфере Солнца, в составе других звезд Млечного Пути и некоторых метеоритов подтверждено научными данными.
Если вам нравится данная статья, приглашаю вас присоединиться к нашему каналу на Яндекс.Дзен, где вы сможете найти еще больше полезной информации из мира популярной науки и техники.
Неон, светящийся при нагревании красноватым оттенком, получается из воздуха при его глубоком охлаждении. Из-за сравнительно небольшой концентрации этого инертного газа в атмосфере планеты, неон чаще всего получают в качестве побочного продукта при добыче аргона.
Радон — радиоактивный инертный газ, который может представлять опасность для человеческого здоровья. Газообразный радон способен светиться голубым или синим светом, постепенно облучая человека и даже приводя к онкологическим заболеваниям. Несмотря на это, в медицине часто применяются так называемые радоновые ванны, которые позволяют добиться положительного эффекта при лечении болезней центральной нервной системы.
Радоновое озеро в селе Лопухинка Ленинградской области
И наконец, последний благородный газ, который можно найти в природе — криптон. Это один из самых редких благородных газов во Вселенной. В отличии от остальных инертных газов, этот газ при определенных условиях может испускать резкий запах, схожий с запахом хлороформа. Воздействие криптона на человека и животных крайне мало изучено из-за невероятной редкости этого газа.
Область применения
Свойства инертных газов делают их очень востребованными в сварочной сфере. Основными местами применения являются газовая и газово-дуговая сварка. Они выполняют роль защитной среды, которая отгораживает сварочную ванну с расплавленным металлом от негативного воздействия различных факторов, в том числе и воздушной среды. Как правило, они применяются вместе с техническим кислородом, так как он повышает температуру их горения. При использовании инертных газов швы получаются более надежными и качественными, так как снижается вероятность возникновения брака во время работы.
Вещества используются на строительных площадках при соединении металлоконструкций, в особенности, несущих частей. Ими удобнее работать с тонкими деталями, трубами и прочими объектами, которые сложно поддаются электрической сварке. В ремонтных мастерских по восстановлению автомобилей и прочей сложной техники именно сварка инертными газами является основным методом соединения деталей, так как она обладает деликатным отношением к материалу. В коммунальной сфере, где речь идет о ремонте труб и прочих вещей эти разновидности также используются. При производстве металлических изделий самого различного типа, особенно из цветных сложно свариваемых металлов, инертный газ благородный выступает основным сырьем для работы.
Открытие и список инертных газов
Инертные газы относятся к 18-й группе химических элементов периодической таблицы Менделеева. Всего существует 6 элементов, которые имеют следующие названия и формулы:
- гелий (He);
- неон (Ne);
- аргон (Ar);
- криптон (Kr);
- ксенон (Xe);
- радиоактивный радон (Rn).
Они довольно широко представлены во вселенной. По современным подсчетам космическая масса вселенной состоит на 76% из водорода, на 23% из гелия и только 1% приходится на другие элементы.
Водород и гелий ученые относят к элементам первичной материи вселенной. В атмосфере Земли благородных газов около одного процента. В основном это аргон. Их открытие — одна из увлекательнейших страниц истории науки.Содержание инертных газов в природе:
В космосе особенно много гелия, образующегося там из водорода в результате термоядерной реакции. После водорода, это самый распространенный элемент. На Земле гелий можно обнаружить в составе природных горючих газов.
- Неон присутствует в атмосфере и в земной коре — 0,00005 г/т.
- Аргон — это самый распространенный на планете инертный газ. (в земной коре его ничтожно мало, а в атмосфере почти один процент).
- Криптон, ксенон и радон обнаруживается в земной атмосфере и в отдельных минералах, содержащих уран.
- Радон относится к радиоактивным элементам, среди всех он один из самых тяжелых, он определяет степень естественной радиоактивности воздуха.
Первым из этих элементов был открыт гелий. В 1868 году его обнаружили в солнечном спектре. В Парижской академии газ назвали гелий или «солнечный». Британский химик Уильям Рамзай открыл гелий и на Земле, но уже после того, как был открыт аргон.
В 1892 году в Лондоне химик Джон Уильям Стретт (лорд Рэлей) опубликовывает обращение к ученым в журнале «Природа». Он обнаружил, что азот, полученный из воздуха, имеет больший вес, чем азот, полученный химическим путем. Как объяснить это явление — задал Рэлей вопрос своим коллегам?
Рамзай высказал предположение: в азоте воздуха содержится неизвестный газ. Два года совместных исследований привели к сенсационным результатам. Был открыт новый газ, он оказался инертным. Он стал называться аргон — «медленный» или «неактивный».
Благородные (инертные) газы
Благородные газы ( инертные либо редкие газы ) — группа химических элементов с похожими свойствами: при нормальных условиях они являются одноатомными газами. Химия 7,8,9,10,11 класс, ЕГЭ, ГИА Копировать ссылку РаспечататьБлагородные газы (инертные либо редкие газы) — группа химических элементов с похожими свойствами: при нормальных условиях они являются одноатомными газами. Это химические элементы, которые образуют главную подгруппу 8-й группы периодической системы Менделеева.
При обычных условиях — это газы без цвета, вкуса и запаха, плохо растворимые в воде, не возгораются при нормальных условиях, с очень низкой химической реактивностью. Их температуры плавления и кипения закономерно увеличиваются с увеличением атомного номера.
Среди всех благородных газов лишь у Rn нет стабильных изотопов и только он является радиоактивным химическим элементом.
Редкими (инертными) газами являются:
- гелий (He) (атомный номер 2),
- неон (Ne) (10),
- аргон (Ar) (18),
- криптон (Kr) (36),
- ксенон (Xe) (54)
- радиоактивный радон (Rn) (86).
В последнее время к этой группе также причисляют унуноктий (Uuo) (118).
Все инертные газы собой завершают соответствующий период в Периодической системе и имеют полностью завершенный, устойчивый внешний электронный уровень.
У инертных газов электронная конфигурация ns2np6 (у гелия 1s2) и они образуют VIIIА группу. С возрастанием порядкового номера увеличиваются радиусы атомов и их способность к поляризуемости, что приводит к увеличению межмолекулярных взаимодействий, к увеличению Тпл и Ткип, к улучшению растворимости газов в воде и других растворителях. Для инертных газов существуют такие известные группы соединений: молекулярные ионы, соединения включения, валентные соединения.
Инертные газы относятся к последней при этом они занимают первые 6 периодов и относятся к 18-й группе в периодической таблице химических элементов. Флеровий — элемент 14-й группы показывает некоторые свойства благородных газов, поэтому он способен заменить в периодической таблице унуноктий. Благородные газы неактивны химически и могут принимать участие в химических реакциях только в экстремальных условиях.
Почему благородные газы так названы?
В период открытия этих элементов для их обозначения употреблялось понятие инертные и благородные газы. Последнее понятие предложил Рамзай.
Оно образовалось по аналогии с названием металлов, входящих в группу семейства платины, которые в то время образовывали 8 группу.
На сегодняшний день 0 группа в периодической таблице расформирована, а ее представители перенаправлены в главную подгруппу 8 группы.
Согласно еще одному мнению, такое название эти элементы получили из-за того, что в обычных условиях они не образуют никаких химических соединений, не вступают в реакции с иными веществами.
Однако они не пополняют ряды «химических мертвецов», так как при создании благоприятных условий на основе этих представителей можно получить оксиды, соли.
Чаще всего таким способом получают производные ксенона, радона и криптона.
Где применяются благородные газы?
Самыми применяемыми человеком инертными газами считаются аргон, гелий и неон, которые используются повсеместно от физики до медицины. Так, гелий используется при сварке металлов и в качестве хладоносителя при проведении лабораторных экспериментов. Неон и аргон часто применяются при изготовлении ламп накаливания и в металлургии, при изготовлении алюминиевых сплавов.
Благодаря своим уникальным свойствам, благородные газы нашли свое применение в разных отраслях науки
Остальные благородные газы чаще всего используются в медицине. Как уже упоминалось выше, радон находит свое применение в медицине, а ксенон и криптон используются в качестве наполнителя осветительных ламп.
Невидимость — как и путешествие во времени, телепортация, левитация и сверхскорость — является предметом обсуждения научной фантастики с самого ее появления….
Вселенная — волшебное окно времени, позволяющее нам заглянуть в прошлое. Чем дальше мы смотрим, тем дальше назад во времени мы видим. В отличие от наших мозг…
На сегодняшний день 21% воздуха, которым мы дышим, состоит из молекулярного кислорода. Но этот газ не всегда был в таком количестве, не всегда мог поддержива…
Цвета и спектры инертных газов
Цвета и спектры благородных газов. В первой строке таблицы изображены благородные газы в колбах, через которые пропущен ток, во второй — сам газ в трубке, в третьей — в трубках, которые изображают обозначение элемента в периодической таблице Менделеева.
| Гелий | Неон | Аргон | Криптон | Ксенон |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
Распространенность инертных (редких) газов в природе
Из-за того, что инертные газы обладают химической инертностью, их довольно долго не получалось обнаружить, и их открытие состоялось лишь во 2-й половине XIX века.
Гелий – является вторым (после водорода) по распространенности элементом во Вселенной, в земной коре содержание гелия составляет лишь 1 · 10-6 масс. %. Гелий является продуктом радиоактивного распада и содержится в пустотах горных пород и в природном газе.
Все благородные газы являются составляющими воздуха. В 1 3м воздуха находится 9,3 л аргона, 18 мл неона, 5 мл гелия, 1 мл криптона и 0,09 мл ксенона. Солнце приблизительно на 10% состоит из гелия, образующийся из водорода по реакции ядерного синтеза:
(β+ — позитрон, — антинейтрино). В спектре излучения Солнца довольно интенсивно проявляются линии гелия, которые были впервые обнаружены в 1868 г. На Земле гелий был найден только в 1895 г. при спектральном анализе газов, выделяющихся при растворении в кислотах минерала клевеита U2О3. Уран, входящий в состав минерала, самопроизвольно распадается по уравнению:
238U → 234Th + 4He.
В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Промышленное использование инертных газов основано на их низкой химической активности или специфических физические свойствах.
Некоторые характеристики элементов VIIIА подгруппы (инертных газов)
| Элемент | Радиус атома, нм | Первый потенциал ионизации, эВ | Tпл., K | Tкип., K | Относительная поляризуемость атома, усл. ед. | Энергия возбужденного электрона, эВ |
| Гелий, He | 0,122 | 24,58 | – | 4,18 | 1 | – |
| Неон, Ne | 0,160 | 21,56 | 24 | 27,18 | 2 | 16,6 |
| Аргон, Ar | 0,192 | 15,76 | 34 | 97,29 | 3 | 11,5 |
| Криптон, Kr | 0,198 | 14,00 | 116 | 120,26 | 12 | 9,9 |
| Ксенон, Xe | 0,218 | 12,13 | 162 | 166,06 | 20 | 8,3 |
Уникальными физическими свойствами обладает гелий. Во первых, это — единственное из известных в природе веществ, которое остается жидким при самых низких температурах, вплоть до 0 К. Он кристаллизуется только под давлением 25 атм. Во-вторых, гелий имеет самую низкую из всех веществ температуру кипения. Наконец, самое интересное свойство гелия — сверхтекучесть. При температурах ниже 2,2 К жидкий 4Не существует в виде смеси двух жидкостей, одна из которых имеет обычные свойства, а другая — аномальные. Сверхтекучая компонента жидкого гелия имеет практически нулевую вязкость (в 10 млрд. раз меньше, чем у воды). Это вещество способно просачиваться через мельчайшие отверстия в пористом сосуде, оно самопроизвольно вытекает из непористого сосуда, поднимаясь вверх по его стенкам, и обладает сверхвысокой теплопроводностью.
Электронное строение благородных газов
| Название | Электронная конфигурация | Радиус атома, нм | Потенциал ионизации, эВ | Степени окисления |
| Гелий Не | 1s2 | 0,122 | 24,6 | |
| Неон Ne | [Не]2s22p6 | 0,160 | 21,6 | |
| Аргон Аr | [Nе]3s23p6 | 0,191 | 15,8 | |
| Криптон Кr | [Ar]3d104s24р6 | 0,198 | 14,0 | +2,+4 |
| Ксенон Хе | [Кr]4d105s25p6 | 0,209 | 12,1 | +2,+4,+6,+8 |
| Радон Rn | [Хе]4f145d106s26р6 | — | 10,8 | +2,+4,+6 |
Какие благородные газы используются для светотехники?
В большей части конструкций, характеризующихся наличием источников света, имеются инертные газообразные элементы таблицы Менделеева. Во время прохождения по их верхним слоям электрического тока, масса начинает светиться. Оттенок свечения может быть разным:
- неон обладает оранжево-красным свечением, из-за чего используется для создания световой рекламной продукции, газоразрядных лампочек;
- криптон может окраситься в зеленоватый или грязно-белесый оттенок, а при высоком напряжении дает сине-белый свет: широкое применение получил у фото-художников с целью формирования специфического освещения;
- гелий обладает синим, серым, зелено-голубым свечением, в некоторых ситуациях окрашивается в бело-оранжевый цвет: также применяется для создания освещения;
- аргон дает фиолетовый голубой оттенок;
- ксенон может давать серое, синеватое свечение: используется для фотовспышек, лампочек индикации;
- радон характеризуется синим светом: не имеет применения в газосветильных приборах из-за отсутствия стабильных изотопов.
Указанные характеристики инертных элементов таблицы Менделеева позволяют их широко применять в практических целях.
Существует множество научных исследований, дающих возможность использования веществ в медицине, строительстве, промышленности, а также художественной деятельности.
Как экономить воду по счетчику: подсказки и советы.
Как экономить воду на предприятии: советы и подсказки.
В этом видео рассказано о неоне. Не забывайте оставлять свои вопросы, пожелания и комментарии к статье.
Физические свойства
Менделеев открытие аргона расценивал как испытание периодического закона. Ведь если аргон существует, то он должен стоять на месте калия, однако это противоречило бы закону периодической повторяемости свойств элементов.
Испытание было выдержано с успехом. Открытие гелия на Земле позволило предположить наличие отдельной группы. Из-за инертности газов их выделили в нулевую группу. Рамзай был непоколебимым сторонником периодического закона Менделеева и, опираясь на него, предсказал, а потом уже открыл неон, криптон и ксенон.
Радон был обнаружен в 1900 году, как результат распада радиоактивного радия. Сам он также подвергался дальнейшему распаду. Превращаемость элементов, стала доказанным фактом и новые открытия, обусловленные развитием техники.
Инертные газы имеют следующие физические свойства:
- они не обладают ни цветом, ни запахом;
- их с трудом можно обратить в жидкое состояние;
- с возрастанием поляризуемости молекул от гелия к радону, повышается их способность растворяться в воде;
- они могут легко растворяться в органических растворителях, например, спирте или бензине;
- они способны адсорбироваться на поверхности активированного угля при низких температурах, что дает возможность проводить их очистку и разделение;
- у гелия очень высока способность проникать в другие химические элементы, он может просачиваться сквозь стенки различных сосудов (стеклянных, пластмассовых и некоторых металлических).
При помощи масс-спектрографа у всех инертных газов обнаружены изотопы. В природе у гелия наименьшее количество стабильных изотопов — 2, у ксенона — наибольшее 9. У радона стабильных изотопов не обнаружено.
Строение атомов
Причина инертности благородных газов в строении атомов. Исследования показали, что у них максимально заполненные энергетические уровни. Гелий обозначается как 1s2 элемент. Он имеет самую прочную структуру атома среди всех химических элементов.
Остальные благородные газы — это p элементы. Электронное строение атома определяет многие свойства этих газов. Их молекулы одноатомные. У них низкая энергия сродства к электрону.
Завершенность внешнего энергетического уровня обусловливает диамагнитность благородных газов. Высокие потенциалы ионизации, также прямое следствие замкнутости и устойчивости электронных оболочек атомов.
С ростом порядкового номера элемента его потенциал ионизации уменьшается. При сравнении видно, что начиная с криптона, у инертных газов ионизационный потенциал уже ниже, чем у кислорода и фтора. Это обусловливает возможность взаимодействия этих элементов.
Опровержение теории химической инертности
По плотности они делятся на легкие: гелий и неон и тяжелые — все остальные. Гелий самый легкий газ в природе, он легче воздуха в 7 раз. Аргон открывает группу тяжелых газов. Жидкий аргон тяжелее не только воздуха, но и воды.
С увеличением поляризуемости от гелия к радону, увеличиваются радиусы атомов, а также возрастает растворимость в воде и абсорбируемость. Газообразный гелий с трудом можно собрать в закрытый сосуд. Аргон, по сравнению с гелием, уже более вязкий. Его можно перелить из сосуда в сосуд. С увеличением атомной массы и радиуса атома у газов уменьшается теплопроводность, повышается температура кипения. Кроме того, увеличивается возможность деформации внешних электронных слоёв, а значит создается предпосылка химической связи.
Для сжижения благородных газов нужны сверхнизкие температуры, особенно для гелия. У жидкого гелия обнаружено уникальное свойство — сверхтекучесть.
Это подтверждается простым опытом. Если погрузить пробирку в сосуд с жидким гелием, то жидкость будет ползти вверх по наружной стенке пробирки и опускаться по внутренней. Если пробирку приподнять, то гелий начинает двигаться в обратную сторону, выравнивая уровни. Когда пробирку вынимают, то гелий продолжает стекать по ней и капать вниз.
Это свойство у гелия открыл советский физик, академик Петр Леонидович Капица. В 1962 году канадский химик Нил Бартлетт, наконец, опроверг теорию химической инертности благородных газов. Ему удалось в процессе гетерогенного катализа синтезировать соединение ксенона с гексафторидом платины (Xe+PtF6=Xe (PtF6)x).
Событие это было также сенсационно, как заявление Рамзая об инертности аргона. Это позволило инертным газам покинуть нулевую группу. Инертные газы в таблице Менделеева справедливо заняли свое место в восьмой группе.
Правда, еще до открытия Бартлетта были получены клатратные соединения тяжелых инертных газов. При относительно высоких давлениях молекулы газов, в этом случае криптона, плотно окружаются молекулами гидрохинона и включаются в них.
В клатратных соединениях связь молекулярная, валентные электроны в них не взаимодействуют. Клатраты нестойкие соединения, в растворах они быстро распадаются на составные части. Их можно использовать как удобные формы для хранения благородных газов.
Благородные, или инертные газы: свойства и применение
Инертные газы — группа элементов в таблице Менделеева, обладающих однотипными свойствами. Все эти вещества — одноатомные газы, с большим трудом взаимодействующие с другими веществами. Это объясняется тем, что их внешние атомные оболочки полностью «укомплектованы» (кроме гелия) восемью электронами и являются энергетически стабильными.
Эти газы еще называют благородными или редкими. В группу входят: гелий, неон, аргон, криптон, ксенон и радиоактивный радон. Некоторые исследователи сюда же относят и новый элемент оганессон.
Впрочем, он еще мало изучен, а теоретический анализ структуры атома предсказывает высокую вероятность того, что этот элемент будет твердым, а не газообразным.
На нашей планете благородные газы преимущественно содержатся в воздухе, но они есть в небольших количествах в воде, горных породах, природных газах и нефти.
Много гелия в космическом пространстве, это второй по распространенности элемент после водорода. В Солнце его почти 10%. Судя по имеющимся данным, благородных газов много в атмосферах крупных планет Солнечной системы.
Все газы, кроме гелия и радона, добывают из сжиженного воздуха фракционным разделением. Гелий получают как сопутствующий продукт при добыче природного газа.
Свойства
Газы без цвета, запаха и вкуса. Они всегда есть в атмосферном воздухе, но их невозможно увидеть или почувствовать. Плохо растворяются в воде. Не горят и не поддерживают горение.
Плохо проводят тепло. Хорошо проводят ток и при этом светятся. Практически не реагируют с металлами, кислородом, кислотами, щелочами, органическими веществами.
Химическая активность растет по мере увеличения атомной массы.
Гелий и неон вступают в реакции только при определенных, как правило, очень сложных условиях; для ксенона, криптона и радона удалось создать достаточно «мягкие» условия, при которых они реагируют, например, со фтором.
В настоящее время химики получили несколько сотен соединений ксенона, криптона, радона: оксиды, кислоты, соли. Большая часть соединений ксенона и криптона получают из их фторидов. Скажем, чтобы получить ксенонат калия, сначала растворяют фторид ксенона в воде.
К полученной кислоте добавляют гидроокись калия и тогда уже получают искомую соль ксенона. Аналогично получают ксенонаты бария и натрия.
Инертные газы не ядовиты, но способны вытеснять кислород из воздуха, понижая его концентрацию до смертельно низкого уровня.
Смеси тяжелых благородных газов с кислородом оказывают на человека наркотическое воздействие, поэтому при работе с ними следует использовать средства защиты и строго следить за составом воздуха в помещении.
Хранят газы в баллонах, вдали от источников пламени и горючих материалов, в хорошо проветриваемых помещениях. При транспортировке баллоны следует хорошо укрепить, чтобы они не бились друг о друга.
Применение
- В газовой и газово-дуговой сварке в металлургии, строительстве, автостроении, машиностроении, коммунальной сфере и пр. Для получения сверхчистых металлов.
- Нерадиоактивные благородные газы применяются в цветных газоразрядных трубках, часто используемых в уличных вывесках и рекламе, а также в лампах дневного света и лампах для загара.
Гелий
- Жидкий гелий — самая холодная жидкость на планете (кипит при +4,2 °К), востребована для исследований при сверхнизких температурах, для создания эффекта сверхпроводимости в электромагнитах, например, ядерных ускорителей, аппаратов МРТ (магнитно-резонансной томографии).
- Гелий-газ применяют в смесях для дыхания в аквалангах. Он не вызывает наркотического отравления на больших глубинах и кессонной болезни при подъеме на поверхность.
- Так как он значительно легче воздуха, им заполняют дирижабли, воздушные шары, зонды. К тому же он не горит и гораздо безопаснее ранее использовавшегося водорода.
- Гелий отличается высокой проницаемостью — на этом свойстве основаны приборы поиска течи в системах, работающих при низком или высоком давлении.
- Смесь гелия с кислородом применяется в медицине для лечения болезней органов дыхания.
Неон
- Применяется в радиолампах. Смесь неона и гелия — рабочая среда в газовых лазерах.
- Жидкий неон используется для охлаждения, он обладает в 40 раз лучшими охлаждающими свойствами, чем жидкий гелий, и в три раза лучшими, чем жидкий водород.
Аргон
- Аргон широко применяется из-за своей низкой стоимости. Его используют для создания инертной атмосферы при манипуляциях с цветными, щелочными металлами, жидкой сталью; в люминесцентных и электрических лампах. Аргоновая сварка стала новым словом в технологии резки и сварки тугоплавких металлов.
- Считается лучшим вариантом для заполнения гидрокостюмов.
- Радиоактивный изотоп аргона применяется для проверки систем вентиляции.
Криптон и ксенон
- Криптон (как и аргон) обладает очень низкой теплопроводностью, из-за чего используется для заполнения стеклопакетов.
- Криптоном заполняют криптоновые лампы, используют в лазерах.
- Ксеноном заполняют ксеноновые лампы для прожекторов и кинопроекторов. Его используют в рентгеноскопии головного мозга и кишечника.
- Соединения ксенона и криптона со фтором являются сильными окислителями.
Радон
- Применяется в научных целях; в медицине, металлургии.
Свойства благородных газов
Физические свойства благородных газов приведены в табл. 17.
Физические свойства благородных газов. Таблица 17
| Температура плавления, °С | ||||
| Гелий Не
Неон Ne Аргон Аr Криптон Кr Ксенон Хе Радон Rn |
4,026
20,179 38,948 83,80 131,3 222 |
0,17848
0,899 1,7837 3,736 5,851 9,96 |
—268,9
—245,9 — 185,87 —153,2 —107,1 —65 |
—272,6
—248,6 —189,3 —156,6 —111,8 —71 |
Благородные газы не имеют запаха, вкуса, бесцветны во всех агрегатных состояниях. Из всех благородных газов уникальными свойствами обладает гелий.
Он в 7 раз легче воздуха, особенно трудно сжижается, крайне мало растворим в воде (в 100 объемах воды при нормальных условиях растворяется 1 объем гелия). В жидком состоянии гелий обладает сверхпроводимостью и сверхтекучестью.
Растворимость остальных газов повышается с возрастанием атомного веса и у радона достигает 50 объемов в 100 объемах воды. Остальные благородные газы также хорошо проводят электрический ток.
О химических свойствах благородных газов уже говорилось выше (§90). Наиболее полно изучены химические свойства ксенона, его фториды, оксиды и соединения с металлами платиновой группы.
Однако есть данные о соединениях криптона и радона.
Следует заметить, что благородные газы имеют очень характерные спектры.
Это позволяет легко обнаруживать их и различать между собой, что и используется для их аналитического определения.
Применение и получение благородных газов
Применение благородных газов связано с особенностью их свойств. Легкость и негорючесть гелия позволили использовать его первоначально в воздухоплавании при строительстве дирижаблей.
Низкая растворимость его в воде привела к использованию этого газа для изготовления газовой смеси для дыхания при кессонных и водолазных работах.
Широко применяются благородные газы в светотехнике. В газосветных разрядных лампах они светятся разными цветами: неон — розовым, аргон — синим, криптон — зеленым.
Это позволяет использовать их в световых рекламах, а неон — и на маяках. Наполняемые аргоном электрические лампочки накаливания долговечнее, чем наполняемые азотом. При заполнении ламп криптоном или ксеноном возрастает светоотдача, а колбы таких ламп можно делать значительно меньше.
В люминесцентные лампы также добавляют немного аргона или криптона для лучшей их работы. Благородные газы используются и в телевизионной аппаратуре.
В связи с химической инертностью благородные газы, главным образом аргон и гелий, используют для работы в их атмосфере с некоторыми металлами, к которым предъявляются требования особой чистоты и точности обработки.
Гелий имеет очень большое значение для получения сверхнизких температур.
Ксенон и радон нашли применение в медицине: ксенон — при рентгеноскопии головного мозга, радон — в физиотерапии (радоновые ванны).
Смесь криптона с кислородом оказывает наркотизирующее действие.
Применение благородных газов
Имеется 3 цилиндра. В одном из них находится кислород, в другом — азот, в третьем — аргон. Как распознать, в каком цилиндре какой газ? Каким реактивом при этом следует воспользоваться? Подтвердите свой ответ уравнениями реакций.
Благородные газы — неон, аргон, криптон и ксенон — получают из воздуха.
Для их полной очистки от примесей азота пользуются многократной фракционной перегонкой, пропусканием при нагревании над металлическим литием и пылевидным титаном. Разделение смеси благородных газов можно произвести при помощи активированного угля. Чем больше атомный вес газа, тем выше его поглощаемость углем.
Благородные газы содержатся в небольших количествах в земной атмосфере.
Больше всего (0,9% по объему) в ней содержится аргона. Аргон поступает в атмосферу из земной коры при радиоактивном распаде изотопа калия 40 К. Гелий встречается в составе залежей природных газов или впитывается рыхлыми горными породами, из которых его можно извлекать. Огромное количество гелия обнаружено на солнце.
Он и открыт был именно при спектроскопическом исследовании солнечного света. Радон встречается в воде минеральных источников в растворенном виде (Цхалтубо).
Преимущества
Разобравшись, что значит инертный газ, стоит понять, почему именно он так популярен в данной области. Это обусловлено рядом преимуществ, которые основаны на его свойствах. Естественно, что у каждого из них могут быть свои особенности, но в целом можно выделить следующие положительные моменты:
- Вещество практически не вступает в реакцию с металлами, с которыми ведется работа, кислородом, окружающей средой и так далее;
- Газы дают достаточно высокую температуру при сваривании, что обеспечивает проварку на большую глубину металла;
- Есть возможность регулировать сварочное пламя, его соотношение с кислородом для получения нужных параметров;
- Хранение и перевозка в сжиженном состоянии или под большим давлением, оказывается выгодным делом за счет компактности;
- Добыча некоторых газов может осуществляться непосредственно на рабочем месте благодаря специальным установкам генераторам.
Недостатки
Тем не менее, хоть для этой области газы и являются одним из наиболее качественных решений, их использование имеет определенные недостатки, среди которых основными являются следующие:
- Хранение и перевозка баллонов с газами является достаточно сложным делом, так как есть риск взрыва;
- Большинство веществ такого рода вызывают удушье, когда их концентрация в окружающем воздухе доходит до определенного значения;
- Некоторые из газов очень вредны для органов дыхания и могут вызывать профессиональные болезни за относительно короткий период времени, поэтому, обязательно нужно использовать индивидуальные средства защиты;
- Ацетилен и другие газы подобного рода могут иметь высокую стоимость, что делает процесс сварки более дорогостоящим.
Виды инертных газов
Аргон – не ядовитый, не имеет запаха и цвета. Он тяжелее воздуха почти в 1,5 раза. Газ не растворяется в металлах, как в твердом, так и в жидком состоянии. Для промышленности выпускается в виде высшего и первого сорта. Высший сорт содержит 99,993% чистого вещества и применяется при сваривании ответственных соединений. Первый сорт содержит 99,98% чистого вещества. В качестве добавок имеется азот и кислород. Хорошо подходит для сварки алюминия.
Аргон в баллонах
Гелий – не ядовитый, не имеет запаха и цвета. Он легче воздуха. Вещество выпускают по ГОСТ 20461-75. Это может быть технический газ чистотой 99,8% и сорт высшей чистоты 99,985%. В сварке используется не так часто, как аргон, так как он более дорогой и дефицитный. Он почти в 2 раза эффективнее, так как дуга выделяет с ним больше энергии и обеспечивается лучшая защита и более глубокая проварка. Основной сферой использования является сварка активных и химически чистых материалов на основе магния и алюминия.
Гелий в баллонах
Азот – не ядовитый, не имеет запаха и цвета. Применяется для сварки меди и сплавов из этого металла. Выпускается по ГОСТ 9293-74 и согласно данному стандарту выделяют 4 основных сорта. В высшем содержится 99,9% чистого материала, в первом – 99,5%, во втором – 99%, и в третьем – 97%.
Азот в баллонах
Инструкция по применению
При использовании инертных газов они в первую очередь пускаются в горелку, чтобы проверить ее работоспособность. Только после этого можно добавлять кислород. Пламя может использоваться для предварительного подогрева и постепенного остывания, а не только для сварки. При начале сваривания нужно выставить параметры соотношения газов и их подачу в нужный режим.
Важно!
Перед началом работ всегда нужно проверять все шланги на целостность, чтобы газ не выходил из них.
Меры безопасности
- Баллоны с газом должны находиться на расстоянии от 5 метров от источника пламени и легковоспламеняющихся веществ;
- Поблизости не должно быть масляных пятен;
- Во время работы баллоны должны быть надежно закреплены;
- Нужно всегда следить за состоянием загазованности помещения, чтобы не возникло удушья.
Хранение и транспортировка
Транспортировка должна проводиться на транспортном средстве с рессорами. Баллоны должны быть закреплены, чтобы исключить их удары друг о друга и падения. Хранение должно проводиться в проветриваемом помещении.