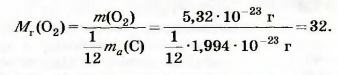There are many known compounds and molecules. The compounds made up only of ions are called ionic compounds. The concept of the formula unit of ionic compounds and the formula mass helps find the atomic masses of the ionic compounds. The formula mass is then calculated in the same way in which the molecular mass is calculated. Since the electrons that transform an atom into an ion have negligible mass, the atomic mass of an atom and its ion is identical. Since the formula for an ionic compound does not describe the composition of a discrete molecule, the term “molecular mass” may not be appropriate.
What Are Ionic Compounds?
Ionic compounds are those that are made up entirely of ions. The strong electrostatic forces of attraction hold the positively charged ions known as cations and negatively charged ions known as anions together in an ionic compound.
Ionic bonds, also known as electrovalent bonds, are the forces that hold the ions in an ionic molecule together. The overall charge of an ionic compound is zero because it is made up of an equal number of positive and negative ions.
For example- Potassium chloride is an ionic compound composed of an equal amount of positively charged potassium ions (K+) and negatively charged chloride ions (Cl–).
Some of the common ionic compounds, their formulae, and the ions present in them are shown in the following table.
|
Name |
Formulae |
Ions present |
|
Sodium chloride |
NaCl |
Na+ and Cl– |
|
Ammonium chloride |
NH4Cl |
NH4+ and Cl– |
|
Magnesium chloride |
MgCl2 |
Mg2+ and Cl– |
|
Potassium chloride |
KCl |
K+ and Cl– |
|
Calcium chloride |
CaCl2 |
Ca2+ and Cl– |
|
Magnesium oxide |
MgO |
Mg2+ and O2- |
|
Calcium oxide |
CaO |
Ca2+ and O2- |
|
Aluminium oxide |
Al2O3 |
Al3+ and O2- |
What is the Formula Unit of Ionic Compounds?
An ionic compound is made up of a large number of positively and negatively charged ions that have been bonded together. Since sodium chloride is an ionic compound containing a large but equal amount of sodium ions (Na) and chloride ions (Cl), the actual formulae of sodium chloride compound should be (Na+)n(Cl–)n or (Na+Cl–)n, where n is a very large number. The simplest formula for sodium chloride is NaCl, which is not the actual formula.
A formula unit of ionic compounds is the simplest combination of ions that produces an electrically neutral unit. An ionic compound’s formula unit can be considered as the smallest unit of that compound, it is equivalent to a molecule of that compound.
For example:
- NaCl is the formula unit for sodium chloride, which is made up of one Na+ ion and one Cl– ion.
- (NH4)2SO4 is the formula unit for ammonium sulphate. There are two NH4+ ions and one SO42- ion in it.
- Calcium nitrate has the formula Ca(NO3)2. It consists of one Ca2+ ion and two NO3– ions.
What is Formula Mass?
Since ionic compounds are not made up of molecules, using the term ‘molecular mass’ for them is inaccurate. As a result, we refer to ionic compounds that lack individual molecules as ‘formula mass.’
The formula mass of an ionic compound is the sum of the atomic masses of the atoms or ions represented by its formula in comparison to the mass of a carbon-12 atom taken as 12 units, i.e., the formula mass is the sum of the atomic masses of the atoms or ions represented by its formula.
The sum of the atomic weights of the atoms in the empirical formula of the compound is the formula mass, also known as formula weight. The mass is expressed in atomic mass units (amu) or (u). Ionic compounds are made up of discrete cations and anions that are mixed in specific ratios to produce electrically neutral bulk matter. To determine the formula mass of an ionic compound, we need to know the ionic compound’s formula as well as the atomic masses of all the atoms or ions in the formula.
For example- Consider the chemical name for typical table salt, sodium chloride, or NaCl. The ionic compound sodium chloride is made up of sodium cations, Na+, and chloride anions, Cl–, in a 1:1 ratio. Since Na has an atomic mass of 23 u and Cl has an atomic mass of 35.5 u, the formula mass for NaCl is 23+35.5=58.5 u. This calculation used the average masses of neutral sodium and chlorine atoms rather than the masses of sodium cations and chloride anions. When computing the formula mass of an ionic compound, this method is completely appropriate. Even though a sodium cation has a slightly lower mass than a sodium atom (due to the absence of an electron), the fact that a chloride anion is slightly more massive than a chlorine atom will compensate for this discrepancy (due to the extra electron).
Furthermore, in comparison to the mass of a normal atom, the mass of an electron is negligibly small. Even when calculating the mass of an isolated ion, the missing or extra electrons can usually be ignored because their contribution to the overall mass is insignificant, represented only in the non-significant digits that will be lost when the computed mass is properly rounded. Very light ions produced from elements with precisely determined atomic masses are the only exceptions to this rule.
Solved Questions
Question 1: Write the name of the given compound Al2(SO4)3. Also, mention the ions present in it
Answer:
The given compound is called aluminium sulphate. The ions present in it are Al3+ and SO42-.
Question 2: Calculate the formula mass of potassium carbonate K2CO3. Given atomic masses K=39u, C=12u and O=16u.
Answer:
Formulas mass of K2CO3 = Mass of 2 K atoms + Mass of 1 C atom + Mass of 3 O atoms
=2×(39) + 12 + 3×(16)
=78 + 12 + 48
=138 u
So the formula mass of potassium carbonate is 138 u.
Question 3: What is the relationship between the mass of an atom and the formula mass?
Answer:
The formula mass is the sum of the atomic masses of the atoms in the formula.
Question 4: Calculate the formula mass of sodium oxide Na2O. Given atomic masses N=23u, and O=16u.
Answer:
Formulas mass of Na2O = Mass of 2 Na atoms + Mass of 1 O atoms
= 2 × (23) + 16
= 46 + 16
= 62 u
So the formula mass of sodium oxide is 62 u.
Question 5: The ions present in the compound are K+ and NO3–. Write the name and the formula of the compound represented by the given ions.
Answer:
The ions present are, one ion of potassium (K+) and one ion of nitrate (NO3–). So, the formula becomes KNO3 and its name is potassium nitrate.
Question 6: Why does the chloride ion have a negative charge (Cl–)?
Answer:
Since it has more electrons than a neutral atom, so the chloride ion has a negative charge.
Last Updated :
29 Oct, 2021
Like Article
Save Article
Вычисление масс ионов
По этой ссылке вы найдёте полный курс лекций по математике:
Пример !. Вычислить массу ионов К+ и SOT», содержа-щихся в 1,20 4 2М раствора сульфата калия KjSO*. Решение. Концентрация ионов в растворе равна произведению молярности раствора на степень диссоциации электролита и на число ионов, получаемых при диссоциации молекулы. В математической форме это можно выразить так: где п — число ионов, получаемых при диссоциации одной молекулы. Уравнение диссоциации: KaS04 = 2К+ + SOJ-
Сульфат калия относится к сильным электролитам, диссоциирующим в водном растворе почти полностью. Поэтому степень диссоциации его можно принять равной 1. В соответствии с этим Ск+ = 2М • 2 = 4М; Cso,«- = = 2М . 1 2М- |1К+ = 39 г/ион; psot— = 96 г/ион. Отсюда г/ион • 4 г-ион/л . 1,20 л 155 г т$о- « 96 е/г-ион • 2 г-ион/л • 1,20 л =» 225,2 г Пример 2. Степень диссоциации Н£Оз по первой ступени равна 1%. Вычислить массу ионов Н+ и НСО~ в 2 л 0,006М раствора. Решение.
Вычисление масс ионов цнсо,- =» 61 г/е-ион; тном ртяш.
Возможно вам будут полезны данные страницы:
См • * • п mH+ = 1 г/г-ион • 0,006 е-ион1л • 0,01. 2 л = = 0,00012 г = 12 . 10-* г тнсо-« 61 г/г-ион — 0,006 гчюн/л • 0,01 • 2 л — = 0,00732 г — 7,32 • 10-3 г Вычисление количества ионов, содержащихся в данном объеме раствора. Грамм-ион содержит такое же число ионов, как грамм-молекула-—молекул и грамм-атом — атомов, т. е. 6,02 • 104
Пример. В 1 м9 воды внесли каплю 0,Ш раствора хлорида магния. Определить, сколько ионов оказалось в капле полученного раствора. Принять, что в 1 мл содержится 30 капель. Решение. Сколько молей хлорида магния MgQs содержалось в 1 мл 0,Ш раствора: Сколько молей хлорида магния MgQa содержалось в 1 капле 0,1 М раствора:
Сколько молекул хлорида магния
содержалось в 1 капле 0,1 М раствора: = 6,02 • 10» • 3,33 . 10-« « 20 • 10»’ молекул Сколько молекул хлорида магния содержалось в 1 мл разбавленного раствора: tj= 90[Jf ~ 20, 10″ молекул Сколько молекул содержалось в 1 капле разбавленного раствора: Вычисление масс ионов Сколько ионов Mg®+ и С1- содержалось в 1 капле разбавленного раствора. Так как из одной молекулы хлорида магния MgCla получаются 1 ион Mg*+ и 2 иона С1~, то ионов Mg*+ будет столько же, сколько молекул MgCl,, а ионов Q-в 2 раза больше:
Как найти массу иона?
Формулу).
Вопрос Как найти массу иона?, расположенный на этой странице сайта, относится к
категории Химия и соответствует программе для 5 — 9 классов. Если
ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска
похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему.
Для этого ключевые фразы введите в строку поиска, нажав на кнопку,
расположенную вверху страницы. Воспользуйтесь также подсказками посетителей,
оставившими комментарии под вопросом.
Из
сказанного в предыдущих параграфах
следует прежде всего, что заряды, несомые
положительными и отрицательными ионами,
будучи обратными по знаку, должны
быть тождественными по абсолютной
величине, так как они образуются, вообще
говоря, путем расщепления нейтральных
молекул вещества. Первые количественные
определения величин, позволяющих судить
о массе ионов различных категорий,
были произведены Дж. Дж. Томсоном и В.
Вииом, а первые приближенные определения
заряда иона были выполнены Дж. Дж.
Томсоном.
Основные
серии исследований были посвящены
определению отношения заряда иона е
к его массеm. В одном
из методов, примененных Дж. Дж. Томсоном
в 1897 году, он оперировал с так называемымикатодными лучами, открытыми Круксом
и состоящими из потока каких-то весьма
своеобразных частиц, несущих отрицательные
заряды. Как известно, катодные лучи были
наблюдены Круксом в очень ясно
выраженной форме внутри стеклянного
сосуда с весьма разреженным пространством,
в котором были расположены два электрода:
плоский или слегка вогнутый катод и
какой-либо анод. При достаточно высокой
разности потенциалов между этими
электродами с поверхности отрицательного
электрода, приблизительно перпендикулярно
ей, исходят вышеупомянутые катодные
лучи, обладающие целым рядом особых
свойств. Пучок катодных лучей отклоняется
действием поперечного магнитного поля,
что можно обнаружить, пользуясь либо
флюоресценцией остатков газа в
трубке, либо флюоресценцией специального
экрана, на который падают лучи. Такое
же отклонение можно получить, пропуская
катодные лучи и между пластинками
конденсатора, распо-
256
ложенными
внутри трубки и заряжаемыми от некоторого
постоянного источника. В обоих случаях
направление отклонения точно соответствует
отрицательной электризации частиц,
образующих катодные лучи. Подобные
наблюдения можно произвести, например,
при помощи трубки с очень разреженным
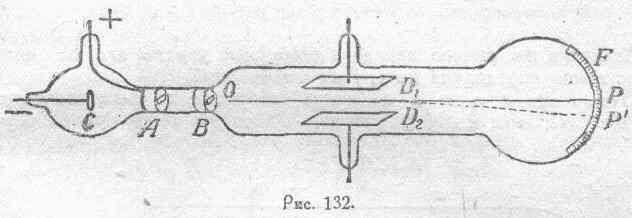
газом, представленной на рисунке 132.
Здесь
С есть катод, А — анод со щелью
порядка 2 — 3 миллиметров,В —
металлический диск, соединенный с
землей и имеющий щель около одного
миллиметра шириною,D1
иD2 — пластины
конденсатора,F —
флюоресцирующий экран, нанесенный
на внутренней поверхности стеклянной
трубки. Катодные лучи, исходящие с
поверхности катода С, проходят через
щели вА иВ в направленииОР
и дают на экране светящийся следР.
Представим себе теперь, что трубка
расположена в однородном магнитном
поле, перпендикулярном плоскости рисунка
132, т. е. перпендикулярно ОP.
Катодный пучок при этом из прямолинейного
превратится в искривленный(ОР’) по
дуге круга, радиус которого будет
зависеть от магнитной индукцииВ, от
зарядае частиц, образующих катодные
лучи, от их массыт и от их скоростиv. Действительно,
радиус кривизны траектории иона будет
определяться условием равенства по
абсолютной величине центробежной силы,
с одной стороны, и силы, отклоняющей
частицу к центру кривизны, с другой
стороны. Центробежная сила будетmv2/r.
Отклоняющая частицу
сила
будет равна произведению из магнитной
индукции В и величиныev,
представляющей собою не что иное, как
меру силы тока, обусловливаемого
движением зарядае со скоростьюv
(угол между направлением вектораВ
равен в данном случае 90°). Следовательно,
можем написать:
mv2/r=Bev.
С
другой стороны, сообщая пластинам D1
и D2
некоторую разность потенциалов,
мы можем вызвать отклонение катодного
пучка и путем воздействия поперечным
электрическим полем на движущиеся
заряженные элементы пучка. Обозначая
электрическую силу между пластинамиD1 иD2
черезЕ, мы можем механическую
силу этого воздействия на каждую
отдельную частицу выразить черезЕе.
При этом знак разности потенциалов
между пластинамиD1иd2
257
может быть
взят такой, чтобы отклоняющие действия
на катодный пучок со стороны электрического
и магнитного полей были противоположны
друг другу. Установив некоторое
определенное значе-ни5 электрической
силы Е, будем затем изменять
соответствующим образом магнитную
индукциюВ и таким путем можем
добиться уничтожения отклонения
катодного пучка, о чем можно судить по
возвращении флюоресцирующего следа
пучка в точкуР. Когда это будет
достигнуто, мы будем иметь право написать:
Ее=Веv.
Принимая
в внимание значение В, таким образом
подобранное, и комбинируя полученные
два соотношения, мы получаем:
Величина
же самого заряда е была, как увидим
дальше, непосредственно определена
из других наблюдений.
Отношение
е кm и величина
скоростиv были
получены Дж. Дж. Томсоном и другим
методом, в котором, между прочим,
определялась по способу Перрена величина
количества отрицательного электричества,
несомого некоторой порцией катодного
потока (рис. 133).
Именно
на пути катодного пучка, исходящего из
отрицательного электрода С,
располагается пустотелый металлический
цилиндр В с отверстием в днище,
обращенном к электроду С. Этот цилиндрВ весьма тщательно изолирован и для
предотвращения всякого рода влияний
электрического характера помещен внутри
охранной металлической камерыА,
играющей в то же время роль анода.
ЦилиндрВ присоединяется к специально
градуированному электрометру, при
помощи которого можно измерять
электрический заряд, приобретаемый
цилиндром. Как показал Перрен, катодный
пучок, попадая внутрь цилиндраВ,
заряжает его отрицательным
электричеством, причем величина этого
заряда при данных неизменных условиях
строго пропорциональна времени, в
течение которого катодный пучок
действует. Производя опыт в течение
неко-
258
торого
определенного промежутка времени, Дж.
Дж. Томсон измерил заряд Q,
приобретенный за это время цилиндромВ. Обозначая черезN число
носителей отрицательного электричества,
вошедших внутрь цилиндраВ, получаем:
Ne=Q.
Затем
Дж. Дж. Томсон измерил количество
кинетической энергии, которою обладают
эти N частиц, заставляя тот же катодный
пучок в такой же промежуток времени
падать на специально изготовленную
термопару, располагаемую для этого на
пути катодного пучка, вместо цилиндраВ, и проградуированную, как калориметр.
Обозначая черезW
количество энергии, приобретаемой
калориметрической термопарой
вследствие бомбардировки ееNчастицами, обладающими массойm
каждая и несущимися со скоростьюv,
и допуская, что кинетическая энергия
каждой частицы целиком превращается
в тепло при ударе о поверхность термопары,
получаем второе соотношение:
,
1/2Nmv2=M.
Производя,
наконец, описанный выше опыт с отклонением
катодного пучка магнитным полем,
присоединяем третье соотношение:
mv2/r=Bev.
Из
этих трех соотношений получается:
Таким
образом, Дж. Дж. Томсон мог различными
способами определить отношение заряда
к массе и скорость частиц, из которых
состоит катодный пучок. Величина скорости
v в широких пределах
зависит от разности потенциалов,
приложенной к электродам трубки. В
условиях работы Дж. Дж. Томсона при
напряжениях, доходивших до 10000 вольт и
несколько выше,v
доходило до 3,6•109сантиметра в
секунду, т. е. до величины, несколько
превышавшей одну десятую скорости
света. Что касается величины отношенияe/m,
то совершенно независимо от всяких
привходящих обстоятельств (напряжения,
природы газа в трубке, вещества
отрицательного электрода и т. д.), это
отношение оказывается неизменно одного
и того же порядка. Дж. Дж. Томсон получал
в описанных опытах:
e/m=около
107в абс. эл.-магн. единицах.
259
В
настоящее время мы знаем, на основании
результатов позднейших, более
совершенных экспериментов, что более
точное значение этого отношения
должно быть:
e/m=1,76•107в абс. эл.-магн. единицах.
Указанное
небольшое расхождение, объясняемое
целым рядом источников ошибок в
первоначальных опытах, не имеет, однако,
никакого существенного значения при
обосновании тех чрезвычайно важных
и принципиальных выводов, к которым Дж.
Дж. Томсон пришел, анализируя полученные
им результаты. В этом отношении
необходимо знать лишь порядок величины
— , и его-то Дж. Дж. Томсон определил в
достаточной степени точно, а затем
сопоставил полученное значение с
тем, что получается для отношения заряда
к массе в случае обычных материальных
ионов. Он подсчитал, что в случае
самого легкого иона, с которым мы имеем
дело при прохождении тока через
электролиты, именно в случае водородного
иона, интересующее нас отношение будет
около 104(более точная его величина
равна 0,96•104). Как мы увидим дальше,
Дж. Дж. Томсон показал, что величина
заряда элементов катодного пучка и
электролитических ионов должна быть
признана одной и той же. Из этого он
вывел заключение, что масса частицы
катодного потока во много раз (более,
чем в тысячу раз) легче самого легкого
атома, атома водорода. В настоящее время
мы знаем, что масса атома водорода
приблизительно в 1840 раз больше массыэлектрона, каковое название,
предложенное Джонстоном Стонеем,
окончательно утвердилось в науке для
обозначения тех носителей отрицательного
электричества, с которыми мы встречаемся,
вообще говоря, всегда в случае прохождения
тока через газы и пустоту. Величайшая
заслуга Дж. Дж. Томсона состоит именно
в том, что он первый установил основные
физические характеристики легчайших
материальных частиц, являющихся
носителями наименьшего электрического
заряда, с которым мы встречаемся на
опыте. Эти легчайшие частицы, масса
которых в 1840 раз меньше массы атома
водорода, мы теперь с полным основанием
рассматриваем какатомы электричества.
Тщательное теоретическое и
экспериментальное изучение вопроса
о массе электрона показывает, что она
не постоянна, но оказывается функцией
скорости. Обозначая массу электрона,
двигающегося медленно сравнительно со
скоростью света, черезm0,
можно на основании новейших опытов
принять:
m0=8,95•10-28грамма. Вводя далее обозначение
k=v/c,
260
где
v есть скорость
движения электрона, ас — скорость
света, можно теоретически обосновать
следующее выражение для массы электрона,
двигающегося со скоростьюv:
В
связи с этим возникло представление об
электромагнитной природе массы
электрона.
Представляет
большой интерес сопоставление значений
— для электрона и для положительных
газовых ионов, и с этою целью можно
воспользоваться результатами опытов
В. Вина, который определял это отношение
в случае положительных ионов, образующих
так называемыезакатодные лучи, впервые
наблюденные Гольдштейном. Если
электрический разряд происходит между
некоторыми анодом и катодом в сильно
разреженном газе и при этом катод состоит
из металлической пластинки с большим
числом небольших отверстий, то позади
катода, т. е. со стороны, противоположной
аноду, наблюдаются очень слабо светящиеся
пучки, проникающие сквозь отверстия
и вызывающие заметную флюоресценцию
стекла в месте их падения на стенки
сосуда. Вин показал, во-первых, что
закатодные лучи Гольдштейна состоят
из положительно заряженных ионов,
которые приобрели очень большие скорости
в электрическом поле по другую сторону
катода и благодаря этому оказались
способными, так сказать, проскочить по
инерции сквозь отверстия. Воздействуя
на пучок закатодных лучей электрическим
и магнитным полем и пользуясь тем же
методом, который был выше описан
применительно к катодным лучам, Вин
мог
определить величину — для закатодных
лучей и получил: e/m=около
300 в абс. эл.-магн. единицах,
v
— около 3•107сантиметров в
секунду.
Итак,
скорость оказалась раз в 100 меньше
скоростей, наблюдаемых для электронов
в условиях аналогичных электрических
полей. Так как, далее, нет сомнения в
том, что заряды, несомые как положительными,
так и отрицательными ионами в газах
должны быть тождественными, то, очевидно,
масса положительных ионов в опытах Вина
оказалась приблизительно в 30000 раз
больше массы электрона. Для справки
можем указать, что для железа при
электролизе растворов солей железа
получается
e/m=около
400.
Другими
словами, положительные газовые ионы
обладают массами того же порядке,
что и тяжелые электролитические ионы,
т. е. они представляют собою те или иные,
иногда очень тяжелые комбинации обычных
атомов и молекул вещества.
261
Переходя
теперь к вопросу о зарядах, несомых
газовыми ионами, остановимся сначала
на работах Дж. Дж. Томсона, который был
первым, определившим заряд электрона.
Он воспользовался свойством водяных
паров сгущаться вокруг ионов и образовывать
капельки тумана. Свойство это было
открыто Вильсоном, показавшим, что
в случае адиабатического расширения
насыщенного водяного пара в присутствии
газовых конов возникает туман и при
меньшей степени расширения, чем это
требуется, если воздух совершенно не
содержит ионов. Вильсон установил, что
в воздухе, очищенном от пыли и свободном
от ионизации, насыщенный водяной пар
дает туман только тогда, когда внезапное
увеличение объема газа будет не менее,
чем в 1,38 раза. При расширении в 1,25 раза
образуется туман лишь при наличии
отрицательных ионов, конденсирующих
на себе капельки воды. Это наблюдается
и при дальнейшем увеличении степени
расширения вплоть до предела, равного
1,31, по достижении которого начинают
конденсировать воду и положительные
ионы. При степени расширения от 1,31 до
1,38 водяные пары будут сгущаться на ионах
обоих знаков. Начиная с расширения в
1,38 раза, образование тумана происходит,
как было выше указано, независимо от
наличия ионов. Дж. Дж. Томсон ионизировал
при помощи рентгеновых лучей воздух,
насыщеный водяным паром, и производил
затем адиабатическое (практически,
очень быстрое) расширение его в 1,25 раза.
Облачко тумана, образовавшееся из
капелек, сконденсировавшихся вокруг
отрицательных ионов, падает под
действием силы тяжести, и, пользуясь
соотношениями, данными Стоксом, можно
было по скорости падения определить
размеры и массу отдельных капелек.
Полное количество сконденсированной
воды Дж. Дж. Томсон вычислил, основываясь
на данных термодинамики, и разделил его
на массу отдельной капельки. Таким путем
было определено число всех капелек,
составлявших туман. Для получения
величины полного заряда, несомого
совокупностью отрицательных ионов,
участвовавших в образовании тумана,
было применено электрическое поле, под
действием которого ионы одного знака
оседали на электрод, соединенный со
специально проградуированным
электрометром. Разделяя этот полный
заряд на число капелек, Дж. Дж. Томсон
получил заряд каждого иона. И в данном
случае большим достижением его было
достаточно точное определение порядка
величины заряда газового иона. Именно,
он получил:
е=около
4•10-10абс. эл.-стат. единиц.
Дж.
Дж. Томсон сопоставил это количество
электричества с зарядом электролитического
иона, например, водородного. Если N
есть число молекул в куб. сантиметре
водорода при давлении в 760мм ртутного
столба и при температуре 0°С, ае есть
заряд водородного иона, с которым мы
имеем дело при электролизе растворов,
то на основании непосредственных опытов
можно положить:
Ne‘=1,22•1010абс. эл.-стат. единиц.
262
Далее,
исходя из кинетической теории газов,
Дж. Дж. Томсон подсчитал, что Nлежит в пределах от 2,1•1019до 1020.
Из этого получается
1,29•10-10<е'< 6,1•10-10,
откуда
следует, что заряд, несомый газовым
ионом, равен заряду, которым обладает
водородный ион при электролизе растворов.
Этот результат классических опытов Дж.
Дж. Томсона в полной мере оправдывается
всею совокупностью современных данных,
с несомненностью свидетельствующих о
том, что в самых разнообразных случаях
мы неизменно встречаемся с одним и тем
же элементарным электрическим зарядом.
Более поздние и более совершенные методы
наблюдений позволили весьма точно (с
точностью до четырех знаков) определить
величину заряда е. В этом отношении
особенное значение имеют опыты Милликена,
наблюдавшего поведение в электрическом
поле отдельных мельчайших капелек масла
и ртути, заряженных очень небольшим
числом ионов. Определяя заряды капелек,
Милликен установил, что они неизменно
оказываются кратными некоторого
определенного количества электричества(е), и тем показал на непосредственном
опыте атомность электричества. В
настоящее время значениее, полученное
Милликеном, считается весьма достоверным
и, таким образом, на основании его
исследований принимают:
е=4,774•10-10абс. эл.-стат. единиц =1,592•10-20абс.
эл.-магн. единиц.
Гипермаркет знаний>>Химия>>Химия 7 класс>> Относительная молекулярная и относительная формульная массы
Относительная молекулярная и относительная формульная массыМатериал параграфа поможет вам:
> выяснить, что такое относительная молекулярная масса и относительная формульная масса;
> правильно вычислять относительные молекулярные и формульные массы.
Относительная молекулярная масса.
Массы молекул, как и атомов, чрезвычайно малы. Поэтому в химии используют относительные массы молекул. Их еще называют относительными молекулярными массами.
Относительная молекулярная масса — это отношение массы Молекулы к 1/12 массы атома Карбона.
Относительную молекулярную массу сокращенно обозначают Mr. Эта величина, как и относительная атомная масса, не имеет размерности.
Математическая формула для ее вычисления, исходя из массы молекулы:
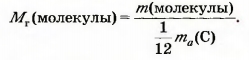
Найдем относительную молекулярную массу кислорода, использовав массы молекулы кислорода (5,32 • 10-23 г) и атома Карбона (1,994 • 10-23 г):
Значительно проще вычислять относительную молекулярную массу, используя относительные атомные массы.
Относительная масса молекулы равна сумме относительных масс атомов, которые входят в ее состав.
Найдем относительные молекулярные массы кислорода и воды, взяв из периодической системы Менделеева значения относительных атомных масс Оксигена и Гидрогена:
Mr(O2) = 2Аr(0) = 2 • 16 = 32;
Mr(H2O) = 2Ar(H) +Ar(O) = 2 • I + 16 = 18.
► Вычислите относительные молекулярные массы азота N2 и аммиака NH3.
Это интересно
Наименьшую массу имеют ионы Гидрогена H+ и H— .
Относительная формульная масса.
Для ионов, а также веществ с атомным и ионным строением (они не содержат молекул) вместо термина «относительная молекулярная масса» используют другой «относительная формульная масса». Эту физическую величину обозначают и рассчитывают так же, как и относительную молекулярную массу.
Относительная формульная масса иона. Масса простого иона почти не отличается от массы соответствующего атома, так как ион содержит наодин или несколько электронов больше или меньше, чем атом, а масса электрона в тысячи раз меньше массы атома. Совпадают также относительные формульные массы простых ионов и относительные атомные массы элементов:
Mr(K+) = Ar(K); Mr(O2- ) = Ar(O).
Относительные формульные массы сложных ионов можно рассчитать тем же способом, что и относительные молекулярные массы:
Mr(CO2-3 ) =Ar (C ) + ЗАr(0) = 12 + 3 • 16 = 60.
► Вычислите относительные формульные массы ионов NH+4 и NO—2.
Это интересно
Значение относительной формульной массы 100 имеют соединения с Формулами
CrO3, Mg3N2, CaCO3.
Относительная формульная масса ионного вещества. Вычисление относительной формульной массы поваренной соли осуществляют так:
Mr(NaCl) =A r(Na) +Ar(Cl) = 23 + 35,5 = 58,5.
В качестве другого примера возьмем алюминий сульфат Al2(SO4)3. Это соединение состоит из простых ионов Al3+ и сложных ионов SO4— .
Относительную формульную массу соединения можно вычислить двумя способами.
1 способ. Используем относительные атомные массы:
Mr[Al2(SO4)3] = 2Ar(Al) + 3Ar(S) + 3 • 4Аr(0) = 2 • 27 + 3 • 32 + 12 • 16 = 342.
2 способ. Используем относительные формульные массы ионов:
Mr(Al3+) =A r(Al) =27;
Mr(SO2-4) = Ar(S) + 4Аr(0) = 32 + 4 • 16 = 96;
Mr[Al2(S04)3] = 2Mr(Al3+) + 3Mr(S02-4 ) = 2 • 27 + 3 • 96 = 342.
Относительная формульная масса — это относительная масса формульной единицы вещества.
Понятие «относительная формульная масса» является универсальным. Оно может быть использовано для веществ любого строения, а также для ионов — простых и сложных.
Выводы
Относительная молекулярная масса — это отношение массы молекулы к — массы атома Карбона или сумма относительных масс атомов, которые входят в состав молекулы.
Для ионов, веществ атомного и ионного строения используют относительную формульную массу. Ее обозначают и вычисляют так же, как и относительную молекулярную массу.
?
84. Что такое относительная молекулярная масса? Как ее рассчитать: а) исходя из массы молекулы; б) по химической формуле молекулы?
85. У какого вещества наименьшая относительная молекулярная масса?
86. Вычислите (желательно устно) относительные молекулярные массы веществ, которые имеют такие формулы:
a) Cl2, O3, P4; б) CO, H2S, H3PO4.
87. Рассчитайте относительные формульные массы веществ с такими формулами:
a) CaH2, AIH3; б) Li2O, MgO; в) Cu(OH)2, (NH4 )2S.
88. Во сколько раз масса атома Оксигена больше или меньше массы:
а) молекулы водорода; б) молекулы метана CH4; в) иона Купрума Cu2+; г) иона S02-4? Попробуйте выполнить расчеты устно.
89. Относительная молекулярная масса соединения Хлора с Оксигеном равна 183. В его молекуле — 7 атомов Оксигена. Какова формула вещества?
90. Относительная формульная масса соединения элемента X с Флуором вдвое превышает относительную атомную массу Фосфора. Определите элемент X и напишите формулу соединения.
91. Масса молекулы воды равна 3 • 10-23 г, а атома Карбона — 2 • 10-23 г.
Вычислите по этим данным относительную молекулярную массу воды.
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урокаконспект урока и опорный каркас
презентация урока
интерактивные технологии
акселеративные методы обучения Практика
тесты, тестирование онлайн
задачи и упражнения
домашние задания
практикумы и тренинги
вопросы для дискуссий в классе Иллюстрации
видео- и аудиоматериалы
фотографии, картинки
графики, таблицы, схемы
комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения
рефераты
шпаргалки
фишки для любознательных
статьи (МАН)
литература основная и дополнительная
словарь терминов Совершенствование учебников и уроков
исправление ошибок в учебнике
замена устаревших знаний новыми Только для учителей
календарные планы
учебные программы
методические рекомендации
обсуждения
Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний — Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов —
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других «взрослых» тем.
Разработка — Гипермаркет знаний 2008-
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: