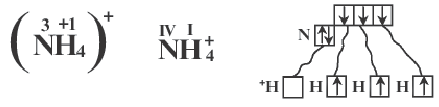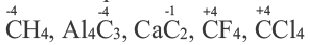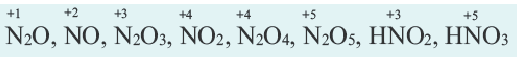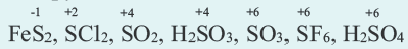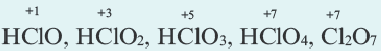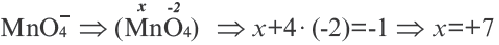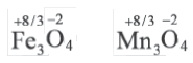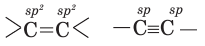Как определить ионную связь
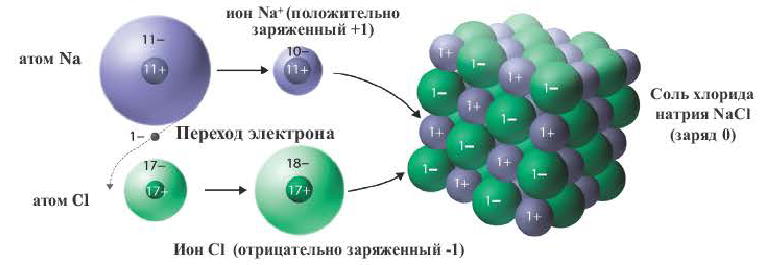
Когда между атомами образуется химическая связь, происходит перераспределение электронной плотности. В результате, могут образоваться заряженные частицы – ионы. Если атом теряет электроны, он становится катионом – положительно заряженным ионом. Если же он притягивает к себе чужой электрон, становится анионом – отрицательно заряженным ионом. А поскольку частицы с разными зарядами могут притягиваться друг к другу, ионы образуют химическую связь. При этом образуются химические соединения. Эта связь так и называется ионная.

Инструкция
Существует закономерность: ионную связь образуют главным образом атомы щелочных и щелочноземельных металлов, соединяясь с атомами галогенов. То есть прежде всего посмотрите на химическую формулу вещества. Вот, например, поваренная соль – хлористый натрий, NaCl. Натрий – щелочной металл, находится в первой группе таблицы Менделеева, хлор – газ, галоген, находится в седьмой группе. Следовательно, в молекуле поваренной соли – ионная химическая связь. Или, например, фтористый калий, КF. Калий — также щелочной металл, причем еще более активный, чем натрий. Фтор – галоген, еще более активный, чем хлор. Поэтому в молекуле этого вещества – тоже ионная химическая связь.
Об ионном типе связи могут свидетельствовать некоторые физические признаки. Например, вещества с такой связью имеют высокие температуры плавления и кипения. У того же хлористого натрия они составляют 800,8 и 1465 градусов, соответственно. Растворы таких веществ проводят электрический ток. Если вы обнаружите подобные свойства – знайте, что это вещество с ионной связью.
Можно воспользоваться значениями электроотрицательности каждого химического элемента, то есть показателем того, насколько легко атом этого элемента притягивает или отдает электроны. Существуют разные таблицы электроотрицательности. Наиболее широко известна шкала Полинга, названная в честь известного американского ученого. Минимальное значение электроотрицательности по этой шкале имеет самый активный щелочной металл франций (0,7), максимальное – самый активный галоген фтор (4,0).
Чтобы определить, имеет ли ионный тип связи вещество, состоящее из двух элементов, необходимо сделать следующее: найдите электроотрицательности этих элементов (по шкале Полинга).
Вычтите из большего значения меньшее значение. То есть установите разность электроотрицательностей (ЭО). Например, для той же самой поваренной соли она будет составлять: 3,16(Cl)–0,99(Na)=2,17. Сравните полученную величину ЭО с 1,7. Если она больше этого значения – связь в веществе ионная.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Содержание:
Ионная связь:
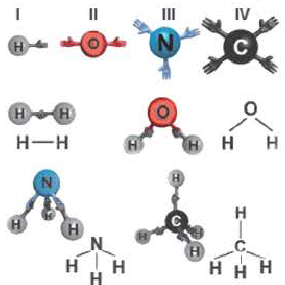
Ионы образуются в результате отдачи или присоединения электронов атомами. Атомы, отдающие свои валентные электроны, превращаются в положительно заряженные ионы, а атомы, принимающие эти электроны в отрицательно заряженные ионы. Ионы это заряженные частицы. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы анионами. Катионы в основном образуются от металлов и ионов аммония. Неметаллы в одиночку не образуют катионов (кроме H+). Из курса физики известно, что положительно и отрицательно заряженные ионы взаимно притягивают друг друга. Следовательно, между положительно и отрицательно заряженными ионами существуют взаимные силы притяжения.
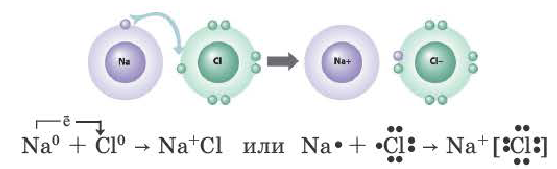
Химическая связь, образованная между ионами в результате действия электростатических сил притяжения, называется ионной связью. Полученное при этом соединение носит название ионного или гетерополярного соединения. Ионная связь образуется между металлами и неметаллами, т.е. между атомами элементов с резко отличающимися электроотрицательностями. Самая сильная ионная связь возникает в солях кислородсодержащих и бескислородных кислот (например, между металлами (щелочные и щелочноземельные металлы) и галогенами), в основаниях. Следовательно, молекула хлорида натрия состоит из ионов натрия (Na+) и хлорид-ионов (Cl).
Свойства ионной связи
Ионной связи присущ целый ряд характерных свойств:
- В соединениях с ионной связью кристаллы состоят не из молекул, а из множества ионов с противоположными зарядами.
- В обычных условиях бывают в твердом состоянии, не проводят электрический ток.
- Расплавы и водные растворы ионных соединений проводят электрический ток.
- Соединения с ионной связью хорошо растворяются в полярных растворителях, легко вступают в химические реакции.
В солях, образованных щелочными металлами с одинаковыми галогенами, по мере возрастания порядкового номера металла, ионная связь усиливается, что объясняется активностью металла (например, в ряду LiF, NaF, K.F, RbF, CsF ). В различных галогенидах одних и тех же металлов по мере возрастания порядкового номера галогена, ионная связь ослабляется (например, NaF, NaCl, NaBr, NaI). Это объясняется ослаблением окислительных способностей (неметаллических свойств) галогена. В солях аммония также между ионом аммония (NH
В соединениях с ионной связью число ионных связей равно произведению числа катионов на валентность.
В солях, в составе которых содержится кислород и ион аммония, в том числе и в основаниях, имеются как ионная, так и полярная ковалентная связи.
В основаниях число полярных ковалентных связей равно числу гидроксильных групп.
В нормальных солях число полярных ковалентных связей равно произведению валентности центрального элемента на его индекс. В кислых же солях число полярных ковалентных связей равно произведению суммы валентности центрального элемента и количества H на индекс кислотного остатка.
Если в соединениях разница электроотрицательностей элементов больше 1,7, то это соединение с ионной связью, а если меньше 1,7, с ковалентной связью.
Металлическая связь
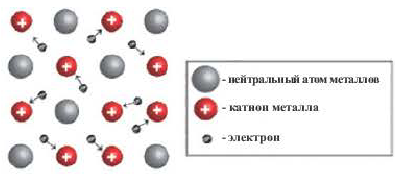
Химическая связь, образованная между положительно заряженными ионами металлов и относительно свободными электронами кристаллических решеток, называется металлической связью. Атомы металлов легко отдают свои валентные электроны и превращаются в положительно заряженные ионы. Огносительно свободные электроны, оторвавшись от атомов, движутся между положительными ионами металлов, образуя металлическую связь, те. электроны словно цементируют положительные ионы кристаллической решетки металлов.
Металлическая связь обладает целым рядом характерных свойств:
- При образовании металлической связи валентные электроны относятся не к двум атомам, а ко всему кристаллу.
- Высокая электро- и теплопроводность металлов, их плавление при высокой температуре и способность отражать свет объясняются металлической связью.
- Металлическая связь характерна для металлов и их расплавов.
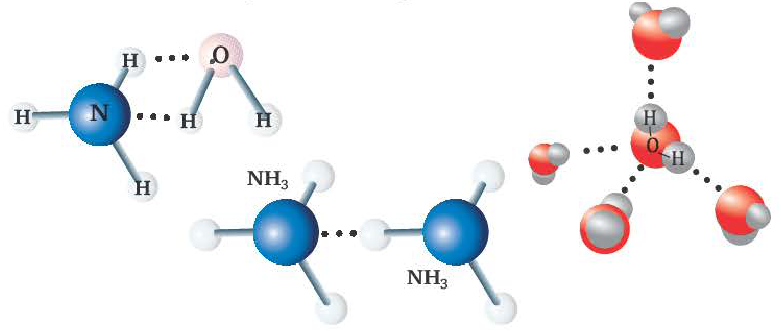
Водородная связь
Химическая связь, образованная между атомом водорода одной молекулы и атомом более сильного электроотрицательного элемента (O,N,F) другой или же аналогичной молекулы, называется водородной связью.
Характерные свойства водородной связи:
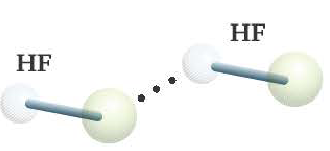
- Водородная связь обозначается 3-мя точками.
- Водородная связь в 15 20 раз слабее ковалентной связи.
- Образуется в таких веществах, как NH3, Н2O, HF, в том числе между органическими веществами, содержащими группы ОН, NH2 COOH и др.
- Водородная связь может быть как межмолекулярной, так и внутримолекулярной.
Вода, HF, спирты, водные растворы спиртов образуют межмолекулярные водородные связи. Для белков и многих органических соединений характерна внутримолекулярная водородная связь.
Радиус атома водорода очень маленький и при перемещении или отдаче своего единственного электрона другому атому он становится положительно заряженным. За счет этого водород одной молекулы взаимодействует с находящимися в составе других молекул (HF, Н2О) атомами электроотрицательных элементов с частично отрицательным зарядом.
Образование водородной связи
За счет водородной связи действительная формула воды имеет следующий вид: (H2O)n
При переходе того или иного вещества, образующего водородную связь, из жидкого состояния в газообразное состояние, водородная связь разрывается, а в обратном процессе вновь восстанавливается.
Вода, находясь в твердом (лед) и жидком состояниях, образует водородную связь. При переходе же в газообразное состояние водородная связь разрывается.
При 1 и 2 превращениях водородная связь сохраняется, при третьем состоянии -разрывается, а при четвертом — восстанавливается. Увеличение объема воды при понижении температуры (т.е. объем льда бывает больше объема жидкой воды одинаковой массы, а плотность — меньше) объясняется наличием водородной связи. Эго связано с тем, что при понижении температуры происходит образование более упорядоченной структуры молекул и в результате их «упаковочная» плотность уменьшается.
Одна из причин того, что фтористая кислота является слабой кислотой, заключается в ассоциации друг с другом молекул HF посредством водородной связи. Вот почему действительная формула фтороводородной кислоты следующая: (HF)n.
Типы кристаллических решеток
Кристаллические и аморфные вещества:
При механическом раздроблении кусочка хлорида натрия или другого твердого вещества образуются кристаллы определенной формы. Такие вещества называют кристаллическими веществами. Однако существуют и такие твердые вещества (стекло, куски смолы), которые при раздроблении под действием удара образуют осколки неопределенной формы. Такие вещества называют аморфными, т.е. бесформенными веществами.
Частицы (атомы, ионы и т.д.) твердых веществ, располагаясь в строгом порядке, образуют различного типа кристаллические решетки. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
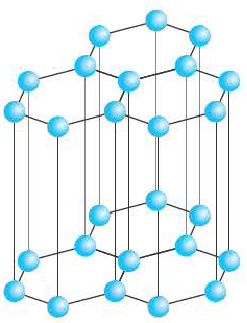
В графите атомы углерода на одной плоскости расположены близко друг к другу, а на разных плоскостях на отдаленном расстоянии друг от друга. Расположение атомов углерода, находящихся на разных плоскостях, в отдалении друг от друга приводит к расслоению графита на чешуйки. Свидетельством тому являются оставленные карандашом следы на бумаге (чешуйки графита).
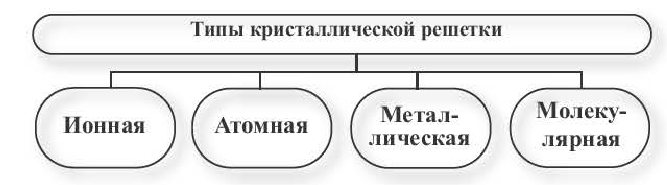
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллической решетки.
В отличие от кристаллических веществ, в аморфных веществах частицы расположены не в такой закономерности, а неупорядоченно.
 |
Профессор Худу Мамедов (1927 1988) являлся член корреспондентом НАНА, доктором геолого минералогических наук, почетным членом Коралевской Академии Великобритании. Его основные научные труды от носятся к области ристаллохимии. Исследовал молекулярное и кристаллическое строения более 50 ти органических комплексных соединений слигандами. |
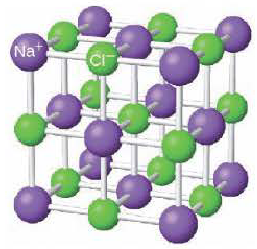
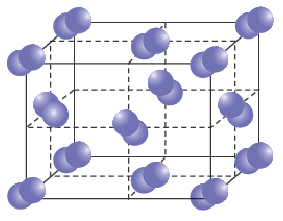
Ионная кристаллическая решетка. Кристаллические решетки, в узлах которых содержатся соединенные ионными связями положительно и отрицательно заряженные ионы, называются ионными кристаллическими решетками. Ионные кристаллические решетки характерны для оксидов металлов, оснований и солей: NaCl, KCl, NaBr, KBr, N2CO3, Na2SO4, Fe2O3, Ca(OH)2 и др.
Строение кристаллической решетки поваренной соли
Строение кристаллической решетки графита
Из-за сильного притяжения между ионами веществ с ионной кристаллической решеткой, эти вещества отличаются относительной тугоплавкостью, малой летучестью и определенной твёрдостью.
Атомные кристаллические решетки
Кристаллические решетки, в узлах которых содержатся отдельные атомы, связанные друг с другом ковалентной связью, называются атомными кристаллическими решетками.
В атомных кристаллических решетках атомы, как и ионы, располагаются в пространстве в различных положениях, образуя в результате различной формы кристаллы. Например, в узлах кристаллической решетки как алмаза, так и графита содержатся атомы углерода. Однако вследствие их различного расположения, кристаллы алмаза обладают формой тетраэдра, а кристаллы графита слоистой формой.
| Аллотропические видоизменения углерода | Состояния гибридизации углерода | Xимический cocтав | Тип кристаллической решетки | Cтроение кристаллической решетки |
| Алмаз | sp3 | Одинаковый (C) | Атомный | тетраэдрическое |
| Графит | sp2 | слоистое | ||
| Карбин | sp | линейное |
Хотя тип кристаллической решетки аллотропических видоизменений углерода и одинаковый, однако у них различное строение. Примерами веществ, образующих атомную кристаллическую решетку, являются В, С, Si, SiC (карборунд), SiO2, красный и черный фосфор.
Так как в атомных кристаллических решетках этих веществ ковалентные связи между атомами обладают прочностью, для них характерны большая твердость и высокая температура плавления.
Хотя SiC и SiOi обладают атомной кристаллической решеткой, связь между их атомами образована посредством полярной ковалентной связи.
Молекулярная кристаллическая решетка
Кристаллические решетки, в узлах которых содержатся полярные и неполярные молекулы, связанные между собой межмолекулярными силами, называются молекулярными кристаллическими решетками. Молекулярные вещества образуют кристаллические решетки молекулярного типа.
Строение кристаллической решетки йода
Вещества, находящиеся при комнатной температуре в твердом состоянии и образованные только посредством ковалентной связи, в обычных условиях имеют молекулярную кристаллическую решетку, а газообразные, жидкие вещества образуют молекулярную кристаллическую решетку лишь в определенных условиях. В качестве примера веществ с молекулярными кристаллическими решетками в обычных условиях можно привести белый фосфор (Р4), кристаллическую серу (S8), Н3РО4, иод (I2), НРО3, Р2О5, глюкозу (C6H12O6), сахарозу (C12H22O11) и др.
В молекулярных кристаллических решетках веществ с неполярными ковалентными связями (H2, N2, О2, О3, F2, Сl2, Вr2, l2, Р4, S8) связи между молекулами создаются лишь слабыми межмолекулярными силами. В веществах с неполярной ковалентной связью межмолекулярное притяжение слабое. Вследствие этого они обладают очень низкой температурой плавления.
В кристаллических решетках веществ с полярной ковалентной связью (кроме SiC и SiO2) действуют межмолекулярные и электростатические силы притяжения. Значит, только вещества, образованные посредством полярной ковалентной и неполярной ковалентной связи, создают молекулярную кристаллическую решетку. Например, H2O, HCl, HBr, HI, CO2, HNO3, H2SO4, большинство органических веществ и др.
Металлические кристаллические решетки
Кристаллические решетки, в узлах которых содержатся отдельные атомы или ионы металлов, связанные общими электронами, называются металлическими кристаллическими решетками. Большинство металлов (Na, Ca, Fe, Al, Cu и др.), а также расплавов, образуют металлические кристаллические решетки.
Многие свойства металлов электрическая проводимость, теплопроводность, ковкость и др. объясняются свободным движением электронов, образующих металлическую связь.
Некоторые физические свойства веществ зависят от типов кристаллических решеток. В этой связи существует такая закономерность: при известном строении веществ можно заранее предсказать их свойства, и наоборот, если известны свойства веществ, то можно определить их строение.
Вещества, обладающие молекулярной кристаллической решеткой, называются молекулярными (состоят из молекул), а обладающие ионной, атомной и металлической кристаллическими решетками немолекулярными (состоят из атомов или ионов) веществами.
Валентность
Валентность элементов относится к основным понятиям химии.
Валентность — это свойство атомов элементов присоединять или замещать определенное число атомов других элементов. Понятие валентности было введено в науку в 1852 году Эдуардом Франклендом.
Данное определение валентности носит несколько формальный характер, так как не дает представления о природе, свойствах вещества. C развитием учения о химической связи содержание понятия «валентность» в настоящее время обычно выражается так:
Валентность это свойство атомов элементов создавать определенное число ковалентных химических связей.
Валентность определяется числам ковалентных связей, посредством которых в соединениях один атом связывается с другими атомами.
Согласно представлениям о ковалентной связи, независимо от способа образования общих электронных пар, валентность определяется числом общих электронных пар, связывающих атомы в молекуле.
Как вам известно, числовое значение валентности связано с положением элемента в периодической системе химических элементов Д.И.Менделеева. Высшая валентность элемента по числовому значению равна номеру его группы в периодической системе. Некоторые элементы не подчиняются этой закономерности (например, N, О, F). Это связано с тем, что из-за отсутствия в их атомах незаполненных орбиталей, они не могут возбуждаться. Максимальная валентность в соответствующем соединении того или иного элемента определяется числом орбиталей, участвующих в образовании связей в его атоме.
Образование связи в соответствии с валентностью элемента
В образовании иона аммония (NH
Степень окисления
Степень окисления это условный заряд, который приходится на долю каждого атома в молекуле. Степень окисления может принимать отрицательные, нулевые, положительные и дробные значения. Значение степени окисления определяется числом электронов, отданных атому другого элемента или полученных от атома данного элемента.
| Элементы | Степень окисления, проявляемая в соединениях |
| Li, Na, К, Rb, Cs | + 1 |
| Be, Mg, Ca, Sr, Ba, Ra, Zn | +2 |
| Al | +3 |
| F | -1 |
Для определения степени окисления каждого элемента в соединениях используются нижеприведенные данные. В таблице даны элементы с постоянной степенью окисления в соединениях.
Степень окисления у других элементов бывает переменной.
Степень окисления водорода в его соединениях с металлами и кремнием равна 1 (например: ВН3, SiH4, NaH, CaH2 и др.), а во всех других соединениях+1.
Вот почему в периодической таблице водород записан как в подгруппе 1А, так и в подгруппе VIIA.
Степень окисления кислорода в пероксидах равна 1 (H2O2, Na2O2, CaO2 и др), в супероксидах 1 /2 (КО2), фтористых соединениях (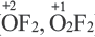
Углерод в своих соединениях проявляет степень окисления -4 ÷ +4.
Степень окисления азота в его соединениях с металлами (например, в нитридах Na3N, AIN, Ca3N2 и др.), аммиаке (NH3) равна -3, а в кислородсодержащих соединениях от +1 ÷ +5.
Степень окисления фосфора в его соединениях с металлами, фосфидах (Na3P, K3P, Ca3P2, AlP и др.), фосфине (PH3) равна -3, а в других соединениях +3 и +5 (P2S3, P2O3, P2O5, PCl5, HPO3, H3PO3, H3PO4 и др.).
Степень окисления серы в сульфидах равна -2 (H2S, Na2S, FeS, P2S3, P2S5, CS2, и др.), а в других соединениях -1 ÷ +6 .
Из галогенов хлор, бром и йод только в соединениях с металлами проявляют степень окисления 1, а в кислородсодержащих соединениях +l÷+-7.
Степень окисления элементов в простых веществах всегда равна нулю.
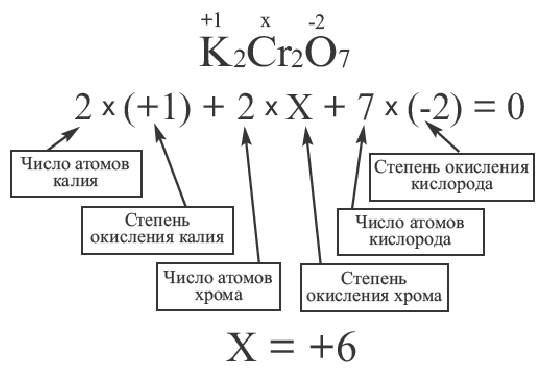
Алгебраическая сумма значений степени окисления элементов в сложных веществах всегда равна нулю. Следуя этому правилу, можно легко вычислить степень окисления любого химического элемента, если известны степень окисления других химических элементов в соединении. Неизвестная степень окисления элемента всегда принимается за х.
В сложных ионах алгебраическая сумма степеней окисления элементов равна заряду иона. Неизвестная степень окисления элемента в сложном ионе принимается за х. Записав в скобках формулу иона, за скобками (справа сверху) отмечают его заряд.
У большинства элементов самая высокая степень окисления соответствует номеру группы, в которой данный элемент размещается (кроме F, О, Fe, Си, Ag, Au). Самая низкая степень окисления любого неметалла (кроме H и В) определяется путем вычитания числа 8 от номера группы, где он расположен.
| Группа | VI | VII | V | IV |
| Элемент | S | Cl | N | C |
| Самая низкая степень окисления | 6 8=-2 | 7 8=-1 | 5 8=-3 | 4 8=-4 |
Металлы никогда не проявляют отрицательной степени окисления. Самая низкая степень окисления у них равна нулю.
В большинстве случаев степень окисления элемента по своему численному значению совпадает с его валентностью. Но такое бывает не всегда. Например: углерод трехвалентный только в угарном газе (СО), во всех остальных соединениях он четырехвалентный. Кислород трехвалентный только в ионе гидроксония (Н3О+) и угарном газе, во всех остальных соединениях он двухвалентный. В таких соединениях, как Аl4С3, CO2, CCl4, CF4, CS2, численные значения степени окисления и валентности у углерода совпадают.
При определении степени окисления посредством общего баланса отданных и полученных электронов ее среднее значение иногда может быть выражено дробным числом.
При разных степенях окисления атомов одного элемента в соединении степени окисления выражаются дробными числами. Среднее значение вычисляется способом электронного баланса.
Значение степени окисления, в отличие от заряда иона, проставляется над химическим знаком элемента (вначале ставится знак заряда, а затем число).
| Степень окисления | +2 Fe |
+3 Fe |
-2 S |
+6 S |
| Заряд иона | Fe2+ | Fe3+ | S2- | S6+ |
Пример №1
Сколько процентов от числа валентных электронов азота (7N 2s22p3) создают связь по механизму обмена?
Решение: В атоме азота из 5-ти валентных электронов 3 одиночные.
Значит, (3/5) ∙ 100%=60% участвуют в механизме обмена.
Каждая электронная пара, образующая химическую связь, обозначается по одной валентной линии, формулы молекул изображаются графически.
Пример №2
Определите отношения между а, b, с.
| Соли | Число донорно-акцепторных связен |
| (NH4)2SO4 | а |
| NH4Cl | b |
| (NH4)3PO4 | c |
Решение: Число донорноакцепторных связей в солях аммония равно числу ионов аммония.
Тогда: a=2; b=l; с=3
Ответ: b

Пример №3
Определите количество а) полярных ковалентных и b) неполярных ковалентных связей в молекуле соединения:
Решение: Полярная ковалентная связь образуется между атомами двух разных неметаллов. В таком случае, в данном соединении N(пол.ков.связь) N(C Н)связь N(H) 6
А неполярная ковалентная связь образуется между атомами одного вида (в представленном соединении это линии между атомами углерода). Тогда N(κeпoл.ков.связь.) = 3
Ответ: а=6; b=3
Пример №4
Определите общее число орбиталей, участвующих в образовании химических связей в соединении Н3С CH2 СН3.
Решение: Кроме угарного газа (СО), во всех соединениях углерода все 4 орбитали внешнего электронного слоя участвуют в образовании связи. Поскольку атом H имеет 1 орбиталь, его орбиталь тоже участвует в образовании связи. В таком случае, общее число орбиталей, участвующих в образовании связи: N(оpб.)o6щ. N(C) • 4 + N(H) 3•4 + 8 20
Пример №5
Определите в данном соединении гибридное состояние углерода.
Решение:
- Химические реакции
- Теория электролитической диссоциации
- Электролиты и неэлектролиты в химии
- Металлы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Ковалентная связь
- Валентность и степень окисления
Ионы – это атомы, потерявшие или получившие электроны и, как следствие, некоторый заряд. Для начала хотелось бы напомнить, что ионы бывают двух типов: катионы (положительный заряд ядра больше, чем количество электронов, несущих отрицательный заряд) и анионы (заряд ядра меньше количества электронов). Ионная связь образуется в результате взаимодействия двух ионов с разноименными зарядами.
Ионная и ковалентная связь
Данный тип связи является частным случаем ковалентной. Разность электроотрицательностей в данном случае столь велика (более чем 1,7 по Полингу), что общая пара электронов не частично смещается, а полностью переходит к атому с большей электроотрицательностью. Поэтому образование ионной связи является результатом возникновения сильного электростатического взаимодействия между ионами. Важно понимать, что не существует стопроцентно ионной связи. Данный термин применяется, если «ионные признаки» более выражены (т.е. электронная пара сильно смещена к более электроотрицательному атому).
Механизм ионной связи
Атомы, имеющие практически полную или практически пустую валентную (внешнюю) оболочку, наиболее охотно вступают в химические реакции. Чем меньше пустых орбиталей на валентной оболочке, тем выше шанс, что атом получит электроны извне. И наоборот – чем меньше электронов находится на внешней оболочке, тем вероятнее, что атом отдаст электрон.
Это способность атома притягивать к себе электроны, поэтому атомы с наиболее заполненными валентными оболочками более электроотрицательны.
Типичный металл охотно отдает электроны, тогда как типичный неметалл охотнее их забирает. Поэтому чаще всего ионную связь образуют металлы и неметаллы. Отдельно следует упомянуть другой тип ионной связи – молекулярную. Ее особенность в том, что в роли ионов выступают не отдельные атомы, а целые молекулы.
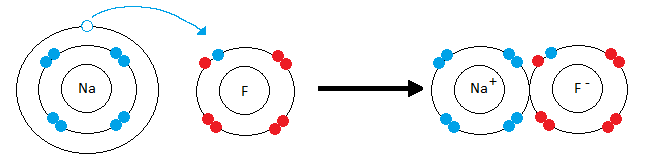
Схема ионной связи
На рисунке схематически изображено формирование фторида натрия. Натрий имеет низкую электроотрицательность и всего один электрон на валентной оболочке (ВО). Фтор – значительно более высокую электроотрицательность, ему не хватает всего одного электрона для заполнения ВО. Электрон с ВО натрия, переходит на ВО фтора, заполняя орбиталь, в следствии чего оба атома приобретают разноименные заряды и притягиваются друг к другу.
Свойства ионной связи
Ионная связь достаточно сильна – разрушить ее при помощи тепловой энергии крайне сложно, а потому вещества с ионной связью имеют высокую температуру плавления. В то же время радиус взаимодействия ионов достаточно низкий, что обуславливает ломкость подобных соединений. Важнейшими ее свойствами являются ненаправленность и ненасыщаемость. Ненаправленность происходит из формы электрического поля иона, которое представляет собой сферу и способно взаимодействовать с катионами или анионами во всех направлениях. При этом поля двух ионов не компенсируются полностью, вследствие чего они вынуждены притягивать к себе дополнительные ионы, образуя кристалл, – это и есть явление, называемое ненасыщаемостью. В ионных кристаллах нет молекул, а отдельные катионы и анионы окружены множеством ионов противоположного знака, количество которых зависит в основном от положения атомов в пространстве.
Кристаллы поваренной соли (NaCl) – типичный пример ионной связи.
Таблица веществ с ионной связью
| Название | Формула | Применение и свойства |
|---|---|---|
| Бромид серебра | AgBr | Ионная связь в молекуле разрывается под воздействием фотонов (фотолиз), что широко применяется в фотографии и оптике. |
| Хлорводород | HCl | Как следует из формулы, ионная связь тут образуется между хлором и водородом, а потому водный раствор HCl (соляная кислота), широко применяется для получения различных хлоридов. |
| Оксид кальция | CaO | Негашеная известь. Широко применяется при производстве кирпича. |
| Фторид натрия | NaF | Применяется для укрепления зубной эмали, в производстве керамики. |